La hepatitis autoinmune (HAI) es una enfermedad hepática crónica e inflamatoria que puede progresar a fibrosis, cirrosis y falla hepática si no se logra la remisión. Afecta a personas de todas las edades, razas y grupos étnicos, aunque entre el 70 y el 95% de los adultos afectados son del sexo femenino. Los objetivos de tratamiento en la HAI incluyen la resolución de los síntomas e inflamación hepática, prevención del desarrollo o progresión de la fibrosis y el mantenimiento de la remisión. Actualmente el tratamiento de primera línea recomendado por las guías internacionales consiste en la inducción a la remisión con esteroides, seguida del mantenimiento con inmunosupresores no esteroideos1. Estudios diversos han evaluado la respuesta bioquímica con diferentes dosis de esteroides, por ejemplo, en un estudio multicéntrico, retrospectivo recientemente demostró que no hay diferencia en alcanzar una respuesta completa después de 6 meses de tratamiento con prednisolona al comparar 30mg/día versus más de 30mg/día. Sin embargo, otros estudios han demostrado que utilizar dosis más alta de prednisolona al inicio del tratamiento se relacionó con una normalización más rápida de la alanina aminotransferasa (ALT) y una mejor supervivencia a largo plazo2.
Por otra parte, sabemos que por décadas la azatioprina (AZA) ha sido el tratamiento de mantenimiento estándar de la HAI, sin embargo, esta recomendación se basa en estudios realizados hace más de 20 años con diseños metodológicos limitados. Sabemos que con el esquema actual de tratamiento solo del 50 al 60% de los pacientes logran una respuesta bioquímica completa, esto condiciona a una limitada resolución histológica y un mayor riesgo de progresión de la enfermedad. Además, entre el 15 y el 25% de los pacientes tratados con AZA desarrollan intolerancia o falta de respuesta, lo que obliga interrumpir el tratamiento y usar un esquema de segunda línea3.
El micofenolato de mofetilo (MMF) es un inhibidor selectivo, no competitivo y reversible de la isoforma II de la inosina-5’-monofosfato deshidrogenasa, considerado como un inmunosupresor selectivo con pocos efectos adversos. Existen estudios retrospectivos donde han evaluado la seguridad y la efectividad del MMF como tratamiento de segunda línea en la HAI. Estos resultados han mostrado alcanzar la respuesta bioquímica deseable, considerando actualmente al MMF como una opción en los pacientes intolerantes o refractarios al tratamiento estándar4. Ante estos hallazgos, recientemente se ha explorado el uso de MMF como tratamiento de primera línea. A propósito, Zachou et al.5, evaluaron de forma prospectiva el MMF como tratamiento de inducción y mantenimiento. En este estudio reportaron una respuesta clínica y bioquímica del 88% y una repuesta parcial del 12%, superior al tratamiento estándar. Solo 2 pacientes con cirrosis presentaron eventos adversos severos (septicemia). Snijders et al.6. en el estudio CAMARO describieron una diferencia significativa a favor del MMF para lograr la remisión bioquímica a 24 semanas comparado con AZA (56.4 vs. 29%, diferencia porcentual del 27.4%; IC 95%: 4-46.7; p=0.022), además la tasa de eventos adversos serios fue menor con MMF vs. AZA (0 vs. 12.9%; p=0.034). De igual forma, en el estudio de Dalekos et al.7, describieron una remisión bioquímica completa a 12 meses a favor de MMF vs. AZA (86 vs. 71.8%; p<0.05) y al final del seguimiento a 57 meses fue similar (96 vs. 87.2%; p=0.03). En comparación con el MMF, el uso de la AZA mostró más efectos secundarios serios (18.8 vs. 3.8%; p=0.0003).
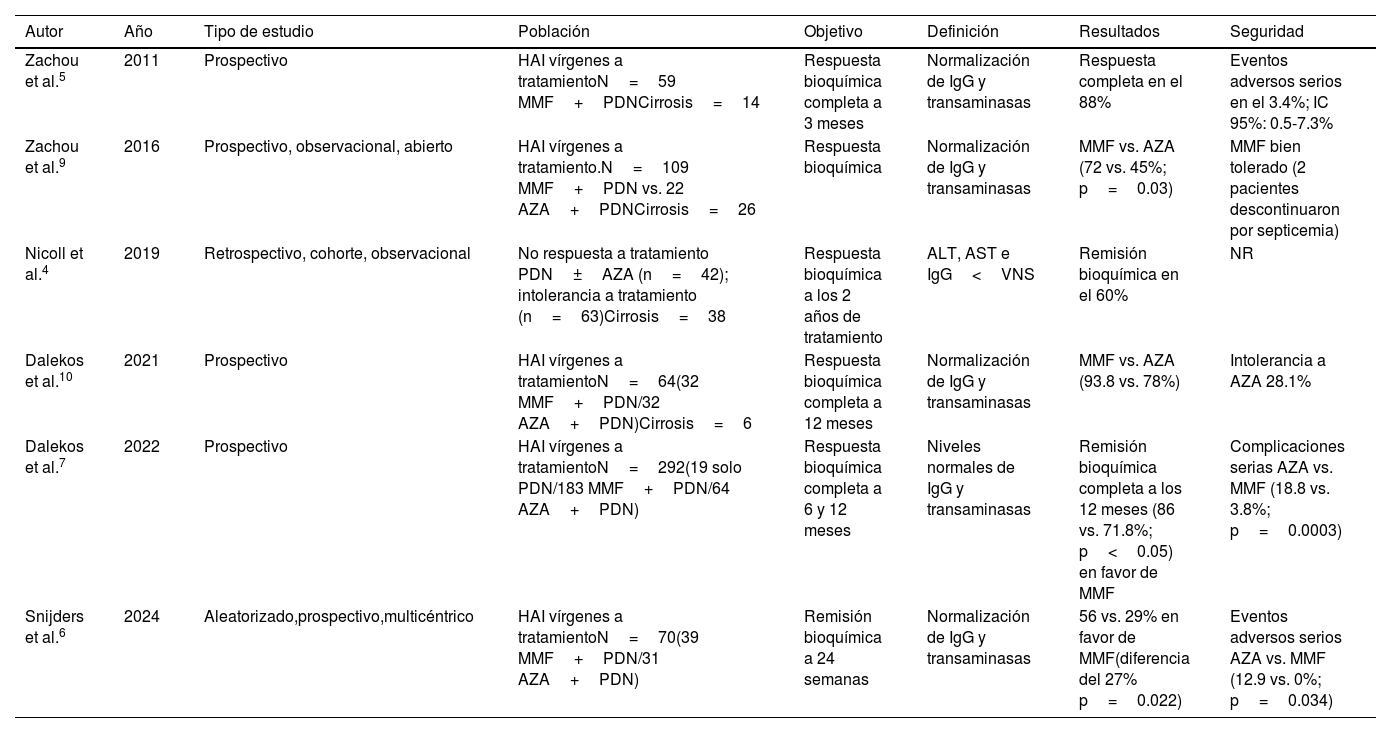
A pesar de los diferentes resultados prometedores, estas publicaciones poseen algunas limitaciones, principalmente el no evaluar la respuesta bioquímica sostenida a largo plazo del MMF o al cese de la inmunosupresión. Otra desventaja, no existe un reporte del impacto en la remisión histológica. Finalmente, en la metodología algunos de los estudios fueron no aleatorizados y otros de etiqueta abierta. En la tabla 1 describimos otros estudios relacionados.
Estudios de uso de MMF en HAI
| Autor | Año | Tipo de estudio | Población | Objetivo | Definición | Resultados | Seguridad |
|---|---|---|---|---|---|---|---|
| Zachou et al.5 | 2011 | Prospectivo | HAI vírgenes a tratamientoN=59 MMF+PDNCirrosis=14 | Respuesta bioquímica completa a 3 meses | Normalización de IgG y transaminasas | Respuesta completa en el 88% | Eventos adversos serios en el 3.4%; IC 95%: 0.5-7.3% |
| Zachou et al.9 | 2016 | Prospectivo, observacional, abierto | HAI vírgenes a tratamiento.N=109 MMF+PDN vs. 22 AZA+PDNCirrosis=26 | Respuesta bioquímica | Normalización de IgG y transaminasas | MMF vs. AZA (72 vs. 45%; p=0.03) | MMF bien tolerado (2 pacientes descontinuaron por septicemia) |
| Nicoll et al.4 | 2019 | Retrospectivo, cohorte, observacional | No respuesta a tratamiento PDN±AZA (n=42); intolerancia a tratamiento (n=63)Cirrosis=38 | Respuesta bioquímica a los 2 años de tratamiento | ALT, AST e IgG<VNS | Remisión bioquímica en el 60% | NR |
| Dalekos et al.10 | 2021 | Prospectivo | HAI vírgenes a tratamientoN=64(32 MMF+PDN/32 AZA+PDN)Cirrosis=6 | Respuesta bioquímica completa a 12 meses | Normalización de IgG y transaminasas | MMF vs. AZA (93.8 vs. 78%) | Intolerancia a AZA 28.1% |
| Dalekos et al.7 | 2022 | Prospectivo | HAI vírgenes a tratamientoN=292(19 solo PDN/183 MMF+PDN/64 AZA+PDN) | Respuesta bioquímica completa a 6 y 12 meses | Niveles normales de IgG y transaminasas | Remisión bioquímica completa a los 12 meses (86 vs. 71.8%; p<0.05) en favor de MMF | Complicaciones serias AZA vs. MMF (18.8 vs. 3.8%; p=0.0003) |
| Snijders et al.6 | 2024 | Aleatorizado,prospectivo,multicéntrico | HAI vírgenes a tratamientoN=70(39 MMF+PDN/31 AZA+PDN) | Remisión bioquímica a 24 semanas | Normalización de IgG y transaminasas | 56 vs. 29% en favor de MMF(diferencia del 27% p=0.022) | Eventos adversos serios AZA vs. MMF (12.9 vs. 0%; p=0.034) |
AZA: azatioprina; HAI: hepatitis autoinmune; MMF: micofenolato de mofetilo; NR: no reportado; PDN: prednisolona; VNS: valor normal superior.
A diferencia de la AZA, las razones de abandono del tratamiento con MMF son principalmente por costos del fármaco y en las mujeres en edad fértil, el deseo de embarazo. Existen reportes que muestran que la administración de MMF durante el embarazo se asocia a un mayor riesgo de pérdida del producto en el primer trimestre del 49% y malformaciones congénitas hasta en el 27%, principalmente malformaciones faciales (labio-paladar hendido, micrognatia, hipertelorismo), defectos oculares y del oído (coloboma, microftalmia, malformación de oído externo), malformaciones cardiacas (defectos del septo auricular y ventricular), atresia esofágica y espina bífida8. Por esta razón, en las mujeres en edad reproductiva, la administración de MMF se debe efectuar bajo estrictas medidas anticonceptivas, siendo esta una limitante para su uso en este grupo de pacientes. Otra de las limitantes importantes del MMF es el elevado costo al compararlo contra la terapia estándar.
En conclusión, con la reciente evidencia publicada, el MMF ha mostrado tener mejores tasas de remisión bioquímica y menores efectos adversos con respecto a la AZA, por lo cual se debe considerar la necesidad de actualizar las guías de tratamiento de la HAI y posiblemente considerar el MMF como la opción de primera línea en el tratamiento de la HAI.
FinanciaciónNo se recibió ningún tipo de financiación para la realización de este proyecto.
Consideraciones éticasEl propósito de este trabajo es emitir una opinión basada en los resultados de estudios previos, por lo tanto, no se vulnera la privacidad de pacientes, así como tampoco se realizó ninguna intervención, por lo que no consideramos su inclusión a comité de ética institucional.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses relacionado al trabajo.