La enfermedad por reflujo gastroesofágico (ERGE) es altamente prevalente en los pacientes con fibrosis pulmonar idiopática (FPI), incluso en ausencia de síntomas. La información al respecto en Latinoamérica es limitada. El objetivo de este trabajo fue determinar la prevalencia de dismotilidad y ERGE con manometría esofágica de alta resolución (HRM) e impedanciometría multicanal con pHmetría (IMM-pH) de 24h en los pacientes con FPI candidatos a trasplante pulmonar.
Material y métodosEstudio retrospectivo, descriptivo y observacional realizado en un centro de tercer nivel. Se realizaron estudios de HRM e MII-pH de 24h como parte del protocolo de candidatos a trasplante pulmonar. Se analizaron los datos manométricos y de impedanciometría incluyendo el gradiente de presión toracoabdominal (GPTA).
ResultadosSe incluyeron 37 pacientes. La media de DCI fue de 1530.47mmHg/cm/s (DE±1210.03). Catorce (37.8%) presentaron motilidad esofágica ineficaz (MEI). Los pacientes con MEI tenían una mediana de porcentaje de tiempo de exposición al ácido (TEA) de 3.20% (rango: 1.42-4.90) vs. 0.50% (rango: 0.2-2.90) en los pacientes con motilidad esofágica normal (p=0.022). La media del porcentaje de TEA fue del 3.02% (DE±4.17). La media de episodios proximales de reflujo fue 25.88 (DE±19.37). Cinco (13.5%) pacientes tuvieron un TEA anormal y estos presentaron una media de GPTA de 14.66mmHg (DE±4.89) vs. 17.09mmHg (DE±6.92) en aquellos con un TEA <6% (p=0.457).
ConclusionesCasi el 40% de los pacientes con FPI candidatos a trasplante tienen MEI. Sin embargo, la prevalencia de ERGE es baja y no se asocia a cambios en el GPTA.
Gastroesophageal reflux disease (GERD) is highly prevalent in patients with idiopathic pulmonary fibrosis (IPF), even in the absence of symptoms. Information on this disease in Latin America is limited. The aim of our study was to determine the prevalence of dysmotility and GERD through high-resolution esophageal manometry (HREM) and 24h multichannel intraluminal impedance-pH (MII-pH) monitoring in IPF patients, candidates for lung transplantation.
Material and methodsA retrospective, descriptive, observational study was conducted at a tertiary care hospital center. HREM and 24h MII-pH studies were carried out as part of the protocol for lung transplantation candidates. The manometric and impedance data, including the thoracoabdominal pressure gradient (TAPG), were analyzed.
ResultsThe study included 37 patients. The mean distal contractile integral was 1530.47mmHg-s-cm (SD±1210.03). Fourteen patients (37.8%) presented with ineffective esophageal motility (IEM). The median percentage of acid exposure time (AET) was 3.20% (range: 1.42-4.90) in the patients with IEM versus 0.50% (range: 0.2-2.90) in the patients with normal esophageal motility (P=.022). The mean AET percentage was 3.02% (SD±4.17) and the mean number of proximal reflux episodes was 25.88 (SD±19.37). Five patients (13.5%) had abnormal AET and a mean TAPG of 14.66mmHg (SD±4.89) versus 17.09mmHg (SD±6.92) in patients with AET<6% (P=.457).
ConclusionsAlmost 40% of the patients with IPF, who were candidates for lung transplantation, had IEM. However, the prevalence of GERD was low and not associated with changes in the TAPG.
La fibrosis pulmonar idiopática (FPI) es la enfermedad pulmonar intersticial más común1. Se caracteriza por ser crónica, progresiva y afectar principalmente a los adultos mayores2. En los EE. UU. su prevalencia es de 10 a 60 casos por 100,000 personas, sin embargo, esta cifra puede llegar a ser tan alta como 494 casos por 100,000 personas en los mayores de 65 años3,4. La prevalencia de esta enfermedad en México se desconoce, sin embargo, en promedio cada neumólogo de México diagnostica 8 pacientes con FPI por año5. La FPI tiene una evolución clínica desfavorable, actualmente cuenta con una mediana de sobrevida de 3.8 años4, un elevado índice de hospitalización y un alto impacto económico en el sistema de salud6.
En la actualidad, la etiología de la FPI permanece poco clara, sin embargo, se han propuesto factores de riesgo que contribuyen a su desarrollo (tabaquismo, fármacos, exposición laboral y ambiental). Adicionalmente, la enfermedad por reflujo gastroesofágico (ERGE) es un factor de riesgo ampliamente conocido7. Se teoriza que el mecanismo por el cual la ERGE incrementa el riesgo de FPI es debido a microaspiraciones del contenido gástrico, las cuales causan un insulto epitelial pulmonar crónico que conlleva al desarrollo de fibrosis8. Por otra parte, también se ha propuesto a la FPI como causa de ERGE9 debido a que la disminución en la complianza pulmonar en la FPI provoca un aumento de la presión negativa intratorácica y del gradiente de presión toracoabdominal (GPTA)10. Debido a la naturaleza de presión positiva del abdomen y al entorno de presión negativa del tórax, existe una tendencia a que el líquido gástrico fluya del estómago al esófago, y el GPTA determinaría la magnitud de este flujo. Los candidatos a trasplante pulmonar con un grado de FPI avanzada presentan una presión torácica más negativa y en consecuencia un mayor GPTA por lo que se espera que presenten una mayor prevalencia de la ERGE11,12. Adicionalmente, los datos apoyan una asociación entre la ERGE y la lesión del aloinjerto en los pacientes que se someten a trasplante pulmonar, por lo que se fomenta una estrategia de diagnóstico precoz y tratamiento intensivo de la ERGE en los receptores de trasplante pulmonar para mejorar los resultados en este grupo de pacientes13.
El objetivo del presente estudio fue documentar los resultados de la evaluación mediante manometría esofágica de alta resolución (HRM) e impedanciometría multicanal con pHmetría (IMM-pH) de 24h en los pacientes con diagnóstico de FPI candidatos a trasplante pulmonar, y evaluar la asociación entre el GPTA y la prevalencia de la ERGE en nuestra cohorte.
Pacientes y métodosSe llevó a cabo un estudio retrospectivo, descriptivo y analítico durante el período de marzo del 2021 a marzo del 2024. Durante el período evaluado se realizaron tanto HRM, como MII-pH de 24h de manera consecutiva en 37 pacientes con diagnóstico de FPI como parte del protocolo de candidatos a trasplante pulmonar. Los pacientes fueron diagnosticados en el Servicio de Neumología del Hospital Universitario «Dr. José Eleuterio González» con base en criterios clínicos y de imagen establecidos para el diagnóstico de FPI.
Se consideró diagnóstico definitivo de FPI en los pacientes: a) en los que se haya excluido otras entidades clínicas definidas o enfermedades pulmonares parenquimatosas difusas de causa conocida (exposición ambiental u ocupacional, enfermedades del tejido conectivo, toxicidad farmacológica) y b) la presencia de un patrón histológico de neumonía intersticial usual en el examen del tejido pulmonar obtenido mediante biopsia pulmonar quirúrgica, o evidencia radiológica de un patrón de neumonía intersticial usual en la tomografía computarizada de alta resolución, o ambas14.
Se incluyeron todos los pacientes adultos con diagnóstico de FPI en protocolo de trasplante pulmonar que fueron enviados al Servicio de Gastroenterología del Hospital «José Eleuterio González» y que completaron el protocolo de Chicago 4.0 durante la manometría esofágica de alta resolución y que, además, fueron sometidos a pHmetría con impedanciometría de 24h.
Los pacientes que contaran con un diagnóstico confirmado de ERGE previo a su enfermedad pulmonar o aquellos en quienes no fue posible realizar el protocolo completo de HRM o MII-pH fueron excluidos. De la misma manera, los pacientes con síntomas típicos de ERGE, los pacientes que presentaran una unión esofagogástrica (UEG) tipo III en el análisis de HRM y los pacientes con obesidad grado III al momento del estudio fueron excluidos del análisis. En caso de que el paciente estuviera bajo tratamiento con un supresor de ácido (inhibidor de bomba de protones, antagonistas de receptores H2 o bloqueadores de ácido competitivos de potasio) este fue suspendido al menos 7 días previos al estudio de HRM y MII-pH de 24h.
Protocolo de manometría esofágica de alta resoluciónLos pacientes se presentaron al Servicio de Gastroenterología del Hospital Universitario «Dr. José Eleuterio González» para la realización de su estudio de HRM. Todos los pacientes tuvieron un ayuno de 8h. Medicamentos que alteraran la motilidad esofágica y la relajación del esfínter esofágico inferior (EEI) fueron descontinuados al menos 7 días previo al estudio. Todos los estudios fueron realizados por un experto en neurogastroenterología (GTB) utilizando un catéter de manometría de estado sólido con 36 transductores de presión circunferencial espaciados a intervalos de 1cm (ManoScan™; Sierra Scientific Instruments, Los Ángeles, CA, EE. UU.). El catéter se calibró de 0 a 300mmHg mediante presión aplicada externamente previo a su uso. A continuación, se introdujo el catéter vía transnasal colocándose para registrar la presión desde la faringe hasta el estómago, permitiendo registrar de manera simultánea la presión del esfínter esofágico superior (EES), el cuerpo esofágico, la presión intratorácica, el esfínter esofágico inferior (EEI), la crura diafragmática (CD) y la presión gástrica.
Los pacientes fueron colocados en posición de decúbito (a 30°), seguido de un período de estabilización de 60s. Luego se les pidió que realizaran 3 respiraciones profundas, seguido de un período basal en el cual los pacientes no realizaron degluciones durante un período de 30s. Este período se utilizó para la medición de la presión en reposo de las estructuras de la UEG. Posterior a esto se administró 5ml de agua a temperatura ambiente, se le solicitó al paciente que diera un trago único y esto se repitió en 10 ocasiones. Se realizó como maniobra de provocación, la prueba de tragos múltiples (5 tragos de 2ml consecutivos). Luego de la maniobra de tragos múltiples, se les solicitó a los pacientes que se colocaran en posición sentado, seguido de un período de adaptación de 60s, 3 respiraciones profundas y un período basal de 30s. Se administraron 5 tragos sencillos de 5ml de agua cada uno. Al finalizar se realizó la prueba de ingesta rápida de 200ml. Todos los estudios fueron analizados por el Dr. GTB siguiendo las normativas de análisis y clasificación de la función motora esofágica y de la UEG sugeridas por la clasificación de Chicago 4.015. El diagnóstico de motilidad esofágica ineficaz (MEI) se definió como >70% de degluciones ineficaces o ≥50% de degluciones fallidas15.
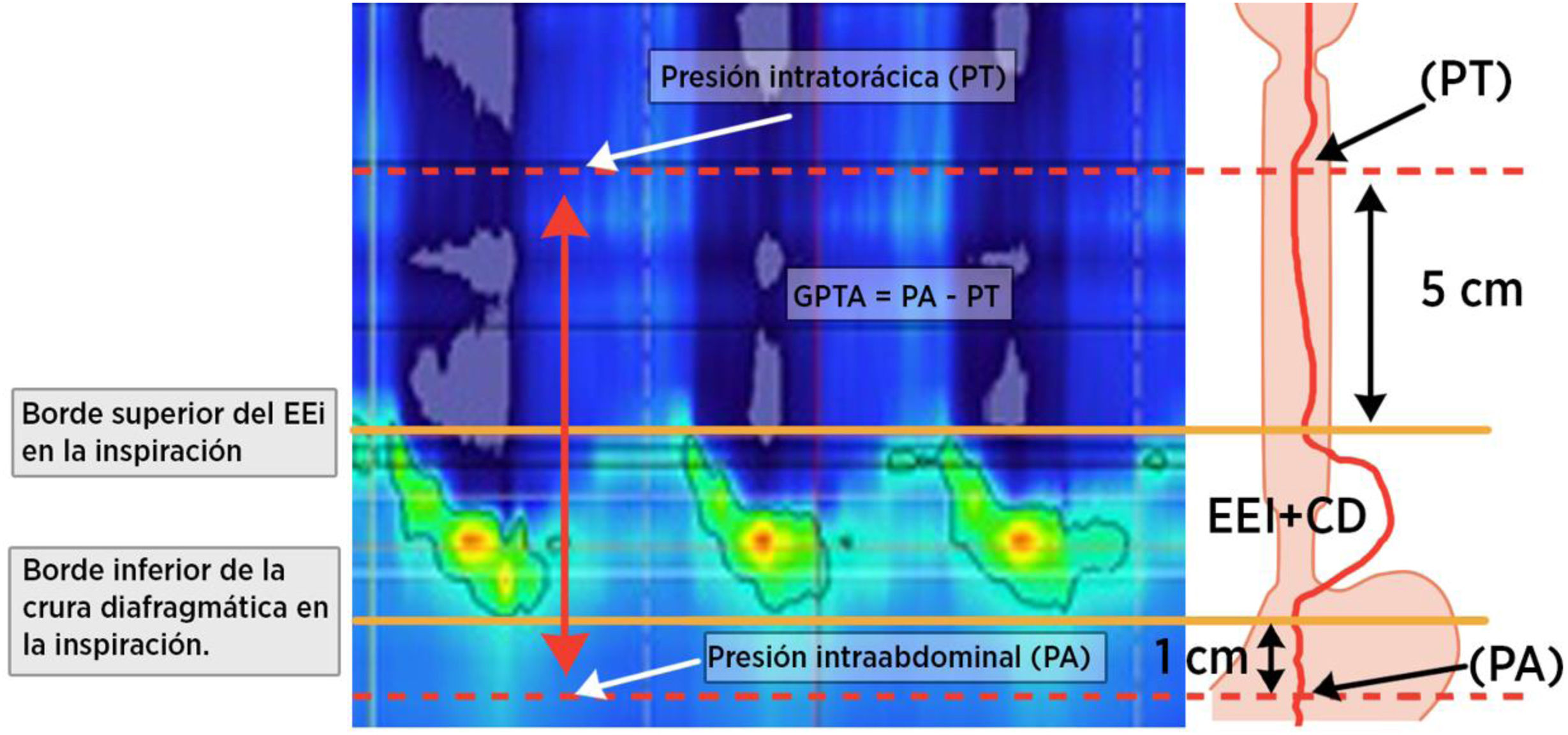
Análisis del gradiente de presión toracoabdominalUtilizando la fase de reposo en decúbito supino de los estudios de HRM, se evaluaron la presión abdominal, la presión torácica y el GPTA (fig. 1). La presión abdominal se definió como la presión 1cm por debajo del borde inferior de la CD en inspiración (referida a la presión atmosférica), la presión torácica se definió como la presión 5cm por encima del borde superior del EEI en inspiración (referida a la presión atmosférica). El GPTA fue definido como la diferencia de presión entre la presión gástrica/abdominal y la presión negativa esofágica/torácica16.
Impedanciometría multicanal con pHmetría de 24hPosterior al estudio de HRM, se obtuvo la localización del borde superior del EEI en la posición sentada. Se utilizó un equipo ZepHr® Impedance/pH Reflux Monitoring System (Diversatek Healthcare). En cada paciente se colocó vía transnasal el catéter multicanal de pH-impedanciometría ZAN-BG-44 Diversatek Healthcare. El canal encargado de la medición del pH esofágico se colocó 5cm por encima del borde del EEI. La duración mínima del estudio fue de 16h y máxima de 24h. Se analizaron los trazados de MII-pH de 24h de cada paciente por el Dr. GTB, teniendo en cuenta las siguientes variables:
- •
Número total de episodios de reflujo gastroesofágico por impedancia. Se consideró como anormal >80 episodios de reflujo.
- •
Score de DeMeester (valor anormal >14.72).
- •
Cantidad de episodios de reflujo que alcanzan canales proximales.
- •
Porcentaje de tiempo de exposición al ácido (TEA).
El diagnóstico de ERGE fue definido exclusivamente como un TEA>6% de la duración total del estudio de pHmetría e impedanciometría17.
Análisis estadísticoSe realizó un análisis descriptivo y se presentó como frecuencias (%) las variables categóricas y como medianas (q25-q75) o media (±DE) las variables cuantitativas. Las variables cuantitativas se compararon con la prueba de la t de Student y la U de Mann-Whitney según correspondiera. Las variables categóricas con la prueba de Chi-cuadrado de Pearson. La correlación de Spearman se utilizó para probar la asociación entre 2 variables numéricas. Para realizar el análisis estadístico se utilizó SPSS® versión 22.0 (IBM SPSS Statistics for Windows, IBM Corp., Armonk, NY, EE. UU.), considerando significativo un valor de p<0.05.
ResultadosSe incluyeron un total de 37 pacientes con diagnóstico de FPI, candidatos a trasplante pulmonar. La mediana de edad fue 62 (rango: 52-65) años. Veinte (54.1%) pacientes eran varones y 17 (45.9%) mujeres. La media del índice de masa corporal (IMC) fue de 25.74 (DE±3.96). Dieciséis (43.3%) pacientes tenían un peso normal, 14 (37.8%) sobrepeso y 7 (18.9%) obesidad grado 1.
Manometría esofágica de alta resoluciónEn la totalidad de nuestra cohorte el promedio de la presión media del esfínter esofágico inferior (EEI) fue de 27mmHg (DE±14.53). La media de longitud del EEI fue de 2.52 (DE±0.61) cm. La UEG tipo I estuvo presente en 26 (70.3%) pacientes y la UEG tipo II en el resto de pacientes. La media de la presión intratorácica fue de −4.98 (DE±3.88) y la media de presión intraabdominal fue de 11.78 (DE±6.94). La media del GPTA fue de 16.76mmHg (DE±6.68), la media de integrated relaxation pressure (IRP) fue de 7.77mmHg (DE±4.61) y la media de distal contractile integral (DCI) fue de 1530.47mmHg/cm/s (DE±1210.03). En los pacientes con peso normal la media de presión abdominal fue de 11.30 (DE±7.69), en sobrepeso fue de 11.92 (DE±4.40) y en los pacientes con obesidad fue de 11.88 (DE±6.31) (p=0.965). La media del GPTA en los pacientes con peso normal fue de 17.64 (DE±6.94), en sobrepeso fue de 18.12 (DE±4.55) y en obesidad de 13.54 (DE±6.25) (p=0.253).
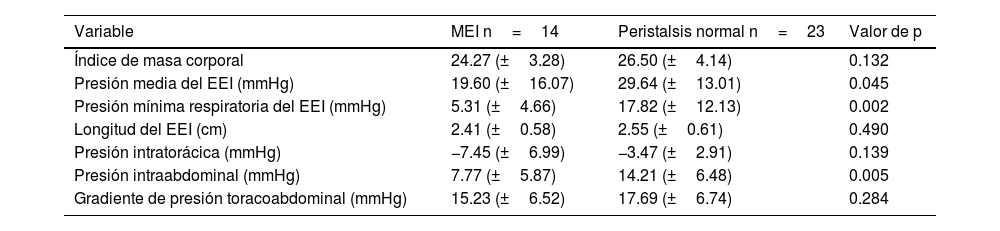
Catorce (37.8%) pacientes cumplieron criterios de MEI de acuerdo a la clasificación de Chicago 4.0, el resto de los pacientes fueron diagnosticados con motilidad esofágica normal. El grupo de pacientes con MEI tenían una media del GPTA de 15.23 (DE±6.52) vs. 17.69 (DE±6.74) en aquellos con motilidad esofágica normal (p=0.284). Asimismo, los pacientes con MEI tenían una mediana de TEA de 3.20 (rango: 1.42-4.90) vs. 0.50 (rango: 0.2-2.90) en los pacientes con motilidad esofágica normal (p=0.022). El resto de los hallazgos manométricos del grupo de pacientes con MEI se detallan en la tabla 1.
Características clínicas y manométricas de los pacientes con fibrosis pulmonar idiopática (comparación entre los pacientes con MEI y motilidad esofágica normal)
| Variable | MEI n=14 | Peristalsis normal n=23 | Valor de p |
|---|---|---|---|
| Índice de masa corporal | 24.27 (±3.28) | 26.50 (±4.14) | 0.132 |
| Presión media del EEI (mmHg) | 19.60 (±16.07) | 29.64 (±13.01) | 0.045 |
| Presión mínima respiratoria del EEI (mmHg) | 5.31 (±4.66) | 17.82 (±12.13) | 0.002 |
| Longitud del EEI (cm) | 2.41 (±0.58) | 2.55 (±0.61) | 0.490 |
| Presión intratorácica (mmHg) | −7.45 (±6.99) | −3.47 (±2.91) | 0.139 |
| Presión intraabdominal (mmHg) | 7.77 (±5.87) | 14.21 (±6.48) | 0.005 |
| Gradiente de presión toracoabdominal (mmHg) | 15.23 (±6.52) | 17.69 (±6.74) | 0.284 |
EEI: esfínter esofágico inferior; MEI: motilidad esofágica ineficaz.
En nuestro grupo de pacientes la media del porcentaje de tiempo de exposición a un pH<4 fue del 3.02% (DE±4.17). La media del total de episodios de reflujo por impedancia fue de 44.51 (DE±22.75). La media de episodios proximales de reflujo por impedancia fue de 25.88 (DE±19.37). Solamente 3 (8.1%) pacientes presentaron más de 80 episodios de reflujo durante el estudio. La media del puntaje de DeMeester fue de 11.21 (DE±15.28). Ocho (21.6%) pacientes presentaron un puntaje de DeMeester 5. Cuatro (10.8%) pacientes tuvieron una exposición al ácido entre el 4 y el 6%, y 5 (13.5%) tuvieron una exposición anormal al ácido (pH <4, al menos el 6% del tiempo total del estudio). De estos 5 pacientes con exposición anormal al ácido, 2 (14.3%) tuvieron MEI (p=0.915). La media de presión del esfínter esofágico inferior en aquellos pacientes con un TEA>6% fue de 20.62 (DE±9.79) vs. 26.66 (DE±15.47) en los pacientes con un TEA≤6% (p=0.406).
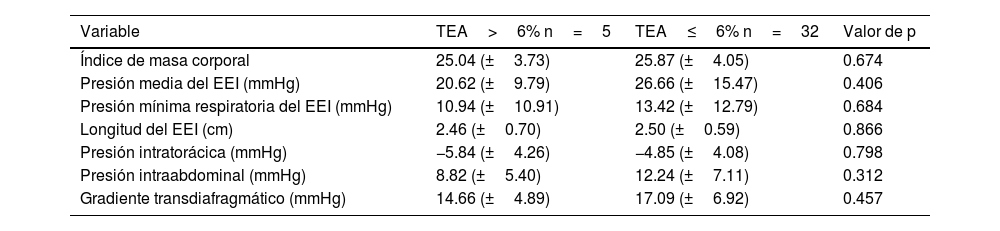
Gradiente toracoabdominal y enfermedad por reflujo gastroesofágicoEl grupo de pacientes con un TEA anormal tenían una media del GPTA de 14.66 (DE±4.89) vs. 17.09 (DE±6.92) en aquellos con un TEA<6% (p=0.457). El grupo de pacientes con un número mayor a 80 episodios totales de reflujo por impedancia tuvieron una media del GPTA de 12.73 (DE±5.26) vs. 17.12 (DE±6.73) en aquellos con menos episodios de reflujo (p=0.282). Los pacientes con un puntaje de DeMeester anormal obtuvieron una media del GPTA de 16.86 (DE±5.30) vs. 16.73 (DE±7.09) en aquellos con un puntaje de DeMeester normal (p=0.964). Se encontró una correlación negativa entre el número de episodios de reflujo proximales y el GPTA (rs=−0.235, p=0.248).
El resto de los hallazgos manométricos de los pacientes con exposición normal y anormal al ácido se detallan en la tabla 2.
Características clínicas y manométricas de los pacientes con fibrosis pulmonar idiopática (comparación entre los pacientes con TEA normal y anormal)
| Variable | TEA>6% n=5 | TEA≤6% n=32 | Valor de p |
|---|---|---|---|
| Índice de masa corporal | 25.04 (±3.73) | 25.87 (±4.05) | 0.674 |
| Presión media del EEI (mmHg) | 20.62 (±9.79) | 26.66 (±15.47) | 0.406 |
| Presión mínima respiratoria del EEI (mmHg) | 10.94 (±10.91) | 13.42 (±12.79) | 0.684 |
| Longitud del EEI (cm) | 2.46 (±0.70) | 2.50 (±0.59) | 0.866 |
| Presión intratorácica (mmHg) | −5.84 (±4.26) | −4.85 (±4.08) | 0.798 |
| Presión intraabdominal (mmHg) | 8.82 (±5.40) | 12.24 (±7.11) | 0.312 |
| Gradiente transdiafragmático (mmHg) | 14.66 (±4.89) | 17.09 (±6.92) | 0.457 |
EEI: esfínter esofágico inferior; TEA: tiempo de exposición al ácido.
El objetivo del presente estudio fue describir los hallazgos manométricos y de pHmetría con impedancia en los pacientes con FPI candidatos a trasplante pulmonar, además de evaluar la asociación entre el GPTA y la ERGE. Lo anterior debido a que en la actualidad se ha reportado una alta incidencia de ERGE en los pacientes con FPI la cual oscila entre un 60 y un 90% en países desarrollados18–22. Esto debido principalmente a cambios en la presión torácica de los pacientes, causando un mayor GPTA y en consecuencia una mayor exposición de reflujo ácido23–25. Sin embargo, en nuestra cohorte la prevalencia fue significativamente menor que lo reportado en la literatura previa (13.8%). Una posible explicación es que se excluyeron en nuestro estudio aquellos pacientes con factores de riesgo independientes para la ERGE (hernia hiatal26, tabaquismo27,28, IMC elevado29). También es probable que la diferencia de nuestro estudio con los previos es que estudiamos pacientes con FPI altamente seleccionados (p. ej., se descartaron pacientes con diagnóstico previo de reflujo), para poder evaluar si efectivamente las alteraciones del GPTA podrían ser un factor determinante del TEA anormal en esta población de pacientes. Existen pocos estudios que evalúen la influencia del GPTA en el desarrollo del TEA anormal en los pacientes con FPI candidatos a trasplante pulmonar, y de acuerdo con la baja prevalencia es probable que en estos pacientes las alteraciones de dinámicas de presión toracoabdominal no sean más que un epifenómeno.
Se ha propuesto que un GPTA elevado facilitará el reflujo gastroesofágico al vencer la presión de la UEG. Este gradiente suele encontrarse elevado en los pacientes con obesidad, consecuencia de un aumento de la presión intraabdominal30,31, y en aquellos con enfermedades pulmonares severas, por aumento de la presión intratorácica11,24. Es importante destacar que, a diferencia de otros estudios30,31, el IMC no influyó de manera significativa sobre la presión intraabdominal ni el GPTA en nuestros pacientes. Este gradiente tampoco tuvo influencia significativa en el TEA, el número de episodios de reflujo, o el puntaje de DeMeester de nuestra cohorte, en consonancia con reportes previos16,30–32.
Por otra parte, se sabe que la UEG funciona como una barrera anatómica y fisiológica contra el reflujo gastroesofágico. La evaluación de sus componentes mediante HRM ha cobrado relevancia en los últimos años, ya que se ha postulado que una UEG competente puede fungir como adyuvante contra el reflujo gastroesofágico. De acuerdo con el consenso de Lyon 2.017, los hallazgos manométricos que se han asignado como evidencia de soporte en el diagnóstico de ERGE son la presencia de hernia hiatal, una UEG débil (integral contráctil menor a 25mmHg/cm)15 y la MEI/contractilidad ausente.
Las alteraciones motoras esofágicas son frecuentes en la FPI. El hallazgo comúnmente asociado en este grupo de pacientes es la MEI, con una prevalencia que va desde el 17 hasta el 45% en estudios recientes33,34. La MEI estuvo presente hasta en un 38% de nuestros pacientes. Este trastorno se ha asociado con un empeoramiento de la severidad de la ERGE y mayor número de reflujos proximales33 debido a la inadecuada eliminación esofágica del reflujo gástrico. El TEA en nuestros pacientes con MEI fue significativamente mayor, sin embargo, el TEA esofágico y la media de eventos de reflujo proximales no fueron mayores que los de los pacientes con motilidad esofágica normal.
A pesar de no alcanzar significancia estadística, la presión intratorácica fue el doble de negativa en los pacientes con MEI que en los de motilidad normal, sin embargo, el GPTA fue similar entre ambos grupos. Esto debido a que la presión intraabdominal fue significativamente mayor en aquellos con motilidad esofágica normal, posiblemente debido a un mayor IMC estos últimos.
El trasplante pulmonar es crucial en el tratamiento de la FPI. Este provee una sobrevida aproximada del 55% a 5 años postrasplante35. La disfunción crónica del injerto es la principal causa de muerte en este grupo, y se manifiesta predominantemente como bronquiolitis obliterante36,37. El diagnóstico de MEI en los candidatos a trasplante pulmonar ha sido asociado recientemente a un aumento de rechazo agudo del injerto34. Al ser un diagnóstico tan frecuente en nuestra cohorte, su presencia debe tomarse en consideración ya que es posible que este subgrupo de pacientes se beneficie de un seguimiento más estrecho y así evitar un rechazo temprano del injerto en el posoperatorio.
Nuestros resultados están limitados por el tamaño relativamente reducido de la muestra y que los hallazgos corresponden a una cohorte de un solo centro y en una población muy seleccionada. Adicionalmente, no fue posible evaluar la utilidad de la impedancia basal nocturna media ni la asociación sintomática en nuestro grupo de pacientes ya que dicha información no se encontraba disponible. Si bien describimos las alteraciones previas al trasplante pulmonar, sería interesante saber cuál es la prevalencia de estas alteraciones y conocer si estas son permanentes o reversibles. A pesar de estas limitaciones, la documentación detallada de los hallazgos manométricos y de MII-pH de 24h en nuestros pacientes proporciona información valiosa sobre la influencia de estos hallazgos en el desarrollo de la ERGE en los pacientes con FPI.
En conclusión, nuestros hallazgos sugieren una mayor atención a la motilidad esofágica en los pacientes con FPI, ya que casi el 40% de los pacientes con FPI candidatos a trasplante tuvieron MEI. Sin embargo, la prevalencia de la ERGE es baja, y no se asocia a cambios en el GPTA. Sin embargo, se necesitan estudios prospectivos y postrasplante con una muestra mayor que corroboren dichos hallazgos.
FinanciaciónEl presente trabajo no recibió financiación de ningún tipo.
Consideraciones éticasLos pacientes fueron sometidos al protocolo de estudio previo a su trasplante pulmonar. El presente estudio describe los hallazgos clínicos encontrados en este grupo de pacientes, de manera anónima y recopilados de manera retrospectiva. Por lo que no se requirió consentimiento informado ni autorización por parte del comité de ética.
No se expone el nombre ni los resultados individuales de ningún paciente durante el presente manuscrito.
Conflicto de interesesLos autores declaran que no tienen conflicto de intereses en el presente manuscrito.