La enfermedad celiaca (EC) es una enteropatía autoinmune inducida por el gluten del trigo dietético, con serias consecuencias si no se diagnostica y trata tempranamente. Hay además otras alteraciones asociadas a la ingestión de gluten, que es importante conocer, por su multiplicidad de presentaciones clínicas.
ObjetivosDescribir los patrones más comunes de presentación de EC y alteraciones asociadas al gluten en niños de la región noroeste de México, con incipiente conocimiento de su prevalencia.
Pacientes y métodosSe registraron la edad, el género, la historia familiar y los síntomas gastro y extraintestinales, en 24 pacientes, entre 2006 y 2010. Se recogieron datos bioquímicos y hematológicos. Se analizaron anticuerpos antigliadinas y antitransglutaminasa en todos los casos; haplotipos (HLA-DQ2/DQ8) y biopsia duodenal en parte de los mismos.
ResultadosDe los 24 pacientes (14 mujeres y 10 varones), 13 presentaron EC típica con síntomas de mala absorción gastrointestinal; 7 promediando 5 años de edad, con EC no típica; 2 iniciaron con problemas gastro y extraintestinales (neurológicos), y 2 con otros desórdenes asociados al gluten. Todos presentaron serología positiva; 11/15 presentaron HLA-DQ2/DQ8 y 4 al menos un alelo; las 6 biopsias tomadas, mostraron mucosa dañada. Una tercera parte estaban anémicos, 6 con albúmina < 3.5g/dL, 4 con deficiencias de minerales. El 83% de los pacientes mejoró con la dieta sin gluten.
ConclusionesLos patrones de presentación fueron: 1) EC típica; 2) EC no típica; 3) EC con síntomas gastro y extraintestinales (neurológicos), y 4) sin EC, con otros desórdenes relacionados con el gluten.
Celiac disease (CD) is an autoimmune enteropathy induced by dietary wheat gluten that can have serious consequences if not diagnosed and treated early. It is important to be familiar with other alterations associated with gluten ingestion due to the multiplicity of clinical presentations.
ObjectivesTo describe the most common CD presentation patterns and alterations associated with gluten in children from the northwest region of Mexico, with an incipient knowledge of its prevalence.
Patients and methodsAge, sex, family history, and gastrointestinal and extraintestinal symptoms were recorded in 24 patients within the time frame of 2006 to 2010. Biochemical and hematologic data were collected. Anti-gliadin and anti-transglutaminase antibodies were analyzed in all the cases, and haplotypes (HLA-DQ2/DQ8) and duodenal biopsy were evaluated in some of the cases.
ResultsOf the 24 patients (14 girls and 10 boys), 13 presented with typical CD with symptoms of poor gastrointestinal absorption; 7 patients with a mean age of 5 years presented with atypical CD; 2 had disease onset with gastrointestinal and extraintestinal (neurologic) problems; and 2 with other gluten-related disorders. All of the patients had positive serology; 11/15 presented with HLA-DQ2/DQ8 and 4 with at least one allele; damaged mucosa was observed in the 6 biopsies taken. A third of the patients were anemic, 6 presented with an albumin value of<3.5g/dL, and 4 with mineral deficiencies. A total of 83% of the patients improved with a gluten-free diet.
ConclusionsThe presentation patterns were: 1) typical CD, 2) atypical CD, 3) CD with gastrointestinal and extraintestinal (neurologic) symptoms, and 4) gluten-related disorders other than CD.
La enfermedad celiaca (EC) es sistémica, está mediada inmunológicamente, es precipitada por exposición al gluten dietario y se desarrolla en individuos genéticamente susceptibles. Se caracteriza por diversas manifestaciones clínicas, anticuerpos específicos, haplotipos HLA-DQ2 y DQ8 y enteropatía1,2.
La EC se presenta con una amplia variedad de signos y síntomas no específicos que pueden ser gastrointestinales o extraintestinales. Así, se ha clasificado en típica, no típica, asintomática, subclínica y potencial2-4. La EC pediátrica típica se caracteriza por retardo del crecimiento, diarrea, emaciación, pérdida del apetito y distensión abdominal; cuando aparece con cualquier otro signo o síntoma, no es típica. La EC asintomática o silente no presenta síntomas ni signos para la sospecha clínica y se dice que es subclínica cuando está bajo el umbral de la detección clínica. La EC potencial, en algunos tratados llamada latente, se define por la presencia de anticuerpos y haplotipos compatibles, pero sin anormalidades en la mucosa duodenal; puede o no presentar síntomas o enteropatía1,2.
Hay además una entidad recientemente reconocida, llamada sensibilidad o hipersensibilidad al gluten no celiaca2,5. Se caracteriza por síntomas clínicos (gastrointestinales) muy similares a los de la EC; los pacientes presentan títulos positivos de anticuerpos antigliadinas, pero negativos los de anticuerpos antitransglutaminasa5. Los enfermos no presentan atrofia de las vellosidades intestinales, pero sí infiltración de eosinófilos en la mucosa duodenal y de colon; además, no presentan alergias ligadas a IgE. En muchos casos de hipersensibilidad, los pacientes tienen haplotipos HLA-DQ2 y DQ8 y en todos los casos sus síntomas se resuelven en una dieta sin gluten.
También está bien caracterizada la EC refractaria, que se define por sus síntomas de mala absorción persistentes o recurrentes y la atrofia de las vellosidades intestinales, a pesar de la dieta estricta sin gluten durante 6-12 meses2,6. La EC refractaria puede ser de tipo 1 o 2. En el primero, los pacientes no responden a la dieta sin gluten, pero sus linfocitos intraepiteliales son normales. El tipo 2 se caracteriza por clonas de linfocitos intraepiteliales anormales, que no presentan los marcadores CD3, CD8 y receptor de células T, pero expresan CD3 intracelularmente, y se asocia a un pobre pronóstico, debido a que puede evolucionar a linfoma de células T6,7.
Con esta diversidad de signos y síntomas, el diagnóstico de EC y otras alteraciones asociadas al gluten suele complicarse y se oscurece la dimensión del problema. Se estima que entre 1:100 y 1:200 individuos de cualquier población presenta alguna forma de EC; sin embargo, los datos publicados difieren entre sí. Por ejemplo, para la población mexicana, el análisis de sueros de donadores sanos para anticuerpos IgA antitransglutaminasa resultó en una prevalencia de 1:378; cuando se reanalizó para anticuerpos antiendomisio, disminuyó a 1:1689. En contraste, en un estudio reciente de 7,798 personas en los Estados Unidos, 1:141 fueron celiacos; mientras que entre 1,686 méxico-americanos, en ese mismo estudio, no hubo uno solo positivo10, usando los mismos indicadores serológicos.
Las consecuencias de la EC en la salud, si no se diagnostica y trata de forma temprana, pueden ser muy graves, especialmente en los niños, ya que afecta a su crecimiento y desarrollo. En México, recién se inicia el diagnóstico y atención de la EC. Así, el objetivo de este trabajo fue describir los patrones más comunes de presentación de EC y otras alteraciones asociadas al gluten, en niños de la región noroeste de México, con incipiente conocimiento de su prevalencia.
Pacientes y métodosEntre el año 2006 y el 2010, previa invitación y conocimiento informado a los padres de los niños y adolescentes, se incluyó de manera secuencial a 47 pacientes con cuadro clínico sospechoso de EC, de los cuales fueron descartados 23 por tener marcadores serológicos y/o haplotipos negativos o demostrarse otra afección. De esta manera, se seleccionó a 24 pacientes que forman parte de este informe. Las variables consideradas fueron: edad, género, antecedentes heredo-familiares y existencia de enfermedades, como: diabetes mellitus de tipo 1, tiroiditis, osteoporosis, síndrome de Down, neuropatía periférica, ataxia y trastornos conductuales. De acuerdo con las definiciones de Oslo, los síntomas considerados típicos fueron diarrea crónica, distensión abdominal, pérdida de peso o retardo del crecimiento, pérdida de apetito y emaciación2. Se consideraron no típicos cuando la presentación fue con síntomas gastrointestinales aislados, como reflujo gastroesofágico, o que no presentan mala absorción, como constipación y dolor abdominal2; así como con síntomas extraintestinales, como anemia, neuropatía, fatiga y baja densidad ósea1,2.
Los estudios de laboratorio colectados fueron biometría hemática, hierro sérico, urea creatinina, glucosa, calcio, albúmina, análisis coproparasitoscópico y, en algunos casos, prueba de absorción de D-xilosa en sangre u orina. En todos los casos, se realizaron exámenes serológicos específicos de anticuerpos IgG e IgA antigliadinas, así como IgA antitransglutaminasa por ensayo inmunoabsorbente ligado a enzimas (ELISA), como se hizo previamente11. El punto de corte fue el promedio+2 DE de la densidad óptica de 30 muestras de sueros de niños sanos. La reactividad se expresó como un índice; esto es, la densidad óptica del suero a probar divida entre el valor del punto de corte. Los índices iguales o mayores de 1.0 se consideran positivos12. Entre 1 y 5 son títulos bajos, entre 5-10 modestos, entre 10 y 20 altos, y mayores de 20 muy altos. En 15 de los niños se analizaron el ADN extraído de sangre total, los haplotipos HLA-DQ2 y HLA-DQ8 por PCR convencional, usando los iniciadores diseñados por Olerup et al.13. En 6 casos se realizó y analizó biopsia de la mucosa intestinal tomada con cápsula peroral o por endoscopia.
El seguimiento dietario se realizó con el apoyo de una guía dietaria para niños celiacos entre 1 y 6 años de edad14. Así mismo, durante el seguimiento se continuó evaluando los anticuerpos específicos hasta que fueron negativos.
El proyecto de estudio fue aprobado por los comités de ética del Hospital Infantil de Estado de Sonora y del Centro de Investigación en Alimentación y Desarrollo, A.C.
El trabajo es una descripción de casos y para los ELISA los índices son promedio de al menos 4 diluciones, por duplicado (8 lecturas de absorbancia).
ResultadosDe 24 pacientes, 14 fueron del género femenino y 10 del masculino. Todos excepto uno, que al inicio del estudio ya estaba en dieta sin gluten, presentaron índices positivos de anticuerpos IgA e IgG antigliadinas. Ese mismo caso y 2 menores de 2 años fueron negativos para IgA antitransglutaminasa; el resto presentó índices positivos. Cuatro de los pacientes presentaron índices de anticuerpos específicos muy altos, 5 altos, 2 modestos y los otros 13, bajos. De 15 de los niños a los que se analizó predisposición genética, 7 tuvieron HLA-DQ2, 4 HLA-DQ8 y los 4 restantes al menos un alelo de uno de los 2 haplotipos. Los signos de desnutrición, afectando incluso al desarrollo, se dieron en 3 de los niños, con déficit de peso mayor al 40%; 7 presentaron déficit entre 26 y 39%, y uno, déficit de 22%. En cuanto a los minerales, 6 presentaron menos de 40 ug/dL de hierro sérico, en 8 la hemoglobina fue menor a 10g/dL y 4 presentaron hipocalcemia.
Considerando los signos y síntomas, los índices de anticuerpos específicos y, en algunos casos, haplotipos o biopsia se clasificaron los patrones de presentación más comunes de la muestra, en 4 grupos: 1) EC con presentación típica; 2) EC con inicio no típico; 3) EC con síntomas gastro y extraintestinales (problemas de mala absorción y neurológicos), y 4) con trastornos relacionados con el gluten, no celiacos.
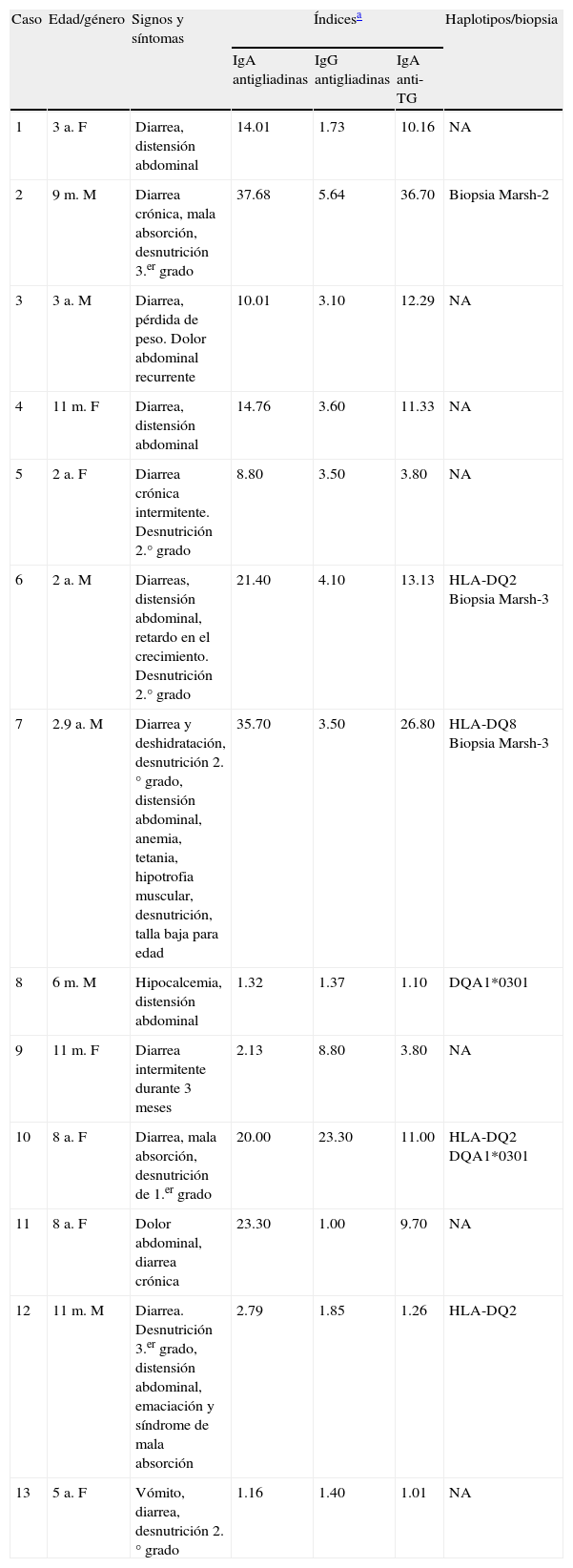
En la tabla 1 se presentan 13 casos, 10 de los cuales tenían entre 6 meses y 3 años de edad, con características de desarrollo de la EC típica. Esto es, niños pequeños, con síntomas gastrointestinales repentinos y severos de mala absorción, desnutrición y complicaciones asociadas, poco tiempo después de la introducción del gluten15,16. Los 3 casos restantes caen en esta categoría debido a sus problemas de mala absorción2, aunque no iniciaron al introducirles el gluten en su alimentación, sino más tarde en su vida.
Características de casos con enfermedad celiaca de presentación típica
| Caso | Edad/género | Signos y síntomas | Índicesa | Haplotipos/biopsia | ||
| IgA antigliadinas | IgG antigliadinas | IgA anti-TG | ||||
| 1 | 3 a. F | Diarrea, distensión abdominal | 14.01 | 1.73 | 10.16 | NA |
| 2 | 9m.M | Diarrea crónica, mala absorción, desnutrición 3.er grado | 37.68 | 5.64 | 36.70 | Biopsia Marsh-2 |
| 3 | 3 a. M | Diarrea, pérdida de peso. Dolor abdominal recurrente | 10.01 | 3.10 | 12.29 | NA |
| 4 | 11m. F | Diarrea, distensión abdominal | 14.76 | 3.60 | 11.33 | NA |
| 5 | 2 a. F | Diarrea crónica intermitente. Desnutrición 2.° grado | 8.80 | 3.50 | 3.80 | NA |
| 6 | 2 a. M | Diarreas, distensión abdominal, retardo en el crecimiento. Desnutrición 2.° grado | 21.40 | 4.10 | 13.13 | HLA-DQ2 Biopsia Marsh-3 |
| 7 | 2.9 a. M | Diarrea y deshidratación, desnutrición 2.° grado, distensión abdominal, anemia, tetania, hipotrofia muscular, desnutrición, talla baja para edad | 35.70 | 3.50 | 26.80 | HLA-DQ8 Biopsia Marsh-3 |
| 8 | 6m.M | Hipocalcemia, distensión abdominal | 1.32 | 1.37 | 1.10 | DQA1*0301 |
| 9 | 11m. F | Diarrea intermitente durante 3 meses | 2.13 | 8.80 | 3.80 | NA |
| 10 | 8 a. F | Diarrea, mala absorción, desnutrición de 1.er grado | 20.00 | 23.30 | 11.00 | HLA-DQ2 DQA1*0301 |
| 11 | 8 a. F | Dolor abdominal, diarrea crónica | 23.30 | 1.00 | 9.70 | NA |
| 12 | 11m.M | Diarrea. Desnutrición 3.er grado, distensión abdominal, emaciación y síndrome de mala absorción | 2.79 | 1.85 | 1.26 | HLA-DQ2 |
| 13 | 5 a. F | Vómito, diarrea, desnutrición 2.° grado | 1.16 | 1.40 | 1.01 | NA |
NA: no analizado; TG: transglutaminasa.
Entre los signos y los síntomas más comunes en los pacientes con EC típica de la tabla 1 estuvieron principalmente diarrea crónica en 11/13 y la distensión abdominal (5/13). Fue en este grupo en donde se presentaron los índices de anticuerpos más altos, de más de 10 o más de 20 veces el valor de la referencia saludable.
En cuanto al seguimiento de la dieta sin gluten y sus efectos en el estado nutricio, todos los niños de este grupo presentados en la tabla 1 respondieron adecuadamente. Los que presentaban desnutrición en algún grado al diagnóstico de EC recuperaron su peso y talla para la edad con el tratamiento dietario. Solo en el caso 5 la recuperación del estado nutricio tomó varios meses después del tratamiento.
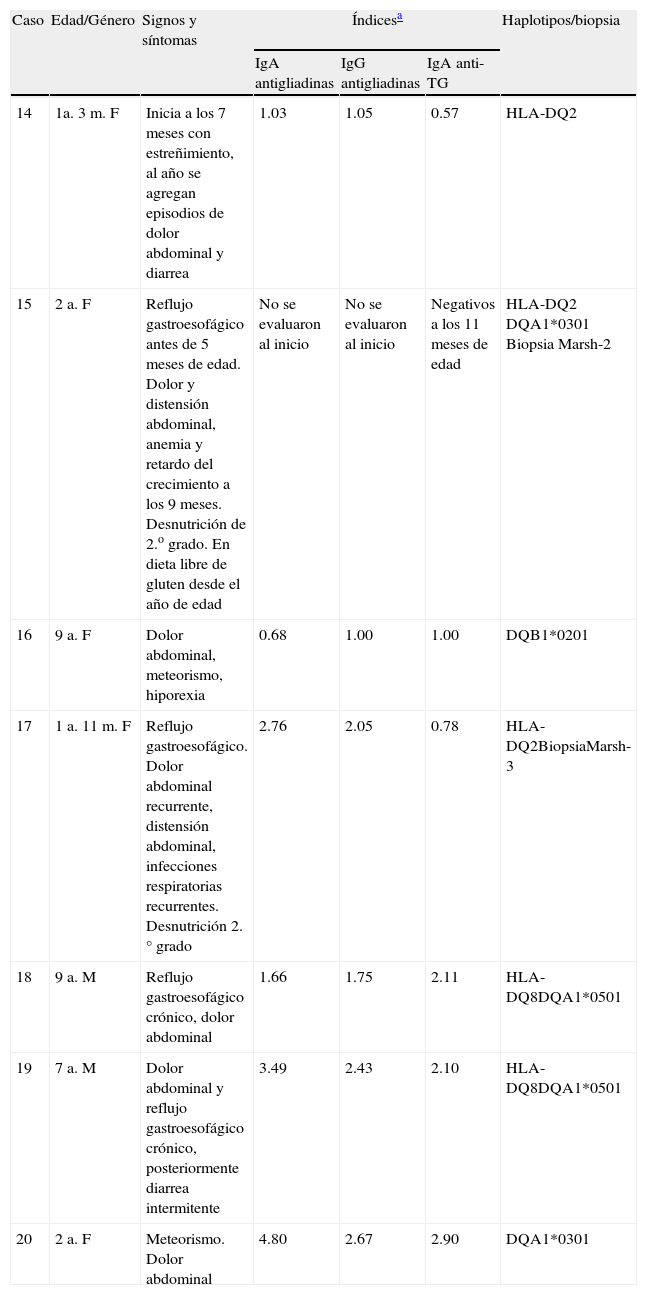
En la tabla 2 se presentan 7 casos, desde 15 meses hasta 9 años de edad, promediando los 6 años, que presentaron síntomas gastrointestinales aislados al inicio de la EC, así como componentes extraintestinales, como lo definen Aurangzeb et al.15. Entre sus signos y síntomas estuvieron reflujo gastroesofágico en 4/7 y dolor abdominal en los 7. Aquellos que tuvieron desnutrición tenían además historia de enfermedad respiratoria recurrente. En ninguno de estos casos hubo índices de anticuerpos altos o muy altos.
Características de casos con inicio de enfermedad celiaca no típica
| Caso | Edad/Género | Signos y síntomas | Índicesa | Haplotipos/biopsia | ||
| IgA antigliadinas | IgG antigliadinas | IgA anti-TG | ||||
| 14 | 1a. 3m. F | Inicia a los 7 meses con estreñimiento, al año se agregan episodios de dolor abdominal y diarrea | 1.03 | 1.05 | 0.57 | HLA-DQ2 |
| 15 | 2 a. F | Reflujo gastroesofágico antes de 5 meses de edad. Dolor y distensión abdominal, anemia y retardo del crecimiento a los 9 meses. Desnutrición de 2.o grado. En dieta libre de gluten desde el año de edad | No se evaluaron al inicio | No se evaluaron al inicio | Negativos a los 11 meses de edad | HLA-DQ2 DQA1*0301 Biopsia Marsh-2 |
| 16 | 9 a. F | Dolor abdominal, meteorismo, hiporexia | 0.68 | 1.00 | 1.00 | DQB1*0201 |
| 17 | 1 a. 11m. F | Reflujo gastroesofágico. Dolor abdominal recurrente, distensión abdominal, infecciones respiratorias recurrentes. Desnutrición 2.° grado | 2.76 | 2.05 | 0.78 | HLA-DQ2BiopsiaMarsh-3 |
| 18 | 9 a. M | Reflujo gastroesofágico crónico, dolor abdominal | 1.66 | 1.75 | 2.11 | HLA-DQ8DQA1*0501 |
| 19 | 7 a. M | Dolor abdominal y reflujo gastroesofágico crónico, posteriormente diarrea intermitente | 3.49 | 2.43 | 2.10 | HLA-DQ8DQA1*0501 |
| 20 | 2 a. F | Meteorismo. Dolor abdominal | 4.80 | 2.67 | 2.90 | DQA1*0301 |
TG: transglutaminasa.
En algunos de los pacientes en la tabla 2 no desaparecieron los síntomas a corto plazo una vez en la dieta sin gluten, sino paulatinamente. Lo mismo sucedió con su recuperación nutricia, que no se logró hasta varios meses después del tratamiento dietario. El caso 15 no recuperó la velocidad de crecimiento sino más de un año después del tratamiento. En el caso 18 disminuyeron los síntomas pero no desapareció por completo el reflujo.
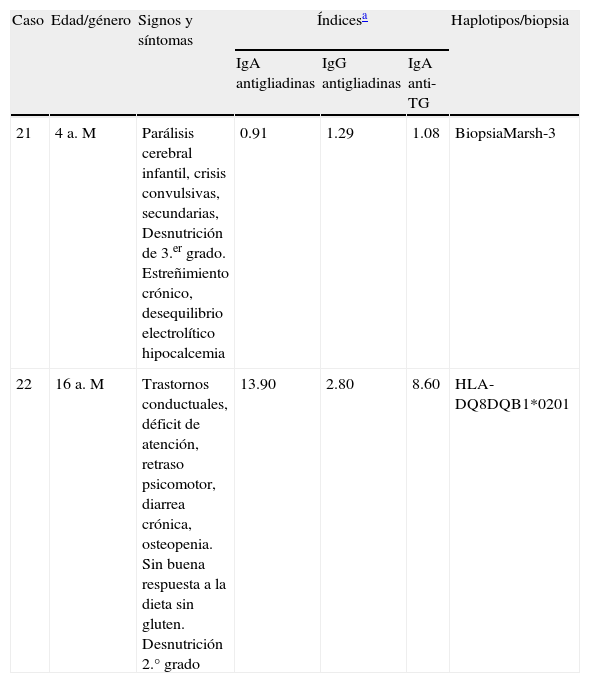
En la tabla 3 se registran 2 casos, de 4 y 16 años de edad, que pueden clasificarse como con inicio no típico de la EC, pero se pusieron en esta tabla separada, ya que ambos iniciaron con problemas neurológicos. Uno de los pacientes presentaba trastornos de conducta y trastornos de déficit de atención; el otro, parálisis cerebral. En ambos casos se presentaron junto con los problemas neurológicos (extraintestinales) y los síntomas gastrointestinales como estreñimiento en uno, diarrea en el otro; en ambos casos, desnutrición avanzada. Uno de los casos presentó títulos bajos, aunque positivos, de anticuerpos específicos, mientras en el otro fueron entre modestos y altos. En ambos casos hubo evidencia extra con una biopsia de mucosa intestinal en uno de ellos y la detección de HLA-DQ8 en el otro.
Características de casos de enfermedad celiaca con síntomas gastro y extraintestinales
| Caso | Edad/género | Signos y síntomas | Índicesa | Haplotipos/biopsia | ||
| IgA antigliadinas | IgG antigliadinas | IgA anti-TG | ||||
| 21 | 4 a. M | Parálisis cerebral infantil, crisis convulsivas, secundarias, Desnutrición de 3.er grado. Estreñimiento crónico, desequilibrio electrolítico hipocalcemia | 0.91 | 1.29 | 1.08 | BiopsiaMarsh-3 |
| 22 | 16 a. M | Trastornos conductuales, déficit de atención, retraso psicomotor, diarrea crónica, osteopenia. Sin buena respuesta a la dieta sin gluten. Desnutrición 2.° grado | 13.90 | 2.80 | 8.60 | HLA-DQ8DQB1*0201 |
TG: transglutaminasa.
Los casos de la tabla 3 fueron difíciles de seguir en cuanto a desaparición de síntomas y recuperación nutricia. De hecho, el niño más pequeño se recuperó parcialmente y el mayor no logró recuperarse sino solo parcialmente en síntomas, pero no en estado nutricio; podría tratarse de EC refractaria.
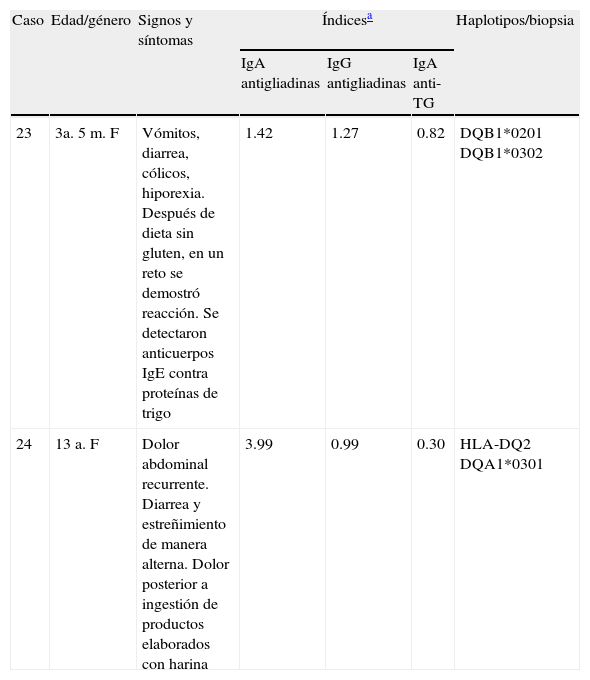
En la tabla 4 se presentan 2 casos de trastornos relacionados con el gluten; en uno, mediado por IgE, con respuesta alérgica y en el otro mediada por IgA, con sensibilidad al gluten no celiaca, ya que su índice de anticuerpos IgA antitransglutaminasa fue negativo. Los signos y los síntomas en ambas pacientes de 3 años 5 meses y de 13 años de edad fueron gastrointestinales y remitieron en dieta sin gluten. Después de un reto con gluten, se demostró alergia mediada por IgE en la niña más pequeña; en la otra, se sospecha de sensibilidad al gluten no celiaca y continuó en dieta sin gluten.
Características de casos con otras alteraciones asociadas al gluten
| Caso | Edad/género | Signos y síntomas | Índicesa | Haplotipos/biopsia | ||
| IgA antigliadinas | IgG antigliadinas | IgA anti-TG | ||||
| 23 | 3a. 5m. F | Vómitos, diarrea, cólicos, hiporexia. Después de dieta sin gluten, en un reto se demostró reacción. Se detectaron anticuerpos IgE contra proteínas de trigo | 1.42 | 1.27 | 0.82 | DQB1*0201 DQB1*0302 |
| 24 | 13 a. F | Dolor abdominal recurrente. Diarrea y estreñimiento de manera alterna. Dolor posterior a ingestión de productos elaborados con harina | 3.99 | 0.99 | 0.30 | HLA-DQ2 DQA1*0301 |
TG: transglutaminasa.
Durante largos años, la EC permaneció en muchos países como una enfermedad rara; en México no fue la excepción. Sin embargo, en los últimos 15-20 años, se ha llegado a una buena comprensión de su etiopatogénesis y es la enfermedad inflamatoria más común del intestino delgado16. Es autoinmune, viene no solo de la exposición al gluten, sino de una combinación de factores, incluyendo genes de predisposición y anormalidades en la estructura del intestino delgado17. Con esto, los procedimientos para el estudio y el diagnóstico de pacientes con sospecha de EC han mejorado notablemente18,19.
Los criterios para el diagnóstico de la EC han ido variando a medida que se conoce mejor su patogénesis y que las técnicas de estudio se afinan. Antes de conocer el mecanismo de patogénesis, había solamente los síntomas clínicos, pruebas poco específicas y, para confirmar el daño intestinal, la única forma era la biopsia de la mucosa. En 1969 la Sociedad Europea de Gastroenterología, Hepatología y Nutrición Pediátrica (ESPGHAN, por sus siglas en inglés), estableció el primer criterio de diagnóstico. Este consistía en tomar 3 biopsias: una al diagnóstico, otra después de la dieta sin gluten y la tercera después de un reto con gluten. En 1990 se cambiaron los criterios a una sola biopsia, en conjunto con análisis serológicos y la respuesta clínica a la dieta sin gluten20.
La biopsia positiva ha sido el estándar de oro para el diagnóstico de EC. Sin embargo, en los últimos años, ha habido una tendencia hacia el uso del análisis serológico para hacer un diagnóstico definitivo. La importancia y la utilidad de este tipo de análisis se fundamentan no solo en el conocimiento de la presencia de anticuerpos contra el antígeno endógeno, sino que están basados en un paso muy importante del mecanismo de patogénesis. En 1998, en 2 estudios independientes, Molberg et al.21 y van de Wal et al.22 mostraron que la transglutaminasa tisular modifica los péptidos de gliadinas, aumentando su reactividad para las células T en la EC. En esta forma, los celiacos no solo presentan anticuerpos contra las gliadinas, sino también contra su propia transglutaminasa.
Así, el diagnóstico se enfoca a la detección de anticuerpos IgA antigliadinas, antiendomisio y antitransglutaminasa. Este último es también el que se ha usado para evaluar la incidencia y la prevalencia de la EC en diferentes poblaciones17. Debido a que un 2% de los celiacos son deficientes en IgA, se cuantifica también IgG. Lo más reciente son los análisis de anticuerpos antipéptidos de gliadinas deamidadas; esto es, tal y como se encontrarían después de la digestión proteolítica y la acción de la transglutaminasa para hacerlos más específicos aun. Hay juegos de reactivos que cuantifican al mismo tiempo IgA e IgG contra dichos péptidos3,23.
En niños muy pequeños, como es el caso de muchos de los pacientes del presente estudio, la sensibilidad de IgA contra gliadinas es mejor que contra la transglutaminasa o antiendomisio24. Por eso, se considera necesario el análisis de anticuerpos antigliadinas en niños < 24 meses, con signos y síntomas indicativos de EC23. Los casos 14 y 17 en la tabla 2 lo muestran con toda claridad; sus índices de anticuerpos antigliadinas fueron positivos, mientras que sus índices contra transglutaminasa fueron negativos. De hecho, los casos 15 y 17 mostraron biopsias claramente afectadas (Marsh 2 y 3), aunque sus índices de anticuerpos antitransglutaminasa fueron negativos. Cuando los resultados clínicos, de análisis serológicos y de biopsia, son discordantes, el análisis de HLA-DQ2 y DQ8 puede aportar. Si no se encuentran estos haplotipos, se puede asegurar que no hay EC, ya que prácticamente todos los pacientes presentan alguno de los haplotipos o ambos1,16,25.
De acuerdo con la ESPAGHAN1, para el diagnóstico de niños asintomáticos con sospecha de EC se debe ofrecer el análisis de haplotipos DQ2 y DQ8 en primer término. Su ausencia indica que no hay necesidad de continuar con más estudios para descartar la EC. Así se procedió con los casos de la tabla 2. El caso 15 es una niña que desde los 7 meses tenía síntomas intestinales pero no diarrea. No se le analizaron los anticuerpos antigliadinas y sus anticuerpos anti-TG fueron negativos; una biopsia presentó atrofia moderada. Además, presentó HLA-DQ2; la dieta sin gluten y un reto contribuyeron al diagnóstico de EC. Por su parte, los casos 17, 18 y 19 presentaron como síntoma muy destacado el reflujo gastroesofágico, que no está entre los más comentados en la bibliografía. Los 3 presentaron haplotipos de predisposición. En un estudio de niños celiacos canadienses, un 8% presentó reflujo al inicio26.
De los 15 casos analizados para haplotipos, la mayoría presentó alelos DQA1*0501 y DQB1*0201 o el haplotipo HLA-DQ2.5, que conforman ambos alelos. Solo 3 de los casos podrían ser HLA-DQ2.2 (DQA1*0201 y DQB1*0202) y 4 fueron HLA-DQ8. Esto a pesar de que, en una población de niños sonorenses recién nacidos, hay casi igual proporción de DQ2 que DQ8 (1.2:1)27. De acuerdo con diversos autores, el DQ2.5 es de mayor predisposición de EC que el DQ2.228, ya que se encuentra en la superficie de las células presentadoras de antígenos, con mayor posibilidad de interacción4,25. También se considera HLA-DQ2 de mayor predisposición que HLA-DQ8, ya que su molécula expresada enlaza a un rango más amplio de péptidos29.
Los haplotipos HLA-DQ2 y DQ8 en la población de estudio también podrían ser importantes para decidir el tipo de análisis serológico. A diferencia de HLA-DQ8, que puede reconocer péptidos de gliadinas nativas o deamidadas, las células T restringidas a HLA-DQ2 tienen una preferencia marcada por las deamidadas4. Así, los anticuerpos en circulación podrían diferir y quizá no sea necesario analizar anticuerpos antipéptidos de gliadinas deamidadas en una población con preponderancia de HLA-DQ8, como son las amerindias30. Tampoco sería lo más apropiado en los niños muy pequeños, ya que su respuesta inmunitaria es contra gliadinas no deamidadas31.
Debido a lo confuso de sus síntomas, a varios de los pacientes del estudio no se les diagnosticó la EC desde su inicio. Esto es algo que sucede en todas partes del mundo, incluso en países desarrollados que reconocen la EC desde hace muchos años. Por lo común, en los adultos se puede retrasar de 11 a 13 años, pero también en los niños se retrasa el diagnóstico26,32. El caso más claro en el presente estudio fue el 22, de un adolescente cuya madre relató que los síntomas gastrointestinales de su hijo iniciaron desde que era pequeño, pero cuyos síntomas neurológicos fueron más llamativos. Por tanto, el diagnóstico de la EC se le realizó a los 16 años de edad.
De los 24 casos presentados en este estudio, solo se tomaron biopsias de mucosa intestinal en 6. En acuerdo con la ESPGHAN, si hay sospecha clínica fuerte de EC y anticuerpos específicos positivos, el análisis de HLA-DQ2 y DQ8 puede ayudar para descartar el diagnóstico de EC1. Así, además de los 6 con biopsia positiva, solo 2 más se podrían considerar diagnosticados. Sin embargo, en 7 casos se trataba de niños menores de 2 años, cuyos títulos de anticuerpos específicos pueden no ser tan altos, como se comentó antes. En otros 3 casos, los títulos fueron altos pero no se tuvo la facilidad de analizar haplotipos en el tiempo en que se trataron. En los casos restantes, no se tomó biopsia porque los padres no lo permitieron. Sin embargo, especialmente en los niños con EC típica, en la dieta sin gluten sin lugar a duda, remitieron los síntomas y se hicieron negativos los índices de anticuerpos.
Por otra parte, la mayoría de los pacientes estudiados tuvieron, además de su predisposición genética, un manejo poco adecuado de sus regímenes de lactancia y alimentación complementaria. En esta población solo el 29% de los niños son amamantados hasta el tercer mes de edad y los cereales se introducen muy temprano en su dieta33-35. Esto, de acuerdo con Ivarsson et al.36, es un factor que propicia el desarrollo de la EC en niños predispuestos genéticamente.
ConclusionesEn conclusión, se agruparon los casos por similitudes en la sintomatología, encontrando EC típica, por lo común en los niños más pequeños; no típica, sin síntomas de mala absorción, en niños de diversas edades; con síntomas gastro y extraintestinales (como los neurológicos), y con trastornos relacionados con el gluten, sin EC. Esta fue una forma de clasificación para describir los patrones en que se presentaron los casos en la población de estudio.
La EC debiera evaluarse en el contexto de signos clínicos, marcadores serológicos, haplotipos e histología de biopsia intestinal, así como la respuesta a la dieta sin gluten, en diversas regiones, para una descripción completa a nivel de país. Para el diagnóstico definitivo de EC, se deben seguir los criterios de la ESPGHAN.
FinanciaciónEl estudio fue parcialmente financiado por el proyecto S0008-2009-1/115212 Sectorial Salud y Conacyt (México).
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Se agradece la ayuda técnica de Q.J.R. Valenzuela Miranda, para el análisis de anticuerpos específicos, y de M.C. Melissa Ruiz Dyck, por el análisis de haplotipos, así como de M.C. Adriana V. Bolaños, por la edición final del manuscrito.