La enfermedad hepática esteatósica asociada a disfunción metabólica (MASLD) es la causa más común de enfermedad hepática crónica en niños y adolescentes. El desarrollo de MASLD está asociado con los hábitos alimentarios, y las características de la ingesta dietética son un factor de riesgo relevante. Este estudio tuvo como objetivo analizar las características de la ingesta dietética en niñas, niños y adolescentes e investigar cómo varía la dieta entre aquellos con y sin MASLD.
MétodosEste fue un estudio transversal que incluyó niñas, niños y adolescentes de 8 a 18 años. Los criterios para MASLD incluyeron esteatosis en la ecografía abdominal y cumplir con al menos un criterio de síndrome metabólico. La obesidad se diagnosticó con base en el índice de masa corporal adecuado para la edad. Los hábitos alimentarios se evaluaron utilizando un registro de alimentos de 2 días recopilado en diferentes días representativos (martes y domingo), centrándose en la ingesta dietética de energía, macronutrientes, ácidos grasos poliinsaturados, grasas trans, fibra dietética y antioxidantes.
ResultadosSe evaluaron 89 niñas, niños y adolescentes, 50 (56%) de sexo femenino y 21 (24%) con MASLD. El grupo con la enfermedad presentó menor ingesta de proteínas (mediana [rango intercuartil] 76.6g [57.7-87.7] vs. 85.8 [71.0-114.1], p=0.035), así como de vitamina E (media [desviación estándar] 6.0 [2.8] vs. 8.0 [6.2], p=0.040), cinc (7.9 [2.7] vs. 10.3 [4.9], p=0.031) y hierro (9.9 [2.5] vs. 12.2 [5.4], p=0.009) en comparación con el grupo sin MASLD. Tras el ajuste por variables de confusión, solo el índice cintura-talla se asoció con MASLD.
ConclusiónLa cantidad y calidad de los alimentos pueden estar relacionadas con MASLD, y la obesidad abdominal debe combatirse desde la infancia.
Metabolic dysfunction-associated steatotic liver disease (MASLD) is the most common cause of chronic liver disease in children and adolescents. The development of MASLD is associated with dietary habits, and dietary intake characteristics are a relevant risk factor. The aim of the present study was to analyze dietary intake characteristics in children and adolescents and study how diet varies in subjects with and without MASLD.
MethodsA cross-sectional study was conducted that included children and adolescents from 8 to 18 years of age. The criteria for MASLD included steatosis on abdominal ultrasound study and meeting at least one metabolic syndrome criterion. Obesity was diagnosed based on the age-appropriate body mass index. Dietary habits were evaluated utilizing a 2-day food register collected on different representative days (Tuesday and Sunday), focusing on dietary energy intake, macronutrients, polyunsaturated fatty acids, trans fats, dietary fiber, and antioxidants.
ResultsA total of 89 children and adolescents were evaluated; 50 (56%) were females and 21 (24%) presented with MASLD. The MASLD group had lower intake of protein (median [interquartile range] 76.6g [57.7-87.7] vs. 85.8 [71.0-114.1], p=0.035), vitamin E (mean [standard deviation] 6.0 [2.8] vs. 8.0 [6.2], p=0.040), zinc (7.9 [2.7] vs. 10.3 [4.9], p=0.031), and iron (9.9 [2.5] vs. 12.2 [5.4], p=0.009), compared with the non-MASLD group. After confounding variable adjustment, only the waist-to-height ratio was associated with MASLD.
ConclusionThe quantity and quality of foods may be related to MASLD, and abdominal obesity should be prevented in childhood.
La enfermedad esteatósica hepática asociada a disfunción metabólica (MASLD) es actualmente la causa principal de enfermedad hepática en población pediátrica, con tasas de prevalencia estimadas de 9.6 y 38% entre niñas, niños y adolescentes con peso normal y obesidad, respectivamente, dependiendo de la localización del estudio, el estatus nutricional y los métodos diagnósticos1,2. Los síntomas en población pediátrica pueden ser leves o ausentes y, por lo tanto, el diagnóstico es a menudo incidental1. Sin embargo, la gravedad de la MASLD puede progresar incluso en la infancia y persistir en la edad adulta. Parece tener un fenotipo más grave que en los adultos, con hasta un 15% de la población pediátrica con MASLD en etapa 33.
La resistencia a la insulina y la obesidad están entre los factores de riesgo de mayor importancia para MASLD en población pediátrica. Sin embargo, no todos los pacientes con obesidad presentan MASLD, a la vez que pacientes sin obesidad pueden presentar MASLD, y la calidad de la dieta puede ser un factor para el inicio, progreso y tratamiento de la enfermedad3,4. Algunos estudios muestran que una alta ingesta energética y de grasas saturadas, y una baja ingesta de fibra, antioxidantes y omega-3, en combinación con un estilo de vida sedentario, son claves para un inicio temprano de MASLD3,4. Por lo tanto, el presente estudio tuvo como objetivo analizar las características de alimentación en niñas, niños y adolescentes, así como investigar cómo varía la dieta entre sujetos con MASLD y sin la enfermedad.
Materiales y métodosDiseño de estudio y poblaciónSe llevó a cabo un estudio transversal para analizar las características de alimentación de niñas, niños y adolescentes e investigar como esta dieta varía entre aquellos con y sin MASLD, según los lineamientos de reporte de Reforzamiento de los Reportes de Estudios Observacionales en Epidemiología –STROBE–. El estudio fue desarrollado con pacientes tratados en la Clínica Ambulatoria General de Pediatría del Hospital Universitario de la Universidad Federal de Bahía. Se incluyó a pacientes de ambos sexos entre 8 y 18 años. No se incluyó a menores de 8 años, ya que las enfermedades hepáticas en ese grupo etario tienen una mayor asociación con síndromes hepáticos raramente asociados con MASLD. Los criterios de exclusión fueron: clasificación como bajo de peso con base en un índice de masa corporal (IMC) acorde a la edad, obesidad sindrómica, anomalías puberales, uso de fármacos con influencia en el metabolismo glucémico y hepático, como corticoesteroides, sulfamidas, antipsicóticos o anfetaminas y suplementos antioxidantes. También se excluyó a pacientes con hipotiroidismo, otras enfermedades hepáticas (hepatitis viral A, B y C, enfermedades autoinmunes, enfermedad de Wilson y hemocromatosis) y procesos infecciosos sistémicos y/o agudos, en los últimos 10 días.
Evaluación clínicaSe obtuvieron las variables sociodemográficas (edad, sexo e ingreso familiar), hábitos de estilo de vida (participación en actividad física)5, datos clínicos, como etapa puberal6 y presencia de acantosis nigricans7, por medio de un cuestionario estructurado proporcionado por el equipo de investigación y clasificado con base en la literatura publicada.
Criterios de diagnóstico para MASLDSe diagnosticó MASLD cuando se observó esteatosis hepática en la ecografía abdominal, asociada con al menos un criterio de síndrome metabólico8. Los criterios de síndrome metabólico asociados con MASLD en el momento del diagnóstico son: IMC≥percentil 85 para edad/sexo (puntaje IMC z≥+1) o circunferencia de cintura>percentil 95 o el equivalente ajustado para etnicidad; glucosa sérica en ayuno≥5.6mmol/l (≥100mg/dl) o glucosa sérica≥11.1mmol/l (≥200mg/dl) o niveles de glucosa poscarga≥7.8mmol (140mg/dl) o HbA1c≥5.7% (39mmol/l) o diabetes tipo 2 ya diagnosticada/tratada o tratamiento para diabetes tipo 2; presión arterial<13 años, presión arterial≥percentil 95 o ≥130/80mmHg (lo que haya sido menor); edad≥13 años, 130/85mmHg o tratamiento con fármaco antihipertensivo específico; triacilglicéridos en plasma, en <10 de años de edad: ≥1.15mmol/l (≥100mg/dl), y en ≥10 años: 1.70mmol/l (≥150mg/dl) o estar ya con tratamiento para reducir lípidos; y colesterol de lipoproteínas de alta densidad (HDL) en plasma≤1.0mmol/l (≤40mg/dl) o tratamiento para reducir lípidos. El estudio de ecografía abdominal fue realizado por un solo especialista.
Evaluación antropométricaLas medidas antropométricas fueron estandarizadas y comparadas estadísticamente. Dos evaluadores realizaron las mediciones y se utilizó el promedio. La diferencia máxima aceptada fue 0.5cm. El peso fue medido utilizando una báscula LD 1050® digital, y la altura se midió con un estadiómetro LD 1050®, con una escala de intervalos de 0.1cm. Los indicadores antropométricos fueron evaluados con base en el IMC9 apropiado para la edad y el sexo con el WHO AnthroPlus, 2011, versión 16. Los pacientes fueron divididos en 2 grupos: el de peso normal para la edad (−2<puntaje z<+1) y con sobrepeso (puntaje z>+1)9. La circunferencia de cintura, medida como la circunferencia mínima entre la cresta ilíaca y la caja torácica10, fue evaluada de acuerdo con los criterios de Rinella et al.8. La circunferencia del cuello (CCU) fue medida en el punto medio del cuello y evaluada siguiendo a Da Silva et al.11. El índice cintura-talla (ICT) fue considerado normal cuando fue≤0.512. El índice de conicidad13 tuvo un rango de 1.14 a 1.16 para menores de 9 años y de 1.06 a 1.12 para mayores de 10 años.
Evaluación bioquímicaSe realizaron pruebas bioquímicas después de un ayuno de 8h. Se analizaron la alanina aminotransferasa, la aspartato transaminasa y la gamma glutamil transpeptidasa por medio del método de química seca. Los valores de referencia para alanina aminotransferasa se establecieron de acuerdo con la recomendación de la North American Society for Pediatric Gastroenterology, Hepatology and Nutrition –NASPGHAN– (2017)14, con hasta 22U/l para niñas y hasta 26U/l para niños. La aspartato transaminasa fue considerada elevada > 59 U/l y la gamma glutamil transpeptidasa fue considerada elevada cuando fue cuando fue>73U/l, según los estándares recomendados por el laboratorio, dado el método usado. La glucosa en ayuno fue evaluada siguiendo a Rinella et al.8, y los niveles de insulina sérica fueron evaluados según las recomendaciones de la Sociedad Brasileña de Diabetes15. La evaluación del modelo homeostático de resistencia a la insulina –HOMA-IR– fue analizado con base en el valor de resistencia a la insulina≤3.0 recomendado por Yin et al.16. El colesterol total y el colesterol de lipoproteínas de baja densidad (LDL) fueron evaluados con base en los niveles normales de la Sociedad Brasileña de Cardiología, 2019-202017. El colesterol HDL y los triacilglicéridos fueron evaluados según los valores sugeridos por Rinella et al.8.
Los niveles en sangre de vitamina C, E y A y de selenio, cinc y cobre fueron medidos y evaluados con los niveles normales de laboratorio: 4.6-15.0mg/dl, 3-10.0mg/dl, 0.3-0.7mg/dl, 20.0-190.0μg/dl, 70.0-120.0μg/dl, y 80.0-160.0μg/dl, respectivamente.
Evaluación alimenticiaPara comprender la ingesta alimentaria de la población, se registró la ingesta de 2 días para cada paciente. El registro alimentario incluyó información de los alimentos consumidos, la hora de los alimentos, la preparación, el tipo y la cantidad de alimentos, y las cantidades consumidas. El registro alimentario fue tomado en martes y domingo. Los pacientes y sus tutores recibieron plantillas para registrar sus alimentos, además de instrucciones sobre como llenarlas con un ejemplo proporcionado por el equipo. Los registros de los 2 días fueron realizados en casa y fueron revisados en el momento de ser entregados. El registro fue realizado por el cuidador principal. De ser necesario, se proporcionó apoyo por medio de fotografías de tamaños de porciones.
La evaluación alimentaria fue realizada utilizando la plataforma de evaluación alimentaria DietBox®. La ingesta calórica, de hidratos de carbono, proteínas, lípidos totales, ácidos grasos poliinsaturados (PUFA), fibra dietética y micronutrientes fue evaluada utilizando la referencia de ingesta alimentaria 2002/200518. La ingesta de grasas trans fue determinada utilizando los parámetros propuestos por la Organización Mundial de la Salud en 202319.
Análisis estadísticoLa muestra consistió en toda la población pediátrica tratada en la clínica ambulatoria antes mencionada. Para el análisis de datos se utilizó el Statistical Package for the Social Sciences® versión 18. Las variables categóricas fueron expresadas como frecuencias relativas y absolutas, y las variables cuantitativas fueron expresadas como medias y desviaciones estándar o medianas y rangos intercuartiles. Los participantes fueron divididos en 2 grupos: con MASLD y sin MASLD. Las siguientes pruebas estadísticas fueron utilizadas para comparar los grupos: la prueba t y la prueba U de Mann-Whitney para muestras independientes, para comparar las variables cuantitativas, y la prueba chi cuadrada y la exacta de Fisher para comparar las variables categóricas. La significación estadística fue determinada a p<0.05.
Para evaluar las variables de confusión, se realizó una regresión logística, considerando variables con valor de p<0.05 en el análisis bivariado, las cuales no tuvieran colinealidad y presentaran plausibilidad biológica con MASLD: colesterol LDL, ICT categorizado como elevado (sí o no), ingesta adecuada de cinc (sí o no) e ingesta diaria de proteína (g/día).
Consideraciones éticasSe siguieron las recomendaciones de la Declaración de Helsinki, enmendadas por la 64.a Asamblea de la Asociación Médica Mundial, de 2013. El presente estudio fue aprobado por el Comité de Ética de Investigación de la Escuela de Nutrición de la UFBA (número de proceso: 1.471.817). Los pacientes y sus padres o tutores firmaron un documento de consentimiento informado. Tras la recolección de datos, todos los pacientes tuvieron acceso a los servicios ambulatorios de nutrición. Los autores declaran que se tomaron todas las precauciones debidas para mantener el anonimato de los pacientes.
ResultadosTodas las niñas, niños y adolescentes tratados en la clínica ambulatoria fueron invitados a participar en el estudio y no se presentaron rechazos o retiros, lo cual resultó en un total de 89 niñas, niños y adolescentes de entre 8 y 18 años, de los cuales 50 (56.0%) fueron del sexo femenino. De los 89 pacientes, 21 fueron diagnosticados con MASLD. Todos presentaron esteatosis en la ecografía abdominal, 20 (95.2%) presentaron sobrepeso u obesidad, y uno (4.8%) presentó colesterol HDL bajo. Ningún paciente presentó cambios glucémicos, diabetes mellitus, cambios en la presión arterial o hipertensión arterial sistémica.
Para las comparaciones, los participantes fueron divididos en 2 grupos: con MASLD y sin MASLD. Las características sociodemográficas fueron similares entre los 2 grupos y existieron diferencias significativas en los indicadores antropométricos, incluidos el IMC, la CCU y el ICT (tabla 1).
Características demográficas y antropométricas de las niñas, niños y adolescentes con y sin enfermedad MASLD, observados en la Clínica Ambulatoria Pediátrica, 2022
| Características | MASLD | p | |
|---|---|---|---|
| Sí21 (24.0%) | No68 (76.0%) | ||
| Edad en años, media (DE) | 11.7 (2.0) | 11.7 (3.0) | 0.924 |
| Sexo masculino, n (%) | 11 (52.4) | 28 (41.2) | 0.366a |
| Participación en actividad física, n (%) | 9 (42.9) | 20 (29.4) | 0.251a |
| Presencia de acantosis nigricans, n (%) | 12 (57.1) | 40 (58.8) | 0.891a |
| Etapa puberal, n (%) | |||
| Prepuberal | 3 (14.3) | 17 (25.0) | 0.382b |
| Puberal y pospuberal | 18 (85.7) | 51 (75.0) | |
| Índice de masa corporal elevado según la edad, n (%) | 20 (95.2) | 39 (57.4) | 0.001a |
| Circunferencia de cuello elevada, n (%) | 17 (81.0) | 26 (38.2) | 0.001a |
| Relación cintura-talla elevada, n (%) | 17 (81.0) | 33 (48.5) | 0.009a |
| Circunferencia de cintura elevada, n (%) | 18 (85.7) | 45 (66.2) | 0.085a |
| Índice de conicidad elevado, n (%) | 20 (95.2) | 67 (98.5) | 0.418a |
DE: desviación estándar; MASLD: enfermedad esteatósica hepática asociada a disfunción metabólica.
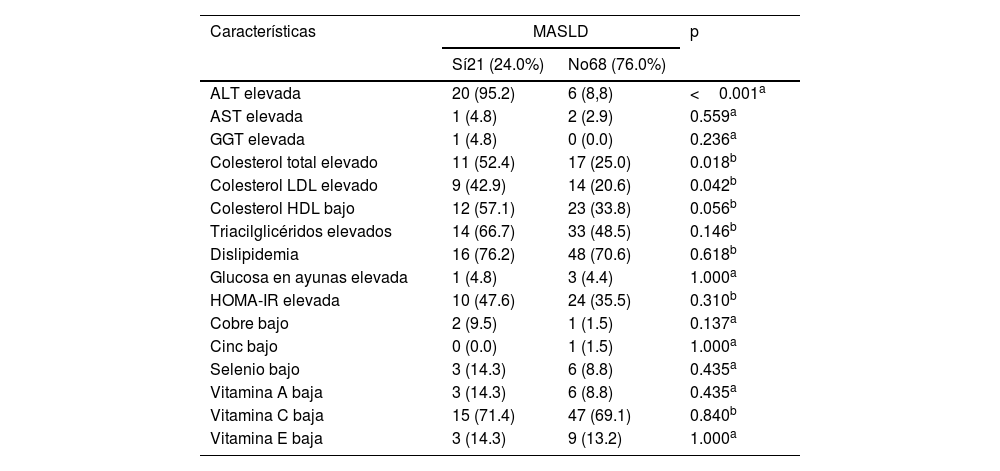
En el grupo con MASLD, las frecuencias de niveles de colesterol total y LDL altos fueron mayores. Sin embargo, cuando todos los tipos de dislipidemias se analizaron en conjunto, no existieron diferencias entre grupos. Los grupos tuvieron diferencias en términos de suficiencia de alanina aminotransferasa y no tuvieron diferencias respecto a los micronutrientes o vitaminas (tabla 2).
Niveles séricos de enzimas hepáticas, indicadores lipídicos, control de glucosa y micronutrientes por estatus de MASLD en niñas, niños y adolescentes observados en la Clínica Ambulatoria Pediátrica, 2022
| Características | MASLD | p | |
|---|---|---|---|
| Sí21 (24.0%) | No68 (76.0%) | ||
| ALT elevada | 20 (95.2) | 6 (8,8) | <0.001a |
| AST elevada | 1 (4.8) | 2 (2.9) | 0.559a |
| GGT elevada | 1 (4.8) | 0 (0.0) | 0.236a |
| Colesterol total elevado | 11 (52.4) | 17 (25.0) | 0.018b |
| Colesterol LDL elevado | 9 (42.9) | 14 (20.6) | 0.042b |
| Colesterol HDL bajo | 12 (57.1) | 23 (33.8) | 0.056b |
| Triacilglicéridos elevados | 14 (66.7) | 33 (48.5) | 0.146b |
| Dislipidemia | 16 (76.2) | 48 (70.6) | 0.618b |
| Glucosa en ayunas elevada | 1 (4.8) | 3 (4.4) | 1.000a |
| HOMA-IR elevada | 10 (47.6) | 24 (35.5) | 0.310b |
| Cobre bajo | 2 (9.5) | 1 (1.5) | 0.137a |
| Cinc bajo | 0 (0.0) | 1 (1.5) | 1.000a |
| Selenio bajo | 3 (14.3) | 6 (8.8) | 0.435a |
| Vitamina A baja | 3 (14.3) | 6 (8.8) | 0.435a |
| Vitamina C baja | 15 (71.4) | 47 (69.1) | 0.840b |
| Vitamina E baja | 3 (14.3) | 9 (13.2) | 1.000a |
Los datos se expresan como n (%).
ALT: alanina aminotransferasa; AST: aspartato transaminasa; Colesterol HDL: colesterol de lipoproteínas de alta densidad; Colesterol LDL: colesterol de lipoproteínas de baja densidad; GGT: gamma glutamil transpeptidasa; HOMA-IR: evaluación del modelo homeostático de resistencia a la insulina; MASLD: enfermedad esteatósica hepática asociada a disfunción metabólica.
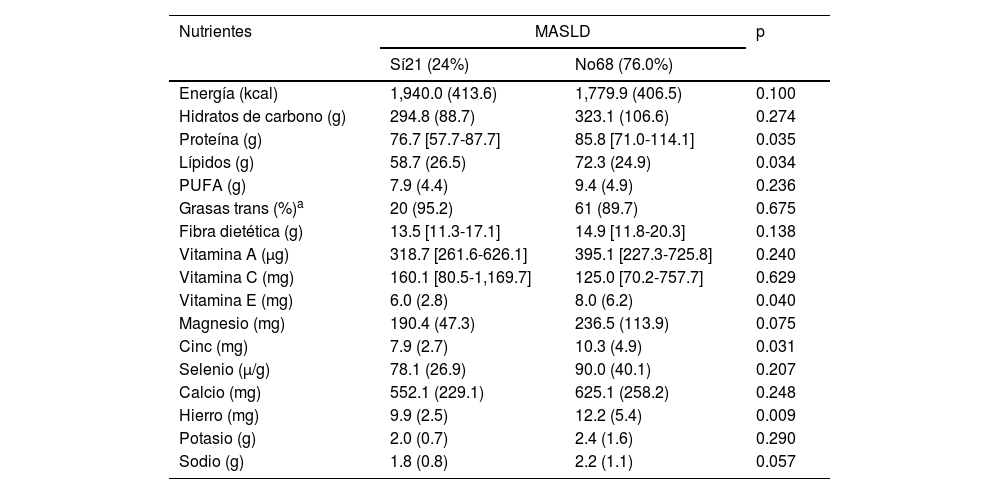
El consumo de grasas trans también fue evaluado según las recomendaciones, con un parámetro de consumo máximo del 1% del total de la ingesta calórica19, y el consumo fue mayor a la recomendación en ambos grupos (95.2% en el grupo con MASLD y 89.7% en el grupo sin la enfermedad, p=0.675) (tabla 3).
Comparación del promedio de ingesta diaria de macronutrientes y micronutrientes en niñas, niños y adolescentes, con y sin MASLD, observados en la Clínica Ambulatoria Pediátrica, 2022
| Nutrientes | MASLD | p | |
|---|---|---|---|
| Sí21 (24%) | No68 (76.0%) | ||
| Energía (kcal) | 1,940.0 (413.6) | 1,779.9 (406.5) | 0.100 |
| Hidratos de carbono (g) | 294.8 (88.7) | 323.1 (106.6) | 0.274 |
| Proteína (g) | 76.7 [57.7-87.7] | 85.8 [71.0-114.1] | 0.035 |
| Lípidos (g) | 58.7 (26.5) | 72.3 (24.9) | 0.034 |
| PUFA (g) | 7.9 (4.4) | 9.4 (4.9) | 0.236 |
| Grasas trans (%)a | 20 (95.2) | 61 (89.7) | 0.675 |
| Fibra dietética (g) | 13.5 [11.3-17.1] | 14.9 [11.8-20.3] | 0.138 |
| Vitamina A (μg) | 318.7 [261.6-626.1] | 395.1 [227.3-725.8] | 0.240 |
| Vitamina C (mg) | 160.1 [80.5-1,169.7] | 125.0 [70.2-757.7] | 0.629 |
| Vitamina E (mg) | 6.0 (2.8) | 8.0 (6.2) | 0.040 |
| Magnesio (mg) | 190.4 (47.3) | 236.5 (113.9) | 0.075 |
| Cinc (mg) | 7.9 (2.7) | 10.3 (4.9) | 0.031 |
| Selenio (μ/g) | 78.1 (26.9) | 90.0 (40.1) | 0.207 |
| Calcio (mg) | 552.1 (229.1) | 625.1 (258.2) | 0.248 |
| Hierro (mg) | 9.9 (2.5) | 12.2 (5.4) | 0.009 |
| Potasio (g) | 2.0 (0.7) | 2.4 (1.6) | 0.290 |
| Sodio (g) | 1.8 (0.8) | 2.2 (1.1) | 0.057 |
Los datos se expresan como media (desviación estándar) o media [rango intercuartil].
MASLD: enfermedad esteatósica hepática asociada a disfunción metabólica; PUFA: ácidos grasos poliinsaturados.
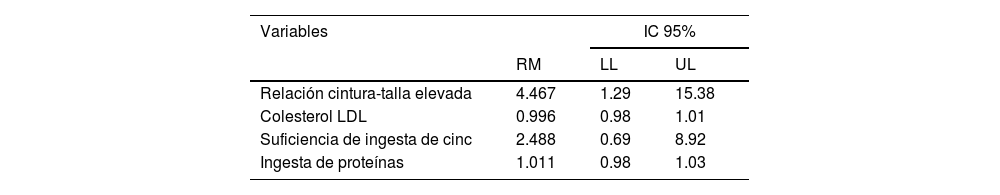
Tras ajustar para las variables de confusión (categorizadas como ICT [sí o no] y colesterol LDL elevado, ingesta adecuada de cinc [sí o no] e ingesta diaria de proteína [g/día]), se encontró que MASLD estaba asociado solamente con ICT (tabla 4).
Análisis de regresión logística para las variables de ingesta alimentaria y características antropométricas y clínicas de pacientes con MASLD, observados en la Clínica Ambulatoria Pediátrica, 2022
| Variables | IC 95% | ||
|---|---|---|---|
| RM | LL | UL | |
| Relación cintura-talla elevada | 4.467 | 1.29 | 15.38 |
| Colesterol LDL | 0.996 | 0.98 | 1.01 |
| Suficiencia de ingesta de cinc | 2.488 | 0.69 | 8.92 |
| Ingesta de proteínas | 1.011 | 0.98 | 1.03 |
Colesterol LDL: colesterol de lipoproteínas de baja densidad; IC 95%: intervalo de confianza del 95%; LL: límite inferior; MASLD: enfermedad esteatósica hepática asociada a disfunción metabólica; RM: razón de probabilidades (odds ratio); UL: límite superior.
Los resultados del presente estudio revelaron que las niñas, niños y adolescentes con MASLD presentaban mayores IMC acorde a la edad, CCU e ICT, en comparación con aquellos sin MASLD. Nuestros resultados también mostraron que los pacientes con MASLD consumían menor cantidad de proteínas, vitamina E, cinc y hierro.
Existe interés en estudiar MASLD en niñas, niños y adolescentes debido al incremento de la obesidad infantil a nivel mundial. La frecuencia de MASLD puede ser 10-20 veces mayor en pacientes con obesidad20; sin embargo, se ha encontrado que la obesidad central es más relevante para MASLD que la grasa corporal total20. En el presente estudio encontramos que MASLD fue más frecuente en pacientes con IMC, ICT y CCU altos y que la presencia de la grasa total y central incrementada se asociaba con la enfermedad.
Algunos estudios han investigado la asociación entre adiposidad central y MASLD, y la explicación para esta asociación parece tener relación con el hecho de que los adipocitos viscerales almacenan y movilizan triglicéridos más rápido que los adipocitos en otras regiones, lo cual incrementa la disponibilidad de ácidos grasos libres. Esto estimula la glucogénesis en el sistema portal e inhibe la depuración hepática de insulina, iniciando el desarrollo de MASLD21,22.
Con la aparición de MASLD en personas cada vez más jóvenes, la ingesta alimentaria es otro aspecto que se ha observado que es relevante para comprender el desarrollo de esta enfermedad. Se ha demostrado en estudios que una dieta alta en calorías, hidratos de carbono simples y grasas saturadas y trans, y por otro lado baja en PUFA, fibra y antioxidantes puede ser un factor detonante de la enfermedad4,23.
Se ha observado en estudios previos que una ingesta incrementada de proteína y disminuida de hidratos de carbono reduce los niveles de almacenamiento de grasa y de colesterol en plasma, lo cual ayuda a prevenir la esteatosis hepática3. En el presente estudio, los participantes con MASLD, en promedio, tuvieron ingesta de proteína baja.
Otro factor de riesgo asociado con MASLD es la ingesta de lípidos de baja calidad. El desequilibrio en la calidad y la cantidad en la ingesta de lípidos puede detonar la enfermedad debido a que la alta ingesta de grasas saturadas y trans promueve el daño hepático2,3. Sin embargo, una ingesta adecuada de PUFA puede prevenir el inicio de la enfermedad al incrementar la oxidación de ácidos grasos y disminuir la resistencia a la insulina2,4. La ingesta total de lípidos fue menor en el grupo con MASLD. Este resultado puede ser evaluado de mejor manera al considerar la menor ingesta de PUFA y la mayor ingesta de grasas trans en el grupo con MASLD, lo cual corrobora hallazgos previos y destaca la necesidad de una dieta de mejor calidad.
Los micronutrientes como las vitaminas A, C y E, y los minerales magnesio, cobre, cinc y selenio juegan un papel antioxidante no enzimático y pueden prevenir el estrés oxidativo y la peroxidación de lípidos, los cuales son factores que contribuyen al desarrollo y progreso de MASLD2,20. El grupo con MASLD presentó tendencia a una menor ingesta de las vitaminas y los minerales ligados a la prevención del estrés oxidativo. El cinc puede ser un antagonista eficiente de la formación de radicales libres; una suplementación de cinc durante 6 meses en un estudio previo estuvo asociada con una disminución de los niveles plasmáticos de malondialdehído24. La vitamina E tiene propiedades antiinflamatorias y antioxidantes, además de que estimula la actividad de enzimas antioxidantes, incluida la glutatión peroxidasa3.
El hierro es otro nutriente que ha sido estudiado con relación al MASLD. Esta asociación no fue observada en el presente estudio. Sin embargo, los individuos con MASLD presentaron tendencia a una menor ingesta diaria de hierro. Existe interés en dicho nutriente debido a que la deficiencia de hierro puede estar asociada con inflamación y baja función mitocondrial, las cuales son condiciones presentes en MASLD25.
La ingesta alta de sodio y baja de potasio están ligadas al síndrome metabólico y, en consecuencia, son factores de riesgo para MASLD, considerando la expresión hepática del síndrome3. En el presente estudio no hubo diferencias en la ingesta de dichos nutrientes entre los 2 grupos. Sin embargo, la ingesta de sodio fue superior al nivel recomendado y la ingesta de potasio no llegó al nivel recomendado en ninguno de los 2 grupos, lo cual indica un factor de riesgo para MASLD. Estos resultados se pueden deber al alto consumo de alimentos procesados, los cuales no fueron evaluados cuantitativamente en el presente estudio, pero se observaron en los registros alimentarios.
Entre las limitaciones del estudio se encuentra la ausencia del análisis de la ingesta de alimentos procesados y la falta de opciones para investigar la ingesta de algunos de los nutrientes en el programa de evaluación alimentaria que se utilizó. Las fortalezas del estudio incluyen el enfoque en población pediátrica y la inclusión de individuos con o sin sobrepeso u obesidad.
Dado el significativo y gradual incremento de obesidad y MASLD a nivel mundial, y debido a que la población joven está expuesta a la enfermedad por periodos de tiempo más largos cuando no se hace un diagnóstico temprano, creemos que estos resultados refuerzan la necesidad de mejorar la ingesta alimentaria en niñas, niños y adolescentes para prevenir la obesidad y la acumulación de grasa en la región central del cuerpo.
AutoríaPatricia Santos: concepto del estudio y diseño, recolección de datos, análisis de datos e interpretación; escritura del artículo o revisión crítica por contenido intelectual importante; aprobación final de la versión a presentar. Helma Cotrim: concepto del estudio y diseño; revisión crítica por contenido intelectual importante; aprobación final de la versión a presentar. Raquel Rocha: concepto del estudio y diseño; revisión crítica por contenido intelectual importante; aprobación final de la versión a presentar. Carla Daltro: concepto del estudio y diseño; análisis de datos e interpretación; revisión crítica por contenido intelectual importante; aprobación final de la versión a presentar. Sandra Andrade: recolección de datos. Allana Miranda: recolección de datos; aprobación final de la versión a presentar. Allana Castelo: recolección de datos; aprobación final de la versión a presentar.
FinanciaciónEste proyecto fue financiado por el Consejo Nacional para el Desarrollo Científico y Tecnológico (CNPq) y por el Programa Permanente/PROAE-UFBA por medio de becas de investigación. El apoyo del CNPq, con número de proceso 447322/2014-1, fue utilizado para las pruebas bioquímicas y la institución no participó en esta o cualquier otra decisión. El apoyo del PROAE fue destinado a académicos de pregrado (LAS, n. 20557) (KABT, n.18635) y estudiantes de pregrado (ICB, n. 26658). El CNPq no participó en el diseño, análisis o escritura del presente artículo. No hubo financiamiento por parte de los autores para finalizar o traducir este trabajo. Agradecemos a las instituciones financiadoras por su apoyo y aliento.
Conflicto de interesesLos autores declaran que no existió conflicto de intereses.
AgradecimientosQuisiéramos agradecer a Luanny Alves de Souza, Luana Milen Varjão, Isadora Cardim Barreto y Carolina Assumpção Sacramento por realizar la recolección de datos.
Disponibilidad de datosLos datos son privados porque pertenecen a humanos. Sin embargo, de ser necesario, las bases de datos pueden estar disponibles en el futuro.
Véase contenido relacionado en DOI: 10.1016/j.rgmx.2024.12.007, Vázquez-Frias R. La alimentación es pieza clave en la patogénesis de la enfermedad hepática esteatósica asociada a disfunción metabólica en la población pediátrica. Rev Gastroenterol Mex. 2025;90: 347–348.