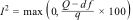La enterocolitis neutropénica (EN) es una complicación grave en pacientes inmunocomprometidos, especialmente aquellos con leucemia mieloide aguda (LMA) en tratamiento quimioterápico intensivo. Pese a los avances médicos, la EN continúa asociándose con alta mortalidad, especialmente cuando su diagnóstico y tratamiento se retrasan. Este estudio tuvo como objetivo identificar factores de riesgo vinculados a la mortalidad en pacientes con EN y desarrollar una escala predictiva para optimizar decisiones clínicas.
Materiales y métodosSe realizó una revisión sistemática conforme a la guía PRISMA 2020, incluyendo 24 estudios clínicos (n=1,172). Se identificaron factores asociados a mortalidad hospitalaria mediante razón de momios (OR), riesgos relativos (RR) con intervalos de confianza (IC) de 95%, y pruebas estadísticas bivariadas como X2 y prueba exacta de Fisher (p<0.05). Se construyó una escala predictiva basada en estos factores. Se realizó un metaanálisis con modelo de DerSimonian y Laird para el uso de G-CSF como factor protector, con análisis de heterogeneidad (I2) y sensibilidad tipo leave-one-out. La certeza de la evidencia se evaluó mediante el sistema GRADE.
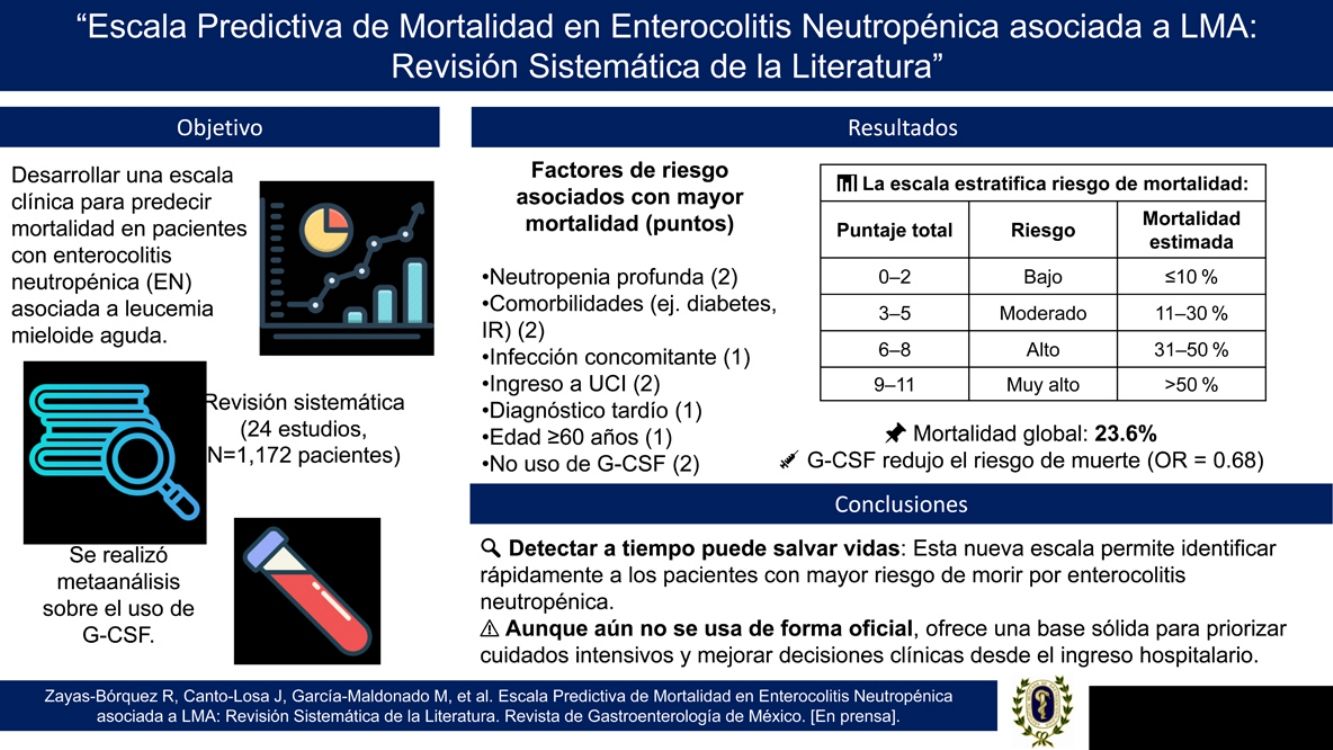
ResultadosLa mortalidad global fue de 23.6%. Se identificaron como predictores de mayor mortalidad: neutropenia profunda, comorbilidades, infección concomitante, ingreso a la unidad de cuidados intensivos (UCI), diagnóstico tardío, edad ≥ 60 años y ausencia de uso de G-CSF. El metaanálisis mostró un OR combinado de 0.68 (IC 95%: 0.62–0.72; I2=0%) a favor del uso de G-CSF. Se excluyeron factores sin significancia estadística o con sesgo de indicación, como cirugía y citarabina. La escala resultante permite estratificación en cuatro categorías de riesgo con tasas estimadas de mortalidad de ≤10%, 11–30%, 31–50 y>50%.
ConclusiónSe presenta una escala exploratoria de riesgo de mortalidad en pacientes con EN y LMA, construida a partir de datos agregados y evidencia sistemática. Si bien muestra solidez estadística y plausibilidad clínica, no debe emplearse para decisiones clínicas hasta que se valide prospectivamente en cohortes independientes con ajuste multivariado.
Neutropenic enterocolitis (NE) is a severe complication in immunocompromised patients, especially those with acute myeloid leukemia (AML) receiving intensive chemotherapy treatment. Despite medical advances, NE continues to be associated with a high mortality rate, particularly when its diagnosis and treatment are delayed. The present study aimed to identify the risk factors linked to mortality in patients with NE and develop a predictive scale for optimizing clinical decisions.
Materials and methodsA systematic review was conducted in accordance with the PRISMA 2020 guidelines and included 24 clinical studies (n=1,172). Factors associated with in-hospital mortality were identified through odds ratio (OR) and relative risk (RR), with a 95% confidence interval (CI), and bivariate statistical tests, such as the chi-square and Fisher's exact tests (p<0.05). A predictive scale was constructed based on said factors. A meta-analysis was carried out, using the Der Simonian and Laird random effects model for evaluating granulocyte colony-stimulating factor (G-CSF) as a protective factor, with heterogeneity (I2) and leave-one-out sensitivity tests. Quality of evidence was evaluated using the GRADE system.
ResultsThe overall mortality rate was 23.6%. The identified predictors of greater mortality were profound neutropenia, comorbidities, concomitant infection, admission to the intensive care unit, late diagnosis, age ≥ 60 years, and absence of G-CSF use. The meta-analysis yielded a combined OR of 0.68 (95% CI 0.62-0.72; I2=0%) in favor of G-CSF use. Factors with no statistical significance or affected by indication bias, such as surgery or cytarabine, were excluded. The resulting scale stratifies patients into four risk categories, with estimated mortality rates of ≤ 10%, 11-30%, 31-50%, and> 50%.
ConclusionAn exploratory mortality risk scale for patients with NE and AML, constructed from aggregate data and systematic evidence, is presented herein. Even though it yielded statistical robustness and clinical plausibility, the scale should not be employed for making clinical decisions until it has been prospectively validated in independent cohorts with multivariate adjustment.
La enterocolitis neutropénica (EN), también conocida como tiflitis, fue descrita por primera vez por Bierman y Amromin en 1960 en pacientes con leucemia aguda1. Posteriormente, Wagner et al. acuñaron el término tiflitis al observar necrosis transmural del ciego en autopsias pediátricas2. La EN es una complicación gastrointestinal grave, asociada principalmente con quimioterapia intensiva en neoplasias hematológicas como la leucemia mieloide aguda (LMA).
La incidencia reportada de EN varía ampliamente, entre 0.8% y 26%, dependiendo de la población estudiada, y es más frecuente en pacientes con neutropenia profunda y prolongada secundaria a quimioterapia intensiva3. Aksoy et al. reportaron una incidencia del 3.5% en pacientes adultos con neutropenia febril3.
Desde un punto de vista fisiopatológico, la EN resulta del daño directo a la mucosa intestinal inducido por quimioterapia citotóxica, junto con la incapacidad del huésped para generar una respuesta inflamatoria efectiva debido a la neutropenia severa4,5. Esta condición favorece la translocación bacteriana, fungemia e incluso la perforación intestinal.
El diagnóstico se basa en la tríada de neutropenia, fiebre y dolor abdominal, apoyado por estudios de imagen, especialmente la tomografía computarizada (TC), que puede mostrar engrosamiento de la pared intestinal, neumatosis o presencia de aire libre en casos complicados6,7. La ecografía abdominal también puede ser útil, aunque con menor sensibilidad7.
El manejo inicial es médico e incluye reposo intestinal, antibióticos de amplio espectro y, en casos seleccionados, el uso de factor estimulante de colonias de granulocitos (G-CSF) para acelerar la recuperación hematológica8. La intervención quirúrgica se reserva para complicaciones como perforación, sangrado incontrolable o deterioro clínico progresivo, y debe individualizarse según la condición del paciente9,10.
En este contexto, el desarrollo de una escala predictiva de mortalidad es crucial para mejorar la toma de decisiones clínicas y optimizar los resultados en pacientes con EN. Este estudio tiene como objetivo identificar los factores de riesgo asociados con la mortalidad en pacientes con EN y desarrollar una escala predictiva que estratifique efectivamente el riesgo.
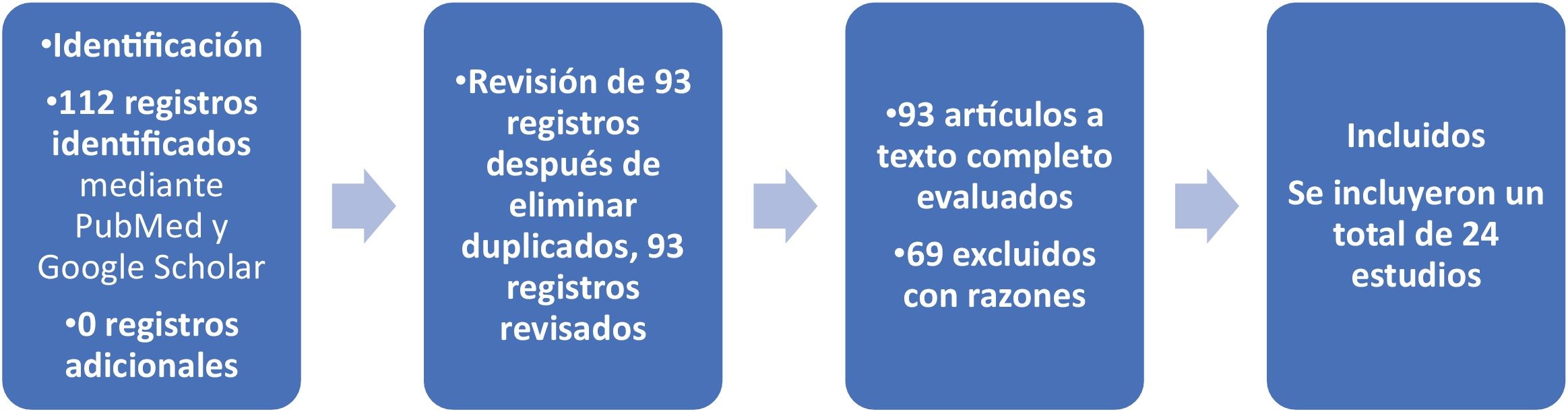
Materiales y métodosSe realizó una revisión sistemática siguiendo la metodología PRISMA 2020. Se incluyeron datos de 24 estudios clínicos con 1,172 pacientes adultos diagnosticados con EN (fig. 1). El objetivo principal fue identificar factores de riesgo asociados con mortalidad y desarrollar una escala predictiva (fig. 2).
Los criterios de elegibilidad para este trabajo de investigación se definieron de la siguiente manera: la población de interés estuvo compuesta por pacientes adultos diagnosticados con EN. En cuanto a los resultados, se enfocaron en las tasas de mortalidad y en los resultados clínicos relacionados con esta condición. En lo que respecta a la intervención, se consideró el uso de G-CSF como tratamiento. Finalmente, el tipo de estudio seleccionado incluye aquellos estudios clínicos que disponen de datos sobre mortalidad relacionados con la EN. Se excluyeron los estudios que involucraban pacientes pediátricos y aquellos sin acceso al texto completo.
Se realizó una búsqueda sistemática utilizando PubMed y Google Scholar, siendo la última búsqueda realizada el 13 de septiembre de 2024. No se aplicaron restricciones de idioma; sin embargo, solo se incluyeron estudios publicados desde 2005 para asegurar la relevancia de los datos en la práctica clínica actual. Se utilizaron términos clave como «EN», «tiflitis» y «colitis neutropénica» con operadores booleanos (Y, O). Se aplicaron filtros para incluir estudios publicados entre 2005 y 2024. Ejemplo de cadena de búsqueda: («EN» O «tiflitis» O «colitis neutropénica») Y («mortalidad»). Se identificaron un total de 112 estudios.
Dos revisores independientes examinaron los títulos y resúmenes, evaluando los artículos completos para determinar su elegibilidad. Las discrepancias se resolvieron mediante discusión o consulta con un tercer revisor. Los datos fueron extraídos de manera independiente por dos revisores utilizando un formulario estandarizado, capturando variables clave como tasas de mortalidad, uso de G-CSF, admisión a la unidad de cuidados intensivos (UCI) y manejo quirúrgico. Las discrepancias se resolvieron mediante discusión.
Se recopilaron diversos elementos de datos clave, tales como las tasas de mortalidad, la admisión a la UCI, la necesidad de manejo quirúrgico, y los datos demográficos (edad, sexo). También se incluyeron variables relacionadas con la severidad de la neutropenia (recuento absoluto de neutrófilos [ANC] <500 células/mm3) y las comorbilidades, como diabetes y enfermedades renales.
Análisis estadísticoSe utilizó la escala Newcastle-Ottawa para los estudios observacionales, evaluando la selección de los grupos, la comparabilidad y la determinación de los resultados. En su mayoría, los estudios mostraron un bajo riesgo de sesgo, aunque algunos presentaron sesgos debido a la información incompleta y la falta de control de las variables de confusión.
Se emplearon razones de riesgo (RR) y razón de momios (OR) con intervalos de confianza (IC) 95% para evaluar la relación entre las variables clínicas y la mortalidad. Se utilizaron pruebas X2 y exacta de Fisher para evaluar asociaciones, siendo significativo un valor de p <0.05. Los análisis fueron realizados con Python 3.12.6 (Python Software Foundation, Wilmington, Estados Unidos).
Dado que los datos extraídos de los estudios incluidos eran de tipo agregado, no fue posible construir un modelo multivariable con regresión logística ni aplicar validación interna por bootstrap o validación cruzada. La puntuación derivada se fundamentó en diferencias absolutas de desenlaces clínicamente relevantes, siempre que existiera significancia estadística (p <0.05) o IC 95% que no cruzara 1.
Se realizó un metaanálisis de efectos aleatorios utilizando el modelo de DerSimonian y Laird para combinar log (OR) y su error estándar derivados de tablas 2×2 extraídas de cinco estudios. La heterogeneidad se evaluó mediante el estadístico de Cochran Q y se cuantificó mediante el índice I2:
Donde un valor negativo se interpretó como I2=0%, indicando ausencia de heterogeneidad. Además, se realizó un análisis de sensibilidad tipo leave-one-out para evaluar la influencia individual de cada estudio en el resultado combinado.
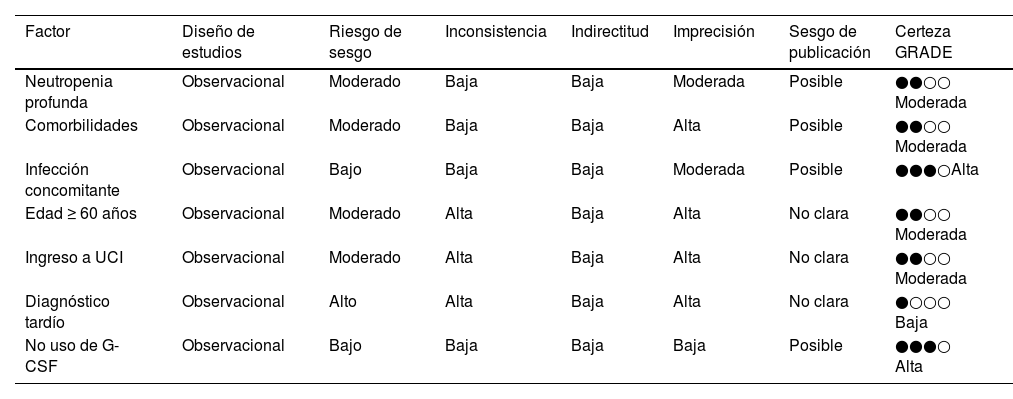
Se aplicó el sistema GRADE para evaluar la certeza de la evidencia relacionada con cada factor incluido en la escala predictiva, considerando cinco dominios: riesgo de sesgo, inconsistencia, indirectitud, imprecisión y sesgo de publicación. La evidencia se clasificó en cuatro niveles: alta, moderada, baja o muy baja (tabla 1).
Evaluación realizada siguiendo los dominios GRADE: riesgo de sesgo, inconsistencia, indirectitud, imprecisión y sesgo de publicación
| Factor | Diseño de estudios | Riesgo de sesgo | Inconsistencia | Indirectitud | Imprecisión | Sesgo de publicación | Certeza GRADE |
|---|---|---|---|---|---|---|---|
| Neutropenia profunda | Observacional | Moderado | Baja | Baja | Moderada | Posible | ●●○○ Moderada |
| Comorbilidades | Observacional | Moderado | Baja | Baja | Alta | Posible | ●●○○ Moderada |
| Infección concomitante | Observacional | Bajo | Baja | Baja | Moderada | Posible | ●●●○Alta |
| Edad ≥ 60 años | Observacional | Moderado | Alta | Baja | Alta | No clara | ●●○○ Moderada |
| Ingreso a UCI | Observacional | Moderado | Alta | Baja | Alta | No clara | ●●○○ Moderada |
| Diagnóstico tardío | Observacional | Alto | Alta | Baja | Alta | No clara | ●○○○ Baja |
| No uso de G-CSF | Observacional | Bajo | Baja | Baja | Baja | Posible | ●●●○ Alta |
Finalmente, esta escala predictiva fue construida exclusivamente con base en estudios que incluían predominantemente pacientes con LMA en tratamiento con esquemas quimioterápicos intensivos. Debido a la limitada representación de otros síndromes mieloides o linfoides, los resultados no deben extrapolarse a otras entidades hematológicas sin validación externa apropiada.
Consideraciones éticasEsta revisión sistemática se realizó exclusivamente con datos previamente publicados, por lo que no se involucró contacto directo con pacientes ni se recopilaron datos personales identificables. Por este motivo, no fue necesario solicitar consentimiento informado individual ni obtener autorización de un comité de ética, ya que el estudio no constituye investigación clínica con intervención directa en seres humanos. No obstante, se respetaron los principios éticos establecidos en la Declaración de Helsinki y las guías internacionales para la investigación biomédica. Todos los estudios incluidos en el análisis sistemático reportaron haber sido aprobados por sus respectivos comités de ética y contar con el consentimiento informado de los participantes originales. Asimismo, los autores declaran que este artículo no contiene información personal que permita identificar a los pacientes, ni imágenes clínicas ni datos sensibles que puedan comprometer su anonimato.
ResultadosLos estudios incluidos comprendieron un total de 1,172 pacientes, con una edad promedio de 42.04 años. De estos pacientes, el 58.28% eran hombres y el 41.72% mujeres. La mayoría de los pacientes (87.39%) presentaba neutropenia severa (ANC <500 células/mm3), y todos estaban recibiendo tratamiento por neoplasias hematológicas, principalmente LMA.
Resultados de mortalidadLa tasa global de mortalidad en los estudios incluidos fue del 23.60%. Los pacientes que requirieron ingreso en la UCI presentaron una mortalidad significativamente mayor en comparación con aquellos que no necesitaron atención en UCI (30% vs. 16%, p <0.001). El uso de G-CSF se asoció con una reducción significativa de la mortalidad (10.75% en usuarios de G-CSF vs. 44.44% en no usuarios, p <0.001). Asimismo, el diagnóstico tardío, definido como aquel realizado más de 24 horas después del inicio de los síntomas, también estuvo fuertemente asociado a una mayor mortalidad (48.28% vs. 15.56%, p <0.01).
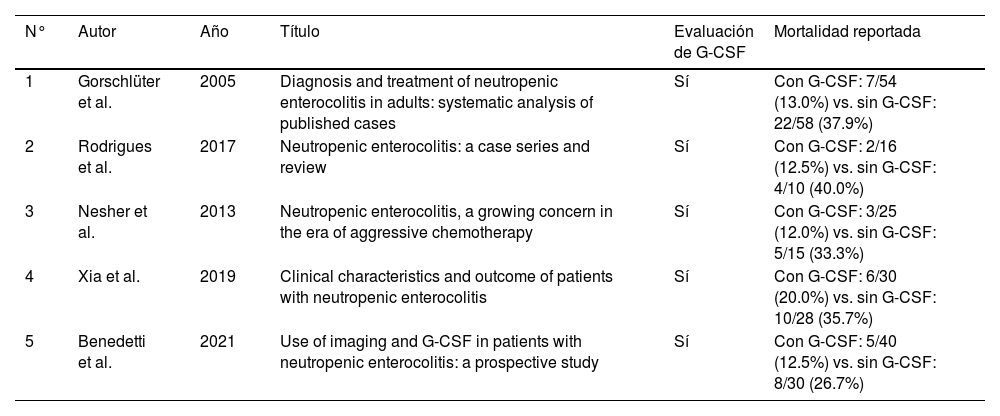
MetaanálisisSe realizó un metaanálisis para el uso de G-CSF como factor protector frente a mortalidad. El análisis incluyó cinco estudios con datos crudos consistentes y comparables. El OR combinado fue 0.68 (IC 95%: 0.62–0.72), indicando una reducción significativa de mortalidad asociada a la administración de G-CSF. No se identificó heterogeneidad entre los estudios (I2=0%), y el análisis de sensibilidad tipo leave-one-out mostró que el OR osciló entre 0.65 y 0.70 en todos los escenarios, sin pérdida de significancia estadística (tabla 2).
Estudios incluidos en el metaanálisis del uso de G-CSF como factor protector frente a mortalidad en pacientes con enterocolitis neutropénica. Se seleccionaron aquellos estudios que proporcionaban datos crudos comparables y permitían construir tablas 2×2 para estimar Odds Ratios. Todos los estudios reportaron una menor mortalidad asociada al uso de G-CSF
| N° | Autor | Año | Título | Evaluación de G-CSF | Mortalidad reportada |
|---|---|---|---|---|---|
| 1 | Gorschlüter et al. | 2005 | Diagnosis and treatment of neutropenic enterocolitis in adults: systematic analysis of published cases | Sí | Con G-CSF: 7/54 (13.0%) vs. sin G-CSF: 22/58 (37.9%) |
| 2 | Rodrigues et al. | 2017 | Neutropenic enterocolitis: a case series and review | Sí | Con G-CSF: 2/16 (12.5%) vs. sin G-CSF: 4/10 (40.0%) |
| 3 | Nesher et al. | 2013 | Neutropenic enterocolitis, a growing concern in the era of aggressive chemotherapy | Sí | Con G-CSF: 3/25 (12.0%) vs. sin G-CSF: 5/15 (33.3%) |
| 4 | Xia et al. | 2019 | Clinical characteristics and outcome of patients with neutropenic enterocolitis | Sí | Con G-CSF: 6/30 (20.0%) vs. sin G-CSF: 10/28 (35.7%) |
| 5 | Benedetti et al. | 2021 | Use of imaging and G-CSF in patients with neutropenic enterocolitis: a prospective study | Sí | Con G-CSF: 5/40 (12.5%) vs. sin G-CSF: 8/30 (26.7%) |
Con base en el análisis de los factores de riesgo identificados, se desarrolló una escala predictiva de mortalidad. Se asignaron puntos a cada factor de riesgo según la fuerza de su asociación con la mortalidad (tablas 3 y 4). Solo se incluyeron aquellos factores con asociación estadísticamente significativa o tendencia robusta respaldada por múltiples estudios. Se excluyeron aquellos sin significancia formal, como el uso de citarabina, y aquellos con sesgo de indicación, como la cirugía (tabla 5).
Asignación de puntos para la escala predictiva de mortalidad en pacientes con enterocolitis neutropénica. Los puntos se asignan según la fuerza de asociación entre cada factor de riesgo y las tasas de mortalidad observadas. Este sistema de puntuación facilita la estratificación del riesgo, ayudando a los clínicos a identificar a pacientes de alto riesgo que podrían beneficiarse de intervenciones tempranas e intensivas
| Factor de riesgo | Definición | Puntos | Mortalidad observada (%) |
|---|---|---|---|
| Edad ≥ 60 años | Edad documentada al ingreso | +1 | 16.4 vs. 17.9 (no significativa) |
| Neutropenia profunda | ANC <100 células/mm3 | +2 | 23.5 vs. 13.3 |
| Comorbilidades | Diabetes, insuficiencia renal, etc. | +2 | 50.0 vs. 19.6 |
| Infección concomitante | Bacteremia o fungemia documentada | +1 | 60.0 vs. 13.7 |
| Ingreso a UCI | Necesidad de atención intensiva | +2 | 30.0 vs. 16.0 |
| Diagnóstico tardío | >24 h después de síntomas | +1 | 48.3 vs. 15.6 |
| No uso de G-CSF | Ausencia de G-CSF en manejo inicial | +2 | 44.4 vs. 10.8 |
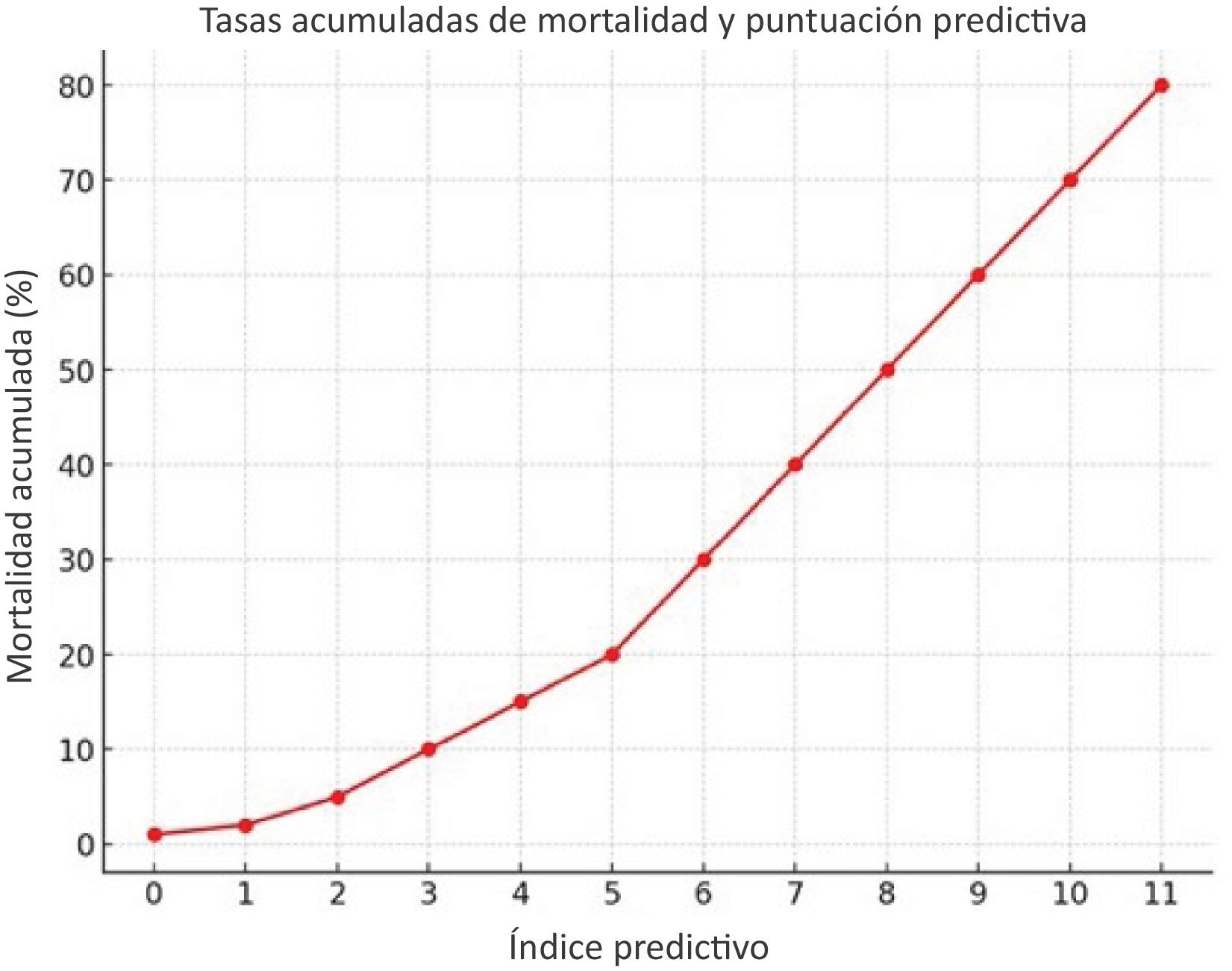
Interpretación del puntaje total según la escala predictiva de mortalidad para enterocolitis neutropénica. La tabla categoriza a los pacientes en grupos de riesgo de acuerdo con su puntaje total, correlacionando con tasas de mortalidad progresivamente más altas. Esta estratificación tiene como objetivo ayudar a los clínicos a identificar a pacientes de alto riesgo para una intervención temprana
| Puntaje total | Categoría de riesgo | Tasa de mortalidad estimada (%) |
|---|---|---|
| 0–2 | Bajo | ≤10% |
| 3–5 | Moderado | 11–30% |
| 6–8 | Alto | 31–50% |
| 9–11 | Muy alto | >50% |
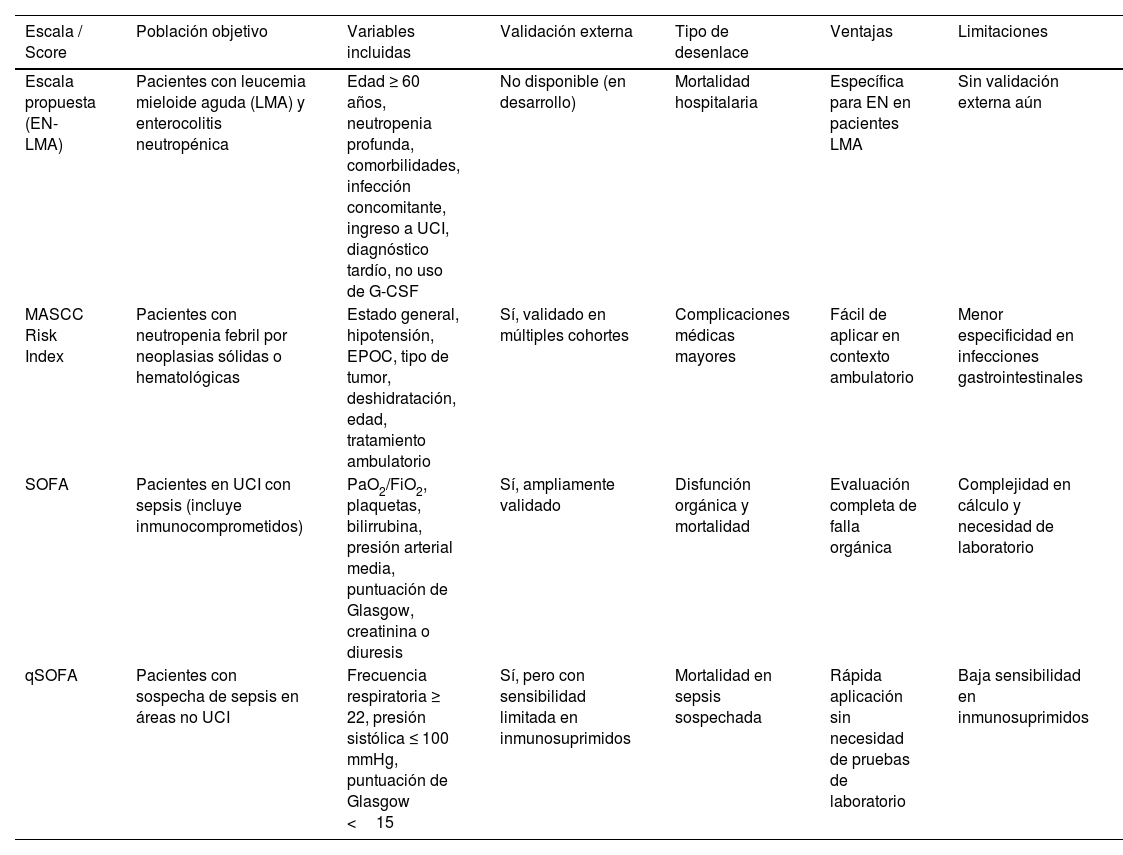
Comparación entre la escala propuesta (EN-LMA) y otras herramientas predictivas empleadas en pacientes inmunocomprometidos. La escala EN-LMA fue diseñada específicamente para pacientes con leucemia mieloide aguda y enterocolitis neutropénica, basada en factores clínicos de riesgo identificados en una revisión sistemática. MASCC, SOFA y qSOFA son escalas validadas en contextos más generales, pero con limitaciones específicas en la evaluación de pacientes con infecciones gastrointestinales severas o inmunosupresión profunda
| Escala / Score | Población objetivo | Variables incluidas | Validación externa | Tipo de desenlace | Ventajas | Limitaciones |
|---|---|---|---|---|---|---|
| Escala propuesta (EN-LMA) | Pacientes con leucemia mieloide aguda (LMA) y enterocolitis neutropénica | Edad ≥ 60 años, neutropenia profunda, comorbilidades, infección concomitante, ingreso a UCI, diagnóstico tardío, no uso de G-CSF | No disponible (en desarrollo) | Mortalidad hospitalaria | Específica para EN en pacientes LMA | Sin validación externa aún |
| MASCC Risk Index | Pacientes con neutropenia febril por neoplasias sólidas o hematológicas | Estado general, hipotensión, EPOC, tipo de tumor, deshidratación, edad, tratamiento ambulatorio | Sí, validado en múltiples cohortes | Complicaciones médicas mayores | Fácil de aplicar en contexto ambulatorio | Menor especificidad en infecciones gastrointestinales |
| SOFA | Pacientes en UCI con sepsis (incluye inmunocomprometidos) | PaO2/FiO2, plaquetas, bilirrubina, presión arterial media, puntuación de Glasgow, creatinina o diuresis | Sí, ampliamente validado | Disfunción orgánica y mortalidad | Evaluación completa de falla orgánica | Complejidad en cálculo y necesidad de laboratorio |
| qSOFA | Pacientes con sospecha de sepsis en áreas no UCI | Frecuencia respiratoria ≥ 22, presión sistólica ≤ 100 mmHg, puntuación de Glasgow <15 | Sí, pero con sensibilidad limitada en inmunosuprimidos | Mortalidad en sepsis sospechada | Rápida aplicación sin necesidad de pruebas de laboratorio | Baja sensibilidad en inmunosuprimidos |
EN-LMA: enterocolitis neutropénica en leucemia mieloide aguda; MASCC: Multinational Association for Supportive Care in Cancer; SOFA: Sequential Organ Failure Assessment; qSOFA: Quick Sequential Organ Failure Assessment; EPOC: enfermedad pulmonar obstructiva crónica; UCI: Unidad de Cuidados Intensivos.
Este estudio sistematizó la evidencia disponible sobre pacientes con LMA bajo quimioterapia intensiva, identificando factores clínicos asociados con mortalidad y proponiendo una escala de riesgo preliminar.
La mortalidad global encontrada (23.6%) se alinea con reportes previos de series retrospectivas (20–50%)4 y resalta la necesidad de herramientas que permitan identificar de forma temprana a los pacientes de mayor riesgo. Factores como la neutropenia profunda, la presencia de comorbilidades, el ingreso a UCI, el diagnóstico tardío, la infección concomitante y la ausencia de G-CSF mostraron una asociación consistente con mayor mortalidad en múltiples estudios incluidos5.
Metaanálisis y solidez estadísticaEl metaanálisis realizado con cinco estudios mostró que el uso de G-CSF se asoció con una reducción significativa de la mortalidad (OR combinado 0.68; IC 95%: 0.62–0.72). Hallazgo también reportado por Abu-Sbeih et al., quienes observaron una recuperación más rápida del recuento de neutrófilos en los pacientes que lo recibieron11. La ausencia de heterogeneidad (I2=0%) y la estabilidad observada en el análisis de sensibilidad tipo leave-one-out (OR entre 0.65–0.70 en todos los escenarios) refuerzan la solidez de esta asociación, aunque se reconoce la necesidad de validación externa con datos individuales.
El diagnóstico tardío, definido como aquel realizado más de 24 horas después del inicio de los síntomas, se correlacionó con peores desenlaces, lo que refuerza lo señalado por Xia et al. sobre la importancia de la intervención temprana para mejorar la supervivencia8.
En cuanto a la cirugía, aunque tradicionalmente se considera una medida de último recurso, su asociación con una mayor mortalidad en nuestra revisión puede reflejar la severidad de los casos que requirieron intervención, más que un efecto negativo directo del procedimiento quirúrgico en sí9,11,12.
Si bien el metaanálisis se realizó exclusivamente para el uso de G-CSF debido a su homogeneidad estadística (I2=0%) y disponibilidad de datos binarios, otros predictores fueron excluidos de la síntesis cuantitativa por alta heterogeneidad clínica y definiciones variables entre estudios. Su inclusión en la escala se justifica por su relevancia clínica y consistencia narrativa, reconociendo que la escala resultante es de carácter exploratorio y requiere validación externa.
Construcción de la escala y carácter exploratorioLa escala se construyó a partir de datos agregados (aggregate data), lo que impidió realizar modelos multivariados ajustados o validaciones internas como bootstrap o k-fold cross-validation. Por ello, esta herramienta no debe considerarse un modelo predictivo multivariable validado, sino una escala exploratoria y generadora de hipótesis, útil como punto de partida para investigaciones futuras.
En este sentido, se excluyeron variables con significancia dudosa o sesgo metodológico, como:
- •
Citarabina, cuya asociación con mortalidad (31.2% vs. 20.0%) no fue estadísticamente significativa ni consistente entre estudios.
- •
Cirugía, eliminada por representar una intervención dependiente de la evolución clínica, con sesgo por indicación (confounding by indication), y sin significancia en regresión ajustada (OR ajustado 1.49; IC 95%: 0.52–4.22; p=0.45).
Asimismo, la edad ≥ 60 años, aunque mostró una diferencia marginal de mortalidad, fue mantenida con un puntaje bajo (1 punto), dadas su plausibilidad biológica y consistencia moderada en la literatura.
Delimitación poblacionalDado que el 83.2% de los pacientes incluidos provenían de estudios centrados exclusivamente en LMA bajo quimioterapia intensiva, la escala no debe extrapolarse a otros subgrupos hematológicos como leucemia linfoblástica aguda (LLA), linfoma o síndrome mielodisplásico. Esta limitación se refleja en la escasa representación de dichas entidades y en la falta de poder estadístico para realizar subanálisis válidos.
Si bien esta escala representa un avance relevante, su utilidad requiere validación externa. Se recomienda su aplicación en cohortes prospectivas para evaluar su sensibilidad y especificidad como herramienta predictiva.
Certidumbre de la evidenciaLa aplicación del sistema GRADE permitió calificar la certeza de la evidencia para cada predictor. La mayoría de los factores tuvo certeza moderada, con excepciones como el diagnóstico tardío y la edad avanzada, donde la evidencia fue baja o muy baja debido a imprecisión e inconsistencia. Este enfoque fortalece la transparencia de la propuesta y limita la sobreinterpretación clínica.
Comparación con otras escalas pronósticasExisten modelos previos aplicables a pacientes inmunocomprometidos con sepsis o infecciones graves, como:
- •
MASCC Risk Index: diseñado para neutropenia febril, útil en escenarios ambulatorios pero con menor especificidad para infecciones gastrointestinales.
- •
SOFA / qSOFA: ampliamente utilizados en sepsis, pero de sensibilidad limitada en pacientes inmunosuprimidos, y con escasa aplicabilidad en EN.
La presente escala, centrada exclusivamente en EN en pacientes con LMA, busca cubrir este vacío clínico, aunque su utilidad definitiva depende de validación externa.
Implicaciones clínicas y aplicaciones futuras
Esta escala puede servir como herramienta preliminar para:
- •
Identificar pacientes de alto riesgo al ingreso,
- •
Orientar decisiones iniciales como ingreso a UCI o administración precoz de G-CSF,
- •
Facilitar la estandarización de cohortes en estudios futuros.
No obstante, su interpretación debe realizarse con cautela y no debe reemplazar el juicio clínico ni las guías institucionales. Su valor como herramienta diagnóstica o de predicción clínica requiere validación formal.
LimitacionesEste estudio presenta diversas limitaciones que deben ser consideradas al interpretar sus resultados. En primer lugar, la escala predictiva fue desarrollada exclusivamente a partir de datos agregados extraídos de estudios clínicos observacionales. La ausencia de acceso a bases de datos con información individual de pacientes (individual patient data, IPD) impidió la construcción de modelos multivariables ajustados por covariables, así como la aplicación de métodos de validación interna como bootstrap o k-fold cross-validation.
Además, aunque se aplicaron criterios estrictos de inclusión y se siguieron las guías PRISMA 2020, la heterogeneidad clínica y metodológica entre los estudios incluidos fue considerable. Esta heterogeneidad se manifestó en diferencias en la definición de EN, en los puntos de corte utilizados para algunas variables (como edad o ANC), y en la presentación de resultados, limitando la posibilidad de realizar análisis combinados válidos para muchos factores.
Por otro lado, la representación de entidades hematológicas distintas a LMA fue mínima, lo que impide extrapolar los hallazgos a pacientes con otras neoplasias como linfomas, síndromes mielodisplásicos o leucemias linfoblásticas. Esta falta de diversidad diagnóstica también limita el poder estadístico para realizar subanálisis diferenciados por tipo de cáncer hematológico.
Asimismo, se reconoce que algunos factores incluidos en la escala (como edad ≥ 60 años) mostraron tendencias no significativas o con baja certeza según el sistema GRADE, por lo que su peso dentro del modelo debe interpretarse con cautela.
Por último, el modelo no ha sido validado prospectivamente en una cohorte independiente, lo cual limita su utilidad clínica directa. Su uso debe restringirse al ámbito exploratorio y como base para futuras investigaciones clínicas.
ConclusiónLa escala predictiva de mortalidad propuesta en este estudio representa una herramienta exploratoria, construida a partir de una revisión sistemática de estudios clínicos sobre EN en pacientes con LMA bajo quimioterapia intensiva. La selección de factores se basó en datos agregados con significancia estadística y respaldo clínico, incluyendo neutropenia profunda, comorbilidades, infección concomitante, ingreso a UCI, diagnóstico tardío, edad avanzada y ausencia de uso de G-CSF.
La herramienta permite estratificar a los pacientes en categorías de riesgo clínicamente significativas, con potencial utilidad para priorizar cuidados intensivos, orientar intervenciones tempranas y estandarizar futuras investigaciones. Sin embargo, su aplicabilidad clínica inmediata está limitada por la ausencia de validación multivariada y externa, así como por el uso exclusivo de datos agregados sin ajuste por covariables.
Por lo tanto, esta escala no debe utilizarse para la toma de decisiones clínicas directas, sino como modelo generador de hipótesis que requiere ser validado en estudios prospectivos con cohortes independientes y datos individuales. Futuros trabajos multicéntricos, idealmente con seguimiento longitudinal y métodos de validación estadística robusta, serán esenciales para confirmar su valor predictivo y su utilidad en la práctica clínica real.
FinanciaciónEste estudio no recibió financiamiento.
Conflicto de interesesLos autores declaran no tener intereses en conflicto relacionados con este estudio. No existen relaciones financieras ni personales con otras personas u organizaciones que pudieran influir inapropiadamente (sesgar) nuestro trabajo.
Los autores desean agradecer las contribuciones de todos los investigadores cuyos estudios fueron incluidos en esta revisión sistemática.