La terapia neoadyuvante en el cáncer de recto se asocia con una disminución del tamaño tumoral y es la indicación terapéutica para pacientes con tumores T3, T4 o con compromiso ganglionar. El objetivo de este trabajo fue describir la frecuencia de respuesta patológica y la supervivencia de los pacientes sometidos a neoadyuvancia para cáncer de recto.
Materiales y métodosEstudio de seguimiento, retrospectivo, con análisis de supervivencia. Se incluyeron los pacientes con cáncer de recto localmente avanzado, que recibieron tratamiento neoadyuvante y se operaron en el Instituto de Cancerología Las Américas (Medellín, Colombia). La supervivencia se estimó por el método de Kaplan-Meier.
ResultadosSe incluyeron 152 pacientes, con un promedio de edad de 59 años (DE 12.8), 53.9% hombres, 58.6% diagnosticados en estadio IIIB. La respuesta patológica completa (pRC) se logró en el 17% de los pacientes. El protocolo de quimiorradioterapia se dio a 146 (96.1%) pacientes; presentaron metástasis y/o recaída 52 (34.2%), de los cuales uno (3.8%) había tenido pRC. La mediana de seguimiento fue de 33 meses (Q1-Q3: 20-45), con una supervivencia global de 79.5% (IC 95% 70.9-85.8). Para quienes tuvieron pRC, la supervivencia a 5 años fue del 80% (IC 95% 20.3-96.9).
ConclusionesLa frecuencia de pRC fue similar a la hallada en otros estudios publicados y su recidiva fue menor con respecto de quienes no tuvieron respuesta. La supervivencia a 5 años de los pacientes con pRC fue alta, aunque inferior a lo publicado en otros estudios.
Neoadjuvant therapy in rectal cancer is associated with a decrease in tumor size and is the therapeutic indication for patients with T3 or T4 tumors or lymph node involvement. Our aim was to describe the frequency of pathologic response and the survival rate in patients that underwent neoadjuvant therapy for rectal cancer.
Materials and methodsA retrospective follow-up study with a survival analysis was conducted. Patients with locally advanced rectal cancer that received neoadjuvant treatment and were operated on at the Instituto de Cancerología Las Américas (Medellín, Colombia) were analyzed. Survival was calculated using the Kaplan-Meier method.
ResultsA total of 152 patients were included. Mean patient age was 59 years (12.8 SD), 53.9% were men, and 58.6% of the patients were diagnosed with stage IIIB disease. The pathologic complete response (pCR) was achieved in 17% of the patients. A total of 146 (96.1%) patients received the chemoradiotherapy protocol. Fifty-two (34.2%) patients developed metastasis and/or relapse, and one (3.8%) of those patients had presented with pCR. The median follow-up period was 33 months (Q1-Q3: 20-45), with an overall survival rate of 79.5% (95% CI 70.9-85.8). The 5-year survival rate for the patients that had pCR was 80% (95% CI 20.3-96.9).
ConclusionsThe frequency of pCR was similar to that in other published studies and disease recurrence was lower, compared with patients with no response. The 5-year survival rate in patients with pCR was high, albeit lower than that reported in other studies.
El cáncer de recto es una enfermedad altamente frecuente, cuyo número de casos nuevos en el mundo para el 2018 se estimó en 704,376, con tasas de incidencia de 10 por 100,000 mujeres y 5.6 por 100,000 hombres. En Suramérica, las tasas estimadas fueron 7.7 en mujeres y 5.4 en hombres1. Según GLOBOCAN, para el 2018 en Colombia el cáncer de recto era la décima causa, con 2,922 casos nuevos2.
Actualmente, el tratamiento neoadyuvante es la indicación terapéutica para pacientes con adenocarcinoma de recto que tengan tumores T3, T4 o sospecha de compromiso ganglionar regional3,4. Las guías National Institute for Clinical Excellence (NICE) y National Comprehensive Cancer Network (NCCN) recomiendan ofrecer quimiorradioterapia preoperatoria con un intervalo antes de la cirugía para permitir una reducción del tamaño tumoral y obtener mejores resultados quirúrgicos en pacientes con cáncer rectal operable de alto riesgo4,5.
La terapia neoadyuvante se asocia con una disminución significativa del tamaño tumoral, un descenso de la incidencia de recurrencia local, un aumento de la probabilidad de preservar el esfínter anal y, además, con la posibilidad de lograr una respuesta patológica completa (pRC)6.
Para conocer los resultados obtenidos con la neoadyuvancia existen en la actualidad 5 diferentes clasificaciones de valoración de la respuesta patológica a la quimiorradioterapia y la clasificación del American Joint Committee on Cancer es la usada como estándar7–9. Esta se categoriza como: (0) respuesta completa cuando no se ven células tumorales; (1) respuesta moderada cuando se observan solo pequeños nidos tumorales o células únicas; (2) respuesta mínima cuando hay cáncer residual pero con fibrosis predominante, y (3) pobre respuesta cuando la regresión tumoral fue mínima o nula.
El objetivo de este estudio fue describir la respuesta patológica y la supervivencia de los pacientes sometidos a tratamiento neoadyuvante para cáncer de recto.
Materiales y métodosSe realizó un estudio retrospectivo de seguimiento. Los datos se tomaron del Sistema de Información para el Seguimiento de Pacientes con Cáncer Colorrectal del Instituto de Cancerología (IDC) Las Américas. Se incluyeron los pacientes atendidos en el periodo 2011-2017 por cáncer de recto, estadio T3, T4 y/o compromiso ganglionar tumoral y/o M1 con intención curativa, que recibieron quimioterapia y/o radioterapia neoadyuvante y que se operaron en el IDC.
Se tuvieron en cuenta variables sociodemográficas como edad, sexo, tipo de aseguramiento en salud; condiciones clínicas, como comorbilidades médicas (hipertensión, diabetes, enfermedad pulmonar obstructiva crónica, enfermedad renal crónica y enfermedades cardiacas), diagnóstico histológico, estadio clínico; de tratamiento, como neoadyuvancia, esquema de quimioterapia, dosis de radioterapia, tipo de cirugía, meses entre diagnóstico-neoadyuvancia, tiempo entre neoadyuvancia-cirugía y complicaciones (durante la neoadyuvancia se consideraron como graves aquellas donde se tuvo que suspender el tratamiento y las postoperatorias aquellas que requirieron reintervención). Además, se incluyeron variables de recurrencia como metástasis y/o recaída, meses entre cirugía-metástasis y estado vital.
Se empleó el sistema de estadificación del American Joint Committee on Cancer. La estadificación clínica se realizó con colonoscopia, tomografía contrastada de tórax y resonancia magnética de abdomen y pelvis contrastada.
El protocolo de quimiorradioterapia se realizó con radioterapia conformada tridimensional. El volumen grueso se definió como la enfermedad macroscópica identificada por examen físico y radiológico como la tomografía contrastada o la resonancia magnética de pelvis. El volumen clínico cubre la totalidad del mesorrecto y los ganglios linfáticos iliacos internos derecho e izquierdo para los tumores T3, y los ganglios iliacos externos derecho e izquierdo para los tumores T4. La dosis total para las cadenas ganglionares fue de 45 a 1.8Gy, y la del tumor fue de 50.4 a 1.8Gy.
El esquema de quimioterapia fue de 5FU 350mg/m2 por vía intravenosa al día, más leucovorina 20mg/m2 por vía intravenosa al día, por 5 días la primera y la quinta semana de radioterapia; en caso de desabastecimiento, capecitabina 1,650mg/m2/día por vía oral cada 12h todos los días durante la radioterapia.
La cirugía incluyó escisión mesorrectal total en la mayoría de los pacientes. La preservación o no del esfínter anal dependió del nivel de resección de la masa. Se planteó resección anterior baja de recto bien por abordaje abierto, bien por abordaje laparoscópico y resección abdominoperineal (bien por abordaje abierto, bien por abordaje laparoscópico). En algunos pacientes que expresaron su negativa a la escisión mesorrectal se les hizo resección local por abordaje transanal.
Todos los especímenes de resección fueron evaluados y estadificados por los patólogos del Laboratorio de Patología Las Américas, teniendo en cuenta las guías del College of American Pathologists y del American Joint Committee on Cancer8,9. De los especímenes con enfermedad macroscópicamente visible se procesaron partes representativas del tumor para la evaluación microscópica. En los casos en que no se observó tumor macroscópicamente, el lecho tumoral, las áreas ulceradas, fibróticas o sospechosas de tumor se procesaron en su totalidad en cortes seriados con un espesor de 4mm, se incluyeron en bloques de parafina y posteriormente se evaluaron microscópicamente. Los ganglios linfáticos se procesaron y evaluaron en su totalidad.
La pRC se definió como la ausencia de células tumorales viables en el espécimen quirúrgico (ypT0ypN0) y no completa cuando se clasificó como casi completa, parcial, pobre o sin respuesta.
La supervivencia global (SG) se determinó como el tiempo transcurrido desde el diagnóstico hasta la muerte por cualquier causa, y la supervivencia libre de enfermedad (SLE) se definió como el tiempo desde el diagnóstico hasta la aparición de signos y/o síntomas de la enfermedad o muerte. La fecha de fallecimiento se obtuvo de la historia clínica, de la base de datos de la Registraduría Nacional del Estado Civil o de la Administradora de Recursos del Sistema. Se estableció el 30 de agosto de 2018 como la fecha de cierre para obtener la información necesaria para SG y SLE. Los pacientes en los que no se pudo conocer su estado vital en las fuentes mencionadas se censuraron con la fecha del último contacto en el IDC.
Análisis estadísticoLas variables cuantitativas se expresaron como media y desviación estándar (DE) o mediana y rango intercuartílico (RIC), según fuera la simetría de la variable. Se usó la prueba de Kolmogorov-Smirnov para comprobar la normalidad. Las variables categóricas se expresaron mediante frecuencias absolutas y porcentajes. Para determinar la asociación entre 2 variables se utilizó la prueba de Chi-cuadrado de Pearson, la t de Student o la U de Mann-Whitney, según su naturaleza. La supervivencia se calculó mediante el método de Kaplan-Meier y para comparar las curvas de supervivencia se empleó el log-rank test. Los datos se analizaron con el programa estadístico STATA v12.
Consideraciones éticasEl protocolo se elaboró según las normas éticas internacionales y la legislación colombiana, y tanto este como la ejecución del estudio fueron aprobados y vigilados por el Comité de Ética Independiente del IDC Las Américas, el cual cumple con las normas de Buenas Prácticas Clínicas en todas sus actividades.
El Comité de Ética dispensó al investigador de la obtención de consentimiento informado al ser una investigación clasificada como sin riesgo según la normatividad colombiana. Los autores han seguido los protocolos sobre publicación de datos de pacientes y el anonimato de los mismos fue preservado en todo momento.
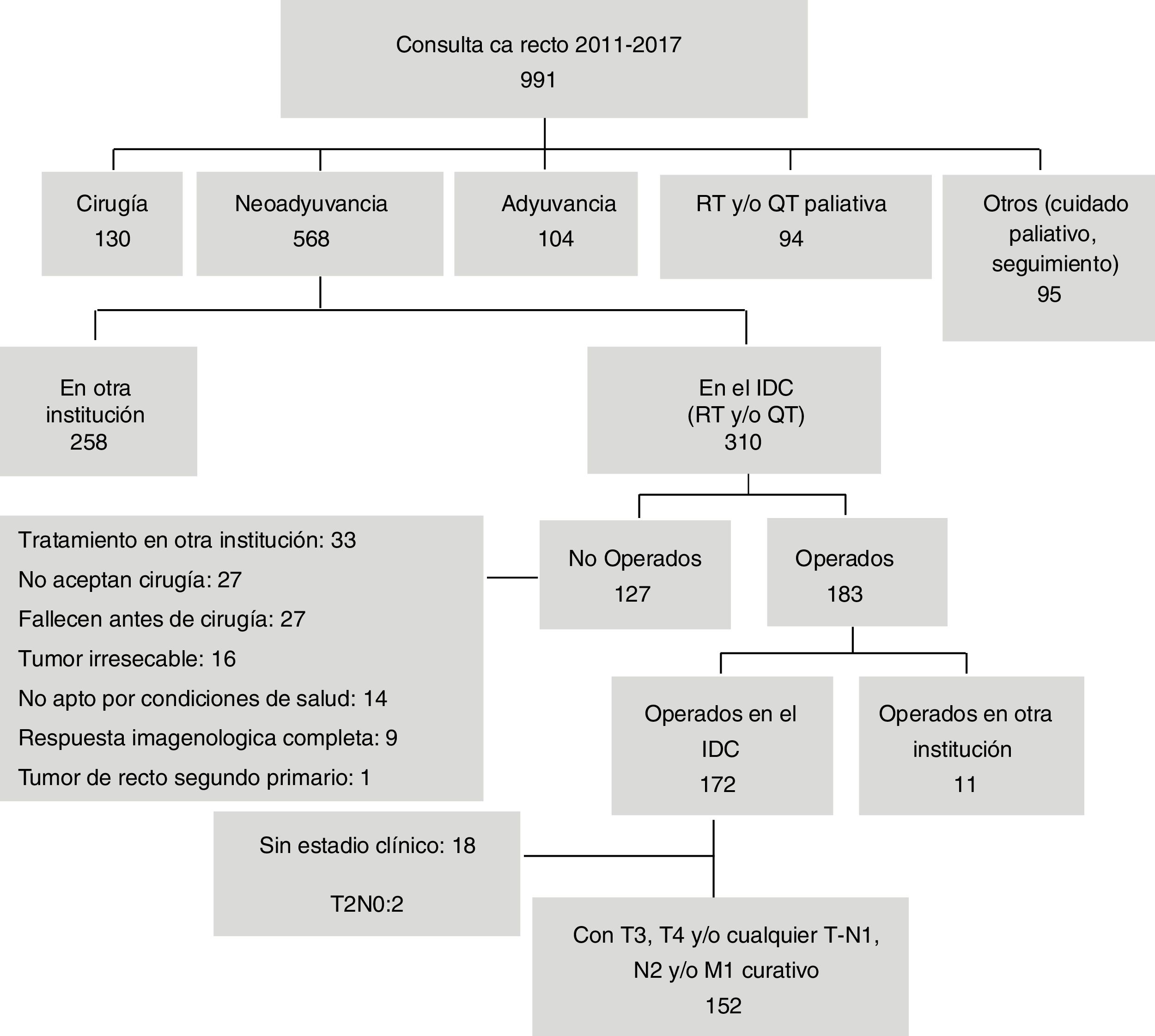
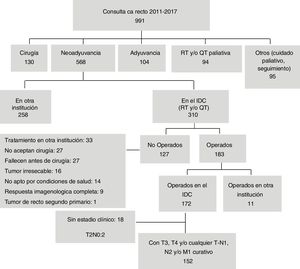
ResultadosDe los 991 pacientes con cáncer de recto atendidos en el periodo, 310 (31.3%) recibieron neoadyuvancia en el IDC, de los que se incluyeron en el estudio 152 pacientes. Las causas por las que no fueron operados 127 (40.9%) se muestran en la figura 1. Nueve pacientes con respuesta completa por imágenes se llevaron a junta multidisciplinaria a petición de ellos y se decidió no operarlos; de estos, 2 presentaron metástasis, uno falleció y 7 continúan con respuesta clínica completa.
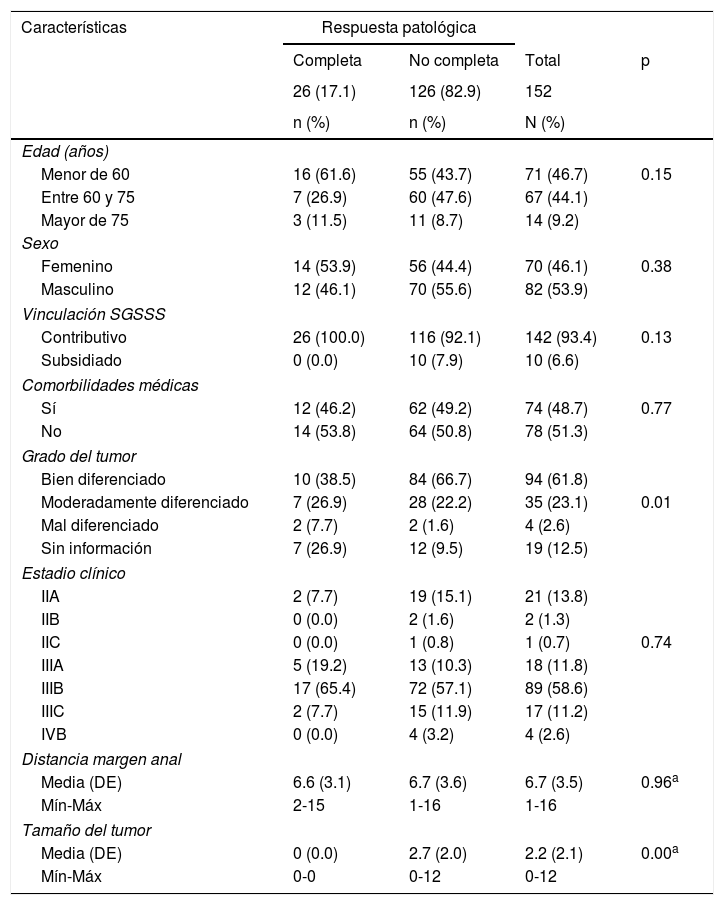
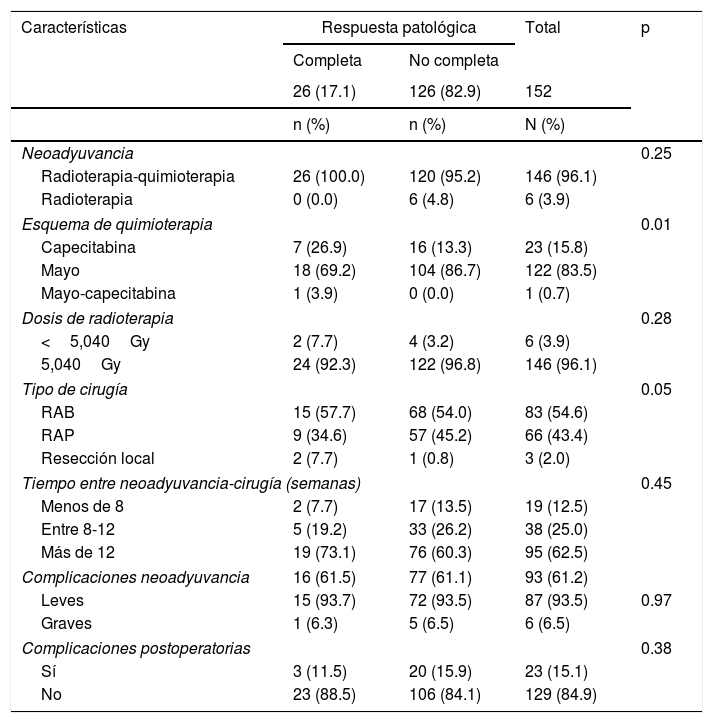
El promedio de edad fue 59 años (DE 12.8), con un rango de 18 a 84 años, con predominio del sexo masculino: 82 (53.9%). Los pacientes que reportaron comorbilidades médicas fueron 74 (48.7%). El estadio clínico fue IIIB en 89 (58.6%) pacientes. La histología de todos los tumores fue adenocarcinoma y el sitio de metástasis de los 4 pacientes estadio iv fue al hígado (2) y al pulmón (2), los cuales fueron tratados con cirugía y quimioterapia. La pRC al tratamiento neoadyuvante se logró en 26 (17%) pacientes, con un promedio de edad de 56 años (DE 13.8) y predominio del sexo femenino: 14 (53.9%) (tabla 1).
Características sociodemográficas y clínicas
| Características | Respuesta patológica | |||
|---|---|---|---|---|
| Completa | No completa | Total | p | |
| 26 (17.1) | 126 (82.9) | 152 | ||
| n (%) | n (%) | N (%) | ||
| Edad (años) | ||||
| Menor de 60 | 16 (61.6) | 55 (43.7) | 71 (46.7) | 0.15 |
| Entre 60 y 75 | 7 (26.9) | 60 (47.6) | 67 (44.1) | |
| Mayor de 75 | 3 (11.5) | 11 (8.7) | 14 (9.2) | |
| Sexo | ||||
| Femenino | 14 (53.9) | 56 (44.4) | 70 (46.1) | 0.38 |
| Masculino | 12 (46.1) | 70 (55.6) | 82 (53.9) | |
| Vinculación SGSSS | ||||
| Contributivo | 26 (100.0) | 116 (92.1) | 142 (93.4) | 0.13 |
| Subsidiado | 0 (0.0) | 10 (7.9) | 10 (6.6) | |
| Comorbilidades médicas | ||||
| Sí | 12 (46.2) | 62 (49.2) | 74 (48.7) | 0.77 |
| No | 14 (53.8) | 64 (50.8) | 78 (51.3) | |
| Grado del tumor | ||||
| Bien diferenciado | 10 (38.5) | 84 (66.7) | 94 (61.8) | |
| Moderadamente diferenciado | 7 (26.9) | 28 (22.2) | 35 (23.1) | 0.01 |
| Mal diferenciado | 2 (7.7) | 2 (1.6) | 4 (2.6) | |
| Sin información | 7 (26.9) | 12 (9.5) | 19 (12.5) | |
| Estadio clínico | ||||
| IIA | 2 (7.7) | 19 (15.1) | 21 (13.8) | |
| IIB | 0 (0.0) | 2 (1.6) | 2 (1.3) | |
| IIC | 0 (0.0) | 1 (0.8) | 1 (0.7) | 0.74 |
| IIIA | 5 (19.2) | 13 (10.3) | 18 (11.8) | |
| IIIB | 17 (65.4) | 72 (57.1) | 89 (58.6) | |
| IIIC | 2 (7.7) | 15 (11.9) | 17 (11.2) | |
| IVB | 0 (0.0) | 4 (3.2) | 4 (2.6) | |
| Distancia margen anal | ||||
| Media (DE) | 6.6 (3.1) | 6.7 (3.6) | 6.7 (3.5) | 0.96a |
| Mín-Máx | 2-15 | 1-16 | 1-16 | |
| Tamaño del tumor | ||||
| Media (DE) | 0 (0.0) | 2.7 (2.0) | 2.2 (2.1) | 0.00a |
| Mín-Máx | 0-0 | 0-12 | 0-12 | |
DE: desviación estándar; Máx: máximo; Mín: mínimo; SGSSS: Sistema General de Seguridad Social en Salud.
El protocolo de quimiorradioterapia se dio a 146 (96.1%) pacientes, con esquema Mayo en 122 (83.5%) y dosis de 50.4Gy en 146 (96.1%). A la mayoría de los pacientes se les practicó resección anterior baja de recto (83; 54.6%). El 62.5% de los pacientes se operó después de las 12 semanas debido a demoras administrativas, como autorizaciones, entrega de documentación y programación del procedimiento, tratamiento concomitante de otra enfermedad o renuencia a la cirugía, entre otros. Los pacientes con pRC recibieron en su totalidad quimiorradioterapia; el tiempo promedio entre el diagnóstico y el inicio de la neoadyuvancia fue 1.8 (RIC 1.5-3.6) meses, inferior al reportado en quienes no tuvieron respuesta completa, que fue de 2.5 (RIC 1.7-3.2) meses (tabla 2).
Tratamiento y complicaciones
| Características | Respuesta patológica | Total | p | |
|---|---|---|---|---|
| Completa | No completa | |||
| 26 (17.1) | 126 (82.9) | 152 | ||
| n (%) | n (%) | N (%) | ||
| Neoadyuvancia | 0.25 | |||
| Radioterapia-quimioterapia | 26 (100.0) | 120 (95.2) | 146 (96.1) | |
| Radioterapia | 0 (0.0) | 6 (4.8) | 6 (3.9) | |
| Esquema de quimioterapia | 0.01 | |||
| Capecitabina | 7 (26.9) | 16 (13.3) | 23 (15.8) | |
| Mayo | 18 (69.2) | 104 (86.7) | 122 (83.5) | |
| Mayo-capecitabina | 1 (3.9) | 0 (0.0) | 1 (0.7) | |
| Dosis de radioterapia | 0.28 | |||
| <5,040Gy | 2 (7.7) | 4 (3.2) | 6 (3.9) | |
| 5,040Gy | 24 (92.3) | 122 (96.8) | 146 (96.1) | |
| Tipo de cirugía | 0.05 | |||
| RAB | 15 (57.7) | 68 (54.0) | 83 (54.6) | |
| RAP | 9 (34.6) | 57 (45.2) | 66 (43.4) | |
| Resección local | 2 (7.7) | 1 (0.8) | 3 (2.0) | |
| Tiempo entre neoadyuvancia-cirugía (semanas) | 0.45 | |||
| Menos de 8 | 2 (7.7) | 17 (13.5) | 19 (12.5) | |
| Entre 8-12 | 5 (19.2) | 33 (26.2) | 38 (25.0) | |
| Más de 12 | 19 (73.1) | 76 (60.3) | 95 (62.5) | |
| Complicaciones neoadyuvancia | 16 (61.5) | 77 (61.1) | 93 (61.2) | |
| Leves | 15 (93.7) | 72 (93.5) | 87 (93.5) | 0.97 |
| Graves | 1 (6.3) | 5 (6.5) | 6 (6.5) | |
| Complicaciones postoperatorias | 0.38 | |||
| Sí | 3 (11.5) | 20 (15.9) | 23 (15.1) | |
| No | 23 (88.5) | 106 (84.1) | 129 (84.9) | |
RAB: resección anterior baja de recto; RAP: resección abdominoperineal.
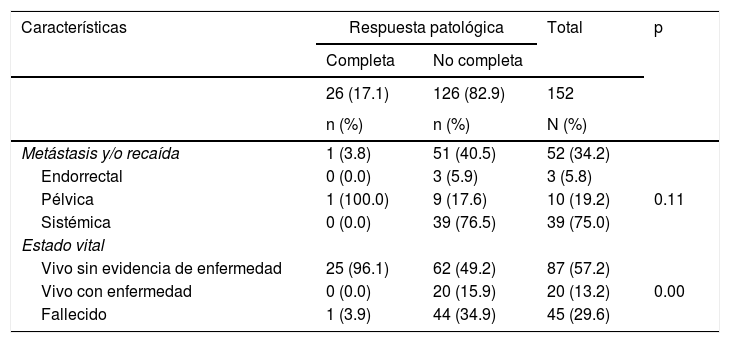
El 34.2% de los pacientes tuvieron progresión de la enfermedad, en 9 los cuales fue antes de la cirugía. Entre los pacientes con pRC solo uno tuvo recaída, con sitio pélvico. Por otra parte, el grupo sin respuesta a la neoadyuvancia tuvo como sitio de recurrencia de mayor frecuencia el sistémico (39; 76.5%). La mediana de tiempo entre la cirugía y la metástasis y/o la recaída fue 13.5 semanas (RIC 6-19)(tabla 3).
Metástasis y/o recaída y estado vital
| Características | Respuesta patológica | Total | p | |
|---|---|---|---|---|
| Completa | No completa | |||
| 26 (17.1) | 126 (82.9) | 152 | ||
| n (%) | n (%) | N (%) | ||
| Metástasis y/o recaída | 1 (3.8) | 51 (40.5) | 52 (34.2) | |
| Endorrectal | 0 (0.0) | 3 (5.9) | 3 (5.8) | |
| Pélvica | 1 (100.0) | 9 (17.6) | 10 (19.2) | 0.11 |
| Sistémica | 0 (0.0) | 39 (76.5) | 39 (75.0) | |
| Estado vital | ||||
| Vivo sin evidencia de enfermedad | 25 (96.1) | 62 (49.2) | 87 (57.2) | |
| Vivo con enfermedad | 0 (0.0) | 20 (15.9) | 20 (13.2) | 0.00 |
| Fallecido | 1 (3.9) | 44 (34.9) | 45 (29.6) | |
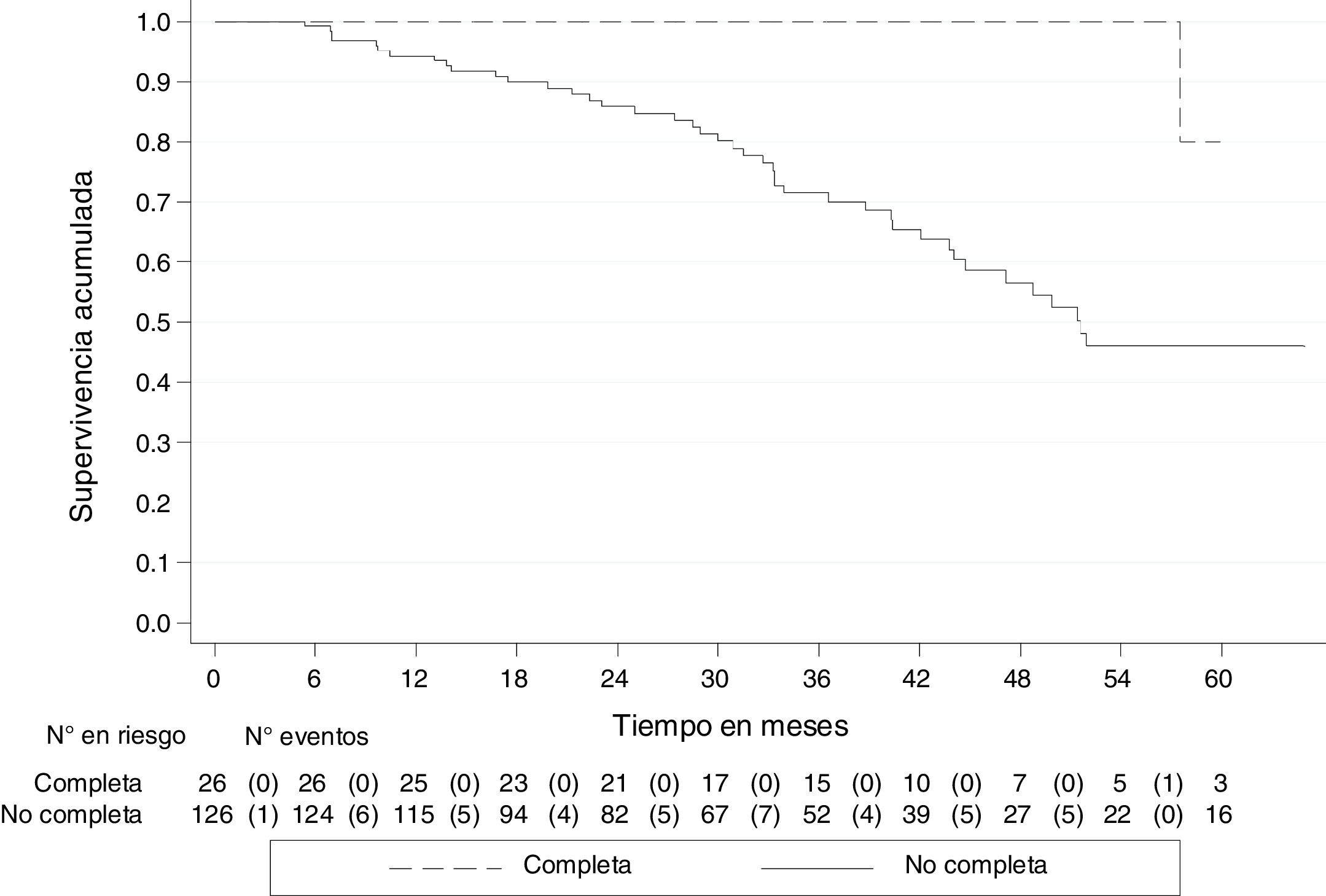
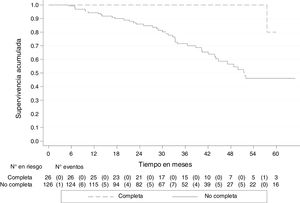
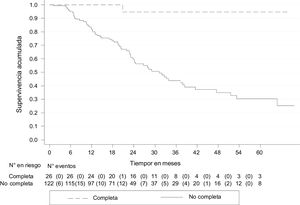
A 30 de agosto de 2018, de los 152 pacientes, 45 (29.6%) habían fallecido, uno (3.9%) con pRC y 44 (34.9%) no completa. La mediana de seguimiento de todos los pacientes fue de 33.3 meses (RIC 20-45), con una SG de 79.5% (IC 95% 70.9-85.8). La SG a 5 años fue del 51.2% (IC 95% 38.6-62.4), para quienes tuvieron pRC, del 80.0% (IC 95% 20.3-96.9) y no completa, del 46.1% (IC 95% 33.3-57.8). Las curvas de Kaplan-Meier muestran una mejor SG para quienes tuvieron pRC (p<0.05) (fig. 2).
Al comparar por estadio se encontró una SG a 5 años del 58.6% (IC 95% 33.3-77.2), el 48.3% (IC 95% 33.1-61.9) y el 50% (IC 95% 0.6-91.0) en estadios ii, iii y iv, respectivamente.
El tiempo entre la finalización de la neoadyuvancia y la realización de la cirugía no mostró diferencias en la SG a 5 años de los pacientes; quienes fueron operados antes de las 8 semanas tuvieron una SG del 51.7% (IC 95% 25.9-72.4), entre 8 y 12 semanas, del 58.2% (IC 95% 32.1-77.3), y mayor de 12 semanas, del 46.5% (IC 95% 27.4-63.5). Tampoco hubo diferencias en la SG a 5 años según el tiempo entre neoadyuvancia y cirugía, tanto en los pacientes que tuvieron pRC como en los que no la tuvieron.
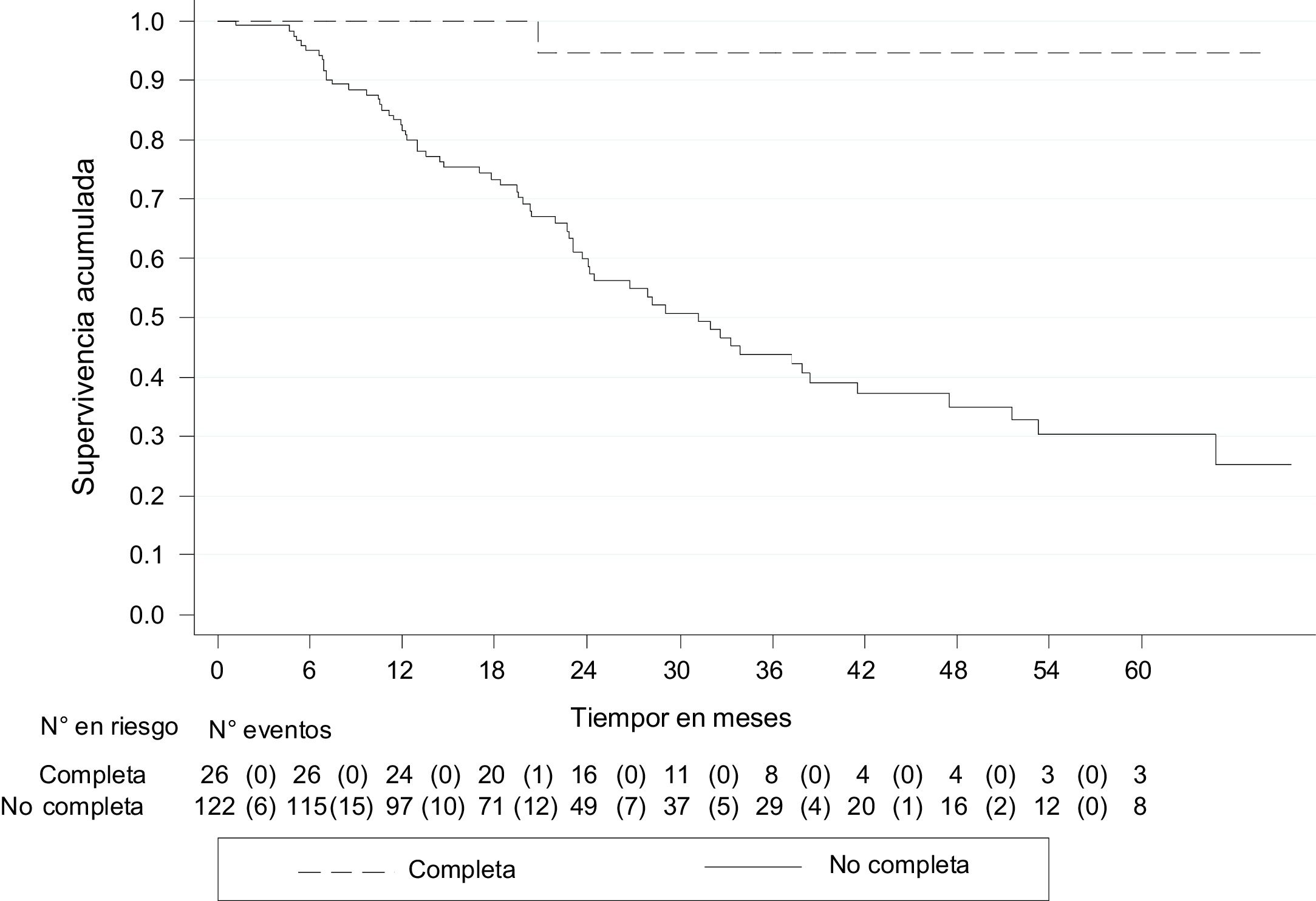
La SLE fue del 71.7% (IC 95% 63.2-78.6) y a los 5 años, del 38.4% (IC 95% 27.1-49.6). Quienes tuvieron pRC mostraron una mayor SLE con respecto de quienes tuvieron respuesta parcial o no respuesta: 94.7% (IC 95% 68.1-99.2) y 30.1% (IC 95% 19.4-41.6), respectivamente (fig. 3).
Discusión y conclusionesVarios estudios han descrito los resultados del tratamiento con quimiorradioterapia neoadyuvante en los pacientes con cáncer de recto localmente avanzado, en cuanto a la pRC, el control local, el locorregional y la supervivencia.
En el presente estudio se pudo identificar que las características sociodemográficas de la cohorte fueron muy similares a las referidas en otros estudios, con una edad media que oscila entre los 58 y los 65 años y mayor representación del género masculino10–13.
La frecuencia de pRC en nuestro estudio fue del 17%, lo que es concordante con lo publicado en otras series. En el estudio de Banurra et al.14, con un seguimiento de 13 años y una cohorte muy similar, se obtuvo una pRC del 12.5%. En el estudio de Cienfuegos et al.10, que corresponde a la cohorte más grande que se conozca con 500 pacientes seguidos, se observó una pRC del 12%. Otros estudios, como el de Codina-Cazador et al.11, Espínola et al.12 y Omejec y Potisek13, con cohortes de 162, 119 y 202 pacientes, describieron pRC en el 11.7, 15.1 y 14.8% de los pacientes, respectivamente.
Por lo general, el tratamiento del cáncer de recto en el estadio ii (T3-4, enfermedad con ganglios negativos con penetración del tumor a través de la pared muscular) o en el estadio iii (enfermedad con ganglios positivos sin metástasis a distancia) incluye el tratamiento locorregional debido al riesgo relativamente alto de reaparición. Este riesgo está asociado con la proximidad del recto a las estructuras y órganos pélvicos, la ausencia de una serosa alrededor del recto y las dificultades técnicas asociadas con la obtención de amplios márgenes quirúrgicos en la resección4. Sauer et al.15 reportaron que la incidencia de recaída local a los 10 años fue del 7.1%. Por el contrario, en otro estudio, Cienfuegos et al.10 describieron una recidiva tumoral en el 28% de los pacientes, de los cuales el 25.6% corresponde a recurrencias a distancia. En nuestra serie, de igual manera se presenta una tasa de recurrencia alta del 34%, sin embargo, en el grupo con respuesta completa solo se registró un caso con recaída pélvica. Finalmente, el resultado de un metaanálisis de 12 estudios16 publicado en el 2012 informó una tasa de recurrencia local a 5 años del 0% entre los pacientes que tenían una pRC. El promedio ponderado global de la tasa de recurrencia local entre todos los estudios fue del 7%. Aquellos con pRC tenían casi 4 veces menos probabilidades de desarrollar una recaída en comparación con quienes presentaron una respuesta parcial o no respuesta. Las recaídas a distancia o metástasis se observaron en el 8.7% de los pacientes que tuvieron una respuesta completa.
La mayoría de los autores han descrito una correlación entre el grado de respuesta y la supervivencia; el estudio retrospectivo comparativo institucional de Lee et al.17 reporta que la tasa de SG a 5 años fue del 76.2% y la de SLE a 5 años fue del 72.1%. Cienfuegos et al.10 reportaron una SG a 5 años del 76.9% y de SLE del 66%. En el metaanálisis16 se informa una tasa de SG a los 5 años para los pacientes con una pRC del 90.2%; estos pacientes tenían una ventaja de SG de 3.3 veces en comparación con quienes no tuvieron respuesta completa. La SLE a 5 años fue del 87% en aquellos con pRC. Este grupo tenía 4.3 veces más probabilidades de estar libre de enfermedad a los 5 años que los pacientes sin respuesta completa. Otros estudios11,12,14 describieron una SG a los 5 años del 100%. En nuestro estudio se encontró que la SG a los 5 años fue del 80% y la SLE, del 94.7%.
Los investigadores han intentado identificar el intervalo de tiempo óptimo entre la neoadyuvancia y la cirugía para aumentar las tasas de respuesta completa, pero los resultados han sido contradictorios e inconsistentes. Además, si los pacientes con una pRC deben someterse a quimioterapia adyuvante también sigue siendo un tema de debate.
Este estudio tiene como fortaleza que es el primero que se conoce en Colombia; sin embargo, está limitado por el número de pacientes, el poco tiempo de seguimiento y haber sido realizado en un solo centro de cáncer. Se pudo evidenciar que los pacientes son similares a los presentados en otros estudios y se concluye que los pacientes que reciben tratamiento neoadyuvante con quimiorradioterapia y obtienen una pRC tienen un excelente control oncológico a largo plazo, al disminuir las tasas de recaída locorregional y a distancia, además de mejorar la SLE y la SG.
FinanciaciónLa presente investigación no ha recibido becas específicas provenientes de agencias del sector público, sector comercial o sin ánimo de lucro.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.