La cirugía es el tratamiento principal para el cáncer gástrico. La gastrectomía radical D2 está asociada a morbilidad y mortalidad postoperatoria variable a nivel mundial. El objetivo del estudio fue identificar los factores de riesgo asociados con morbilidad y mortalidad postoperatoria de la gastrectomía radical D2 con intención curativa por cáncer gástrico.
Material y métodosEn este estudio de serie de casos retrospectivo, se revisó las historias clínicas de los pacientes con cáncer gástrico operados de gastrectomía radical D2 desde enero del 2014 a diciembre del 2018. Se realizó un análisis univariado y multivariado para identificar los factores de riesgo relacionados con la morbilidad y mortalidad postoperatoria a los 90 días.
ResultadosEn 691 pacientes, el porcentaje de morbilidad y mortalidad postoperatoria fue del 23.3% y del 3.3%, respectivamente. En el análisis multivariado, la edad≥70 años (OR=1.85, IC 95%: 1.25-2.76), ASA III-IV (OR=2.06, IC 95%: 1.28-3.34), la realización de gastrectomía total (OR=1.96, IC 95%:1.19-3.23) y pancreatoesplenectomía (OR=5.41, IC 95%:1.42-20.61) se asociaron con mayor morbilidad postoperatoria. Por otro lado, la edad ≥70 años (OR=4.92, IC 95%:1.78-13.65), un menor IMC (OR=0.81, IC 95%:0.71-0.92) e hipoalbuminemia (OR=0.91, IC 95%:0.85-0.98) se asociaron a una mayor mortalidad en la gastrectomía radical D2 distal y total.
ConclusionesLa gastrectomía radical D2 por cáncer gástrico es un tratamiento seguro con una baja morbilidad y mortalidad postoperatoria. La edad≥70 años, ASA III-IV, la gastrectomía total y la realización de pancreatoesplenectomía fueron factores asociados con una mayor tasa de complicaciones. La edad≥70 años, un menor IMC e hipoalbuminemia son predictores de mortalidad en la gastrectomía radical distal y total.
Surgery is the main treatment for gastric cancer. D2 radical gastrectomy is associated with a variable postoperative morbidity and mortality rate worldwide. The aim of the present study was to identify the risk factors associated with the postoperative morbidity and mortality of D2 radical gastrectomy, with curative intent, for gastric cancer.
Materials and methodsA retrospective case series was conducted, in which the medical records were reviewed of patients with gastric cancer that underwent D2 radical gastrectomy, within the time frame of January 2014 and December 2018. Univariate and multivariate analyses were carried out to identify the risk factors related to postoperative morbidity and mortality within 90 days.
ResultsThe percentages of postoperative morbidity and mortality in 691 patients were 23.3% and 3.3%, respectively. In the multivariate analysis, age ≥ 70 years (OR=1.85, 95% CI: 1.25-2.76), ASA III-IV (OR=2.06, 95% CI: 1.28-3.34), total gastrectomy (OR=1.96, 95% CI:1.19-3.23), and pancreatosplenectomy (OR=5.41, 95% CI: 1.42-20.61) were associated with greater postoperative morbidity, and age≥70 years (OR=4.92, 95% CI:1.78-13.65), lower BMI (OR=0.81, 95% CI: 0.71-0.92), and hypoalbuminemia (OR=0.91, 95% CI: 0.85-0.98) were associated with greater mortality in distal and total D2 radical gastrectomy.
ConclusionsD2 radical gastrectomy for gastric cancer was shown to be a safe treatment, with low postoperative morbidity and mortality rates. Age≥70 years, ASA III-IV, total gastrectomy, and pancreatosplenectomy were factors associated with a higher complication rate. Age≥70 years, lower BMI, and hypoalbuminemia were mortality predictors in distal and total radical gastrectomy.
El cáncer gástrico es el quinto cáncer más común y la tercera causa más frecuente de mortalidad por cáncer a nivel mundial1. En Perú, donde la mayoría de los pacientes son diagnosticados con enfermedad localmente avanzada, el cáncer gástrico es la principal causa de mortalidad2. La gastrectomía radical con linfadenectomía D2; la cual es el tratamiento principal para el cáncer gástrico, es un procedimiento quirúrgico complejo que requiere un equipo multidisciplinario para el manejo intraoperatorio y postoperatorio3,4. La gastrectomía radical D2 fue introducida y adoptada sistemáticamente por los cirujanos en nuestro centro médico desde los años 90s, tras recibir entrenamiento en el National Cancer Center de Japón, y el procedimiento ha sido utilizado como el estándar de oro para el cáncer gástrico desde entonces. Varios estudios epidemiológicos han reportado tasas de morbilidad y mortalidad postoperatorias variables con relación al cáncer gástrico a nivel mundial5–8. La gastrectomía radical D2 está frecuentemente asociada con complicaciones postoperatorias no quirúrgicas9,10, pero también puede involucrar complicaciones quirúrgicas, de las cuales la más común es la fuga anastomótica7. La edad, las comorbilidades del paciente, los niveles de hemoglobina, los niveles de albúmina, el tipo de gastrectomía y la resección multivisceral han sido identificados como factores de riesgo para la morbilidad y mortalidad postoperatoria tras gastrectomía11–13. El objetivo del presente estudio fue identificar los factores de riesgo asociados con morbilidad y mortalidad postoperatoria en pacientes con cáncer gástrico sometidos a gastrectomía radical D2 distal o total con intenciones curativas en el Instituto Nacional de Enfermedades Neoplásicas (INEN) en Lima, Perú.
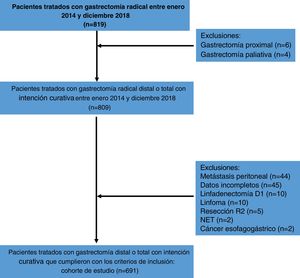
Materiales y métodosDiseño de estudio y selección de pacientesSe llevó a cabo una serie de casos retrospectiva en el Departamento de Cirugía Abdominal del INEN en Lima, Perú. Esta fue realizada por medio de la revisión de las historias clínicas de pacientes diagnosticados con cáncer gástrico y tratados con gastrectomía radical distal o total con linfadenectomía D2 con intenciones curativas, entre enero de 2014 y diciembre de 2018.
Se consideró paciente elegible a quien fuera≥18 años con diagnóstico histológico preoperatorio y postoperatorio de carcinoma gástrico, tratado con gastrectomía radical distal o total con linfadenectomía D2, con intención curativa. Otros criterios de selección incluyeron cirugía abierta o laparoscopia; cirugía electiva; estadio clínico y patológico i, ii y iii (de acuerdo con el Sistema de Estadificación de Cáncer AJCC [8.a edición]) y cirugía con resección R0.
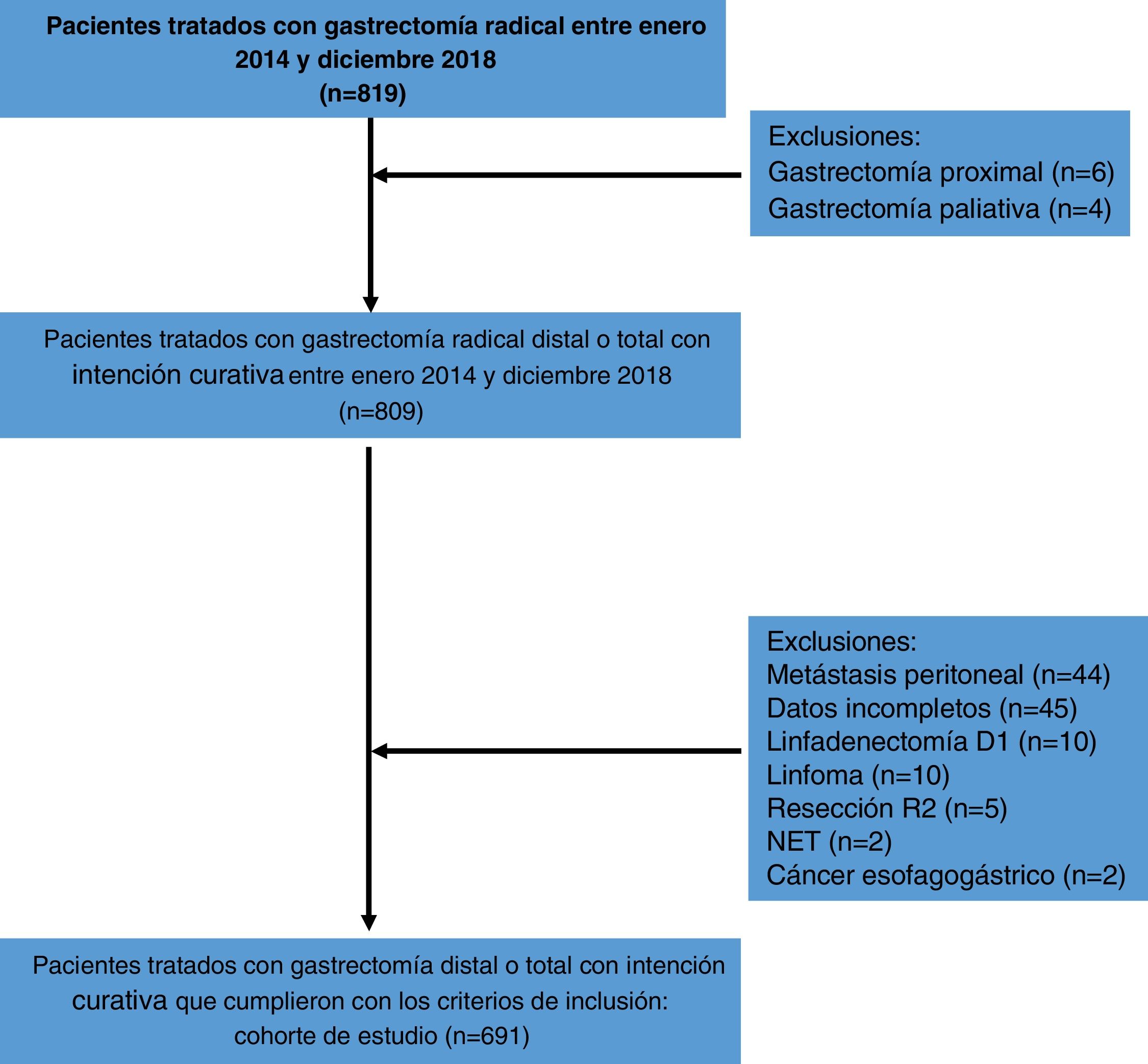
Los criterios de exclusión clave incluyeron tratamiento con gastrectomía proximal; cirugía paliativa o cirugía de urgencia; diagnóstico histológico de linfoma, GIST, NET o enfermedades diferentes a carcinoma gástrico; estadio clínico o patológico iv (de acuerdo con el Sistema de Estadificación de Cáncer AJCC [8.a edición])14; resección R1 o R2; y registros médicos con datos incompletos (pruebas de laboratorio sin reportar, comorbilidades sin reportar y reportes quirúrgicos incompletos).
Evaluación preoperatoriaLa evaluación preoperatoria consistió en endoscopia gastrointestinal superior con biopsia gástrica, hemograma, perfil de coagulación, pruebas de función renal y hepática, y evaluación psicológica, cardiológica y nutricional de rutina. El estudio de imagen preoperatorio fue una tomografía computarizada de tórax-abdomen-pelvis. Los pacientes que presentaron comorbilidades fueron evaluados por un especialista. Con base en la evaluación preoperatoria, se analizaron los factores de riesgo por edad, sexo, estado físico según el criterio de la Sociedad Americana de Anestesiólogos (ASA por sus siglas en inglés), índice de masa corporal (IMC), hemoglobina preoperatoria, albúmina preoperatoria, diagnóstico o historia de hipertensión, diabetes, enfermedad pulmonar obstructiva crónica, enfermedad coronaria e insuficiencia cardiaca. Ningún paciente recibió quimioterapia neoadyuvante, la cual solo estuvo disponible en nuestra institución hasta después del periodo del estudio.
Procedimiento quirúrgicoTodas las cirugías fueron realizadas por cirujanos de oncología abdominal del Departamento de Cirugía Abdominal. La selección de gastrectomía estuvo basada en la ubicación del tumor y los márgenes de resección fueron establecidos de acuerdo con los Lineamientos de Cáncer Gástrico Japoneses15. El alcance de la linfadenectomía en la gastrectomía radical distal incluyó los ganglios 1, 3, 4sb, 4d, 5, 6, 7, 8a, 9, 11p y 12a. Para la gastrectomía radical total, el alcance de la linfadenectomía incluyó los ganglios 1, 2, 3, 4sa, 4sb, 5, 6, 7, 8a, 9 y 10 (solo en casos que requirieron esplenectomía)15. Se realizó bursectomía en casos en los que el tumor penetró la serosa de la pared gástrica posterior4. Se llevó a cabo omenectomía rutinariamente. En casos de invasión directa se realizaron resecciones multiviscerales, y la esplenectomía se llevó a cabo solo en pacientes con tumores de curvatura mayor o ganglios positivos en el hilio esplénico. En caso de gastrectomía total (GT) se realizó una reconstrucción Y de Roux, y en caso de gastrectomía subtotal se hicieron reconstrucciones Billroth II o Y de Roux4. La anastomosis esofagoyeyunal fue realizada de acuerdo a la preferencia del cirujano. Se utilizó una grapadora circular en la mayoría de esos casos y se realizaron secciones duodenales manualmente en 28 pacientes (4.1%), con una grapadora lineal (n=663) (95.9%).
Evaluación postoperatoriaEl manejo postoperatorio fue llevado a cabo por un equipo multidisciplinario constituido por psicólogos, nutriólogos, fisioterapeutas, enfermeras y cirujanos oncólogos. Al día postoperatorio 1 todos los pacientes recibieron terapia física y respiratoria y se retiró el tubo nasogástrico. La dieta oral fue iniciada rutinariamente al día postoperatorio 3. Los pacientes fueron dados de alta cuando pudieron tolerar una dieta blanda por más de 24h y se retiraron los drenajes abdominales profilácticos al mismo tiempo. La morbilidad postoperatoria incluyó todas las complicaciones médicas y quirúrgicas que ocurrieron dentro de los primeros 90 días. Las complicaciones postoperatorias fueron registradas en una base de datos prospectiva y a continuación las historias clínicas fueron analizadas por parte de un equipo médico auditor16. La mortalidad postoperatoria incluyó a todos los pacientes que murieron debido a complicaciones médicas o quirúrgicas dentro de los primeros 90 días.
Análisis estadísticoSe llevó a cabo un análisis descriptivo de la información por medio de frecuencias, porcentajes y mediciones sumatorias (media y desviación estándar).
La asociación de variables cualitativas con morbilidad y mortalidad, respectivamente, fue evaluada con la prueba de chi cuadrado, aplicando la corrección de Yates correspondiente cuando fuera adecuada. Respecto a las variables cuantitativas, las diferencias entre grupos de pacientes, con y sin complicaciones, y entre los grupos de pacientes vivos y fallecidos, fueron evaluadas con la prueba t de Student para muestras independientes o con su prueba no paramétrica correspondiente, después de probar para normalidad.
Las variables cualitativas que asociaron significativamente con morbilidad y mortalidad fueron edad, grado ASA, IMC, nivel de albúmina, nivel de hemoglobina, localización del tumor, tipo de gastrectomía, resección multivisceral y pancreato-esplenectomía. Su influencia en morbilidad y mortalidad fueron evaluadas por medio de análisis de regresión logística binario.
Se consideró significativo un valor de p<0.05 para una asociación, diferencia o influencia.
Se utilizó el programa de estadística SPSS 22 para los análisis.
Consideraciones éticasEl presente estudio cumple con las regulaciones actuales sobre investigación bioética y fue evaluado y aprobado por el Comité de Ética del Instituto Nacional de Enfermedades Neoplásicas (INEN) en Lima, Perú.
Los autores declaran que este artículo no contiene información personal alguna que pueda identificar a los pacientes.
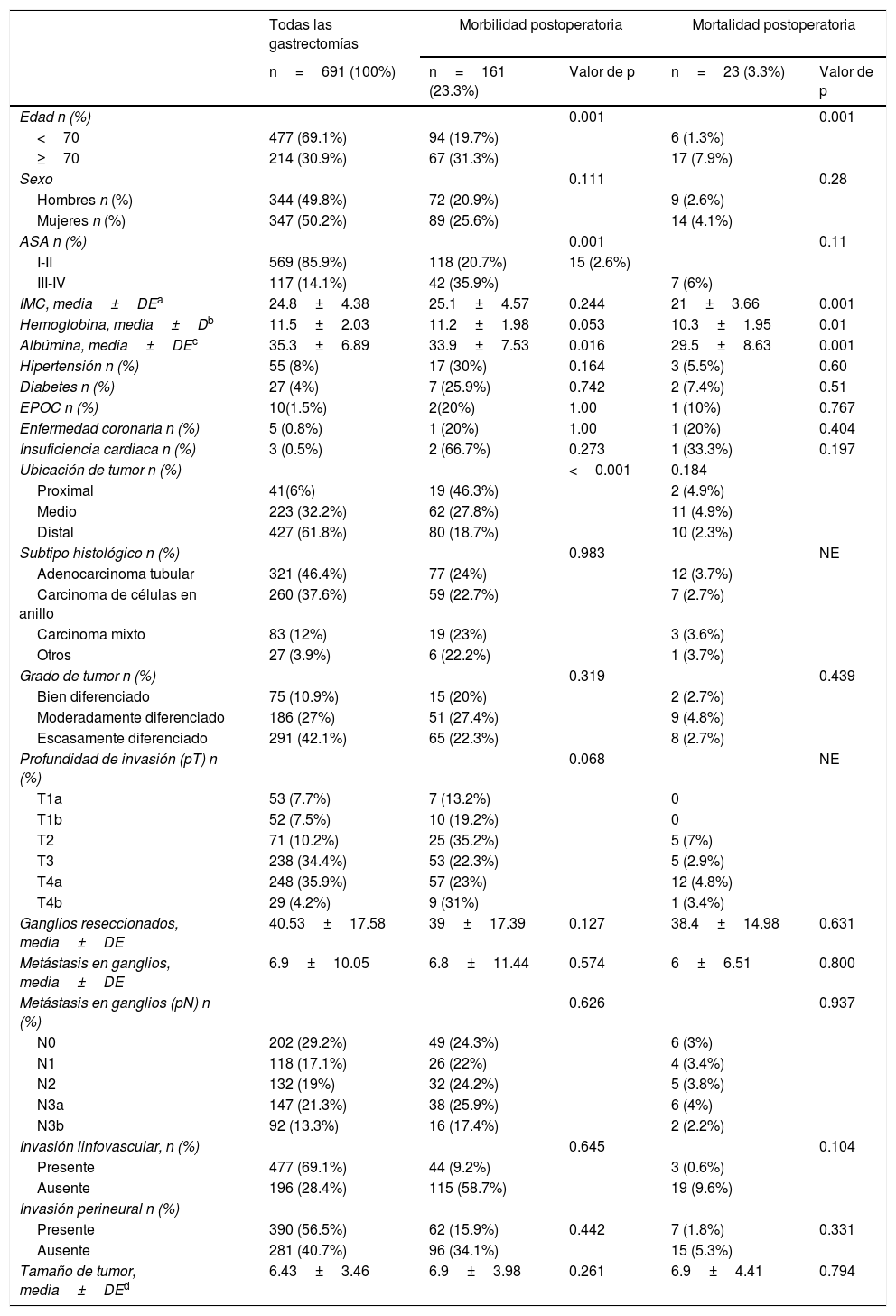
ResultadosUn total de 819 pacientes fueron tratados con gastrectomía radical D2 entre enero 2014 y diciembre 2018, y de ellos 691 cumplieron con los criterios de inclusión. Las causas de exclusión se muestran en la figura 1. Cuatrocientos setenta y siete pacientes (69.1%) tenían menos de 70 años, y 214 pacientes (30.9%) tenían≥70 años. Trescientos cuarenta y siete pacientes (50.2%) eran mujeres y 344 (49.8%) hombres. La hemoglobina media fue 11.5g/dl y la albúmina media fue 35.3g/l. La mayoría de los pacientes (n=569, 85.9%) fueron clasificados como ASA I-II y una minoría (n=117, 14.1%) como ASA III-IV. La media de IMC fue 24.8kg/m2. En la evaluación preoperatoria se observó que 55 pacientes (8%) tuvieron diagnóstico de hipertensión, 27 (4%) diabetes mellitus, 10 (1.5%) enfermedad pulmonar obstructiva crónica, 5 (0.8%) enfermedad coronaria y 3 (0.5%) insuficiencia cardiaca. Los tumores distales fueron los más frecuentes (n=427, 61.8%) y el adenocarcinoma tubular fue el subtipo histológico más común (n=321, 46.4%). La media de ganglios resecados fue 40.53 y la media de metástasis ganglionar fue 6.9. Las características clinicopatológicas de los pacientes se resumen en la tabla 1.
Características clinicopatológicas de pacientes que se sometieron a gastrectomía D2 distal y total
| Todas las gastrectomías | Morbilidad postoperatoria | Mortalidad postoperatoria | |||
|---|---|---|---|---|---|
| n=691 (100%) | n=161 (23.3%) | Valor de p | n=23 (3.3%) | Valor de p | |
| Edad n (%) | 0.001 | 0.001 | |||
| <70 | 477 (69.1%) | 94 (19.7%) | 6 (1.3%) | ||
| ≥70 | 214 (30.9%) | 67 (31.3%) | 17 (7.9%) | ||
| Sexo | 0.111 | 0.28 | |||
| Hombres n (%) | 344 (49.8%) | 72 (20.9%) | 9 (2.6%) | ||
| Mujeres n (%) | 347 (50.2%) | 89 (25.6%) | 14 (4.1%) | ||
| ASA n (%) | 0.001 | 0.11 | |||
| I-II | 569 (85.9%) | 118 (20.7%) | 15 (2.6%) | ||
| III-IV | 117 (14.1%) | 42 (35.9%) | 7 (6%) | ||
| IMC, media±DEa | 24.8±4.38 | 25.1±4.57 | 0.244 | 21±3.66 | 0.001 |
| Hemoglobina, media±Db | 11.5±2.03 | 11.2±1.98 | 0.053 | 10.3±1.95 | 0.01 |
| Albúmina, media±DEc | 35.3±6.89 | 33.9±7.53 | 0.016 | 29.5±8.63 | 0.001 |
| Hipertensión n (%) | 55 (8%) | 17 (30%) | 0.164 | 3 (5.5%) | 0.60 |
| Diabetes n (%) | 27 (4%) | 7 (25.9%) | 0.742 | 2 (7.4%) | 0.51 |
| EPOC n (%) | 10(1.5%) | 2(20%) | 1.00 | 1 (10%) | 0.767 |
| Enfermedad coronaria n (%) | 5 (0.8%) | 1 (20%) | 1.00 | 1 (20%) | 0.404 |
| Insuficiencia cardiaca n (%) | 3 (0.5%) | 2 (66.7%) | 0.273 | 1 (33.3%) | 0.197 |
| Ubicación de tumor n (%) | <0.001 | 0.184 | |||
| Proximal | 41(6%) | 19 (46.3%) | 2 (4.9%) | ||
| Medio | 223 (32.2%) | 62 (27.8%) | 11 (4.9%) | ||
| Distal | 427 (61.8%) | 80 (18.7%) | 10 (2.3%) | ||
| Subtipo histológico n (%) | 0.983 | NE | |||
| Adenocarcinoma tubular | 321 (46.4%) | 77 (24%) | 12 (3.7%) | ||
| Carcinoma de células en anillo | 260 (37.6%) | 59 (22.7%) | 7 (2.7%) | ||
| Carcinoma mixto | 83 (12%) | 19 (23%) | 3 (3.6%) | ||
| Otros | 27 (3.9%) | 6 (22.2%) | 1 (3.7%) | ||
| Grado de tumor n (%) | 0.319 | 0.439 | |||
| Bien diferenciado | 75 (10.9%) | 15 (20%) | 2 (2.7%) | ||
| Moderadamente diferenciado | 186 (27%) | 51 (27.4%) | 9 (4.8%) | ||
| Escasamente diferenciado | 291 (42.1%) | 65 (22.3%) | 8 (2.7%) | ||
| Profundidad de invasión (pT) n (%) | 0.068 | NE | |||
| T1a | 53 (7.7%) | 7 (13.2%) | 0 | ||
| T1b | 52 (7.5%) | 10 (19.2%) | 0 | ||
| T2 | 71 (10.2%) | 25 (35.2%) | 5 (7%) | ||
| T3 | 238 (34.4%) | 53 (22.3%) | 5 (2.9%) | ||
| T4a | 248 (35.9%) | 57 (23%) | 12 (4.8%) | ||
| T4b | 29 (4.2%) | 9 (31%) | 1 (3.4%) | ||
| Ganglios reseccionados, media±DE | 40.53±17.58 | 39±17.39 | 0.127 | 38.4±14.98 | 0.631 |
| Metástasis en ganglios, media±DE | 6.9±10.05 | 6.8±11.44 | 0.574 | 6±6.51 | 0.800 |
| Metástasis en ganglios (pN) n (%) | 0.626 | 0.937 | |||
| N0 | 202 (29.2%) | 49 (24.3%) | 6 (3%) | ||
| N1 | 118 (17.1%) | 26 (22%) | 4 (3.4%) | ||
| N2 | 132 (19%) | 32 (24.2%) | 5 (3.8%) | ||
| N3a | 147 (21.3%) | 38 (25.9%) | 6 (4%) | ||
| N3b | 92 (13.3%) | 16 (17.4%) | 2 (2.2%) | ||
| Invasión linfovascular, n (%) | 0.645 | 0.104 | |||
| Presente | 477 (69.1%) | 44 (9.2%) | 3 (0.6%) | ||
| Ausente | 196 (28.4%) | 115 (58.7%) | 19 (9.6%) | ||
| Invasión perineural n (%) | |||||
| Presente | 390 (56.5%) | 62 (15.9%) | 0.442 | 7 (1.8%) | 0.331 |
| Ausente | 281 (40.7%) | 96 (34.1%) | 15 (5.3%) | ||
| Tamaño de tumor, media±DEd | 6.43±3.46 | 6.9±3.98 | 0.261 | 6.9±4.41 | 0.794 |
ASA: Sociedad Americana de Anestesiólogos (ASA por sus siglas en inglés); IMC: índice de masa corporal; EPOC: enfermedad pulmonar obstructiva crónica; n: número de pacientes.
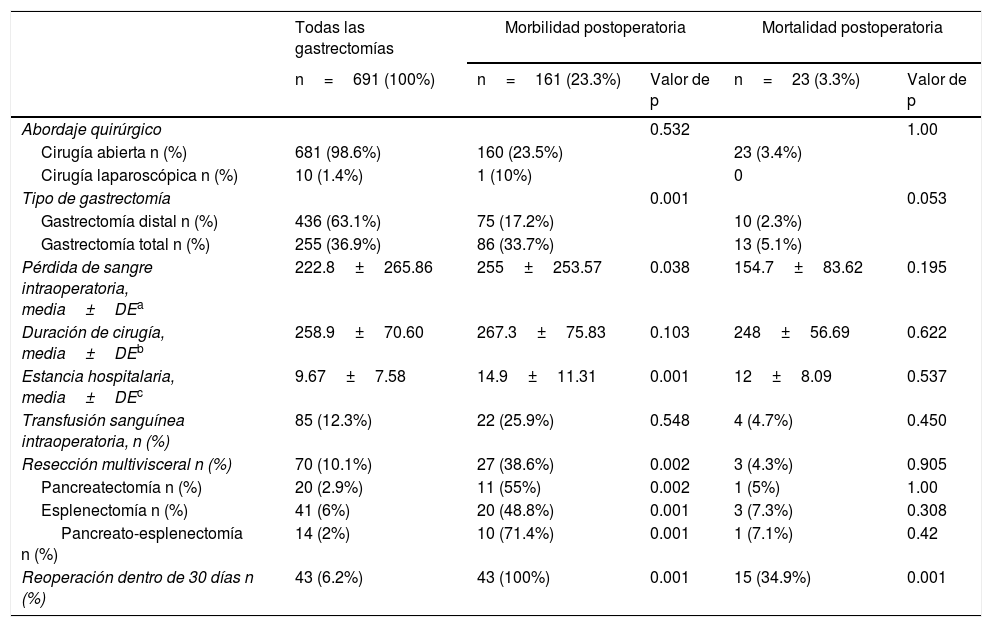
En 681 pacientes (98.6%) se realizó gastrectomía abierta y en 10 pacientes (1.4%) cirugía laparoscópica. En 436 (63.1%) pacientes se realizó gastrectomía distal (GD) y en 255 (36.9%) pacientes GT. La pérdida sanguínea intraoperatoria media fue 222.8ml y la duración media de la cirugía fue 258.9min. Ochenta y cinco pacientes (12.3%) recibieron transfusión sanguínea intraoperatoria. La estancia hospitalaria media fue 9.67 días. Setenta pacientes (10.1%) tuvieron resección multivisceral, mientras que la pancreatectomía fue realizada en 20 pacientes (2.9%) y esplenectomía en 41 (6%). En 14 pacientes (2%) se realizó pancreato-esplenectomía. Las características quirúrgicas están resumidas en la tabla 2.
Características quirúrgicas de los pacientes que se sometieron a gastrectomía distal y total D2
| Todas las gastrectomías | Morbilidad postoperatoria | Mortalidad postoperatoria | |||
|---|---|---|---|---|---|
| n=691 (100%) | n=161 (23.3%) | Valor de p | n=23 (3.3%) | Valor de p | |
| Abordaje quirúrgico | 0.532 | 1.00 | |||
| Cirugía abierta n (%) | 681 (98.6%) | 160 (23.5%) | 23 (3.4%) | ||
| Cirugía laparoscópica n (%) | 10 (1.4%) | 1 (10%) | 0 | ||
| Tipo de gastrectomía | 0.001 | 0.053 | |||
| Gastrectomía distal n (%) | 436 (63.1%) | 75 (17.2%) | 10 (2.3%) | ||
| Gastrectomía total n (%) | 255 (36.9%) | 86 (33.7%) | 13 (5.1%) | ||
| Pérdida de sangre intraoperatoria, media±DEa | 222.8±265.86 | 255±253.57 | 0.038 | 154.7±83.62 | 0.195 |
| Duración de cirugía, media±DEb | 258.9±70.60 | 267.3±75.83 | 0.103 | 248±56.69 | 0.622 |
| Estancia hospitalaria, media±DEc | 9.67±7.58 | 14.9±11.31 | 0.001 | 12±8.09 | 0.537 |
| Transfusión sanguínea intraoperatoria, n (%) | 85 (12.3%) | 22 (25.9%) | 0.548 | 4 (4.7%) | 0.450 |
| Resección multivisceral n (%) | 70 (10.1%) | 27 (38.6%) | 0.002 | 3 (4.3%) | 0.905 |
| Pancreatectomía n (%) | 20 (2.9%) | 11 (55%) | 0.002 | 1 (5%) | 1.00 |
| Esplenectomía n (%) | 41 (6%) | 20 (48.8%) | 0.001 | 3 (7.3%) | 0.308 |
| Pancreato-esplenectomía n (%) | 14 (2%) | 10 (71.4%) | 0.001 | 1 (7.1%) | 0.42 |
| Reoperación dentro de 30 días n (%) | 43 (6.2%) | 43 (100%) | 0.001 | 15 (34.9%) | 0.001 |
n: número de pacientes.
La morbilidad postoperatoria general fue del 23.3%. Setenta y cinco pacientes (17.2%) que se sometieron a GD y 86 (33.7%) que se sometieron a GT tuvieron complicaciones postoperatorias dentro de los primeros 90 días (p<0.001) (tabla 3).
Tasas globales de morbilidad y mortalidad
| Todas las gastrectomías | Gastrectomía distal | Gastrectomía total | Valor p | |
|---|---|---|---|---|
| N= 691 | N= 436 (63.1%) | N= 255 (36.9%) | ||
| Morbilidad global postoperatoriaa | 161 (23.3%) | 75 (17.2%) | 86 (33.7%) | <0.001 |
| Mortalidad dentro de 90 días | 23 (3.3%) | 10 (2.3%) | 13 (5.1%) | 0.04 |
La complicación más frecuente fue neumonía intrahospitalaria en ambos grupos, con 29 casos (6.6%) en el grupo GD y 33 (12.9%) en el grupo GT. Las complicaciones quirúrgicas postoperatorias más comunes en el grupo GD fueron fístula pancreática (2.3%), hemorragia abdominal (1.6%), y obstrucción intestinal (1.3%). En 2 pacientes (0.5%) se reportó dehiscencia de anastomosis gastroyeyunal. En el grupo GT, las complicaciones quirúrgicas postoperatorias más comunes fueron fístula pancreática (10.2%), hemorragia abdominal (4%) y dehiscencia de anastomosis esofagoyeyunal (3.5%).
La tasa de mortalidad general a 90 días fue del 3.3%, con 10 pacientes (2.3%) en el grupo GD y 13 pacientes (5.1%) en el grupo GT (p=0.04). En el grupo GD, la mortalidad a 90 días postoperatoria estuvo asociada con trombosis venosa mesentérica (3 pacientes), peritonitis (2 pacientes), fuga duodenal, hemorragia abdominal, perforación gástrica, neumonía intrahospitalaria y embolia pulmonar (un paciente cada una).
La causa más frecuente de mortalidad postoperatoria en el grupo GT fue la dehiscencia de anastomosis esofagoyeyunal (5 pacientes), seguida de trombosis venosa mesentérica (2 pacientes), hemorragia abdominal (2 pacientes) neumonía intrahospitalaria (2 pacientes), perforación intestinal (un paciente) y embolia pulmonar (un paciente).
En el análisis univariado, encontramos asociación significativa entre la presencia de complicaciones en GD y total D2 con edad≥70 años (p=0.001), clasificación ASA III-IV (p=0.001), hipoalbuminemia (p=0.004), tumores medios (p=0.008), tumores proximales (p=0.001), GT (p=0.001), resección multivisceral (p=0.002) y pancreato-esplenectomía (p=0.001) (tabla 4).
Análisis univariado y multivariado de los factores de riesgo asociados con morbilidad en gastrectomía distal y total
| Análisis univariado | Análisis multivariado | |||||
|---|---|---|---|---|---|---|
| OR | IC 95% | Valor de p | OR | IC 95% | Valor de p | |
| Edad (años) | ||||||
| <70 | Referencia | 1 | ||||
| ≥70 | 1.86 | (1.29-2.68) | 0.001 | 1.85 | (1.25-2.76) | 0.002 |
| ASA | ||||||
| I-II | Referencia | 1 | ||||
| III-IV | 2.14 | (1.39-3.29) | 0.001 | 2.06 | (1.28-3.34) | 0.003 |
| Albúmina g/l | 0.96 | (0.94-0.99) | 0.004 | 0.99 | (0.96-1.01) | 0.289 |
| Ubicación de tumor | ||||||
| Distal | Referencia | 1 | ||||
| Medio | 1.67 | (1.14-2.44) | 0.008 | 1.17 | (0.72-1.89) | 0.537 |
| Proximal | 3.75 | (1.94-7.25) | 0.001 | 2.08 | (0.93-4.66) | 0.075 |
| Tipo de gastrectomía | ||||||
| Gastrectomía distal | Referencia | 1 | ||||
| Gastrectomía total | 2.45 | (1.71-3.51) | 0.001 | 1.96 | (1.19-3.23) | 0.008 |
| Resección multivisceral | 2.28 | (1.36-3.83) | 0.002 | 1.03 | (0.53-1.98) | 0.938 |
| Pancreato-esplenectomía | 8.71 | (2.69-28.16) | 0.001 | 5.41 | (1.42-20.61) | 0.013 |
IC: intervalo de confianza; OR: razón de momios.
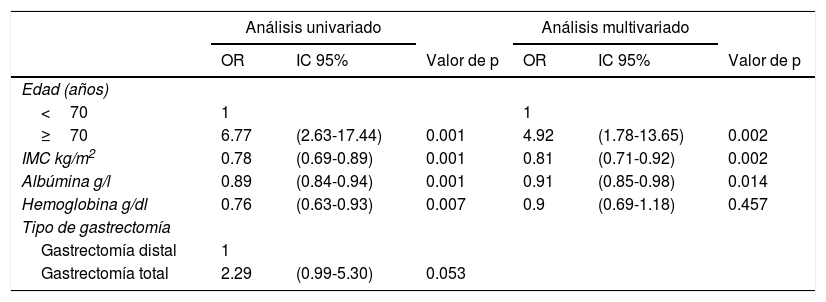
En el análisis univariado, encontramos asociación significativa con mortalidad en GD y total D2 con edad≥70 años (p=0.001), IMC bajo (p=0.001), hipoalbuminemia (p=0.001) y menor valor de hemoglobina (p=0.007) (tabla 5).
Análisis univariado y multivariado de los factores de riesgo asociados con mortalidad en gastrectomía distal y total
| Análisis univariado | Análisis multivariado | |||||
|---|---|---|---|---|---|---|
| OR | IC 95% | Valor de p | OR | IC 95% | Valor de p | |
| Edad (años) | ||||||
| <70 | 1 | 1 | ||||
| ≥70 | 6.77 | (2.63-17.44) | 0.001 | 4.92 | (1.78-13.65) | 0.002 |
| IMC kg/m2 | 0.78 | (0.69-0.89) | 0.001 | 0.81 | (0.71-0.92) | 0.002 |
| Albúmina g/l | 0.89 | (0.84-0.94) | 0.001 | 0.91 | (0.85-0.98) | 0.014 |
| Hemoglobina g/dl | 0.76 | (0.63-0.93) | 0.007 | 0.9 | (0.69-1.18) | 0.457 |
| Tipo de gastrectomía | ||||||
| Gastrectomía distal | 1 | |||||
| Gastrectomía total | 2.29 | (0.99-5.30) | 0.053 | |||
IC: intervalo de confianza; OR: razón de momios.
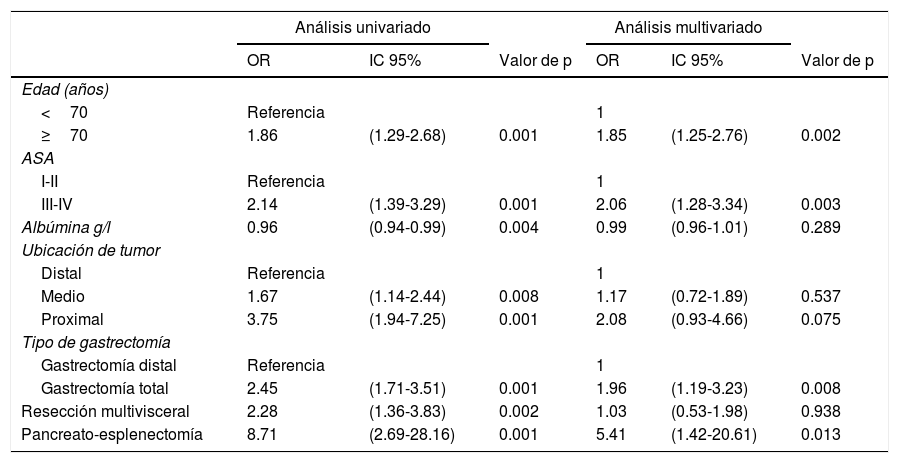
En el análisis multivariado, se identificaron como predictores de morbilidad postoperatoria en gastrectomía radical D2 la edad≥70 años (OR=1.85, IC 95%: 1.25-2.76), clasificación ASA III-IV (OR=2.06, IC 95%: 1.28-3.34), GT (OR=1.96, IC 95%: 1.19-3.23) y pancreato-esplenectomía (OR=5.41, IC 95%: 1.42-20.61) (tabla 4).
En el análisis multivariado, se observó un mayor riesgo de mortalidad postoperatoria en pacientes≥70 años (OR=4.92, IC 95%: 1.78-13.65), en comparación con pacientes<70 años. Además, existió un riesgo reducido de mortalidad postoperatoria en pacientes con IMC más alto (OR=0.81, IC 95%: 0.71-0.92) y nivel elevado de albúmina (OR=0.91, IC 95%: 0.85-0.98) (tabla 5).
DiscusiónPublicaciones previas reportan morbilidades y mortalidades postoperatorias variables en gastrectomías por cáncer gástrico en diferentes regiones del mundo. En Asia, la morbilidad reportada fue entre 15.2% y 16.4%5,7, y la mortalidad fue menor al 1%17. En países occidentales, la morbilidad fue significativamente más alta y varió entre 23.6% y 43%.9–18, La mortalidad postoperatoria también fue mayor en países occidentales con un rango entre 6% y 8%19,20.
En general, la decisión de realizar GD o GT se basa en la ubicación del tumor y la posibilidad de asegurar márgenes libres de resección15,21. En el presente estudio, la mayoría de los pacientes tenían tumores que infiltraban la subserosa (T3) y serosa (T4a) (70.3%), con una mayor presencia de metástasis ganglionar (pN3). Estos resultados son comparables con hallazgos de otros estudios sudamericanos11. En nuestro centro médico, la mayoría de los pacientes fueron diagnosticados con estadios localmente avanzados, que consistían en tumores grandes que requerían cirugía de mayor extensión para asegurar márgenes libres, y en casos selectos, resección multivisceral, lo cual posiblemente explica nuestros resultados2.
En estudios previos realizados en Sudamérica se ha reportado una morbilidad entre 31.1% y 42.9%11,22. De manera similar, en un estudio peruano que incluyó a 899 pacientes, los autores describieron complicaciones postoperatorias en 109 pacientes, con una morbilidad general de 12.1%, entre 1990 y 20002. Nuestro hallazgo de morbilidad del 23.3% es comparable con estos resultados previamente reportados.
En el presente estudio, el grupo GT presentó morbilidad general y mortalidad mayores, en comparación con el grupo GD. Este resultado concuerda con los resultados de estudios previos20,23. En el análisis multivariado, la GT estuvo asociada significativamente con una mayor morbilidad (OR=1.96, IC 95%: 1.19-3.23). En el análisis multivariado, la GT no estuvo asociada significativamente con un riesgo incrementado de mortalidad.
Revisiones sistemáticas y metaanálisis recientes reportan una morbilidad postoperatoria mayor en GT en comparación con GD (21.9 vs. 15.1%)24. Sin embargo, en un meta análisis de Kong et al. no se encontró diferencia significativa en términos de morbilidad entre los 2 procedimientos. Es importante mencionar que en dicho metaanálisis, los pacientes en malas condiciones fueron excluidos de la aleatorización25.
De acuerdo con nuestros resultados, la complicación más frecuente fue la neumonía adquirida en hospital. Varios estudios han reportado resultados similares, con una incidencia de hasta 16.2%18,26,27. En nuestro estudio, la principal complicación quirúrgica en ambos grupos fue la fístula pancreática (2.3% en el grupo GD y 10.2% en el grupo GT). Es importante mencionar que la fístula pancreática más frecuente en GD fue grado B y solo requirió tratamiento médico. En el grupo GT, las fugas bioquímicas fueron el tipo más frecuente de fístula pancreática. Sin embargo, las publicaciones recientes ya no consideran a la fuga bioquímica una verdadera complicación28. Incluso sin considerar las fugas bioquímicas, la fístula pancreática fue la complicación más común en ambos grupos. La hemorragia abdominal fue la segunda complicación quirúrgica más frecuente en ambos grupos, lo cual resultó en la muerte de un paciente en el grupo GD y de 2 pacientes en el grupo GT.
Varios estudios retrospectivos de cohorte han reportado que la dehiscencia de anastomosis esofagoyeyunal es la complicación quirúrgica más común en GT18. En revisiones sistemáticas y metaanálisis también se han reportado tasas altas de dehiscencia anastomótica con GT24,25. En el presente estudio, la dehiscencia de anastomosis esofagoyeyunal fue la tercera complicación postoperatoria más frecuente en GT (3.5%) y causó la muerte de más del 50% de esos pacientes.
La mortalidad postoperatoria general a 90 días en nuestro estudio fue del 3.3%. En estudios retrospectivos de Sudamérica se ha descrito una mortalidad postoperatoria que va del 2.1% al 4.7%, en gastrectomías distales y totales11,22. Ruiz et al. reportaron que la tasa de mortalidad postoperatoria disminuyó del 4.4% al 2.2% en Perú entre 1950 y 20002.
La mortalidad general en el presente estudio fue más alta en el grupo GT que en el grupo GD (p=0.04). Un resultado similar fue reportado en un metaanálisis que comparaba GD vs. GT24. La causa principal de mortalidad en el grupo GD fue la trombosis venosa mesentérica. La trombosis venosa mesentérica ya había sido reportada como complicación postoperatoria tras gastrectomía con una incidencia menor a 1%29.
La dehiscencia de anastomosis esofagoyeyunal fue una de las causas principales de mortalidad en el grupo GT en nuestro análisis, y Gersten et al. reportaron que la dehiscencia anastomótica tuvo el mayor impacto general sobre la mortalidad postoperatoria (PAF 29.2%)26.
En el análisis multivariado de nuestro estudio identificamos a la edad≥70 años, la ASA III-IV, la GT y la pancreato-esplenectomía como factores asociados con el incremento de complicaciones postoperatorias en GD y GT. Varios estudios han reportado una morbilidad más elevada en pacientes mayores, en comparación con pacientes más jóvenes, pero se utilizaron diferentes valores de punto de corte para la edad30. Robb et al. reportaron que la edad≥60 años era un factor predictivo para complicaciones postoperatorias, en el análisis multivariado (p=0.001)31 y Nelen et al. encontraron que pacientes mayores de 70 años tenían morbilidad más elevada32.
La clasificación ASA fue reportada en múltiples estudios como un factor predictivo de complicaciones postoperatorias. En un análisis multivariado, Martin et al. encontraron que la ASA IV y V estaban relacionadas con un incremento en complicaciones postoperatorias13.
Otros estudios indican que la clasificación ASA III podría ser un factor de riesgo para complicaciones, determinado por medio de análisis multivariados31,32. Varios estudios encontraron que la resección multivisceral en cáncer gástrico está asociada con una mayor morbilidad postoperatoria12,17. En un estudio retrospectivo, Norero et al. reportaron que un mayor número de órganos reseccionados era un factor predictivo de mortalidad postoperatoria11.
En el presente estudio, la resección multivisceral estuvo relacionada significativamente con una morbilidad incrementada en el análisis univariado (OR=2.28, IC 95%: 1.36-3.83), pero no se encontró asociación en el análisis multivariado. La pancreato-esplenectomía también estuvo asociada significativamente con un mayor riesgo de morbilidad postoperatoria, en los análisis univariado y multivariado (OR=5.41, IC 95%: 1.42-20.61).
De manera similar, la edad≥70 años, el IMC más bajo, y la hipoalbuminemia estuvieron asociados con un incremento en mortalidad en el análisis multivariado. Papenfuss et al. reportaron que la edad y la pérdida de peso fueron factores asociados con mortalidad en el análisis multivariado9. Martin et al. describieron resultados similares a los nuestros, pero en su estudio, la transfusión sanguínea también fue un factor de riesgo para mortalidad13.
En nuestra región, Norero et al. reportaron que el ASA III y la resección multivisceral fueron factores asociados con mortalidad. Además, Ruiz et al. reportaron que la albúmina<3.5g/l, la transfusión sanguínea y la tasa de reoperación fueron factores relacionados con mortalidad postoperatoria incrementada en gastrectomías distales y totales2.
En el presente artículo presentamos una de las series de casos más grandes en Sudamérica que describe gastrectomías radicales D2 con intención curativa por cáncer gástrico. Como se mencionó anteriormente, la linfadenectomía D2 fue introducida en nuestra institución por cirujanos capacitados en Japón en los 90 y se ha mantenido desde entonces como tratamiento estándar. Nuestro análisis de morbilidad y mortalidad a 90 días proporcionó datos más precisos respecto a complicaciones y muerte postoperatoria, en comparación con la tasa de 30 días33,34. En contraste con otros estudios a nivel mundial, nuestras tasas de morbilidad y mortalidad fueron adecuadas e incluso más bajas.
Los factores de riesgo asociados con una mayor tasa de complicaciones postoperatorias y mortalidad fueron analizadas por separado, lo cual nos permitió identificar con mayor precisión los factores que podrían estar relacionados con una mayor probabilidad de muerte postoperatoria.
Una de las limitaciones de nuestro estudio fue su diseño retrospectivo, a pesar del uso prospectivo de una base de datos de complicaciones. Además, los grados ASA fueron determinados por diferentes anestesiólogos, y por lo tanto, existe subjetividad en ellos. Elegimos dicha clasificación porque ha sido ampliamente utilizada en estudios previos, pero incluso con dicha limitación, ASA III y ASA IV estuvieron asociadas con una mayor morbilidad postoperatoria en el análisis multivariado.
En conclusión, la gastrectomía radical D2 por cáncer gástrico fue un procedimiento seguro, con morbilidad y mortalidad bajas. La edad≥70 años, el ASA III-IV, la GT, y la pancreato-esplenectomía fueron factores asociados con una mayor tasa de complicaciones. La edad≥70 años, el IMC más bajo y la hipoalbuminemia fueron predictores de mortalidad en gastrectomía radical total y distal.
Conflicto de interesesLos autores declaran no tener conflicto de intereses.
Los autores desean expresar su agradecimiento a todos los miembros del Departamento de Cirugía Abdominal en el Instituto Nacional de Enfermedades Neoplásicas (INEN) en Lima, Perú.