La enfermedad celiaca (EC), esprúe celíaco o enteropatía sensible al gluten, es una enfermedad autoinmune generalizada que se caracteriza por inflamación crónica y atrofia de la mucosa del intestino delgado, causada por la exposición al gluten de la dieta que afecta a individuos genéticamente predispuestos. En México se estima que al menos 800,000 personas podrían padecerla, por lo que la Asociación Mexicana de Gastroenterología convocó a un grupo multidisciplinario de expertos para que realizaran la Guía clínica para diagnóstico y tratamiento de enfermedad celíaca en México, y se establecieran recomendaciones para la comunidad médica, sus enfermos y la población general. Los profesionistas participantes, divididos en 3 mesas de trabajo, recibieron material bibliográfico seleccionado por los coordinadores (ART, LUD, JMRT), quienes propusieron los enunciados que fueron discutidos y votados en 3 sesiones: 2 a través de medios electrónicos y una presencial. Al final se aceptaron 39 enunciados que, una vez aprobados, fueron desarrollados y revisados por los coordinadores hasta su versión final, que fue aprobada por todos los participantes. Dentro de estas se destaca que la epidemiología y factores de riesgo asociados (familiares de primer grado, enfermedades autoinmunes, poblaciones de alto riesgo) a EC en México son similares a los descritos en otras partes del mundo. Se establecen pautas para el diagnóstico y el tratamiento apropiado de los pacientes mexicanos que la padecen. Se insiste en que una dieta estricta libre de gluten es indispensable solo en las personas con EC confirmada, y que su papel en pacientes con sensibilidad al gluten sin EC es aún un tema de controversia.
Celiac disease, celiac sprue, or gluten-sensitive enteropathy, is a generalized autoimmune disease characterized by chronic inflammation and atrophy of the small bowel mucosa. It is caused by dietary exposure to gluten and affects genetically predisposed individuals. In Mexico, at least 800,000 are estimated to possibly have the disease, prompting the Asociación Mexicana de Gastroenterología to summon a multidisciplinary group of experts to develop the “Clinical guidelines on the diagnosis and treatment of celiac disease in Mexico” and establish recommendations for the medical community, its patients, and the general population. The participating medical professionals were divided into three working groups and were given the selected bibliographic material by the coordinators (ART, LUD, JMRT), who proposed the statements that were discussed and voted upon in three sessions: two voting rounds were carried out electronically and one at a face-to-face meeting. Thirty-nine statements were accepted, and once approved, were developed and revised by the coordinators, and their final version was approved by all the participants. It was emphasized in the document that epidemiology and risk factors associated with celiac disease (first-degree relatives, autoimmune diseases, high-risk populations) in Mexico are similar to those described in other parts of the world. Standards for diagnosing the disease and its appropriate treatment in the Mexican patient were established. The guidelines also highlighted the fact that a strict gluten-free diet is essential only in persons with confirmed celiac disease, and that the role of gluten is still a subject of debate in relation to nonceliac, gluten-sensitive patients.
La enfermedad celiaca (EC), esprúe celíaco o enteropatía sensible al gluten, es una enfermedad autoinmune generalizada que se caracteriza por inflamación crónica y atrofia de la mucosa del intestino delgado, causadas por la exposición al gluten de la dieta que afecta a individuos genéticamente predispuestos1,2.
Aunque se consideraba rara en nuestro país, en la última década se ha generado información relevante respecto a su epidemiología y se estima que entre 800,000 y 1,000,000 de mexicanos podrían padecerla3,4. En el ámbito internacional se desarrolló nueva evidencia respecto a su diagnóstico y tratamiento, por lo que la Asociación Mexicana de Gastroenterología convocó a un grupo de profesionistas interesados en el tema para que se propusiera la Guía clínica para diagnóstico y tratamiento de enfermedad celíaca en México, y se establecieran recomendaciones útiles para la comunidad médica y los nutriólogos sobre este tema de indiscutible actualidad.
El objetivo es proveer un documento actualizado sobre epidemiología, diagnóstico y tratamiento de la EC en México. Las recomendaciones están basadas en una extensa revisión de la bibliografía y en la opinión consensuada de especialistas.
MétodosPara el desarrollo de la presente guía se designó a 3 coordinadores (LFUD, JMRT y ART), quienes organizaron un grupo multidisciplinario de gastroenterólogos (adultos y pediatras), endoscopistas, patólogos y nutriólogas divididos en 3 mesas de trabajo que discutirían: 1) definición y epidemiología; 2) diagnóstico; y 3) vigilancia y tratamiento. Los coordinadores realizaron una búsqueda exhaustiva en las siguientes bases de datos: CENTRAL (The Cochrane Central Register of Controlled Trials), MEDLINE (PubMed), EMBASE (Ovid), LILACS, CINAHL, Bio Med Central y World Health Organization International Clinical Trials Registry Platform (ICTRP) entre el 1 de enero de 2010 y el 28 de febrero de 2017. Los criterios incluyeron los términos: enfermedad celiaca/celiac disease combinado con: «epidemiology», «incidence», «prevalence», «Mexico», «gluten», «sensitivity», «diagnosis», «differential diagnosis», «treatment», «therapy», «management», «review», «guidelines» y «meta-analysis», así como sus equivalentes en español. Toda la bibliografía se puso a disposición de los colaboradores para que se pudiera revisar en cualquier momento a lo largo del proceso.
Cada mesa de trabajo identificó áreas de relevancia clínica, realizó la revisión de la bibliografía proporcionada para identificar la evidencia y elaboró enunciados pertinentes que fueron revisados por cada uno los integrantes de la mesa correspondiente por vía electrónica en 2 ocasiones, para ser finalmente presentados, discutidos y votados en una reunión presencial que se realizó el 7 de septiembre de 2017 en la ciudad de Tijuana, Baja California. Los enunciados fueron votados por todos los asistentes con base en 3 posibles respuestas: a) «totalmente de acuerdo»; b) «parcialmente de acuerdo»; y c) «en desacuerdo». Aquellos enunciados que alcanzaron un acuerdo total>75% se mantuvieron, y los que tuvieron un desacuerdo total>75% se eliminaron. Una vez establecidos todos los enunciados que formarían parte de la guía, los coordinadores elaboraron la primera versión del documento, y otorgaron un grado de recomendación y evaluación de la calidad de la evidencia empleando el sistema Grading of Recommendations Assessment, Development, and Evaluation (GRADE)5. En este sistema la calidad de la evidencia no se califica únicamente en función del diseño o metodología de la investigación, sino en función de una pregunta claramente planteada con relación a una variable de desenlace, que también debe formularse de manera clara. Sobre estas bases la evidencia puede ser alta, moderada, baja o muy baja. Además, establece la fuerza de las recomendaciones en fuerte o débil, a favor o en contra de la intervención o enunciado6. El sistema GRADE se expresa empleando un código que usa letras mayúsculas para hablar de la calidad de la evidencia, seguida de un índice numérico para indicar la fuerza de la recomendación (tabla 1).
Código del sistema GRADE. Clasificación de la calidad de la evidencia y de la fuerza de las recomendaciones
| Calidad de la evidencia | Código |
|---|---|
| Alta | A |
| Moderada | B |
| Baja | C |
| Muy baja | D |
| Fuerza de la recomendación | Código |
|---|---|
| Fuerte a favor de la intervención | 1 |
| Débil a favor de la intervención | 2 |
| Débil en contra de la intervención | 2 |
| Fuerte en contra de la intervención | 1 |
La versión final del documento fue aprobada por todos los participantes.
ResultadosDefinición, clasificación y notas epidemiológicas1. La EC es una enfermedad autoinmune desencadenada por la ingestión de gluten y proteínas relacionadas, que afecta a personas con susceptibilidad genética.
Calidad de la evidencia y fuerza de la recomendación: A1 fuerte a favor del enunciado (totalmente de acuerdo 100%).
La EC, también conocida como esprúe celiaco o enteropatía sensible al gluten, se define por intolerancia a las gliadinas del trigo y prolaminas contenidas en otros cereales que ocasionan daño a la mucosa del intestino delgado en grado variable en individuos genéticamente susceptibles7. La susceptibilidad genética está conferida por la presencia de los alelos de histocompatibilidad HLA-DQ2 con el heterodímero típico DQA1*0501/DQB1*0201 presente en 95% de los individuos y el HLA-DQ8 con el heterodímero HLA-DQB1*0302 en el restante 5%8. Aunque la presencia de estos alelos es indispensable para el diagnóstico de la enfermedad, se requiere la interacción con otros factores medioambientales para su desarrollo7. El fenómeno autoinmune se corrobora al demostrar una respuesta celular mediada por linfocitos CD4+9 y la presencia de autoanticuerpos en contra de la transglutaminasa tisular (anti- tTg y tTg2), que son proteínas pertenecientes a una familia de enzimas citoplásmicas dependientes de calcio10. Se sabe que el gluten produce daño tisular y aumenta la permeabilidad, dando como resultado la liberación de tTg citosólica al espacio extracelular para posteriormente ser presentados por células especializadas del complejo mayor de histocompatibilidad a los linfocitos T CD4+11.
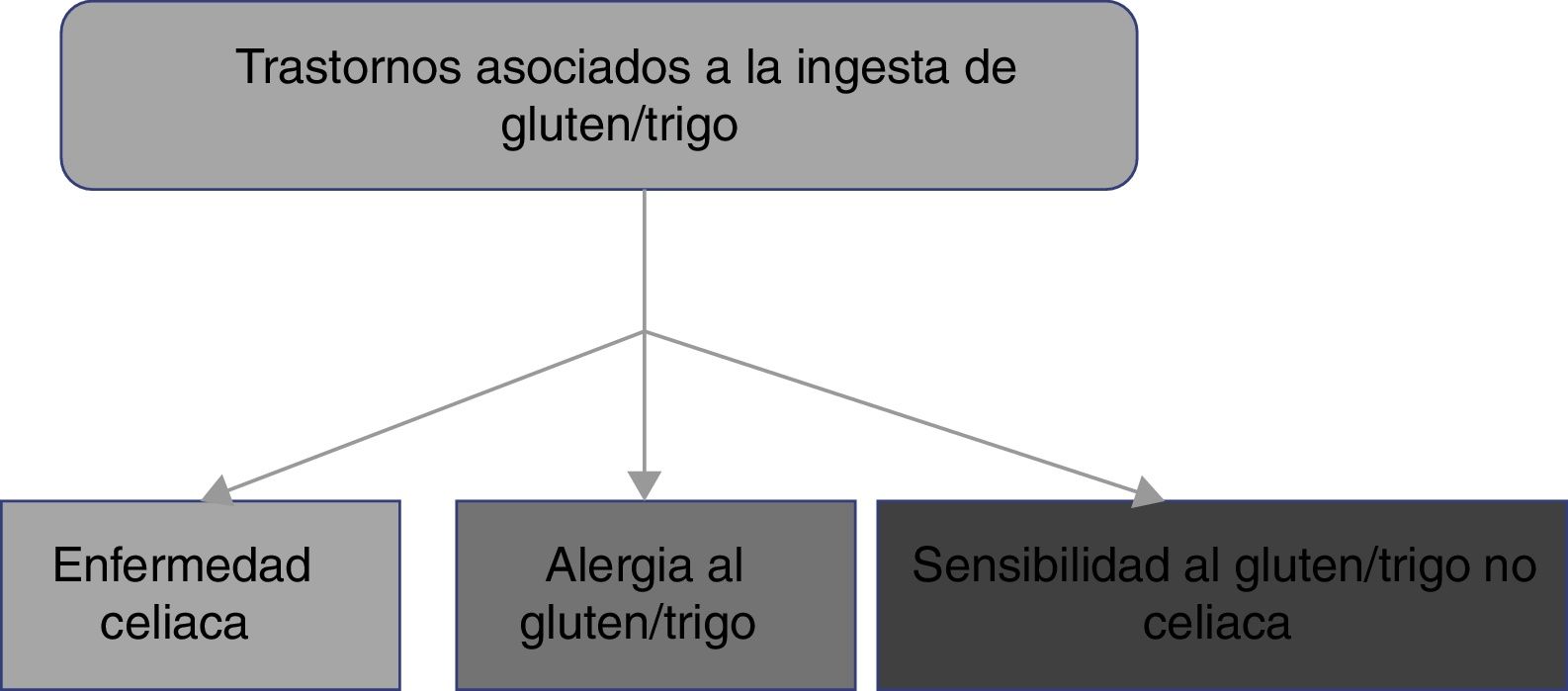
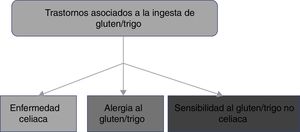
2. La EC forma parte de los trastornos relacionados con la ingestión de gluten que incluyen la alergia al gluten/trigo y la sensibilidad al gluten/trigo no celiaco.
Calidad de la evidencia y fuerza de la recomendación: A1 fuerte a favor del enunciado (totalmente de acuerdo 89%, parcialmente de acuerdo 11%).
El consumo de alimentos que contienen gluten ha sido y es de suma importancia para la alimentación de la humanidad. Sin embargo, de manera reciente, los trastornos relacionados con la ingestión de gluten/trigo presentan un incremento en su prevalencia, estimando que afectan a cerca del 5% de la población mundial1. Existen múltiples mecanismos que se han vinculado con la fisiopatogenia de los trastornos relacionados con la ingestión de gluten, algunos bien definidos, mientras que otros aún son motivo de controversia (fig. 1). La clasificación actual de los trastornos relacionados con la ingestión de gluten/trigo es evolutiva. En la EC se reconoce que la activación de linfocitos T se desencadena por la exposición al gluten, el cual está presente en alimentos que contienen trigo, cebada y centeno1,2. Por otra parte, tanto la alergia como la sensibilidad al gluten no celiaca (SGNC) pueden estar relacionadas con otras proteínas diferentes al gluten, por lo que grupos de expertos han recomendado que estos trastornos se clasifiquen como relacionados con el gluten/trigo12. La alergia a los componentes del trigo se presenta como una reacción inmune asociada a IgE, que desencadena una respuesta inflamatoria contra alfa-amilasa/inhibidor de la tripsina, proteína de transferencia de lípidos no específicos, gliadinas y gluteninas de alto peso molecular, que epidemiológicamente es más frecuente en la población pediátrica2. La SGNC se caracteriza por la presencia de síntomas intestinales y extraintestinales tras la ingestión de alimentos que contienen gluten/trigo, y cuya fisiopatología no se ha dilucidado completamente13. Un grupo de expertos definió criterios para el diagnóstico de la SGNC (criterios de Salerno) que, hasta el momento, constituyen el mejor protocolo para diagnosticarla. Es esperable que las definiciones se ajusten en el futuro mientras se reconocen los mecanismos fisiopatológicos de estos trastornos.
3. La prevalencia de EC en México se estima entre 0.5-0.7%.
Calidad de la evidencia y fuerza de la recomendación: B2 débil a favor del enunciado (totalmente de acuerdo 100%).
La EC tiene una distribución mundial, con una prevalencia estimada entre 1:67 y 1:250, aunque en algunas áreas la prevalencia real puede estar subvalorada, especialmente en poblaciones hispanoamericanas14,15. En población mestiza mexicana se ha calculado una seroprevalencia de anticuerpos anti-tTg y anti-endomisio (EMA) de 0.59% (0.27-1.29%), asociadas principalmente a un genotipo HLA predominantemente DQ83,4,16–18. Estas observaciones indican que la prevalencia y susceptibilidad genética de la población mestiza mexicana son similares a las de otras poblaciones.
4. Existen grupos de personas con mayor riesgo para EC y por tanto sujetos a la realización de prueba de escrutinio.
Calidad de la evidencia y fuerza de la recomendación: B1 fuerte a favor del enunciado (totalmente de acuerdo 94%, parcialmente de acuerdo 6%).
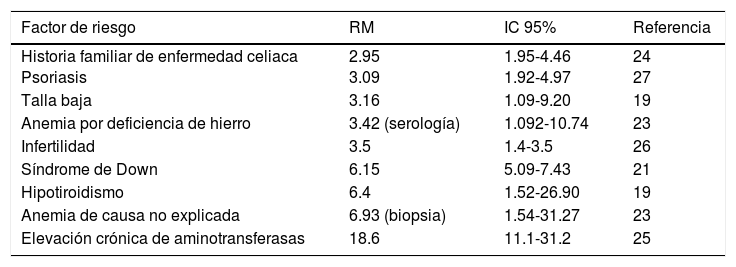
Algunos estudios han mostrado la asociación de EC con ciertas condiciones, por lo que, ante la presencia de estas, se sugiere realizar pruebas de escrutinio para descartarla. Dentro de estas se encuentran: familiares en primer y segundo grado de enfermos celíacos, enfermedades autoinmunes (diabetes mellitus tipo i, tiroiditis autoinmune, enfermedad de Addison)19,20, síndrome de Down21, síndrome de Turner22,23, anemia por deficiencia de hierro de causa no explicada24, elevación de aminotransferasas de causa no explicada25, osteopenia y osteoporosis no explicada,2 neuropatía, migraña, ataxia, dermatitis herpetiforme, psoriasis26, talla baja, hipoplasia del esmalte dental, infertilidad primaria27, síndrome de Williams-Beuren y deficiencia selectiva de IgA (tabla 2)2,12. Sin embargo, recientemente un estudio de casos y controles demostró que la detección a través de este tipo de estrategia (identificando grupos de alto riesgo, a excepción del hipotiroidismo) no es efectiva para la mayoría de casos con EC no diagnosticada28. Así pues, se necesitan mejores estrategias para la identificación de nuevos casos.
Poblaciones en riesgo para enfermedad celiaca y que se consideran susceptibles para realizar escrutinio
| Factor de riesgo | RM | IC 95% | Referencia |
|---|---|---|---|
| Historia familiar de enfermedad celiaca Psoriasis | 2.95 3.09 | 1.95-4.46 1.92-4.97 | 24 27 |
| Talla baja | 3.16 | 1.09-9.20 | 19 |
| Anemia por deficiencia de hierro | 3.42 (serología) | 1.092-10.74 | 23 |
| Infertilidad | 3.5 | 1.4-3.5 | 26 |
| Síndrome de Down | 6.15 | 5.09-7.43 | 21 |
| Hipotiroidismo | 6.4 | 1.52-26.90 | 19 |
| Anemia de causa no explicada | 6.93 (biopsia) | 1.54-31.27 | 23 |
| Elevación crónica de aminotransferasas | 18.6 | 11.1-31.2 | 25 |
5. La frecuencia de EC en algunos grupos de mayor riesgo estudiados en México es similar a la informada en otros países.
Calidad de la evidencia y fuerza de la recomendación: B2 débil a favor del enunciado (totalmente de acuerdo 100%).
La prevalencia de EC en México es similar a la informada en otras partes. Incluso en poblaciones de alto riesgo como pacientes con diabetes mellitus tipo 1, en los que se encontró una prevalencia de 5.9% (serología e histología) en adultos mexicanos29 y entre el 9% y 12% en población pediátrica30. También se ha observado en otras poblaciones de riesgo como: enfermos con monosomía 7 o síndrome de Williams-Beuren (23%)31, enfermedades hepáticas autoinmunes (6.6%)32 y personas con infertilidad inexplicable (3-5%)33.
Se ha informado que en pacientes mexicanos con síndrome de intestino irritable (SII) con predominio de diarrea y mixto, de acuerdo a criterios de Roma III, la prevalencia de EC varía entre el 2.25% y 3.5% comparado con el 0.5% de la población general (RM 5.21; IC 95% 1.13-2.93; p=0.04)34. El mismo grupo de investigadores describe que hasta el 6% de los pacientes mexicanos con dispepsia no investigada pueden padecer de EC35.
6. Según su presentación la EC puede ser clasificada en: 1. Sintomática; 2. Asintomática; y 3. Potencial.
Calidad de la evidencia y fuerza de la recomendación: A1 fuerte a favor del enunciado (totalmente de acuerdo 100%).
Los signos y síntomas de enfermedad celiaca fueron descritos hace más de 100 años. En este extenso período la investigación y el conocimiento de la enfermedad han aumentado notablemente2,12. Esta evolución en el conocimiento ha sido acompañada por el empleo de muchos términos y clasificaciones, lo que ha generado confusión y falta de consenso. En este contexto, y de acuerdo con las definiciones que han sido publicadas por un grupo multidisciplinario de estudio, se propone que la EC sea clasificada desde un punto de vista clínico en 1. Sintomática; 2. Asintomática; y 3. Potencial.
7. La EC sintomática puede presentarse con manifestaciones gastrointestinales (EC clásica) o extraintestinales.
Calidad de la evidencia y fuerza de la recomendación: A1 fuerte a favor del enunciado (totalmente de acuerdo 100%).
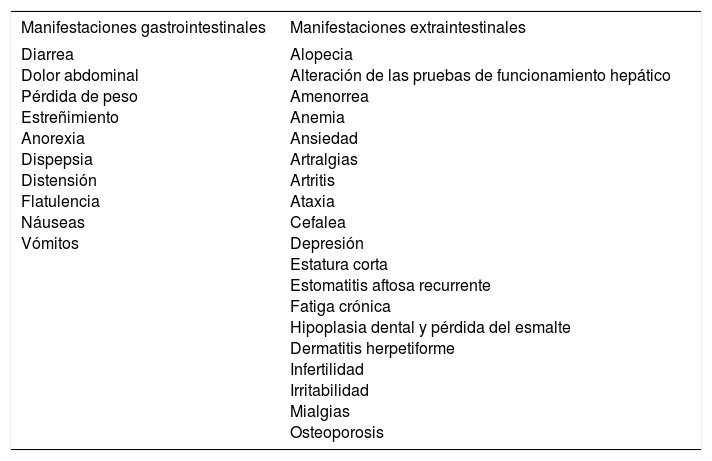
La EC sintomática se caracteriza por la presencia de cualquier tipo de síntomas, gastrointestinales o extraintestinales (tabla 3) que de manera clara pueden asociarse con la ingestión de gluten36,37. Dentro de esta categoría se puede incluir a los pacientes que presentan síntomas clásicos de la enfermedad como diarrea, esteatorrea, pérdida de peso o retraso en el crecimiento. Es importante evitar el término «enfermedad celíaca típica», ya que este alude a la frecuencia, y cada vez hay más evidencia de que los síntomas considerados como clásicos no son los más comunes y, por tanto, se aconseja mejor emplear el término «enfermedad celiaca sintomática». Es importante mantener un alto índice de sospecha para establecer el diagnóstico, ya que menos del 50% de los adultos presentan síntomas gastrointestinales38. Con el desarrollo de pruebas no invasoras, altamente sensibles y específicas, ha sido posible conocer mejor la enfermedad e identificarla en sujetos de riesgo39. Los síntomas gastrointestinales son la forma de presentación más común en niños pequeños, en quienes la EC se muestra generalmente con vómito, dolor abdominal, diarrea y estreñimiento refractario, mientras que las manifestaciones extraintestinales se presentan en niños de mayor edad y adolescentes40.
Manifestaciones clínicas de la enfermedad celíaca sintomática
| Manifestaciones gastrointestinales | Manifestaciones extraintestinales |
|---|---|
| Diarrea Dolor abdominal Pérdida de peso Estreñimiento Anorexia Dispepsia Distensión Flatulencia Náuseas Vómitos | Alopecia Alteración de las pruebas de funcionamiento hepático Amenorrea Anemia Ansiedad Artralgias Artritis Ataxia Cefalea Depresión Estatura corta Estomatitis aftosa recurrente Fatiga crónica Hipoplasia dental y pérdida del esmalte Dermatitis herpetiforme Infertilidad Irritabilidad Mialgias Osteoporosis |
La EC no clásica es parte de la EC sintomática y se caracteriza porque no existen datos de absorción intestinal deficiente (por ejemplo, personas con dolor abdominal o estreñimiento).
8. Las manifestaciones clínicas más clásicas de la EC son distensión y dolor abdominal, borborigmos, diarrea con absorción deficiente de nutrimentos, pérdida de peso y ataque al estado general.
Calidad de la evidencia y fuerza de la recomendación: A1 fuerte a favor del enunciado (totalmente de acuerdo 94%, parcialmente de acuerdo 6%).
Históricamente la EC clásica se ha definido por la presencia de diarrea, desnutrición o síndrome de absorción intestinal deficiente (pérdida de peso, esteatorrea y edema secundario a hipoalbuminemia)2. Ahora sabemos que los síntomas de la EC clásica son menos frecuentes35. Aunque no todos son considerados hoy día como «clásicos», los más comunes incluyen distensión y dolor abdominal, borborigmos, diarrea con absorción deficiente de nutrimentos (como deficiencia de hierro), pérdida de peso, ataque al estado general, fatiga crónica y osteoporosis38,39,41. La prevalencia de las manifestaciones clínicas varía de acuerdo a diversos factores como la población estudiada (v. gr. los niños más pequeños sufren principalmente de manifestaciones gastrointestinales y retraso del crecimiento, mientras que los adolescentes presentan más manifestaciones extraintestinales), las definiciones operacionales utilizadas e incluso la época en la que se han estudiado42. Actualmente la EC se muestra frecuentemente monosintomática, con cuadros menos graves en términos de síntomas y enfermedad intestinal.
Un estudio de 2 centros de referencia en nuestro país que evaluó a 80 pacientes mexicanos con EC destacó que la manifestación más común fue la diarrea (86%), seguida de distensión (77%) y dolor abdominal (71%). La duración promedio de manifestaciones clínicas antes del diagnóstico fue de 10 años, y notablemente en el 64% de los pacientes se diagnosticó previamente síndrome de intestino irritable43.
9. La variedad asintomática de la EC se caracteriza por: 1. serología positiva de autoinmunidad celiaca; 2. alteraciones en la biopsia de mucosa duodenal; y 3. ausencia de síntomas o signos aparentes.
Calidad de la evidencia y fuerza de la recomendación: A1 fuerte a favor del enunciado (totalmente de acuerdo 100%).
La EC asintomática es aquella en la que no existen síntomas en el momento del diagnóstico inicial, aun si se realiza un interrogatorio dirigido. Se trata de individuos identificados mediante programas de detección en países con alta prevalencia o con condiciones asociadas con un riesgo alto de EC.
En algunos casos el cuadro es discreto y quizá ha acompañado al paciente durante toda su vida, por lo que este no lo identifica como patológico hasta que desaparece al suspender el consumo de gluten. En los niños esta variedad asintomática puede caracterizarse solo por baja talla para la edad, mientras que en las jóvenes puede haber una ligera anemia u osteopenia, especialmente después de la menarquia.
Una serología positiva se refiere a la detección de anticuerpos contra péptidos desaminados de gliadinas (PDG) o contra proteínas endógenas como tTg y/o endomisio (EMA), mientras que las alteraciones histológicas pueden ser acortamiento de las vellosidades y aumento de linfocitos intraepiteliales2,40.
10. La EC potencial se presenta en personas con una biopsia de intestino normal que tienen un riesgo elevado de desarrollar EC, debido a la presencia de anticuerpos contra PDG, tTg, y/o EMA.
Calidad de la evidencia y fuerza de la recomendación: A1 fuerte a favor del enunciado (totalmente de acuerdo 100%).
La EC potencial se refiere a individuos con mucosa de intestino delgado normal que tienen un riesgo aumentado de desarrollar el padecimiento por presentar serología positiva para EC. Se sugiere evitar el término «enfermedad celíaca latente», para el que se han identificado al menos 5 definiciones, lo que genera confusión2,12.
En casos de EC potencial es conveniente analizar haplotipos HLA-DQ2 /DQ8 para descartar otra causa que explique el hallazgo de anticuerpos asociados a EC24. Además, es importante repetir el análisis al menos 3 meses después del primer resultado positivo para insistir en EC potencial. En cualquier caso, es importante realizar análisis de anticuerpos 2 veces al año en estas personas si son adultas, y tal vez más frecuentemente si se trata de niños. El tratamiento con una dieta sin gluten puede considerarse especialmente en enfermos con EMA positivo, ya que puede prevenir el desarrollo de síntomas y daño en la mucosa duodenal.
11. La EC sin respuesta a tratamiento se caracteriza por persistencia de síntomas, signos de carencias nutrimentales o alteraciones de laboratorio a pesar de seguir una dieta estricta libre de gluten por 6 meses.
Calidad de la evidencia y fuerza de la recomendación: A1 fuerte a favor del enunciado (totalmente de acuerdo 94%, parcialmente de acuerdo 6%).
La persistencia o recidiva de los síntomas a pesar del cumplimiento de la dieta libre de gluten se observa en alrededor del 30% de los enfermos celíacos44. El paso inicial en la evaluación de estos pacientes es asegurarse de que el diagnóstico de EC sea correcto, lo que implica la revisión detallada del tipo de anticuerpos que dio el resultado positivo y de las laminillas de la biopsia duodenal45. El siguiente paso es la evaluación cuidadosa de posibles fuentes alimentarias de contaminación con gluten por parte de un nutriólogo experto46. La investigación sistemática de otras causas (enunciado 36) no relacionadas, a la falta de cumplimiento de la dieta, está indicada si la evaluación inicial descarta contaminación con gluten47. Una vez que se han excluido causas potenciales, la presencia de absorción deficiente grave, desnutrición progresiva y atrofia de vellosidades intestinales persistente sugiere EC refractaria.
12. La EC refractaria es una variedad rara que se define por la persistencia o recidiva de síntomas y signos sugerentes de absorción deficiente, con atrofia de vellosidades intestinales, a pesar de seguir una dieta estricta libre de gluten durante 12 meses, en ausencia de otra causa que explique los síntomas.
Calidad de la evidencia y fuerza de la recomendación: A1 fuerte a favor del enunciado (totalmente de acuerdo 100%).
La EC refractaria es rara y afecta a menos del 2% de los enfermos celiacos48. Es más frecuente en hombres con diagnóstico establecido en la edad adulta. Es excepcional antes de los 30 años de edad. La hipoalbuminemia es un factor de mal pronóstico49. Los autoanticuerpos (tTg y EMA) son frecuentemente negativos50. Es un diagnóstico que requiere la exclusión sistemática de otras causas más comunes de falta de respuesta a la dieta libre de gluten.
13. Existen 2 tipos de EC refractaria de acuerdo a su inmunofenotipo: tipo I, mediada inmunológicamente, y tipo II caracterizada por clonas de linfocitos intraepiteliales monoclonales. El tipo I responde bien al tratamiento médico y el tipo II tiene pobre pronóstico debido a su asociación con desnutrición grave y linfoma intestinal.
Calidad de la evidencia y fuerza de la recomendación: A1 fuerte a favor del enunciado (totalmente de acuerdo 100%).
La EC refractaria se clasifica por presencia de clonas anormales de células T en la mucosa del intestino. Las clonas deben buscarse mediante estudios moleculares especiales, inmunohistoquímica o citometría de flujo, en biopsias de intestino51. Las clonas anormales de células T expresan el marcador CD3 en el citoplasma, pero pierden la expresión del marcador CD8 en la superficie, además demuestran rearreglo clonal del receptor gamma de las células T. La presencia de clonas anormales de células T definen la EC refractaria tipo ii, que no responde adecuadamente a los tratamientos disponibles, incrementa el riesgo de transformación a linfoma y tiene una elevada mortalidad52. La EC refractaria tipo i caracteriza a enfermos que cumplen criterios clínicos de EC refractaria en ausencia de clona anormal de células T. La EC refractaria tipo i tiene un mejor pronóstico, ya que responde favorablemente al tratamiento médico con esteroides tales como budesonida y/o inmunosupresores (por ejemplo, azatioprina)53. El uso de nutrición parenteral total debe considerarse en aquellos casos de desnutrición grave. El tratamiento de la EC refractaria tipo ii debe individualizarse y es recomendable referir estos enfermos a un centro especializado.
Diagnóstico14. La base para establecer el diagnóstico de EC es pensar en ella en un contexto clínico apropiado. El diagnóstico de certeza incluye la combinación de historia clínica, serología y biopsia de mucosa duodenal.
Calidad de la evidencia y fuerza de la recomendación: A1 fuerte a favor del enunciado (totalmente de acuerdo 100%).
«Si no la piensa, no la busca; si no la busca, no la encuentra». Este es un principio básico en la práctica de la medicina. No se puede diagnosticar aquello que no se sospecha. La EC es un claro ejemplo de este concepto. Habituados a incluirla en el diagnóstico diferencial de enfermos con síndrome de absorción intestinal deficiente, se pasan por alto manifestaciones clínicas que afectan a otros órganos y sistemas y que, en el momento actual, dominan el escenario clínico de la mayoría de las personas afectadas por esta enfermedad2,40. Es por esto que se debe aumentar el índice de sospecha y buscarla de manera dirigida en otras entidades que no suelen presentarse con molestias atribuibles al aparato digestivo.
En todo caso, el diagnóstico de certeza no recae sobre un dato aislado, y es necesario conjuntar aspectos clínicos con los resultados de exámenes de laboratorio, especialmente la cuantificación de autoanticuerpos y las alteraciones histopatológicas compatibles, aunque no exclusivas de EC.
15. En personas de 2 o más años de edad se sugiere como prueba de tamiz la cuantificación de anticuerpos anti-transglutaminasa tisular IgA (anti-tTg IgA). En niños con anti-tTg IgA negativos (especialmente si son menores de 2 años) pero con síntomas sugerentes de EC se propone la cuantificación de anticuerpos anti-PDG IgG y/o IgA.
Calidad de la evidencia y fuerza de la recomendación: A1 fuerte a favor del enunciado (totalmente de acuerdo 95%, parcialmente de acuerdo 5%).
El desarrollo de pruebas serológicas para diagnóstico de EC se inició alrededor de 1980 con la introducción de los anticuerpos anti-gliadinas nativas, cuyo uso se ha abandonado debido a su baja sensibilidad y especificidad. Pronto aparecieron los anticuerpos anti-reticulina que también se han descontinuado al obtener mejores resultados con otros ensayos desarrollados casi de manera simultánea. En el momento actual la prueba con más especificidad es la cuantificación de anticuerpos anti-endomisio (anti-EMA), que requiere de personal y tecnología especializada, y no siempre está disponible en nuestro medio2,40.
El descubrimiento de que el antígeno contra el cual reaccionan los anticuerpos anti-EMA es la transglutaminasa tisular permitió el desarrollo de mejores técnicas, que han hecho posible que prácticamente en cualquier laboratorio clínico se puedan cuantificar anticuerpos anti-tTg IgA e IgG, que son por otro lado más baratos y objetivos, no sujetos a interpretación personal, como los anti-EMA.
Hopper et al.54 analizaron el rendimiento de la cuantificación de anticuerpos anti-tTg contra la cuantificación secuencial de anti-tTg y anti-EMA. Los valores de predicción negativos fueron similares con ambas estrategias (99.6% vs 99.7%), pero la sensibilidad fue ligeramente mayor con la medición única de anti-tTg (90.9% vs 85.7%). Basándonos en su relativa facilidad, accesibilidad y coste, la mayoría de guías clínicas recomiendan iniciar el estudio de una persona con sospecha de EC cuantificando anticuerpos anti-tTg IgA2,40.
De manera reciente se ha desarrollado un método de laboratorio que emplea como antígeno los péptidos desaminados de gliadina (PDG) que, por ser más inmunogénicos, prometían en un inicio mejores resultados. Sin embargo, los anticuerpos anti-PDG IgA e IgG no ofrecen ventaja sobre los anti-tTg IgA, excepto en 2 condiciones clínicas específicas: personas con deficiencia selectiva de IgA y niños menores de 2 años de edad2,10,12.
16. Si los anti-tTg IgA son negativos, pero la sospecha de EC es alta, se debe descartar deficiencia selectiva de IgA y, si se confirma, solicitar anti-tTg IgG o anti-PDG IgG.
Calidad de la evidencia y fuerza de la recomendación: B1 fuerte a favor del enunciado (totalmente de acuerdo 95, parcialmente de acuerdo 5%).
Aunque el rendimiento diagnóstico de las pruebas en sangre es bastante elevado hay 2 condiciones en donde se pueden dar resultados falsamente negativos: 1) la deficiencia selectiva de IgA; y 2) cuando los exámenes se realizan en un enfermo que lleva una dieta libre de gluten o toma medicamentos inmunosupresores.
La deficiencia selectiva de IgA es sensiblemente mayor en las personas con EC2,10,40. Una práctica común en varias partes del mundo es la de iniciar el estudio del enfermo con sospecha de EC cuantificando IgA en suero. Si esta es normal se solicita anti-tTg IgA. En caso contrario se solicita anti-tTg IgG o anti-PDG IgG. Esta estrategia no se ha validado en nuestro medio, y tampoco se conoce con certeza la tasa de deficiencia selectiva de IgA. Por otro lado, muchos de los laboratorios clínicos informan de manera simultánea las concentraciones de anti-tTg IgA e IgG, y en otros es posible solicitar una prueba que combina anti-tTg IgA y anti-PDG IgG en la misma muestra. Habrá que realizar análisis de costo-beneficio considerando la prevalencia relativamente baja de EC que presenta la población mexicana55.
La popularidad de la dieta libre de gluten ha ocasionado que muchas personas la sigan sin tener un diagnóstico de certeza. Esta es una situación cada vez más común y limita la utilidad de los marcadores serológicos. Una medida práctica es realizar una encuesta dietética detallada. No es infrecuente constatar que, pese a sus esfuerzos, las personas siguen consumiendo gluten2,40,55. En ese caso, la negatividad de los autoanticuerpos puede ser real. En caso contrario, cuando en efecto no se está consumiendo gluten, lo más recomendable es convencer al enfermo sobre consumir una dieta normal para entonces cuantificar autoanticuerpos.
17. En casos con alta probabilidad de EC conviene solicitar desde el inicio anticuerpos anti-tTg IgA/anti-PDG IgG o anti-EMA.
Calidad de la evidencia y fuerza de la recomendación: B1 fuerte a favor del enunciado (totalmente de acuerdo 95, parcialmente de acuerdo 5%).
Aun con pruebas de laboratorio con elevada sensibilidad y especificidad (como es el caso de los autoanticuerpos para EC), el valor de predicción positiva y predicción negativa puede ser bajo, ya que el rendimiento de estos depende de la prevalencia de la enfermedad que se está investigando. Si se hace un ejercicio estadístico considerando la prevalencia de EC informada en México (0.7%) y se calculan los valores de predicción positiva y negativa, tomando en cuenta la sensibilidad y especificidad de los anti-tTg IgA (90% y 95% respectivamente), se vería que un título de anti-tTg IgA positivo referiría un valor de predicción positivo de solo un 12%. Esto es, ¡la mayoría de los resultados (88%) serían falsamente positivos! En cambio, el mismo ejercicio aplicado a una población con una posibilidad a priori mayor para la EC, como ocurre en los grupos identificados como de alto riesgo (ver enunciados 4 y 5), ofrecería un valor de predicción positiva cercano al 80%. Por esta razón, un artículo de posición recientemente publicado señala la poca utilidad de tamizar para EC a personas asintomáticas sin factores de riesgo y procurar la búsqueda intencionada de casos56.
La táctica propuesta en este enunciado no se ha validado ni se ha propuesto en otros algoritmos donde la ruta que se sigue es la señalada en enunciados previos. Sin embargo, tiene un sentido práctico: 1. con la cuantificación simultánea de anti-tTg IgA y anti-PDG IgG se descarta la posibilidad de que la deficiencia selectiva de IgA pudiera estar dando valores falsamente negativos; y 2. estudios realizados en grupos de enfermos con probabilidad alta para EC han informado cifras de sensibilidad y especificidad muy elevadas (95% y 98% respectivamente)2,40,55.
En cuanto a los anti-EMA, en prácticamente todos lados se ha demostrado su alta especificidad, por lo que un resultado positivo prácticamente confirma la existencia de EC. Su sensibilidad, sin embargo, no es suficiente para utilizarla como prueba de tamizaje, ya que un número no despreciable de enfermos celíacos tienen anti-EMA negativos en suero55.
18. La positividad de anti-tTg IgA y anti-EMA apoya el diagnóstico de EC.
Calidad de la evidencia y fuerza de la recomendación: A1 fuerte a favor del enunciado (totalmente de acuerdo 100%).
Confirmar el diagnóstico de EC implica reunir varios elementos que necesariamente deben partir de la sospecha clínica. El rendimiento de las pruebas serológicas las ha convertido en una herramienta indispensable que, sin embargo, interpretadas de manera incorrecta, pueden conllevar errores que motiven medidas terapéuticas injustificadas. Esta situación no es despreciable, ya que actualmente se sabe que muchas personas que siguen una dieta libre de gluten no tienen un diagnóstico bien definido. El problema se magnifica en países con una prevalencia de EC relativamente baja como México. En este sentido habrá que insistir que la positividad de una sola prueba no establece el diagnóstico, y que para ello es más bien necesario utilizar la combinación de otros ensayos serológicos2,40,55. Por si esto no bastara, los títulos de los autoanticuerpos son otros elementos que tomar en cuenta. Por ejemplo, una baja concentración de anti-tTg IgA de forma aislada seguramente corresponde a un valor falso positivo: en cambio, cuando se acompaña con un valor también positivo de anti-EMA, prácticamente se confirma la sospecha clínica55.
19. En adultos la biopsia de duodeno es indispensable para confirmar el diagnóstico de EC y establecer la gravedad del daño a la mucosa.
Calidad de la evidencia y fuerza de la recomendación: A1 fuerte a favor del enunciado (totalmente de acuerdo 100%).
Diversos grupos interesados, que trabajan en centros de referencia, han informado sobre el excelente rendimiento diagnóstico de los autoanticuerpos. La sensibilidad y especificidad, tanto de los anti-tTg IgA como de los anti-EMA, es más baja en el mundo real donde la prevalencia de EC es menor e intervienen otros factores, como las variaciones que pueden existir al utilizar distintos kits comerciales con respecto a los valores sugeridos para identificar a los enfermos celiacos, mismo que no siempre son óptimos para este fin. De esta manera, la confirmación histológica a través de biopsias duodenales asegura el diagnóstico antes de indicar una medida terapéutica costosa, difícil y limitante, como la dieta libre de gluten que tendrá que seguirse de por vida2,35,40,57. Otro beneficio de la confirmación histológica es permitir el seguimiento de los enfermos, que sigan una dieta restrictiva y que no responden de manera adecuada o continúan exhibiendo títulos altos de autoanticuerpos. La tipificación correcta de EC refractaria o resistente al tratamiento requiere la demostración de daño tisular en la mucosa del intestino delgado. Por otro lado, aunque con cierta controversia, se ha señalado que la persistencia de atrofia de vellosidades intestinales correlaciona con un pronóstico menos bueno de los enfermos celiacos47.
En 2012 la Sociedad Europea de Gastroenterología, Hepatología y Nutrición Pediátrica (ESPGHAN)58 propuso una estrategia de diagnóstico para evitar la endoscopia en niños siempre que se cumplieran las siguientes condiciones: 1. elevación de anti-tTg IgA 10 veces por arriba del valor de corte; 2. confirmación con una prueba positiva de anti-EMA en una muestra diferente de sangre; 3. HLA DQ2/DQ8 positivo; y 4. cuadro clínico compatible (EC sintomática). Estas recomendaciones se han validado en análisis retrospectivos y estudios prospectivos, tanto en niños como en adultos, así como en población con y sin síntomas. Sin embargo, no han sido universalmente aceptadas.
20. Para una mejor evaluación de las alteraciones histológicas es conveniente tomar al menos 4 fragmentos de mucosa de duodeno distal y uno o 2 de bulbo duodenal.
Calidad de la evidencia y fuerza de la recomendación: B1 fuerte a favor del enunciado (totalmente de acuerdo 100%).
Para el análisis histológico se requieren cuando menos 4 biopsias tomadas de la segunda porción de duodeno (D2). En un estudio retrospectivo Pais et al.59demostraron la superioridad diagnóstica de 4 en comparación con 2 biopsias (100% vs 90%). Kurien et al.60, en un estudio de cohorte prospectivo, informaron un mayor grado de atrofia de vellosidades cuando las biopsias del duodeno correspondían al cuadrante «entre las 9 y las 12» (sensibilidad 96.4%; IC 95%, 79.-100%), a diferencia de las obtenidas «entre el de las 12 y las 3» (92% vs. 65% respectivamente; p=0.02).
En estudios realizados en Estados Unidos y Reino Unido se ha informado que entre el 5% y el 14% de los pacientes con diagnóstico reciente de EC ya contaban con una evaluación endoscópica previa. Por esto, para mejorar la detección de EC, estudios recientes han sugerido tomar biopsias de la primera porción del duodeno (D1), con lo que se incrementa el rendimiento diagnóstico hasta en un 10%61, además de que en algunos enfermos (1.8-14%) la porción D1 puede ser el único sitio afectado (EC ultracorta)62–64. González et al.65 encontraron afección de D1 o D2 en el 90% de los casos, y en ambos sitios en el 75% de los pacientes, pero de manera relevante solo fue posible realizar el diagnóstico de EC por los cambios histológicos en D1 en el 13% de los casos.
21. Las alteraciones histológicas deben evaluarse e informarse de manera sistemática empleando clasificaciones validadas.
Calidad de la evidencia y fuerza de la recomendación: A1 fuerte a favor del enunciado (totalmente de acuerdo 100%).
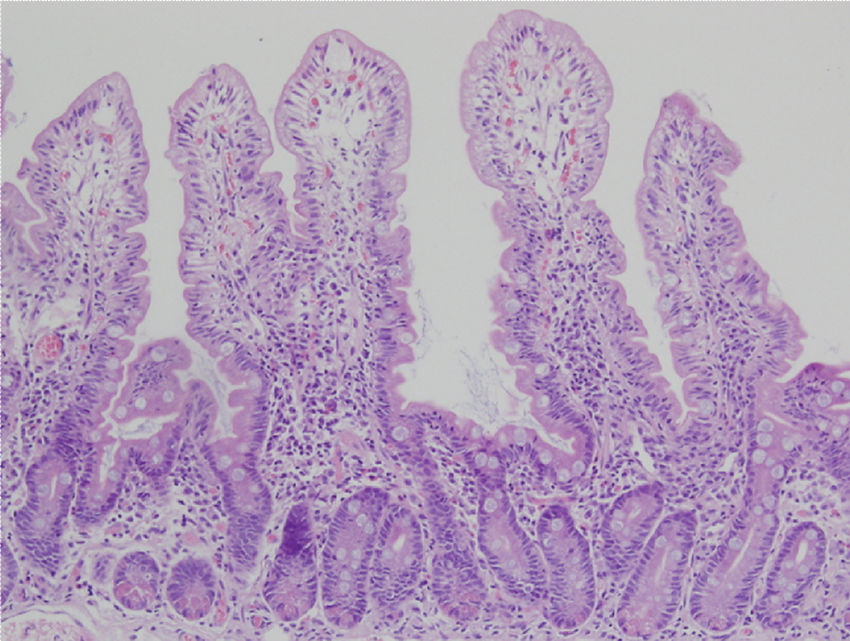
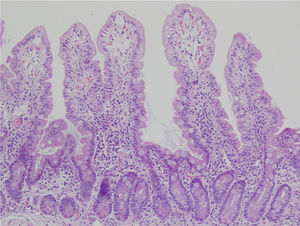
Las biopsias pueden orientarse en fresco y ser fijadas sobre papel o pueden dejarse libres en formalina54–57. Las alteraciones histológicas deben evaluarse en biopsias bien orientadas, y se deben identificar al menos 4 vellosidades que deben tener la morfología observada en la microfotografía que se muestra en la figura 2. De esta manera, es posible definir con mayor precisión la altura de las vellosidades y la profundidad de las criptas, lo que permite establecer la proporción vellosidad/cripta que normalmente debe ser 3:157. El informe debe indicar el número de biopsias y las que son evaluables anotando las siguientes características:
- •
La morfología de las vellosidades, si existe atrofia y si esta es parcial, subtotal o total.
- •
El contenido celular en la lámina propia (linfocitos, células plasmáticas, eosinófilos o neutrófilos).
- •
La presencia de glándulas de Brunner.
- •
La presencia de hiperplasia de las criptas.
- •
El número de linfocitos intraepiteliales (LIE) por cada 20 enterocitos en la porción alta de cuando menos 5 vellosidades, o por cada 50 enterocitos. Se considera normal menos de 25 LIE por cada 100 enterocitos2,57.
- •
En las cuentas limítrofes o equívocas la inmunohistoquímica (CD3) puede ser de utilidad para realizar la cuantificación.
Biopsia duodenal para análisis histológico de la EC.
Las alteraciones histológicas deben evaluarse en biopsias bien orientadas y se deben identificar al menos 4 vellosidades que deben tener la morfología observada en la microfotografía. La descripción debe incluir: a) morfología de las vellosidades, si la atrofia está presente o no, si la atrofia es parcial, subtotal o total; b) contenido celular en la lámina propia (linfocitos, células plasmáticas, eosinófilos o neutrófilos); c) presencia de glándulas de Brunner e hiperplasia de las criptas; y d) número de linfocitos intraepiteliales considerando normal menos de 25 linfocitos/100 enterocitos.
22. En caso de atrofia de vellosidades intestinales con autoanticuerpos para EC negativos deben descartarse otras enfermedades.
Calidad de la evidencia y fuerza de la recomendación: B1 fuerte a favor del enunciado (totalmente de acuerdo 100%).
En nuestro medio no es infrecuente encontrar personas con diagnóstico de EC únicamente en función de los hallazgos histopatológicos. El aumento de LIE, hiperplasia de criptas y atrofia de vellosidades pueden encontrarse en otras condiciones que no son raras en México como giardiasis, sobrecrecimiento bacteriano, uso de ciertos medicamentos (olmesartán, antiinflamatorios no esteroideos), esprúe tropical y alergia a la proteína de la soja o de la leche66–68. Las mismas alteraciones histológicas pueden observarse en enfermedades menos comunes que también deben incluirse en el diagnóstico diferencial, como enteropatía autoinmune, enfermedad de injerto contra huésped o enfermedad inflamatoria intestinal69.
23. El análisis de antígenos de histocompatibilidad DQ2/DQ8 es útil para descartar EC en situaciones especiales, como atrofia de vellosidades con serología negativa (discrepancia entre serología e histología) y/o en personas que ya siguen dieta libre de gluten y rehúsan hacerse una prueba de reto.
Calidad de la evidencia y fuerza de la recomendación: B1 fuerte a favor del enunciado. (totalmente de acuerdo 100%).
La expresión de antígenos del complejo mayor de histocompatibilidad clase ii: HLA DQ2 (codificado por los alelos A1*05 y B1*02) o HLA DQ8 (codificado por los alelos A1*03 and B1*0302) es indispensable para que se desarrolle la EC. Por lo tanto, ante pruebas serológicas negativas o imposibilidad para llevar a cabo una prueba de reto con gluten, el análisis de estos alelos es de ayuda diagnóstica40,70–72. Su importancia radica en que su ausencia prácticamente descarta la enfermedad (alto valor predictivo negativo>99%) y obliga a buscar otras causas que expliquen síntomas o alteraciones histopatológicas. Sin embargo, su presencia no la confirma, ya que el 30-40% de la población en Europa, Asia y América, incluyendo México (24% DQ8 y 16% DQ2), expresan dichos haplotipos o sus alelos, y de estos solo el 3% tienen EC (bajo valor predictivo positivo<12%). Es, por tanto, un rasgo necesario pero claramente no suficiente para desarrollar EC73.
El análisis de las moléculas HLA también es útil para descartar la enfermedad y, por tanto, la necesidad de estudios adicionales de escrutinio en personas con alto riesgo, como los familiares de primer grado de enfermos celiacos (ver enunciados 4 y 5). Es importante señalar que la prueba genética no debe usarse de manera rutinaria en el diagnóstico de personas con sospecha de EC. En población mestiza mexicana la EC se asocia principalmente a un genotipo HLA-DQ816.
24. El empleo de la enteroscopia, así como videocápsula (VC) se justifica únicamente en casos de EC complicada en la que se sospeche la existencia de lesiones premalignas o malignas en el intestino delgado.
Calidad de la evidencia y fuerza de la recomendación: B2 débil a favor del enunciado (totalmente de acuerdo 100%).
La endoscopia se ha posicionado como una herramienta indispensable en el diagnóstico de los enfermos con EC, ya que a pesar de su baja sensibilidad para la detección de atrofia de vellosidades permite la toma de biopsias duodenales, que continúa siendo el estándar de oro para el diagnóstico74.
Debido a sus características operacionales (segura y mínimamente invasiva) el empleo de VC es un área en continuo desarrollo. Un estudio realizado en enfermos celiacos con diagnóstico confirmado mediante biopsias duodenales encontró que la sensibilidad para identificar atrofia de vellosidades fue significativamente mayor con VC comparado con endoscopia convencional (92% vs. 55%, p=0.0005), con especificidad del 100% con ambos métodos, observándose hasta en más del 90% de los casos afección de la mucosa duodenal (duodeno en el 32% y duodeno/yeyuno en el 59%). Además, la VC permitió la evaluación de la extensión de la enfermedad y respuesta al tratamiento75.
La VC puede ser de utilidad en otros casos bien seleccionados, por ejemplo: en personas con serología negativa y cambios histológicos mínimos (Marsh I-II) en quienes rechacen la realización de endoscopia o esta esté contraindicada, en presencia de cambios endoscópicos sugerentes de atrofia con biopsia negativa y elevada sospecha diagnóstica, o en casos con lesiones en parches (15%), y por lo tanto, susceptibles al error de muestreo en las biopsias duodenales76–78. Sin embargo, su uso como único método de diagnóstico es limitado debido a que los hallazgos no son patognomónicos y a que, hasta ahora, no es posible obtener una muestra para confirmación histológica.
La VC ha mostrado utilidad en casos de EC refractaria con adecuada concordancia con histología en casos de atrofia, así como en la evaluación de la extensión (mayor extensión en casos de EC refractaria tipo ii comparado con EC refractaria tipo i (54% vs 9%) y factores asociados a mal pronóstico79,80. Recientemente se evaluó el papel de la VC y enteroscopia para detectar de lesiones premalignas y malignas en casos de EC complicada, y se encontró un rendimiento general global cercano a 20%, lo que tiene implicaciones en el tratamiento de este grupo de pacientes, debido al pronóstico asociado con la naturaleza de estas lesiones81. Además de lo anterior la VC ayuda a evaluar la respuesta al tratamiento, ya que las biopsias de duodeno no reflejan el grado de mejoría debido a que los cambios de cicatrización de la mucosa se producen en sentido distal a proximal82.
Por lo anterior, y de acuerdo con la evidencia de la literatura médica, el empleo de VC y enteroscopia se justifica únicamente en los casos de EC refractaria o en aquellos que, a pesar de una adecuada respuesta al tratamiento, los síntomas reaparecen o persisten.
25. La estrategia de diagnóstico de EC en las personas que ya siguen una dieta libre de gluten incluye una prueba de reto con 3g gluten/día durante 4-6 semanas cuantificando anti-tTg IgA.
Calidad de la evidencia y fuerza de la recomendación: B1 fuerte a favor del enunciado (totalmente de acuerdo 100%).
La gran popularidad de la dieta sin gluten ha ocasionado que un número cada vez mayor de personas se autodesignen celiacos. En estos casos, el establecer el diagnóstico de EC representa un desafío. Una aproximación simple consistiría en conocer el estado de HLA del sujeto en cuestión. Si no expresa alguno de los haplotipos de riesgo (DQ2/DQ8) la enfermedad se descarta. Pero si se tiene algún alelo, hecho que a priori se espera en el 40% de los casos, es necesario proponer una prueba de reto cuantificando anti-tTg IgA. De manera reciente se ha demostrado que la ingestión de dosis bajas de gluten (3g/día) durante periodos relativamente cortos (2 semanas) es suficiente para inducir una respuesta serológica y cambios histológicos compatibles; sin embargo, debido a que la producción de anticuerpos puede ser lenta en algunos casos, varios expertos sugieren prolongar la dieta 6 o más semanas si las condiciones clínicas lo permiten83. Esta dosis puede alcanzarse consumiendo de forma regular al menos 2 rebanadas de pan de caja por el período establecido.
26. En una persona con síntomas asociados con la ingestión de gluten con serología negativa, histología normal y haplotipos HLA DQ2/DQ8 negativos se descarta EC.
Calidad de la evidencia y fuerza de la recomendación: A1 fuerte a favor del enunciado (totalmente de acuerdo 100%).
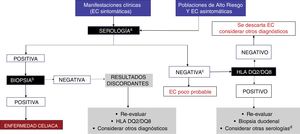
El diagnóstico de EC se establece con pruebas serológicas positivas y biopsia compatible y, en caso de discrepancia, el análisis de alelos HLA clase ii (fig. 2). Si estas pruebas son negativas deberán buscarse causas alternativas que expliquen los síntomas como sensibilidad al gluten (trigo) no celiaca, alergia a gluten o intolerancia a hidratos de carbono fermentables de cadena corta. Para esto deberán realizarse pruebas especiales como la de provocación doblemente a ciegas con gluten/placebo para evaluar la reproducibilidad de los síntomas13. En estos casos conviene referir a los enfermos a centros con interés y experiencia en el campo de la EC2,13,40.
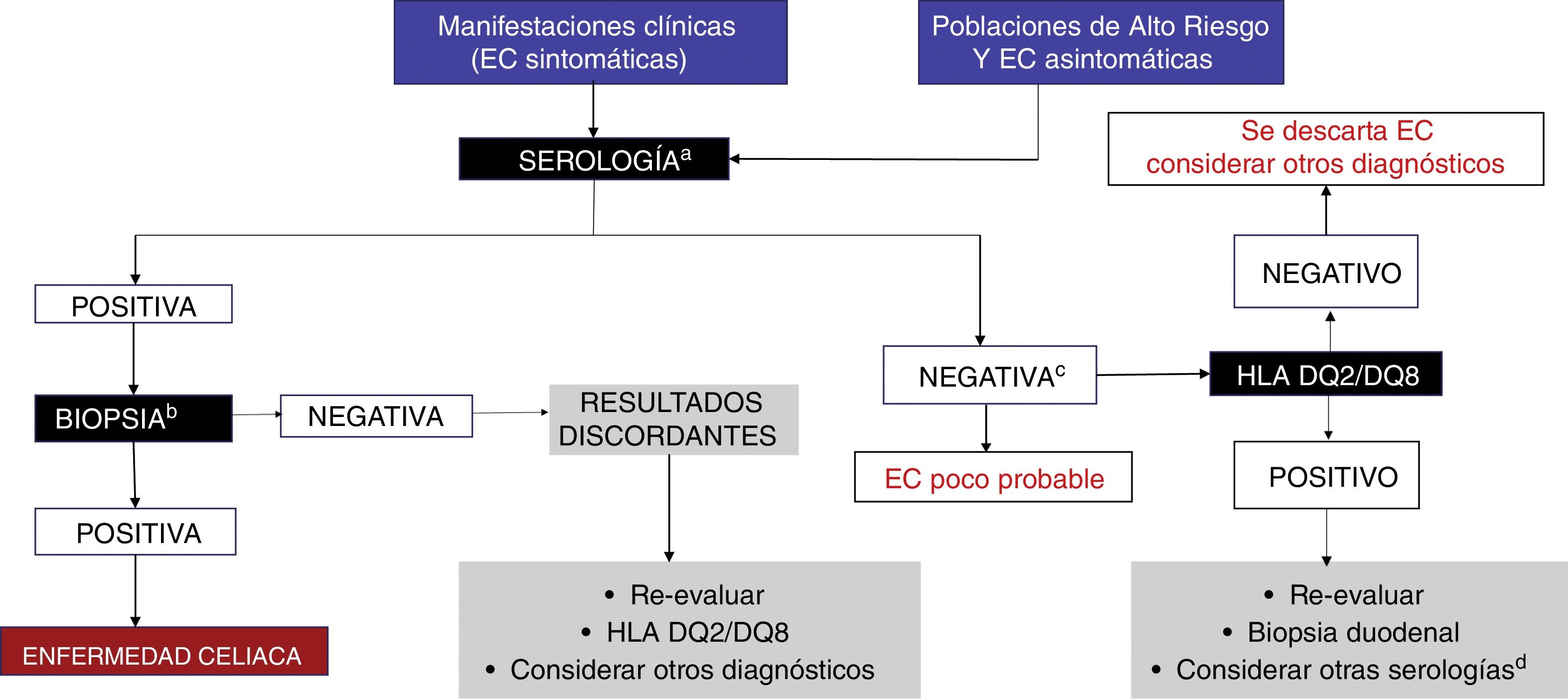
En la figura 3 el grupo de expertos propone un algoritmo diagnóstico para la EC en México.
Algoritmo diagnóstico.
a Se recomienda realizar IgA, transglutaminasa tisular-IgA y péptidos deaminados de gliadina-IgG mientras los sujetos estén recibiendo una dieta con gluten.
b Al menos 4 biopsias de la segunda porción del duodeno y una a 2 de bulbo duodenal.
C Decisión de realizar prueba genética debe individualizarse (en la mayoría de los enfermos no será necesaria).
d Considerar realización de anti-endomisiales.
EMA: endomisiales; PDG: péptidos deaminados de gliadina; tTg: transglutaminasa tisular.
27. La dieta libre de gluten (DLG) es primordial para el tratamiento de la EC. Los enfermos con EC deben adherirse a una dieta libre de gluten durante toda su vida.
Calidad de la evidencia y fuerza de la recomendación: A1 fuerte a favor del enunciado (totalmente de acuerdo 100%).
La DLG es indispensable para el enfermo con EC, ya que actualmente no existe ningún medicamento que evite o prevenga el daño de la mucosa intestinal ante la exposición al gluten. Este tipo de dieta disminuye la morbimortalidad, mejora la osteopenia, osteoporosis84, anemia85, riesgo de enfermedades malignas86 y síntomas gastrointestinales87 y de manera muy importante mejora la calidad de vida de los pacientes con EC88. Esto se logra evitando el trigo (y sus híbridos como triticale, espelta y kamut), cebada, centeno e ingredientes derivados de ellos o alimentos que puedan estar contaminados por estos granos o sus derivados89. Es necesario que los pacientes con EC adopten esta dieta durante toda su vida.
28. El consumo de alimentos con menos de 20ppm de gluten se considera seguro para los pacientes con EC.
Calidad de la evidencia y fuerza de la recomendación: B1 fuerte a favor del enunciado (totalmente de acuerdo 100%).
Aunque se considera que los alimentos que contienen entre 20 y 100ppm tienen una cantidad de gluten tolerable, de acuerdo al Codex Alimentarius, FDA y EFSA el consumo de alimentos y productos alimenticios que contienen menos de 20ppm se considera seguro para los pacientes con EC6,90. Estos se clasifican como «exentos o libres» de gluten91.
Algunas agencias, como Gluten-Free Certification Organization, certifican alimentos que contienen menos de 10ppm92. En México existen asociaciones de enfermos celiacos quienes tienen información completa respecto al contenido de gluten de los alimentos, como ACELMEX (www.acelmex.org.mx) y Celíacos de México (www.celiacosdemexico.org.mx), entre otras. Si se tiene duda respecto a la presencia o cantidad de gluten en el alimento es preferible evitarlo.
29. En el caso de diagnóstico reciente es recomendable una dieta libre de lactosa durante un tiempo variable, dependiendo de la tolerancia del paciente. La avena no contaminada con gluten podrá introducirse 3-6 meses después de mantener una DLG.
Calidad de la evidencia y fuerza de la recomendación: B1 fuerte a favor del enunciado (totalmente de acuerdo 82%, parcialmente de acuerdo 18%).
Es probable que en un inicio el paciente con EC presente absorción deficiente e intolerancia a la lactosa secundaria a la atrofia de vellosidades intestinales93. En este caso, para disminuir los síntomas y mientras la atrofia se revierte, es recomendable ingerir una dieta libre de lactosa94. En niños, de acuerdo a las guías del ESPGHAN, no se recomienda una dieta sin lactosa de forma rutinaria, y en caso de ser necesario se indica por períodos cortos58.
Los pacientes con EC pueden incluir gradualmente avena que no esté contaminada con gluten en una cantidad de 50g (peso seco) al día, lo que corresponde a un consumo seguro y facilita el seguimiento de la DLG al ser una opción más para el paciente95.
30. Todo paciente con EC debe ser evaluado por un nutriólogo con experiencia en el manejo de la enfermedad.
Calidad de la evidencia y fuerza de la recomendación: A1 fuerte a favor del enunciado (totalmente de acuerdo 100%).
La atención multidisciplinaria es indispensable en el tratamiento integral de los pacientes con EC. La Asociación Americana de Dietética recomienda que la terapia nutricia en pacientes con EC sea dirigida y vigilada por un nutriólogo certificado, quien deberá coordinar el cuidado nutricio junto con el resto del equipo de profesionales clínicos96.
31. En la evaluación inicial de un paciente con diagnóstico de EC es conveniente contar por lo menos con la medición de glucosa, electrolitos séricos, perfil hepático, biometría hemática completa, hierro, ácido fólico, vitamina B12, vitamina D y densitometría ósea, para establecer el impacto de la enfermedad en el estado nutricio del paciente.
Calidad de la evidencia y fuerza de la recomendación: B2 débil a favor del enunciado (totalmente de acuerdo 82%, parcialmente de acuerdo 18%).
Debido a que en el momento del diagnóstico de EC es probable que la atrofia de vellosidades haya condicionado absorción deficiente de vitaminas, alteraciones metabólicas y desnutrición, es indispensable utilizar pruebas bioquímicas que permitan valorar el estado nutricio del paciente1,2,40,58. Por lo tanto se recomienda, independientemente de los signos clínicos, que a todo paciente con EC se mida:
- •
Glucosa y electrólitos séricos.
- •
Perfil de lípidos.
- •
Pruebas de función hepática.
- •
Biometría hemática, perfil de hierro, ácido fólico y vitamina B12.
- •
25-hidroxi vitamina D.
- •
Densitometría ósea.
En el caso de pacientes con EC y anemia por deficiencia de hierro se debe recomendar el consumo diario de multivitamínicos con hierro libre de gluten, o una dosis terapéutica adicional de hierro calculada de forma individual. De acuerdo a la Asociación Americana de Dietética la suplementación de hierro y su seguimiento debe repetirse hasta que se encuentren valores normales de hemoglobina96. En el caso de deficiencia de ácido fólico y vitamina B12 la recomendación es similar94.
La realización de una densitometría ósea de forma basal se sustenta en el hecho de que se ha informado que al momento del diagnóstico los pacientes con EC tienen una importante reducción de minerales y de la masa ósea. La densitometría deberá repetirse de acuerdo a los criterios establecidos para la detección y manejo de osteopenia y osteoporosis96–98.
32. La adherencia estricta a la dieta se debe evaluar en las consultas por el grupo tratante (médico y nutriólogo).
Calidad de la evidencia y fuerza de la recomendación: B1 fuerte a favor del enunciado (totalmente de acuerdo 100%).
La evaluación periódica por parte del grupo multidisciplinario tiene como objetivo evaluar los planes de alimentación y dar recomendaciones para evitar que los pacientes tengan exposición inadvertida o contaminación cruzada1,2,97. Incluso se aconseja compartir fuentes de información y educar a los individuos con EC para que revisen los ingredientes en etiquetas de productos alimenticios y suplementos, evitando así la ingestión inadvertida de gluten.
33. En los pacientes adultos con EC se debe garantizar un consumo de al menos 1,000mg calcio/día. En pacientes pediátricos se debe asegurar el consumo de acuerdo a las recomendaciones de ingestión diaria recomendada.
Calidad de la evidencia y fuerza de la recomendación: B1 fuerte a favor del enunciado (totalmente de acuerdo 100%).
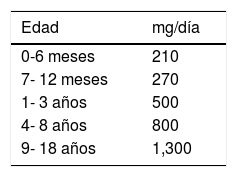
Debido a que los pacientes con EC pueden cursar con osteopenia/osteoporosis es recomendable la suplementación con calcio de acuerdo a los requerimientos diarios por edad (tabla 4)98 a través de una dieta variada, y solo en aquellos casos en los que no sea suficiente se deberá considerar la suplementación de calcio y otros minerales98–101. Los suplementos deben contener vitamina D y estar exentos de gluten.
Requerimientos de calcio de acuerdo a la edad
| Edad | mg/día |
|---|---|
| 0-6 meses | 210 |
| 7- 12 meses | 270 |
| 1- 3 años | 500 |
| 4- 8 años | 800 |
| 9- 18 años | 1,300 |
Adaptada de: Institute of Medicine (US) Standing Committee on the Scientific Evaluation of Dietary Reference Intakes98.
34. El seguimiento tiene como objetivo evaluar la mejoría de los síntomas e identificar la aparición de complicaciones. En niños con EC es indispensable el seguimiento estricto del crecimiento y desarrollo.
Calidad de la evidencia y fuerza de la recomendación: B1 fuerte a favor del enunciado (totalmente de acuerdo 100%).
El tratamiento y la vigilancia de los pacientes con EC es de por vida. Aunque hay poca evidencia sobre los medios más efectivos de vigilancia, se recomienda la evaluación periódica por parte del médico y nutriólogo(a) con el objetivo de controlar la resolución de síntomas, mantenimiento de crecimiento y desarrollo continuo (en caso de población pediátrica), revisión dietética y repetición de pruebas serológicas. Durante estas evaluaciones los profesionales de la salud pueden reforzar los beneficios del cumplimiento de una dieta estricta libre de gluten para toda la vida97,102.
35. El seguimiento de los enfermos con EC debe incluir la cuantificación de anticuerpos anti-tTg IgA al menos cada 6 meses el primer año.
Calidad de la evidencia y fuerza de la recomendación: B2 débil a favor del enunciado (totalmente de acuerdo 95%, parcialmente de acuerdo 5%).
El cumplimiento de la DLG se establece mediante una combinación de síntomas y serología (anti-tTg IgA o anti-PDG IgA o IgG). Los marcadores serológicos dependen del consumo de gluten, de tal forma que sus valores disminuyen o se hacen negativos después de unos meses con DLG, o sus títulos aumentan o se hacen positivos cuando se realiza el reto con gluten97,103,104. En niños la negativización de los anti-tTg IgA y de anti-PDG IgG son marcadores sensibles y específicos de recuperación de la mucosa94. En adultos la recuperación de la mucosa es más lenta y la negativización de los marcadores serológicos no correlaciona con la normalización de la atrofia de la mucosa intestinal105. Debido a que los marcadores, además, no son útiles para detectar ingestión muy baja de gluten, se han desarrollado pruebas para cuantificar la excreción de péptidos inmunogénicos del gluten en orina o heces, y así detectar el consumo reciente de gluten106,107.
36. En caso de EC sin respuesta al tratamiento o recaídas se debe revisar exhaustivamente el cumplimiento de las recomendaciones dietéticas y descartar la posibilidad de contaminación cruzada o ingestión inadvertida de gluten. Incluso deben descartarse otras causas, como uso de medicamentos, procesos infecciosos, inflamatorios o trastornos funcionales.
Calidad de la evidencia y fuerza de la recomendación: B1 fuerte a favor del enunciado (totalmente de acuerdo 100%).
La EC que no responde al tratamiento es aquella en la que el paciente persiste con signos, síntomas o alteraciones de laboratorio típicas de la EC, a pesar de consumir una DLG por 6 a 12 meses. Ocurre en el 10-30% de los pacientes con EC45. Las causas más frecuentes son: exposición inadvertida al gluten (36%), síndrome de intestino irritable (22%), EC refractaria (10%), intolerancia a la lactosa (8%) y colitis microscópica (6%)107. En un estudio de 56 pacientes mexicanos con EC la ingestión inadvertida de gluten se presentó en el 34%108.
En algunos casos la persistencia de los síntomas puede deberse a caseínas de la leche y zeínas del maíz109. Sin embargo, tanto la leche como el maíz son considerados alimentos seguros para la mayoría de los enfermos celíacos.
37. Cuando el paciente no responde a la dieta estricta y se han descartado otras causas, se recomienda endoscopia de tubo digestivo superior con toma de biopsias.
Calidad de la evidencia y fuerza de la recomendación: B1 fuerte a favor del enunciado (totalmente de acuerdo 100%).
La biopsia intestinal es el único método para documentar la normalización de la mucosa intestinal97,104. En adultos la recuperación completa de la mucosa después de iniciar una DLG puede tardar hasta 3 años110, mientras que en los niños la recuperación de la mucosa se alcanza en menos de 2 años111. Si las biopsias intestinales de seguimiento son normales, los síntomas del paciente pueden deberse a otras etiologías. Si las biopsias siguen demostrando atrofia y/o infiltración de linfocitos entonces se debe sospechar de exposición inadvertida al gluten, sobrecrecimiento bacteriano u otras causas de atrofia (por ejemplo, medicamentos como antiinflamatorios no esteroideos) y finalmente EC refractaria112. Para ese último diagnóstico es importante solicitar estudios de inmunohistoquímica y moleculares específicamente para investigar EC refractaria tipo ii113.
38. Los pacientes con EC refractaria deben ser canalizados a centros con experiencia en esta condición.
Calidad de la evidencia y fuerza de la recomendación: B1 fuerte a favor del enunciado (totalmente de acuerdo 100%).
Aunque esta es una condición poco frecuente, estos pacientes se presentan con desnutrición grave y riesgo de linfoma y sepsis, por lo que se recomienda que sean evaluados en centros especializados1,57,114. Aunque no existen ensayos clínicos controlados se pueden utilizar algunos fármacos como budesonida, prednisona y/o inmunosupresores115–118. En los casos en que los pacientes desarrollen linfoma se puede intentar cirugía, quimioterapia e incluso trasplante de médula ósea con eficacia muy limitada119.
39. La DLG estricta y de por vida solamente se recomienda en pacientes con EC.
Calidad de la evidencia y fuerza de la recomendación: B1 fuerte a favor del enunciado (totalmente de acuerdo 100%).
Debido a que la DLG es restrictiva, poco diversa y, en caso de incorporar productos industrializados libres de gluten, su costo es elevado, solo se recomienda en pacientes con EC y alergia al trigo1,2,40,108. En el caso de los pacientes con sensibilidad al gluten no celiaca el papel de la DLG de por vida es controvertido89.
Por otra parte, a pesar del enorme incremento del mercado de productos libres de gluten, no se ha demostrado que evitar la ingestión de derivados del trigo tenga beneficios en la salud en la población general89. Se sabe que los productos libres de gluten tienen menor contenido de proteína (hasta 70% menos), sobre todo las pastas y los panes120. Incluso una DLG se puede asociar con un aumento en el índice de masa corporal, colesterol total y disminución de triglicéridos y homocisteína121. En un estudio reciente en población general no se demostró que la dieta baja en gluten tuviera algún efecto beneficioso en el riesgo cardiovascular, y cuando este se ajustó al consumo de cereales enteros la ingestión de gluten tuvo un efecto protector122. Finalmente, la DLG es difícil de implementar y hasta 3 veces más costosa (>500% para el pan) que una dieta convencional123.
ConclusionesLa epidemiología y factores de riesgo asociados (familiares de primer grado, enfermedades autoinmunes, poblaciones de alto riesgo) a EC son similares en México a los descritos en otras partes del mundo. Se establecen pautas para diagnóstico apropiado y manejo multidisciplinario de los pacientes mexicanos que padecen EC. Se hace hincapié en que la DLG es indispensable solo en las personas con EC confirmada, y que el papel de la dieta estricta en pacientes con sensibilidad al gluten sin EC es aún un tema de controversia.
Responsabilidades éticasProtección de las personas y los animalesLos autores declaran que no se realizaron experimentos en seres humanos o animales para este estudio.
Confidencialidad de los datosLos autores declaran que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que no aparecen datos de pacientes en este artículo.
FinanciaciónEste consenso se realizó con el apoyo económico de la Asociación Mexicana de Gastroenterología, que permitió la participación, transporte y hospedaje durante la votación presencial.
Conflicto de interesesDr. Luis F. Uscanga-Domínguez es miembro del consejo asesor de Asofarma.
Dr. José María Remes-Troche es miembro del consejo asesor de Takeda Pharmaceuticals, Alfa-Wassermann y Asofarma. Recibió fondos para la investigación por Sanfer. Ponente para Takeda, Asofarma, Alfa-Wassermann, Carnot, Almirall y Astra-Zeneca.
Dr. Alberto Rubio-Tapia declara no tener conflicto de intereses.
Dr. Guillermo Rafael Aceves Tavares declara no tener conflicto de intereses.
Dra. Ana María Calderón de la Barca declara no tener conflicto de intereses.
Dr. Ramón Carmona Sánchez es miembro del Consejo Asesor de Mayoly-Spindler, ponente para Mayoly-Spindler y Grünenthal, y participa en protocolos de investigación patrocinados por Laboratorios Senosian y Asofarma.
Dr. Eduardo Cerda Contreras declara no tener conflicto de intereses.
Dr. Enrique Coss-Adame es miembro del consejo asesor de Takeda Pharmaceuticals y Carnot Laboratorios. Ponente para Takeda, Asofarma, Alfa-Wassermann y Carnot.
Dra. María Eugenia Icaza Chávez es ponente para Asofarma, Takeda y Astra-Zeneca.
Dr. Aurelio López-Colombo es ponente de Takeda y Alfa-Wassermann.
Dra. María del Pilar Milke-García declara no tener conflicto de intereses.
Dr. Miguel Morales Arámbula es ponente para Takeda y Grünenthal.
Dr. Mario Peláez-Luna declara no tener conflicto de intereses.
Dr. París Ramos Martínez declara no tener conflicto de intereses.
Dr. Sergio Sánchez Sosa declara no tener conflicto de intereses.
Lic. en Nutrición María Cristina Treviño Mejía declara no tener conflicto de intereses.
Dr. Rodrigo Vázquez Frías es ponente para Nestlé y Sanofi.
Dra. Liliana Beatriz Worona Dibner declara no tener conflicto de intereses.
Dr. Luis Eduardo Zamora-Nava declara no tener conflicto de intereses.