Los inhibidores de la bomba de protones (IBP) son el estándar de referencia para el tratamiento de las enfermedades relacionadas con el ácido. En la enfermedad por reflujo gastroesofágico (ERGE) la supresión ácida se asocia con una alta tasa de cicatrización de la mucosa; sin embargo, la respuesta sintomática difiere entre los fenotipos endoscópicos. Las manifestaciones extraesofágicas tienen buena respuesta clínica en quienes presentan una exposición anormal al ácido (prueba diagnóstica) en el esófago.
Los IBP han demostrado su efectividad para disminuir la intensidad sintomática en el reflujo nocturno y en los trastornos del sueño, mejorando la calidad de vida y la productividad laboral. Esto se logra, en ocasiones, mediante las modificaciones al fraccionar o aumentar la dosis, así como la galénica.
Estos fármacos no están exentos de aspectos controversiales en relación con los eventos adversos asociados. El desarrollo tecnológico está encaminado a mejorar el rendimiento del IBP mediante el incremento de la vida media, la concentración máxima y el área bajo la curva de las concentraciones plasmáticas mediante la galénica, y por otra parte a crear fármacos más seguros y tolerables.
En esta revisión nos enfocamos a los mecanismos de acción, las propiedades farmacocinéticas y los avances tecnológicos para incrementar el rendimiento farmacológico de un IBP.
Proton pump inhibitors are the reference standards for the treatment of acid-related diseases. Acid suppression in gastroesophageal reflux disease is associated with a high rate of mucosal cicatrization, but symptom response differs among endoscopic phenotypes. Extraesophageal manifestations have a good clinical response in patients that present with abnormal acid exposure (diagnostic test) in the esophagus.
Proton pump inhibitors have shown their effectiveness for reducing symptom intensity in nighttime reflux and sleep disorders, improving quality of life and work productivity. That can sometimes be achieved through dose modifications by splitting or increasing the dose, or through galenic formulation.
Proton pump inhibitors are not exempt from controversial aspects related to associated adverse events. Technological development is directed at improving proton pump inhibitor performance through increasing the half-life, maximum concentration, and area under the curve of the plasma concentrations through galenic formulation, as well as creating safer and more tolerable drugs.
The present review is focused on the mechanisms of action, pharmacokinetic properties, and technological advances for increasing the pharmacologic performance of a proton pump inhibitor.
La burimamida (1972) fue el primer antagonista de los receptores-H2 (ARH2) validado en humanos. El prototipo fue la cimetidina, descubierta en 1976, y después vinieron la ranitidina (1981), la famotidina (1981) y la nizatidina (1987)1-3.
La carrera por la supresión ácida con los inhibidores de la bomba de protones (IBP) se inició con el descubrimiento del timoprazol (1975)2, asociado a toxicidad (tiromegalia y atrofia del timo)3, y se desarrolló con el omeprazol (1979) al modificar el anillo de bencimidazol4. Sin embargo, las inquietudes sobre los efectos de la supresión prolongada restringieron la dosis inicial (20mg)4,5. Más tarde aparecieron el lansoprazol 30mg (1995), el rabeprazol 10mg (1999) y el pantoprazol 40mg (2000).
Los IBP tienen una vida media (t1/2) plasmática de 1-1.5h6. Son formas racémicas con dos isómeros equimoleculares (izquierda-levógiro y derecha-dextrógiro) con igual fórmula química pero diferente estructura, propiedades y configuraciones. El s-enantiómero (levógiro) del omeprazol, el esomeprazol (2000), fue creado mediante la isomería6.
La adición de una capa de bicarbonato de sodio (2006) al omeprazol logró la rápida alcalinización gástrica, la activación de las bombas de protones (BP) y el incremento de su absorción, reflejándose en la concentración máxima [Cmax]7. El dexlansoprazol (R-lansoprazol) fue creado al girar la molécula de lansoprazol; su rendimiento aumentó al agregarse un sistema de liberación dual que produjo una mayor área bajo la curva de la concentración plasmática [AUC24]8.
Los IBP son la tercera clase de drogas más vendidas en el mundo y no han estado exentos de controversias con respecto a su seguridad. Más de 21 millones de personas recibieron una prescripción en Estados Unidos, y las ventas anuales fueron reportadas en $13,900 millones9,10. En 2010 la Food and Drug Administration (FDA) requirió que los fabricantes advirtieran del riesgo asociado a fracturas11, y después, de hipomagnesemia12, eventos cardiovasculares (EACV)13 (2013), demencia14, insuficiencia renal crónica15, neumonía adquirida en la comunidad16 y osteoporosis10 (2016).
Vaezi et al.17 señalaron que es responsabilidad de los investigadores y de los medios de comunicación evitar una «epidemia de ansiedad» exhortando a «un enfoque más crítico y responsable para que los resultados débiles no se presenten al público como hechos».
La evidencia de estas asociaciones causales es muy débil, con inconsistencias en el tamaño del efecto debido a los diseños metodológicos. Por ejemplo, el riesgo de EACV fue mayor en estudios observacionales comparado con los aleatorios (RM 1.25 vs. 0.89, p=0.85)18. La tabla 1 resume las estimaciones del tamaño del efecto en los eventos adversos.
Estimaciones más recientes del tamaño del efecto
| Evento adversoHeterogeneidad | Tamaño del efecto (IC 95%) | |
|---|---|---|
| Infección enteral | OR 2.55 (1.53-4.26) | Sí |
| Neumonía adquirida-comunidad | OR 1.49 (1.16-1.92) | Sí |
| Diarrea por Clostridium difficile | OR 1.26 (1.12-1.29) | Sí |
| Fractura de cadera | OR 1.26 (1.16-1.36) | Sí |
| Demencia | HR 1.44 (136-1.52) | N/A |
| Deficiencia de vitamina B12 | HR 1.83 (1.36-2.46) | Limítrofe |
| Falla renal crónica | RR 1.36 (1.07-1.72) | Sí |
| Infarto de miocardio | OR 1.16 (1.09-1.24) | N/A |
OR: odds ratio; RR: riesgo relativo.
Fuente: Laheij et al.16.
La fuerza de la asociación (criterios de Hill) evalúa la causalidad en los estudios observacionales. Podemos ver que aunque los resultados en la mayoría de los estudios reportan una significancia estadística (p<0.05), la razón de momios (RM) es <3.0, con amplios intervalos de confianza del 95% (IC95%), lo cual traduce una gran heterogeneidad de los datos o un tamaño muestral pequeño.
Una RM>3.0 es probable que tenga una asociación causal, pero la mayoría de los reportes caen en zonas de «sesgo potencial» (0.33-3.0); es importante señalar que la mayoría de los fenómenos naturales son multifactoriales, por lo cual no es sorprendente el modesto tamaño del efecto17,19. En general, se ha recomendado el uso adecuado (indicaciones aprobadas), a la dosis efectiva más baja, y que en los no-respondedores al IBP no debe aumentarse la dosis ni mantener una terapia continua20.
Haciendo una analogía, la carrera por la supresión ácida representa la lucha entre diferentes caballeros medievales, con todas las herramientas disponibles (estructura, dosis, isomería, mecanismos de liberación, etc.), por alcanzar la fortaleza (la célula parietal) en donde se encuentra escondido el Santo Grial (la enzima secretora del ácido).
La secreción ácida: un universo ácidoEl sistema nervioso entérico es la red neural que inerva el estómago y se origina en los plexos mientérico de Auerbach y en el submucoso de Meissner. Las fibras aferentes (80-90%) y eferentes (10-20%) del nervio vago interactúan con el control parasimpático del corazón, de los pulmones y del tracto digestivo21-23.
La fase cefálica de la secreción ácida, mediada por mecanismos colinérgicos y vagales, se inicia con el solo ver, pensar, probar u oler la comida, y con la deglución. Es un reflejo, «todo pasa a través de los sentidos». En la fase gástrica se produce la máxima secreción e involucra al nervio vago y a la gastrina. Las terminaciones aferentes vagales detectan el alimento y la distensión gástrica libera la acetilcolina al estimular los receptores23.
La célula parietal: el origen del ácidoLa célula parietal (CelP) secreta ácido clorhídrico (HCl) y factor intrínseco24-26. La secreción ácida se produce en respuesta a estímulos neurocrinos, paracrinos y endocrinos. Los receptores de la membrana basolateral responderán a los estímulos de la histamina (H), de la acetilcolina y de la gastrina. La gastrina activa las células enterocromafines liberando H, que estimula a la CelP activando a la adenilciclasa para producir el AMP cíclico (3’,5’-monofosfato cíclico de adenosina). La H cambia la morfología de la CelP en reposo para que entre en actividad. Las vesículas del citosol conteniendo a la enzima H+/K+ ATPasa se fusionan a la membrana apical exponiéndose al canalículo25,26.
La enzima H+, K+-ATPasa abre la compuerta y se produce el ácidoEsta enzima α, β-heterodimérica tiene dos componentes. El sitio que aumenta la velocidad de reacción química (catalític<) está en la subunidad α (PM∼100kDa). El aminoácido Asp386 es el sitio de unión con la ATP para la fosforilación15. La enzima tiene alta afinidad por el [H+] del lado citoplásmico (conformación E1).
El paso inicial es la unión reversible al ATP (ausencia [K+]). La transferencia de γ-fosfato de ATP al sitio Asp386 de la unidad catalítica (E1-P·H+) es mediada por [Mg2+]. El siguiente paso es la conformación E2 (E1PH3O+ a E2PH3) con alta afinidad por [K+] y baja para el [H3O+]. Este proceso libera [H3O+] e incrementa la unión al [K+]15.
El despertar del gran dragón: la secreción ácidaLa secreción ácida se produce con el intercambio iónico [H+] (intracelular) por [K+] (luminal). Por cada [H+] transportado al canalículo (H+, K+-ATPasa) el transportador de la membra [Cl−]/[HCO3] entregará [HCO3−] al plasma y [Cl−] al citosol. Este último actúa como contraión del flujo del [K+] equilibrando las cargas (secreción electroneutral). La estimulación de la enzima H+, K+-ATPasa es el paso final de la secreción ácida25.
Los sujetos normales tienen una aumento nocturno (10:00pm-2:00am) de la secreción ácida, siendo continua con grandes variaciones de noche a noche y de sujeto a sujeto26. En la vigilia es mínima si no hay estimulación del alimento. En contraste, en la úlcera duodenal hay un incremento en el volumen y la concentración. Sin embargo, no existe correlación entre las etapas del sueño con la secreción y concentración ácida15,27,28. El horario de las comidas es el principal reloj regulador de la secreción ácida.
Inhibidores de la bomba de protonesEl blanco molecularLos IBP tienen como blanco molecular el bloqueo de la enzima H+, K+-ATPasa. Las propiedades farmacocinéticas (biodisponibilidad, metabolismo y variabilidad genética) afectan su rendimiento farmacológico. La protonación (adición H+) en un ambiente ácido es necesaria para la activación de estas prodrogas. La liberación retardada y la mayor t1/2 mejorarán el rendimiento (biodisponibilidad) al aumentar el [AUC24]29-32.
Estos fármacos son metabolizados por CYP2C19 y CYP3A4, por lo que los factores que interfieren con la actividad enzimática afectarán el [AUC]. Las variaciones CYP2C19 son el factor farmacogenético más importante que afecta a la respuesta33.
Mecanismos de acciónEstas bases débiles tienen un anillo de piridina y otro de bencimidazol unidos por un grupo metilsulfinilo con variaciones (anillo lateral)34. El recubrimiento entérico es disuelto y el fármaco es absorbido al alcanzar el duodeno (pH>5.6). La molécula no protonada (ionizada) puede penetrar libremente las membranas lipídicas. El pKa es el pH al cual la mitad de la molécula estará ionizada y la otra no35.
Esta prodroga se acumula selectivamente en la CelP. Este es el único compartimento del organismo rodeado por una membrana con pH<4, en donde el pH es 1,000 veces más ácido que la sangre26,27. La acumulación estará determinada por su pKa1 (∼4 omeprazol, lansoprazol y pantoprazol, ∼5.0 rabeprazol y 5.38 ilaprazol)35-37.
La primera protonación (piridina) produce que la molécula quede atrapada dentro de la CelP. La estabilidad al ácido depende del pKa1; el menor pK1 de pantoprazol le confiere mayor estabilidad (pantoprazol 3.83, omeprazol 4.0, lansoprazol 3.83 y rabeprazol 4.53)38,39. La reacción con las cisteínas se produce durante la segunda protonación (Nimidazol 2C-bencimidazol) en el canalículo (pH<1) a un pKa2 ∼1. Debido al pKa2 (0.6) del rabeprazol su activación es mayor40-42.
La tasa de activación dependerá de la protonación. El pKa y el pH influyen en la acumulación, activación y estabilidad del ácido34,35. La supresión se logra mediante la unión de la molécula activa a enlaces covalentes disulfuro (S=S) de la cisteína38,41,42.
La ingesta del IBP (30 a 60min) antes del primer alimento del día asegurará que un mayor número de BP estén activas. El pH intragástrico es mayor después del desayuno que con la cena (5.0 vs. 4.5, p<0.01). La [Cmax] y la [AUC] de lansoprazol y esomeprazol disminuirán con los alimentos, a diferencia del pantoprazol, omeprazol y rabeprazol37.
Unión a cisteínas en el dominio transmembrana (TM) de la CelPLa molécula activa forma enlaces estables con dos cisteínas (Cys321, Cys813, Cys822 y Cys892). Los IBP se unen a Cys813 (TM5 y 6) fijando la enzima (configuración E2); la selectividad por la otra cisteína es variable31. Omeprazol, lansoprazol y rabeprazol se unen a Cys892, mientras que lansoprazol y rabeprazol, a Cys321. Debido a que pantoprazol se une en el otro 50% a Cys822 localizada en TM más profundas, los enlaces S=S permanecerán estables, ya que no son accesibles al efecto reductor del glutatión31,32.
Si la recuperación de la secreción fuera debida a la síntesis de nuevas BP al suspender el IBP, entonces el tiempo de supresión debiera ser cercano a la t1/2 de la BP (∼48h). Aunque se cree que los enlaces S=S son estables, la recuperación ácida varía entre los IBP, lo que sugiere que la t1/2 de recuperación de la bomba es diferente40, siendo más rápida con lansoprazol (∼13h) y omeprazol (∼27h) que con pantoprazol (∼46h), que es más cercana a la esperada (54h) si la neosíntesis fuera el único mecanismo de restauración41-44.
Existen otros factores que interfieren con la inhibición secretoria: 1)BP; 2)neosíntesis continua (25%/día), y 3)reversión parcial de los enlaces S=S con algunos IBP25,26,45.
Estabilidad en medio ácido del IBPSe requieren ∼3días para alcanzar un estado inhibitorio estable, es decir, alcanzar el equilibrio entre la inhibición de las BP activas, la estimulación de las BP inactivas, al desaparecer el IBP de la sangre, y la neosíntesis de bombas46.
Una dosis inhibirá hasta el 66% de la secreción ácida, ya que ∼70% de las BP activas estarán disponibles. Una vez alcanzada la dosis óptima, el aumentar la dosis no impactará en la efectividad, a diferencia de si se aumenta la frecuencia posológica46.
Con el alimento, ∼80% de BP activas pueden ser inhibidas (primera dosis de IBP). El segundo día tendremos las nuevas BP más el 20% no inhibidas el primer día. El equilibrio se repetirá hasta alcanzar un estado farmacodinámico estacionario (número de BP inhibidas=sintetizadas)43.
La t1/2 de la BP en la rata es de ∼54h. El 20% de nuevas BP se sintetizarán mayormente durante la noche. La dosis nocturna de IBP no aumentará la inhibición de la secreción nocturna del ácido, ya que habrá desaparecido para cuando sea evidente la secreción durante la noche44,45.
Breve explicación de la farmacocinética y la farmacodinámicaLa farmacocinética trata de lo que le sucede al fármaco (concentración) desde el momento en que se administra (dosis) hasta su eliminación total del cuerpo. La farmacodinámica estudia lo que le sucede al organismo por la acción del fármaco46-48.
Las características fisicoquímicas, la forma farmacéutica, el lugar de absorción, la eliminación y el «primer paso hepático» influyen en la absorción. Los IBP son bases débiles ionizadas (polares) e hidrosolubles (permeables) que al activarse se convierten en liposolubles (no ionizadas y no permeables)46,47.
Una base es más débil si su pKa es menor. Es mejor absorbida en el intestino (>pH). En un medio ácido, la base aumentará el número de moléculas no ionizadas al aceptar protones. El pH para el cual la mitad de las moléculas de un ácido ceden su protón es el pKa37,47,49,50.
La capa entérica (pH-sensible/tiempo) evita la degradación o la activación protegiendo al núcleo del ácido para su entrega en un determinado sitio51-54. Varios factores influyen en el comportamiento del recubrimiento55,56: a)polímero (pH-umbral); b)composición; c)núcleo, propiedades de hinchamiento y desintegración, y naturaleza (dosificación); d)imperfecciones (integridad); e)espesor de las capas; f)condiciones de prueba in vitro (composición, pH, fuerza iónica e intensidad de agitación), y g)condiciones gástricas.
El IBP es transportado en la sangre (plasma, eritrocitos o proteínas) para su distribución, que es dependiente de la fijación a las proteínas (omeprazol 95%, esomeprazol 97%, lansoprazol 97%, dexlansoprazol 96%, pantoprazol 98% y rabeprazol 96.3%)57,58.
Las transformaciones químicas reducen la liposolubilidad y la actividad biológica del IBP. Las enzimas modifican la molécula mediante reacciones químicas clasificadas de acuerdo a su funcionalización (fase1) o la de biosíntesis (fase2)57,58.
- •
Reacciones de fase 1 (oxidación e hidrólisis). La pérdida de la actividad se producirá al introducir o exponer un grupo funcional produciendo sustancias más polares. La reacción más importante es la oxidación.
- •
Reacciones de fase 2 (conjugación con ácido glucurónido, con glicina o con ácido acético). Un fármaco o metabolito se une con un sustrato. El enlace S=S entre el grupo funcional (droga) y el ácido glucurónido, sulfatos, aminoácidos o acetato producirá compuestos altamente polares, inactivos, que serán excretados por la orina y las heces.
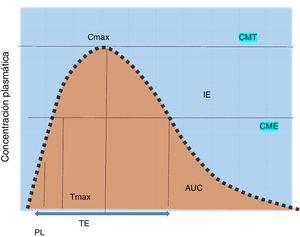
Son hemoproteínas que absorben la luz (450NM). La mayoría de estos f rmacos son biotransformados por CYP3A4 (50%), CYP2D6 (20%), CYP2C9 y CYP2C19 (15%). La inhibición o la inducción de las interacciones metabólicas de una o más enzimas dependerán de la dosis y de la unión a la enzima30. Para predecir el efecto de las concentraciones tisulares se calculan sus concentraciones plasmáticas del fármaco47,48 (fig. 1).
Concentración plasmática del fármaco y efectos.
AUC: área bajo la curva; Cmax: concentración máxima; CME: concentración efectiva mínima del efecto buscado; CMT: concentración efectiva mínima de la reacción adversa; IE: ventana terapéutica; PL: período de latencia; TE: tiempo de exposición; Tmax: tiempo máximo.
Fuente: Armijo47.
Es el tiempo transcurrido desde la ingesta hasta el inicio del efecto farmacológico, es decir, la concentración máxima esperada (fig. 1).
Biodisponibilidad (fracción disponible)Es la velocidad y la cantidad inalterada de la droga que llegará a la circulación sistémica; su biodisponibilidad se mide con el [AUC24]48.
Vida media plasmática (t1/2) en horasEs el tiempo que transcurre para que su concentración disminuya a la mitad. Si la t1/2 es menor deberá administrarse más frecuentemente. Para alcanzar la estabilización se requieren de 4 a 5días, ya que el tiempo para disminuir de 150 a 75mg es el mismo que de 50 a 25mg. Es decir, en cada t1/2 se eliminará el 50%, el 75% en la segunda, el 87.5% en la tercera y >95% con 4-5 t1/240,47-49.
Concentración máxima [Cmax] μg/mlEs la medida farmacocinética que determina la dosis. Es la velocidad de absorción51-53.
Área bajo de la curva de la concentración plasmáticaEs la concentración plasmática de la droga o [AUC24] (μg h/ml). Las formulaciones equimolares pueden tener diferente [AUC24] con similar velocidad de absorción, o similar [AUC24] y diferente velocidad54,55.
Después de la administración repetida, los IBP con farmacocinética no-lineal (omeprazol y esomeprazol) tendrán un aclaramiento disminuido (⇑[AUC24]) por la inhibición de CYP2C19. Los otros IBP tienen una farmacocinética lineal56-59.
Eficacia de los IBP en la enfermedad por reflujo gastroesofágicoLa enfermedad por reflujo gastroesofágico (ERGE) consiste en el regreso del contenido gástrico hacia el esófago provocando síntomas que afectan el bienestar, causando o no complicaciones60. Según el Consenso de Montreal, se clasifica en: 1)síndromes esofágicos: sintomáticos o con daño de la mucosa, y 2)síndromes extraesofágicos: con asociación establecida o propuesta61.
Prueba diagnóstica con IBPEn ausencia de datos de alarma, es el enfoque inicial para tratar los síntomas-ERGE típicos19. Sin embargo, la especificidad (17-29%) y el cociente de verosimilitud (+) (0.5 a 1.5) para el diagnóstico son subóptimos62, ya que la respuesta no establece ni excluye el diagnóstico. El IBP cambia el pH (material refluido) pero no tiene efecto directo sobre el reflujo63,64. En la pirosis no investigada, la respuesta al IBP (8semanas) es del 70%, con un número necesario a tratar (NNT) de 2.2 para la mejoría sintomática65.
Esofagitis erosiva y no erosivaLa efectividad del IBP demostrada para la cicatrización es del 86% (NNT=1.8)66 y la respuesta sintomática es del 72%67,68. Son más efectivos que los ARH2 y los procinéticos (RR 0.37 vs. 0.77 vs. 0.86), independientemente de la gravedad, de la dosis y de la duración del tratamiento69. En la enfermedad por reflujo no erosiva (ERNE) el RR fue 0.73 (IBP), 0.84 (ARH2) y 0.72 (procinético)70.
La respuesta sintomática (EE 56% vs. ERNE 37%; p=0.0001) y la ganancia terapéutica en síntomas-ERGE es mayor para el fenotipo erosivo (−48% [IC95%: 24.6-93.8] vs. 27.2% [IC95%: 20.9-35.3]), mientras que la respuesta-placebo es similar (9.5% vs. 7.5%; p=0.05)71.
La cicatrización fue del 8% a favor de esomeprazol 40mg sobre omeprazol 20mg (RR1.08). En la contrastación con otros IBP, esomeprazol demostró superioridad al omeprazol72 (tabla 2). En otro estudio clínico aleatorizado [n=2,425 EE H. pylori(−) - serología], la tasa también fue superior (esomeprazol 93.7% vs. omeprazol 84.2%, p=0.001)73.
Diferencias de riesgo relativo a 4 y 8 semanas entre los IBP versus omeprazol 20mg
| IBP versus omeprazol 20 mg | Duración del tratamiento | |
|---|---|---|
| 4 semanas | 8 semanas | |
| Esomeprazol 40 mg | 1.14 (IC 95%: 1.10, 1.18) | 1.08 (IC 95%: 1.05, 1.10) |
| Lansoprazol 30 mg | 1.02 (IC 95%: 0.97, 1.08) | 1.01 (IC 95%: 0.97, 1.05) |
| Pantoprazol 40 mg | 1.00 (IC 95%: 0.94, 1.07) | 1.00 (IC 95%: 0.96, 1.04) |
| Rabeprazol 20 mg | 0.93 (IC 95%: 0.84, 1.03) | 0.93 (IC 95%: 0.86, 1.01) |
| Lansoprazol, pantoprazol, rabeprazol | 1.00 (IC 95%: 0.97, 1.04) | 1.00 (IC 95%: 0.97, 1.03) |
Fuente: Richter et al.72.
Un metaanálisis reportó que esomeprazol aumentó 5% [RR1.05] la probabilidad de cicatrización (n=15,316) (reducción del riesgo absoluto4% y NNT25). El NNT fue en esofagitisA 50, B 33, C 14 y D 8; la mejoría de la pirosis (4semanas) fue del 8% (RR1.08). A pesar de su mayor efectividad, el tamaño del efecto fue modesto, limitado a la severidad (C o D), y sin diferencias para la pirosis74.
La respuesta-IBP difiere entre fenotipos si el diagnóstico se basa en las pruebas funcionales [pH(+)0.73 vs. pH(−)0.72] o en síntomas-ERGE (50.5%). La respuesta es mayor en los erosivos (57%) en comparación con ERNE (49%) o no-ERGE (35%)75.
Persistencia sintomática a pesar del IBPExisten diferencias entre la dosis estándar o duplicada con fluctuaciones (10-81%) en el %t pH<4 (gástrico) pero no en el promedio de pH esofágico (p=0.0001) entre los IBP65,75,76.
Entre el 35 y el 42% de ERNE tendrán una exposición esofágica al ácido (EAA) normal, que complica las predicciones de la respuesta debido a su heterogeneidad y refractariedad64,75-77. Esta última puede explicarse ya que el diagnóstico está basado en síntomas, a que la persistencia de eventos de reflujo débilmente ácidos tiene extensiones al esófago proximal, y por la hipersensibilidad visceral78.
El índice de síntomas (IS) (correlación de los eventos de pirosis con los episodios de reflujo ácido) puede identificar dos subtipos en los pacientes con exposición normal al ácido: la hipersensibilidad al reflujo (IS>50%) y la pirosis funcional (IS<50%)79,80.
La composición del reflujo, la sensibilización con EAA y el aclaramiento lento de bolo juegan un papel en la percepción de la pirosis. El «vapor de ácido» puede percibirse como pirosis y regurgitación73, siendo mayor si el gas está en el material refluido aun sin EAA81,82.
La IIM-pH 24h define con mayor especificidad a IBP-refractarios83,84. Los síntomas pueden producirse a pH>4, 5 o 6. La falla puede deberse a una mala clasificación de la enfermedad; ∼20% (15-27%) no responderán a la dosis estándar aun con un adecuado diagnóstico80.
Los criterios de Johnson-DeMeester (%t pH<4 para >4.2% de las veces) dan el mismo peso a soluciones con pH4 y pH1 (diferencia 1,000 veces) pero tienen baja sensibilidad para detectar períodos cortos de alta acidez (pH<2) asociados a síntomas85.
La hipersensibilidad visceral es el principal mecanismo responsable del dolor torácico no cardiaco (DTNC) y de las alteraciones funcionales, la ERGE refractaria y la hipersensibilidad al reflujo86,87. El dolor es inducido por la distensión mecánica, el ácido, la temperatura y la osmolaridad88-90. La EAA(+) crónica aumenta la permeabilidad tisular con el paso de moléculas sensibilizadoras de las terminaciones nerviosas sensoriales aferentes90,91.
Manifestaciones extraesofágicas y ERGELa ganancia terapéutica del IBP sobre el placebo es baja (17%) en la regurgitación92,93 y en síntomas atípicos (DTNC, pulmonares y laríngeos). En el DTNC la respuesta al IBP aumentará si existe un reflujo ácido [EAA(+) 56-85% vs. EAA(−) 0-17%]94,95. La prueba terapéutica tiene una sensibilidad del 84% y una especificidad del 74% para predecir reflujo (excluyendo cardiopatías)96,97.
Es difícil establecer la asociación causal en las manifestaciones extraesofágicas. La exactitud diagnóstica de la pH-24h es baja, mientras que la pH-impedancia intraluminal multicanal (IIM-pH24h) ayudará a evaluar la composición del reflujo (física y química)98-100. La pirosis/regurgitación están ausentes en el 40-60% de asmáticos, en el 57-94% de laringitis y el 43-75% de tos crónica101.
Laringitis por reflujo o reflujo faringolaríngeoLa ERGE es una causa de inflamación laríngea que puede provocar ronquera, disfonía, odinofagia, carraspeo, tos crónica, globus, disfagia, goteo posnasal y laringospasmo101,102. La respuesta al IBP es similar al placebo en el reflujo no-ácido103,104 con mínima ganancia terapéutica (0.04%)103. Otros han informado superioridad del IBP (93 vs. 29%)105,106.
Tos crónica por reflujoEs diurna, en posición vertical, durante la fonación, al levantarse de la cama y asociada a alimentos. No hay una prueba diagnóstica definitiva. La pH-24h tiene una especificidad del 66%107. La mejoría y la resolución sintomática con IBP son raras108.
Asma por reflujoLos síntomas nocturnos y los parámetros funcionales (pulmonar) responden mejor al IBP en las personas con pirosis y daño mucoso106. No se recomienda el uso de IBP en asmáticos mal controlados, a menos que presenten síntomas-ERGE107.
Respuesta clínica al IBPMantenimiento para evitar la recurrenciaEl IBP (largo plazo) disminuye la recurrencia108,109 y es superior al placebo (93% vs. 29%)110,111.
IBP y respuesta clínica globalEl efecto global sobre el placebo en la cicatrización fue de 11.4 (IC95%: 8.17-16.3) y en la mejoría sintomática de 4.2 (IC95%: 3.25-5.48). En la tabla 3 se resumen los datos112.
IBP comparado contra placebo Razón de Momios (IC95%) para la curación de la esofagitis
| Dosis IBP mg/día | Omeprazol | Pantoprazol | Rabeprazol | Lansoprazol | Esomeprazol |
|---|---|---|---|---|---|
| 10 | − | − | 9.6 (5.63,14.62) | − | − |
| 15 | − | − | − | 8.23 (4.87,12.8) | − |
| 20 | 10.2 (6.93,14.5) | 6.88 (4.23,10.8) | 12.0 (7.78,18) | − | 11.7 (7.33,17.7) |
| 40 | 14.9 (9.5,23.1) | 11.6 (8.16,16.1) | 15.1 (9.58,23.5) | − | 15.5 (10.2,22.0) |
| 30 | − | − | − | 12.3 (8.6,17.0) | − |
| 60 | − | − | − | 14.1 (9.44,21.1) | − |
Fuente: Zhang et al.111.
Este es un efecto de clase visto con todos los IBP de liberación tardada. De los consumidores de IBP (dos veces/día), ∼70% tendrán una caída nocturna (10:00pm-6:00am) de pH<4 gástrico (>1h continua)113,114. Con una sola dosis diurna, el escape ácido nocturno ocurrirá más tempranamente que con los horarios de dosificación nocturnos, hacia las 11:00pm115.
Dosis, isomería y mecanismos para un mayor rendimientoDosis fraccionada versus aumentadaEl efecto supresor de una dosis diurna de esomeprazol fue superior a otros IBP115. La dosis fraccionada (20-20mg) tuvo mejor control del pH (pH esomeprazol 3.9±1.3 vs. pantoprazol 5.1±0.9; p=0.05) y del escape ácido nocturno (pH esomeprazol 5.1±0.9 vs. pantoprazol 3.9±1.3; p=0.05; %t pH>4 pantoprazol 48.9±22.8 vs. esomeprazol 68.1±19.7, p=0.05)116.
La dosis aumentada (40-40mg) de esomeprazol fue más efectiva que el pantoprazol para el control pH-24h intragástrico (6.4 vs. 5.1; p<0.00005), duración del efecto (21.1h vs. 16.8h, p<0.0001), pH>4/24h (96.7% vs. 56.7%; p=0.0002) y el control nocturno del ácido (85.4% vs. 63.6%; p=0.0001)117.
Otro estudio reportó que el efecto fue dependiente de la dosis (40-40mg 19.2h [80.1%], 20-20mg 17.5h [73%] vs. 40mg 14.2h [59.2%]) con un mejor control del %t pH>4 nocturno [83.7% vs. 79.2% vs. 57.9%]118.
Isomería, acarreadores y mecanismos de liberaciónEsomeprazolLa mayor duración del efecto supresor del ácido con esomeprazol 40mg (14h), en comparación con otros IBP como omeprazol 20mg (12.1h), lansoprazol 30mg (11.8h), rabeprazol 20mg (11.5h) y pantoprazol 40mg (10.0h), ha sido relacionada con la isomería119; sin embargo, el efecto aditivo del acarreador magnésico no fue evaluado.
Pantoprazol magnésicoEl magnesio aumenta la biodisponibilidad del pantoprazol. A dosis bioequivalentes, esomeprazol vs. pantoprazol, ambos magnésicos mostraron similares tasas de cicatrización (81% vs. 79%, p=NS); sin embargo, el alivio sintomático fue superior con el pantoprazol-Mg (91.6% vs. 86.0%, p=0.037)120. La severidad sintomática tuvo una reducción del 73% (intención a tratar o ITT) y 80% (por protocolo)121. En pacientes mexicanos, los síntomas-ERGE nocturnos (42.7%) tuvieron mayor probabilidad de tener síntomas extraesofágicos relacionados a reflujo (p<0.001), los cuales respondieron satisfactoriamente con el uso del pantoprazol-Mg122.
S-pantoprazolEl pantoprazol es una mezcla racémica de S(+) y R(+)-pantoprazol. El S-isómero disminuye la variación (metabolismo), tiene una farmacocinética predecible, es más efectivo y menos dependiente del citocromo (2C19)123. La isomería aumenta su potencia (1,5-1,9 veces) y también su efectividad (3-4 veces)124. El uso de dosis bajas de S-pantoprazol es igualmente efectivo que R(+) 40mg en la cicatrización (p=1) y logra un mejor control sintomático125. Otro estudio reportó tasas similares de cicatrización (94% vs. 97%) entre S-pantoprazol y R-pantoprazol126. Sin embargo, no hay estudios clínicos aleatorios que comparen S-pantoprazol con IBP modificados de segunda o tercera generación en todo el espectro clínico de la ERGE.
DexlansoprazolEl R-enantiómero del lansoprazol (DMR) utiliza un mecanismo de liberación retardada dual que incrementa el [AUC24]. Constituye >80% del lanzoprazol circulante post-administración oral, tiene menor aclaramiento y mayor exposición sistémica (>5 veces)127,128. La cápsula tiene dos tipos de gránulos, liberados en el 25% en el duodeno proximal (pH5.5) y en el 75% en íleon (pH6.8), mostrando un perfil con doble pico (concentración/tiempo)129,130.
La esofagitis moderada-severa se presenta en el 25-30% de todas las esofagitis. Un subgrupo (10-15%) persistirá sintomático y/o con daño (C y D) a pesar del IBP, y >40% ERNE tendrán insatisfacción al tratamiento131-133.
DMR fue superior a lansoprazol en la cicatrización (60mg: 86% vs. 79%; 90mg: 90% vs. 85%; p<0.05) con mayor rendimiento para 90mg (ganancia del 8%). El NNT para prevenir un fracaso fue 17 en C y D, y 13 para todos los grados. DMR fue eficaz en el control sintomático (>80% de resolución de la pirosis)126.
DMR 30 y 60mg fueron superiores al placebo (75% vs. 83% vs. 27%, p<0.0025), con más días libres de pirosis diurna (91-96%) y nocturna (96-99%)133. Un estudio clínico reportó mayor efectividad con 90mg (87%,) en comparación con 60mg (82%) o placebo (26%). El porcentaje de días libres de pirosis fue mejor con DMR (DMR 60mg 97%; 90mg 98%; placebo 50%)134. Las comparaciones indirectas en la cicatrización vs. esomeprazol 40mg no fueron significativas135.
En la pirosis diurna (50.0% vs. 54.9% vs. 17%; p<0.00001) y en el porcentaje de noches sin pirosis (80.8% vs. 76.9% vs. 51.7%, p>0.00001), DMR (30 y 60mg) fue superior al placebo136; DMR 30mg fue más efectivo que esomeprazol 20/40mg (RR2.01 vs. 2.17) en la pirosis137. DMR 30mg fue más efectivo (80%) en quienes falló el uso previo de otros IBP138.
Los síntomas-ERGE nocturnos están asociados a mala calidad de sueño; hasta el 50% refieren síntomas nocturnos139,140. La frecuencia fue reportada en el 42.7% de 4,302 pacientes mexicanos con ERGE141.
DMR 30mg fue más efectivo que el placebo para controlar la pirosis (73.1% vs. 35.7%, p<0.0001), para mejorar la calidad del sueño (69.7% vs. 47.9%; p<0.001), en la productividad-trabajo y para disminuir la severidad de síntomas nocturnos (69.7% vs. 47.9%; p<0.001)142.
IlaprazolEs un derivado del bencimidazol metabolizado por CYP3A4 con una t1/2 de 8.1-10.1h. Es una prodroga de tercera generación30,143. La comparación entre ilaprazol (5, 10 y 20mg) vs. omeprazol 20mg mostró diferencias significativas en el promedio pH>4 pero no en %t pH>4 intragástrico144. Sin embargo, el efecto fue muy inferior a lo reportado previamente en voluntarios sanos145. Los autores concluyeron que las diferencias poblacionales (occidentales vs. asiáticos) pudieran explicar los resultados.
El enfoque de los estudios clínicos se han centrado en la no superioridad de otros IBP sobre bajas dosis de ilaprazol en la cicatrización; las tasas (por protocolo) para esomeprazol 40, ilaprazol 10 e ilaprazol 15mg fueron del 93.3, del 94.9 y del 97.6% a las 8 semanas (p=0.611)146. Sin embargo, no hay estudios clínicos occidentales contra otros IBP en el control de la secreción ácida diurna y nocturna, manifestaciones extraesofágicas, en el dolor torácico o en los casos refractarios a IBP.
TenatoprazolEsta prodroga (pKa=4.04) es una imidazopiridina (no bencimidazol) unida a un anillo de piridina (sulfinilmetilo) que se une a Cys813 y Cys822. Su t1/2 es prolongada (8.7h). El AUC del tenatoprazol 40mg es más prolongada que esomeprazol 40mg, por lo que tiene mejor control de la secreción ácida nocturna (pH>4: 4.6 vs. 4. 2)147,148. Este IBP no ha sido comercializado en la actualidad.
Los nuevos caballeros en el horizonteUna nueva clase de drogas dirigida a la supresión ácida del estómago, los bloqueadores de la bomba del potasio, K+, de la ATPasa (P-CABs), ha sido descubierta. Estos impiden el intercambio de H+ con una alta afinidad a K+ (conformación E2). Una ventaja importante de este enfoque farmacológico es el rápido inicio del efecto con una inhibición completa de la secreción de ácido gástrico en 30min de administración de drogas.
El vonoprazán logra una rápida y más prolongada supresión del ácido en comparación con los IBP149. El promedio de pH intragástrico (día7) en sujetos sanos que recibieron 10-40mg (una vez al día) de vonoprazán en población japonesa y occidental tuvo una respuesta lineal. La respuesta fue mayor con la dosis de 40mg, alcanzando un pH>4/24h en un porcentaje de 86.5±15.5 (día1) a 100±0.1 (día7)149.
El paso siguiente es evaluar cuál es la utilidad y el beneficio clínico de la supresión extrema del ácido y cuáles sus eventos adversos a largo plazo, y ponderar el tamaño del efecto en estudios clínicos aleatorizados al compararse con los IBP en el amplio espectro de la ERGE.
La búsqueda del Grial aún continúa.
ConclusionesLos IBP han demostrado su efectividad, seguridad y tolerabilidad en el espectro de la ERGE. La respuesta clínica está asociada a sus propiedades farmacocinéticas. La optimización del IBP se basa en las modificaciones en la dosis (fraccionada o aumentada), la galénica, la isomería y los mecanismos de liberación. Los esfuerzos han sido dirigidos a aumentar la vida media, la concentración máxima y el área bajo la curva de las concentraciones plasmáticas. Aunque es esperable que haya una respuesta sintomática favorable en las enfermedades relacionadas con el ácido, el rendimiento farmacológico es mayor en aquellos con exposición anormal al ácido en el esófago (EAA) confirmada con los estudios funcionales. Así, los ERNE verdaderos (ausencia de daño mucoso con EAA+) tendrán un comportamiento clínico similar a la esofagitis erosiva.
El tamaño del efecto de los eventos adversos asociados a los IBP se encuentra en la zona de riesgo potencial de sesgos metodológicos, ya que han sido basados en los estudios observacionales que tienen un mayor riesgo de confusores.
El conocimiento básico farmacocinético y el entendimiento de la enfermedad permitirán la optimización de un IBP en la práctica clínica. La carrera por la supresión ácida dependerá de la entidad dentro del espectro clínico de la ERGE.
Responsabilidades éticasLos autores del manuscrito manifestamos lo siguiente:
Protección de sujetos (humanos y animales)Los autores del manuscrito declaramos que en el artículo titulado «Una carrera por la supresión ácida» no hubo intervención en humanos ni en animales. Esta es una revisión de la literatura de lengua inglesa y en español para buscar las evidencias de la eficacia, seguridad, tolerabilidad y eventos adversos de una clase de fármacos.
ConfidencialidadLos autores declaramos que en este manuscrito no se realizó investigación en pacientes.
Derecho a la privacidad y consentimiento informado por escritoLos autores declaramos que en este manuscrito no se realizó investigación en pacientes.
FinanciaciónNinguno de los autores recibió financiamiento para el desarrollo del manuscrito.
Conflicto de interesesSergio Sobrino-Cossío, Oscar Teramoto-Matsubara, Gualberto Mateos-Pérez, Juan Miguel Abdo-Francis, Antonio Orozco y José Tawil han sido conferencistas de Laboratorios Takeda, México.
Claudia Olguín-Ramírez y Elymir Soraya Galvis-García no tienen conflictos de intereses a declarar.