La esofagitis eosinofílica (EEo) es una enfermedad crónica mediada por alérgenos, caracterizada por síntomas esofágicos, eosinofilia esofágica y ausencia de respuesta favorable a inhibidores de la bomba de protones (IBP). En los adultos es la causa más frecuente de disfagia e impactación alimentaria. Su incidencia y prevalencia son muy altas en los países desarrollados (EUA, Europa y Australia), en donde ha alcanzado una connotación de epidemia. Mientras que en los países desarrollados se publican estudios con grandes series de pacientes, en nuestro subcontinente se reporta en series con pocos casos o en casos aislados. Las causas de las diferencias de la prevalencia de la enfermedad entre ambas regiones se desconocen. Se han invocado causas genéticas o raciales. No obstante, el carácter epidémico de la enfermedad sugiere que las causas ambientales son más poderosas.
Con base en hipótesis publicadas, así como en los estudios epidemiológicos, en la presente revisión se discutirán algunas de las posibles causas de la disparidad de prevalencia de la EEo entre ambos tipos de países. Se revisará la «hipótesis de la higiene», así como la posible relación del Helicobacter pylori, los parásitos intestinales y las modificaciones de la microbiota esofágica con la EEo. Con base en estudios realizados en EUA, se revisará el comportamiento clínico y evolutivo de la EEo en individuos hispanos y se discutirá acerca de un posible fenotipo predominante en los pacientes de América Latina y México. Finalmente, sobre la base anterior, se propondrá un algoritmo de estudio de la enfermedad en nuestros países.
Eosinophilic esophagitis is a chronic antigen-mediated disease characterized by esophageal symptoms, esophageal eosinophilia, and the absence of response to proton pump inhibitors. It is the most frequent cause of dysphagia and food impaction in adults. Its incidence and prevalence is very high in the developed countries (USA, Europe, Australia), where its connotation is that of an emerging epidemic. While studies have been published with large case series in the developed countries, those published in Latin America are small or consist of isolated case reports. The differences in the prevalence of the disease between the developed and developing regions are unknown. Genetic or racial causes have been cited. Nevertheless, the epidemic nature of the disease suggests that environmental causes are the most powerful.
Based on the published hypotheses, as well as on epidemiologic studies, the present review discusses some of the possible causes of the disparity in the prevalence of eosinophilic esophagitis between the two types of countries. The ‘hygiene hypothesis’ is reviewed, together with the possible relation of Helicobacter pylori, intestinal parasites, and modifications of the esophageal microbiota in patients with eosinophilic esophagitis. In reference to studies conducted in the United States, the clinical behavior and progression of eosinophilic esophagitis in Hispanics is reviewed and a possible predominant phenotype in Mexican and other Latin American patients is discussed. Finally, based on the above, an algorithm for studying the disease in the Latin American countries is proposed.
La esofagitis eosinofílica (EEo) es una enfermedad crónica del esófago provocada por alérgenos alimentarios y ambientales. Se caracteriza por la presencia de síntomas de disfunción esofágica, infiltrado de eosinófilos (≥15 eosinófilos/campo de alto poder) en la mucosa esofágica y ausencia de respuesta clínica e histológica a un tratamiento con inhibidores de la bomba de protones (IBP) durante 8 semanas1,2. De acuerdo con las guías de diagnóstico establecidas por los consensos internacionales sobre eosinofilia digestiva del 2007, 2011 y 20131-3, la EEo debe diferenciarse de la eosinofilia esofágica causada por enfermedad por reflujo gastroesofágico y la eosinofilia esofágica sensible a los IBP (EE-SIBP)3. Esta última entidad es clínica, endoscópica e histológicamente indistinguible de la EEo2,4, y se desconoce si es un fenotipo de la EEo que responde a los IBP o si se trata de una entidad independiente5.
La EEo fue descrita inicialmente en los niños y fue hasta 1978 cuando se describió en los adultos6. En los niños se manifiesta como un fenotipo inflamatorio caracterizado clínicamente por vómitos, pirosis, dolor torácico y dificultad para ganar peso corporal. En la endoscopia hay exudado inflamatorio en la mucosa esofágica en forma predominante7,8. En los adultos, actualmente es la causa más frecuente de disfagia e impactación alimentaria, ya que se comporta como una enfermedad crónica progresiva, altamente recurrente y con tendencia a la remodelación esofágica (fibrosis submucosa) y estenosis9,10. Afecta a los hombres con más frecuencia que a las mujeres en una relación de 4 a 1 y a los individuos de la cuarta y quinta década de la vida11.
En este artículo se señalarán de una manera general las características clínicas y epidemiológicas de la EEo en los países desarrollados y en vías de desarrollo (norte y sur), particularmente los de América Latina, poniendo énfasis en las diferencias de la prevalencia entre ambas regiones del mundo. Al mismo tiempo, con base en las escasas evidencias de carácter epidemiológico que hasta la fecha se han publicado, discutiremos las posibles causas involucradas en tales diferencias. En seguida, con base en información clínica disponible, intentaremos delinear las características clínicas y evolutivas de la enfermedad en nuestras poblaciones, y finalmente propondremos medidas sobre el diagnóstico y tratamiento de la enfermedad en México y Latinoamérica.
Epidemiología de la esofagitis eosinofílica. Prevalencia e incidencia en los países desarrollados y en vías de desarrolloCon base en estudios realizados en población general, desde su descripción inicial en la década de los 80, la incidencia y la prevalencia de la EEo han aumentado significativamente en los Estados Unidos de América (EUA), Canadá, Europa Occidental y Australia (este último, país situado en el sur pero con desarrollo económico y social equiparable a Europa y EUA)12-15. Este aumento tan inusitado ha recibido connotación de epidemia en esos países. Se ha determinado que la prevalencia en niños y adultos de la población general en dichas regiones geográficas es de 10 a 90/100,000 habitantes con una incidencia estimada de 2 a 13 casos/100,000 habitantes. Estas cifras son las más altas en comparación con las reportadas en los escasos estudios publicados en Latinoamérica16-18, en China19,20, en Japón21,22 y en Arabia Saudita23. No se han reportado casos en la India ni en África del Norte y subsahariana.
En nuestro país y en Latinoamérica la incidencia de la enfermedad en la población general se desconoce debido a la ausencia de estudios. Se ha reportado solo en casos aislados o en pequeñas series en algunos países de América del Sur (Chile, Uruguay, Argentina, Perú)24-26. En dos estudios prospectivos latinoamericanos, realizados uno en México y otro en Brasil, en sujetos a los cuales se les realizó esofagogastroduodenoscopia por síntomas esofágicos, se reportaron prevalencias del 1 y 1.7%16,18, las cuales fueron menores que las reportadas en estudios similares en EUA y España (5 al 8%)27,28. En otro estudio mexicano realizado por nuestro grupo en pacientes con datos clínicos de enfermedad por reflujo gastroesofágico refractario, la prevalencia fue también baja, del 4%17.
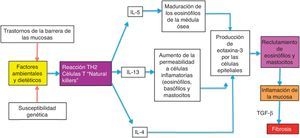
Posibles causas de la epidemia de esofagitis eosinofílica en los países desarrollados y de la baja prevalencia en los países en vías de desarrolloLa EEo es una enfermedad alérgica con mecanismos fisiopatogénicos similares a los que actúan en otras enfermedades atópicas como el asma bronquial, la rinitis alérgica y la dermatitis atópica. Está bien documentado que la EEo es disparada por alérgenos contenidos en los alimentos y el medio ambiente, ya que la restricción de algunos alimentos mejoran los síntomas y el infiltrado eosinofílico esofágico y además tiene una elevada incidencia estacional, siendo más frecuente entre el verano y el otoño, épocas de mayor concentración de polen en el medio ambiente29. Estos alérgenos provocan una reacción inflamatoria mediada por linfocitos T colaboradores (helper) conocida como reacción tipo Th2, la cual induce la producción de las interleucinas IL-4, IL-5 e IL-13 y la secreción de eotaxina-3 por las células epiteliales de la mucosa esofágica. Este agente es un poderoso reclutador de eosinófilos y de células cebadas, cuya presencia provoca inflamación de la mucosa y disrupción de la barrera epitelial (fig. 1).
Similar a lo que se ha observado con la EEo, otras enfermedades alérgicas como el asma, la rinitis alérgica y la dermatitis atópica han tenido una tendencia a incrementarse en los últimos 30 años en Europa y EUA, convirtiéndose el asma en un fenómeno epidémico30 y doblando o triplicando la dermatitis atópica su prevalencia31.
Aunque el conocimiento de las bases genéticas de la EEo se ha definido en años recientes32, el comportamiento epidémico de la enfermedad sugiere que las causas ambientales son más poderosas que las genéticas. No está claro la causa por la cual los alimentos y los alérgenos ambientales que habían sido tolerados por muchos años en los países afectados son ahora detonantes de la EEo. Los factores involucrados en la epidemia podrían al mismo tiempo explicar las causas de su baja prevalencia en los países en vías de desarrollo incluyendo a México. Estos factores podrían ser múltiples y complejos y su discusión cae en el terreno de la especulación, ya que la mayoría de ellos no se han estudiado intencionalmente en relación con la EEo y los pocos estudios se encuentran en fase preliminar (tabla 1). No obstante, recientes observaciones epidemiológicas han arrojado datos interesantes y sobre ellas se discutirá en este artículo.
Factores que podrían estar involucrados en la esofagitis eosinofílica (EEo) como causa de epidemia en países desarrollados y con la baja prevalencia en países no desarrollados
| Hipótesis de la higiene: erradicación de infecciones (inductor) |
| Exposición temprana a antibióticos (inductor) |
| Nacimiento por cesárea (inductor) |
| Procesamiento de alimentos: conservadores, aditivos químicos, uso de hormonas, pesticidas (inductor) |
| Susceptibilidad genética (protector o inductor) |
| Cambios en la microbiota esofágica (protector o inductor) |
| Helicobacter pylori (protector) |
| Otras bacterias (protector) |
| Parásitos intestinales (protector) |
La explicación por la cual los individuos de los países desarrollados podrían tener una mayor intensidad de la reacción alérgica contra alimentos y alérgenos ambientales que la que tenían hace tiempo y que la que actualmente tienen los individuos de los países en vías de desarrollo podría encontrarse en la «hipótesis de la higiene» propuesta por Okada et al. en el 201033. Según esta hipótesis, la reducción en la incidencia de infecciones en los individuos de los países desarrollados debido a la erradicación farmacológica de bacterias y parásitos es el origen de la incidencia incrementada de enfermedades alérgicas y autoinmunes como la enfermedad inflamatoria intestinal. En apoyo a esta hipótesis, se ha reportado un incremento en la incidencia en las últimas décadas de enfermedades alérgicas mediadas por mecanismos fisiopatogénicos similares a la EEo como el asma, la rinitis alérgica y la dermatitis atópica30. La incidencia de la dermatitis atópica se ha doblado o triplicado en países desarrollados durante las últimas 3 décadas31. Los mecanismos mediante los cuales la «hipótesis de la higiene» intenta explicar estos fenómenos no están bien definidos, sin embargo, propone que el principal podría estar relacionado con una redirección de las reacciones inflamatorias Th1 y Th2. Los linfocitos T colaboradores (helper) en la reacción Th1 producen citocinas inflamatorias como la interleucina IL-2, interferón-γ, y el factor de necrosis tumoral alfa (FNT-α) que actúan en la inmunidad mediada por células. En contraste, los linfocitos T colaboradores de la reacción Th2 producen interleucinas IL-4, IL-5 e IL-13 que contribuyen a la producción de inmunoglobulinas tipo E (IgE) y respuestas alérgicas mediadas por eosinófilos. Algunos autores sugieren que en los países desarrollados la reducción de la carga microbial en la niñez temprana (que normalmente favorece una reacción inflamatoria Th1 fuerte) redirige la respuesta inflamatoria hacia el fenotipo Th2 y por lo mismo predispone al individuo a trastornos alérgicos.
Helicobacter pyloriEn el contexto de la «hipótesis de la higiene», se ha reportado recientemente que existe una relación inversa de la prevalencia de Helicobacter pylori (H. pylori) y EEo. Dellon et al., en un estudio extenso en biopsias de individuos de la población general realizado en EUA, encontraron que los individuos con eosinofilia esofágica tenían una razón de momios de H. pylori significativamente reducida en comparación con los individuos con biopsia normal. Encontraron además una relación dosis-respuesta entre el incremento del infiltrado eosinofílico y la prevalencia reducida de H. pylori34. Otro estudio más reciente realizado en Alemania confirmó estos hallazgos. En este estudio de casos y controles con 58 pacientes, aquellos con EEo tuvieron serología positiva contra H. pylori en el 5.2% en comparación con el 37.9% sin EEo35.
En México, la prevalencia de H. pylori obtenida en una encuesta nacional en población abierta fue del 66%36 y en algunos países de Centroamérica y Sudamérica puede llegar al 90%37,38, en cambio, en los países desarrollados la prevalencia es significativamente baja, del orden del 6 al 20%39. Las diferencias en la prevalencia entre las dos regiones se han atribuido a las tasas de exposición y contagio con el H. pylori en la edad infantil, las cuales son altas en nuestros países40,41.
Es interesante señalar que desde su caracterización en 1980 y su consecuente erradicación, la prevalencia de H. pylori ha tenido una reducción significativa en los EUA; en cambio, ha permanecido alta o se ha reducido poco en países menos desarrollados42. En los EUA la prevalencia de H. pylori varía entre los diferentes grupos raciales que conforman su población; es menor entre los caucásicos (8-26%) y mayor entre afroamericanos y latinos (52-54% y 48-64%, respectivamente)43-45. Esta diferencia intergrupal está más ligada a las diferencias socioeconómicas que a las raciales, como lo demuestra el estudio de Malaty y Graham realizado en población hispana residente en los EUA, en donde hubo una relación inversa entre la prevalencia de H. pylori y el nivel socioeconómico. Los hispanos de clases socioeconómicas alta, media y baja tuvieron prevalencias de H. pylori del 6, 43 y 86%, respectivamente46.
Además de las diferencias étnicas, se ha especulado que las diferencias en el clima y en la exposición a alérgenos podrían explicar la desigual prevalencia de EEo entre los países desarrollados y en vías de desarrollo. En contra de estos argumentos podrían interpretarse los resultados de los estudios realizados en los EUA en los que se evalúa la prevalencia de la EEo en los diferentes grupos poblacionales, en los cuales se ha reportado que la EEo es significativamente menos frecuente en los individuos de origen hispánico que en los caucásicos a pesar de estar expuestos al mismo clima y a los mismos alérgenos alimentarios y ambientales que los caucásicos. En un estudio de población abierta con más de 6 millones de individuos, de los cuales 3,360 (0.05%) tenían EEo, 3,160 (94.04%) fueron caucásicos, 190 (5.65%) fueron afroamericanos y solo 10 (0.29%) fueron hispanos47. Estos resultados podrían indicar que los individuos afroamericanos y los hispánicos podrían tener factores «protectores» contra la EEo y podrían además ser argumentos a favor de la relación inversa entre H. pylori y EEo y de la «hipótesis de la higiene». No se puede descartar el efecto concomitante de la susceptibilidad genética y racial.
ParásitosLa parasitosis intestinal podría ser, con base en la «hipótesis de la higiene», un factor de protección contra la EEo, ya que en los países en vías de desarrollo las parasitosis aún tienen una alta prevalencia. No obstante, este aspecto ha sido escasamente evaluado. En algunos estudios se ha observado, en países tropicales y subtropicales, que las infecciones por Schistosoma tienen una fuerte protección contra la atopia48, que Necator americanus puede tener un efecto protector sobre el asma y que la erradicación de helmintos incrementa la sensibilidad cutánea atópica49,50. Sin embargo, el efecto protector sobre las enfermedades alérgicas, particularmente sobre el asma, de la erradicación de parásitos intestinales no se ha observado en otros estudios51. Además, el mecanismo propuesto mediante el cual las infecciones bacterianas reducirían los riesgos de enfermedades alérgicas (redirección de las reacciones inflamatorias Th1 y Th2) no sería el mismo para los parásitos, ya que estos justamente inducen reacciones Th2. Sin embargo, otros mecanismos alternos podrían estar involucrados, tales como la competencia antigénica y la inmunorregulación. El primero propone que dos respuestas inmunes provocadas por distintos antígenos tienden a inhibirse unas con otras33. El segundo postula que en una reacción inmunológica podrían activarse células reguladoras T que suprimen las respuestas inmunológicas distintas de las respuestas contra los antígenos en cuestión52. Esta teoría sobre los parásitos es interesante, sin embargo, se requieren más estudios que evalúen la relación que pudiera existir con la EEo.
MicrobiotaEl intestino humano es colonizado con diferentes cepas de bacterias después del nacimiento. La microbiota intestinal es importante para múltiples funciones fisiológicas, mantener la integridad de la barrera mucosa y regular las funciones inmunológicas53,54. En años recientes se ha señalado que las alteraciones en la composición de la microbiota intestinal podrían están involucradas con las causas de algunas enfermedades crónicas y neoplasias55,56. En este contexto la microbiota intestinal ha sido extensamente estudiada, en cambio, la microbiota esofágica no había sido caracterizada sino hasta en años recientes. Hasta la fecha existen escasos estudios que evalúan las alteraciones de la microbiota esofágica en la EEo. Un estudio realizado con 33 niños con EEo: 18 con enfermedad activa y 15 con enfermedad inactiva fueron comparados con 35 controles. Se evaluaron las modificaciones del microbioma esofágico después de la manipulación dietética y se encontraron diferencias significativas en la composición de esta en niños con EEo activa en comparación con los controles (Proterobacteria en EEo y Streptococcus y Atopobium genera en los controles), la cual no fue modificada por los cambios de la dieta57. En otro estudio realizado con 70 niños se encontraron diferencias significativas en la composición de la microbiota esofágica en pacientes con EEo en comparación con pacientes con reflujo gastroesofágico y los normales. En los pacientes con EEo predominó significativamente Hemophillus58. Finalmente, otro estudio encontró modificaciones significativas de la microbiota esofágica con el uso crónico de los IBP en adultos con enfermedad por reflujo gastroesofágico, Barret y adenocarcinoma esofágico y gástrico59,60. Aunque no se ha demostrado que el uso crónico de IBP es un factor de riesgo para la EEo, se ha invocado como posible causa a través de mecanismos alternos a los relacionados con la supresión ácida61.
Aunque los hallazgos de estos estudios son interesantes, aún no se puede asegurar que las modificaciones de la microbiota esofágica sean la causa de EEo y podrían ser más bien un efecto de la enfermedad62. Se necesitan más estudios al respecto.
Posible predominio de un fenotipo clínico atenuado de la esofagitis eosinofílica en los países en vías de desarrolloEn los países desarrollados la EEo es una enfermedad crónica con una elevada tasa de recurrencia clínica y patológica cuando se suspende el tratamiento63,64. Estudios recientes han puesto de manifiesto que tiene una elevada tendencia a progresar del fenotipo inflamatorio (el que ocurre en los niños) al fenotipo fibroestenótico (el que ocurre en los adultos), dando lugar a estenosis esofágica e impactación alimentaria65,66. Estas complicaciones son más frecuentes a medida que se incrementa el tiempo de evolución de la enfermedad, llegando a observarse hasta en el 70% de los casos con más de dos décadas de actividad sintomática67,68.
Por lo anterior es interesante señalar que en un estudio publicado por el grupo del Dr. J. Richter en 2011, realizado en un solo centro hospitalario de los EUA con 64 pacientes con eosinofilia esofágica detectada por reportes de patología, con un seguimiento de 10 años (81% caucásicos, 12% afroamericanos y 6% hispanos), se encontraron datos interesantes: los afroamericanos y los hispanos tenían una forma clínicamente atípica de la enfermedad, caracterizada por edad más avanzada, mayor frecuencia de síntomas de enfermedad por reflujo gastroesofágico, menos disfagia para alimentos sólidos y en la endoscopia menos alteraciones relacionadas con fibrosis (anillos circunferenciales) en comparación con los caucásicos. Los autores concluyeron que estas diferencias intergrupales en el comportamiento clínico de la eosinofilia esofágica podrían deberse a diferencias en el fenotipo de la propia enfermedad o a la presencia de entidades clínicas diferentes69. Los resultados de este estudio fueron confirmados en el 2016 en un estudio extenso multicéntrico realizado en 5 grandes centros hospitalarios de los EUA con 793 pacientes con EEo (476 adultos y 317 niños), de los cuales el 83% fueron caucásicos, el 10% afroamericanos y el 7% hispánicos y asiáticos. Al igual que en el estudio de Richter et al., los grupos no-caucásicos tuvieron una forma atípica «benigna» de la enfermedad, ya que presentaron significativamente con menor frecuencia disfagia (56 y 53% vs. 74%) e impactación alimentaria esofágica (13 y 13% vs. 35%) que los caucásicos. En la endoscopia tuvieron con menor frecuencia anillos concéntricos y surcos lineales. Los autores concluyeron que el diagnóstico de EEo debe ser considerado en los afroamericanos e hispánicos aunque no tengan síntomas típicos70.
Los hallazgos de estos dos estudios podrían tener implicaciones más amplias. Hay que recordar que la EE-SIBP es una condición clínica e histológicamente indistinguible de la EEo, que responde favorablemente a los IBP71,72. En el último consenso del grupo de trabajo internacional sobre EEo del 2016 se sugirió que esta entidad clínica representa una parte del espectro de la EEo, con posibles características clínicas y evolutivas diferentes73. Su frecuencia es del 50 al 75% entre los pacientes con eosinofilia esofágica en general74,75. Se ha sugerido que los IBP podrían tener un efecto restaurador de las lesiones producidas por el ácido en la mucosa del esófago, las cuales aumentan su permeabilidad haciendo posible la penetración de alérgenos76,77. También se ha observado que los IBP tienen propiedades antiinflamatorias independientes de la supresión de ácido, inhibiendo la secreción de eotaxina-378,79. Hasta hace poco se desconocía la historia natural a largo plazo de esta entidad clínica. Recientemente, en un estudio retrospectivo con 94 pacientes se demostró que los pacientes con EE-SIBP en comparación con EEo tuvieron significativamente menos riesgo de estenosis distal y estrechamientos del calibre esofágico después de 20 años con síntomas (30.2% vs. 72.3%)80. Hasta la fecha se desconoce si existen diferencias raciales en la distribución de esta entidad.
Los resultados de los estudios previamente discutidos sugieren que los individuos no-caucásicos (hispanos y afroamericanos) podrían tener factores «protectores» o atenuantes de la EEo, particularmente contra el fenotipo fibroestenótico de la enfermedad. Es posible que en los países en vías de desarrollo prevalezca un fenotipo inflamatorio atenuado de la EEo con características clínicas «atípicas» y sensible a IBP71. En dos estudios publicados en México en el 2011 y 2016 se describe un predominio de las características clínicas típicas, sin embargo, se trata de series de pocos casos17,81. Se desconoce la cantidad y las características de los pacientes subdiagnosticados en nuestro país y no se ha evaluado el desenlace clínico a largo plazo. En nuestra experiencia con 8 pacientes vistos en nuestro hospital desde el año 2007, ninguno de ellos ha requerido dilataciones esofágicas y solo uno había presentado impactación alimentaria en el momento del diagnóstico (datos personales no publicados).
Conclusiones y recomendacionesEn conclusión, la incidencia de la EEo en los países desarrollados ha ido en rápido aumento en los últimos años alcanzando características de epidemia. En cambio, en los países en vías de desarrollo incluyendo a México, la prevalencia es muy baja. Las causas atribuidas a este hecho se desconocen. El comportamiento epidémico de la EEo, al igual que otras enfermedades alérgicas, sugiere que las causas ambientales son más poderosas que la posible susceptibilidad genética o racial. Las causas imputables son nuevos reactivos ambientales y/o hipersensibilidad inmunológica a alérgenos. Las teorías actuales postulan que esta hipersensibilidad podría haber sido inducida por exacerbación de los hábitos de higiene personal y comunitaria y erradicación de enfermedades infecciosas no letales como resultado de una mejoría de los niveles socioeconómicos. Se han invocado también como posibles causas la erradicación de H pylori, parásitos digestivos, alteraciones de las ecologías microbianas intestinal y esofágica por el uso indiscriminado de antibióticos, nacimiento por cesáreas, procesamiento industrial de alimentos con aditivos, conservadores, pesticidas, etc.82. Estas teorías sientan las bases mecanicistas para la investigación futura en relación con la etiopatogenia y la terapéutica de la enfermedad.
Por otra parte, con base en evidencias expuestas en este artículo, la EEo en los países en vías de desarrollo podría ser predominantemente un fenotipo «atípico» clínicamente más atenuado, manifestado principalmente por síntomas de reflujo, más relacionado con inflamación que con fibrosis esofágica (fig. 2) y con una elevada respuesta a los IBP, similar a lo que se conoce como EE-SIBP. Sin embargo, se necesitan estudios clínicos, de preferencia multicéntricos, dada su baja prevalencia, para comprobarlo.
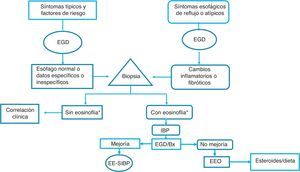
Con base en lo anterior consideramos que, en nuestros países, la EEo ciertamente debe sospecharse en los individuos que tengan factores de riesgo clásicos ya conocidos (jóvenes, con disfagia y atopia), sin embargo, también en sujetos de mayor edad con síntomas de reflujo gastroesofágico y datos endoscópicos de inflamación de la mucosa esofágica (exudados moteados blanquecinos, mucosa frágil y papel crepé), a los cuales se deberá tomar biopsia en esófago proximal y distal. Si se encuentra eosinofilia esofágica se deberá descartar reflujo gastroesofágico mediante monitoreo ambulatorio de pH esofágico en 24h o con una prueba con IBP, después de lo cual es imperativo repetir el control endoscópico e histológico. Si desaparecen las alteraciones endoscópicas y la eosinofilia, deberá considerarse el padecimiento como una EE-SIBP y solo en el caso de que no haya mejoría histológica se deberá establecer el diagnóstico de EEo y tratar con esteroides tópicos o dietas de restricción (fig. 3).
Algoritmo de diagnóstico y tratamiento de la eosinofilia esofágica y esofagitis eosinofílica propuesto para nuestras poblaciones.
* Eosinofilia: ≥15 eosinófilos/campo de alto poder; EGD: esofagogastroduodenoscopia; EEo: esofagitis eosinofílica; IBP: inhibidores de la bomba de protones; Bx: biopsia; EE-SIBP: eosinofilia esofágica sensible a IBP.
El conocimiento de las características clínicas y evolutivas de la eosinofilia esofágica con buen número de pacientes en nuestros países contribuirá al mejoramiento de las prácticas clínicas y sentará las bases para el establecimiento de guías de diagnóstico y tratamiento adaptadas a nuestras poblaciones.
FinanciaciónNo se recibió patrocinio de ningún tipo para llevar a cabo este artículo/estudio.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.







![Fenotipo inflamatorio (A: moteado blanquecino; B: surcos longitudinales; C: edema mucosa [papel crepé]) y fenotipo fibroestenótico (D: anillos; E: estenosis con impactación alimentaria) de la esofagitis eosinofílica por endoscopia.](https://static.elsevier.es/multimedia/03750906/0000008200000004/v1_201709230043/S0375090617300666/v1_201709230043/es/main.assets/thumbnail/gr2.jpeg?xkr=ue/ImdikoIMrsJoerZ+w97o/wdEXW47bqlyT1CqG6R0=)