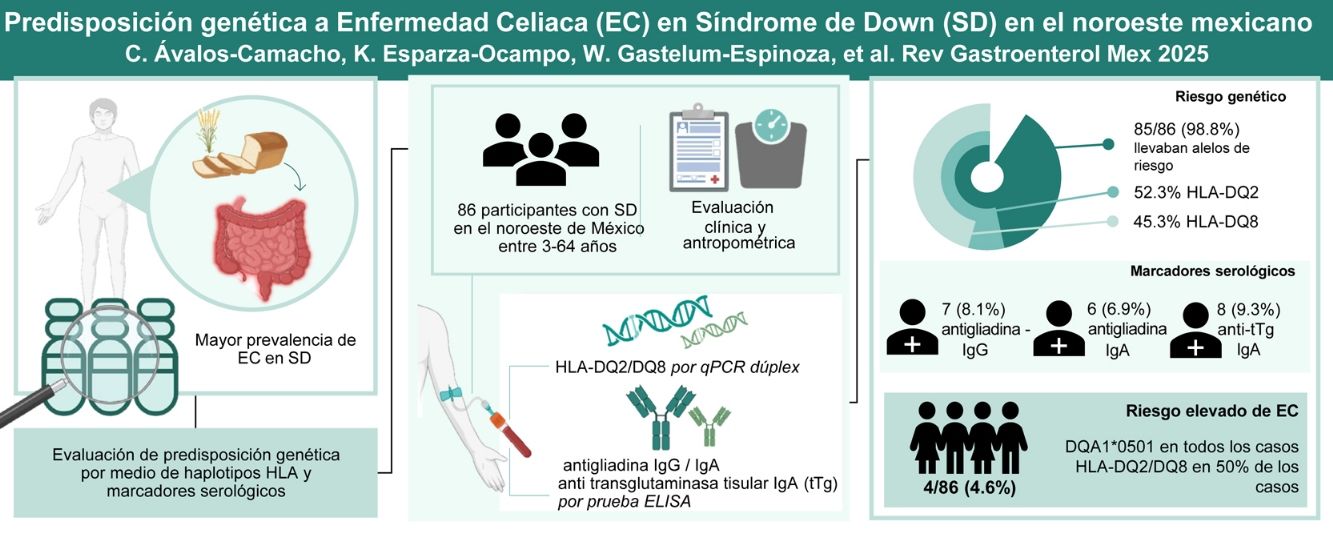
La enfermedad celíaca (EC) es una enteropatía detonada por la ingesta de gluten, con síntomas intra y extragastrointestinales. Los individuos con síndrome de Down (SD) tienen una mayor prevalencia de trastornos autoinmunes, incluida la EC. El presente estudio tuvo como objetivo evaluar la predisposición genética (haplotipos HLA) y los marcadores serológicos de EC en individuos con SD, en el noroeste de México.
MétodosSe incluyó a 86 participantes con SD, de 3 a 64años. Evaluamos los haplotipos HLA-DQ2 y DQ8 por PCR dúplex y síntomas relacionados, al igual que por anticuerpos antigliadina IgG e IgA y anticuerpos antitransglutaminasa tisular IgA por inmunoanálisis enzimático.
ResultadosLa mayoría de los participantes eran portadores de alelos de riesgo, el 52.9% con HLA-DQ2 y el 45.9% con HLA-DQ8. Los anticuerpos antigliadina IgG fueron positivos en el 8.1% de los participantes. Comparativamente, el 6.9% dieron positivo para anticuerpos antigliadina IgA y el 9.3% presentaron un índice positivo para anticuerpos antitransglutaminasa tisular IgA. Cuatro participantes (4.6%) presentaron haplotipos HLA-DQ2/DQ8 completos o parciales, índices positivos para anticuerpos IgA antigliadina y antitransglutaminasa tisular relacionados con la EC.
ConclusionesEl estudio reveló una predisposición genética casi completa a la autoinmunidad y un riesgo muy alto de EC en individuos con SD. Se recomiendan protocolos de diagnóstico mejorados y monitorización activa para el manejo de EC en esta población vulnerable.
Celiac disease (CD) is an autoimmune enteropathy triggered by ingested gluten, with intra- and extra-gastrointestinal symptoms. Individuals with Down syndrome (DS) have a higher prevalence of autoimmune disorders, including CD. This study aimed to evaluate genetic predisposition (HLA haplotypes) and serological markers of CD in individuals with DS, from Northwestern Mexico.
MethodsEighty-six participants with DS, 3 to 64years of age, were included in the study. We assessed HLA-DQ2 and DQ8 haplotypes by duplex PCR and related symptoms, as well as IgG and IgA anti-gliadin antibodies, and IgA anti-tissue transglutaminase antibodies by an enzymatic immunoassay.
ResultsMost participants (98.8%) carried risk alleles, with 52.9% having HLA-DQ2 and 45.9% HLA-DQ8. IgG anti-gliadin antibodies were positive in 8.1% of participants. In comparison, 6.9% were positive for IgA anti-gliadin antibodies, and 9.3% had a positive index for IgA anti-tissue transglutaminase antibodies. Four participants (4.6%) presented full or partial HLA-DQ2/DQ8 haplotypes, positive indexes for IgA anti-gliadin, and anti-transglutaminase antibodies related to CD.
ConclusionsThe study reveals an almost complete genetic predisposition to autoimmunity and a very high risk of CD in individuals with DS. Enhanced diagnostic protocols and ongoing monitoring are recommended to improve the management of CD in this vulnerable population.
El síndrome de Down (SD), también conocido como trisomía21, es un trastorno genético causado por la presencia de una copia extra, completa o parcial, del cromosoma21 (Hsa21)1. Ocurre globalmente aproximadamente en 1 de cada 1,000 nacimientos2,3, y en México la tasa de incidencia es de 23 por cada 100,000 habitantes, lo cual la convierte en la principal causa de aneuploidía severa en neonatos4. El SD presenta un rango de características fenotípicas cognitivas y físicas, siendo las discapacidades motrices e intelectuales las más prominentes. También se asocia con un riesgo más elevado de dislipidemia, debido principalmente a niveles desfavorables de colesterol de lipoproteínas de alta densidad (cHDL) y triglicéridos5. Adicionalmente, existe un riesgo elevado (tasas de incidencia de 1.2 a 94.7) para varias condiciones clínicas como diabetes, enfermedad inflamatoria intestinal, obesidad, enfermedades autoinmunes y renales, hipotiroidismo y enfermedad de Alzheimer6,7.
La enfermedad celíaca (EC) es un trastorno sistémico autoinmune detonado por la ingesta de gluten, la proteína principal en trigo, cebada y centeno, causando daño en la mucosa intestinal e induciendo malabsorción e inflamación crónica. Los síntomas gastrointestinales incluyen diarrea, dolor abdominal, náusea, vómito, distensión abdominal, pérdida de apetito, malabsorción de nutrientes y pérdida de peso no intencional8. Las manifestaciones extraintestinales incluyen estatura baja, fatiga, anemia por deficiencia de hierro y condiciones cardiacas, musculoesqueléticas y neurológicas9,10. El reconocimiento de las manifestaciones clínicas de EC en individuos con SD puede ser un desafío, ya que estos síntomas se sobreponen o se confunden con los problemas típicos de salud asociados a SD11.
La patogénesis de la EC involucra interacciones complejas entre factores alimentarios (como el consumo de gluten), predisposición genética (HLA-DQ2 y HLA-DQ8) y mecanismos autoinmunes (transglutaminasa tisular actuando como autoantígeno). El componente genético juega un papel significativo en la predisposición a EC, ya que los haplotipos HLA-DQ2 (DQA1*0501 y DQB1*0201) y HLA-DQ8 (DQA1*0301 y DQB1*030/3) se presentan en la superficie de células presentadoras de antígenos. Estos muestran una fuerte afinidad con péptidos de gliadina deaminada, los cuales son procesados por la enzima transglutaminasa. Estos péptidos se presentan a las célulasT CD4+, llevando a la producción de anticuerpos contra las gliadinas y anticuerpos contra la transglutaminasa, comenzando una cascada inflamatoria12,13.
Se estima que la prevalencia de EC afecta a entre el 0.5 y el 1.0% de la población general. En individuos con SD la prevalencia es más alta, entre el 4 y el 13%, con un riesgo entre seis y diez veces mayor, en comparación con poblaciones neurotípicas14,15. Sin embargo, aproximadamente la mitad de los individuos con SD y EC tienen dificultad para expresar sus síntomas, lo cual puede llevar a retrasar el diagnóstico o no realizarlo11.
La detección temprana de EC en individuos con SD es crucial, ya que el diagnóstico oportuno y el tratamiento pueden evitar complicaciones de largo plazo, como desnutrición, osteoporosis, complicaciones hepáticas y neurológicas, linfomas y mayor susceptibilidad a otras enfermedades autoinmunes, mejorando así la calidad de vida de esta población vulnerable. Aunque la presencia de EC en SD está documentada en algunos países, en México se carece de datos relativos a esta condición. Por lo tanto, el objetivo del presente estudio fue hacer un tamizaje de riesgo de EC en pacientes con SD en el noroeste de México, por medio de la detección de los haplotipos HLA-DQ2/DQ8 y marcadores séricos de EC.
Materiales y métodosDiseño del estudio y poblaciónSe realizó un estudio transversal observacional en individuos con SD del noroeste de México, reclutados por medio de muestreo de conveniencia, de agosto a diciembre de 2022. El estudio se apegó a los lineamientos STROBE para asegurar el rigor metodológico y la transparencia. El consentimiento informado fue obtenido de los padres o tutores de los participantes del estudio. El protocolo del estudio fue aprobado por el Comité de Ética en la Investigación de la Facultad de Medicina de la Universidad Autónoma de Sinaloa. Todos los procedimientos del estudio se adhirieron a la Declaración de Helsinki de 1964 y sus enmiendas posteriores o estándares éticos comparables. Los tutores legales recibieron información sobre el objetivo del estudio y se obtuvo el consentimiento informado firmado. Los participantes fueron individuos de ambos sexos, de más de 2años, con un diagnóstico citogenético de SD. Los criterios de exclusión fueron datos incompletos o muestras de sangre insuficientes para los análisis bioquímicos o genéticos. Se realizó una historia clínica de cada participante por medio de entrevistas con los padres o tutores, obteniendo edad, sexo y síntomas clínicos.
Medidas antropométricasLa evaluación antropométrica siguió los procedimientos de la Sociedad Internacional para el Avance de la Cineantropometría (ISAK, por sus siglas en inglés). El peso corporal fue medido utilizando una báscula Tanita HS-302 (Tanita Corporation of America, Inc, Arlington Heights, IL, EE.UU.), con los participantes usando ropa ligera. La altura se midió con el estadiómetro SECA 213 (MFBIA; SECA, Hamburgo, Alemania). El índice de masa corporal (IMC) se calculó (peso en kilogramos/altura en metros al cuadrado) y se clasificó de acuerdo con Flores Arizmendi et al.16 para participantes menores de 20años, considerando bajo peso por debajo del percentil 5 y obesidad en el percentil 95, o mayor. Para los mayores de 20años la clasificación se basó en los puntos de corte de la Organización Mundial de la Salud (OMS) para bajo de peso (≤18.5kg/m2), peso normal (18.5-24.9kg/m2), sobrepeso (≥25kg/m2) y obesidad (≥30kg/m2).
Perfil bioquímicoSe obtuvo una muestra de sangre periférica por medio de venopunción tras 12horas de ayuno, utilizando tubos con gel separador tipo SST (sin anticoagulante) y en tubos con EDTA K2 (como anticoagulante). Las muestras fueron centrifugadas a 2,500× g por 10min a 4°C para separar suero y plasma. Se midieron los niveles de hemoglobina utilizando un analizador de hematología automatizado (Beckman Coulter® LH 780, CA, EE.UU.) con base en el método de cianmetahemoglobina, siguiendo las instrucciones del fabricante. Los valores de hematocrito se determinaron utilizando el mismo equipo, con el método de microcentrifugado, calculando el porcentaje de células rojas totales en sangre. La glucosa en plasma fue medida utilizando equipos enzimáticos (HUMAN Diagnostics Worldwide; Wiesbaden, Alemania). La medición de HbA1c fue realizada por medio de cromatografía líquida de alto desempeño (HPLC), utilizando un analizador de HbA1c certificado (Bio-Rad D-10® Hemoglobin Testing System, Bio-Rad Laboratories, Hercules, CA, EE.UU.) y los resultados se reportaron como porcentajes.
Genotipo de los haplotipos HLA-DQ2 y HLA-DQ8La extracción del ADN se realizó en tubos Eppendorf de 1.5-2ml, comenzando con una mezcla de 300μl de sangre periférica y 600μl de buffer de lisis, incubando a 68°C por 5min. A continuación de la centrifugación se agregó cloroformo para separar las fases. El supernadante fue tratado con CTAB5% (Sigma-Aldrich, MO, EE.UU.) y agua inyectable, para ser centrifugado de nuevo. Se agregó cloruro de sodio y etanol frío y la mezcla fue centrifugada para obtener el pellet, el cual fue lavado con etanol al 70% y se dejó secar. Finalmente se suspendió en un buffer TE a 56°C y se cuantificó con un espectrofotómetro NanoDrop™ (Thermo Fisher Scientific, MA, EE.UU.).
Posterior a la extracción de ADN genómico se realizó el genotipo de los haplotipos HLA-DQ2 y HLA-DQ8 por medio de qPCR, utilizando SYBR Green Supermix (Bio-Rad, California, EE.UU.) con el ciclador térmico StepOnePlus (Applied Biosystems, California, EE.UU.). Se realizaron reacciones dúplex siguiendo a Aguayo-Patrón et al.17 para alelos del haplotipo HLA-DQ2 (DQA1*0501, sentido 5’-acggtccctctggccagta-3’ y contrasentido5’-agttggagcgtttaatcagac-3’; DQB1*0201, sentido 5’-gtgcgtcttgtgagcagaag-3’ y contrasentido 5’-gcaaggtcgtgcggagct-3’) y el haplotipo HLA-DQ8 (DQA1*0301, sentido 5’-ttcactcgtcagctgaccat-3’ y contrasentido 5’-caaattgcgggtcaaatcttct-3’; DQB1*0302/3 sentido 5’-gacggagcgcgtgcgtta-3’ y contrasentido 5’-caaattgcgggtcaaatcttct-3’), según Olearup y Fogdell18. Se utilizó beta-actina como control interno (sentido 5’-gcaagcaggagtatgacgag-3’ y contrasentido 5’-gtcaccttcaccgttccagt-3’). Para descripción, el HLA-DQ2 fue exclusivo para los alelos DQA1*0501 y DQB1*0201, mientras que el haplotipo HLA-DQ8 fue exclusivo para DQA1*0301 y DQB1*0302. Estos alelos, al formar dímeros con una cadena diferente, fueron nombrados A1*0501, B1*0201, A1*0301 o B1*0302, respectivamente, como en Mejía-León et al.19.
El riesgo genético para EC fue acorde con lo reportado en una población del noroeste mexicano19. En el estudio de Mejía-León, el riesgo fue expresado como 1:N, donde N representa el número de individuos en quienes se encontró un caso positivo. Este valor fue calculado utilizando la frecuencia de cada perfil HLA-DQ en la población general, multiplicado por 100 y dividido en su frecuencia en pacientes.
Pruebas de anticuerpos en suero (IgG e IgA antigliadina e IgA antitransglutaminasa)Los anticuerpos antigliadina IgG e IgA (no desamidados) fueron cuantificados en muestras de suero, al igual que los antitransglutaminasa IgA, utilizando un ensayo inmunoabsorbente ligado a enzimas (ELISA), siguiendo el método descrito por Cabrera-Chávez et al.20. Brevemente, las microplacas fueron cubiertas con gliadinas o transglutaminasa, y después bloqueadas con gelatina. Las muestras de suero fueron diluidas serialmente e incubadas en las placas, seguido de la adición de anticuerpos anti-IgG o anti IgA conjugados con HRP. Una vez que la reacción se desarrolló, fue detenida con H2SO4. Los resultados fueron el promedio de 4 diluciones en duplicado (8 lecturas de absorbencia total), medidos a 450nm, utilizando el iMark Microplate Absorbance Reader (Bio-Rad, California, EE.UU.). El positivo fue definido como un índice >1.0 de la razón de la absorbencia media de la muestra, dividida entre la media más dos desviaciones estándar de la absorbancia media, de todas las muestras de suero20,21.
Análisis estadísticoLa normalidad de los datos fue verificada utilizando histogramas y la prueba Kolmogorov-Smirnov. Se utilizó estadística descriptiva para resumir las características antropométricas y clínicas de los participantes. Las variables continuas fueron reportadas como medias con desviaciones estándar y rangos, incluyendo edad, IMC, glucosa, HbA1c, hemoglobina y hematocrito. Las variables categóricas como sexo e índices positivos de marcadores serológicos (anticuerpos antigliadina IgG e IgA y anticuerpos antitransglutaminasa tisular) fueron expresados como frecuencias e índices. La prevalencia de haplotipos HLA específicos (HLA-DQ2 y HLA-DQ8) también fue determinada. Todos los análisis estadísticos fueron realizados utilizando el programa STATA v.13 (Stata Corp, College Station, TX, EE.UU.). Los datos se reportaron como medias ±desviaciones estándar o porcentajes (%).
Consideraciones éticasSe obtuvo el consentimiento informado de todos los participantes previo a su inclusión en el estudio. Para participantes menores de edad, se obtuvo el consentimiento informado de sus padres o tutores legales, asegurando la comprensión absoluta del acuerdo con los objetivos y procedimientos de la investigación. Los autores declaran que el presente estudio fue realizado siguiendo los protocolos aprobados por el Comité de Ética de la Investigación de la Facultad de Medicina de la Universidad Autónoma de Sinaloa, con código de registro CONBIOÉTICA-25-CEI-003-20181012, en adherencia a los principios éticos establecidos en la Declaración de Helsinki para la investigación con participantes humanos. Todos los datos fueron anónimos para asegurar la confidencialidad y la privacidad de los participantes sin incluir información personal identificable. El presente estudio cumplió estrictamente con todos los estándares legales y éticos aplicables para salvaguardar los derechos y la integridad de los individuos involucrados.
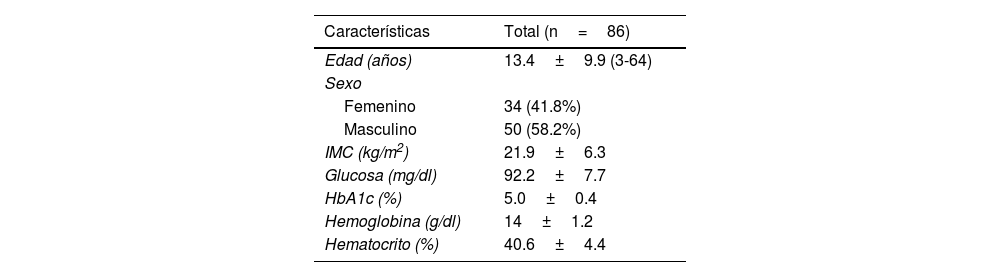
ResultadosLas características demográficas, antropométricas y clínicas de los 86 participantes con SD se muestran en la tabla 1. De acuerdo con el IMC, el número medio de pacientes con SD estuvo dentro de un peso normal, y solo el 23.3% de ellos presentaron sobrepeso u obesidad. Los participantes tuvieron rangos normales de glucosa en ayuno y HbA1c, sin signos de diabetes, y no existieron datos consistentes con anemia.
Características generales de los participantes
| Características | Total (n=86) |
|---|---|
| Edad (años) | 13.4±9.9 (3-64) |
| Sexo | |
| Femenino | 34 (41.8%) |
| Masculino | 50 (58.2%) |
| IMC (kg/m2) | 21.9±6.3 |
| Glucosa (mg/dl) | 92.2±7.7 |
| HbA1c (%) | 5.0±0.4 |
| Hemoglobina (g/dl) | 14±1.2 |
| Hematocrito (%) | 40.6±4.4 |
HbA1c: hemoglobina glicosilada; IMC: índice de masa corporal.
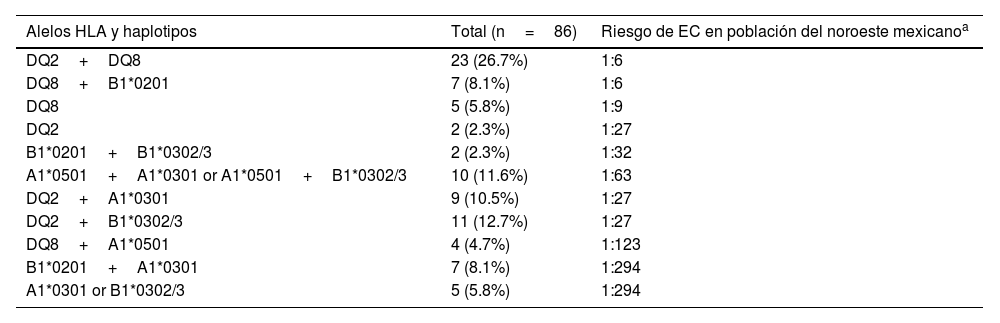
Casi todos los participantes con SD (85/86) presentaron predisposición genética a EC, con al menos un alelo de los haplotipos HLA-DQ2/DQ8; 69 de ellos con un riesgo mayor a 1:63 (tabla 2). El haplotipo HLA-DQ2 fue el de mayor prevalencia, con el 52.3% de los participantes, seguido de HLA-DQ8, con el 45.3%. Veintitrés (26.7%) participantes presentaron los dos haplotipos (HLA-DQ2 y HLA-DQ8) y 31 participantes (36%) llevaban alelos formando dímeros con una cadena diferente (A1*0501, B1*0201, A1*0301 o B1*0302). Solo un individuo no llevaba alelos de riesgo.
Alelos HLA y riesgo para enfermedad celiaca en la población del noroeste de México
| Alelos HLA y haplotipos | Total (n=86) | Riesgo de EC en población del noroeste mexicanoa |
|---|---|---|
| DQ2+DQ8 | 23 (26.7%) | 1:6 |
| DQ8+B1*0201 | 7 (8.1%) | 1:6 |
| DQ8 | 5 (5.8%) | 1:9 |
| DQ2 | 2 (2.3%) | 1:27 |
| B1*0201+B1*0302/3 | 2 (2.3%) | 1:32 |
| A1*0501+A1*0301 or A1*0501+B1*0302/3 | 10 (11.6%) | 1:63 |
| DQ2+A1*0301 | 9 (10.5%) | 1:27 |
| DQ2+B1*0302/3 | 11 (12.7%) | 1:27 |
| DQ8+A1*0501 | 4 (4.7%) | 1:123 |
| B1*0201+A1*0301 | 7 (8.1%) | 1:294 |
| A1*0301 or B1*0302/3 | 5 (5.8%) | 1:294 |
Respecto a los marcadores serológicos para el diagnóstico de EC, 7 (8.1%) de los participantes presentaron índices positivos de anticuerpos antigliadina IgG (anti-Gd), 6 (6.9%) dieron positivo para anticuerpos anti-Gd IgA y 8 (9.3%) dieron positivo para anticuerpos IgA antitransglutaminasa tisular (anti-TG).
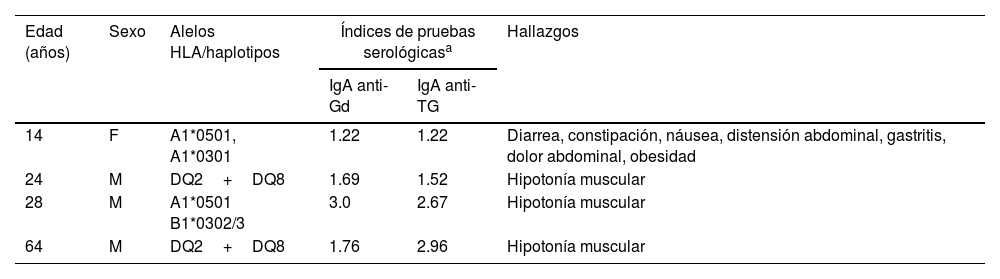
La tabla 3 muestra a los participantes que presentaron coexistencia de haplotipos de riesgo, anticuerpos asociados con EC y signos y síntomas. El primer participante descrito en la tabla es un adolescente con diagnóstico de EC antes de su participación en el estudio y, de acuerdo con el reporte de sus padres, estaba con una dieta libre de gluten y presentaba síntomas gastrointestinales, incluida diarrea, constipación, náusea, gastritis, acidez, vómito, dolor abdominal y obesidad. Además, tres participantes adultos presentaron anticuerpos IgA anti-Gd y anti-TG y no reportaron síntomas gastrointestinales aparentes. De manera notable, dos de los cuatro individuos descritos en la tabla llevaban HLA-DQ2 y HLA-DQ8, el mayor riesgo para EC en la población del noroeste de México.
Características de los participantes con una alta probabilidad de enfermedad celiaca
| Edad (años) | Sexo | Alelos HLA/haplotipos | Índices de pruebas serológicasa | Hallazgos | |
|---|---|---|---|---|---|
| IgA anti-Gd | IgA anti-TG | ||||
| 14 | F | A1*0501, A1*0301 | 1.22 | 1.22 | Diarrea, constipación, náusea, distensión abdominal, gastritis, dolor abdominal, obesidad |
| 24 | M | DQ2+DQ8 | 1.69 | 1.52 | Hipotonía muscular |
| 28 | M | A1*0501 B1*0302/3 | 3.0 | 2.67 | Hipotonía muscular |
| 64 | M | DQ2+DQ8 | 1.76 | 2.96 | Hipotonía muscular |
anti-Gd: anti-gliadina; anti-TG: anti-transglutaminasa; F: femenino; M: masculino.
Como se mencionó antes, los individuos con SD tienen una mayor susceptibilidad a diversas comorbilidades, especialmente enfermedades autoinmunes como la EC. Por lo tanto, los pacientes con SD han sido tamizados para EC en diferentes partes del mundo, resultando en una detección de EC en el 3.1 al 13%, en comparación con el 1% o menos en la población general15,22. Sin embargo, este tamizaje es prácticamente inexistente en países latinoamericanos, excepto por 2-3 estudios en Brasil y Colombia15,23,24. Hasta donde sabemos, no existen estudios publicados sobre población mexicana con SD, y el tamizaje es importante para evaluar el riesgo y prevenir complicaciones que podrían comprometer la salud de estos pacientes.
Encontramos que el 4.6% de nuestra población con SD tenía riesgo potencial de EC, con base en riesgo genético y anticuerpos IgA específicos antigliadinas y antitransglutaminasa, en comparación con el 0.6% en la población mexicana general25. Es importante señalar que todos los individuos con potencial EC en nuestro estudio llevaban el alelo DQA1*0501, el cual es un componente del haplotipo HLA-DQ2, con lo que destaca la fuerte asociación entre HLA-DQ2 y la susceptibilidad para EC en este grupo. Además, 2/4 individuos presentaron los dos haplotipos HLA-DQ2 y HLA-DQ8, lo cual sugiere que aunque los dos haplotipos contribuyen al riesgo genético, el HLA-DQ2 fue el de mayor prevalencia entre los individuos con riesgo potencial de EC. Esta observación está en línea con los hallazgos en niños colombianos con SD y EC, en quienes el HLA-DQ2 también predominó (3/5), en comparación con el HLA-DQ8 (2/5)23.
Es notable que el riesgo genético fue extremadamente alto, con 85/86 de los participantes con SD presentando algún grado de riesgo genético y el 81% de ellos con un riesgo >1:100.
La predisposición genética debida a la presencia de genes HLA claseII juega un papel significativo en la etiología de la EC26. Las guías clínicas de la Sociedad Europea de Gastroenterología, Hepatología y Nutrición Pediátrica (ESPGHAN, por sus siglas en inglés) recomienda hacer el genotipo para HLA-DQ2 y HLA-DQ8 para diagnosticar EC asintomática o su sospecha en niños, dado que la ausencia de estos alelos indica un riesgo muy bajo de EC27,28. En nuestro estudio, el HLA-DQ2 fue el de mayor prevalencia (52.9%) y HLA-DQ8 se expresó en el 45.9% de los casos. HLA-DQ2 está presente en el 30-40% de las poblaciones, principalmente en Europa, y HLA-DQ8 es más común (20-25%) en Centro y Sudamérica23,29.
Específicamente, el alelo DQA1*0501 del haplotipo HLA-DQ2 estuvo presente en 55/86 individuos con SD, en concurrencia con lo reportado para la población del noroeste mexicano. Nuestros participantes con SD presentaron una combinación particular de haplotipos, con una relación DQ2:DQ8 de 1.2:1. La población saludable de la región Noroeste es muy diferente de otras poblaciones mestizas de Latinoamérica, México incluido, principalmente por la menor frecuencia del alelo DQB1*030219. Sin embargo, en la tabla 2 se observa que la frecuencia de DQB1*0302 fue casi del doble en casos de EC en la mayoría de los participantes.
Los haplotipos de riesgo similar, HLA-DQ2 y DQ8, predisponen a diabetes tipo1 (DT1)19. A pesar de que casi el 100% de nuestros participantes con SD presentaron los haplotipos o sus alelos, ninguno de ellos había desarrollado DT1, como se puede observar por los niveles normales de glucosa en ayuno y HbA1c en la tabla 1.
Nuestra población de estudio presentó índices positivos de anticuerpos IgG anti-Gd, IgA anti-Gd e IgA anti-Tg, con el 8.1, el 6.9 y el 9.3%, respectivamente. Se han reportado resultados similares en Latinoamérica, con una prevalencia de 8.2% de niveles elevados de anticuerpos anti-TG IgA en niños con SD en Colombia23 y un rango del 6.5 al 17.5% de niños y adolescentes con SD en Brasil15-24.
En poblaciones europeas con SD, como Polonia, se reportan niveles elevados de anticuerpos IgA anti-TG e IgG anti-Gd con el 6.3 y el 9%, respectivamente30. La prevalencia de anti-TG IgA en Irlanda es del 9.4%31, del 12.2% en Portugal y del 5.2% en los Países Bajos32. Los datos de la India son similares, con una prevalencia del 7%33. Por otro lado, las poblaciones del Medio Oriente presentan porcentajes más elevados para individuos con niveles elevados de anti-Gd IgG e IgA, al igual que anti-TG IgA (57.7-79%, 23-32.1% y 9.6-15.4%, respectivamente)34,35.
La EC está asociada con dificultades conductuales y emocionales36, las cuales pueden ser exacerbadas en poblaciones vulnerables, como quienes tienen SD. La presencia de síntomas prominentemente neurológicos y síntomas gastrointestinales sutiles complica la identificación de EC. La literatura publicada indica que hasta una tercera parte o más de los pacientes con SD y EC no presentan síntomas característicos de EC11,36 debido a la variabilidad de manifestaciones clínicas, incluidos los síntomas gastro y extraintestinales, síntomas atípicos e incluso casos asintomáticos37.
En nuestro estudio, uno de los cuatro (25%) pacientes con EC potencial presentaba varios síntomas gastrointestinales (tabla 3), destacando el iceberg representacional de EC en SD, donde la prevalencia es marcadamente más alta, en comparación con poblaciones euploides38,39. Esta relación podría pasar desapercibida debido a la insidiosa y ocasionalmente silenciosa naturaleza de la EC. Dado el riesgo serológico y genético observado, es esencial que estos pacientes se sometan a biopsia intestinal para confirmar el diagnóstico y asegurarse del manejo clínico adecuado.
La IgA anti-Tg es un predictor confiable de EC, como se demostró en un estudio con niños alemanes con anticuerpos anti-TG IgA detectados y haplotipos de riesgo, en quienes se confirmó EC por medio de biopsias de duodeno dos años más tarde40. Los niveles elevados de anti-TG IgA han sido sugeridos también como reflejo posible de atrofia en las vellosidades del intestino delgado29. Otro estudio que involucró a 14 centros especializados en EC en diferentes países evaluó adultos con sospecha de EC y encontró que anti-TG IgA era un predictor confiable de atrofia de vellosidad duodenal en el 98% de los casos. Sin embargo, se observaron discrepancias en la evaluación histológica de biopsias duodenales, señalando dificultades, incluso para especialistas en histología41.
Por otro lado, es importante considerar que anti-TG IgA puede ser positivo en pacientes con infecciones entéricas, como giardiasis y otros patógenos, al igual que en otras enfermedades42. Tuvimos ocho pacientes con anti-TG IgA positivos, pero cuatro dieron negativo para anticuerpos antigliadina. Debido a que la prevalencia de infecciones entéricas es común en nuestra población43, es posible que nuestros casos presentaran infección.
El diagnóstico de EC en población SD es un reto significativo debido a factores de discapacidad intelectual, dificultades conductuales y la presentación atípica de la enfermedad. Esta complejidad, sumada a la necesidad de evaluaciones sistemáticas para su detección, lleva a una falta de diagnóstico o a un diagnóstico retrasado. Es necesario realizar tamizaje por medio de pruebas serológicas y hacer genotipos de haplotipo de riesgo para asegurar que la población con SD reciba el diagnóstico y el tratamiento adecuados.
En conclusión, el presente estudio muestra una alta predisposición genética a EC con un patrón de alelos HLA-DQ2/DQ8 o haplotipos típicos de la población del noroeste de México con esta enfermedad. Además, debido al alto riesgo de EC en la muestra de nuestro estudio, evidenciado en los anticuerpos serológicos IgA antigliadina y antitransglutaminasa tisular, junto con la presencia de los alelos HLA-DQ2 y HLA-DQ8, es necesario confirmarlo por medio de biopsias intestinales. También, en caso de confirmación de EC, la implementación oportuna de una dieta sin gluten es crucial para evitar complicaciones. Por lo tanto, es esencial para los individuos con SD el monitoreo constante de signos y síntomas de EC e intervenciones de diagnóstico temprano, para evitar otras comorbilidades, como malabsorción mineral y sus consecuencias, y especialmente linfoma intestinal asociado a EC no tratada.
FinanciaciónNo se recibió financiamiento para la realización del presente estudio.
Conflicto de interesesLos autores declaran que no existe conflicto de intereses.