Helicobacter pylori es un bacilo gramnegativo que coloniza la mucosa gástrica e infecta a más de la mitad de la población mundial. El tratamiento consta de dos antibióticos y un inhibidor de la bomba de protones (IBP) que favorece la replicación de la bacteria y potencia la actividad de los antibióticos. A pesar de la importancia del uso de los IBP en la terapia contra H.pylori, aún no son precisos los mecanismos por los cuales estos medicamentos ejercen un efecto sobre la fisiología de la bacteria.
ObjetivoRecopilar información sobre el efecto de los IBP sobre la fisiología de H.pylori y el mecanismo por el cual producen alteraciones en la bacteria.
MétodosSe realizó una búsqueda de bibliografía en PubMed, Science Direct y LILACS. Se incluyeron artículos originales preclínicos y clínicos publicados en cualquier idioma.
ResultadosLos IBP y su forma sulfenamida tienen efectos en H.pylori, incluyendo la inducción de cambios estructurales, la inhibición del crecimiento bacteriano, la interferencia con enzimas como la ureasa, ATPasas y alcohol deshidrogenasa.
ConclusionesLa unión de la forma sulfenamida de los IBP a componentes estructurales y enzimáticos bacterianos demostró ser el principal mecanismo por el que se altera la fisiología de H.pylori in vitro. En los estudios clínicos no se precisan los mecanismos por los que estos fármacos inducen alteraciones en la bacteria.
Helicobacter pylori is a Gram-negative bacillus that colonizes the gastric mucosa and infects more than half of the world population. Treatment consists of two antibiotics and a proton pump inhibitor (PPI) that favors the replication of the bacterium and enhances the activity of the antibiotics. Despite the importance of proton pump inhibitor use in treating H.pylori infection, the precise mechanisms through which PPIs affect the physiology of the bacterium are not yet understood.
AimOur aim was to compile information pertaining to the effect of PPIs on the physiology of H.pylori and the mechanisms through which they produce alterations in the bacterium.
MethodsA bibliographic search was conducted, utilizing the PubMed, Science Direct, and LILACS databases, and included preclinical and clinical original articles published in any language.
ResultsThe sulfenamide form of PPIs was shown to have effects on H.pylori, including the induction of structural changes, inhibition of bacterial growth, and interference with enzymes, such as urease, ATPases, and alcohol dehydrogenase.
ConclusionsThe binding of the sulfenamide form of PPIs to the bacterial structural and enzymatic components was the main mechanism through which H.pylori physiology was altered in vitro, but how they induce alterations in the bacterium was not established in the clinical studies analyzed.
Helicobacter pylori (H. pylori) es una bacteria gramnegativa, microaerofílica, flagelada que coloniza la superficie epitelial de la mucosa gástrica humana1. La infección por H.pylori tiene alta prevalencia mundial, con diferencias entre países2: alrededor del 50% de la población tiene la bacteria, y su prevalencia oscila entre el 85 y el 95% en los países con bajos ingresos y entre el 30 y el 50% en países de altos ingresos3. Pese a la alta prevalencia de la infección por H.pylori, solo el 10% de los individuos infectados manifiestan sintomatología, esto debido a varios factores, como la variabilidad genética de los aislamientos, factores biológicos y factores ambientales del hospedero, como el tipo de dieta, el tabaquismo, el etilismo y el uso de antibióticos2,4.
H.pylori es considerado uno de los principales factores de riesgo para el desarrollo de cáncer gástrico (CG) y úlcera péptica (UP), por lo cual la Organización Mundial de la Salud (OMS), a través de la Agencia Internacional de Investigación sobre el Cáncer (IARC), lo clasificó como carcinógeno gradoI, siendo las personas infectadas seis veces más susceptibles de padecer CG5; el desarrollo de este tipo de cáncer se relacionó con diferentes factores de virulencia de la bacteria. Dentro de estos se resalta la enzima ureasa como uno de los más importantes, ya que favorece la resistencia de la bacteria al pH ácido por medio de la hidrólisis de urea en dióxido de carbono (CO2) y amoníaco (NH3); de esta manera, amortigua el pH periplásmico y aumenta el pH gástrico, lo que facilita su establecimiento en el hospedero, la activación de la respuesta inmune y el estrés oxidativo que estimulan la transformación maligna del epitelio1.
Debido a la capacidad que tiene H.pylori para establecerse y multiplicarse en la mucosa gástrica, la terapia actual para la erradicación de esta bacteria consiste en el uso de un inhibidor de la bomba de protones (IBP) (omeprazol, lansoprazol, pantoprazol, etc.) y al menos dos antibióticos (claritromicina, amoxicilina, entre otros)1. Los IBP suprimen la secreción de ácido gástrico mediante el bloqueo de la H+/K+ ATPasa (bomba de protones gástrica)1. Estos fármacos son fundamentales porque promueven diferentes cambios en el microambiente del hospedero, como el aumento del pH gástrico, favoreciendo la replicación del microorganismo e incrementando la susceptibilidad a los antibióticos6.
Diferentes estudios in vitro demostraron la inhibición de la actividad de la ureasa con la administración de omeprazol en dosis altas; además, se evidenció que los IBP generan cambios en la estructura celular y la morfología de H.pylori6; Mirshahi F et al. demostraron el efecto bactericida y bacteriostático de estos medicamentos contra bajas y altas densidades bacterianas, respectivamente, así como la alteración en la viabilidad y la recuperación por cultivo de H.pylori después de la exposición a los IBP7,8.
A pesar del amplio uso de los IBP en el tratamiento de la infección por H.pylori y los cambios descritos in vitro sobre la morfología, el crecimiento y la actividad enzimática de la bacteria, aún no son precisos los mecanismos o vías por las cuales los IBP generan estos efectos en H.pylori. Además, se desconoce si estos se presentan durante la infección en el hospedero o con el consumo indiscriminado de estos medicamentos, afectando el diagnóstico y el éxito de la terapia actual. Por otro lado, no se encuentran estudios que sinteticen todos los efectos que tienen los IBP sobre la bacteria y definan la concentración a los que estos medicamentos generan cambios. Por esta razón, el objetivo de esta revisión es recopilar la información sobre los efectos y mecanismos asociados que tienen los IBP sobre la fisiología de H.pylori.
MetodologíaEstrategia de búsquedaEsta revisión sistemática se realizó siguiendo las recomendaciones de la declaración Preferred Reporting Items for Systematic Reviews and Meta-Analyses (PRISMA) 2020, estableciendo una pregunta PICO, definiendo como problema de interés los cambios en la fisiología de H.pylori; la intervención a analizar son los IBP, sin ninguna comparación, y como resultados se definieron los mecanismos de los IBP que generan cambios sobre la fisiología de H.pylori, agrupando estos ítems en la siguiente pregunta: ¿Cuál es el mecanismo por el cual los IBP generan cambios en la fisiología de H.pylori?
Se identificó sistemáticamente artículos en PubMed (librería nacional de medicina de Estados Unidos, Bethesda, MD, EE.UU.), Science Direct y LILACS (Literatura Latinoamericana de Información en Ciencias de la Salud). Además, se definió un conjunto de palabras clave en inglés: growth, metabolism, nutrition, enzymeactivity y enzyme, y se utilizaron los siguientes términos MeSH (Medical Subject Headings): «proton pump inhibitors», «growth». Este enfoque basado en términos permite la homogeneidad en la estrategia de búsqueda para diferentes idiomas. Con el propósito de garantizar la reproducibilidad del estudio, las estrategias de búsqueda utilizadas para cada base de datos se emplearon por las autoras de la revisión en momentos diferentes. Dichas estrategias se muestran en la tabla 1.
Estrategia de búsqueda
| Base de datos | Estrategia de búsqueda |
|---|---|
| Science Direct | Title «Helicobacter pylori» OR «H. pylori»Title, abstract or author-specified keywords(«proton pump inhibitors» OR «proton pump inhibitors» OR PPI OR omeprazole OR esomeprazole OR pantoprazole OR rabeprazole OR lansoprazole) AND (Growth)(«proton pump inhibitors» OR «proton pump inhibitors» OR PPI OR omeprazole OR esomeprazole OR pantoprazole OR rabeprazole OR lansoprazole) AND (metabolism)(«proton pump inhibitors» OR «proton pump inhibitors» OR PPI OR omeprazole OR esomeprazole OR pantoprazole OR rabeprazole OR lansoprazole) AND («enzyme activity»)(«proton pump inhibitors» OR «proton pump inhibitors» OR PPI OR omeprazole OR esomeprazole OR pantoprazole OR rabeprazole OR lansoprazole) AND (enzyme)(«proton pump inhibitors» OR «proton pump inhibitors» OR PPI OR omeprazole OR esomeprazole OR pantoprazole OR rabeprazole OR lansoprazole) AND (nutrition) |
| LILACS | (ti:(«Helicobacter pylori»)) AND («proton pump inhibitors») AND (growth)(ti:(«Helicobacter pylori»)) AND («proton pump inhibitor») AND (growth)(ti:(«Helicobacter pylori»)) AND («PPI») AND (growth)(ti:(«Helicobacter pylori»)) AND (omeprazole) AND (growth)(ti:(«Helicobacter pylori»)) AND (esomeprazole) AND (growth)(ti:(«Helicobacter pylori»)) AND (pantoprazole) AND (growth)(ti:(«Helicobacter pylori»)) AND (lansoprazole) AND (growth)(ti:(«Helicobacter pylori»)) AND (rabeprazole) AND (growth)(ti:(«Helicobacter pylori»)) AND («proton pump inhibitors») AND (metabolism)(ti:(«Helicobacter pylori»)) AND («proton pump inhibitor») AND (metabolism)(ti:(«Helicobacter pylori»)) AND («PPI») AND (metabolism)(ti:(«Helicobacter pylori»)) AND (omeprazole) AND (metabolism)(ti:(«Helicobacter pylori»)) AND (esomeprazole) AND (metabolism)(ti:(«Helicobacter pylori»)) AND (pantoprazole) AND (metabolism)(ti:(«Helicobacter pylori»)) AND (lansoprazole) AND (metabolism)(ti:(«Helicobacter pylori»)) AND (rabeprazole) AND (metabolism)(ti:(«Helicobacter pylori»)) AND («proton pump inhibitors») AND (nutrition)(ti:(«Helicobacter pylori»)) AND («proton pump inhibitor») AND (nutrition)(ti:(«Helicobacter pylori»)) AND («PPI») AND (nutrition)(ti:(«Helicobacter pylori»)) AND (omeprazole) AND (nutrition)(ti:(«Helicobacter pylori»)) AND (esomeprazole) AND (nutrition)(ti:(«Helicobacter pylori»)) AND (pantoprazole) AND (nutrition)(ti:(«Helicobacter pylori»)) AND (lansoprazole) AND (nutrition)(ti:(«Helicobacter pylori»)) AND (rabeprazole) AND (nutrition)(ti:(«Helicobacter pylori»)) AND («proton pump inhibitors») AND («enzyme activity»)(ti:(«Helicobacter pylori»)) AND («proton pump inhibitor») AND («enzyme activity»)(ti:(«Helicobacter pylori»)) AND («PPI») AND («enzyme activity»)(ti:(«Helicobacter pylori»)) AND (omeprazole) AND («enzyme activity»)(ti:(«Helicobacter pylori»)) AND (esomeprazole) AND («enzyme activity»)(ti:(«Helicobacter pylori»)) AND (pantoprazole) AND («enzyme activity»)(ti:(«Helicobacter pylori»)) AND (lansoprazole) AND («enzyme activity»)(ti:(«Helicobacter pylori»)) AND (rabeprazole) AND («enzyme activity»)(ti:(«Helicobacter pylori»)) AND («proton pump inhibitors») AND (enzyme)(ti:(«Helicobacter pylori»)) AND («proton pump inhibitor») AND (enzyme)(ti:(«Helicobacter pylori»)) AND («PPI») AND (enzyme)(ti:(«Helicobacter pylori»)) AND (omeprazole) AND (enzyme)(ti:(«Helicobacter pylori»)) AND (esomeprazole) AND (enzyme)(ti:(«Helicobacter pylori»)) AND (pantoprazole) AND (enzyme)(ti:(«Helicobacter pylori»)) AND (lansoprazole) AND (enzyme)(ti:(«Helicobacter pylori»)) AND (rabeprazole) AND (enzyme) |
| PubMed | («Helicobacter pylori» [Title] OR «H.pylori» [Title]) AND («proton pump inhibitors» [MeSH Terms] OR «proton pump inhibitors» [Tiab] OR «proton pump inhibitor» [Tiab] OR PPI [Tiab] OR omeprazole [Tiab] OR esomeprazole [Tiab] OR pantoprazole [Tiab] OR rabeprazole [Tiab] OR lansoprazole [Tiab]) AND (Growth [MeSH Terms] OR Growth [Tiab])(«Helicobacter pylori» [Title] OR «H.pylori» [Title]) AND («proton pump inhibitors» [MeSH Terms] OR «proton pump inhibitors» [Tiab] OR «proton pump inhibitor» [Tiab] OR PPI [Tiab] OR omeprazole [Tiab] OR esomeprazole [Tiab] OR pantoprazole [Tiab] OR rabeprazole [Tiab] OR lansoprazole [Tiab]) AND (Metabolism [Tiab])(«Helicobacter pylori» [Title] OR «H.pylori» [Title]) AND («proton pump inhibitors» [MeSH Terms] OR «proton pump inhibitors» [Tiab] OR «proton pump inhibitor» [Tiab] OR PPI [Tiab] OR omeprazole [Tiab] OR esomeprazole [Tiab] OR pantoprazole [Tiab] OR rabeprazole [Tiab] OR lansoprazole [Tiab]) AND (enzymes [Tiab] OR «enzyme activity» [Tiab])(«Helicobacter pylori» [Title] OR «H.pylori» [Title]) AND («proton pump inhibitors» [MeSH Terms] OR «proton pump inhibitors» [Tiab] OR «proton pump inhibitor» [Tiab] OR PPI [Tiab] OR omeprazole [Tiab] OR esomeprazole [Tiab] OR pantoprazole [Tiab] OR rabeprazole [Tiab] OR lansoprazole [Tiab]) AND (nutrition [Tiab]) |
Se seleccionaron artículos originales, con textos completos publicados en cualquier idioma desde el año 1990 hasta diciembre de 2022, con el fin de delimitar el periodo de tiempo y garantizar la reproducibilidad de la búsqueda en momentos posteriores. La búsqueda se produjo entre el 10 y el 27 de marzo de 2023. Se seleccionaron artículos que dentro del título y resumen incluyeran las palabras clave y proporcionaran información de interés para desarrollar la revisión. Como estrategia adicional se revisaron las referencias de los artículos elegidos con el fin de obtener mayor número de fuentes bibliográficas.
Criterios de exclusiónLas revisiones narrativas, sistémicas y artículos duplicados se excluyeron, así como los artículos con información incompleta o irrelevante para el objetivo de la revisión y que no estuvieran disponibles en texto completo.
Evaluación de la calidad metodológicaPara evaluar la calidad metodológica y los posibles sesgos de los estudios incluidos en esta revisión se utilizó la lista de verificación de Joanna Briggs Institute, la cual fue adaptada para los artículos incluidos e implementada por las autoras de la revisión de manera independiente.
Extracción de variables y análisis de la informaciónPara el análisis de la información se definió el siguiente grupo de variables para cada artículo: tipo de IBP, concentración utilizada de cada IBP, tiempo de exposición, efecto en crecimiento, metabolismo y/o actividad enzimática de H.pylori, tipo de estudio (preclínicos o clínicos), métodos y resultados. Con el propósito de organizar y estructurar la información obtenida, las variables anteriores se registraron en tablas de Excel, lo que permitió extraer datos específicos de cada estudio incluido en la revisión.
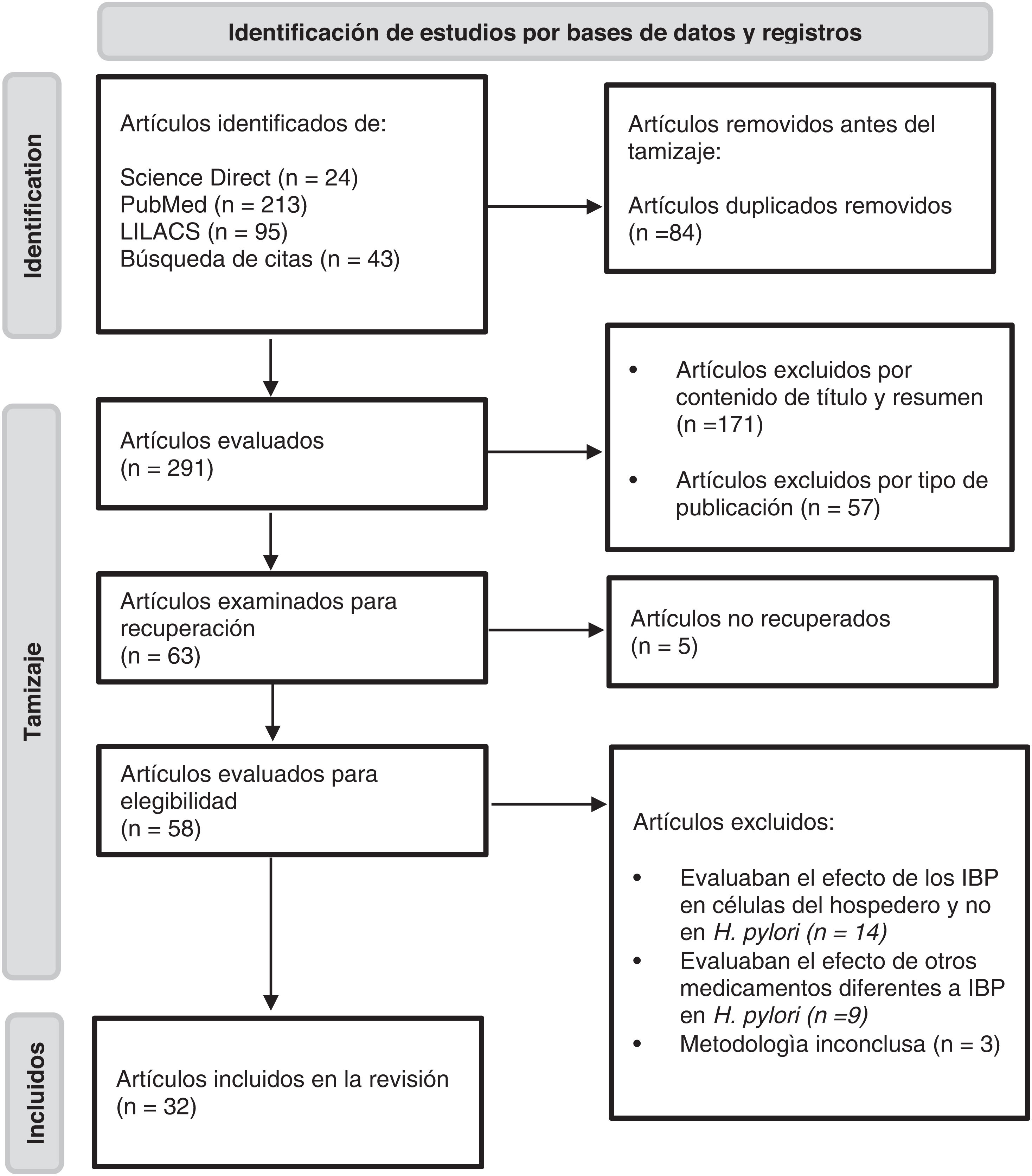
ResultadosSiguiendo la estrategia de búsqueda, se identificó un total de 375 artículos, de los cuales 24 fueron encontrados en la base de datos de Science Direct, 213 en PubMed, 95 en LILACS y 43 de otras fuentes. De estos registros, se excluyeron 84 duplicados y 57 por el tipo de publicación. Posteriormente, se descartaron 171 artículos con base en la lectura del título y resumen para un total de 63 artículos para lectura de texto completo. De estos registros se eliminaron 31 artículos debido a los siguientes aspectos: evaluaban el efecto de los IBP en células del hospedero y no en H.pylori, estudiaban otro tipo de medicamentos diferentes a los IBP, presentaban metodología inconclusa y/o no estaban disponibles para lectura completa. Aplicando estos criterios, se obtuvieron 32 artículos para la construcción de la revisión sistemática. En la figura 1 se presenta el flujograma que esquematiza los resultados obtenidos una vez aplicados los criterios de inclusión y exclusión. En la tabla 2 se muestran los artículos incluidos en la revisión y el efecto evaluado.
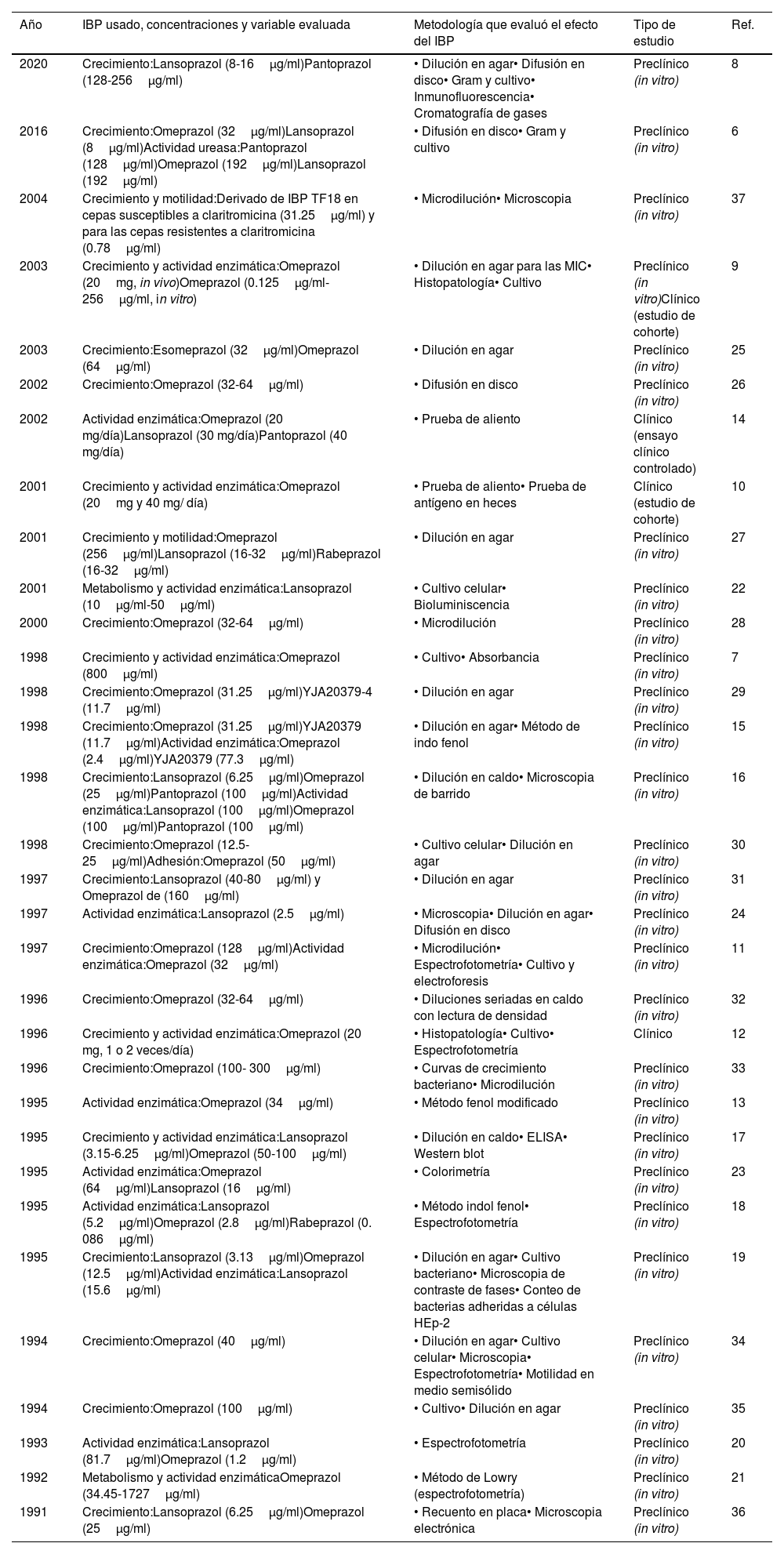
Artículos incluidos y efecto evaluado
| Año | IBP usado, concentraciones y variable evaluada | Metodología que evaluó el efecto del IBP | Tipo de estudio | Ref. |
|---|---|---|---|---|
| 2020 | Crecimiento:Lansoprazol (8-16μg/ml)Pantoprazol (128-256μg/ml) | • Dilución en agar• Difusión en disco• Gram y cultivo• Inmunofluorescencia• Cromatografía de gases | Preclínico (in vitro) | 8 |
| 2016 | Crecimiento:Omeprazol (32μg/ml)Lansoprazol (8μg/ml)Actividad ureasa:Pantoprazol (128μg/ml)Omeprazol (192μg/ml)Lansoprazol (192μg/ml) | • Difusión en disco• Gram y cultivo | Preclínico (in vitro) | 6 |
| 2004 | Crecimiento y motilidad:Derivado de IBP TF18 en cepas susceptibles a claritromicina (31.25μg/ml) y para las cepas resistentes a claritromicina (0.78μg/ml) | • Microdilución• Microscopia | Preclínico (in vitro) | 37 |
| 2003 | Crecimiento y actividad enzimática:Omeprazol (20mg, in vivo)Omeprazol (0.125μg/ml-256μg/ml, in vitro) | • Dilución en agar para las MIC• Histopatología• Cultivo | Preclínico (in vitro)Clínico (estudio de cohorte) | 9 |
| 2003 | Crecimiento:Esomeprazol (32μg/ml)Omeprazol (64μg/ml) | • Dilución en agar | Preclínico (in vitro) | 25 |
| 2002 | Crecimiento:Omeprazol (32-64μg/ml) | • Difusión en disco | Preclínico (in vitro) | 26 |
| 2002 | Actividad enzimática:Omeprazol (20 mg/día)Lansoprazol (30 mg/día)Pantoprazol (40 mg/día) | • Prueba de aliento | Clínico (ensayo clínico controlado) | 14 |
| 2001 | Crecimiento y actividad enzimática:Omeprazol (20mg y 40 mg/ día) | • Prueba de aliento• Prueba de antígeno en heces | Clínico (estudio de cohorte) | 10 |
| 2001 | Crecimiento y motilidad:Omeprazol (256μg/ml)Lansoprazol (16-32μg/ml)Rabeprazol (16-32μg/ml) | • Dilución en agar | Preclínico (in vitro) | 27 |
| 2001 | Metabolismo y actividad enzimática:Lansoprazol (10μg/ml-50μg/ml) | • Cultivo celular• Bioluminiscencia | Preclínico (in vitro) | 22 |
| 2000 | Crecimiento:Omeprazol (32-64μg/ml) | • Microdilución | Preclínico (in vitro) | 28 |
| 1998 | Crecimiento y actividad enzimática:Omeprazol (800μg/ml) | • Cultivo• Absorbancia | Preclínico (in vitro) | 7 |
| 1998 | Crecimiento:Omeprazol (31.25μg/ml)YJA20379-4 (11.7μg/ml) | • Dilución en agar | Preclínico (in vitro) | 29 |
| 1998 | Crecimiento:Omeprazol (31.25μg/ml)YJA20379 (11.7μg/ml)Actividad enzimática:Omeprazol (2.4μg/ml)YJA20379 (77.3μg/ml) | • Dilución en agar• Método de indo fenol | Preclínico (in vitro) | 15 |
| 1998 | Crecimiento:Lansoprazol (6.25μg/ml)Omeprazol (25μg/ml)Pantoprazol (100μg/ml)Actividad enzimática:Lansoprazol (100μg/ml)Omeprazol (100μg/ml)Pantoprazol (100μg/ml) | • Dilución en caldo• Microscopia de barrido | Preclínico (in vitro) | 16 |
| 1998 | Crecimiento:Omeprazol (12.5-25μg/ml)Adhesión:Omeprazol (50μg/ml) | • Cultivo celular• Dilución en agar | Preclínico (in vitro) | 30 |
| 1997 | Crecimiento:Lansoprazol (40-80μg/ml) y Omeprazol de (160μg/ml) | • Dilución en agar | Preclínico (in vitro) | 31 |
| 1997 | Actividad enzimática:Lansoprazol (2.5μg/ml) | • Microscopia• Dilución en agar• Difusión en disco | Preclínico (in vitro) | 24 |
| 1997 | Crecimiento:Omeprazol (128μg/ml)Actividad enzimática:Omeprazol (32μg/ml) | • Microdilución• Espectrofotometría• Cultivo y electroforesis | Preclínico (in vitro) | 11 |
| 1996 | Crecimiento:Omeprazol (32-64μg/ml) | • Diluciones seriadas en caldo con lectura de densidad | Preclínico (in vitro) | 32 |
| 1996 | Crecimiento y actividad enzimática:Omeprazol (20 mg, 1 o 2 veces/día) | • Histopatología• Cultivo• Espectrofotometría | Clínico | 12 |
| 1996 | Crecimiento:Omeprazol (100- 300μg/ml) | • Curvas de crecimiento bacteriano• Microdilución | Preclínico (in vitro) | 33 |
| 1995 | Actividad enzimática:Omeprazol (34μg/ml) | • Método fenol modificado | Preclínico (in vitro) | 13 |
| 1995 | Crecimiento y actividad enzimática:Lansoprazol (3.15-6.25μg/ml)Omeprazol (50-100μg/ml) | • Dilución en caldo• ELISA• Western blot | Preclínico (in vitro) | 17 |
| 1995 | Actividad enzimática:Omeprazol (64μg/ml)Lansoprazol (16μg/ml) | • Colorimetría | Preclínico (in vitro) | 23 |
| 1995 | Actividad enzimática:Lansoprazol (5.2μg/ml)Omeprazol (2.8μg/ml)Rabeprazol (0. 086μg/ml) | • Método indol fenol• Espectrofotometría | Preclínico (in vitro) | 18 |
| 1995 | Crecimiento:Lansoprazol (3.13μg/ml)Omeprazol (12.5μg/ml)Actividad enzimática:Lansoprazol (15.6μg/ml) | • Dilución en agar• Cultivo bacteriano• Microscopia de contraste de fases• Conteo de bacterias adheridas a células HEp-2 | Preclínico (in vitro) | 19 |
| 1994 | Crecimiento:Omeprazol (40μg/ml) | • Dilución en agar• Cultivo celular• Microscopia• Espectrofotometría• Motilidad en medio semisólido | Preclínico (in vitro) | 34 |
| 1994 | Crecimiento:Omeprazol (100μg/ml) | • Cultivo• Dilución en agar | Preclínico (in vitro) | 35 |
| 1993 | Actividad enzimática:Lansoprazol (81.7μg/ml)Omeprazol (1.2μg/ml) | • Espectrofotometría | Preclínico (in vitro) | 20 |
| 1992 | Metabolismo y actividad enzimáticaOmeprazol (34.45-1727μg/ml) | • Método de Lowry (espectrofotometría) | Preclínico (in vitro) | 21 |
| 1991 | Crecimiento:Lansoprazol (6.25μg/ml)Omeprazol (25μg/ml) | • Recuento en placa• Microscopia electrónica | Preclínico (in vitro) | 36 |
De los 32 artículos incluidos en la revisión sistemática, 18 refirieron que los IBP ejercen efecto en la actividad enzimática de H.pylori in vitro; de estos, 14 demostraron que inhiben la actividad enzimática de la ureasa6,7,9-20, mientras que solo uno evaluó el efecto tanto en la enzima ureasa como en la ATPasa. Tres estudios refirieron que estos medicamentos in vitro inhiben la actividad de otras enzimas importantes para H.pylori, tales como las ATPasas, la alcohol deshidrogenasa (ADH), la NADPH-quinona oxidorreductasa y la piruvato-flavodoxina oxidorreductasa, enzimas que participan en procesos metabólicos de la bacteria21-23.
El IBP más evaluado fue el omeprazol, con siete artículos7,9-13,21, seguido del lansoprazol, con dos22,24; además, cuatro evaluaron estos dos fármacos en conjunto, y los artículos restantes incluyeron en menor medida rabeprazol, pantoprazol, esomeprazol, entre otros IBP6,14-20. Por otro lado, los métodos más utilizados para medir la actividad ureasa de H.pylori fueron las técnicas colorimétricas, como el método de fenol modificado y el de indofenol, que miden la concentración de amonio producido por la enzima7,11-13,15,16,18,20. El mecanismo por el cual se altera esta función podría estar relacionado con la capacidad de los IBP de bloquear los residuos sulfhidrilos (SH) en la cisteína del sitio activo de la ureasa6,7,11,16-18,20.
Se observó heterogeneidad en las concentraciones de los IBP utilizadas para evaluar el efecto en la actividad de la ureasa in vitro: las del omeprazol oscilaron entre 1.2 y 800μg/ml, mientras que para lansoprazol fue de 1.7 y 192μg/ml6,7,9-20,24. En los ensayos clínicos se describió que la dosis de 20mg una o dos veces al día de omeprazol, o de lansoprazol de 30mg/día, aumentaba el número de falsos negativos en la prueba rápida de la ureasa, así como en las pruebas serológicas y moleculares9,12,14.
Efecto de los IBP en el crecimientoSe encontraron 25 artículos que evaluaron el efecto de los IBP en el crecimiento de H.pylori, siendo el omeprazol el que exhibió mayor efecto. Veintiún estudios que realizaron los ensayos con este medicamento hallaron concentraciones inhibitorias mínimas (MIC) entre 12.5 a 800μg/ml, a las 72horas de exposición utilizando principalmente el método de dilución en agar6,7,9,11,15-17,19,25-36. El segundo IBP más evaluado fue el lansoprazol, con 8 estudios, hallándose MIC que oscilaron entre 3.13 hasta 40μg/ml, con un promedio de 17.9μg/ml empleando dilución en agar6,8,16,17,19,27,31,36. En solo cinco estudios rabeprazol, pantoprazol y esomeprazol se evaluaron en combinación con omeprazol y/o lansoprazol; no obstante, estos presentaron un efecto similar a los demás6,8,9,16,27.
Diez de los autores no especifican el mecanismo por el cual estos compuestos ejercen la actividad bactericida y bacteriostática en H.pylori7,9,10,12,17,19,27,29-31; la mayoría coinciden en que son procesos independientes de la inhibición de la ureasa y que estarían mediados por varios factores, entre ellos la unión del compuesto sulfenamida en pH ácidos a diferentes proteínas y enzimas tales como las ATPasas bacterianas u otras como la fumarato reductasa y la succinato-citocromo creductasa involucradas en la cadena respiratoria32-36. Finalmente, otras investigaciones explican que el efecto de los IBP sobre el crecimiento y la viabilidad de H.pylori está relacionado con la alteración en la membrana celular producto de modificaciones en el contenido de ácidos grasos, llevando a la inhibición de la división celular, cambios en la permeabilidad y lisis bacteriana6,8,11,16,26,28,37.
Efecto de los IBP en el metabolismo o nutriciónDe los artículos, solo dos evaluaron el efecto de los IBP en procesos metabólicos importantes para H.pylori. Los IBP evaluados fueron omeprazol y lansoprazol con rangos de concentraciones de 3.45 a 1,727μg/ml y 3 a 50μg/ml, respectivamente21,22. La metodología empleada fue diferente para ambos estudios. Nagata et al.22, se basaron en bioluminiscencia para medir la producción de ATP celular mediante el método luciferina-luciferasa, y la técnica de polarografía con electrodos de oxígeno para determinar la producción de oxígeno celular por minuto. Por otro lado, Roine et al.21 utilizaron métodos colorimétricos para evaluar la actividad de la ADH.
Según Nagata et al.22, los IBP alteran la actividad de la piruvato-flavodoxina oxidorreductasa, la cual interviene en la descarboxilación y deshidrogenación del piruvato, el principal sustrato para la generación de energía en H.pylori. A su vez, afecta la producción de NADPH que participa en la cadena respiratoria de la bacteria. Por otro lado, Roine et al.21 describen la acción de los IBP sobre la ADH, enzima que participa en la fermentación de hidratos de carbono a etanol e interviene en el metabolismo energético bacteriano.
DiscusiónLos IBP son medicamentos patentados desde 1979 para el tratamiento de la gastritis, la úlcera péptica y el reflujo gástrico, entre otros. Estos se unen selectivamente a la bomba H+/K+ ATPasa de las células parietales gástricas inhibiendo la secreción de ácido clorhídrico. Posteriormente, cuando se estableció la relación entre H.pylori y el desarrollo de la úlcera gástrica, se usaron en la terapia triple combinada con dos antibióticos, como claritromicina, amoxicilina o metronidazol38. En esta revisión se recopilaron estudios que demuestran el efecto inhibidor de los IBP sobre el crecimiento, la actividad enzimática y el metabolismo de H.pylori. Sin embargo, se resalta la heterogeneidad en las concentraciones utilizadas para la exposición de la bacteria a este grupo de fármacos, esto debido posiblemente a características intrínsecas de la metodología empleada por cada investigador, como la cepa empleada, las condiciones de temperatura, el pH y el medio de cultivo, entre otros.
Dentro de la actividad enzimática de H.pylori, una de las enzimas más estudiadas es la ureasa. Esta es necesaria para la colonización y el establecimiento de H.pylori en la mucosa gástrica, y por esto se considera un blanco potencial de los IBP, ya que la unión de estos compuestos benzimidazólicos al sitio activo de la enzima explicaría en parte el efecto bactericida y bacteriostático15,33. Aunque algunos autores no explican el mecanismo por el cual los IBP afectan la actividad ureasa en H.pylori, otros coinciden en que este efecto depende tanto de la dosis del fármaco como del pH gástrico, porque al estar en su forma activa, estos compuestos se unen a proteínas bacterianas, entre ellas la ureasa11,16-18,20.
Si bien la ureasa se relaciona con la supervivencia de H.pylori en el hospedero, estudios in vitro demostraron la inhibición del crecimiento en cepas delecionadas para el gen de la ureasa posterior a la exposición de IBP, lo que sugiere que el bloqueo de esta enzima no es el único efecto bactericida de estos compuestos, y probablemente hay otros mecanismos implicados en la actividad antibacteriana13,17. Recientemente se propuso a las ATPasas de H.pylori como otras posibles dianas de los IBP, y entre ellas se destaca la ATPasa tipoP, la cual está involucrada en el mantenimiento del pH, el equilibrio de iones intracelulares y el control de la presión de turgencia en la bacteria38,39. Otras son las ATPasas tipoF, que participan en la translocación de protones y son importantes para mantener el pH intracelular regulado y la síntesis de ATP39. Aunque la actividad de la F/P ATPasa bacteriana es importante para la adaptación de H.pylori, estudios in vitro plantean que la unión de los IBP a estas enzimas no está implicada en la inhibición del crecimiento de la bacteria6,32.
Por otra parte, Kumiko et al.22 proponen que la actividad inhibitoria del lansoprazol está relacionada con la alteración de la cadena respiratoria de H.pylori. A pesar de que esta bacteria no posee un ciclo completo de ácido tricarboxílico, utiliza el succinato, el α-cetoglutarato, el isocitrato y el piruvato como sustratos respiratorios, siendo este último la principal fuente de energía. El lansoprazol interfiere con la actividad de la piruvato-flavodoxina oxidorreductasa y afecta la transferencia de átomos de hidrógeno al NADP mediante la flavodoxina NADP oxidorreductasa impidiendo la formación de NADPH, principal donante de electrones en la cadena respiratoria de H.pylori. Esto finalmente altera el metabolismo energético y, por consiguiente, el crecimiento bacteriano; por ello, profundizar en el estudio de estas enzimas sería fundamental para entender la relación entre las alteraciones enzimáticas y metabólicas con el efecto bactericida de los IBP en H.pylori22.
Aunque no existen suficientes estudios recientes que asocien la inhibición de la ADH bacteriana con la supresión del crecimiento de H.pylori, lo encontrado señala que los IBP tienen efecto sobre la ADH, enzima importante en la fermentación de azúcares a etanol, proceso realizado por la bacteria para la obtención de energía11,18,21. Al afectar la actividad de esta enzima, el omeprazol no solo interfiere con una ruta energética importante para el crecimiento de H.pylori, sino que disminuye la formación de acetaldehído, compuesto que está relacionado con las lesiones gástricas. Esto explicaría de forma alternativa la supresión del crecimiento de la bacteria y la resolución de las lesiones gástricas posterior a la administración de IBP21.
Se encontró amplia evidencia sobre la capacidad de los IBP para protonarse en pH ácido, convirtiéndose a la forma sulfenamida, que favorece la unión a diferentes proteínas bacterianas, tanto estructurales como enzimáticas11,16-18,20,21,25. Debido a esto se puede sugerir que este es el principal mecanismo que respalda la acción bactericida y bacteriostática que ejercen los IBP sobre H.pyloriin vitro. Dado que el compuesto sulfenamida es altamente reactivo, logra unirse de manera inespecífica a grupos SH disponibles de la bacteria, que no solo están presentes en enzimas como la ureasa sino también en ATPasas, reductasas y demás proteínas importantes para diversos procesos fisiológicos y la supervivencia bacteriana; esta acción es reversible y está mediada por características como el pH, la dosis y el tiempo de exposición al fármaco21-24.
Otros estudios proponen procesos alternos que explican la inhibición del crecimiento de H.pylori por los IBP, entre ellos la capacidad que tienen estos medicamentos de interactuar y alterar la composición de la membrana celular bacteriana8,11,16,26,28,37. Al ser compuestos con características lipofílicas y catiónicas, los IBP logran unirse a compuestos aniónicos como los fosfolípidos y ácidos grasos. Se ha señalado que los antimicrobianos que poseen estas propiedades provocan la separación y el reordenamiento de los lípidos, causando la formación de poros, la fuga de contenido celular y cambios en la fluidez y la permeabilidad de la membrana, acciones que potencian la muerte de la bacteria; ante este estrés, el ajuste a la composición de ácidos grasos de H.pylori es fundamental para mantener las propiedades biofísicas de la membrana; sin embargo, este gasto de energía adicional se compensa con la disminución de la división celular y del crecimiento, que garantiza la conservación de la rigidez estructural y la resistencia a la lisis. Kadkhodaei et al.8 evaluaron la capacidad de cultivo de la bacteria después del tratamiento con IBP, hallando variaciones en la composición de ácidos grasos de la membrana celular y alteraciones en el crecimiento de la bacteria que fueron reversibles al cultivarla en medios ricos en colesterol; este hallazgo sugiere una forma de cultivo alternativa para la recuperación y la detección de H.pylori en biopsias provenientes de pacientes que consumen estos medicamentos.
Ensayos adicionales demostraron que tras la exposición a los IBP se alteran otras funciones, como la motilidad de H.pylori19,37. Tsutsui et al. describen los flagelos y la forma en espiral de este microorganismo como factores de virulencia importantes en la colonización de la mucosa gástrica y plantean la posibilidad de que derivados de los IBP como el tioéter de rabeprazol se unan a estas estructuras o a moléculas presentes en la superficie bacteriana interfiriendo con su virulencia y motilidad; sin embargo, estos efectos parecen no tener relación con la inhibición del crecimiento de la bacteria40,41. Escoffier et al. demostraron el efecto negativo del pantoprazol sobre la motilidad de espermatozoides humanos, revelando que este IBP inhibe la H+/K+ ATPasa no gástrica de los espermatozoides y altera el intercambio de iones a través de la membrana. Esta investigación aporta evidencia sobre la capacidad que tienen los IBP de alterar no solo componentes y enzimas bacterianas, sino también estructuras de organismos diferentes42.
Aun cuando los estudios in vitro proponen diferentes mecanismos para explicar los efectos de los IBP sobre H.pylori, los estudios realizados en personas no esclarecen la razón por la cual estos fármacos presentan un efecto sobre la fisiología de la bacteria. Se debe considerar que en ensayos in vitro, a diferencia de los ensayos en pacientes, se garantiza la exposición de la bacteria con el medicamento de manera constante. Además, en ensayos clínicos es difícil controlar factores del hospedero como los movimientos peristálticos, el pH y el transporte de sustancias sobre la mucosa gástrica, los cuales están implicados en el comportamiento de H.pylori30.
Esta revisión incluye pocos estudios clínicos; sin embargo, se demostró que la administración de IBP afecta el crecimiento, la morfología y la actividad ureasa de H.pylori, hecho que conduce a resultados falsos negativos en los métodos diagnósticos empleados para la detección de este microorganismo como la prueba rápida de la ureasa, el test de aliento con urea, el cultivo de biopsia y la histopatología; por esta razón, los autores recomiendan el cese de estos medicamentos al menos dos semanas antes de realizar estos procedimientos9,10,12,14. A través de esta revisión se resalta la importancia de nuevos ensayos in vivo y clínicos que permitan detallar el efecto de estos medicamentos sobre H.pylori y su posible repercusión en el tratamiento y el diagnóstico de enfermedades gástricas causadas por esta bacteria.
ConclusiónLos IBP generan múltiples efectos en la fisiología de H.pyloriin vitro, como la inhibición de la actividad ureasa, la interacción con ATPasas, la interferencia de la ADH y otras enzimas importantes en la cadena respiratoria, además de la modificación en la composición de la membrana celular y la afectación de la motilidad bacteriana. El mecanismo principal está relacionado con la capacidad de los IBP para convertirse en sulfenamida, la cual se une de manera inespecífica a diversas enzimas y proteínas bacterianas, afectando tanto componentes estructurales como procesos fisiológicos esenciales de la bacteria.
Los estudios coinciden en que hay un mayor efecto inducido por lansoprazol y omeprazol, ya que existe una relación inversamente proporcional entre la dosis empleada y el efecto generado sobre H.pylori. Mientras que los IBP muestran amplio espectro de efectos sobre la fisiología de H.pylori in vitro, la traducción precisa de estos hallazgos a la práctica clínica requiere mayor comprensión de los mecanismos que ejercen estos medicamentos sobre la bacteria in vivo y la consideración de las complejidades del entorno gástrico del hospedero; por lo tanto, se necesitan investigaciones adicionales para aclarar los detalles de estos efectos y su relevancia clínica.
FinanciaciónEste estudio fue financiado por el Comité Para el Desarrollo de la Investigación (CODI) Universidad de Antioquia, con código 2020–34042.
Conflicto de interesesLos autores declaran ausencia de conflicto de intereses.