El síndrome compartimental abdominal se define cuando 2 o más compartimentos anatómicos tienen una presión intraabdominal con valor sostenido >20mmHg, asociado a una falla orgánica. La incidencia es del 2% y la prevalencia del 0 al 36.4%.
Se realizó la búsqueda bibliográfica en diferentes bases de datos. Se incluyeron artículos publicados desde 1970 al 2018, en inglés o español, con el fin de proporcionar los conceptos, clasificaciones y manejo integral en el abordaje del síndrome compartimental, para tratar y evitar complicaciones severas en los pacientes asociados a dicha entidad.
La medición de la presión intravesical es el método estándar para el diagnóstico. El tratamiento se basa en la evacuación de contenidos intraluminales, identificar y tratar las lesiones intraabdominales, mejorar la complianza de la pared abdominal, y la óptima administración de fluidos y perfusión tisular. La laparotomía es generalmente seguida de un cierre temporal de la pared abdominal de 5 a 7 días después de la cirugía. La reconstrucción es realizada de 6 a 12 meses después de la última operación.
Se debe diagnosticar e intervenir antes del daño orgánico ocasionado por el síndrome compartimental abdominal. Con frecuencia la lesión renal puede progresar, siendo este un parámetro para considerar la descompresión abdominal. Contar con un biomarcador de daño temprano sería ideal. El tratamiento quirúrgico es exitoso en la mayoría. Un enfoque multidisciplinario es necesario para los cuidados intensivos y necesidades reconstructivas del paciente, por lo que es preciso seguir trabajando para definir e implementar estrategias que mitiguen la calidad de vida del paciente.
Abdominal compartment syndrome occurs when 2 or more anatomic compartments have a sustained intra-abdominal pressure >20mmHg, associated with organ failure. Incidence is 2% and prevalence varies from 0% to 36.4%.
A literature search was conducted utilizing different databases. Articles published from 1970 to 2018 were included, in English or Spanish, to provide the concepts, classifications, and comprehensive management in the approach to abdominal compartment syndrome, for its treatment and the prevention of severe complications associated with the entity. Intravesical pressure measurement is the standard diagnostic method. Treatment is based on evacuation of the intraluminal content, identification and treatment of intra-abdominal lesions, improvement of abdominal wall compliance, and optimum administration of fluids and tissue perfusion. Laparotomy is generally followed by temporary abdominal wall closure 5 to 7 days after surgery. Reconstruction is performed 6 to 12 months after the last operation.
Abdominal compartment syndrome should be diagnosed and operated on before organic damage from the illness occurs. Kidney injury can frequently progress and is a parameter for considering abdominal decompression. Having a biomarker for early damage would be ideal. Surgical treatment is successful in the majority of cases. A multidisciplinary focus is necessary for the intensive care and reconstructive needs of the patient. Thus, efforts must be made to define and implement strategies for patient quality of life optimization.
La Sociedad Mundial del Síndrome Compartimental Abdominal (WSACS) define presión intraabdominal (PIA) como la presión abdominal espiratoria final en posición supina en un escenario donde la musculatura de la pared abdominal está completamente relajada1. Medir la PIA es de utilidad para calcular la presión de perfusión abdominal (PPA), la cual se obtiene al restar la PIA de la presión arterial media (PAM); en este sentido la PPA se puede interpretar como el análogo abdominal de la presión de perfusión cerebral y se puede utilizar como un predictor de la perfusión tisular1,2.
En adultos se consideran fisiológicos los niveles de PIA de hasta 5mmHg (el rango normal es de 2 a 7mmHg); sin embargo, en pacientes obesos, la PIA puede oscilar entre 10 y 15mmHg1–3.
En el paciente gravemente enfermo esta puede encontrarse frecuentemente entre 5 y 7mmHg, lo que sumado con la obesidad coopera para el incremento de las mediciones basales de dicha presión4.
La WSACS define la hipertensión intraabdominal (HIA) como PIA sostenida mayor de 12mmHg1–3,5, y la divide en 4 grados: HIA grado I (12-15mmHg), HIA grado II (16-20mmHg), HIA grado III (21-25mmHg), HIA grado IV (>25mmHg)1.
El síndrome compartimental abdominal (SCA) se define, según la WSACS, como un síndrome en el cual 2 o más compartimentos anatómicos cuentan con una PIA>20mmHg (grados III y IV de HIA) en la cavidad abdominal, con o sin PPA<60mmHg, y asociado a una disfunción o falla orgánica1–3,5–7.
La presente revisión actualizada tiene como objetivo proporcionar los conceptos, clasificaciones y manejo integral en el abordaje del síndrome compartimental, para tratar y evitar complicaciones severas en los pacientes asociados a dicha entidad.
Material y métodosSe realizó la búsqueda bibliográfica en PubMed, Medline, Index Medicus, Base de Datos sobre Literatura Latinoamericana en Ciencias de la Salud (LILACS), International Serials Data System; Periódica-Índice de Revistas Latinoamericanas en Ciencias-CICH-UNAM; Bibliomex Salud; Ulrich's International Directory, desde el año 1970 hasta diciembre del 2018, empleando las palabras clave en español o inglés: síndrome compartimental abdominal, hipertensión intraabdominal, presión intraabdominal, tratamiento, manifestaciones clínicas.
ResultadosEpidemiologíaDe acuerdo con un estudio realizado en Escandinavia (2014), la incidencia de HIA es del 39% y la de SCA es del 2%8, mientras que en la Unidad de Cuidados Intensivos (UCI) la incidencia de SCA varía entre el 0.5 y 58.8%2,5,9,10. En los pacientes con antecedente de trauma, las tasas de incidencia aumentan hasta el 14%2.
La prevalencia de SCA varía del 0 al 36.4% en pacientes con daño visceral6, y del 0.9 al 36.4% en pacientes sometidos a laparotomía por trauma abdominal1,6.
Con base en la clasificación de la WSACS, se reporta una incidencia del 23 al 27% en HIA grado I, del 9 al 14% en grado II, del 2 al 3% en grado III y del 1 al 2% en grado IV6,7. A mayor grado de HIA incrementa el riesgo de mortalidad8.
La mortalidad asociada a SCA es elevada; en 2 artículos recientes se reporta una mortalidad del 47.1% y 53.1%, respectivamente2,6.
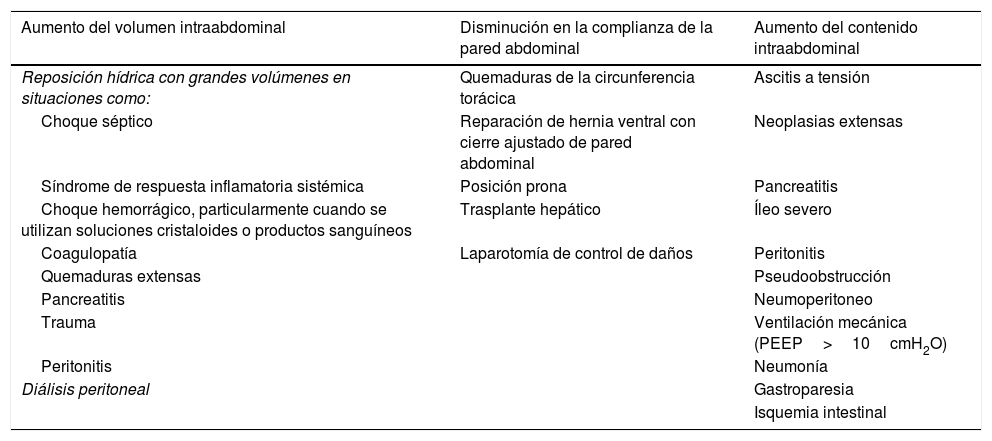
Etiología y factores de riesgoSe ha reportado que la HIA es un factor importante de mortalidad con un riesgo relativo (RR) de 1.85, aun cuando no tenga desarrollado el SCA11. Existen varios factores de riesgo asociados al desarrollo de HIA; sin embargo, es difícil predecir qué pacientes desarrollarán HIA. En general, el aumento de la PIA puede resultar de la disminución de la complianza de la pared abdominal, un aumento en el volumen del contenido abdominal, o una combinación de las dos1. Los principales factores de riesgo de HIA y SCA se resumen en la tabla 11,5,6,12–14.
Factores de riesgo para desarrollar síndrome compartimental abdominal
| Aumento del volumen intraabdominal | Disminución en la complianza de la pared abdominal | Aumento del contenido intraabdominal |
|---|---|---|
| Reposición hídrica con grandes volúmenes en situaciones como: | Quemaduras de la circunferencia torácica | Ascitis a tensión |
| Choque séptico | Reparación de hernia ventral con cierre ajustado de pared abdominal | Neoplasias extensas |
| Síndrome de respuesta inflamatoria sistémica | Posición prona | Pancreatitis |
| Choque hemorrágico, particularmente cuando se utilizan soluciones cristaloides o productos sanguíneos | Trasplante hepático | Íleo severo |
| Coagulopatía | Laparotomía de control de daños | Peritonitis |
| Quemaduras extensas | Pseudoobstrucción | |
| Pancreatitis | Neumoperitoneo | |
| Trauma | Ventilación mecánica (PEEP>10cmH2O) | |
| Peritonitis | Neumonía | |
| Diálisis peritoneal | Gastroparesia | |
| Isquemia intestinal |
Resumen los factores de riesgo para desarrollar síndrome compartimental abdominal (SCA). Estos factores se clasifican de acuerdo con su repercusión sobre la región abdominal: aumento del volumen intraabdominal, disminución en la complianza de la pared abdominal y/o aumento del contenido intraabdominal. Dentro de estos grupos se mencionan diferentes situaciones clínicas que pueden desencadenar en estos efecto, por ejemplo: el choque séptico implica una reposición hídrica con grandes volúmenes, lo que aumenta el volumen intraabdominal, convirtiéndose así en un factor de riesgo para desarrollar SCA; una laparotomía de control de daños conduce a una disminución en la complianza de la pared abdominal, convirtiéndose igualmente en un factor de riesgo para SCA; el caso de una pseudoobstrucción que conlleva un aumento del contenido intraabdominal, volviéndose factor de riesgo para presentar SCA; etc.
Los factores de riesgo independientes para el SCA son la transfusión masiva (>10concentrados de eritrocitos por 24h), un índice de masa corporal (IMC)>30kg/m2, hipotermia (<33°C), un pH<7.2 y la reanimación con >5,000ml de cristaloides en 24h2.
Estos factores de riesgo independientes son esenciales para muchos otros, como quemaduras, heridas y pancreatitis, que requieren reanimación con líquidos y, por lo tanto, pueden inducir SCA2.
FisiopatologíaLa PIA está determinada por 2 elementos: el volumen intraabdominal y la complianza de la pared abdominal5. Tanto el SCA como la HIA resultan de la alteración en la perfusión tisular causada por un aumento de la presión dentro del volumen establecido de un compartimento anatómico1,2.
El efecto que tiene el SCA sobre diversos sistemas es amplio.
En el sistema nervioso central, conlleva una disminución de la perfusión sanguínea cerebral aunado a un incremento de la presión intracraneana al inducir estasis venosa2,14.
A nivel cardíaco, el aumento en la PIA tiene consecuencias, entre ellas, una disminución del retorno venoso causado por la compresión de la vena cava inferior y por lo tanto repercute en la elevación de la presión intratorácica (PIT). Se produce alteración en la función cardíaca debido a una compresión del corazón secundaria a una elevación diafragmática14; como la fuga capilar que genera edema, por lo tanto se manifiesta en un estado de hipovolemia14. La PIA alta también puede aumentar la resistencia vascular sistémica al comprimir la aorta y la circulación esplénica, lo que da como resultado una poscarga aumentada y un volumen sistólico reducido generando una disminución neta en el gasto cardíaco con la hipotensión resultante1.
El aumento del síndrome de permeabilidad se ha correlacionado en pacientes con persistencia de inflamación sistémica en su defecto para reducir la pérdida transcapilar de albúmina; puede representar un tercer golpe (complicación) después de la lesión inicial y la lesión por isquemia-reperfusión. Existen marcadores novedosos, como el índice de fuga capilar, el agua pulmonar extravascular y el índice de permeabilidad pulmonar, que pueden ayudar en el control de la administración de fluidos de manera dirigida a las necesidades individuales en cada paciente, ya que la fuga capilar es una condición inflamatoria que resulta de una vía común que incluye la isquemia-reperfusión, la generación de metabolitos tóxicos de oxígeno, lesión de la pared celular y lesión enzimática que conlleva una pérdida de la función de la barrera endotelial capilar14.
A nivel pulmonar, el aumento de la PIA conduce a la elevación del diafragma, lo que reduce el volumen torácico, la capacidad residual funcional y la distensibilidad, al tiempo que aumenta la presión intrapleural1,5,14,15. La atelectasia por compresión resultante incrementa el espacio muerto fisiológico2. El desajuste de la relación ventilación-perfusión resultante a menudo causa un empeoramiento progresivo de la hipoxemia, la hipercapnia y la acidosis, que pueden requerir soporte con ventilación mecánica invasiva1,2,5,14. Incrementos en la presión pico, meseta y alveolar aumentan el riesgo para desarrollar barotrauma y volutrauma alveolar. La isquemia asociada con la hipoxia tisular puede provocar la liberación sistémica de citocinas proinflamatorias, resultando en acumulación de neutrófilos y producción de radicales libres de oxígeno a nivel pulmonar. Estos mecanismos están implicados en el desarrollo de lesión pulmonar aguda y el síndrome de dificultad respiratoria aguda1,2,14,15.
La presencia de HIA dará lugar a la hipertensión pulmonar a través de un aumento de la PIT y por consiguiente una compresión directa al parénquima pulmonar y los vasos, dando lugar a una disfunción ventricular izquierda y derecha2,16.
La mala perfusión intestinal resultante de la disminución de la circulación esplénica, la lesión renal aguda secundaria a disminución del flujo sanguíneo glomerular y la disminución del retorno venoso como resultado de la compresión de la vena cava inferior pueden llevar a acidosis sistémica y colapso cardiovascular1.
Tanto la presión venosa central como la producción urinaria no reflejan la potencial depleción de volumen de los pacientes con SCA2,16. Por lo tanto, el índice de volumen diastólico final del ventrículo derecho es el diagnóstico de elección para obtener una impresión de la situación intravascular2,16.
Una alteración de la microperfusión de la mucosa resulta en la elevación del lactato sérico, lo que disminuye el pH, y causa isquemia mesentérica2. La isquemia intestinal puede manifestarse como edema intersticial y/o íleo, los cuales aumentan el volumen intraabdominal y empeoran el SCA. Se ha reportado que después de 60min de PIA sostenida mayor de 25mmHg, el flujo sanguíneo de la mucosa se altera, incluso en pacientes bien reanimados, y se ha demostrado que permite la translocación de bacterias intraluminales a través de la barrera mucosa dañada. Esta translocación bacteriana puede provocar sepsis o choque séptico si el SCA no se reconoce y se trata de manera inmediata, provocando un rápido deterioro clínico o la muerte del paciente1.
La disfunción renal también es común en el SCA y se manifiesta como oliguria cuando la PIA es >15mmHg o como anuria cuando la PIA es >30mmHg1,5. La HIA reduce el flujo plasmático renal y la tasa de filtración glomerular mediante la compresión de la arteriola renal (la resistencia vascular de los vasos renales aumenta hasta un 500% si la PIA es >20mmHg)2 y la circulación venosa y de los túbulos mismos1,14, dando como resultado una activación del sistema renina-angiotensina (vasoconstricción de los vasos renales) y niveles séricos elevados de hormona antidiurética (ADH) y aldosterona (efectos antidiuréticos). Esta empeora el SCA por un aumento adicional de la HIA y una disminución adicional de la perfusión renal1,2,14.
Reconociendo el papel fundamental de la reanimación con líquidos en la patogénesis de la HIA y el SCA, se debe evitar la reanimación de gran volumen con cristaloides en pacientes con o en riesgo de presentar SCA5.
Una PIA elevada podría ocasionar hipoperfusión hepática, ya que evoca una reducción del flujo sanguíneo a través de la vena porta de hasta el 35%1,2. La insuficiencia hepática se manifiesta a través de la eliminación alterada del lactato en plasma, lo que resulta en una acidosis metabólica. Además, los aumentos en los niveles de lactato sérico deprimen el pH del suero, lo que puede provocar una disminución de la contractilidad miocárdica. La acidosis láctica también puede causar dilatación arteriolar sistémica, lo que deprime aún más la presión arterial sistémica, afecta la respiración celular y aumenta aún más la producción de ácido láctico, creando de manera efectiva un ciclo de retroalimentación que acelera el deterioro fisiológico1.
ClasificaciónDe acuerdo con su patogénesis, el SCA se clasifica como primario si la HIA resulta de una lesión o enfermedad intraabdominal (lesión de órganos parenquimatosos como bazo o hígado, rotura de un aneurisma aórtico abdominal, pancreatitis, hemorragia retroperitoneal)2,12,13,17.
El SCA secundario se define como una HIA causada por una patología extraperitoneal o sistémica, como sepsis o quemaduras graves2,12,13,17.
El SCA terciario es una enfermedad recurrente después del tratamiento inicial exitoso del SCA primario o secundario2.
Manifestaciones clínicasLa presentación clínica generalmente incluye un abdomen tenso, distendido, disnea, ortopnea, dolor abdominal, sensación de plenitud, hipotensión o hipertensión, hipercapnia y oliguria2,3.
Por el contrario, se ha descrito que el paciente ventilado presenta edema y distensión abdominal2.
DiagnósticoEl requisito más importante para el diagnóstico y tratamiento del SCA es la medición de la PIA, que puede medirse de manera directa o indirecta, intermitente o continua16.
El reconocimiento temprano de la HIA es el primer paso esencial para la prevención del SCA. La PIA debe medirse en pacientes con 2 o más factores de riesgo (tabla 1)1. En tales casos, la PIA debe ser monitoreada a intervalos de 4 a 6h, con monitorización de la PIA por hora restringida a pacientes que sufren de disfunción orgánica grave3.
La medición de la PIA se puede determinar indirectamente por medio de catéteres intravesicales o intragástricos, entre otros18. La medición de la presión intravesical es el método estándar para determinar la presencia de SCA o de HIA por medio del método modificado de Kron, dada su simplicidad, confiabilidad, facilidad de uso y reproducibilidad, con los beneficios adicionales de bajo costo, poco invasivo, riesgos de complicación mínima y simple1–3,5,7,16,19.
La presión intravesical se mide mediante la instilación de 20ml de agua estéril o solución salina en la vejiga a través de un catéter urinario conectado a un manómetro a cero en el nivel de la línea axilar media. El procedimiento debe realizarse con técnica estéril para prevenir infecciones iatrogénicas del tracto urinario. La instilación de más de 50ml en el catéter aumenta artificialmente la PIA medida. Esta técnica está contraindicada en aquellos con antecedentes de cistectomía, lesión vesical traumática o empaquetamiento pélvico1.
Se han descrito variaciones de la técnica original, entre ellas, utilizar un transductor de presión conectado a un sistema de llave de paso, técnica de tubo en U y la que emplea un conjunto Y3.
De acuerdo con la WSACS, la PIA debe expresarse en mmHg y las mediciones se realizan al final de la espiración, con el paciente en posición supina completa y en ausencia de contracciones del músculo abdominal1,15.
La medición directa de PIA es teóricamente el método más preciso, pero requiere acceso al compartimento peritoneal, incluyendo los riesgos asociados con los procedimientos abdominales invasivos. Por lo tanto, estas técnicas no son ampliamente útiles en el cribado de HIA1.
Las mediciones de presión de la vena cava inferior han demostrado una buena correlación con las presiones obtenidas a través de otros métodos validados. La presión intragástrica es un medio alternativo para medir indirectamente la PIA y se obtiene mediante manometría de tubo nasogástrico u orogástrico1,5,16,19–21; sin embargo, las mediciones intermitentes obtenidas con esta técnica pueden ser poco confiables debido a los efectos de confusión del aumento de presión causado por las contracciones gástricas. El monitoreo continuo de la presión usando un balón intragástrico puede ser útil para superar esta limitación. Aunque esta técnica supera los efectos de confusión de las contracciones gástricas, otros factores, como la administración de alimentos enterales, pueden confundir las mediciones; un efecto que no está suficientemente caracterizado en la literatura. Se han descrito otras técnicas novedosas que utilizan catéteres especializados con microchips incrustados para medir las presiones intravesical, rectal o intrauterina, pero son menos rentables que las técnicas más simples descritas anteriormente1.
La sensibilidad y valor predictivo positivo de la exploración física oscilan en un 40-60%1–3. El uso del perímetro abdominal es igualmente inexacto. Estudios de imagen como la radiografía simple de abdomen, ecografía abdominal o tomografía computarizada también son pruebas poco específicas para detectar el aumento de la PIA13,15,16.
Kreis et al., 2013, recomiendan que a todos los pacientes en terapia intensiva posterior a una cirugía abdominal aguda o posterior a una reanimación hídrica deberá medirse la PIA al menos cada 6h22.
TratamientoEl manejo médico y el quirúrgico han sido descritos como el tratamiento en el SCA y no tienen por qué ser mutuamente excluyentes.
La WSACS publicó un algoritmo de tratamiento, que se basa en 5 columnas: (1) evacuación de contenidos intraluminales, (2) evacuación de lesiones intraabdominales que ocupan espacio, (3) mejora de la complianza de la pared abdominal, (4) óptima administración de fluidos y (5) perfusión óptima2,3,5,7.
Evacuación de contenidos intraluminalesEl primer paso de la evacuación endoluminal puede ser la inserción de drenaje por sonda nasogástrica o rectal, que ha demostrado ser eficaz para reducir la PIA2.
Para evitar la distensión abdominal, los procinéticos como la metoclopramida y la eritromicina o la neostigmina son ampliamente utilizados. Para el tratamiento del estreñimiento inducido por opioides, la metilnaltrexona puede ejercer efectos procinéticos. Si el paciente no responde, se debe considerar la descompresión del colon mediante endoscopia2.
Lesiones ocupantes de espacioLas lesiones ocupantes de espacio se observan comúnmente después de una cirugía abdominal mayor, pancreatitis o trauma. Además, la sobrecarga de líquidos durante la reanimación temprana puede dar como resultado un cambio de fluido hacia la cavidad peritoneal. Además del hecho de que estas lesiones conllevan el riesgo de infección secundaria, pueden causar o contribuir al aumento de PIA en la UCI2.
Para los grados I y II de HIA, el soporte con líquido ayuda a mantener la perfusión y esto contrarrestará los efectos negativos de la HIA23. Una técnica invasiva para lograr la reducción de volumen intraabdominal es el drenaje percutáneo con catéter o paracentesis de gran volumen2,5. Sin embargo, pueden surgir dificultades técnicas con dichos métodos incluyendo infección secundaria a ascitis, perforación del intestino u otras estructuras intraabdominales, incluyendo las estructuras vasculares24.
Aumento de la complianza de la pared abdominalEl bloqueo neuromuscular es una maniobra de rescate para disminuir la PIA mediante un aumento de la complianza de la pared abdominal. Sin embargo, debe evitarse el uso habitual de sustancias relajantes debido a sus efectos secundarios (atelectasia, neumonía, etc.)1,2,25.
El bloqueo neuromuscular tiene una utilidad clínica limitada en el tratamiento definitivo de la HIA y es ineficaz para el tratamiento del SCA verdadero. No obstante, puede ser útil como una medida temporal cuando el manejo quirúrgico definitivo no está disponible o no es factible1.
Administración optimizada de fluidos y perfusión de órganosCuando se emplea la reanimación temprana con líquidos en el paciente séptico, el intensivista tiene que equilibrar la corrección de la hipovolemia para evitar un SCA iatrogénico secundario. La WSACS recomienda la diuresis farmacéutica en la fase inicial, con el uso de agentes diuréticos de asa como la furosemida, así como terapia de reemplazo renal2,7,26. La furosemida no solo reduce el volumen intravascular sino que también puede disminuir el edema de la pared intestinal, lo que conduciría a una reducción de la PIA27. La elección de la técnica depende del condicionante de distensión luminal, ya sea a través de la evacuación intestinal, evacuación de hematomas, drenaje por medio de sonda nasogástrica y rectal, entre otras medidas28.
De acuerdo con la situación clínica, la hemofiltración continua puede ser necesaria y debe instalarse temprano en la terapia de SCA. Como se mencionó anteriormente, la presión venosa central a menudo es artificialmente elevada. Por lo tanto, el índice de volumen diastólico final del ventrículo derecho podría servir como una guía durante la terapia de volumen. A pesar de depender de la contractilidad cardíaca y la fracción de eyección, un volumen de <90ml/m2 se asocia con una alta tasa de respuesta a la administración de líquidos. Una vez optimizado, más líquido no mejorará el índice de volumen diastólico final del ventrículo derecho, pero podría agravar el edema del intestino y la HIA2.
Descompresión quirúrgica y conceptos modernos de la gestión del abdomen abiertoEl abdomen abierto es un dilema para el cirujano. Por un lado, la tasa de complicaciones aumenta después de 8 días de terapia de abdomen abierto; por otro lado, un cierre de la cavidad abdominal bajo una tensión excesiva conlleva el riesgo de un SCA terciario. Debido a sus riesgos, los cirujanos e intensivistas deben buscar un cierre fascial definitivo rápido tan pronto como sea posible pues reduce la mortalidad y las complicaciones postoperatorias significativamente2. Se ha sugerido que el cierre abdominal se realice dentro de los primeros 5 a 7 días posteriores a la descompresión abdominal si es que el paciente fue sometido a una descompresión temprana antes de desarrollar una lesión orgánica2,19.
El tratamiento definitivo del SCA en la mayoría de las causas distintas de la ascitis tensa implica la descompresión quirúrgica emergente del abdomen a través de una laparotomía media, que a menudo se realiza al lado de la cama en la UCI2,7,25,28,29. Sin embargo, esto puede ser extremadamente mórbido (49.2%) y debe reservarse solo para las formas más graves de HIA o SCA verdadero1,2,7,19,21,22. La mayoría de los autores coinciden en que la laparotomía descompresiva se debe realizar en pacientes con insuficiencia orgánica nueva o progresiva con PIA>20mmHg7,19,21,22.
El manejo del abdomen abierto conlleva varias complicaciones y riesgos: el paciente quirúrgico se ve amenazado por la pérdida permanente de proteínas, la retracción fascial, el abdomen congelado y las fístulas enteroatmosféricas2,30.
Se ha demostrado que una descompresión abdominal previa a que se desarrolle el SCA mejora la sobrevida31.
Cabe destacar el hecho de que pueden presentarse complicaciones tras una descompresión súbita, como son el síndrome de isquemia-reperfusión que puede resultar en hipotensión severa e inclusive en paro cardíaco. Para prevenir esta situación, se debe asegurar que el paciente reciba el soporte suficiente con líquidos por vía parenteral y previamente a la descompresión abdominal32.
Existen diferentes técnicas de cierre temporal abdominal (CTA): cierre de piel, bolsa de Bogotá, técnica de sándwich Opsite (lámina de polietileno, apósitos Opsite, drenajes de succión), malla absorbible (Vicryl), cremallera no absorbible/cremallera comercial (parche Wittmann) y cierre asistido por vacío (VAC)2,33,34. De acuerdo con Hecker et al., 2016, las técnicas CTA mejoraron drásticamente el manejo clínico de estos pacientes de cuidados intensivos. La técnica CTA ideal debería prevenir la evisceración y permitir la extracción del líquido intraabdominal y el lavado continuo de la cavidad peritoneal, evitar la retracción fascial, la pérdida de la complianza de la pared abdominal y las fístulas enteroatmosféricas2. Hasta el momento, no se ha descrito ninguna técnica de CTA que cumpla todos estos requisitos y pueda considerarse óptima2.
Históricamente la bolsa de Bogotá, nombrada así por Mattox, quien observó este procedimiento en Bogotá, utilizaba una bolsa de 3l de solución salina que cubre el contenido abdominal y se suturaba a la piel. Las ventajas de esa técnica son el bajo costo, el no ser adherente, previniendo la evisceración, la facilidad de su aplicación y su accesibilidad. Las desventajas son la pérdida de piel, la dificultad de reentrada, la necesidad de esterilizar los materiales y el poco control de fuga de líquido al tercer espacio35.
En cuanto a las mallas, las absorbibles son de poliglactina 910 y ácido poliglicólico. Ambas se pueden asegurar a la piel o a la fascia y ofrecen gran fuerza de resistencia. La desventaja de utilizar mallas absorbibles es que tienen una mayor incidencia en el desarrollo de fístulas enterocutáneas36. Las mallas no absorbibles más utilizadas son las de polipropileno y las de politetrafluoroetileno. Debido a que son no absorbibles, son propensas a la colonización e infecciones, deben ser retiradas y no se puede realizar un cierre definitivo37.
El parche de Wittmann es un dispositivo de poliamida y polipropileno con un cierre tipo Velcro. Estas hojas son suturadas a los bordes de la fascia. El parche es retirado y se puede proceder a un cierre definitivo. Las ventajas de este método incluyen facilidad para reentrada y prevención de pérdida del dominio abdominal. Las desventajas incluyen el costo, la manipulación de la fascia con posibilidades de que aparezca necrosis de la fascia y disminución del control de líquido del tercer espacio38.
El cierre con aspiración asistida utiliza un envoltorio no adherente sobre el contenido abdominal. Primero el cirujano debe realizar fenestraciones en el envoltorio. Se colocan las almohadillas de laparotomía sobre el envoltorio junto con 2 tubos de drenaje empaquetados entre las almohadillas de laparotomía39. Se cubre con loban y se aplica succión a los drenajes, para que se aplique presión negativa a la herida. En general los apósitos se cambian cada 48-72h, con aproximación de los bordes de la fascia. Las ventajas del uso de aspiración son que disminuye la probabilidad de que aparezca SCA, disminución de la pérdida de dominio, remueve y se puede cuantificar el líquido del tercer espacio y favorece el cierre temprano de la fascia40. Los pacientes que se mantienen con abdomen abierto están en riesgo de complicaciones como el síndrome de respuesta inflamatoria sistémica, síndrome de disfunción multiorgánica, fistulas e íleo postoperatorio41.
La laparotomía es generalmente seguida de un cierre de la pared abdominal temporal a fin de crear un espacio funcional peritoneal para disminuir la probabilidad de recurrencia del SCA. Se debe tomar en cuenta que ni el sistema VAC evita las recurrencias. Por lo tanto, el médico debe estar alerta y dar un seguimiento de los pacientes para verificar que no exista incremento de la PIA42. Estos pacientes requieren al menos una, y con frecuencia varias reexploraciones antes del cierre abdominal definitivo, muchos de los cuales se pueden realizar en la UCI bajo sedación profunda. Para aquellos que son incapaces del cierre abdominal en su primera reexploración, existen varias opciones en cuanto a su manejo, como las técnicas de extensión fascial, las técnicas de separación de componentes con o sin refuerzo de malla (biológico o sintético), y malla temporal seguida de un injerto de piel de espesor dividido43.
El realizar una laparotomía descompresiva asociada a un cierre abdominal temporal con malla de politetrafluoroetileno expandido (PTFEe) en pacientes con un SCA ante una pancreatitis aguda grave permite una reducción de la PIA y constituye un procedimiento terapéutico a tener en cuenta; asimismo, este tipo de cierre abdominal temporal permite una reconstrucción precoz de la pared abdominal44. Las principales ventajas de la malla de PTFEe son: ausencia de adhesiones que facilitan la formación de fístulas, resistencia del material a la tracción a la que es sometida con elevadas presiones, posibilidad de reexplorar la cavidad abdominal a través de la propia malla, cortándola y volviéndola a suturar, y, por último, permite realizar una aproximación progresiva de la malla para facilitar el posterior cierre definitivo de la pared abdominal45.
El momento de la reconstrucción de la pared abdominal es generalmente de 6 a 12 meses después de la última operación, para permitir disminuir la inflamación. La reconstrucción consiste en la extirpación del injerto de piel, lisis de las adherencias, restaurar la continuidad gastrointestinal si hay una ostomía, y el cierre de la fascia frontal46.
Una revisión reciente de la literatura reveló que es posible el cierre de la fascia abdominal en el 72% de los pacientes con CTA. Curiosamente, la tasa de cierre fue significativamente menor en pacientes sépticos en comparación con pacientes no sépticos (por ejemplo, trauma). Si la técnica de CTA elegida era un método dinámico que combinara la presión negativa con la retracción fascial (por ejemplo, mediante la implantación de malla), la tasa de cierre aumentó al 82%2.
Para el sistema VAC, que consiste en una esponja en forma de araña, se ha informado una tasa de cierre fascial secundaria del 89%. A pesar del éxito de las técnicas de CTA basadas en el vacío, corren el riesgo de desarrollar una fístula enterocutánea2.
El cierre primario tardío sin la presencia de tensión es la forma de cierre definitivo de elección en el abdomen abierto. El riesgo de aparición de infección, fístulas enterocutáneas y problemas de la herida disminuyen si se realiza un cierre primario. Sin embargo, la morbimortalidad en el cierre primario se asocia a un cierre en presencia de tensión en la fascia46. En caso de que el cierre primario no se pueda realizar, las opciones de cierre definitivo incluyen prótesis permanentes, que comprenden mallas absorbibles y no absorbibles, y cierre con tejido autólogo cubierto con injerto de piel sobre una base de tejido granulado47.
De manera simultánea el paciente debe ser mantenido en la UCI buscando la mejor perfusión tisular sistémica y por ende del compartimento abdominal, a través del uso de líquidos de manera racional, buscando la dosis óptima con base en el método preferido en cada unidad (invasivos y no invasivos)48, el uso adecuado de vasopresores que permitan tener una presión de perfusión adecuada y el manejo del apoyo mecánico ventilatorio como claves fundamentales, este último basado en una vigilancia adecuada con la medición de presiones intraabdominal y esofágica que permita mantener una relación adecuada de las presiones generadas por el ventilador que disminuyan la posibilidad de daño inducido por el mismo, basados en la protección pulmonar con volúmenes bajos, PEEP (por sus siglas en inglés: presión positiva al final de la espiración), óptimo para la situación de PIA que permita la mejor distensibilidad pulmonar y en caso necesario poder realizar maniobras de reclutamiento alveolar que mantengan el intercambio de gases de manera adecuada. Esto complementado por medidas de confort para el paciente a través del uso de sedación y analgesia que deberá ser ajustada de acuerdo con el momento en que se encuentre el paciente (abdomen abierto vs. cerrado, manejo inicial médico, etc.), llegando a ser necesario en ocasiones la relajación muscular para favorecer el control estrecho de la PIA49.
ConclusionesEn la actualidad, consideramos que estamos aún con la falta de un diagnóstico oportuno de SCA. Idealmente, debemos ser capaces de diagnosticar oportunamente el SCA para intervenir antes de la aparición del daño orgánico. Con frecuencia la lesión renal persiste y puede progresar a una insuficiencia renal aguda, siendo este uno de los principales parámetros para considerar la descompresión abdominal. Al igual que en otros sistemas u órganos, el contar con un biomarcador de daño fácilmente identificable y temprano será lo ideal.
El tratamiento quirúrgico del SCA en la mayoría de los casos es exitoso, y restaura a la mayoría de los pacientes con un estado funcional adecuado. Múltiples terapias coadyuvantes son a menudo necesarias para optimizar los resultados en un determinado grupo de pacientes críticamente enfermos.
Un enfoque multidisciplinario es generalmente necesario para cumplir los cuidados intensivos, convalecencia y necesidades reconstructivas de los pacientes, siendo altamente recomendable seguir trabajando para definir e implementar estrategias que mitiguen contra la calidad de vida de la población afectada. Se requieren estudios de investigación clínica y en ciencias básicas, para mejorar el estudio integral del SCA.
Consideraciones éticasNo se involucraron pacientes en la redacción de este artículo, por lo que no se solicitaron consentimientos informados. Los pacientes que se mencionan en el manuscrito corresponden a los pacientes involucrados en el estudio del artículo citado.
No se consideró necesaria la autorización por parte del comité de ética debido a que no se involucraron pacientes o modelos animales en la realización de esta investigación bibliográfica
Los autores declaran que este artículo no contiene información personal que permita identificar a los pacientes, debido a que no se involucran pacientes.
FinanciaciónLos autores declaran que no se recibió ningún tipo de financiación para este estudio.
Conflicto de interesesNo existe ningún conflicto de intereses que divulgar.
Se agradece a los médicos cirujanos Ericka Hazzel Contreras Flores y Alan I. Contreras Treviño su apoyo técnico editorial.