El síndrome de hiperémesis cannabinoide (SHC) es un trastorno crónico caracterizado por episodios de vómito intenso alternados con periodos asintomáticos o mínimamente sintomáticos. Los episodios de emesis tienden a ser incapacitantes, afectando negativamente la calidad de vida. Su principal característica es que se asocia a un consumo previo intenso y crónico de cannabis. El SHC es similar al síndrome de vómitos cíclicos (SVC), salvo que se espera que el cese sostenido del cannabis resuelva los episodios de vómitos.
La duración media entre el inicio de los episodios agudos de SHC y el diagnóstico oscila entre los tres y seis años con base en los casos publicados previamente. Este retraso diagnóstico demuestra una falta de concientización de los médicos con respecto a esta enfermedad. El retraso diagnóstico del SHC da lugar a frecuentes visitas al servicio de urgencias, aumenta los costes de la asistencia hospitalaria, y la falta de un tratamiento eficaz conduce a una mala evolución de los pacientes. El diagnóstico plantea considerables dificultades y algunos autores diagnostican el SHC en pacientes con vómitos cíclicos y consumo crónico de cannabis, independientemente de la duración o la potencia del consumo.
El objetivo de esta revisión narrativa es proporcionar un análisis detallado y crítico de los conocimientos actuales sobre el SHC. Este documento se centrará en una revisión bibliográfica detallada sobre el consumo de cannabis en el mundo, el papel del sistema endocannabinoide en la fisiopatología del SHC, los criterios diagnósticos y el tratamiento actual del SHC.
Cannabinoid hyperemesis syndrome (CHS) is a chronic disorder characterized by episodes of severe vomiting, alternating with asymptomatic or minimally symptomatic periods. The episodes of emesis tend to be disabling, negatively affecting quality of life. The disorder's main characteristic is that it is associated with previous chronic heavy cannabis use. CHS is similar to cyclic vomiting syndrome (CVS), with the exception that the sustained cessation of cannabis use is expected to resolve the vomiting episodes.
The average time between the onset of acute CHS episodes and diagnosis ranges from three to six years, based on previously published cases. This delay in the diagnosis reflects a lack of awareness of the condition on the part of physicians. Delayed diagnosis of CHS results in frequent emergency room visits and increased healthcare costs, and the lack of effective treatment leads to poor patient outcomes. The diagnosis is challenging, and some authors have diagnosed CHS when patients had cyclic vomiting, in the context of chronic cannabis use, regardless of the duration of use or the potency of the product used.
The aim of this narrative review is to provide a detailed and critical analysis of current knowledge about CHS. The present document focuses on a thorough review of the literature on worldwide cannabis use, the role of the endocannabinoid system in the pathophysiology of CHS, diagnostic criteria, and current management of CHS.
Durante las últimas dos décadas, cada vez menos adultos han visto el uso del cannabis como riesgoso. Sin embargo, aunque algunos sujetos pueden utilizar el cannabis sin daño alguno, su uso en otras personas ha sido asociado con trastornos gastrointestinales, uno de los cuales es el síndrome de hiperémesis cannabinoide (SHC)1,2. El SHC es un trastorno crónico caracterizado por episodios de vómito graves, alternando con periodos asintomáticos o relativamente asintomáticos, que están asociados con un uso intenso y crónico de cannabis. El SHC se describió por primera vez en 1966 en un hombre de 22años que presentó náusea y vómito recurrentes durante dos años3. El SHC es similar al síndrome de vómitos cíclicos (SVC), excepto que se espera que la suspensión sostenida del uso de cannabis resulte en la resolución de los episodios de vómito. Los episodios de emesis tienden a ser incapacitantes, teniendo un impacto negativo en la calidad de vida. La prevalencia del vómito cíclico ha crecido en los Estados Unidos, en paralelo con la legalización del cannabis, y por lo tanto ha sido sujeto de mayor atención por parte de la comunidad científica en años recientes. Sin embargo, los datos sobre la fisiopatología del SHC, los factores asociados y el tratamiento aún son desconocidos. A pesar de existir una heterogeneidad considerable en el diagnóstico de la enfermedad, la Fundación de Roma estableció los criterios para el diagnóstico de SHC en 2016. La tabla 1 describe los criterios de RomaIV para el SHC.
Criterios de diagnóstico para el síndrome de hiperémesis cannabinoide según el consenso de Roma IV
| • Episodios estereotipados de vómito similares a los presentes en el síndrome de vómitos cíclicos en términos de inicio, duración y frecuencia |
| • Presentación de uso prolongado y abundante de cannabis |
| • Mejoría clínica después del cese del uso prolongado de cannabis |
| Criterios observados durante al menos 3 meses, con comienzo de síntomas al menos 6 meses previo al diagnóstico |
Fuente: adaptado de Stanghellini et al.121.
Sin embargo, existen desafíos considerables involucrados en la realización del diagnóstico. Algunos autores han diagnosticado SHC cuando los pacientes tenían vómito cíclico, en el contexto de uso crónico de cannabis, independientemente de la duración del uso o de la potencia del cannabis utilizado. Otros autores han diagnosticado SHC con base en la asociación con baños con agua caliente, aunque esto no es patognomónico4. Además, muchos pacientes no están dispuestos a dejar de usar cannabis, dados sus supuestos beneficios, lo cual representa un desafío significativo para el diagnóstico. El SHC resulta en visitas frecuentes a la sala de urgencias, un elevado costo al sistema de salud, y la falta de tratamiento efectivo lleva a malos desenlaces para los pacientes.
Aunque el uso de cannabis data de hace miles de años, aún no es claro por qué el SHC no ha sido evidente hasta hace poco en la práctica clínica5,6. Se ha postulado que el uso de productos de cannabis de alta potencia que han estado disponibles al público durante las últimas dos décadas resulta en hiperémesis.
El objetivo de esta revisión narrativa es hacer una revisión detallada de la literatura sobre el uso de cannabis a nivel mundial, el papel del sistema endocannabinoide en la fisiopatología del SHC, los criterios de diagnóstico y el manejo actual del SHC.
Materiales y métodosRealizamos una revisión narrativa que evaluó y analizó artículos publicados nacional e internacionalmente sobre el diagnóstico y el tratamiento del SHC. Se realizó una búsqueda cruzada en MEDLINE, EMBASE, Web of Science y Scopus de todos los estudios publicados entre enero de 1996 y septiembre de 2014, utilizando los siguientes términos y abreviaturas en español e inglés: vómito, hiperémesis, síndrome, cannabinoides, epidemiología, diagnóstico, tratamiento, lineamientos, consenso y revisión.
Se identificaron los artículos más relevantes, incluyendo revisiones técnicas, revisiones sistemáticas, metaanálisis, recomendaciones y ensayos clínicos sobre SHC. La información de estudios observacionales, series de casos, reportes de casos, resúmenes y estudios de intervención en pacientes con SHC también fue revisada. De 313 resúmenes encontrados en la búsqueda, se incluyó la información completa de 147 artículos. Los artículos que no se pudieron obtener completos fueron excluidos.
Prevalencia de uso de cannabis en NorteaméricaEl cannabis es un género de plantas con flores (Cannabis sativa, C. indica y C. ruderalis) que se cultiva por su fibra (cáñamo) y su uso como sustancia medicinal y recreativa7. La planta produce un grupo de sustancias químicas llamadas cannabinoides, cuya concentración es más alta en las flores y frutos de la planta hembra, la cual se consume principalmente una vez que se ha secado8,9.
Uso de cannabis en los Estados Unidos de AméricaEl cannabis ha sido usado en los Estados Unidos (EE.UU.) desde los años 1800 y la percepción pública del daño potencial que causa ha disminuido considerablemente a lo largo del tiempo10. En 1996, el congreso en los EE.UU. aceptó el uso legal de cannabis para fines médicos. A partir de esto, Colorado se convirtió en el primer estado en los EE.UU. en permitir la venta de marihuana para consumo recreativo el 1 de enero de 201411. La prevalencia del uso de cannabis en EE.UU. fue del 4.1% en 2001-2002, con un incremento al 9.5% en 2012-201312,13. Más de 52 millones de personas en EE.UU. (19%) usaron cannabis al menos una vez en 2021 (vs 11% en 2002), mientras que el consumo diario ha subido del 18% al 27% entre los usuarios14,15. El incremento en el uso de cannabis en EE.UU. se ha observado en ambos sexos16-19. También se ha reportado que adultos con comorbilidades tienen mayor probabilidad de usar cannabis, en comparación con adultos sin condiciones médicas20,21.
Uso de cannabis en CanadáA nivel global, Canadá es uno de los países con mayor prevalencia de uso de cannabis. En este país, el uso terapéutico de cannabis ha sido un fenómeno cada vez más común22. A partir de 2001, los canadienses pudieron obtener cannabis para uso medicinal por las Regulaciones de Acceso a la Marihuana Médica, las cuales permitieron que los individuos tuvieran cannabis deshidratada cuando las terapias médicas convencionales no fueran consideradas exitosas. En 2016 se legalizó la venta de cannabis deshidratada, aceites de cannabis y materiales frescos de cannabis y se permitió que los individuos produjeran o designaran a alguien para cultivar su propia cannabis. En 2018 el gobierno canadiense legalizó el uso recreativo de la cannabis para adultos. La Encuesta Canadiense de Cannabis estima que el 13% de los canadienses de 16años o mayores usan cannabis para manejar síntomas asociados a una enfermedad o condiciones de salud, y las mayores tasas de uso se encuentran en los adultos de entre 20-24años, con reporte de uso en el pasado año del 51% de ellos23.
Uso de cannabis en MéxicoEn México, el cannabis es la sustancia ilícita usada más comúnmente. En 2016, el Instituto Mexicano de Salud Pública reportó que la prevalencia de uso de cannabis en la vida fue del 8.6%. La prevalencia de uso de cannabis en hombres adultos (14%) fue más alta que en mujeres adultas (3.7%). En hombres adolescentes, la prevalencia de uso de cannabis incrementó del 2.1% en 2002 al 5.8% en 2016, y en mujeres adolescentes incrementó del 0.2% en 2002 al 4.8% en 2016. Más recientemente, en 2021 se legalizó el consumo de cannabis en México24. Una encuesta mexicana de 2023 reportó que 654 (20.7%) sujetos se identificaban como consumidores activos de cannabis. De dichos consumidores, el 74.3% reportaron usar cannabis con fines recreativos, mientras que el resto reportó un uso medicinal. La mayoría de los usuarios de cannabis reportaron usarla semanalmente, con el 42.7% reportando un uso de 1-2 veces por semana y el 35.6% reportando un uso de 3-6 veces por semana. Solo el 16.2% reportó uso diario. Una minoría reportó el consumo de cannabis de manera mensual (2.3%) y el 3.2% reportó usarla de 3-6 veces por mes25.
Sistema endocannabinoide y receptores cannabinoidesEl sistema endocannabinoide (SEC) es un sistema neuromodulador extendido que juega un papel importante en la regulación de la náusea, el vómito y el estrés. El sistema no está limitado al cerebro y está involucrado en procesos como la modulación de la tolerancia inmune26, la motilidad gastrointestinal, el dolor visceral, la náusea y el vómito27. El SEC consiste en receptores cannabinoides tipo1 (CB1) y tipo2 (CB2), junto con ligandos y enzimas endógenos (endocannabinoides) que son responsables de la síntesis endocannabinoide y su degradación. Los endocannabinoides anandamida (AEA) y 2-araquidonoilglicerol (2-AG) activan los dos receptores cannabinoides de membrana acoplados a la proteínaG (CB1 y CB2), al igual que varios otros tipos de receptores no cannabinoides. Los receptores CB1 están distribuidos densamente en áreas del cerebro, como el complejo vagal dorsal (el núcleo del tracto solitario, el área postrema y el núcleo motor dorsal del vago), el cual es parte del circuito emético. Los receptores CB1 también se encuentran en transmisores dopaminérgicos, noradrenérgicos y otros, que contienen neuronas en regiones del cerebro involucradas en el control de la náusea y el vómito.
Los receptores CB2 están localizados a lo largo de los intestinos, principalmente en las neuronas mientéricas y submucosas y en células no neuronales como las células epiteliales28. Los receptores CB2 están localizados principalmente en células inflamatorias y epiteliales y en menor grado en neuronas mientéricas y submucosas29,30.
Propiedades antieméticas del cannabisSe piensa que el delta-9-tetrahidrocannabinol (THC) y el cannabidiol son dos constituyentes importantes del cannabis, aunque hay decenas de otras moléculas relacionadas, con una variedad de acciones que se encuentran típicamente en niveles bajos en la planta7,9,31. El THC es el componente psicoactivo principal del cannabis, y se piensa que es responsable de la mayoría de sus efectos centrales y activa los receptores CB1 y CB2. Se piensa que su acción vía los receptores CB1 localizados en áreas del cerebro que están asociadas con la regulación de la náusea, el vómito y la respuesta al estrés es responsable de sus propiedades antieméticas32-34. El cannabidiol no es psicoactivo, y, a diferencia del THC, actúa principalmente sobre los receptores 5HT1A. Sin embargo, tiene efecto sobre el cerebro y los intestinos como modulador de los efectos del THC, y sus propiedades antieméticas son conocidas en animales35-37.
El conocimiento del SEC se ha ampliado y ahora incluye un repertorio de moléculas de señalización y receptores, por medio de la inclusión de endovanilloides y el receptor de potencial transitorio vanilloide-1 (TRPV1)38. Debido a que los endovanilloides también están involucrados en la regulación de la emesis, el agonista TRPV1, capsaicina, es un terapéutico potencial para el SHC38-40.
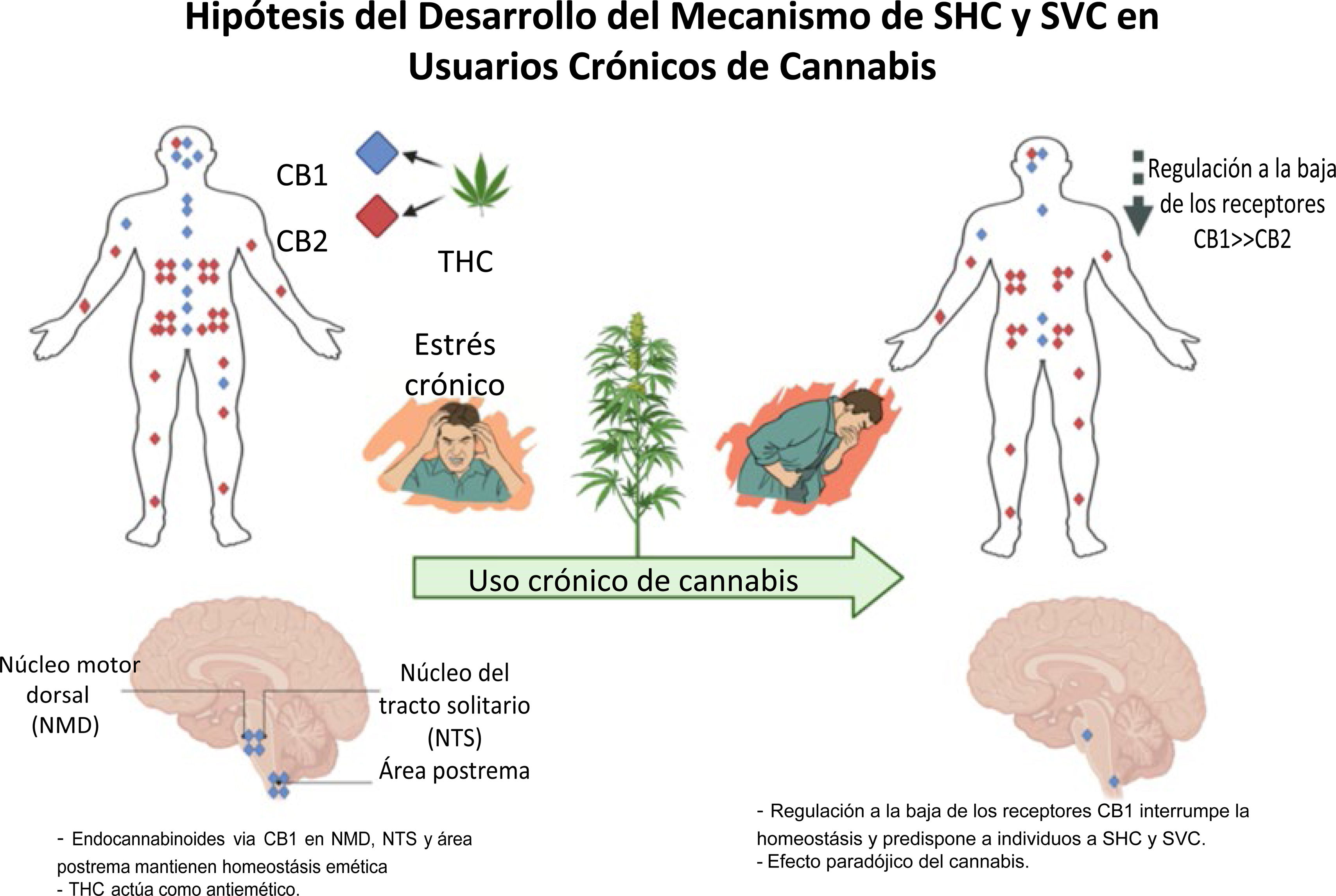
La paradoja del uso intenso crónico de cannabis: mayor riesgo de hiperémesisEl uso intenso crónico de cannabis lleva en algunas personas a náusea, vómito y dolor abdominal recurrentes, y presumiblemente a SHC. Estos síntomas se oponen a lo que se ha delineado arriba, y por lo tanto representan un efecto paradójico del cannabis. Se puede obtener el alivio temporal de dichos síntomas con baños calientes, pero la terapia antiemética estándar no es particularmente efectiva41-43. Los mecanismos subyacentes a los efectos paradójicos son desconocidos, pero se especula que se deben a una regulación a la baja de los receptores cannabinoides causada por alta exposición a ligandos. Esto último, en conjunto con estrés crónico en sujetos predispuestos genéticamente, parece tener un efecto sinérgico sobre la homeostasis del SEC y, en consecuencia, el desarrollo de SVC y SHC (fig. 1)44.
Papel del Sistema endocannabinoide en la regulación de la náusea y el vómito. Fisiopatología propuesta que podría explicar el desarrollo del síndrome de hiperémesis cannabinoide.
Fuente: adaptado de DeVuono et al.44.
Los pacientes con SHC frecuentemente presentan una característica conducta compulsiva de tomar múltiples baños calientes que proporcionan alivio temporal de los síntomas45. Uno de los primeros reportes sobre baños con agua caliente fue realizado por Allen et al.46 en una serie de casos de 18 pacientes que tenían episodios recurrentes de vómito y uso crónico de cannabis. Aunque se pensaba que este patrón de baños con agua caliente era patognomónico del uso de cannabis y SHC, esta conducta también ha sido reportada en el 50% de los pacientes con SVC que no usaban cannabis47.
Se ha reportado que los baños con agua caliente resultan en una mejoría marcada, aunque temporal, de la náusea, vómito y dolor abdominal, además de síntomas asociados con pánico. Los síntomas a menudo recurren después de entre 10-30minutos, lo cual podría explicar por qué los pacientes toman hasta 20 baños con agua caliente por día, o permanecen en una tina con agua caliente el mayor tiempo posible. En casos extremos, los pacientes incluso se hospedan en un hotel para asegurarse tener agua caliente continua. En comparación con usuarios ocasionales de cannabis o con sujetos que no usan cannabis, los usuarios regulares de cannabis tienen más probabilidades (>4 veces/semana) de usar baños de agua caliente y permanecer en una tina con agua caliente por periodos de tiempo más largos para sentir el alivio proporcionado por el agua caliente48. Además, se ha observado que los usuarios regulares presentan una mayor carga de síntomas gastrointestinales y mayor ansiedad, en comparación con usuarios ocasionales o sujetos no usuarios. Cerca del 4% de los pacientes que presentan la conducta de baños con agua caliente pueden incluso presentar quemaduras, llamadas eritema ab igne, como resultado de dicha conducta. No se comprende aún esta conducta de baños con agua caliente en SHC, ni cómo contribuye a mejorar los síntomas. Se sabe que el SEC se involucra durante la respuesta a estímulos estresantes49, con un incremento de endocannabinoides dentro de algunos minutos de la exposición al estrés, y usualmente vuelve a niveles basales dentro de una hora50. Estos datos nos llevan a la hipótesis de que la exposición al agua caliente puede aliviar los síntomas de la náusea y el vómito debido al incremento de liberación de endocannabinoides y la subsiguiente activación de receptores CB1. Sin embargo, hasta donde sabemos, nadie ha examinado los efectos de la exposición al agua caliente respecto a los niveles de endocannabinoides.
También se han propuesto mecanismos, como una mayor temperatura del centro del cuerpo por medio de los efectos sobre los receptores CB1 en los centros termorreguladores del hipotálamo, la estimulación del receptor cutáneo vanilloide-1 y el cambio de flujo sanguíneo de las vísceras a la piel46. Un segundo objetivo es el receptor TRPV1, también conocido como capsaicina o receptor vanilloide51. Los receptores TRPV1 se distribuyen en varias partes del tracto gastrointestinal y aferentes vagales con inervaciones al estómago e intestinos, y también se distribuyen por el sistema nervioso entérico. Estos receptores se activan por el calor (temperatura >43°C), la capsaicina y por altas concentraciones de anandamida. Esto sugiere que los baños con agua caliente no actúan por medio de los receptores TRPV1, lo cual requeriría temperaturas demasiado elevadas. Por lo tanto, especulamos que la anandamida movilizada podría activar inicialmente pero después desensibilizar TRPV1, resultando en una mejoría de síntomas extendida. La comprensión de los mecanismos y las características específicas de este patrón de baños calientes en el SHC ayudará a determinar la fisiopatología en el SHC y el SVC, ayudando potencialmente al desarrollo de terapias dirigidas a estas entidades complejas.
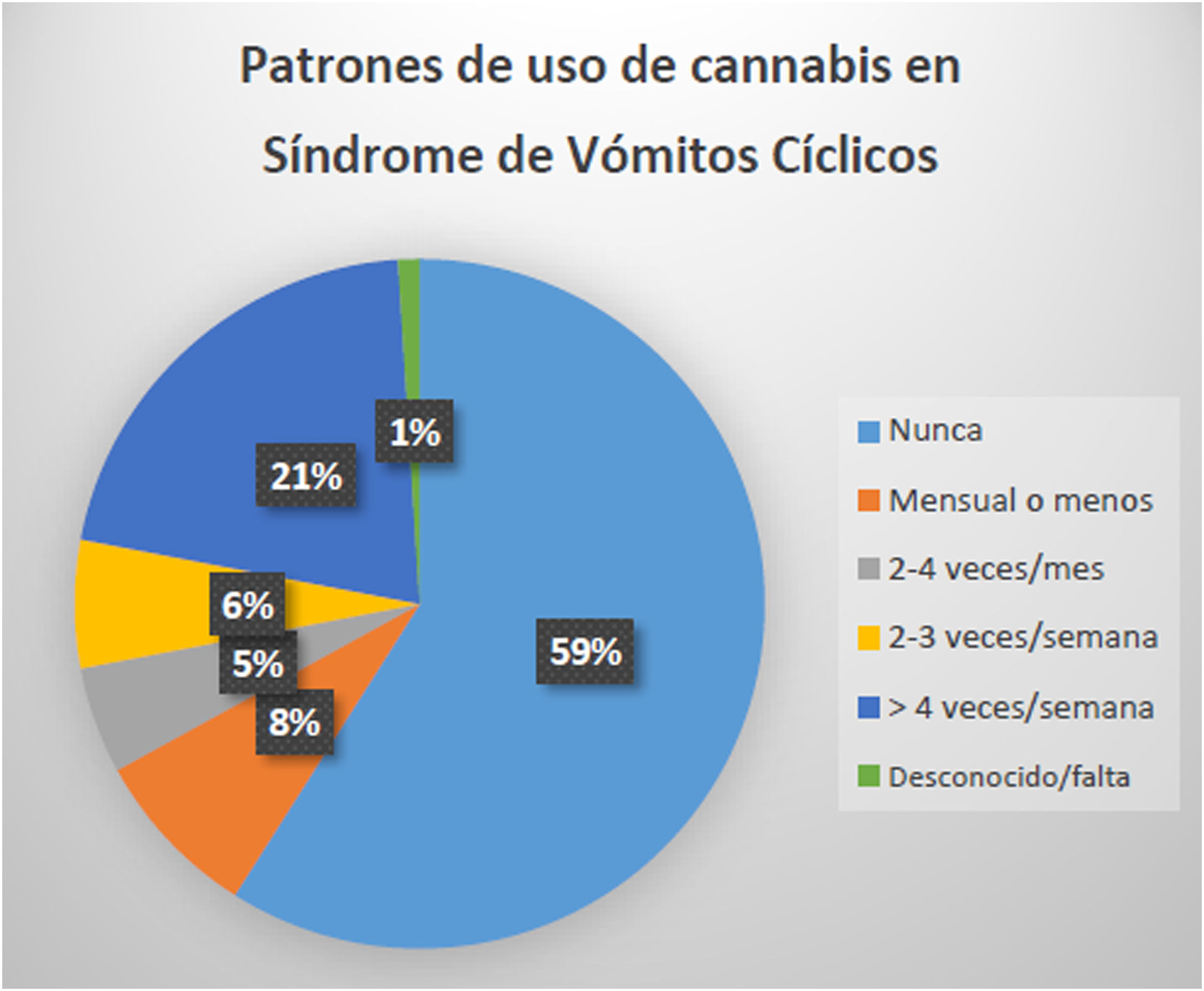
Síndrome de hiperémesis cannabinoide vs. síndrome de vómitos cíclicosA pesar de tener un cuadro clínico similar (náusea persistente, dolor abdominal y vómito repetitivo), hay áreas de diferencia entre el SVC y el SHC. Se ha propuesto que el SHC podría resolverse después del cese definitivo del uso de cannabis, aunque esto ha sido difícil de aseverar, dada la falta de seguimiento de largo plazo en la mayoría de los pacientes, salvo la serie de casos de Allen et al.46. Un estudio de Venkatesan et al.52 demostró patrones de uso de cannabis en SVC (fig. 2).
Patrones de uso de cannabis en pacientes diagnosticados con síndrome de vómitos cíclicos.
Fuente: adaptado de Venkatesan et al.52.
La información detallada sobre la duración, la frecuencia y la potencia del uso del cannabis en SHC es escaso. Aún más importante es que la mayoría de los reportes sobre SHC tienen poco o nada de seguimiento, lo cual dificulta aseverar si el cannabis fue realmente la causa de la hiperémesis. En una revisión sistemática, la duración mediana del uso de cannabis antes del inicio de los síntomas de SHC fue de 42meses y la edad mediana del comienzo del uso de cannabis en pacientes con SHC fue de 16años40. Se reportó que la duración del uso de cannabis fue ≤1año para el 25.1%, de 2-5años para el 36.3%, de 6-10años para el 16.8% y ≥11años para el 21.8% de los pacientes. La frecuencia del uso de cannabis fue >1vez por día en el 23.7%, diario en el 47.9%, semanal en el 19.4% y <1vez por semana en el 2.4%40. Además, una revisión sistemática realizada por Venkatesan et al.4 identificó 25 series de casos y 101 reportes de caso individuales de pacientes identificados con SHC43,45,46,53-119. Ellos reportaron una heterogeneidad significativa en los criterios utilizados para definir los casos de SHC. El diagnóstico de SHC fue realizado con base en múltiples criterios, incluidos el patrón de baños con agua caliente, el vómito cíclico y el uso de cannabis. Los autores de dicha revisión sistemática destacaron la falta de detalles en la literatura, lo cual dificulta la interpretación, al igual que el uso del vómito cíclico con patrones de baños calientes como características patognomónicas del SHC, lo cual llevó muy probablemente a una sobreestimación del SHC. Los autores destacaron la necesidad de estudios sistemáticos sobre el uso de cannabis en el SVC, con relación a la hiperémesis.
Presentación clínica y diagnóstico de SHCEl SHC es un trastorno crónico de la interacción intestino-cerebro incluido en la clasificación de trastornos gastrointestinales funcionales de los criterios de RomaIV de 201662.
El SHC se caracteriza por vómitos cíclicos, náusea y dolor abdominal, y en algunos casos está asociado con una conducta de tomar baños prolongados en agua caliente43,46. Aunque el patrón de baños calientes no es patognomónico de SHC120, se asocia significativamente con SHC47. En una revisión sistemática de pacientes diagnosticados con SHC, la duración media del uso de cannabis antes del inicio de síntomas fue de 6.6años, el uso diario ocurrió en el 68% y los baños calientes se reportaron en el 71% de los pacientes4.
Los criterios de RomaIV121 son los criterios de diagnóstico más ampliamente aceptados para el SHC, pero son principalmente de naturaleza cualitativa. Otros investigadores han intentado generar más criterios cuantitativos para diferenciar el SHC del SVC. Como parte de su revisión sistemática, los ocho miembros del Comité de Lineamientos de Práctica para SVC detallaron características del uso de cannabis para ayudar a diagnosticar SHC con mayor precisión e incluyeron la duración del uso de cannabis previo al comienzo del SHC, la frecuencia del uso y las cantidades de cannabis utilizadas4. Con base en esa información, el comité propuso los siguientes criterios de diagnóstico clínico para SHC, además de elementos a identificar en la historia del paciente4:
- 1.
Características clínicas: vómito episódico estereotípico que aparenta ser SVC en términos de inicio y con una frecuencia de 3 o más veces por año.
- 2.
Patrones de uso de cannabis: duración de uso de cannabis >1año antes del inicio de síntomas; frecuencia de uso >4veces por semana, en promedio.
- 3.
Cese de uso de cannabis: resolución de síntomas tras un periodo de abstinencia de uso de cannabis por al menos 6meses, o al menos igual a la duración total de tres ciclos típicos de vómito.
El abordaje al diagnóstico de SHC también requiere de una buena historia clínica y evaluaciones anatómicas, con una endoscopia gastrointestinal superior y/o tomografía computarizada del abdomen para excluir obstrucción de salida y otras causas orgánicas del vómito.
Se debe evitar una evaluación diagnóstica extensa a menos que existan características específicas que sugieran un diagnóstico alternativo. Otros diagnósticos diferenciales que los médicos podrían considerar incluyen el síndrome de rumiación, gastroparesia, SVC, embarazo, migraña y náusea funcional crónica y síndrome de vómito122.
Tratamiento para el SHCEn general, el tratamiento para el SHC es similar al tratamiento para el SVC y se puede dividir en terapias abortivas y preventivas. Los expertos están de acuerdo en que el SHC es un subconjunto del SVC y recomiendan que se les ofrezca el mismo tratamiento a los pacientes con un patrón de SVC y uso de cannabis que a los pacientes con SVC. La terapia principal para el manejo a largo plazo (terapia profiláctica) es el asesoramiento para lograr el cese de uso de marihuana y antidepresivos tricíclicos (TCA) como la amitriptilina123.
La abstinencia del uso de cannabis es necesaria para un tratamiento exitoso de SHC. Además, aconsejar a los pacientes con SHC de dejar de usar cannabis inmediatamente puede estar asociado con síntomas de abstinencia significativos y una alta frecuencia de reincidencia. Por lo tanto, la recomendación de una reducción gradual de frecuencia y de cambiar a productos de menor potencia (con menos THC) puede ser una estrategia más exitosa en el contexto clínico.
Terapia abortivaLa evidencia para el tratamiento para SHC es limitada a series de caso y pequeños ensayos clínicos que favorecen el uso tópico de capsaicina, benzodiazepinas, haloperidol, prometazina, olanzapina y ondansetrón, entre otros, para los ataques agudos de vómito5,46,124-126.
Capsaicina tópicaLa crema de capsaicina tópica ha sido exitosa a corto plazo como terapia adyuvante en pacientes con SHC39. La crema de capsaicina tópica (0.1%) puede mejorar los síntomas por medio de la activación de los receptores TRPV1, pero la información es limitada. La capsaicina tópica se aplica en la parte superior del abdomen y puede reducir la necesidad de antieméticos127-129. La capsaicina puede causar una redirección del flujo sanguíneo del sistema entérico hacia la piel, lo cual lleva a la activación de los receptores TRPV1 y a reducir la sustanciaP130. Un ensayo clínico aleatorizado examinó la capsaicina tópica (0.1%) versus crema placebo aplicadas al abdomen y los autores reportaron una reducción del 46% de náusea respecto a la línea de base en el grupo con capsaicina versus el 24.9% en el grupo con placebo. Sin embargo, el vómito o el dolor abdominal (los rasgos característicos de SHC) no fueron evaluados128. Por otro lado, un reciente estudio retrospectivo encontró una mejoría moderada en el dolor abdominal después de dos horas de aplicación de capsaicina131. Un estudio retrospectivo de cohorte mostró que la longitud de la estancia en el departamento de urgencias fue reducida modestamente con una mediana de 22minutos (201 vs 179min, p=0.33) con capsaicina tópica aplicada al abdomen a diferentes porcentajes (0.025-0.1%). Además, los pacientes recibieron menos medicamentos adicionales si se utilizó capsaicina (4 vs 3 dosis, p=0.015)132.
De manera notable, la serie de casos donde se utilizó capsaicina tuvo una cohorte de pacientes pequeña y, como resultado, la eficacia de la capsaicina deberá ser evaluada en cohortes prospectivas mayores133.
DroperidolEl droperidol es un antagonista de la dopamina de acción corta usado como agente antiemético y antipsicótico133. Una revisión sistemática dirigida por Furyk et al.134 examinó el papel del droperidol en el manejo de SHC. Se encontró que 0.625-2.5mg de droperidol intravenoso (IV) mostraba diferencias significativas en la escala análoga visual (en una línea de 0 a 100, el cero corresponde a «sin náusea» y 100 significa «náusea insoportable») en comparación con placebo en 48 pacientes. La evidencia actual ha mostrado que la administración de droperidol a pacientes con SHC resultó en una estancia hospitalaria más corta, una menor necesidad de otros antieméticos (ondansetrón y metoclopramida) y demostró una disminución significativa en la gravedad de la náusea en comparación con placebo135.
BenzodiazepinasUna serie de casos de cuatro pacientes con SHC resistentes a tratamiento examinó una benzodiazepina (clonazepam) como opción de tratamiento. El estudio reveló que de 1 a 2 dosis de 0.5mg de clonazepam oral llevó a una terminación rápida de síntomas, un alivio sintomático completo y la alta dentro de las primeras 24horas de la administración del fármaco136. Debe señalarse que la evidencia para el uso de benzodiazepina en SHC es limitada. Su mecanismo de acción es la potenciación de la actividad del ácido gamma-aminobutírico, el cual es el mayor neurotransmisor inhibidor del sistema nervioso central. Este mecanismo reduce la náusea anticipatoria y el vómito137. Además, las benzodiazepinas reducen la activación del receptor CB1 en la corteza frontal, potenciando su efecto antiemético138.
HaloperidolEl haloperidol ha sido utilizado en el manejo de náusea y vómito graves en casos severos de SHC135,136. Un reporte de caso de Inyat et al.139 mostró que un paciente de 27años tuvo mejoría clínica significativa con 2mg de haloperidolIV (Haldol, Janssen Pharmaceuticals, Raritan, Nueva Jersey, EE.UU.) sin reacciones adversas.
Su conducta compulsiva de baños calientes y síntomas gastrointestinales comenzaron a disminuir después de dos dosis consecutivas de 2mg de haloperidolIV. El paciente reportó una completa resolución de la náusea refractaria, el vómito y el dolor abdominal después de la administración del esquema antes mencionado y no mostró síntomas recurrentes en el seguimiento a un mes139. Una serie de casos realizada por Witsil y Mycyk140 encontró que 5mg de haloperidolIV resultó en un alivio exitoso de la náusea y el vómito en 4 pacientes en el departamento de urgencias. Un ensayo aleatorizado con control dirigido por Ruberto et al.126 examinó el uso de haloperidol y ondansetrón para SHC. Una dosis de 0.05 o 0.1mg/kg de haloperidol fue superior al ondansetrón para disminuir la náusea y el vómito y hubo menos uso de antieméticos de rescate, al igual que una menor estancia en el departamento de urgencias. Sin embargo, hubo dos regresos por distonía aguda, ambos en el grupo de 0.1mg/kg de haloperidol126. De manera notable, la mayor parte de la evidencia para haloperidol vino de la serie de casos, lo cual limita su generalizabilidad139-141.
PropranololRichards y Dutczak142 presentaron un reporte de caso que examinó un caso extremo de SHC en el departamento de urgencias. El paciente tenía náusea, vómito e incomodidad abdominal intratables que no respondían a los antieméticos estándar. Un miligramo de propranololIV llevó a una rápida terminación de la náusea y el vómito. El médico de emergencias que atendió el caso eligió propranolol y su dosis con base en experiencia y desenlaces exitosos en pacientes con SVC. La evidencia del uso de propranolol es limitada, ya que este fue el único caso que encontramos en la literatura.
AprepitantEl aprepitant es un antagonista del receptor de neuroquinina1 y está aprobado por la FDA en EE.UU. para tratar la náusea y el vómito inducidos por quimioterapia. Un reporte de caso de Parvataneni et al.143 describió una mujer de 30años con náusea y vómito intermitentes que no respondía a los antieméticos convencionales, como el ondansetrón y la metoclopramida. Fue dada de alta sin síntomas 24horas después de la administración de aprepitant. Sin embargo, en este caso la paciente reportó náusea y vómito intermitentes por 4años y uso crónico de marihuana algunas veces por semana durante 4años. No cumplió con los criterios de resolución de síntomas clínicos posterior a la abstinencia del uso de cannabis por al menos 6meses y puede haber tenido SVC.
Terapia profilácticaEl tratamiento profiláctico es recomendado en pacientes con enfermedad moderada/grave (con ≥4 episodios por año de náusea y vómito severo que lleven al paciente a buscar ayuda médica en el departamento de urgencias o que requiera hospitalización). Los TCA son los fármacos de primera línea para la profilaxis de SHC y SVC, y se ha demostrado que reducen la duración, la gravedad y la frecuencia de los episodios, al igual que el número de visitas a urgencias y hospitalizaciones144. La amitriptilina se inicia usualmente a una dosis baja de 25mg y se incrementa gradualmente en 10mg cada semana para llegar a una dosis objetivo de aproximadamente 100mg por la noche en adultos. Los TCA pueden causar una prolongación en el intervalo QT, por lo que se debe realizar un electrocardiograma de línea base y monitorearlo durante la valoración del TCA145. Los datos obtenidos de ensayos principalmente retrospectivos y abiertos proporcionan evidencia de que la amitriptilina es efectiva en aproximadamente el 70% de los pacientes146.
Impacto clínico y económico del SHC y del SVCEl SHC y el SVC están asociados con una carga y costos significativos en el sistema de salud. El diagnóstico tardío o equivocado puede llevar a una mayor frecuencia de necesidad de atención en el departamento de urgencias o a un mayor número de hospitalizaciones, con su consiguiente impacto económico. Recientemente se estudiaron los desenlaces de las hospitalizaciones de los pacientes con SVC, obtenidos de una base de datos de pacientes hospitalizados a nivel nacional entre enero de 2010 y diciembre de 2011. El estudio incluyó 20,952 pacientes con SVC y 44,262 pacientes sin SVC. Los pacientes con SVC presentaron una mayor tendencia a ser más jóvenes, hombres y blancos, en comparación con los pacientes sin SVC. Además, el SVC estuvo asociado con comorbilidades (disautonomía, migraña, ansiedad, uso de marihuana, síndrome de intestino irritable, enfermedad de reflujo esofagogástrico, asma, tabaquismo e hipertensión). Los pacientes con SVC también presentaron un mayor número de estudios gastrointestinales de diagnóstico, menor mortalidad y hospitalización más corta. Toda la cohorte de SVC costó unos $4,000,000.00 de dólares americanos en los dos años de análisis147.
Chen et al.148 reportaron que los pacientes diagnosticados con SVC tenían costos de atención a la salud significativamente más altos que controles sin SVC ($57,140 vs $14,912). También reportaron que los costos totales de atención a la salud fueron cuatro veces mayores para los pacientes con SVC, comparados con los controles sin SVC. Marshall A et al. mostraron que el costo medio de hospitalización fue significativamente más alto después de la legalización del consumo de cannabis ($18,714 vs $7,460), p<0.0005, incluso después de ajustar para la inflación médica ($18,714 vs $8520), p<0.001149.
ConclusionesEl síndrome de hiperémesis cannabinoide (SHC) es una entidad emergente y compleja que se considera un subgrupo del SVC y se espera que incremente su prevalencia con el aumento de la legalización y el uso de productos de cannabis de alta potencia. El SHC puede llevar a una elevada utilización de recursos de la atención a la salud, lo cual causa pérdidas económicas enormes tanto para el sistema de salud como para el paciente. Actualmente, el tratamiento para SHC se basa principalmente en la evidencia farmacológica disponible sobre el manejo del SVC y en pequeñas series de casos. Es necesario comprender mejor el papel del cannabis en el SHC y su fisiopatología, con lo que se podrá informar mejor a los pacientes y a la comunidad médica sobre los efectos del cannabis en la salud gastrointestinal.
FinanciaciónNo se recibió apoyo económico con relación al presente estudio/artículo.
Consideraciones éticasEl presente artículo es una revisión narrativa del síndrome de hiperémesis cannabinoide. No se realizaron experimentos animales o humanos durante el curso de la revisión, por lo que no fue necesaria la autorización del comité de ética. No se publican datos personales que permitan la identificación de pacientes en el presente artículo, por lo tanto, no se solicitó el consentimiento informado para la publicación de esta revisión narrativa.
Conflicto de interesesLos autores declaran que no existe conflicto de intereses.