Los inhibidores del factor de necrosis tumoral (anti-TNF) se han convertido en uno de los principales fármacos biológicos para el manejo de la enfermedad inflamatoria intestinal (EII), con posterior desarrollo de nuevas terapias con mecanismos de acción distintos. A pesar de la eficacia demostrada en monoterapia, existe el escenario de pacientes con EII refractaria, con manifestaciones extraintestinales u otras enfermedades inmunomediadas que requiere combinación de terapias biológicas y/o moléculas pequeñas1.
Actualmente en Latinoamérica no hay experiencia en la combinación de inhibidores de las janus kinasas (iJAK) y anti-TNF. Se presenta la evolución de tres pacientes que iniciaron esta estrategia (tabla 1).
Resumen de los tres pacientes en terapia combinada avanzada
| Caso 1 | Caso 2 | Caso 3 | |
|---|---|---|---|
| Edad | 40 años | 32 años | 32 años |
| Sexo | Masculino | Masculino | Femenino |
| Tipo de EII | Enfermedad de Crohn de ileocolónica• Fenotipo inflamatorio• Compromiso perianal | Enfermedad de Crohn de colonFenotipo inflamatorioCompromiso perianal | Colitis ulcerosa extensa |
| Años de evolución | 14 años | 2 años | Debut |
| MEIS | Pioderma gangrenoso | No | Articular |
| Exposición a terapias previas | Adalimumab con PRSInfliximab - azatioprina (NRP)Ustekinumab (NRP) | Infliximab (PRS)Etrasimod (NRP) | Corticoides y mesalazinaInicia infliximab |
| Tipo de terapia avanzada utilizada | Adalimumab con inducciónUpadacitinib 45mg/día vía oral | Infliximab 10mg/kg con Upadacitinib 45mg al día vía oral | Infliximab 5mg/kg más tofacitinib 20mg/día(3 días con tofacitinib 30 mg/día) |
| Actividad clínica previa a terapia | IHB 12 puntos | IHB 13 puntos | IMp 8 puntos |
| CF previa a la terapia combinada | – | 660 μg/g | 798 μg/g |
| Colonoscopia previa a la terapia | SES-CD 23 puntos | SES-CD 13 puntos | Mayo endoscópico 3 puntos |
| Actividad clínica postinducción | IHB 7 puntos | IHB 6 puntos | IMp 0 puntos |
| CF postinducción | – | 120 μg/g | 54 μg/g |
| Colonoscopia postinducción | SES-CD 30 puntos | SES-CD 6 puntos | Mayo endoscópico 0 puntos |
| Terapia postinducción | Upadacitinib 45mg al día vía oral más adalimumab 40mg/semanal subcutáneoProlongación de inducción | Upadacitinib en monoterapia 30mg/día vía oral | Infliximab 10mg/kg cada 4 semanas intravenoso |
CF: calprotectina fecal; EII: enfermedad inflamatoria intestinal; IHB: índice de Harvey-Bradshaw; Imp: índice de Mayo parcial; MEIS: manifestaciones extraintestinales; NRP: no respuesta primaria; PRS: pérdida de respuesta secundaria; SES-CD: simple endoscopic score for Crohn's disease.
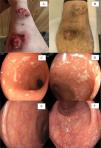
Caso 1. Hombre de 40 años con enfermedad de Crohn (EC) de colon de 14años de evolución, fenotipo inflamatorio, enfermedad perianal y pioderma gangrenoso. Inicialmente con terapia combinada con adalimumab y metotrexato, logrando remisión sintomática, calprotectina fecal (CF) y endoscópica. Evoluciona con pérdida de respuesta y reactivación del compromiso intestinal y dermatológico (fig. 1A). Recibe infliximab y luego ustekinumab, cada uno en monoterapia, sin respuesta. En conjunto con el paciente, se decide inicio de terapia combinada avanzada con adalimumab y upadacitinib. Tras la inducción, logra respuesta clínica con un índice de Harvey-Bradshaw (IHB) de 7 (previo 12) y regresión del compromiso dermatológico (fig. 1B). Por persistencia de la actividad endoscópica, se prolonga la dosis de inducción de upadacitinib por 24semanas.
A) Imagen del caso1, previo a la terapia combinada. B)Caso1, posterior a la inducción de terapia combinada. C,D)Caso3: compromiso colónico previo al inicio de la terapia combinada avanzada (tofacitinib - infliximab). E,F)Caso3 en remisión endoscópica postinducción con terapia combinada avanzada (tofacitinib - infliximab).
Caso 2. Hombre de 32 años, con EC de colon fenotipo inflamatorio, de 2años de evolución. Inicialmente con terapia combinada infliximab y azatioprina, con pérdida de respuesta secundaria. Ingresa a protocolo estudio con etrasimod, pese a tener respuesta sintomática inicial, desarrolla una enfermedad perianal que requiere drenaje e instalación de setones, y reactivación clínica (IHB de 13 puntos), CF de 660μg/g y endoscópica (SES-CD 13). En este contexto, se reinicia infliximab en dosis optimizada 10mg/kg semana 0, 1 y 4, en conjunto con upadacitinib. Tras completar inducción de upadacitinib de 12semanas, evoluciona con respuesta clínica, CF de 120μg/g y respuesta endoscópica (SES-CD 6 puntos).
Caso 3. Mujer de 32 años con diagnóstico de colitis ulcerosa (CU) extensa grave, índice de Mayo endoscópico3 (fig. 1C,D). Evoluciona con corticorefractaria, hipoalbuminemia y anemia moderada, por lo que se inicia infliximab 5mg/kg semana 0, 1 y 4, logrando niveles subóptimos de 2.46μg/ml. Se agrega tofacitinib en dosis de inducción de 20mg/día por 8semanas. Evoluciona en forma favorable, logrando remisión sintomática, CF 54μg/g y remisión endoscópica (IMp0) (fig. 1D,E). Se decide continuar terapia con infliximab optimizado y suspender tofacitinib.
La combinación de terapias avanzadas es una estrategia emergente en pacientes con EII de difícil manejo, descrito hasta en un 25% en centros terciarios1,2. Esta combinación ha demostrado inducir una mayor reducción de la inflamación y mejoría de la homeostasis epitelial en comparación con la monoterapia. Incluye distintos esquemas, como terapias aditivas, simultáneas o secuenciales3. Los tres casos presentados muestran que la terapia combinada avanzada es una opción en pacientes con EII de difícil manejo.
La evidencia de la efectividad de la terapia combinada avanzada se basa en estudios retrospectivos, reporte de casos y estudios de cohorte de pacientes refractarios al manejo inicial4.
El primer estudio aleatorizado controlado que evaluó la terapia combinada avanzada fue publicado por Sands et al.5, en el cual 79 pacientes con EC fueron aleatorizados a terapia combinada de infliximab con natalizumab versus infliximab monoterapia. Aunque una mayor proporción de pacientes en terapia combinada logró remisión clínica, no hubo diferencia significativa entre ambos grupos (46% vs 41%). Recientemente el estudio VEGA mostró que la terapia combinada de golimumab (anti-TNF) y guselkumab (anti-p19 interleucina23) fue más efectiva en el manejo de CU que cada una como monoterapia, siendo el único estudio aleatorizado y controlado de terapia dual en CU6. Las combinaciones más usadas son anti-TNF con vedolizumab o ustekinumab, o bien la combinación de estos dos7,8. La combinación de iJAK también ha sido planteada en la literatura, ya se sea con ustekinumab, vedolizumab o infliximab9. En un estudio de Alayo et al.10 se mostró que en 35 pacientes con EII tratados con terapias avanzadas, solo el 17% (6 pacientes) recibió la combinación de tofacitinib e infliximab, con una respuesta clínica en cinco de ellos a las 8semanas. En el estudio de Glassner et al.,9 de un total de 50 pacientes, el 19% (9 pacientes) recibió terapia combinada con tofacitinib y anti-TNF (4 con infliximab, 4 con golimumab y uno con certolizumab). Los autores no mencionan en su estudio la efectividad según el esquema de terapia combinada avanzada utilizado.
Un factor importante a considerar al iniciar una terapia combinada avanzada es el desarrollo de eventos adversos. Estudios han demostrado un bajo porcentaje de eventos adversos, incluyendo eventos graves o con necesidad de suspender la terapia6. En nuestra experiencia, ningún paciente desarrolló un evento adverso durante el tratamiento con esta estrategia.
En conclusión, la terapia combinada avanzada con un enfoque personalizado es una opción efectiva y segura en el manejo de pacientes con EII de difícil manejo o que presenten manifestaciones extraintestinales o enfermedades inmunomediadas asociadas.
FinanciaciónEste artículo no cuenta con financiamiento.
Consideraciones éticasEste estudio fue presentado y aprobado por el comité de ética de la Universidad de Los Andes, bajo el número de registro CEC2024094, siguiendo los principios establecidos en la Declaración de Helsinki de 1975. Cada paciente incluido en este estudio fue informado y firmó un consentimiento informado.
Conflictos de interesesLos autores declaran no tener conflictos de intereses en la realización de este artículo.