La enfermedad por hígado graso no alcohólico es la hepatopatía más prevalente, cercana al 30% de la población general, y se considera será en los siguientes años la indicación más común de trasplante hepático y la etiología más frecuente de carcinoma hepatocelular. El tratamiento actual de la enfermedad por hígado graso no alcohólico se debe basar en las medidas higiénico-dietéticas, que han demostrado ser eficaces incluso para revertir fibrosis. Desafortunadamente, el apego a las medidas generales es muy pobre, de ahí la necesidad de contar con estrategias farmacológicas. Hasta el momento no contamos con tratamientos aprobados por las agencias regulatorias para esta entidad, y los únicos tratamientos recomendados por las sociedades internacionales por tener suficiente evidencia son la pioglitazona y la vitamina E, que no están exentas de efectos adversos. En este artículo revisaremos el estado actual del tratamiento de la enfermedad por hígado graso no alcohólico, incluyendo las medidas higiénico-dietéticas, tratamientos disponibles, fármacos equívocos, tratamientos emergentes, y aquellos que actualmente se encuentran en ensayos clínicos.
Non-alcoholic fatty liver disease is the most prevalent hepatopathy, estimated at 30% in the general population. In the coming years, it will likely be the most common indication for liver transplantation and the most frequent cause of hepatocellular carcinoma. Current treatment for non-alcoholic fatty liver disease is based on dietary and exercise interventions that have been shown to be efficacious, even for reverting fibrosis. Unfortunately, compliance with general measures involving lifestyle modifications is very poor, making pharmacologic strategies a necessary option. At present, there are no treatments for non-alcoholic fatty liver disease approved by regulatory agencies, and the only ones with sufficient evidence and recommended by international societies are treatments with pioglitazone and vitamin E, which are not exempt from adverse effects. We review herein the current management of non-alcoholic fatty liver disease, including dietary and physical activity interventions, available treatments, equivocal therapies, emerging treatments, and treatments presently in clinical trials.
La enfermedad por hígado graso no alcohólico (NAFLD, por sus siglas en inglés) se define como el depósito de lípidos en más del 5% de los hepatocitos, y representa actualmente la hepatopatía más común, con una prevalencia estimada en un 30%1. La NAFLD comprende 2 fenotipos, la esteatosis hepática (NAFL) y la esteatohepatitis (NASH, por sus siglas en inglés), siendo este de peor pronóstico por tener mayor riesgo de progresión a cirrosis y por tener una asociación más estrecha con desenlaces desfavorables como mortalidad cardiovascular. Se estima que el 20-25% de los pacientes con NAFLD tienen NASH, y que de estos, un 20% progresará a cirrosis2. NAFLD es un espectro y los pacientes pueden pasar de tener NAFL a NASH y viceversa, siendo uno de los principales factores involucrados los cambios en el peso3. En promedio la progresión de un estadio de fibrosis a otro en los pacientes con NAFL se da en 14 años mientras que en los pacientes con NASH se da en tan solo 7 años4.
Dada la historia natural de NAFLD, los tratamientos farmacológicos específicos para esta enfermedad se deben centrar en NASH y no en NAFL, ya que en los segundos existe una baja probabilidad de morbimortalidad por hepatopatía5. Actualmente no existe ningún tratamiento aprobado por las agencias regulatorias para NASH, pero cualquier esquema terapéutico debe tener como eje central las medidas higiénico-dietéticas, que han demostrado eficacia incluso para mejorar la fibrosis6. Sin embargo, en un porcentaje importante de los casos, al igual que en pacientes con diabetes o hipertensión, estas resultan ineficaces a largo plazo ya que los pacientes tienen mal apego. Por otro lado, las medidas quirúrgicas también han mostrado ser altamente eficaces pero no representan una alternativa viable para una enfermedad con una prevalencia tan elevada7. Por lo anterior, el tratamiento farmacológico es y será parte medular del manejo de estos pacientes. En esta revisión nos enfocaremos a los tratamientos farmacológicos actuales y futuros, pero mencionaremos por su gran relevancia brevemente la información en cuanto a medidas higiénico-dietéticas.
Medidas higiénico-dietéticasLas medidas higiénico-dietéticas son muy importantes porque modifican la evolución de la enfermedad, además de que usualmente son la base del tratamiento de las comorbilidades que usualmente acompañan al NAFLD como lo son los distintos componentes del síndrome metabólico. Una limitante en el estudio del efecto de la dieta y ejercicio en NAFLD es que usualmente se acompañan de cambios en el peso corporal, lo cual dificulta la interpretación de los resultados. Además, la mayor parte de los estudios se han centrado en el efecto sobre la esteatosis, pero no cuentan con biopsias para determinar el efecto en los componentes de NASH (inflamación, balonización) y fibrosis.
Reducción de pesoLa mayor parte de los estudios enfocados en demostrar el efecto de la pérdida de peso en NAFLD tienen un diseño antes-después, con las limitaciones propias de este diseño. Un estudio en 30 pacientes con biopsias pareadas mostró que se necesita una pérdida de peso corporal mayor o igual al 7% para obtener una mejoría significativa en el NAFLD Activity Score (NAS, por sus siglas en inglés)8, un puntaje utilizado en patología en donde se asignan puntos en base a los grados de esteatosis, inflamación y balonización, encontrados en la biopsia hepática. En un estudio prospectivo de 261 pacientes con biopsias pareadas luego de 52 semanas de cambios en el estilo de vida se observó una relación entre la pérdida de peso obtenida y la mejoría histopatológica: en particular se corroboró que se necesita una pérdida de peso de al menos el 7% para obtener una mejoría significativa en NAS (reducción de>2 puntos). Con relación a la fibrosis, en este mismo estudio se encontró que al perder>7% del peso corporal se lograba la estabilización del estadio de fibrosis en el 50% de los pacientes y mejoría/resolución en el otro 50%, y al perder>10% del peso corporal se lograba mejoría/resolución de la fibrosis en el 80%6. En forma práctica se considera que para reducir la esteatosis se necesita lograr una pérdida de peso de solo>3%, pero para lograr resolución de NASH (ausencia de balonización)>7%, y para mejorar fibrosis de>10%.
DietaCualquier tipo de dieta que logre reducción del peso corporal tendrá potenciales efectos benéficos como observamos en el apartado de reducción de peso, sin embargo, se ha intentado determinar si la composición de la dieta es importante en NAFLD independientemente de los cambios en el peso. En un estudio con diseño cruzado que incluyó a 12 pacientes, la dieta mediterránea logró mayor reducción en esteatosis determinada por espectroscopia por resonancia magnética nuclear (ERM) que una dieta isocalórica baja en grasas y rica en hidratos de carbono independientemente del peso corporal9. Adicionalmente, se sabe que la dieta mediterránea reduce el riesgo de eventos cardiovasculares, haciéndola una alternativa atractiva en este grupo de pacientes10.
EjercicioEs especialmente difícil intentar discernir el efecto del ejercicio del de la pérdida de peso, pero hay estudios bien diseñados que demuestran un efecto benéfico de la actividad física independientemente de los cambios en el peso corporal. En cuanto al ejercicio aeróbico, vale la pena destacar un estudio antes-después en donde se encontró reducción significativa en esteatosis hepática determinada por ERM en 48 sujetos divididos en 4 distintas rutinas de ejercicio (control, bajo volumen-alta intensidad, alto volumen-baja intensidad, bajo volumen-baja intensidad); el efecto fue independiente de los cambios en el peso corporal11. Los estudios que han evaluado el ejercicio de resistencia muestran resultados similares12. Una revisión sistemática concluyó que ambos tipos de ejercicio son eficaces en reducir la esteatosis con un protocolo promedio que consiste en 40-45min de ejercicio, 3 veces por semana, por 12 semanas; sin embargo, en el caso del ejercicio de resistencia, el consumo de energía y la intensidad del ejercicio fueron menores (3.5 equivalentes metabólicos en comparación con 4.8 equivalentes del aeróbico), por lo que puede ser que pacientes con mala condición cardiorrespiratoria toleren más fácilmente el ejercicio de resistencia13.
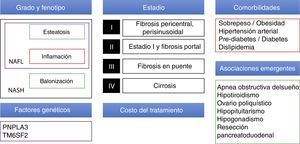
Tratamiento farmacológicoExisten actualmente muchos fármacos en desarrollo para NAFLD, la estrategia terapéutica en el futuro próximo deberá tomar en cuenta múltiples factores como el grado/estadio de la enfermedad (actualmente el estándar para determinar esto sigue siendo la biopsia hepática), las comorbilidades de cada paciente (principalmente en relación con el síndrome metabólico y condiciones emergentes asociadas a NAFLD) y factores genéticos. Además será necesario tomar en cuenta factores no clínicos como el precio de los nuevos medicamentos y el acceso que se tenga a los mismos (fig. 1).
Para su estudio, podemos dividir el tratamiento para NALFD (tabla 1):
Clasificación del tratamiento farmacológico
| Vías metabólicas | Inflamación y estrés oxidativo | Fibrosis | |
|---|---|---|---|
| Disponibles | |||
| Pioglitazona | X | ||
| Vitamina E | X | ||
| Agonistas GLP | X | ||
| Pentoxifilina | X | ||
| Equívocos | |||
| Metformina | X | ||
| Fibratos | X | ||
| Ácidos grasos omega 3 | X | ||
| Simtuzumab | X | ||
| Ácido ursodesoxicólico | X | X | |
| Emergentes | |||
| Saroglitazar | X | ||
| Estatinas | X | ||
| ARA-II | |||
| Probióticos | X | X | |
| Trasplante microbiota fecal | X | X | |
| En ECC para NASH | |||
| Ácido obeticólicoa | X | ||
| Elafibranora | X | ||
| Aramchol | X | ||
| Bitartrato de cisteamina | X | ||
| IVA-337 | X | ||
| GR-MD-02 | X | ||
| Cenicriviroc | X | ||
| Selonsertib | X | ||
| Emricasan | X | ||
| Oltipraz | X | ||
| IMM-124e | X | ||
ARA-II: antagonistas del receptor de angiotensina ii; ECC: ensayo clínico controlado; GLP: péptido similar al glucagón tipo 1 (glucagon-like peptide); NASH: esteatohepatitis (nonalcoholic steatohepatitis).
-En base al proceso fisiopatológico en el que se involucran
-En base a su disponibilidad y evidencia actual, utilizaremos esta lógica para exponer los tratamientos en esta revisión
Tratamientos disponiblesLos tratamientos hasta ahora recomendados por la Asociación Americana para el Estudio del Hígado (AASLD, por sus siglas en inglés) son vitamina E y pioglitazona en los pacientes con NASH5,14, pero no están exentos de efectos adversos. En lo que respecta a la pentoxifilina y los agonistas péptido similar al glucagón tipo 1 (GLP-1, por sus siglas en inglés) también están disponibles y aunque no recomendados por lineamientos internacionales se puede considerar su uso individualizando cada caso.
PioglitazonaAl ser un agonista del receptor gamma activado por el factor proliferador de peroxisomas (PPAR-gamma, por sus siglas en inglés) mejora la sensibilidad a la insulina del tejido adiposo, promoviendo el depósito de ácidos grasos libres en este y no de forma ectópica (p. ej. hígado, páncreas), además incrementa la secreción de adiponectina por el tejido adiposo, favoreciendo la betaoxidación de ácidos grasos libres hepáticos. Este receptor también se encuentra en las células de Kupffer donde ejerce un efecto antifibrótico y antiinflamatorio15.
En el ensayo clínico controlado (ECC) PIVENS se aleatorizaron 247 pacientes con diagnóstico de NASH sin cirrosis, y sin diabetes, durante 2 años, a pioglitazona (30mg qd), vitamina E (400U bid) o placebo. Pioglitazona mejoró resistencia a la insulina, esteatosis, inflamación y resolución de NASH, pero no fibrosis, balonización ni en el desenlace principal del ensayo (mejoría en el NAS>2 puntos sin empeoramiento en fibrosis)16. Existen 3 metaanálisis que concluyen que pioglitazona también mejora la fibrosis17–19.
Desafortunadamente el uso de pioglitazona se asocia a un incremento de peso corporal con lo cual no la hace una estrategia atractiva en pacientes con síndrome metabólico. Además pioglitazona se ha asociado a disminución de la densidad ósea20, aumento del riesgo de fractura de cadera y cáncer de vejiga, aunque esta última asociación no se corroboró en un estudio de un millón de pacientes15.
Vitamina EEs un antioxidante enfocado en mejorar el estrés oxidativo presente en NASH. En el estudio PIVENS la vitamina E no tuvo efecto en el peso ni en la resistencia a la insulina, y mejoró esteatosis, inflamación, balonización y el desenlace principal, no así fibrosis o resolución de NASH16. Como el estudio PIVENS excluyó a pacientes con diabetes, las guías de la AASLD únicamente recomiendan vitamina E en pacientes no diabéticos5,14. Sin embargo, en un análisis retrospectivo en el que se agruparon los resultados del estudio PIVENS y el estudio FLINT21, un ECC que comparó ácido obeticólico con placebo en pacientes con NASH, con o sin diabetes, mostró que la vitamina E es también efectiva en pacientes con diabetes22. En un metaanálisis en red en el que se incluyeron ácido obeticólico, pentoxifilina, vitamina E y pioglitazona, se corroboró la eficacia de la vitamina E para mejorar la esteatosis y la balonización, pero no se encontró mejoría significativa en la inflamación ni en la fibrosis19. Los efectos adversos a los que se ha asociado este compuesto en estudios observacionales han sido incremento en mortalidad general, cáncer de próstata y enfermedad vascular cerebral de tipo hemorrágico23,24. Existe actualmente en curso un ECC multicéntrico que evaluará la eficacia y la seguridad de la vitamina E en NASH luego de 96 semanas de tratamiento (NCT02962297).
PentoxifilinaEs un inhibidor de fosfodiesterasa con propiedades hemorreológicas y antioxidantes al disminuir los niveles del factor de necrosis tumoral alfa. Su evidencia en NASH aunque prometedora se limita a estudios con un escaso número de pacientes. Un metaanálisis mostró mejoría en esteatosis, inflamación, e inclusive en fibrosis, no así en balonización25, mientras que un metaanálisis en red mostró también beneficio en balonización19. Este compuesto tiene un perfil de seguridad muy aceptable y es económico; desafortunadamente, no hay hasta el momento ningún nuevo ECC registrado, y la evidencia actual es muy limitada para poder recomendar su uso en forma rutinaria.
Agonistas del péptido similar al glucagón tipo 1Son tratamientos aprobados para diabetes y obesidad, pero se han investigado en NASH dado que además de promover la pérdida de peso son capaces de aumentar la betaoxidación a nivel hepático, reducir el apetito (efecto sobre los niveles de leptina y retraso en el vaciamiento gástrico), aumentar la secreción de insulina estimulada por glucosa y disminuir la de glucagón26. Un metaanálisis de 5 estudios evidenció una disminución significativa en los niveles de transaminasas27. Un estudio con diseño antes-después de pacientes con esteatosis determinada por ERM que recibieron liraglutide/exenatide mostró mejoría en esteatosis, y se encontró un gradiente entre la mejoría obtenida y los niveles basales de esteatosis28. Más recientemente se publicó el estudio LEAN, un ECC que aleatorizó a 26 pacientes, la mayoría no diabéticos, a placebo o liraglutide, el desenlace principal fue histopatológico (resolución de NASH sin empeoramiento en fibrosis). Luego de un año, liraglutide demostró ser superior a placebo en el desenlace principal (40 vs. 10%); desafortunadamente, el estudio no tenía el poder suficiente para determinar si el efecto fue independiente de la pérdida de peso que se vio en los pacientes en el brazo de liraglutide29. De hecho, un estudio más reciente, el Lira-NAFLD, un estudio con diseño antes-después de 68 pacientes con diabetes mal controlada, evidenció reducción de la esteatosis hepática determinada por ERM únicamente en los pacientes que tuvieron una reducción de peso significativa, cuestionando la hipótesis de que los agonistas GLP-1 tengan algún efecto adicional al derivado de la pérdida de peso30. De hecho, un estudio en pacientes asiáticos que determinó esteatosis por resonancia magnética comparó dieta/ejercicio con liraglutide en 24 pacientes obesos no diabéticos; ambos grupos lograron una reducción significativa y equiparable de peso y de lípidos intrahepáticos, lo que puede indicar que el efecto de liraglutide puede estar confundido por la pérdida de peso que induce31.
Tratamientos equívocosRevisaremos algunos tratamientos cuyo mecanismo de acción respondería a la fisiopatología del NAFLD, pero que hasta el momento no han mostrado ser eficaces. Entre estos se encuentran metformina, el ácido ursodesoxicólico, los fibratos, los ácidos grasos omega 3 y el anticuerpo monoclonal simtuzumab.
MetforminaLas expectativas de metformina eran grandes dado que embona perfectamente en la fisiopatología del NAFLD al mejorar la resistencia a la insulina. Sin embargo, no existe evidencia que respalde su uso en NASH. A pesar de disminuir la resistencia a la insulina, no ha demostrado de forma consistente ser eficaz para mejorar pruebas de función hepática o los componentes histopatológicos de NAFLD (esteatosis, balonización, inflamación, fibrosis)32.
Claro está que esto no significa que los pacientes con NAFLD que tengan indicación para metformina (p. ej. prediabetes o diabetes), que son la mayoría, no deban recibirla. De hecho, estudios observacionales en pacientes con cirrosis han demostrado asociación entre metformina y disminución de mortalidad general y del riesgo de hepatocarcinoma, por lo que inclusive en pacientes con hepatopatía avanzada es importante considerar el uso de metformina en quien tenga indicación clínica33.
Ácido ursodesoxicólicoEl ácido ursodesoxicólico es un ácido biliar secundario hidrofílico utilizado en el tratamiento de la colangitis biliar primaria, colelitiasis y otras formas de colestasis. Se ha investigado en NAFLD dado que tiene un potencial efecto antiapoptótico y antioxidante, además de poder tener una interacción débil con el receptor del farnesoide X (FXR, por sus siglas en inglés). Sin embargo, existe evidencia de buen nivel en NASH (ECC doble-ciego con buen número de pacientes y desenlace histopatológico) en los cuales el ácido ursodesoxicólico no mostró beneficio por lo que no se puede recomendar su uso34,35.
FibratosFuncionan como agonistas de PPAR-alfa, promoviendo la betaoxidación hepática y muscular. Existen 3 estudios no controlados, 2 de ellos con desenlace histopatológico, que resultaron negativos para su uso en NASH36–38. Un ECC que comparó ácido nicotínico, fenofibrato y placebo en esteatosis determinada por ERM también fue negativo39. Con lo anterior, no existe evidencia que sustente su uso en NASH.
Ácidos grasos poliinsaturadosRepresentan una opción plausible dado que disminuyen los niveles de triglicéridos, incrementan los niveles de adiponectina, mejoran la disfunción endotelial e incrementan la sensibilidad a la insulina. Los más estudiados son el ácido docosahexaenoico y el ácido eicosapentaenoico. Existen al menos 2 ECC con desenlace histopatológico, uno de 37 y otro de 41 pacientes, en donde no se encontró diferencia significativa con respecto al placebo40,41. Con la evidencia actual no se puede sustentar su aplicación como tratamiento de NASH, pero las guías de la AASLD hacen énfasis en considerarlos para el tratamiento de hipertrigliceridemia en pacientes con NAFLD5,14.
SimtuzumabEs un anticuerpo monoclonal contra la lisil oxidasa tipo 2, que participa en el entrecruzamiento de colágena y que se ha visto que participa en la progresión de fibrosis. Estudios de esta molécula en pacientes con virus de la hepatitis C y coinfección de virus C y virus de la inmunodeficiencia humana fueron negativos, y NAFLD no fue la excepción; 2 estudios fase 2 de este compuesto en pacientes con NASH y fibrosis avanzada, y NASH y cirrosis (NCT01672866, NCT01672879), fueron concluidos recientemente por falta de eficacia.
Tratamientos emergentesSon tratamientos con una indicación distinta a NASH pero que pudieran ser beneficiosos en esta enfermedad en base a algunos estudios preliminares, sin contar aún con evidencia suficiente.
Antagonistas del receptor de angiotensina iiLos mecanismos potenciales por los cuales podrían servir de tratamiento en NASH son que aumentan los niveles de adiponectina, favorecen la betaoxidación hepática y tienen efecto antiinflamatorio al reducir el factor de necrosis tumoral alfa. En un ensayo clínico con biopsias pareadas se aleatorizaron 54 pacientes con NASH a valsartán o telmisartán por 20 meses y se encontró una mejoría significativa en fibrosis, el NAS y los niveles de transaminasas en el grupo de telmisartán. Al no contar con un grupo control, la interpretación de estos resultados es limitada42. En otro ensayo clínico abierto con biopsias pareadas se aleatorizaron 50 pacientes con NASH a telmisartán y medidas higiénico-dietéticas o solo medidas higiénico-dietéticas; el grupo de telmisartán mostró mejoría histopatológica en esteatosis, inflamación, balonización e inclusive fibrosis43. Sin embargo, el estudio no utilizó placebo, el número de pacientes fue reducido y hubo muchas pérdidas, limitando las conclusiones43.
Esta evidencia es insuficiente para sustentar el uso de telmisartán como tratamiento específico de NASH. Sin embargo, si no existe contraindicación, puede ser un fármaco de primera línea en pacientes con NASH que tengan hipertensión arterial.
EstatinasIndependientemente de que una buena parte de los pacientes con NASH tendrán indicación clínica del uso de estatinas (p. ej. dislipidemia, riesgo cardiovascular), sus propiedades pleiotrópicas indican que serían buen tratamiento de esta enfermedad. Sin embargo, la evidencia es limitada; un estudio de la colaboración Cochrane en 2013 encontró únicamente 2 estudios elegibles en base a criterios de inclusión establecidos, ambos con alto riesgo de sesgo, y de los cuales solo uno incluía biopsias pareadas para evaluar desenlace histopatológico, con lo cual a la conclusión que se llegó es que hacen falta estudios clínicos44. Un estudio antes-después con biopsias pareadas en 20 pacientes con NASH a los que se les administró rosuvastatina por un año mostró resolución de NASH en 19 casos. La mayor limitante de este estudio es que no hubo un grupo control45. Indiscutiblemente las estatinas son un fármaco que puede tener lugar en NAFLD pero se necesitan ECC con un adecuado número de pacientes. Es importante señalar que en el caso de NAFLD la elevación de transaminasas, e inclusive la presencia de cirrosis, no son contraindicaciones para el uso de estatinas, así que deben emplearse en todo paciente con indicación clínica.
ProbióticosRepresentan una estrategia factible dada la íntima relación que existe entre la microbiota intestinal, los productos microbianos, y el hígado a través del sistema porta. Entre otros efectos pueden regular el crecimiento bacteriano, suprimir bacterias patógenas, además de que tienen propiedades inmunomoduladoras y son capaces de reforzar la barrera mucosa. Los pacientes con NAFLD tienen disbiosis, principalmente disminución en la diversidad y en la relación Bacteroides/Prevotella. Existe un ECC con biopsias pareadas que aleatorizó 66 pacientes a placebo o Bifidobacterium longum el cual mostró reducción significativa en esteatosis y el NAS. Las mayores limitantes de los estudios con probióticos a la fecha es que son de pocos pacientes, no evaluaron desenlace histopatológico, y utilizaron cepas y dosis distintas46. Se necesita evidencia más consistente para corroborar el efecto benéfico de los probióticos y para identificar la cepa idónea para pacientes con NAFLD.
Trasplante de microbiota fecalBajo el mismo principio por el cual los probióticos podrían ser útiles en NAFLD, el trasplante de microbiota fecal representa una opción plausible. Existen al menos 4 ensayos clínicos del uso de esta estrategia en NASH (NCT02469272, NCT02868164, NCT02721264, NCT02496390).
Inhibidores del cotransportador Na-glucosa tipo 2Son fármacos que fueron aprobados recientemente para el tratamiento de la diabetes mellitus tipo 2 y cuyo mecanismo de acción consiste en inhibir la resorción de glucosa a nivel renal, favoreciendo el control glucémico. Estudios preclínicos demostraron que dapagliflozina, un medicamento con este mecanismo de acción, redujo el contenido intrahepático de triglicéridos. Actualmente está en marcha un estudio en donde se evaluará el efecto dapagliflozina en esteatosis hepática determinada por ERM en pacientes diabéticos (NCT02696941).
Fármacos para enfermedad por hígado graso no alcohólico que se encuentran en ensayo clínico controladoExisten actualmente varios ECC de nuevos fármacos en NASH, revisaremos algunos de ellos, comenzando con los que se encuentran en estudios de fase 3, y luego los de fase 2.
Ácido obeticólicoEs un ácido biliar semisintético, análogo del quenodesoxicólico, agonista del FXR. Actualmente está aprobado en pacientes con colangitis biliar primaria no respondedores o intolerantes a ácido ursodesoxicólico. Estimula el FXR en íleon distal con la consecuente secreción de factor de crecimiento de fibroblastos 19 (FGF-19, por sus siglas en inglés) al sistema porta, que lo lleva hasta el hígado, en donde disminuye la producción de ácidos biliares, estimula la betaoxidación, disminuye la lipogénesis y la gluconeogénesis. En el estudio FLINT se aleatorizaron 282 pacientes con NASH a ácido obeticólico o placebo por 72 semanas, y el desenlace principal fue mejoría del NAS en al menos 2 puntos sin empeoramiento en fibrosis. El obeticólico fue superior a placebo en forma significativa con respecto al desenlace principal, además de que mejoró esteatosis, inflamación, balonización, e inclusive fibrosis. Sin embargo, uno de los efectos adversos más comunes fue prurito, y se observó un incremento en el colesterol de baja densidad y en la resistencia a la insulina, aspectos preocupantes en pacientes con síndrome metabólico21. Actualmente este fármaco se encuentra en un estudio fase 3 (REGENERATE, NCT02548351) donde se estudiará en pacientes con NASH y fibrosis significativa. Adicionalmente, se encuentra abierto un estudio fase 2 (CONTROL, NCT02633956) cuyo propósito es evaluar el impacto en el perfil de lípidos de los pacientes de la administración conjunta de distintas dosis de obeticólico y atorvastatina.
ElafibranorAgonista PPAR dual (delta y alfa) que estimula la betaoxidación muscular y hepática además de que a nivel hepático disminuye la gluconeogénesis, la producción de triglicéridos, y tiene efecto antiinflamatorio, promoviendo un perfil metabólico favorable, a diferencia de los efectos que se observaron en el estudio FLINT mencionado arriba. En un ECC fase 2a en pacientes con NASH (GOLDEN 505) no se cumplió el objetivo principal (resolución de alguno de los componentes de NASH sin empeoramiento en fibrosis) pero mejoró la inflamación a nivel histopatológico, así como pruebas de función hepática, resistencia a la insulina y perfil de lípidos, pero se asoció a un incremento transitorio en creatinina47. Actualmente se encuentra en un estudio fase 3 (RESOLVE-IT, NCT02704403) en pacientes con NASH y fibrosis.
Otros agonistas del receptor gamma activado por el factor proliferador de peroxisomasIVA337Es un agonista pan-PPAR, actualmente se encuentra reclutando pacientes el estudio NATIVE, un ECC fase 2b en donde se evaluarán 2 dosis distintas de este compuesto contra placebo; el desenlace es histopatológico (NCT03008070).
SaroglitazarEs un agonista PPAR dual (gamma y alfa) originalmente aprobado para el tratamiento de dislipidemias. Actualmente se encuentra reclutando pacientes con NASH el estudio EVIDENCES II, en el que se evaluarán 3 distintas dosis de este compuesto. El desenlace será histopatológico (NCT03061721).
AramcholEs un conjugado de ácido araquidónico y ácido cólico que inhibe la enzima estearoil coenzima A desaturasa (SCD1, por sus siglas en inglés), provocando disminución en la síntesis de ácidos grasos, reducción de reservas de triglicéridos, y aumento de la eliminación intracelular de colesterol hacia partículas ApoA1. En un estudio fase 2 disminuyó el grado de esteatosis determinada por ERM48. Actualmente se encuentra en un estudio fase 2b (ARREST, NCT02279524) en el que se compararán dosis (400 y 600mg); el desenlace principal se evaluará con resonancia magnética nuclear, pero también se harán biopsias pareadas.
Otros-El bitartrato de cisteamina es un precursor de glutatión con capacidad antioxidante que ha sido estudiado primordialmente en niños con NAFLD, sin embargo, un ECC no mostró mejoría histológica49.
-GR-MD-02 es un inhibidor de galectina-3 que modula la unión de macrófagos a residuos de galactosa. En un estudio fase 1 mejoró marcadores séricos de fibrosis y actualmente se encuentra en estudio fase 2a en pacientes con cirrosis por NASH, pero aún no se inicia el reclutamiento de pacientes (NCT02462967).
-El Cenicriviroc es un antirretroviral que inhibe el receptor de quimoquinas CCR2 y CCR5. En resultados preliminares del estudio fase 2b (CENTAUR, NCT02217475) se observó un efecto benéfico de este compuesto. Se aleatorizaron 289 pacientes con NASH a cenicriviroc o placebo; al año de seguimiento no hubo mejoría significativa en el desenlace principal (mejoría de al menos 2 puntos en NAS sin empeoramiento en fibrosis) pero si en un desenlace secundario que fue mejoría en fibrosis sin empeoramiento en NASH. Se esperan los resultados de los 2 años de seguimiento.
-Selonsertib es un inhibidor de cinasa reguladora de señal de apoptosis 1 (ASK1, por sus siglas en inglés) que está implicada en las vías de fibrosis hepática. En un estudio fase 2a de pacientes con NASH y fibrosis significativa se aleatorizaron 72 pacientes a 2 dosis distintas de selosertib (18 y 6mg) o placebo, con o sin simtuzumab; resultados preliminares demostraron mejoría significativa en fibrosis con un gradiente dosis-respuesta. La publicación de los resultados definitivos de este estudio está pendiente (NCT02466516).
-Emricasan es un inhibidor de caspasa que se encuentra en un estudio fase 2b (ENCORE-NF, NCT02686762) que incluirá biopsias pareadas. Previamente demostró mejoría en transaminasas en un estudio fase 2a.
-Oltipraz es un inhibidor del receptor X del hígado alfa (LXR-alpha, por sus siglas en inglés) capaz de inhibir la síntesis de lípidos intrahepáticos. En un ECC controlado con placebo de 64 pacientes en el que se evaluaron 2 dosis distintas (60 y 120mg), oltipraz se asoció a una reducción de la esteatosis determinada por ERM50.
-IMM-124e es un compuesto de anticuerpos antilipopolisacárido y adyuvantes, principalmente glucoesfingolípidos, cuya base teórica es modificar la microbiota así como la respuesta inmune innata a nivel intestinal. En un estudio abierto fase i/ii en 10 pacientes con NASH y prediabetes/diabetes la administración de este compuesto por vía oral por 30 días mejoró la resistencia a la insulina, las pruebas de función hepática y los niveles de adiponectina. Actualmente se encuentra en un estudio fase 2 en donde se comparará el efecto de 2 dosis distintas de IMM-124e contra placebo en esteatosis hepática detectada por resonancia magnética (NCT02316717).
ConclusionesLas medidas higiénico-dietéticas han demostrado ser eficaces para el tratamiento del NAFLD y deben representar el eje central de cualquier estrategia terapéutica. Los tratamientos farmacológicos actuales solo están recomendados en pacientes con NASH y son limitados además de no estar libres de efectos adversos, por lo que es necesario individualizar cada caso y explicar a los pacientes los riesgos/beneficios antes de prescribirlos. Es importante siempre tener en mente que la principal causa de mortalidad en estos pacientes es la cardiovascular, por lo que el manejo debe ser integral, tratando cada uno de los componentes del síndrome metabólico. Existen múltiples ECC de nuevos fármacos para el tratamiento de NASH por lo que habrá nuevas alternativas en el futuro próximo. Es posible que se vaya a necesitar de más de un fármaco para el tratamiento satisfactorio del NASH, y cada esquema terapéutico tendrá que tomar en cuenta el fenotipo y estadio de la enfermedad, las comorbilidades de cada paciente, la presencia de condiciones emergentes, el genotipo, e importantemente, la economía de cada paciente.
FinanciaciónLa presente investigación no ha recibido ayudas específicas provenientes de agencias del sector público, sector comercial o entidades, sin ánimo de lucro.
Conflicto de interesesEl autor recibió una beca por parte de Gilead Canadá para completar su entrenamiento en hepatología.