Los tumores neuroendocrinos (TNE) son neoplasias epiteliales con diferenciación neuroendocrina, que sintetizan o secretan hormonas y monoaminas bioactivas1. Representan una causa infrecuente de diarrea crónica, siendo raro su diagnóstico en pacientes jóvenes.
Representan el 0.4% de los tumores y el 2.5% de las neoplasias gastrointestinales. El 65% de los TNE surgen en el aparato digestivo y el páncreas; el 12.9% se encuentran en el colon, de ellos el 70% afecta al colon derecho. Aunque son responsables de menos del 1% de los casos de diarrea crónica, es crucial considerarlos en el diagnóstico diferencial tras descartar las causas más frecuentes.
Se presenta un paciente varón de 28 años, con antecedentes de trastorno obsesivo-compulsivo tratado con lamotrigina, vilazodona y clonazepam, medicamentos suspendidos por decisión del paciente 4 meses antes de su consulta inicial. Acudió por presentar durante 12 meses evacuaciones Bristol 6-7, con frecuencia de 4-5 por día, abundantes, explosivas, que no remitían con el ayuno y muchas de ellas de predominio nocturno. Refirió esteatorrea, negando creatorrea y lientería. Destacó la presencia ocasional de moco, sangre y tenesmo en sus evacuaciones. A ello se sumó dolor abdominal de tipo cólico en el mesogastrio, de intensidad 4/10, sin irradiación, asociado a la ingesta de alimentos, y refirió alivio con las evacuaciones. En la exploración física destaca dolor a la palpación superficial y profunda en el flanco y la fosa ilíaca derecha e índice de masa corporal de 18. Refirió haber sido evaluado previamente por estos síntomas, incluyendo la realización de una endoscopia digestiva alta, siendo diagnosticado como síndrome de intestino irritable y manejado con antiespasmódicos, sin obtener mejoría.
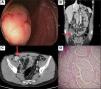
Se abordó por diarrea crónica, se solicitaron estudios en sangre y heces (tabla 1). La esofagogastroduodenoscopia se encontró dentro de los parámetros normales; el reporte histopatológico informó de gastropatía congestiva no atrófica, sin atrofia de vellosidades en el duodeno y en la colonoscopia se observó una lesión exofítica de 30mm en el ciego, de superficie ulcerada y friable a la manipulación (fig. 1A). En la tomografía abdominopélvica contrastada se observó una lesión sobre el borde medial e inferior del ciego, con engrosamiento focal de 18mm de espesor, necrosis e imágenes ganglionares a nivel paracecal (figs. 1 B y C).
Panel de resultados iniciales en el abordaje del paciente. Fuente: Historia clínica
| Determinaciones | Resultado | Rango de normalidad |
|---|---|---|
| Leucocitos | 7.87 103/ul | 4.4-10 |
| Neutrófilos | 5.63 103/ul | 2-8 |
| Linfocitos | 1.51 103/ul | 1-4.4 |
| Hemoglobina | 14.9g/dl | 13.5-17.3 |
| VCM | 83.8fl | 76-96 |
| HCM | 29.1pg | 28-33 |
| Glucosa | 88mg/dl | 50-100mg/dl |
| TSH | 2.56uUI/ml | 0.27-4.2 |
| T3 libre | 2.84pg/ml | 1.71-3.71 |
| T4 libre | 1.16ng/dl | 0.8-2 |
| Sodio | 141.4mEq/l | 135-145mEq/l |
| Potasio | 4.21mEq/l | 3.5-4.5 mEq/l |
| Calcio | 9.8mg/dl | 8.2-10.5mg/dl |
| Magnesio | 1.93 mg/dl | 1.7-2.2mg/dl |
| Creatinina | 1.08mg/dl | 0.70-1.20mg/dl |
| Urea | 29mg/dl | 16.6-48.5mg/dl |
| Bilirrubina total | 0.40 mg/dl | 0.1-1.2 |
| Bilirrubina directa | 0.17 | 0.0-0.14 |
| Bilirrubina indirecta | 0.23 | |
| TGO | 14UI/l | 0-40UI/l |
| TGP | 16UI/l | 0-45UI/l |
| Fosfatasa alcalina | 146.3UI/l | 0-400UI/l |
| GGT | 12UI/l | 12-64UI/l |
| Albúmina | 4.72g/dl | 3.5-5.2g/dl |
| VSG | 2mm/Hr | 0-10 |
| PCR | 0.3mg/l | 0.0-5.00 |
| Inmunoglobulina A (IgA) | 275mg/dl | 83-453mg/dl |
| Anticuerpos transglutaminasa tisular IgA (anti-tTg IgA) | 4.40U/ml | 0-25U/ml |
| Antígeno Giardia lamblia | Negativo | |
| Elastasa fecal | 220mcg/g | >200 |
| Calprotectina fecal | 342mcg/g | <50mcg/g |
| Coprocultivo | Sin aislamiento de gérmenes |
GGT: gamma-glutamil transferasa; HCM: hemoglobina corpuscular media; PCR: proteína C reactiva; T3: triyodotironina; T4: tiroxina; TGO: transaminasa glutámico oxalacética; TGP: transaminasa glutámico pirúvica; TSH: hormona estimulante de la tiroides; VCM: volumen corpuscular medio; VSG: velocidad de sedimentación globular.
Pruebas de imagen realizadas e histología del tumor.
A. Colonoscopia que evidencia una lesión de 3cm en el ciego. B. y C. TAC con contraste en corte coronal y axial, que pone de manifiesto una lesión en el borde medial e inferior del ciego, caracterizada por un engrosamiento focal de la pared de aproximadamente 18mm de espesor con extensión endoluminal. D. Corte histopatológico de un tumor neuroendocrino bien diferenciado grado 2; se observa una neoplasia epitelial que presenta crecimiento en forma de nidos, con células de núcleos moderadamente pleomórficos y cromatina laxa o densa, además de presencia de mitosis y un citoplasma escaso. La neoplasia se desarrolla en un estroma vascularizado y muestra infiltración a través de todas las capas del colon, rebasando la serosa.
Fuente: historia clínica del paciente.
Posteriormente fue sometido a hemicolectomía derecha con resección ganglionar, con valores prequirúrgicos de cromogranina A 117ng/ml (VN<85ng/ml) y somatostatina 6ng/ml (VN<10ng/ml) dentro de los parámetros normales. El reporte histopatológico informó de un tumor neuroendocrino bien diferenciado grado 2 (pT2, pN1, pM0), invasión de todas las capas, rebasando la serosa, permeación linfovascular presente, cromogranina positivo: +++; sinaptofisina positivo +++; Ki-67: positivo: 3-20% y metástasis a 2/28 ganglios (fig. 1 D).
Se efectuaron controles posquirúrgicos a los 2, 4 y 6 meses, con mejoría del patrón evacuatorio y dolor abdominal leve. Los estudios serológicos a los 12 meses revelaron: cromogranina A 58ng/ml (VN 85ng/ml), ácido 5 hidroxi-indolacético (5-HIAA) en orina de 24horas de 2mg (VN<2-9mg/24h), gammagrafía con TC 99M-octreótido negativo para receptores de somatostatina, resultados indicativos de remisión. El estudio colonoscópico y las biopsias de anastomosis revelaron ausencia de actividad tumoral.
La diarrea crónica se define por la evacuación de 3 o más heces blandas al día (Bristol 6-7) durante más de 4 semanas; es una causa habitual de consulta gastroenterológica, siendo más frecuente en adultos>65 años, y su abordaje requiere una anamnesis detallada y la identificación de datos de alarma para diferenciar entre afectación orgánica de la funcional y seleccionar a las personas que ameritan un estudio invasivo temprano. Consta de un amplio espectro de condiciones como neoplasias, inflamación del colon o intestino delgado, malabsorción y trastornos de la motilidad, lo que conlleva la realización de estudios excesivos. Dentro de las formas clínicas la diarrea secretora se produce por un desequilibrio entre los procesos de absorción y secreción intestinal, caracterizándose por un incremento en la secreción de líquidos y electrolitos, desde el plasma hacia la luz intestinal. Clínicamente se manifiesta con evacuaciones líquidas, abundantes (>1l por día), persistentes incluso durante el ayuno y de predominio nocturno2.
En este caso la presencia de signos de alarma, como evacuaciones nocturnas, continuas, de gran volumen, asociadas a pérdida de peso, junto con una calprotectina fecal elevada, orientó el enfoque hacia una causa orgánica subyacente3.
Los TNE del colon se diferencian de los carcinomas neuroendocrinos por su grado de agresividad. Presentan una prevalencia estimada de 5.2/100,000 personas al año4, con una edad media al diagnóstico de 63 años5. El diagnóstico puede retrasarse de 5 a 7 años, lo que subraya la importancia de una evaluación oportuna6. Los TNE representan el 25% de todos los carcinomas neuroendocrinos gastro-entero-pancreáticos. En el colon tienen un comportamiento agresivo, a diferencia de los ubicados en el apéndice y el recto, que son más indolentes, se detectan de manera incidental en la gran mayoría de ocasiones y en otras se asocian a dolor abdominal, sangrado rectal, diarrea crónica secretora, pérdida de peso y/o anorexia7. Estos tumores presentan una alta capacidad metastásica, afectando al hígado, a los ganglios linfáticos, al peritoneo, al hueso y al pulmón8. El diagnóstico se basa en la combinación de morfología a través de estudios endoscópicos, imagen e inmunohistoquímica por la presencia de células enterocromafines productoras de serotonina, que expresan marcadores como sinaptofisina, cromogranina A y CD56, y deben de ser clasificados como bien diferenciados G1/G2/G3, poco diferenciados o mixtos cuando comparten histología no-neuroendocrina9. El tratamiento de elección es la resección quirúrgica, siempre que sea factible10. Desafortunadamente no está consolidado que características clínico-patológicas nos permitan seleccionar a pacientes con alto riesgo de recurrencia o metástasis. Al ser en su mayoría detectados en etapas avanzadas, presentan una supervivencia a 5 años del 71% en la etapa 1 y del 10% en la etapa IV11.
FinanciaciónLos autores declaran no haber recibido ningún tipo de financiación para esta publicación.
Consideraciones éticasPor medio de la presente, los autores declaran que esta investigación no ha involucrado experimentación en seres humanos ni en animales. La información utilizada fue obtenida a partir del expediente clínico del paciente, previa autorización mediante consentimiento informado por escrito. Se han adoptado todas las medidas necesarias para garantizar la confidencialidad de los datos, omitiendo cualquier información que pudiera permitir la identificación del paciente a través de imágenes o datos del artículo, por lo que no se requirió la revisión o aprobación por el comité de ética institucional.
Conflicto de interesesLos autores declaran que no existe ningún conflicto de intereses.