La enfermedad inflamatoria intestinal (EII) en la población pediátrica se encuentra en aumento, alcanzando hasta un 30% de la población total de pacientes con EII1. En Latinoamérica, existe escasa información sobre la epidemiología en esta población. Sin embargo, un estudio publicado en 2021 confirma un aumento en el número de casos2.
Diversas estrategias terapéuticas han sido aprobadas para el tratamiento de la EII3. Sin embargo, los estudios pivotales que avalan su uso se han realizado en población adulta, y sus resultados suelen extrapolarse a la población pediátrica. En caso de falla de anti-factor de necrosis tumoral (anti TNF) existen medicamentos con otros mecanismos de acción, pero no aprobados para el uso pediátrico pero utilizados off label como rescate en caso de refractariedad, como es el caso de moléculas pequeñas tipo Janus Kinasas (JAK)4–8. Según nuestro conocimiento, no existen casos publicados en Latinoamérica sobre el uso de upadacitinib, un inhibidor selectivo de las JAK tipo 1 en población pediátrica con enfermedad de Crohn (EC).
Presentamos el caso de un paciente de 15 años, sexo femenino, sin antecedentes médicos relevantes, quien en diciembre de 2023 inicia deposiciones pastosas diarias con sangre fresca y dolor articular periférico. En exámenes destaca: hemoglobina de 9g/dL, proteína C reactiva normal, albúmina de 3.7g/dL, calprotectina fecal (CF) de 441 ug/g, estudio microbiológico negativo. Se realiza colonoscopia que presenta íleon terminal conservado y que evidencia erosiones y úlceras de 2mm intercaladas con áreas de mucosa respetadas. Se inicia tratamiento con prednisona 40mg según esquema (ocho semanas) y mesalazina 2 g al día vía oral. Sin embargo, tras suspensión de corticoides y mantener mesalazina, la paciente reinicia cuadro de diarrea con sangre, wPCDAI 52.5, y CF 1120 ug/g. Es evaluada en nuestro centro, se realiza colonoscopia que muestra úlceras en íleon terminal y colon compatibles con una EC con actividad inflamatoria moderada (SES-CD 11). Enteroresonancia de abdomen-pelvis confirma compromiso inflamatorio de íleon terminal y segmentario a nivel de colon descendente-sigmoides. Se realiza diagnóstico de EC A1b, L3, B1, G0 de la clasificación Paris e inicia tratamiento con adalimumab, pero a las 16 semanas la paciente persiste con diarrea sanguinolenta, con CF 144 ug/g y niveles plasmáticos de adalimumab predosis de 24.5 ug/mL.
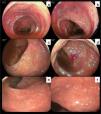
Una nueva colonoscopia confirma EC íleo colónico con actividad inflamatoria grave (SES CD 30) (fig. 1 a-d). Debido a falla primaria a adalimumab se inicia tratamiento con upadacitinib en fase de inducción (45mg al día vía oral durante 12 semanas). La paciente evoluciona favorablemente, logrando remisión sintomática, wPCDAI 0 y respuesta endoscópica, con presencia de úlceras aftoídeas solo en los últimos 2cm del recto distal, SES CD 3 (fig. 1 e-f). Las biopsias rectales muestran únicamente infiltración linfoplasmocitaria sin alteraciones de la arquitectura glandular. Por lo referido, se decide mantener tratamiento con upadacitinib en fase de mantenimiento (30mg día vía oral), evolucionando hasta la fecha asintomática y sin haber presentado eventos adversos al fármaco.
En población pediátrica con EII, similar a lo descrito en adultos, se observa una falla de respuesta primaria hasta en un 25-30% de los casos, así como una pérdida de respuesta secundaria hasta en un 60% de los casos que utilizan terapia anti TNF9,10. En este contexto, se han publicado estudios sobre la efectividad de otras estrategias terapéuticas que incluyen el uso de biológicos con distinto mecanismo de acción vedolizumab y ustekinumab4 o moléculas pequeñas tipo janus-kinasas (JAK)5–8.
En general, la elección de un fármaco debe ser personalizada, considerando el perfil del paciente, las características de la enfermedad, el deseo de embarazo, posibilidades de acceso, vía de administración y principalmente, la opinión del paciente6.
Nuestro caso, al igual que los descritos en otros reportes7,8, muestra que upadacitinib, es una opción terapéutica en población pediátrica y adulta, que han presentado una falla previa a anti-TNF. En nuestro caso, las opciones disponibles eran infliximab, ustekinumab, vedolizumab o upadacitinib. La selección del medicamento fue discutida por la familia de la paciente y debido a cobertura, tiempos y posibilidades de respuesta más favorables, se definió inicio de upadacitinib. La paciente descrita alcanzó la remisión sintomática tras la inducción con este fármaco y logró una respuesta endoscópica.
En cuanto al perfil de seguridad, si bien se describen posibles eventos adversos, en los casos reportados estos han sido manejables, aunque son necesarios estudios a largo plazo y de vigilancia estrecha para su validación7,8. Nuestra paciente no ha presentado ningún evento adverso durante el periodo de tratamiento.
Este caso ejemplifica que el uso de upadacitinib puede inducir remisión clínica y endoscópica en EC pediátrica refractaria a anti-TNF, sirviendo como terapia de rescate exitosa. Aunque es un reporte individual, aporta evidencia alentadora en favor de estudiar formalmente la seguridad y eficacia de los inhibidores de JAK en población pediátrica con EII refractaria.
FinanciaciónNo se recibió patrocinio de ningún tipo para llevar a cabo este artículo.
Responsabilidades éticasLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos.
Utilizamos protocolos de obtención de base de datos de pacientes de nuestro centro de trabajo, preservando el anonimato de la paciente (por lo que no solicitamos consentimiento informado).
Este estudio cumple con la normativa vigente de investigación bioética.
Conflicto de interesesLos autores declaran no presentar conflictos de intereses.