La infección por Helicobacter pylori (H. pylori) continúa siendo muy común en México y a nivel mundial. Ante los avances en diagnóstico, tratamiento y vigilancia epidemiológica, la Asociación Mexicana de Gastroenterología, a través de un grupo multidisciplinario de expertos, desarrolló el «V Consenso Mexicano sobre H. pylori» en 2025. Este consenso proporciona 38 recomendaciones sustentadas en evidencia, y adaptadas al contexto nacional. El acuerdo destaca la creación del Registro Mexicano para el Estudio del Diagnóstico y Tratamiento de la Infección por Helicobacter pylori (Hp-MexReg) y su integración con los proyectos Hp-LatamReg y HpRESLA, permitiendo obtener datos locales de tasas de erradicación y resistencia antimicrobiana. El grupo experto reafirma la alta prevalencia de H. pylori en México (70.5%) relacionada con factores sociales y sanitarios, así como el incremento en cepas resistentes, en particular a claritromicina y levofloxacina. En cuanto al diagnóstico, se prioriza la prueba del aliento con urea marcada como método no invasivo de primera elección, y se recomienda confirmar la erradicación al menos cuatro semanas después del tratamiento. En el aspecto terapéutico, se recomiendan las terapias cuádruples con o sin bismuto son superiores a la triple terapia estándar, y se avala el uso de bloqueadores ácidos competitivos del potasio como una alternativa efectiva a altas dosis de inhibidores de la bomba de protones. De forma destacada, se recomienda erradicar H. pylori puntualizando las situaciones clínicas. Este consenso subraya la necesidad de continuar generando estudios nacionales que permitan adaptar las estrategias a la realidad epidemiológica de México.
Helicobacter pylori (H. pylori) infection remains highly prevalent in Mexico and worldwide. In response to the advances in diagnosis, treatment, and epidemiologic surveillance, the Asociación Mexicana de Gastroenterología, through a multidisciplinary panel of experts, developed the “Fifth Mexican Consensus on H. pylori” in 2025, providing 38 evidence-based recommendations tailored to the Mexican context. The document highlights the establishment of the Hp-MexReg national registry and its collaboration with Hp-LatamReg and HpRESLA projects, enabling the collection of local data on eradication rates and antimicrobial resistance. The expert group reaffirms the high prevalence of H. pylori in Mexico (70.5%) related to social and sanitation factors, as well as the increase of antibiotic-resistant strains, particularly to clarithromycin and levofloxacin. Regarding diagnosis, the 13C-urea breath test is prioritized as the first-line noninvasive method and eradication of the bacterium should be confirmed at least four weeks after treatment. Regarding treatment, quadruple therapies, with or without bismuth, are recommended over standard triple therapy, and potassium-competitive acid blockers are endorsed as an effective alternative to high-dose proton pump inhibitors. H. pylori eradication is strongly recommended, with emphasis on the clinical scenarios in which it is indicated. The present consensus underscores the need to continue conducting national studies that enable strategies to be adapted to Mexico's epidemiologic reality.
Desde la publicación del «IV Consenso Mexicano sobre Helicobacter pylori» en 20181, se han producido avances substanciales en diversos aspectos relacionados con esta infección, incluyendo su diagnóstico, tratamiento y comprensión epidemiológica. La creciente disponibilidad de nuevas tecnologías diagnósticas, la evolución en las estrategias terapéuticas y la incorporación de herramientas de vigilancia regional han motivado la necesidad de una actualización integral de las recomendaciones clínicas para el abordaje de esta infección crónica.
Uno de los desarrollos más relevantes en los últimos años en nuestro país ha sido la creación del «Registro Mexicano para el Estudio del Diagnóstico y Tratamiento de la Infección por Helicobacter pylori» (Hp-MexReg), el cual forma parte del proyecto colaborativo Latinoamericano Hp-LatamReg. Esta iniciativa regional nació de una alianza estratégica con el registro europeo (Hp-Eur Reg), y ha permitido que Hp-MexReg haga parte del registro mundial (Hp World Reg)2. A través de Hp-MexReg ahora se cuenta con datos nacionales que reflejan la diversidad regional de cepas, tasas de resistencia antimicrobiana, y patrones clínicos de presentación, lo que proporciona una base sólida para orientar decisiones clínicas y de salud pública. A la par, esta colaboración internacional ha evaluado la resistencia antimicrobiana de Helicobacter pylori (H. pylori) mediante secuenciación de próxima generación, analizando 511 muestras de pacientes sin tratamiento previo provenientes de 10 países de América Latina; evidenciándose una alta resistencia a claritromicina (36%) y fluoroquinolonas (46.5%), con variaciones regionales significativas, y una resistencia multidrogas del 10.7%. Estos resultados resaltan la importancia de implementar programas de vigilancia epidemiológica y desarrollar esquemas de erradicación basados en la susceptibilidad local o regional para optimizar el tratamiento y controlar la resistencia en la región3. Paralelamente, el advenimiento de los bloqueadores de ácido competitivos de potasio (PCAB), ha transformado el enfoque terapéutico. Estas moléculas han demostrado una eficacia equivalente o superior en la erradicación del H. pylori en comparación con los inhibidores de bomba de protones (IBP) tradicionales, en especial en cepas con altas tasas de resistencia antimicrobiana. El perfil farmacológico y tolerabilidad de los PCAB han abierto nuevas posibilidades terapéuticas en diversos contextos clínicos.
La presente actualización, impulsada por la Mesa Directiva 2025 de la Asociación Mexicana de Gastroenterología, tiene como objetivo integrar estos avances recientes y proporcionar recomendaciones basadas en evidencia científica sólida, pertinentes para la práctica clínica en México. El «V Consenso Mexicano sobre Helicobacter pylori» no solo actualiza los lineamientos diagnósticos y terapéuticos, sino también fomenta una visión más precisa y contextualizada del impacto de esta infección en nuestro país.
MétodosEl Consenso utilizó el proceso Delphi, siguiendo la metodología previamente descrita4. El grupo de trabajo incluyó 20 expertos nacionales y extranjeros que se agruparon en cuatro mesas de trabajo: 1) epidemiología, 2) indicaciones para erradicación, 3) diagnóstico y 4) tratamiento. Los coordinadores (ADCC, FBP, JMRT y JAVR) de las mesas realizaron una búsqueda exhaustiva en las siguientes bases de datos: The Cochrane Central Register of Controlled Trials (CENTRAL), MEDLINE (PubMed), EMBASE (Ovid), LILACS, CINAHL, BioMed Central y World Health Organization International Clinical Trials Registry Platform (ICTRP). La búsqueda comprendió el periodo del 1 de enero de 2010 al 31 de noviembre de 2024. Los criterios de búsqueda incluyeron los siguientes términos: «H. pylori» combinado con: «epidemiology», «incidence», «prevalence», «Mexico», «risk factors», «indications», «diagnosis», «differential diagnosis», «treatment», «antibiotics», «therapy», «treatment», «gastric cancer», «management», «review», «guidelines», «resistance» y «meta-analysis», y sus equivalentes en español. Toda la bibliografía se puso a disposición de los miembros del consenso. La estrategia completa de búsqueda por base de datos, así como los términos empleados, está disponible en el Apéndice A (Material Suplementario).
Cada coordinador general lideró una mesa de trabajo, convocando reuniones virtuales con sus respectivos integrantes con el objetivo de elaborar y proponer los enunciados pertinentes. En esta primera etapa se propusieron 44 enunciados los cuales se sometieron a una primera votación anónima vía electrónica (2 de diciembre de 2024 al 6 de enero de 2025) cuya finalidad fue evaluar la redacción y el contenido de los enunciados. Los participantes del consenso emitieron su voto considerando las siguientes respuestas: a) totalmente de acuerdo, b) parcialmente de acuerdo, c) incierto, d) parcialmente en desacuerdo, y e) totalmente en desacuerdo.
Una vez concluida la primera votación, los coordinadores realizaron las modificaciones correspondientes. Los enunciados que alcanzaron un nivel de acuerdo total superior al 75% se mantuvieron, mientras que aquellos con un desacuerdo total mayor al 75% fueron eliminados. Los enunciados con un acuerdo <75% y un desacuerdo ≤ 75% fueron revisados y reestructurados. Al finalizar esta fase (2 de diciembre de 2024 al 6 de enero de 2025), seis enunciados fueron eliminados y/o fusionados, quedando un total de 38 enunciados que fueron sometidos a una segunda votación anónima por vía electrónica (30 de enero al 10 de febrero de 2025). Posteriormente, con base en los comentarios recibidos, cuatro enunciados que no alcanzaron el 75% de acuerdo fueron modificados por los coordinadores, quienes realizaron las adecuaciones necesarias para su presentación en la reunión presencial celebrada el 20 de marzo del 2025 en Morelia, Michoacán. En dicha sesión se ratificaron los acuerdos y se formuló la propuesta de recomendaciones conforme al sistema Fuerza de las Recomendaciones y Calidad de la Evidencia (GRADE)5.
En el sistema GRADE, la calidad de la evidencia no se califica únicamente con base en el diseño o la metodología del estudio, sino que se evalúa en función de una pregunta claramente formulada y su correspondiente desenlace clínico6. Con base en este enfoque, la evidencia se clasifica como alta, moderada, baja o muy baja. Asimismo, el sistema GRADE establece la fuerza de la recomendación como fuerte o débil, a favor o en contra de la intervención o del enunciado. Es importante destacar que la fuerza de la recomendación únicamente se establece en el contexto de pruebas diagnósticas e intervenciones terapéuticas. Tal como se muestra en la tabla 1, el sistema GRADE se representa mediante un código compuesto por letras mayúsculas para la calidad de la evidencia, seguidas de un número que indica la fuerza de la recomendación a favor o en contra.
Evaluación mediante el sistema GRADE e integración de la evidencia
| Calidad de la evidencia | Código |
|---|---|
| Alta | A |
| Moderada | B |
| Baja | C |
| Muy baja | D |
| Fuerza de la recomendación | |
| Fuerte a favor de la intervención | 1 |
| Débil a favor de la intervención | 2 |
| Débil en contra de la intervención | -2 |
| Fuerte en contra de la intervención | -1 |
GRADE: Grading of Recommendations, Assessment, Development and Evaluation.
Durante la reunión presencial, los enunciados que obtuvieron un consenso> 75% fueron ratificados. Aquellos que no alcanzaron dicho umbral en las votaciones previas (n=3) fueron discutidos con el objetivo de alcanzar consenso; en caso contrario, fueron eliminados o sometidos a nueva votación. En el transcurso de estas discusiones, se formularon tres nuevos enunciados en sustitución de los que no habían alcanzado consenso en las votaciones previas. Estos también fueron sometidos al mismo proceso de votación. Al cierre de la discusión, se reconoció de manera unánime la necesidad urgente de contar con más y mejores estudios nacionales que reflejen la realidad epidemiológica, clínica y terapéutica de H. pylori en México.
Una vez establecidos los enunciados consensuados, los coordinadores elaboraron el presente documento, el cual fue revisado y aprobado por todos los miembros.
A continuación, se presentan los 38 enunciados que forman parte del consenso.
Epidemiología- 1.
En la última década se estima que la prevalencia mundial de la infección por H. pylori es cercana al 50%.
Totalmente de acuerdo 100%
Calidad de la evidencia: A
La infección por H. pylori sigue siendo una de las enfermedades infecciosas crónicas más prevalentes a nivel mundial, con una prevalencia global estimada cercana al 50% de acuerdo con dos revisiones sistemáticas recientes7,8. La prevalencia global de H. pylori en adultos se ha reducido de 52.6% (IC 95% 49.6%–55.6%) antes de 1990 a 43.9% (IC 95% 42.3%–45.5%) entre 2015 y 2022. Sin embargo, en niños y adolescentes, la prevalencia durante este mismo periodo aún fue considerablemente alta, con un 35.1% (IC 95% 30.5%–40.1%)7,8. Los análisis de tendencias temporales y regresión multivariada demuestran que la prevalencia global en adultos ha disminuido en un 15.9% (IC 95% −20.5% a −11.3%). Estos hallazgos sugieren una disminución en la transmisión de la infección en adultos, posiblemente relacionada con mejores condiciones de vida, mayor acceso a agua potable, saneamiento y uso de antibióticos, mientras que en niños y adolescentes persisten desafíos en muchas regiones del mundo, lo cual indica la necesidad de estrategias de prevención más efectivas en la infancia.
Por otra parte, existe una marcada variabilidad regional a nivel mundial7,8. Las regiones con mayores tasas de infección son África y Medio Oriente, reflejando en gran parte las condiciones sanitarias y socioeconómicas menos favorables. En contraste, Europa es la región con la menor prevalencia, reportando un 40%. En América Latina, la prevalencia se sitúa en cerca del 48%, muy similar a lo que pasa en Asia-Pacífico, y también existe variabilidad entre países. Por ejemplo, en adultos, países como Guatemala (86.6%), Ecuador (85.7%), Colombia (83.1%), Nicaragua (83.3%) y Venezuela (81.3%) reportan las tasas más elevadas, cercanas o superiores al 80%. En contraste, Brasil (39.6%) y Perú (63.0%) muestran cifras considerablemente más bajas. México se encuentra en un rango intermedio-alto con una prevalencia del 70.5% (ver enunciado 2). Estos contrastes destacan la necesidad de estrategias nacionales específicas de prevención y control, basadas en la realidad epidemiológica local.
Es importante aclarar que la elección del método diagnóstico tiene un impacto significativo en las estimaciones de prevalencia de H. pylori9. Los estudios que utilizan pruebas serológicas reportan una prevalencia más alta (53.2%; IC 95% 49.8–56.6) en comparación con aquellos que emplearon métodos que detectan infección activa, como la prueba del aliento con urea (43.9%), histología (37.4%), antígeno en heces (42.0%) o la prueba rápida de ureasa (31.9%)8. Esta diferencia se explica porque la serología (anticuerpos IgG) no distingue entre infecciones activas y pasadas, lo que puede llevar a una sobreestimación de la carga actual de la infección. Estos hallazgos subrayan la necesidad de estandarizar los métodos diagnósticos en estudios epidemiológicos y considerar estas diferencias al interpretar y comparar resultados entre poblaciones o a lo largo del tiempo.
A nivel global, las diferencias en la prevalencia de H. pylori entre hombres y mujeres son mínimas, con cifras casi idénticas según los datos disponibles7,8. Sin embargo, factores culturales, socioeconómicos y de exposición ambiental pueden generar diferencias locales que merecen un análisis más detallado.
- 2.
Las regiones con nivel socioeconómico bajo y condiciones sanitarias desfavorables presentan una prevalencia más alta de infección por H. pylori.
Totalmente de acuerdo 100%
Calidad de la evidencia: A
La variabilidad regional refleja disparidades en las condiciones sanitarias, el nivel socioeconómico y el acceso a tratamientos efectivos en diversas partes del mundo. Los países de ingresos bajos y medios presentan una prevalencia significativamente mayor, estimada en 52.8% (IC 95% 50.4–55.2), en comparación con los países de altos ingresos, donde la prevalencia es de 46.1% (IC 95% 43.3–49.0)8. De manera similar, las regiones con menor acceso a servicios de salud universal —aquellas clasificadas por la Organización Mundial de la Salud (OMS) en los niveles 2 y 3 del índice de cobertura, que indican acceso limitado o moderado a intervenciones esenciales de salud pública y atención médica básica— reportan una prevalencia del 59.8% (IC 95% 50.1–69.6). En contraste, los países con mayor cobertura (nivel 5, que representa sistemas de salud con acceso amplio y consolidado a servicios fundamentales) muestran una prevalencia reducida de 44.9% (IC 95% 42.2–47.5). Por otra parte, se ha evidenciado una mayor prevalencia de la infección por H. pylori en poblaciones que presentan condiciones sanitarias deficientes como el consumo de agua no sanitizada10,11. Un ejemplo ilustrativo del impacto de los determinantes sociales en la epidemiología de H. pylori proviene de Santiago de Chile en donde se documentó una reducción significativa en la prevalencia de infección por H. pylori entre el periodo 1995–2003 y el periodo 2010–2020 de 36%12. Notablemente, esta disminución no se asoció con intervenciones masivas de erradicación, sino con mejoras en las condiciones sanitarias, en particular la ampliación del acceso a agua potable y la implementación de plantas de tratamiento de aguas servidas. Este caso subraya cómo los avances en infraestructura básica pueden tener un efecto sustancial en la reducción de la transmisión de H. pylori, especialmente en contextos urbanos, factores asociados a seroprevalencia de H. pylori en población mexicana13. (Tabla 2)
- 3.
En la actualidad, se estima que alrededor de dos terceras partes (70.5%) de la población mexicana tiene infección por H. pylori.
Factores socioeconómicos y condiciones sanitarias que influyen en la prevalencia de infección por H. pylori
| Categoría | Subgrupo | % Seropositivos | RM ajustado(IC 95%) |
|---|---|---|---|
| Sexo | Masculino | 59.8% | 1 |
| Femenino | 62.7% | 1.12 (1.02–1.23) | |
| Nivel educativo | Secundaria | 70.2% | 1.45 (1.20–1.78) |
| Primaria | 79.5% | 1.97 (1.60–2.43) | |
| Sin estudios | 83.7% | 2.42 (1.71–3.44) | |
| Hacinamiento (pers. / cuarto) | <1.6 | 58.8% | 1 |
| 1.6–3.5 | 61.7% | 1.28 (1.12–1.46) | |
| ≥ 3.6 | 62.4% | 1.40 (1.23–1.60) | |
| Índice de Desarrollo Socioeconómico | Alto | 55.3% | 1 |
| Medio | 60.8% | 1.21 (1.02–1.43) | |
| Bajo | 65.2% | 1.43 (1.22–1.68) | |
| Muy bajo | 66.3% | 1.45 (1.20–1.76) |
Adaptado de: Torres J, Leal-Herrera Y, Perez-Perez G, et al. A community-based seroepidemiologic study of Helicobacter pylori infection in Mexico. J Infect Dis. 1998;178:1089–1094.
Totalmente de acuerdo 100%
Calidad de la evidencia: A
De acuerdo con el estudio epidemiológico más grande realizado en México durante la década de los años 80, la prevalencia de infección por H. pylori en la población general era del 66%, con un patrón claramente relacionado con la edad: en adultos de 25 años o más, la prevalencia alcanzaba hasta el 80%14. Con base a este estudio, el mismo grupo de trabajo realizó un modelo catalítico exponencial modificado utilizando modelos jerárquicos para calcular la probabilidad de infección en los siguientes años15. A partir de estos análisis, se estimó que el 85.9% de la población mexicana era susceptible a la infección por H. pylori (IC 95% 84.3–87.5), lo que reflejaba una alta proporción de individuos en riesgo de adquirir la infección durante su vida.
Sin embargo, en el periodo de 2010 y 2022 la prevalencia estimada en adultos mexicanos fue de 70.5% (IC 95% 56.3–81.6) en población pediátrica (niños y adolescentes) la prevalencia alcanza el 48.5% (IC 95% 28.4–69.1)7,16–22. La aparente disminución en la prevalencia de H. pylori en México durante la última década podría estar relacionado con mejoras en las condiciones de vida. Sin embargo, también puede existir relación con la calidad y heterogeneidad de los escasos estudios epidemiológicos realizados en la última década (n=8). En general, los estudios disponibles en México utilizan metodología variable, con diferencias en el tipo de prueba diagnóstica empleada, tamaños de muestra reducidos y escasa representatividad nacional. Asimismo, no suelen contemplarse las diferencias entre poblaciones urbanas y rurales, ni la posibilidad de variabilidad regional entre estados. Esta falta de uniformidad y la ausencia de estadísticas completas dificultan establecer conclusiones sólidas sobre las tendencias actuales, lo que subraya la necesidad de investigaciones bien diseñadas que distingan entre infección activa y exposición previa, y que evalúen adecuadamente los factores sociodemográficos y geográficos asociados a la infección.
- 4.
En la última década en México se reporta que la tasa anual de recurrencia, recrudescencia y reinfección por H. pylori son 9.3%, 2.3% y 7%, respectivamente.
Totalmente de acuerdo 91.7%, parcialmente de acuerdo 8.3%
Calidad de la evidencia: B
En el contexto de la infección por H. pylori, el término recurrencia se utiliza de manera general para describir la reaparición de la bacteria después de una aparente erradicación, sin distinguir inicialmente si se trata de una recrudescencia o una reinfección, especialmente cuando no se cuenta con estudios de tipificación genética. La recrudescencia se refiere a la reaparición de la infección por la misma cepa original debido a un tratamiento fallido; suele presentarse dentro de los primeros 12 meses y está relacionada con factores como resistencia antibiótica, mal cumplimiento terapéutico o esquemas inadecuados. En contraste, la reinfección implica una nueva infección por una cepa distinta de H. pylori después de una erradicación confirmada, y suele ocurrir después del primer año, siendo más frecuente en regiones con alta prevalencia y condiciones sanitarias deficientes. Distinguir entre estos escenarios es esencial para interpretar correctamente los resultados terapéuticos, ajustar estrategias clínicas y comprender mejor la dinámica epidemiológica de la infección.
En México, existe poca evidencia al respecto en la última década, pero de acuerdo con un estudio realizado por Sánchez-Cuén et al., en 128 pacientes con diagnóstico previo de infección por H. pylori, la recurrencia anual de la infección se observó en 12 pacientes (9.3%), distribuyéndose en una tasa de reinfección del 7% (nueve pacientes) y una tasa de recrudescencia del 2.3% (tres pacientes)23. Al analizar la presencia de genes de virulencia bacteriana, se encontró que la tasa de recrudescencia fue de 3.3% (1/30) en pacientes infectados con cepas positivas al antígeno asociado a citotoxina A (CagA) y de 1.8% (2/112) en aquellos con cepas positivas al antígeno vacuolizante A (VacA). En cuanto a la reinfección, las tasas fueron de 10% (3/30) y 5.3% (6/112) para CagA y VacA, respectivamente. Estos resultados sugieren que tanto la recurrencia como sus componentes —recrudescencia y reinfección— pueden estar influenciados por factores bacterianos específicos, lo que subraya la relevancia de la caracterización genotípica en el seguimiento de pacientes tratados23.
Estos resultados contrastan con un estudio realizado en el 2003 por Leal-Herrera et al.,24 que documentó una tasa de recurrencia acumulada de 22.7% en un periodo de seguimiento de 24 meses. El estudio incluyó a 141 pacientes mexicanos con síntomas del tracto gastrointestinal superior atendidos en un hospital de referencia en la Ciudad de México (40 niños y 101 adultos), todos con erradicación documentada por prueba de aliento tras recibir triple terapia estándar. En este último estudio, se observó que una proporción significativa de los casos (28.1%) correspondía a reinfecciones transitorias que se resolvieron espontáneamente, lo que sugiere una alta exposición ambiental inmediata posterior al tratamiento. Además, en los casos en los que se realizó genotipificación de las cepas antes y después de la recurrencia, se identificó que el 75% correspondía a verdaderas reinfecciones y solo el 25% a recrudescencias, lo que refuerza la noción de que, en ciertas poblaciones, particularmente en adultos, la reinfección es un fenómeno frecuente y complejo, frecuentemente asociado a múltiples cepas. Estas diferencias pueden deberse a múltiples factores, incluyendo la metodología diagnóstica, la duración del seguimiento, las condiciones epidemiológicas y socioambientales de cada cohorte, así como las variaciones genéticas de las cepas circulantes.
- 5.
Con base en la evidencia disponible en nuestro país durante la última década, se ha observado un incremento en la resistencia antimicrobiana de las cepas de H. pylori.
Totalmente de acuerdo 83.3%, parcialmente de acuerdo 16.7%
Calidad de la evidencia: A
La resistencia antibiótica de H. pylori representa uno de los principales desafíos en la actualidad para lograr un tratamiento efectivo. La eficacia de los esquemas de erradicación depende en gran medida de la susceptibilidad bacteriana a los antimicrobianos utilizados. La creciente resistencia a antibióticos clave —como claritromicina, metronidazol y fluoroquinolonas— ha reducido significativamente las tasas de éxito de la triple terapia estándar. Este fenómeno, impulsado por el uso indiscriminado de antibióticos y la falta de vigilancia microbiológica sistemática, subraya la necesidad de adaptar las terapias según los patrones locales de resistencia.
En un estudio global reciente (julio 2025), con representantes de 31 países de seis continentes se evaluó los aspectos clave relacionados con el manejo de la resistencia a antibióticos asociada a H. pylori. Los resultados mostraron que la resistencia a los antibióticos más utilizados en los esquemas de erradicación de H. pylori está aumentando a nivel mundial, con tasas de resistencia a claritromicina y levofloxacino superiores al 15% en 24 y 18 de los 31 países, respectivamente. La amoxicilina se mantiene como excepción, con tasas de resistencia menores al 2% en 14 países, aunque en algunos países africanos se han reportado tasas superiores al 90%25.
En México, la resistencia antibiótica muestra variabilidad entre estudios, lo cual puede atribuirse a diferencias metodológicas, geográficas y temporales. La resistencia a metronidazol se ha reportado como elevada, con cifras que alcanzan hasta 76% en estudios locales más antiguos26, mientras que en un estudio multicéntrico reciente esta cifra disminuye a 18%3. Para claritromicina, antibiótico clave en las terapias triples, la resistencia alcanza hasta el 24%, este último valor ubicado por arriba del umbral establecido por las guías internacionales para restringir su uso empírico27. La resistencia a amoxicilina, aunque tradicionalmente considerada baja, se ha reportado entre 1.8% y 10.5%, mientras que las fluoroquinolonas muestran una tasa de resistencia alta (60.5%) que limita su utilidad en esquemas de rescate (tabla 3)26,27. La resistencia a rifabutina ha sido menos frecuente, oscilando entre 2% y 6%. La resistencia a más de un antibiótico se reporta entre 29.6-56.3% de los aislamientos y entre 2.6-13.2% son resistentes a tres o más antibióticos, lo que resalta la presencia creciente de cepas multirresistentes y la necesidad de guiar el tratamiento con base en estudios locales de sensibilidad26,27.
Tasas de resistencia antimicrobiana
| Autor | Año | Claritromicina(%) | Metronidazol (%) | Amoxicilina (%) | Tetraciclinas(%) | Fluoroquinolonas(%) | Rifabutina(%) |
|---|---|---|---|---|---|---|---|
| Torres J et al.14 | 1998 | 24.0 | 76.0 | 18.5 | 0 | No evaluada | No evaluada |
| Camorlinga-Ponce M et al.27 | 2021 | 5.9 | 58.6 | 1.8 | No evaluada | 18.5 | No evaluada |
| Tabesh A et al.13 | 2024 | 26 | 14 | 9 | 0 | 35 | No evaluada |
| Latorre G et al.28 | 2025 | 15.8 | 18.4 | 10.5 | No evaluada | 60.5 | 2.6 |
Así pues, los esquemas basados en claritromicina o fluoroquinolonas no son ideales como tratamiento de primera línea en México. Aunque el metronidazol también muestra una alta resistencia «in vitro», su efectividad clínica persiste cuando se utiliza en terapias cuádruples, particularmente en esquemas concomitantes o aquellos que incluyen bismuto.
- 6.
En México, la prevalencia de cepas de H. pylori positivas para el gen CagA varía entre el 40% y el 80%.
Totalmente de acuerdo 100%
Calidad de la evidencia: A
H. pylori posee diversos factores de virulencia que determinan su capacidad de colonizar la mucosa gástrica, evadir la respuesta inmune del huésped y generar daño tisular. Entre ellos, CagA destaca por su fuerte asociación con inflamación gástrica intensa, úlcera péptica y adenocarcinoma gástrico. Otros factores como VacA, proteína asociada a biofilm A (BapA), proteína de inducción de interleucina-8 (OipA) y el gen inducible por contacto epitelial A (IceA) también desempeñan un papel importante en la patogénesis, al facilitar la adhesión bacteriana, inducir daño celular y modular la respuesta inflamatoria29.
Al igual que en otras poblaciones latinoamericanas, en México se ha reportado una alta prevalencia de cepas CagA positivas, lo cual podría estar relacionado tanto con la evolución genética de las cepas circulantes como con factores ambientales y epidemiológicos locales. En diversos estudios realizados en México, se ha observado que las cepas de H. pylori portadoras del gen CagA, particularmente aquellas con el genotipo combinado VacA s1m1/CagA, son las más frecuentes (44.8%-81.3%) en muestras de biopsias tanto del antro como del cuerpo gástrico. Un estudio reciente confirmó esta tendencia, con una prevalencia de este genotipo del 70.7% en casos de gastritis crónica, 57.9% en úlcera gástrica y hasta 81.3% en pacientes con cáncer gástrico30–34. De manera similar, investigaciones previas en el sur de México han reportado frecuencias de CagA de 71.1% y 69.7%31,32. Estos hallazgos indican que el gen CagA predomina claramente en la población mexicana, y su alta prevalencia podría estar relacionada con la mayor severidad de las manifestaciones clínicas observadas en esta región.
Indicaciones- 7.
La erradicación de H. pylori está indicada en pacientes con úlcera péptica activa o previa, ya que reduce significativamente la recurrencia de la úlcera y las complicaciones asociadas.
Totalmente de acuerdo 100%
Calidad de la evidencia: A; Fuerza de la recomendación: Fuerte a favor
Un análisis donde se incluyeron 55 ensayos clínicos reportó que, en la cicatrización de la úlcera duodenal, la terapia de erradicación fue superior al fármaco cicatrizante de úlceras (FCU) (34 estudios, 3,910 pacientes, riesgo relativo (RR) de persistencia de la úlcera=0.66; IC 95% 0.58-0.76) y a la ausencia de tratamiento (dos estudios, 207 pacientes, RR 0.37; IC 95% 0.26-0.53). En la cicatrización de la úlcera gástrica, no se detectaron diferencias significativas entre la terapia de erradicación y el FCU (15 ensayos, 1,974 pacientes, RR 1.23; IC 95% 0.90-1.68). En la prevención de la recurrencia de la úlcera duodenal, no se observaron diferencias significativas entre la terapia de erradicación y la terapia de mantenimiento con FCU (cuatro ensayos, 319 pacientes, RR 0.73; IC 95% 0.42-1.25), pero la terapia de erradicación fue superior a la ausencia de tratamiento (27 ensayos, 2,509 pacientes, RR 0.20; IC 95% 0.15-0.26). En la prevención de la recurrencia de la úlcera gástrica, la terapia de erradicación fue superior a la ausencia de tratamiento (12 ensayos, 1,476 pacientes, RR 0.31; IC 95% 0.22-0.45)35.
Otro metaanálisis que incluyó a 401 pacientes demostró que la erradicación de H. pylori redujo significativamente la incidencia de recurrencia de úlceras de origen péptico a las 8 semanas (RR 2.97; IC 95% 1.06-8.29) y al año (RR 1.49; IC 95% 1.10-2.03) después de la intervención quirúrgica36. Un estudio que incluyó a 66 pacientes con hemorragia por úlcera péptica positiva para H. pylori mostró que la erradicación de H. pylori se asoció con una reducción significativa en la recurrencia de úlceras (2.4% vs. 62.5%; RR 0.04; IC 95% 0.01–0.17) y en la recaída de hemorragia (0% vs. 37.5%; RR 0.06; IC 95% 0.01–0.45)37. En un ensayo aleatorizado que incluyó a 99 pacientes con infección por H. pylori, aquellos que recibieron tratamiento de erradicación específico presentaron una tasa significativamente menor de recurrencia ulcerosa al año, en comparación con los que recibieron únicamente omeprazol (4.8% vs. 38.1%)38.
- 8.
La erradicación de H. pylori está indicada en pacientes con linfoma gástrico de tejido linfoide asociado a mucosas de bajo grado.
Totalmente de acuerdo 100%
Calidad de la evidencia: A; Fuerza de la recomendación: Fuerte a favor
Un ensayo multicéntrico que incluyó a 84 pacientes con linfoma gástrico de tejido linfoide asociado a mucosas (MALT) de bajo grado en estadio IE informó remisión completa en el 81% de los pacientes tras la erradicación de H. pylori39. Una revisión sistemática de 32 estudios que incluyó a 1,408 pacientes encontró una tasa de remisión del 77.5%, con tasas más altas en el linfoma en estadio I en comparación con el estadio II(1) (78.4% vs. 55.6%) y en poblaciones asiáticas en comparación con las occidentales (84.1% frente a 73.8%)40. Otro análisis de datos combinados de 34 estudios con 1,271 pacientes informó una tasa de remisión global del 77.8% tras la erradicación exitosa de H. pylori41. En años recientes, otro estudio retrospectivo con 63 pacientes con linfoma gástrico MALT de bajo grado reportó remisión completa del linfoma en el 81% de los pacientes en 18 meses42. Finalmente, un metaanálisis sobre la eficacia de la erradicación de H. pylori como tratamiento inicial único en pacientes con linfoma gástrico MALT en estadio temprano mostró que la tasa de remisión completa histológica después de la erradicación fue del 75.18% (IC 95% 70.45%-79.91%). Esta evidencia respalda la recomendación actual de erradicar H. pylori como primera línea de tratamiento en pacientes con linfoma MALT en estadios IE y IIE1, dado su potencial para inducir regresión tumoral sin necesidad de terapias oncológicas adicionales en la mayoría de los casos43.
- 9.
En pacientes con síntomas sugestivos de dispepsia (sin datos de alarma) y prueba positiva para H. pylori, se recomienda llevar a cabo el tratamiento de erradicación, ya que puede mejorar los síntomas dispépticos.
Totalmente de acuerdo 79.2%, parcialmente de acuerdo 16.7%, incierto 4.2%
Calidad de la evidencia: A; Fuerza de la recomendación: Fuerte a favor
Un metaanálisis de 14 ensayos clínicos aleatorizados (ECA) demostró que la erradicación de H. pylori mejoró significativamente los síntomas dispépticos en comparación con el grupo de control. La razón de momios (RM) para la mejoría de los síntomas fue de 1.38 (IC 95% 1.18-1.62) con una baja heterogeneidad (I2=51.8%)44. Otro metaanálisis que incluyó 25 ECA con 5,555 pacientes encontró que la terapia de erradicación de H. pylori resultó en un RR combinado de 1.23 (IC 95% 1.12–1.36) para la mejoría de los síntomas. El seguimiento a largo plazo (≥ 1 año) mostró un beneficio significativo (RR 1.24; IC 95% 1.12–1.37)45. Un ensayo aleatorizado, doble ciego y controlado con placebo realizado en 158 pacientes con dispepsia funcional e infección por H. pylori, mostró que la erradicación condujo a una mejoría significativa de los síntomas de dispepsia (41.77%; IC 95% 30.77–53.41) frente a grupo placebo (18.99%; IC 95% 11.03–29.38)46.
Por otra parte, el estudio HEROES, un estudio doble ciego, aleatorizado placebo controlado, que incluyó a 404 pacientes con dispepsia funcional (Roma III), encontró que el 49% de los pacientes del grupo de erradicación lograron al menos un 50% de mejoría sintomática a los 12 meses en comparación con el 36.5% del grupo control (p=0.01) y el número necesario a tratar (NNT) fue de 847. Otro ECA con un grupo de pacientes (n=213) similar, mostró que solo 91 pacientes completaron el seguimiento de un año. Al comparar la tasa de respuesta de la dispepsia al año entre el grupo no erradicado (n=24) y el grupo erradicado (n=67), cada grupo mostró los siguientes resultados: respuesta completa en 62.5% (no erradicado) vs. 62.7% (erradicado), respuesta satisfactoria (≥ 50%): 0% vs. 19.4%, respuesta parcial (< 50%): 1.25% vs. 11.9% y respuesta refractaria: 25.0% vs. 6.0%. El análisis multivariado mostró que la erradicación de H. pylori (RM 5.81; IC 95% 1.07-31.59) y la mejoría de los síntomas a los tres meses (RM 28.90; IC 95% 5.29–157.82) se asociaron con la mejoría de la dispepsia al año48.
En resumen, la erradicación de H. pylori en pacientes con síntomas dispépticos y pruebas positivas (no serológicas), sin síntomas de alarma, está respaldada por evidencia que indica mejoras significativas en los síntomas. Sin embargo, no existen estudios mexicanos al respecto y considerando el elevado NNT se recomienda realizar estudios al respecto.
- 10.
En pacientes que requieren uso crónico de antiinflamatorios no esteroideos (AINE) o ácido acetilsalicílico (AAS) y están infectados con H. pylori, se recomienda el tratamiento de erradicación para reducir el riesgo de enfermedad ácidopéptica y sus complicaciones.
Totalmente de acuerdo 95.8%, parcialmente de acuerdo 4.2%
Calidad de la evidencia: A; Fuerza de la recomendación: Fuerte a favor
La infección por H. pylori y el uso de AINE aumentan significativamente el riesgo de enfermedad ácido-péptica, incrementando el riesgo 61.1 veces más que en pacientes sin infección por H. pylori y sin consumo de AINE49. Estudios poblacionales han documentado que el uso crónico de AINE en pacientes con infección por H. pylori incrementa el riesgo de desarrollar enfermedad ácido-péptica, con una RM de 2.73. Asimismo, la erradicación de H. pylori disminuye el riesgo de recurrencia de esta enfermedad en usuarios crónicos de AINE, mientras que la falta de erradicación aumenta dicho riesgo (RM 1.24)50.
Estudios de casos y controles han identificado como factores principales para desarrollar lesiones en la mucosa gástrica: edad> 75 años (RM 2.4, IC 95% 1.3-4.2), infección por H. pylori (RM 2.0, IC 95% 1.2-3.5). El uso de antisecretores resulta protector (RM 0.48, IC 95% 0.28-0.99)51.
Se ha documentado que la infección por H. pylori causa un aumento de neutrófilos en la mucosa gástrica. En pacientes infectados por H. pylori que también consumen AINE, se ha observado una mayor incidencia de ulceraciones en comparación con aquellos que tienen la infección por H. pylori, pero no muestran infiltración de neutrófilos en la mucosa gástrica, esta neutrofilia gástrica parece ser un factor importante52. La infiltración de neutrófilos es uno de los factores asociados con la enfermedad ácido-péptica en pacientes que consumen AINE y tienen infección por H. pylori. Otros factores descritos incluyen la exposición previa a AINE, antecedentes de úlcera péptica y ausencia de terapia antisecretora53.
Además se ha demostrado que la erradicación antes del inicio del tratamiento con AINE reduce significativamente el riesgo de complicaciones. En un ECA, se observó que solo el 3% de los pacientes que habían erradicado H. pylori presentaron complicaciones pépticas relacionadas con AINE, en comparación con el 26% de los pacientes que no habían mostrado erradicación54. Un estudio mostró que en pacientes que usan AINE por largo tiempo, erradicar H. pylori reduce el riesgo de úlceras a los seis meses del 34.4% al 12.1%55. Sin embargo, cabe señalar que otros estudios han demostrado que, en pacientes con uso crónico de AINE, la erradicación no mostró una disminución de úlceras sangrantes a los seis meses56. Además de la infección por H. pylori, otros factores como la edad y el antecedente de úlcera son relevantes. Dada la asociación entre H. pylori y lesiones por AINE, recomendamos tratamiento de erradicación en pacientes que usan crónicamente estos fármacos para reducir el riesgo de complicaciones.
- 11.
En pacientes con anemia ferropénica de causa no aclarada e infección por H. pylori está indicado dar tratamiento de erradicación, ya que puede mejorar los niveles de hemoglobina y ferritina.
Totalmente de acuerdo 83.3%, parcialmente de acuerdo 12.5%, incierto 4.2%
Calidad de la evidencia: B; Fuerza de la recomendación: Fuerte a favor
La erradicación de H. pylori en pacientes con deficiencia de hierro puede optimizar ciertos parámetros relacionados con la cinética del hierro; sin embargo, los efectos sobre los depósitos de hierro pueden mostrar variabilidad. La disminución de los niveles de hierro en pacientes con infección por H. pylori puede estar asociada a la gastritis crónica y la aclorhidria inducidas por la infección prolongada. Esta aclorhidria puede interferir con la absorción del hierro presente en los alimentos, contribuyendo a la deficiencia observada en estos pacientes57. Estudios indican que los pacientes con infección por H. pylori no responden a la suplementación oral de hierro, respaldando la hipótesis de mala absorción58. Los pacientes con gastritis crónica por H. pylori pueden tener elevados niveles de lactoferrina gástrica, que captura el hierro de la transferrina. También se ha observado una elevación de la hepcidina, relacionada con anemia en modelos animales y humanos59.
En estudios epidemiológicos que miden anticuerpos contra H. pylori, se ha observado que la seropositividad se asocia con niveles reducidos de ferritina (< 30μg/L) (RM 1.4; IC 95% 1.1–1.8)60. La infección activa se ha vinculado a anemia por deficiencia de hierro en niños61. Finalmente, estudios muestran que erradicar H. pylori en pacientes con deficiencia de hierro, sin suplementación, aumenta el hierro, la saturación de transferrina y la hemoglobina a los seis meses de la erradicación. No se observó aumento de ferritina62. Existe una plausibilidad biológica entre la infección y la deficiencia de hierro, respaldada por estudios que han demostrado esta asociación. La erradicación de la infección puede mejorar los niveles de hierro, por lo que recomendamos proceder con la erradicación.
- 12.
En pacientes diagnosticados con púrpura trombocitopénica idiopática y con infección confirmada por H. pylori, se recomienda la terapia de erradicación como parte del manejo terapéutico, ya que puede contribuir significativamente al aumento del recuento plaquetario y mejorar los desenlaces clínicos.
Totalmente de acuerdo 100%
Calidad de la evidencia: B; Fuerza de la recomendación: Fuerte a favor
En pacientes que presentan purpura trombocitopénica idiopática la erradicación de H. pylori puede incrementar el conteo plaquetario en un porcentaje significativo de pacientes. Desde un punto de vista fisiopatológico, el incremento en el recuento plaquetario puede explicarse por una mayor capacidad patológica de los monocitos en pacientes infectados por H. pylori, debido a una disminución del inhibidor Fcgamma receptor IIB (FcgammaRIIB). Al erradicar H. pylori en estos pacientes, la capacidad patológica de los monocitos se normaliza, mejorando la autoinmunidad contra las plaquetas. Este fenómeno ha sido observado tanto en estudios con modelos animales como humanos63.
La erradicación de H. pylori mejora el conteo plaquetario en 44.7% de los pacientes, con un incremento de plaquetas de 57.3±28.1×109/L a 104.6±37.4 ×109/L. No se observó mejoría en los pacientes en quienes no se logró la erradicación64. El aumento del conteo plaquetario ha demostrado ser beneficioso en estudios de seguimiento, con la mitad de los pacientes respondiendo a corto plazo y la otra mitad hasta por siete años65. La respuesta puede variar según la región geográfica. En algunos estudios, se ha documentado una menor tasa de respuesta en el conteo plaquetario en pacientes con erradicación exitosa de H. pylori, principalmente en áreas con baja prevalencia66. La menor tasa de respuesta en pediatría sugiere diferencias en la fisiopatología respecto a la población adulta67.
La erradicación de H. pylori en pacientes con púrpura cuya infección haya sido confirmada es generalmente recomendada, debido a su potencial para mejorar significativamente los recuentos de plaquetas en una proporción sustancial de estos pacientes. No obstante, la respuesta puede variar según los factores individuales y regionales, y no todos los pacientes pueden beneficiarse de igual manera.
- 13.
En individuos con familiares de primer grado con cáncer gástrico y con infección confirmada por H. pylori, se recomienda la erradicación de la bacteria.
Totalmente de acuerdo 91.7%, parcialmente de acuerdo 8.3%
Calidad de la evidencia: A; Fuerza de la recomendación: Fuerte a favor
La infección crónica por H. pylori y los cambios secundarios en la mucosa gástrica, denominados cascada de Correa (gastritis crónica, atrofia, metaplasia, displasia, cáncer) son responsables del 90% de los adenocarcinomas gástricos a nivel global68. La erradicación de H. pylori ha demostrado reducir el riesgo de cáncer gástrico en familiares de primer grado. En un metaanálisis reciente, se observó una reducción del 34% en la incidencia de este cáncer (RR 0.66; IC 95% 0.49–0.89) tras la erradicación, con mayor beneficio observado en poblaciones asiáticas y en individuos sin lesiones preneoplásicas69.
Además se ha demostrado una disminución de 20 a 70% en la frecuencia de aparición de tumores metacrónicos en individuos con resección gástrica previa con la erradicación del H. pylori70. Alrededor de 10% de casos de cáncer gástrico presentan agregación familiar con múltiples factores que contribuyen a un incremento de dos a 10 veces el riesgo de desarrollar cáncer gástrico en familiares de primer grado del individuo afectado y que parecen actuar de forma sinérgica; entre los que se encuentran predisposición genética, la infección por H. pylori y sus cepas, así como factores ambientales compartidos tales como la dieta; por lo que la erradicación de la infección por H. pylori se considera esencial como prevención primaria en este grupo de alto riesgo y el mayor beneficio se obtiene en ausencia de lesiones premalignas por lo que la intervención temprana es muy importante71–73.
Si bien algunas guías asiáticas (población que cuenta con alta prevalencia de cáncer gástrico) sugieren el inicio en la detección y tratamiento del H. pylori en este contexto entre los 20 y 40 años, es debido a que la erradicación ha demostrado ser más efectiva como prevención en ausencia de lesiones premalignas (atrofia y/o metaplasia)74, por el contrario, una guía de práctica clínica occidental (región de riesgo bajo a intermedio) reciente sobre el escrutinio y vigilancia de estos individuos con alto riesgo de cáncer gástrico propone que el inicio de escrutinio pudiera realizarse: a partir de los 45 años, antes en caso de múltiples factores de riesgo presentes, o individualizarse a 10 años antes de la edad al diagnóstico del caso índice, e incluso se ha planteado el escrutinio combinado con colonoscopia para detección de cáncer de colon con el fin de optimizar recursos (colonoscopia/endoscopia alta en un mismo procedimiento)75,76.
En población con riesgo bajo a promedio (como México), pueden realizarse pruebas no invasivas para detección de H. pylori, y en caso de ser positivas realizar endoscopia, pero este grupo de pacientes, al ser considerado de alto riesgo, se recomienda la realización de una endoscopia de alta calidad y plantear un programa de vigilancia, ya que las lesiones malignas y/o premalignas no pueden ser identificadas con pruebas no invasivas para H. pylori73.
Un ensayo prospectivo doble ciego coreano documentó que el tratamiento para la infección por H. pylori disminuyó en 55% la incidencia de cáncer gástrico en 832 individuos coreanos familiares de primer grado de pacientes con cáncer gástrico versus 844 no tratados, y cuando se analizaron por confirmación de erradicación la disminución en el riesgo fue de 73%, para un seguimiento a 9.2 años (incidencia de 0.8% vs 2.9%)72.
- 14.
La erradicación de H. pylori está indicada en pacientes con gastritis atrófica o metaplasia intestinal, ya que puede detener o retrasar la progresión a displasia o cáncer gástrico.
Totalmente de acuerdo 95.8%, parcialmente de acuerdo 4.2%
Calidad de la evidencia: A; Fuerza de la recomendación: Fuerte a favor
La principal estrategia de prevención primaria del cáncer gástrico es la erradicación de H. pylori, y el mayor beneficio se obtiene cuando aún no se han desarrollado condiciones premalignas70; sin embargo, la erradicación de la bacteria en presencia de estas lesiones premalignas (atrofia/metaplasia) es de gran utilidad y parte de las recomendaciones de tratamiento, además de la vigilancia endoscópica, ya que puede retrasar o prevenir la progresión de estas lesiones76,77.
Familiares de primer grado de pacientes con cáncer gástrico y pacientes con síndromes hereditarios específicos, deben ser considerados para escrutinio de lesiones premalignas mediante endoscopia de alta calidad76. La evaluación endoscópica en búsqueda de lesiones premalignas debe realizarse con alta definición y magnificación, así como toma de biopsias sistemáticamente (protocolo de Sydney actualizado): cinco biopsias,dos de antro, dos de cuerpo y una de incisura, en contenedores diferenciados y foto documentación de al menos seis sitios78.
Es importante en el reporte histopatológico: presencia de atrofia gástrica y/o metaplasia intestinal y extensión de esta, gravedad, subtipo de la metaplasia (completa/incompleta) y presencia o ausencia de H. pylori; estos factores están claramente asociados a progresión y/o regresión de estas condiciones premalignas. El puntaje Operative link for gastritis assessment and Gastric intestinal metaplasia (OLGA/OLGIM) es de utilidad para este fin y los estadios avanzados (III/IV) están fuertemente asociados a progresión a cáncer gástrico79,80.
La erradicación del H. pylori en presencia de atrofia gástrica/metaplasia intestinal leve y limitada puede detener o inducir regresión histológica de estas condiciones premalignas como fue demostrado en una reciente revisión sistemática y metaanálisis, la experiencia de 20 años de una cohorte colombiana y un estudio mexicano realizado en Chiapas en 248 individuos81–83. El manejo de estas condiciones incluye la erradicación del H. pylori y vigilancia endoscópica con toma de biopsias. El intervalo de vigilancia se sugiere sea cada tres años en los siguientes casos76: metaplasia intestinal extensa y/o incompleta, displasia, historia familiar de cáncer gástrico en familiar de primer grado, y la demografía (procedencia de regiones de alta incidencia), así como individuos con OLGA/OLGIM III/IV; este último incrementa 20 veces el riesgo de progresión a cáncer gástrico y es el menos susceptible a regresión con la erradicación del H. pylori82,84.
- 15.
En pacientes que requieren uso prolongado de IBP y están infectados con H. pylori, se recomienda la terapia de erradicación.
Totalmente de acuerdo 100%
Calidad de la evidencia: B; Fuerza de la recomendación: Débil a favor
Es importante recordar que son pocas las indicaciones para uso crónico de IBP, como la gastroprofilaxis en el caso de alta probabilidad de recurrencia de úlceras gastroduodenales con factores de riesgo. De tal manera que antes de considerar la erradicación en este contexto es relevante revisar la necesidad o no de uso crónico de IBP. Para aquellos pacientes que sí tienen indicación de uso crónico de IBP, la justificación de erradicar.H. pylori se basa en evidencia experimental y estudios de cohorte en humanos han demostrado que el uso crónico de IBP induce cambios inflamatorios en la mucosa oxíntica que eventualmente producen atrofia, metaplasia intestinal y displasia85–87. La gastritis crónica metaplásica que predomina en el cuerpo gástrico se considera un factor de riesgo para el desarrollo de adenocarcinoma gástrico no cardial y existe evidencia de que, de las alteraciones inflamatorias preexistentes en el cuerpo gástrico, progresan de manera más rápida en los sujetos infectados con H. pylori que reciben terapia prolongada con IBP88,89.
Otros factores, como la colonización del estómago por organismos distintos al H. pylori o la alteración de ácidos biliares ocasionados por un pH más alcalino, también inducen cambios inflamatorios que contribuyen a incrementar los procesos de remodelación de la mucosa gástrica. Sin embargo, a pesar de la evidencia que sobre el efecto sinérgico en la secreción de ácido gástrico ejercen los IBP y la infección por H. pylori, la relación causal entre estos y el desarrollo de cáncer es aún controvertida90. En todo caso, estos mecanismos fisiopatogénicos deben mitigarse en los enfermos que requieren IBP por tiempo prolongado y es un argumento más para utilizar los IBP de manera juiciosa apegado a las guías de práctica clínica91.
Un aspecto por considerar es que el riesgo para desarrollar cáncer gástrico persiste en algunos enfermos con gastritis crónica metaplásica a pesar de haber recibido tratamiento de erradicación para H. pylori resaltando la necesidad de establecer una estrategia de seguimiento en estos casos76.
- 16.
La erradicación de H. pylori está indicada en pacientes que han sido sometidos a resección quirúrgica o endoscópica de cáncer gástrico, ya que reduce significativamente el riesgo de recurrencia del cáncer y puede mejorar el pronóstico a largo plazo.
Totalmente de acuerdo 100%
Calidad de la evidencia: A; Fuerza de la recomendación: Fuerte a favor
En el momento actual, el único tratamiento curativo para el adenocarcinoma gástrico es la resección quirúrgica o endoscópica de lesiones neoplásicas incipientes. En este grupo de enfermos, las condiciones preneoplásicas, esto es, atrofia, metaplasia y displasia persisten, por lo tanto, la posibilidad de lesiones metacrónicas es más elevada y son tributarios a recibir tratamiento de erradicación aún sin conocer si existe o no infección activa por H. pylori. Esta estrategia de tratamiento es avalada por estudios controlados realizados en varios países orientales92,93.
Una revisión sistemática con metaanálisis que incluyó a 6,967 pacientes demostró una reducción significativa en la mortalidad por cáncer gástrico en aquellos que recibieron tratamiento de erradicación exitoso para H. pylori (RM 0.47; IC 95% 0.33–0.67). Se demostró, además, mejoría de la gastritis atrófica y metaplasia intestinal94. Es importante recordar que en estos casos sigue siendo necesario establecer un programa de seguimiento al largo plazo a pesar de haber logrado la erradicación del H. pylori76.
- 17.
En pacientes que toman Warfarina o AAD (anticoagulantes orales de acción directa) con infección concomitante por H. pylori se recomienda tratamiento de erradicación.
Totalmente de acuerdo 100%
Calidad de la evidencia: C; Fuerza de la recomendación: Débil a favor
El uso de anticoagulantes inhibidores de vitamina K (Warfarina) o de acción directa como dabigatrán (inhibidor de factor II activado o trombina), o rivaroxabán y apixabán (inhibidores factor X activado) incrementan el riesgo de sangrado gastrointestinal no variceal95. Se han identificado factores de riesgo para sangrado gastrointestinal en usuarios de warfarina, como edad> 65, INR> 2.1, cirrosis hepática e historia de hemorragia previa96. En pacientes con fibrilación auricular (FA), la incidencia de hemorragia con warfarina es 2.87 por 100 pacientes/año (IC 95% 2.41-3.41), dabigatrán 2,29 (IC 95% 1.88-2.79), y rivaroxabán 2.84 (IC 95% 2.30-3.52). En pacientes sin FA es 3.71 (IC 95% 2.16-6.40), 4.10 (IC 95% 2.47-6.80) y 1.66 (IC 95% 1.23-2.24) respectivamente, siendo mayor en adultos mayores a 76 años97. El riesgo aumenta si el paciente toma además AINE, AAS o antiagregantes plaquetarios, y es menor si el paciente usa IBP98,99.
La evidencia de asociación entre hemorragia gastrointestinal en pacientes con infección por H. pylori que usan anticoagulantes es menor. Algunos estudios de cohorte no han demostrado riesgo aumentado100, mientras que algunos expertos consideran es un factor de riesgo101. Al ser H. pylori uno de los dos principales factores de riesgo para desarrollo de úlcera péptica, con un riesgo de por vida de úlcera duodenal de 18.4 y de 2.9 para úlcera gástrica en cepas productoras de CagA, se considera que se debe buscar y erradicar si el paciente va a tener cualquier factor de riesgo que incremente el riesgo de sangrado gastrointestinal68,102.
- 18.
En el paciente que presenta úlcera péptica con sangrado activo debe de buscarse infección por H. pylori.
Totalmente de acuerdo 95.8%, parcialmente de acuerdo 4.2%
Calidad de la evidencia: A; Fuerza de la recomendación: Fuerte a favor
Los pacientes con úlcera péptica, independientemente de la causa, tienen riesgo aumentado de hemorragia103. H. pylori tiene una prevalencia de 20-50% en pacientes con sangrado asociado a úlcera péptica, y dos estudios han identificado en su análisis multivariado a la infección por H. pylori como un factor de riesgo independiente para sangrado recurrente por úlcera péptica, con un efecto aditivo en caso de uso de AAS o AINE104,105.
Además del tratamiento estándar para control de sangrado y curación mediante bloqueo ácido con IBP o PCAB, y/o tratamiento endoscópico, las medidas de prevención secundaria incluyen suspender o minimizar cualquier riesgo adicional, que incluye retiro temporal de AINE, AAS y anticoagulantes, o en caso de no poder suspenderlos, uso indefinido de antisecretores gástricos, y búsqueda y erradicación de H. pylori. La tasa de recurrencia de resangrado en úlceras asociadas a H. pylori sin otros factores de riesgo es 11.2-26%103,106. Varios estudios han reportado disminución en tasas de recurrencia y sangrado tras la terapia de erradicación, así como superioridad sobre tratamiento antisecretor solo107,108.
El momento más apropiado para dar el tratamiento de erradicación es aún motivo de controversia, pero se considera puede darse tan pronto se reestablezca la vía oral posterior al sangrado109. Un trabajo comparó las tasas de recurrencia y sangrado y reportaron que retrasar> 120 días la erradicación se asociaba a un riesgo mayor (RR 1.52) de úlceras complicadas110. Los factores asociados a recurrencia de ulceración y sangrado tras la terapia de erradicación son el tamaño y número de las úlceras, y la función de coagulación111.
- 19.
Ante el deseo del paciente para detección y tratamiento de la infección por H. pylori, lo apropiado es evaluar los beneficios y riesgos de manera personalizada, como establece el Código Latinoamericano y Caribeño contra el Cáncer.
Totalmente de acuerdo 95.8%, parcialmente de acuerdo 4.2%
Calidad de la evidencia: C; Fuerza de la recomendación: Débil a favor
Es un derecho de los pacientes pedir la búsqueda y el tratamiento de H. pylori, debido a la asociación con cáncer gástrico. Esto lo establece el enunciado 12 del Código Latinoamericano y Caribeño contra el Cáncer112. Este código establece acciones que las personas pueden hacer para ayudar a prevenir el cáncer y fue desarrollado por especialistas en la materia, convocados por la Agencia Internacional de Investigación sobre el Cáncer (IARC) de la OMS y por la Organización Panamericana de la Salud (OPS).
El H. pylori es un carcinógeno del grupo 1 según la IARC, es decir, que la evidencia como etiología de cáncer en humanos es más que suficiente113. Como se mencionó anteriormente, el H. pylori se asocia a linfoma MALT y adenocarcinoma gástrico, ya que produce la oncoproteína CagA la cual altera vías de señalización implicadas en el proceso de carcinogénesis114. La progresión a cáncer en individuos infectados depende de factores propios del huésped y factores ambientales como tabaquismo, consumo de alcohol, sobrepeso, historia familiar y algunas condiciones hereditarias que se deben discutir con el paciente de forma personalizada.
Asimismo, se debe explicar los diferentes métodos de tamizaje disponibles y seleccionar el que se ajuste mejor a las características del paciente y a las políticas de salud locales. La prevención primaria de cáncer gástrico consiste en la búsqueda y erradicación del H. pylori, lo cual ha demostrado una reducción en la incidencia y mortalidad por dicho cáncer115.
Recientemente, el Grupo de Trabajo de la IARC, en colaboración con la OMS, emitió una guía técnica que respalda la implementación de estrategias de tamizaje y tratamiento (screen-and-treat) para H. pylori como medida poblacional de prevención primaria del cáncer gástrico. Esta recomendación aplica a países con incidencia intermedia-alta de cáncer gástrico (≥ 10 casos por 100,000 habitantes por año), y subraya la necesidad de adaptar su implementación a las condiciones epidemiológicas y operativas locales. Si bien México no cumple con esta clasificación a nivel nacional, existen indicios de variabilidad regional que podrían justificar estrategias focalizadas. No obstante, aún no se cuenta con estudios que definan claramente las zonas del país con mayor incidencia o riesgo, lo que representa una prioridad para orientar futuras políticas de prevención basadas en riesgo.
- 20.
H. pylori no tiene efecto causal en la enfermedad por reflujo gastroesofágico (ERGE). Sin embargo, pacientes con infección por H. pylori y ERGE demostrado, requieren tratamiento de erradicación.
Totalmente de acuerdo 100%
Calidad de la evidencia: C; Fuerza de la recomendación: Débil a favor
La infección por H. pylori no se asocia con el desarrollo de esofagitis erosiva y no tiene un efecto protector contra la ERGE. A su vez, la erradicación del microorganismo tampoco impacta en la exacerbación de la ERGE116.
En un estudio con 171 pacientes, se investigó la relación entre las características histológicas y topográficas de la gastritis por H. pylori y la presencia y gravedad de esofagitis en pacientes con síntomas de reflujo. Se encontró la bacteria en el 75% de los pacientes con ERGE y en el 69% del grupo sin reflujo. No se encontró una diferencia estadísticamente significativa en los grupos entre la presencia y grado de esofagitis117.
En un análisis retrospectivo que incluyó a 340 pacientes, se comparó la longitud del esófago de Barrett según criterios de Praga y la presencia de esofagitis antes y después de la terapia de erradicación. Se identificó esofagitis erosiva en un 2% antes de la erradicación y un 6% posterior a la misma, lo cual fue un incremento significativo (p=0.007). Respecto al esófago de Barrett, se encontró en un 20% previo a la erradicación, con una longitud promedio de C0M1, y posteriormente solo se observó una elongación en el 0.6%. Concluyendo que el tratamiento de H. pylori no tiene un impacto significativo en el desarrollo o aumento del esófago de Barrett118.
En pacientes con infección por H. pylori, el uso crónico de IBP puede tener un impacto en el desarrollo de atrofia y/o metaplasia intestinal; por lo tanto, se recomienda la erradicación en pacientes con uso prolongado de antisecretores, como es el caso de los pacientes con ERGE que requieren terapia de mantenimiento. En conclusión, la presencia de ERGE no debe impactar la decisión de erradicación cuando esté indicada.
Diagnóstico- 21.
En pacientes adultos con sospecha de infección por H. pylori, la prueba del aliento con urea marcada con C13/C14 tiene mayor sensibilidad y especificidad en comparación con la detección de antígenos en heces, por lo cual se considera como la opción diagnóstica preferida en pacientes sin datos de alarma.
Totalmente de acuerdo 100%
Calidad de la evidencia: B; Fuerza de la recomendación: Fuerte a favor
Las pruebas no invasivas para la detección de H. pylori incluyen la serología, la detección de antígeno en heces y la prueba de aliento con urea marcada con carbono (13C o 14C). La prueba del aliento con urea marcada con C13/C14 se considera el método de diagnóstico no invasivo de elección para H. pylori debido a que logra alcanzar sensibilidad diagnóstica del 97% y especificidad del 96%108,119. Se requieren estas características para minimizar el riesgo de los resultados falsos negativos. En contraste, la detección de antígenos en heces, aunque sigue siendo útil, puede verse afectada por diversos factores que disminuyen su efectividad, entre ellos lo más relevante es la carga bacteriana en las heces. La prueba del aliento es accesible y menos invasiva en comparación con la detección de antígenos en heces, demostrando ser una prueba útil en pacientes de bajo riesgo, sin datos de alarma. Además, no depende del estado inmunológico del paciente y es útil tanto para el diagnóstico inicial como para la confirmación de erradicación tras el tratamiento. Por ello, de estar disponible, recomendamos la prueba del aliento con C13/C14 como la primera opción diagnóstica de la infección por H. pylori en pacientes adultos sin datos de alarma120–122.
- 22.
Las pruebas serológicas son útiles en estudios epidemiológicos. No se recomienda para diagnosticar infección o corroborar erradicación de H. pylori.
Totalmente de acuerdo 87.5%, parcialmente de acuerdo 12.5%
Calidad de la evidencia: A; Fuerza de la recomendación: Fuerte a favor
Las pruebas serológicas (determinación de anticuerpos en sangre) solo deben utilizar en el cribado (tamizaje) de la infección por H. pylori y estudios epidemiológicos, ya que su principal desventaja es que no sirven para diferenciar entre la infección actual y la exposición previa. Por otra parte, la infección por H. pylori puede ser reciente y los niveles de anticuerpos pueden no ser aún lo suficientemente altos para su detección, teniendo en cuenta que los anticuerpos IgG aparecen aproximadamente a los 21 días después de la infección por H. pylori y pueden persisten durante varios meses123,124. Sin embargo, en ciertas situaciones clínicas (hemorragia gastrointestinal activa, gastritis atrófica, MALT y cáncer gástrico) las pruebas serológicas podrían utilizarse como prueba inicial para el diagnóstico de la infección por H. pylori. En estos casos, siempre se recomienda una segunda prueba para confirmarlo, ya sea antígeno fecal o prueba de urea en aliento para H. pylori124. Es importante destacar que la serología forma parte de pruebas serológicas más amplias como el panel gástrico o GastroPanel®125. Esta herramienta diagnóstica combina la medición de anticuerpos IgG contra H. pylori con biomarcadores séricos del estado funcional gástrico, incluyendo pepsinógeno I, pepsinógeno II y gastrina-17. El GastroPanel permite evaluar la presencia de H. pylori, atrofia gástrica (antral o corporal) y riesgo de enfermedades gástricas, como gastritis crónica atrófica o cáncer gástrico. Si bien no reemplaza a la prueba de aliento como método de elección para detectar infección activa, el GastroPanel puede ser útil en contextos de evaluación funcional gástrica más amplia o en estudios poblacionales de tamizaje.
- 23.
La confirmación de la erradicación de la infección por H. pylori se deberá realizar mediante una prueba no invasiva. Se consideran válidas la prueba de aliento con urea C13/C14 o la detección de antígenos en heces, las cuales deben realizarse al menos cuatro semanas después de haber completado el tratamiento de erradicación.
Totalmente de acuerdo 100%
Calidad de la evidencia: A; Fuerza de la recomendación: Fuerte a favor
Múltiples consensos y guías recomiendan que la confirmación de la erradicación se realice al menos cuatro semanas después de terminar el esquema de tratamiento con una prueba no invasiva, siendo válidas la prueba de aliento con urea marcada con C13/C14 o la detección de antígenos en heces119,121. La prueba de aliento es de elección por su elevada sensibilidad y especificidad (95% al 98% y 90 al 98%, respectivamente) Además, tiene la ventaja de que su rendimiento no se ve afectado por el uso reciente de antibióticos9,126 Por otro lado, la detección de antígenos en heces también puede considerar como opción, aunque su sensibilidad puede verse comprometida por la baja carga bacteriana. La implementación de pruebas no invasivas para confirmar la erradicación de H. pylori es crucial para reducir la incidencia de patologías gástricas asociadas a la persistencia de la infección121,127.
- 24.
En pacientes sometidos a endoscopia y hallazgos sugerentes de infección por H. pylori se recomienda la toma de biopsias con protocolo de Sydney.
Totalmente de acuerdo 95.8%, parcialmente de acuerdo 4.2%
Calidad de la evidencia: A; Fuerza de la recomendación: Fuerte a favor
La histopatología a través del análisis de biopsias gástricas tomadas durante un procedimiento endoscópico es de utilidad tanto para determinar la presencia de H. pylori, como para detectar lesiones gástricas premalignas como atrofia gástrica, metaplasia intestinal completa o incompleta, displasia de bajo y alto grado e incluso adenocarcinoma in situ108,128,129. Se recomienda realizar la toma de biopsias siguiendo el protocolo de Sydney modificado108,123,128,130. Este es un método estandarizado que ha demostrado mayor rendimiento diagnóstico para detección de H. pylori y lesiones premalignas108,128–130. Diversos estudios han demostrado que este protocolo mejora la detección de H. pylori comparado con biopsias al azar (59.2% vs. 20.5%; OR: 5.7; IC 95%: 2.6–12.2)129 y que la falta de cumplimiento del protocolo de Sydney lleva a omisión de casi el 30% de las lesiones premalignas y del 10% en la detección de H. pylori130. Se recomienda utilizar un frasco de biopsias para las muestras de cuerpo gástrico y otro frasco para las de antro e incisura angularis con la finalidad de que el patólogo pueda estadificar la atrofia y metaplasia intestinal de cada segmento con las escalas de OLGA y OLGIM respectivamente131.
De manera alternativa, en pacientes sin metaplasia intestinal gástrica (EGGIM 0), con atrofia leve endoscópica (Kimura-Takemoto C0–C2), y cuando el procedimiento es realizado por endoscopistas entrenados, se ha sugerido que podría omitirse la toma de biopsias sistemáticas y utilizar únicamente la prueba rápida de ureasa (según disponibilidad), dado que la probabilidad de estadio OLGA 0 es elevada en este contexto. Esta estrategia aún requiere validación antes de recomendarse de forma generalizada.
- 25.
El uso de la clasificación de Kyoto basada en el patrón mucoso y vascular en la endoscopia de imagen mejorada tiene un alto valor predictivo negativo (VPN) para la infección de H. pylori.
Totalmente de acuerdo 100%
Calidad de la evidencia: B; Fuerza de la recomendación: Débil a favor
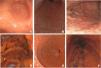
El patrón de las alteraciones mucosas mediante endoscopia de alta resolución puede orientar la sospecha diagnóstica de infección por H. pylori. La clasificación de Kyoto proporciona un alto VPN para la detección de la infección por H. pylori mediante la descripción del patrón mucoso y vascular aunado a que es un indicador predictivo del riesgo de desarrollar cáncer gástrico (En la fig. 1A-1F se muestra la clasificación endoscópica Kyoto). La atrofia gástrica, metaplasia intestinal, y el patrón de venas colectoras regulares se correlacionan con baja probabilidad de infección, con un VPN superior al 90%132,133, el uso de tecnologías de endoscopia de imagen mejorada y la complementación con inteligencia artificial ha demostrado aumentar la precisión diagnóstica al permitir una visualización más clara de estas características mucosas. La clasificación de Kyoto ofrece un enfoque integral al combinar hallazgos endoscópicos con la evaluación del riesgo de cáncer gástrico, haciendo que esta clasificación sea una herramienta esencial en la práctica clínica diaria134,135.
- 26.
Cuando los hallazgos endoscópicos son compatibles con una infección por H. pylori, la prueba de ureasa rápida se considera un método diagnóstico preciso, fácil de usar y rápido para detectar una infección activa.
Clasificación endoscópica de Kyoto: A) Mucosa de aspecto normal: presenta pliegues regulares y una apariencia sana. B) Mucosa atrófica: se observa un adelgazamiento notable de la mucosa, pérdida de glándulas gástricas y áreas de palidez, lo que sugiere un daño significativo y riesgo potencial de malignidad. C) Metaplasia: la mucosa muestra un aspecto rugoso, indicando cambios celulares que pueden ser precoces en el desarrollo de cáncer. D) Pliegues gástricos prominentes y engrosados: este hallazgo es típico de gastritis activa y puede estar asociado con H. pylori. E) Nodularidad: áreas elevadas o nodulares en la mucosa, que son indicativas de inflamación crónica y riesgo de cáncer. F) Eritema: enrojecimiento difuso de la mucosa, lo que refleja una inflamación activa y puede estar asociado con la presencia de H. pylori.
Totalmente de acuerdo 100%
Calidad de la evidencia: A; Fuerza de la recomendación: Fuerte a favor
La prueba de ureasa rápida es una prueba indirecta que evalúa la presencia de la enzima ureasa en una biopsia gástrica. Su utilidad radica en determinar una infección activa. Al entrar en contacto la muestra gástrica con la urea, la acción de la enzima hidroliza la urea y la convierte en dióxido de carbono y amoníaco, lo que produce un cambio de pH que se detecta mediante una variación de color123,136. La biopsia puede tomarse del antro, del cuerpo gástrico o de ambos sitios. La velocidad de la reacción depende de la carga bacteriana y de la temperatura; el resultado positivo puede observarse desde la primera hora y hasta 24 horas después137. La sensibilidad de la prueba varía entre el 88.5% y el 95.6%, y la especificidad oscila entre el 84.2% y el 100%123. Presenta un valor predictivo positivo (VPP) del 94%, un VPN del 100% y una precisión diagnóstica del 98%138. Los resultados falsos negativos pueden deberse al uso de antibióticos, bismuto, los IBP o a condiciones del paciente como gastritis atrófica, metaplasia intestinal o hemorragia digestiva. Los resultados falsos positivos son muy poco frecuentes y pueden estar relacionados con la presencia de otras bacterias productoras de ureasa139.
- 27.
Las técnicas moleculares como la reacción en cadena de la polimerasa (PCR) y técnicas moleculares de secuenciación masiva de nueva generación (NGS) son métodos que permiten la identificación de mutaciones implicados en la resistencia a antibióticos y ser de utilidad para el tratamiento dirigido.
Totalmente de acuerdo 100%
Calidad de la evidencia: A; Fuerza de la recomendación: Fuerte a favor
Las técnicas moleculares han revolucionado el diagnóstico y tratamiento de la infección por H. pylori ya que permiten la identificación precisa de mutaciones genéticas asociadas con la resistencia a antibióticos, crucial para la selección de regímenes terapéuticos efectivos. La PCR permite la detección de genes específicos que confieren resistencia a los antibióticos, como los que codifican para las enzimas β-lactamasas y otros mecanismos de resistencia139. Por otro lado, la NGS realiza un análisis exhaustivo del genoma de H. pylori, permitiendo la identificación de mutaciones conocidas y el descubrimiento de nuevas variantes asociadas a la resistencia a múltiples antibióticos. Este enfoque permite la caracterización del perfil genético de la cepa específica, facilitando la implementación de un tratamiento dirigido y personalizado140–142.
Zhang et al., evaluaron la efectividad de la PCR y NGS para la identificación de mutaciones relacionadas con la resistencia a antibióticos demostrando que la identificación de mutaciones en genes clave, como Gyra y PonA, está directamente relacionada con tasas de erradicación más bajas en comparación con el tratamiento empírico estándar. Esto sugiere que la implementación de pruebas moleculares puede mejorar los resultados clínicos al permitir un enfoque de tratamiento más dirigido y personalizado143. En países de América Latina incluyendo México, Latorre et al.,28 examinaron la resistencia a antibióticos del H. pylori utilizando NGS, sus resultados mostraron que un alto porcentaje de las cepas analizadas presentaban mutaciones asociadas con resistencia a múltiples antibióticos, como las fluoroquinolonas y la claritromicina (tabla 3). Este enfoque permitió identificar patrones específicos de resistencia regionales. Los hallazgos sugieren que la implementación de pruebas moleculares podría ser de utilidad en la toma de decisiones al personalizar el tratamiento basados en perfiles moleculares, mejorando las tasas de erradicación y reduciendo la incidencia de tratamientos fallidos28.
Sin embargo, en países como México, la disponibilidad de estas técnicas moleculares —incluyendo PCR y NGS— sigue siendo limitada y su costo es elevado, lo que restringe su aplicación clínica rutinaria. Se espera que, con el avance de la tecnología, la mayor capacitación de personal y la reducción progresiva de los costos, estas herramientas se vuelvan más accesibles en el futuro cercano, permitiendo un abordaje más preciso y efectivo de la infección por H. pylori en contextos locales.
Tratamiento- 28.
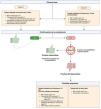
La Terapia Cuádruple con Bismuto (TCB) (Fig. 2) administrada durante 14 días es la opción preferida para erradicar H. pylori, especialmente en áreas con alta resistencia a claritromicina (> 15%) como México. En áreas de baja resistencia o cuando no está disponible, pueden considerarse la terapia concomitante o la triple basada en claritromicina.
Totalmente de acuerdo 100%
Calidad de la evidencia: A; Fuerza de la recomendación: Fuerte a favor
En regiones con resistencia a claritromicina> 15%, la TCB (formulación de subsalicilato de bismuto o su equivalente en subcitrato de bismuto) por 14 días es la opción preferida (TCB), ya que su eficacia no se ve afectada por esta resistencia y es menos impactada por metronidazol144. Cuando la resistencia a claritromicina es baja o el bismuto no está disponible, pueden considerarse alternativas como la terapia concomitante (IBP, amoxicilina, claritromicina y metronidazol), que ha mostrado eficacia similar, pero puede requerir un tratamiento más prolongado145. En México, donde el umbral de resistencia mencionado ya ha sido superado, la TCB por 14 días es el tratamiento de primera línea recomendado para la erradicación de H. pylori146–148. Este esquema, compuesto por un IBP, bismuto, metronidazol y tetraciclina, ha demostrado altas tasas de erradicación incluso en presencia de resistencia antibiótica146,147. No obstante, la disponibilidad de tetraciclina puede ser limitada en algunas regiones del país, lo cual representa una barrera potencial para la implementación sistemática de este esquema.
A pesar de que la tetraciclina no está ampliamente disponible en México, la doxiciclina —un análogo semisintético con propiedades farmacológicas similares— representa una alternativa viable y accesible. Aunque las guías del American College of Gastroenterology (ACG) no califican favorablemente a la doxiciclina en esquemas de erradicación de H. pylori (con base a un solo estudio y con una proporción muy pequeña de pacientes que recibieron doxiciclina), estudios recientes realizados en México respaldan su uso en esquemas cuádruples basados en bismuto144. En particular, un estudio de vida real comparó una terapia cuádruple que emplea tegoprazan (PCAB) más bismuto, metronidazol y doxiciclina, contra un esquema tradicional con omeprazol como base antisecretora149. Los resultados mostraron una tasa de erradicación de 91% en el grupo con tegoprazan, comparado con 77.7% en el grupo con omeprazol, sin diferencias significativas en efectos adversos ni adherencia. Esta evidencia preliminar sugiere que, en ausencia de tetraciclina, la doxiciclina puede ser una alternativa efectiva dentro de esquemas cuádruples, particularmente cuando se combina con un PCAB como tegoprazan. Estos hallazgos apoyan la necesidad de reconsiderar la utilidad clínica de la doxiciclina en contextos donde la tetraciclina no está disponible, especialmente en países con alta resistencia a antibióticos como México.
Si la TCB no está disponible, puede considerarse la terapia concomitante (IBP, amoxicilina, claritromicina y metronidazol), aunque su eficacia es más variable cuando hay resistencia a claritromicina146. La elección del tratamiento debe basarse en los patrones locales de resistencia, disponibilidad de medicamentos y exposición previa a antibióticos146,147.
- 29.
Se debe de demostrar la erradicación de H. pylori 4 semanas después del tratamiento, mediante un método no invasivo.
Totalmente de acuerdo 95.8%, parcialmente de acuerdo 4.2%
Calidad de la evidencia: A; Fuerza de la recomendación: Fuerte a favor
La verificación de la erradicación de H. pylori es esencial, ya que la persistencia de la infección puede derivar en complicaciones como úlcera péptica, adenocarcinoma gástrico y linfoma MALT144. En pacientes con dispepsia, la ausencia de síntomas postratamiento no garantiza el éxito terapéutico, por lo que se recomienda confirmar la erradicación en todos los casos, independientemente de la evolución clínica144. Esto permite determinar si es necesario un régimen alternativo o si se debe reconsiderar el enfoque para el manejo de la dispepsia. Un resultado negativo posterior al tratamiento es alentador, ya que un metaanálisis indicó una tasa de recurrencia del 1% anual (IC 95% 0.3-3) en pacientes radicados en EE. UU150. Además, realizar la prueba antes de este periodo puede llevar a resultados falsamente negativos debido a la supresión transitoria de la bacteria por efecto residual de los antibióticos o antisecretores. Confirmar la erradicación también contribuye a reducir el uso innecesario de antibióticos, limitando así la propagación de cepas resistentes, y proporciona una base sólida para tomar decisiones terapéuticas adicionales en caso de fracaso.
- 30.
Tras el fracaso del tratamiento de primera línea, la selección del régimen debe considerar el historial del paciente, patrones locales de resistencia y disponibilidad terapéutica.
Totalmente de acuerdo 95.8%, parcialmente de acuerdo 4.2%
Calidad de la evidencia: A; Fuerza de la recomendación: Fuerte a favor
El manejo de la infección por H. pylori tras el fracaso del tratamiento de primera línea debe basarse en guías clínicas y evidencia actual. Se recomienda evitar antibióticos previamente utilizados, debido al riesgo de resistencia144,151. Entre las opciones de segunda línea, la TCB (IBP, bismuto, metronidazol y tetraciclina) por 14 días es altamente efectiva. Otra alternativa es la terapia triple con levofloxacina (IBP, amoxicilina y levofloxacina), particularmente si este antibiótico no se usó en el tratamiento inicial o conociendo la susceptibilidad antimicrobiana144,146,152,153. En pacientes con múltiples fallos terapéuticos, se sugiere la terapia triple con rifabutina por 10-14 días146,151. También se considera la terapia dual con IBP y amoxicilina a dosis altas por 14 días, cuando otros esquemas no son viables144. La selección del tratamiento debe guiarse por los patrones locales de resistencia antimicrobiana y la historia de antibióticos del paciente144,151,154. Se prefieren esquemas de 14 días para mejorar las tasas de erradicación146,155. Estudios indican que la TCB tiene mayores tasas de éxito en comparación con la terapia triple con claritromicina, la cual muestra menor eficacia en segunda línea155.
- 31.
La exposición previa a claritromicina reduce significativamente la eficacia de los tratamientos que incluyen este antibiótico y promueve la resistencia, limitando su utilidad como terapia empírica.
Totalmente de acuerdo 95.8%, parcialmente de acuerdo 4.2%
Calidad de la evidencia: A; Fuerza de la recomendación: Fuerte a favor
Las tasas de erradicación de la terapia triple con IBP y claritromicina han disminuido con el tiempo, principalmente debido al aumento en la resistencia a claritromicina, atribuida al uso frecuente de macrólidos en la práctica clínica. Un ECA realizado en EE. UU. y Europa reportó una prevalencia de resistencia a claritromicina del 22.2%156. A pesar de esta tendencia a la baja en la eficacia, la terapia triple con IBP y claritromicina sigue siendo el tratamiento de primera línea más utilizado en EE. UU. y otras regiones157.
- 32.
Las pruebas de susceptibilidad, preferentemente moleculares, deben considerarse antes del tratamiento en áreas de alta resistencia a antibióticos o en casos de resistencia conocida. Estas pruebas permiten identificar resistencias específicas y optimizar la selección de terapias dirigidas, mejorando las tasas de erradicación.
Totalmente de acuerdo 100%
Calidad de la evidencia: A; Fuerza de la recomendación: Fuerte a favor
Según el consenso de expertos, se recomienda el uso de pruebas de susceptibilidad a antibióticos cuando la elección del tratamiento no sea clara, después de considerar tratamientos previos para H. pylori, exposición previa a antibióticos en general y antecedentes documentados de alergia a la penicilina144.
Los métodos moleculares, en particular la PCR en tiempo real, la secuenciación del genoma completo y la PCR digital, permiten la detección de mutaciones en H. pylori asociadas con resistencia a claritromicina, levofloxacina, tetraciclina y rifampicina108.
Estas pruebas pueden tener aplicaciones individuales, con orientación a terapias de rescate personalizadas, así como epidemiológicas, para caracterizar los patrones de resistencia locales y apoyar decisiones terapéuticas poblacionales. Sin embargo, debe reconocerse que en México la disponibilidad clínica de estas herramientas es limitada, lo que restringe su uso rutinario. Su implementación debe ser promovida en centros con capacidad técnica, como parte de estrategias de vigilancia y medicina de precisión.
- 33.
El régimen de 14 días de TCB es el recomendado para la erradicación de H. pylori, ya que proporciona tasas de éxito superiores en comparación con regímenes más cortos.
Totalmente de acuerdo 95.2%, parcialmente de acuerdo 4.8%
Calidad de la evidencia: A; Fuerza de la recomendación: Fuerte a favor
La combinación de IBP, bismuto, metronidazol y tetraciclina administrada por 10 a 14 días ha demostrado tasas de erradicación de ≥ 85%, incluso en regiones con alta prevalencia de resistencia a metronidazol. Dado que la resistencia a este antibiótico es frecuente y las pruebas de susceptibilidad son poco comunes y a veces presentan resultados inconsistentes, se recomienda generalmente el esquema de 14 días108,158,159.
- 34.
En pacientes con tratamientos previos fallidos para H. pylori, se recomienda realizar pruebas de susceptibilidad con el objetivo de identificar resistencias específicas y seleccionar el tratamiento más adecuado, optimizando las tasas de erradicación.
Totalmente de acuerdo 100%
Calidad de la evidencia: A; Fuerza de la recomendación: Fuerte a favor
Este enfoque personalizado, a diferencia del enfoque empírico utilizado anteriormente, tiene el potencial de mejorar las tasas de éxito y disminuir la prescripción inadecuada de antibióticos, reduciendo así su impacto y la aparición de resistencias160. Se recomienda a los profesionales de la salud supervisar las tasas de éxito de los tratamientos que prescriben y considerar la prueba de susceptibilidad antibiótica si las tasas de erradicación de sus terapias de primera línea preferidas son inferiores al 85%.
Se recomienda realizar pruebas de susceptibilidad antibiótica cuando la selección del tratamiento no sea clara, considerando antecedentes de tratamientos previos para H. pylori, exposición a antibióticos (especialmente macrólidos y quinolonas) y alergia documentada a penicilina. Esta recomendación aplica tanto a pacientes sin tratamiento previo como a aquellos con fallos terapéuticos. En particular, se sugiere realizar pruebas de susceptibilidad antes de utilizar esquemas con claritromicina o levofloxacina144.
- 35.
La administración de dosis altas de IBP o PCAB dos veces al día mejora la tasa de erradicación de la terapia triple en comparación con la dosis estándar, cuando no se dispone de TCB.
Totalmente de acuerdo 95.2%, parcialmente de acuerdo 4.8%
Calidad de la evidencia: A; Fuerza de la recomendación: Fuerte a favor
El uso de IBP a dosis altas o PCAB dos veces al día mejora las tasas de erradicación de H. pylori en la terapia triple en comparación con la dosis estándar, especialmente cuando no se dispone de TCB161. Una mayor supresión ácida favorece la estabilidad y actividad de antibióticos como amoxicilina y claritromicina, lo que mejora la eficacia del tratamiento161. Se ha demostrado que los PCAB, como vonoprazan, son más efectivos que los IBP estándar en terapia triple, con un RR de 1.17 en estudios aleatorizados controlados162. En guías clínicas se destaca la importancia de optimizar la supresión ácida en casos refractarios, recomendando dosis más altas de IBP o el uso de PCAB para mejorar la erradicación144. Diferentes IBP pueden utilizarse de manera intercambiable según su equivalencia con omeprazol144,163. Se ha demostrado que el uso de IBP a dosis altas dos veces (por ejemplo, dexlansoprazol 60mg b.i.d, rabeprazol 20mg b.i.d) o hasta 3 veces (esomeprazol 40mg t.i.d) al día mejora la eficacia de la terapia triple, aunque su impacto en terapias cuádruples aún no está claro144. Es importante recalcar que en México se cuenta con 2 PCAB, tegoprazan el cual cuenta con estudios al respecto, y fexuprazan el cual aún no cuenta con la evidencia al respecto164–166. Como se menciona en el enunciado 28. Es importante mencionar que a nivel institucional no existe disponibilidad de los PCAB, por lo que el uso de IBP a dosis altas puede ser una opción recomendable para los pacientes en este entorno. En las tablas 4 y 5 se muestra la dosis estándar de IBP/PCAB y la potencia de los IBP basado en su equivalencia con omeprazol163–167.
- 36.
Los tratamientos con PCAB combinados con antimicrobianos han demostrado tasas de erradicación equivalentes o superiores a las terapias triples convencionales basadas en IBP a dosis estándar. La superioridad es más evidente en pacientes con infecciones resistentes a antimicrobianos. Se requieren estudios locales para validar estos resultados.
Potencia de los IBP basado en su equivalencia con omeprazol
| IBP | Equivalencia a omeprazol |
|---|---|
| Pantoprazol 20 mg | 4.5mg |
| Pantoprazol 40 mg | 9 mg |
| Lansoprazol 15 mg | 13.5 mg |
| Lansoprazol 30 mg | 27 mg |
| Esomeprazol 20 mg | 32 mg |
| Esomeprazol 40 mg | 64 mg |
| Rabeprazol 20 mg | 36 mg |
Adaptado de: Graham DY, Lu H, Dore MP. Relative potency of proton-pump inhibitors, Helicobacter pylori therapy cure rates, and meaning of double-dose PPI. Helicobacter. 2019;24:e12554; Kirchheiner J, Glatt S, Fuhr U, et al. Relative potency of proton-pump inhibitors—comparison of effects on intragastric pH. Eur J Clin Pharmacol. 2009;65:19–31.
Dosis estandarizadas de IBP / PCAB
| IBP | Dosis baja | Dosis estándar | Dosis alta | Dosis doble |
|---|---|---|---|---|
| Omeprazol | 10 mg | 20 mg | 40 mg | 40mg** |
| Pantoprazol | 20 mg | 40 mg | 40 mg | 40mg** |
| Lansoprazol | 15 mg | 30 mg | 30 mg | 30mg** |
| Rabeprazol | 10 mg | 20 mg | 20 mg | 20mg** |
| Esomeprazol | 10 mg | 20 mg | 40 mg | 40mg** |
| Dexlansoprazol | 30 mg | 30 mg | 60 mg | |
| Ilaprazol | 10 mg | 20 mg | ||
| Levopantoprazol | 10 mg | 10 mg | ||
| Dexrabeprazol | 10 mg | 10 mg | ||
| PCAB | ||||
| Tegoprazan | 50 mg | 100 mg | ||
| Fexuprazan | 40 mg | 80 mg | ||
| Vonoprazan | 20 mg | |||
| Revaprazan | 200 mg | |||
| Keverprazan | 20 mg |
Dosis administrada dos veces al día.
Adaptado de: Graham DY, Lu H, Dore MP. Relative potency of proton-pump inhibitors, Helicobacter pylori therapy cure rates, and meaning of double-dose PPI. Helicobacter. 2019;24:e12554; Kirchheiner J, Glatt S, Fuhr U, et al. Relative potency of proton-pump inhibitors—comparison of effects on intragastric pH. Eur J Clin Pharmacol. 2009;65:19–31; Scarpignato C, Hunt RH. Potassium-competitive Acid Blockers: Current Clinical Use and Future Developments. Curr Gastroenterol Rep. 2024;26(11):273–293.
Totalmente de acuerdo 87.5%, parcialmente de acuerdo 12.5%
Calidad de la evidencia: A; Fuerza de la recomendación: Fuerte a favor
La erradicación óptima de H. pylori requiere una inhibición predecible y prolongada de la secreción ácida, con un pH entre 6 y 7, ya que en este rango el microorganismo se encuentra en fase de crecimiento y es más susceptible a claritromicina y amoxicilina168. Los IBP disponibles actualmente no suelen alcanzar este grado o duración de la supresión ácida requerida durante las 24 horas completas, plazo para cumplir este objetivo. Los PCAB, como vonoprazan y tegoprazan, han demostrado tasas de erradicación superiores en comparación con la terapia triple basada en IBP a dosis estándar, especialmente en infecciones resistentes a claritromicina. Un ECA mostró que la terapia triple con vonoprazan logró una tasa de erradicación del 65.8% en cepas resistentes a claritromicina, en contraste con el 31.9% de la terapia triple con lansoprazol169. Un metaanálisis confirmó la superioridad de los regímenes basados en vonoprazan sobre los basados en IBP, con un RR de 1.17, mientras que otro reportó tasas de erradicación del 90.2% para PCAB vs. 75.5% para IBP143–162. Más recientemente, en un metaanálisis con tegoprazan que incluyó nueve estudios controlados aleatorizados con bajo riesgo de sesgo, se evaluó la eficacia y seguridad de terapias de primera línea. Se compararon esquemas que contenían tegoprazán (N=1,052) con aquellos que incluían IBP (N=1,058)170. La tasa global de erradicación fue significativamente mayor en el grupo con tegoprazán (83.4%) en comparación con el grupo con IBP (80.1%) (RR 1.05; IC 95% 1.01–1.08). En cuanto a la seguridad, la incidencia de eventos adversos emergentes del tratamiento fue similar entre ambos grupos (46.48% vs. 46.31%; RR 1.026; IC 95% 0.952–1.106). Estos hallazgos respaldan que la terapia con tegoprazán es superior a los IBP en la erradicación de H. pylori, manteniendo un perfil de seguridad comparable. Dado que la resistencia antibiótica varía según la región, es fundamental realizar estudios locales para validar estos resultados y adaptar las estrategias de tratamiento a los perfiles específicos de resistencia. Como se menciona en el enunciado 28, ya existe experiencia inicial de la terapia con PCAB en la erradicación de H. pylori. De acuerdo con el Hp-MexReg en donde se han incluido más de 1,700 pacientes, y 109 pacientes se han registrado utilizando algún esquema que incluye PCAB, la tasa de erradicación con estos esquemas es del 93%.
- 37.
En pacientes con alergia comprobada a la penicilina, para un tratamiento de primera línea, se debe recomendar la TCB (IBP-bismuto-tetraciclina-metronidazol).
Totalmente de acuerdo 87%, parcialmente de acuerdo 8.7%, incierto 4.3%
Calidad de la evidencia: A; Fuerza de la recomendación: Fuerte a favor
La erradicación de H. pylori en pacientes con alergia a penicilina (reportada en aproximadamente 5%–10% de los individuos) representa un desafío significativo172. El sustituir amoxicilina por metronidazol en la triple terapia basada en claritromicina (IBP–claritromicina–metronidazol) no es efectivo para usarse como tratamiento de primera línea en áreas de alta resistencia173. La TCB debe preferirse como el régimen de primera línea en pacientes con alergia a penicilina173,174. Asimismo, como segunda línea en pacientes alérgicos a la penicilina, si previamente se usó la triple terapia, tras su fracaso, la TCB puede representar una opción empírica de rescate173. Los regímenes con fluoroquinolonas en diversas combinaciones también presentan eficacia174,175. Otras posibles estrategias de erradicación incluyen el administrar un PCAB, para aumentar la potencia de la supresión de secreción de ácido, como se menciona en el enunciado previo176.
- 38.
La adición de probióticos específicos (como Lactobacillus spp. y Saccharomyces boulardii) a la terapia estándar puede reducir efectos adversos como diarrea, náuseas y dolor abdominal. Aunque pueden mejorar el apego al tratamiento, la evidencia sobre su impacto en la tasa de erradicación es limitada.
Totalmente de acuerdo 95.8%, incierto 4.2%
Calidad de la evidencia: A; Fuerza de la recomendación: Débil a favor
El uso de probióticos específicos, como Lactobacillus spp. y Saccharomyces boulardii, en combinación con la terapia estándar para H. pylori ha sido estudiado por su capacidad para reducir efectos adversos y mejorar las tasas de erradicación108.
La evidencia muestra que los probióticos pueden disminuir significativamente efectos adversos como diarrea, náuseas y dolor abdominal. Un metaanálisis reportó que la suplementación con probióticos redujo el riesgo de efectos secundarios (RR 0.54; IC 95% 0.42-0.70)177–179. Además, el uso de Saccharomyces boulardii en combinación con TCB redujo la incidencia de eventos adversos como diarrea y distensión abdominal177–179. En cuanto a la tasa de erradicación, un análisis de revisiones sistemáticas y metaanálisis encontró que la suplementación con probióticos aumentó la erradicación de H. pylori, con (RR 1.10; IC 95% 1.06-1.14). En particular, el uso de Lactobacillus spp. mejoró la erradicación (RR 1.16; IC 95% 1.08-1.25)176,177.
Si bien la evidencia respalda el uso de probióticos como adyuvantes en la terapia de H. pylori, aún se requieren estudios adicionales para definir las cepas y combinaciones óptimas180–182.
Perspectivas futuras para la investigación sobre H. pylori en MéxicoA pesar de que México ha sido históricamente un país con alta prevalencia de H. pylori, los datos epidemiológicos recientes son escasos y en comparación con otras naciones latinoamericanas, el interés investigativo en el tema parece haber disminuido. Como lo evidencia la tendencia decreciente en las publicaciones científicas indexadas en PubMed, es urgente revertir esta situación para contar con información representativa que sustente decisiones clínicas y de salud pública adaptadas al contexto mexicano.
En los próximos cinco años, se considera prioritario desarrollar líneas de investigación que incluyan:
- a.
Estudios epidemiológicos multicéntricos actualizados, con diseño metodológico robusto y representatividad nacional, que utilicen serología y pruebas para infección activa (prueba de aliento, antígeno en heces) y que consideren diferencias urbano-rurales y entre estados.
- b.
Mapeo nacional de resistencia antimicrobiana, mediante la expansión del Hp-MexReg a través de la colaboración con HpLatamReg y HpRESLA y fortalecimiento de redes de vigilancia microbiológica que permitan conocer la dinámica local de cepas multirresistentes, para recomendar esquemas de erradicación racionales, de alta tasa de erradicación, evitando el uso empírico de antibióticos con resistencia local> 15% o esquemas con tasas de erradicación inferiores al 90%.
- c.
Investigaciones genotípicas de cepas mexicanas, enfocadas en factores de virulencia como CagA, VacA, y otros determinantes que expliquen las diferencias en comportamiento clínico y oncogenicidad.
- d.
Estudios demostrativos de implementación para evaluar estrategias de detección y erradicación de H. pylori como medida de prevención primaria del cáncer gástrico, especialmente en grupos de alto riesgo (familiares de primer grado de pacientes con cáncer gástrico o atrofia gástrica).
- e.
Evaluación de nuevas terapias y eficacia clínica de esquemas basados en PCAB, así como esquemas de rescate guiados por antibiograma.
- f.
Análisis de costo-efectividad de estrategias diagnósticas y terapéuticas, que permitan justificar la implementación de políticas públicas de detección y tratamiento en el sistema nacional de salud.
- g.
Estudios de cohorte a largo plazo en poblaciones mexicanas, particularmente en pacientes con metaplasia intestinal o antecedentes familiares de primer grado con cáncer gástrico, son necesarios para estimar tasas de recurrencia, reinfección y progresión a lesiones premalignas o cáncer gástrico.
En resumen, este consenso exhorta a la comunidad científica nacional, autoridades sanitarias y organismos de financiamiento a priorizar la investigación sobre H. pylori como un problema vigente de salud pública en México. Solo mediante evidencia local actualizada se podrán establecer políticas de tamizaje, tratamiento y prevención acordes a la realidad del país. Además, es indispensable fortalecer la red de laboratorios clínicos para el diagnóstico de la infección y la realización de pruebas de resistencia antimicrobiana, así como establecer centros de referencia regionales que garanticen el acceso a diagnóstico y tratamiento de calidad.
FinanciaciónLos laboratorios Carnot proporcionaron el apoyo financiero en cuanto a logística, gastos de viaje y reunión presencial para todos los expertos de este documento. Ningún participante recibió honorarios para la realización de estas guías. Estas recomendaciones están avaladas por la AMG.
DeclaraciónLas contribuciones de los autores del NIH se realizaron como parte de sus deberes oficiales como empleados federales del NIH, cumplen con los requisites de política de la agencia y se consideran Obras del Gobierno de los Estados Unidos. Sin embargo, los hallazgos y conclusiones presentados en este documento son de los autores y no reflejan necesariamente las opiniones del NIH o del Departamento de Salud y Servicios Humanos de los EE. UU.
Consideraciones éticasProtección de personas y animales. En este estudio de investigación no se llevaron a cabo experimentos en animales o en humanos.
Confidencialidad de datosEn la elaboración de este consenso se han seguido todos los protocolos de nuestro centro de trabajo cuidando en todo momento la privacidad y confidencialidad de los sujetos que participaron en el mismo, Se ha preservado el anonimato de los datos de los sujetos evaluados.
Derecho de la privacidad y consentimiento informadoPor la naturaleza del manuscrito no se incluyeron pacientes, ni sujetos por lo que otorgar consentimiento informado no fue requerido.
Conflicto de interesesDr. José María Remes-Troche: es asesor y miembro de consejo consultivo para Adium, Carnot, PRO.MED.CS Praha a.s. y Pisa. Conferencista para Asofarma, Abbot, Carnot, Chinoin, Ferrer, Johnson y Johnson, Menarini Centroamerica, M8, Medix y Medtronic; Dr. Enrique Coss-Adame: Advisory board para Venter Pharma, España y para Adium de México. Recibe fondos de investigación de Venter Pharma de España y Alfa Sigma de México. Conferencista para: Carnot de México, Adium de México, Guatemala y Ecuador, Alfa Sigma de México y Medtronic de México; Dra. Ana D. Cano Contreras es ponente para Medix; Luis Raúl Valdovinos-García es ponente para Carnot; Francisco Bosques-Padilla, José Antonio Velarde-Ruiz Velasco, María Victoria Bielsa-Fernández, Margarita Camorlinga Ponce, M. Constanza Camargo, Francisco Esquivel-Ayanegui, Ángel Ricardo Flores-Rendón, Octavio Gómez-Escudero, María Saraí González-Huezo, Fátima Higuera-de-la-Tijera, Yelda Aurora Leal-Herrera, Yolanda López-Vidal, Eliana Carolina Morel-Cerda, Alejandra Noble-Lugo, Nayeli Xochiquetzal Ortiz-Olvera, Ricardo Raña-Garibay, Arnoldo Riquelme, Miguel A. Tanimoto, Omar Edel Trujillo-Benávides, Luis F. Uscanga-Domínguez y Pedro Antonio Amezcua-Gomez no tienen conflictos de intereses relacionados que declarar.