El cáncer colorrectal (CCR) es el tercer cáncer más prevalente en el mundo. Son muchos los factores de riesgo y la evidencia actual apunta a una conexión entre la microbiota intestinal y la carcinogénesis colorrectal. Se propone a la Fusobacterium nucleatum como uno de los factores de riesgo en el inicio y la progresión del CCR, por modulación inmune e inflamatoria.
Materiales y métodosSe recolectaron 90 muestras de tres diferentes regiones del colon por medio de colonoscopía en pacientes con CCR y se realizó qPCR TagMan® para detectar F. nucleatum y citocinas (IL-17, IL-23 e IL-10) en el tumor, a nivel peritumoral y en tejido normal. Las diferencias entre las muestras fueron analizadas y correlacionadas.
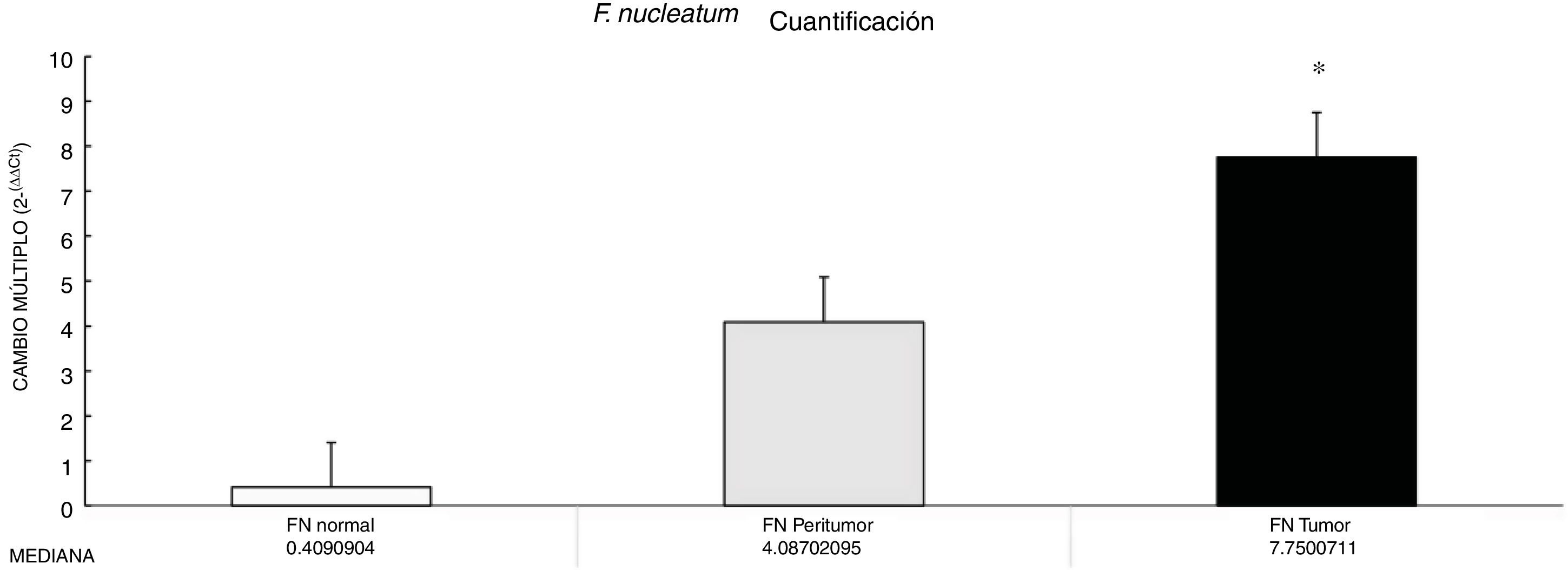
ResultadosLa abundancia de F. nucleatum determinada por medio del método 2-ΔΔCt en CCR (7.750 [5.790-10.469]) fue significativamente mayor que el control normal (0.409 [0.251-0.817]) (p<0.05). No se observó asociación significativa entre F. nucleatum y las citocinas (p>0.05).
ConclusionesEl CCR es una enfermedad heterogénea que se presenta y progresa en un microambiente complejo, parcialmente debido al desequilibrio en la microbiota intestinal. La F. nucleatum se encuentra de manera abundante en los tejidos del CCR, pero aún no está claramente definido si esto es casual o consecuencia del CCR.
Colorectal cancer (CRC) is the third most prevalent cancer worldwide. Many risk factors are involved, and current evidence links the gut microbiota and colorectal carcinogenesis. Fusobacterium nucleatum is proposed as one of the risk factors at the onset and during the progression of CRC, due to immune system and inflammatory modulation.
Materials and methodsNinety samples from three different regions of the colon were collected through colonoscopy in patients with CRC, and qPCR TagMan® was conducted to detect F. nucleatum and cytokines (IL-17, IL-23, and IL-10) in tumor, peritumor, and normal samples. The differences between them were analyzed and correlated.
ResultsThe abundance of F. nucleatum determined through the 2-ΔΔCt method in CRC (7.750 [5.790-10.469]) was significantly higher than in the normal control (0.409 [0.251-0.817]) (p<0.05). There was no significant association between F. nucleatum and the cytokines (p>0.05).
ConclusionsCRC is a heterogeneous disease that presents and progresses in a complex microenvironment, partially due to gut microbiome imbalance. F. nucleatum was enriched in CRC tissue, but whether that is a cause of the pathology or a consequence, has not yet been clearly defined.
El cáncer colorrectal (CCR) es uno de los tumores malignos más comunes en el tracto digestivo y actualmente es considerado un importante problema de salud pública1. En general, el CCR está en cuarta posición en incidencia (9.2% del total de casos de cáncer), pero segundo en mortalidad (9.2% del total de muertes por cáncer)2. En México, se ha observado una tendencia al alza en las tasas de mortalidad por la enfermedad en las tres décadas pasadas. El CCR está entre las 10 causas de morbilidad más prevalentes por malignidad en México3. La carcinogénesis colorrectal es un proceso heterogéneo asociado con varias combinaciones de alteraciones moleculares somáticas que son influidas por la dieta, el medio ambiente y la exposición microbiana. La inflamación ha sido identificada como un factor de riesgo importante4. El tracto digestivo humano tiene más de 1014 bacterias, eucariotas y virus que forman la llamada microbiota intestinal. Estos microorganismos juegan un papel significativo en actividades fisiológicas humanas normales, incluidas la digestión, el metabolismo, la homeostasis epitelial y el desarrollo de tejido linfoide intestinal. La disbiosis en la microbiota intestinal, como cambios en su población o composición, puede causar enfermedades específicas (p.ej., trastornos cardiometabólicos, enfermedad inflamatoria intestinal, enfermedades neuropsiquiátricas y cáncer)5. El enriquecimiento de Fusobacterium nucleatum en tejido con CCR en comparación con grupos control ha sido demostrado en análisis metagenómicos que incluyen la secuenciación del genoma completo, la secuenciación del transcriptoma y la secuenciación del gen 16S ARNr6–8. Además, F. nucleatum tiene una asociación cercana con un mal pronóstico para pacientes con CCR y muy probablemente con mayor quimiorresistencia9,10.
La F. nucleatum es un bacilo anaeróbico gramnegativo, presente en reservorios específicos de la boca humana, el tracto digestivo y otras partes del cuerpo. Está bien establecido que la inflamación crónica inducida por infección bacteriana incrementa el riesgo de cáncer11. En un estudio reciente se observó la relación entre la microbiota intestinal y la capacidad de producción de citocina inflamatoria12. La F. nucleatum induce citocinas inflamatorias locales, incluidas IL-6, IL-8, IL-17, TNF-α y COX-2, en el microambiente del tumor, y dichas citocinas pueden promover carcinogénesis en CCR6,13–15. El objetivo del presente estudio fue evaluar la presencia de F. nucleatum y su relación con inflamación local en tejido con tumor y sin tumor en pacientes mexicanos con CCR.
Materiales y métodosUn total de 30 pacientes consecutivos (18 hombres y 12 mujeres, rango de edad: 45-84 años), que presentaron CCR, confirmado histológicamente como adenocarcinoma, se sometieron a colonoscopía en el Departamento de Cirugía Colorrectal del Hospital Militar en México, entre marzo y septiembre del 2019. No se incluyó a pacientes que tuvieran tumores colorrectales que no fueran adenocarcinoma, que recibieran quimioterapia o radioterapia antes de la colonoscopía y que tuvieran comorbilidades malignas en otros órganos. De cada sujeto se recolectaron muestras de tejido fresco de tumor (una lesión macroscópica), muestras de tejido peritumoral (cerca de una lesión macroscópica) y muestras de mucosa de control (a más de 10cm de los márgenes cancerosos). Las muestras de tejido y de mucosa de control fueron congeladas instantáneamente en nitrógeno líquido para almacenamiento de largo plazo a −80°C, hasta el momento de su utilización. Todos los pacientes fueron incluidos en el estudio qPCR.
Extracción de ADNLa extracción de ADN de las muestras de tejido colorrectal fue realizada utilizando el reactivo TRIzol (Ambion, Carlsbad, CA, EE.UU.) y el protocolo correspondiente del fabricante. Se llevó a cabo una síntesis de ADN complementaria utilizando el miScript II RT kit® (Qiagen, Hilden, Alemania), con el Veriti Thermal Cycler (Applied Biosystems), siguiendo las instrucciones del fabricante.
Reacción en cadena de la polimerasa en tiempo real cuantitativaUna vez obtenido el cADN, se ecualizaron las pruebas en cada muestra por medio de diluciones para formar grupos y realizar la amplificación y secuenciación del gen bacteriano 16S ARNr16. Las regiones hipervariables V3 y V6 del gen 16S ARNr fueron amplificadas por medio de PCR del ADN genómico microbiano con el partidor delantero (TATGGTAATTGTGTGCCAGCMGCCGCGGTAA) y trasero (GGACTACHVGGGTWTCTAAT). Los partidores fueron diseñados con adaptadores protuberantes (delantero: AATGATACGGCGACCACCGAG), (trasero: CAAGCAGAAGACGGCATACGAGAT), de acuerdo con el MiSeq™ System, Illumina, Inc. (San Diego, CA, EE.UU.), para reconocer los adaptadores de secuenciación del índice Illumina que se agregaron en una PCR subsiguiente. Los productos de la PCR fueron evaluados por electroforesis en gel de agarosa al 2% y luego purificados. Tras la purificación, los productos de la PCR fueron cuantificados por medio de espectrofotometría. Las muestras fueron normalizadas a una concentración final de 2nM. Las bibliotecas de 16S ARNr fueron preparadas utilizando un protocolo PCR de dos pasos: primero las concentraciones de ADN extraídas fueron cuantificadas; a continuación, todas las muestras de ADN fueron diluidas a la concentración de la muestra de ADN más diluida, y se utilizaron 2μl de cada muestra de ADN para una reacción PCR a 98°C por 30s (98°C por 30s, 52°C por 30s, 72°C por 30s) por 20 ciclos, y una espera a 4°C. Para cada muestra de ADN, se realizaron cuatro reacciones PCR de 25μl, las cuales a continuación fueron acumuladas y limpiadas con microesferas AmpureXP. La segunda reacción PCR, 4μl del producto PCR previo, fueron utilizados con los partidores de código de barras PE-PCR-III-F y PE-PCR-IV en cuatro reacciones de 25μl con un ciclo PCR a 98°C por 30s (98°C por 30s, 83°C por 30s 72°C por 30s) por 7 ciclos, y una a 4°C. Cada conjunto de cuatro reacciones PCR fue acumulado y las reacciones fueron aclaradas, utilizando cuentas de purificación de secuenciación metagenómica 16S. Las concentraciones de la biblioteca fueron cuantificadas. La biblioteca fue secuenciada en un solo conjunto de líneas Illumina MiSeq, para la lectura base de 300 pares.
Los niveles de F. nucleatum y citocina fueron dados como cuantificación relativa y determinados por 2-ΔCt, donde ΔCt fue la diferencia en el número Ct para la prueba y referencia (gliceraldehído fosfato deshidrogensa [GAPDH, por sus siglas en inglés]) de la evaluación del gen. El cambio en la cuantificación del múltiplo de F. nucleatum y citocina en el tejido enfermo sobre el tejido colorrectal de control fue calculado como 2-ΔΔCt. Partidores y sondas previamente publicadas17–19 fueron sintetizadas por la Integrated DNA Technologies Company (Coralville, Iowa, EE.UU.), con las siguientes secuencias:
- 1)
F. nucleatum: partidor delantero, 5′ CGC AGA AGG TGA AAG TCC TGT AT 3′. partidor trasero, 5′ TGG TCC TCA CTG ATT CAC ACA GA 3′.
- 2)
IL-17: partidor delantero, 5́- CTC ATT GGT GTC ACT GCT ACT G - 3́. partidor trasero, 5́ - CCT GGA TTT CGT GGG ATT GTG - 3́.
- 3)
IL-23: partidor delantero, 5́- ACA CAT GGA TCT AAG AGA AGA GG - 3́. partidor trasero, 5́- CTA TCA GGG AGC AGA GAA GG - 3́.
- 4)
IL-10: partidor delantero, 5́- AAT AAG GTT TCT CAA GGG GCT - 3́. partidor trasero, 5́- AGA ACC AAG ACC CAG ACA TCA A - 3́.
- 5)
GAPDH: partidor delantero 5́- GTCTCCTCTGACTTCAACAGCG -3́. partidor trasero 5́- ACCACCCTGTTGCTGTAGCCAA – 3́.
Todos los análisis estadísticos fueron realizados utilizando el SPSS 25.0 para Windows (SPSS Inc. Chicago, IL, EE.UU.). La relación de F. nucleatum con niveles de citocina entre tejido tumoral, tejido peritumoral y tejido normal colorrectal fue dada como múltiplo de incremento en 2−ΔΔCt, donde ΔΔCt fue la mediana de la diferencia entre ΔCt del tejido enfermo y ΔCt del tejido normal. Los datos continuos fueron expresados como medianas (percentil 25 y 75). Se realizó una prueba de normalidad utilizando la prueba de Shapiro-Wilk. Debido a la naturaleza no gaussiana de la distribución de datos de la qPCR, se consideró apropiada una prueba no paramétrica. En consecuencia, la prueba de suma de rangos de Wilcoxon fue utilizada para comparar la mediana de los niveles de F. nucleatum y citocinas en el tejido enfermo contra el tejido normal y para comparar los niveles de F. nucleatum entre los subsitios del colon. Se realizó la prueba de coeficiente de correlación de rangos de Spearman para comparar la cuantificación de F. nucleatum con la expresión de citocina. Para todos los análisis, un valor de p<0.05 fue considerado estadísticamente significativo.
Consideraciones éticasLos autores declaran que se obtuvo el consentimiento informado de todos los sujetos participantes, de acuerdo con la Declaración de Helsinki. También, todos los pacientes fueron codificados para proteger su anonimato. El estudio fue aprobado por el Comité de Ética de Investigación del Hospital Central Militar, afiliado con la Universidad del Ejército y de la Fuerza Aérea de México.
ResultadosLa F. nucleatum fue más abundante en el tejido con tumor de CCR que en el tejido normal.
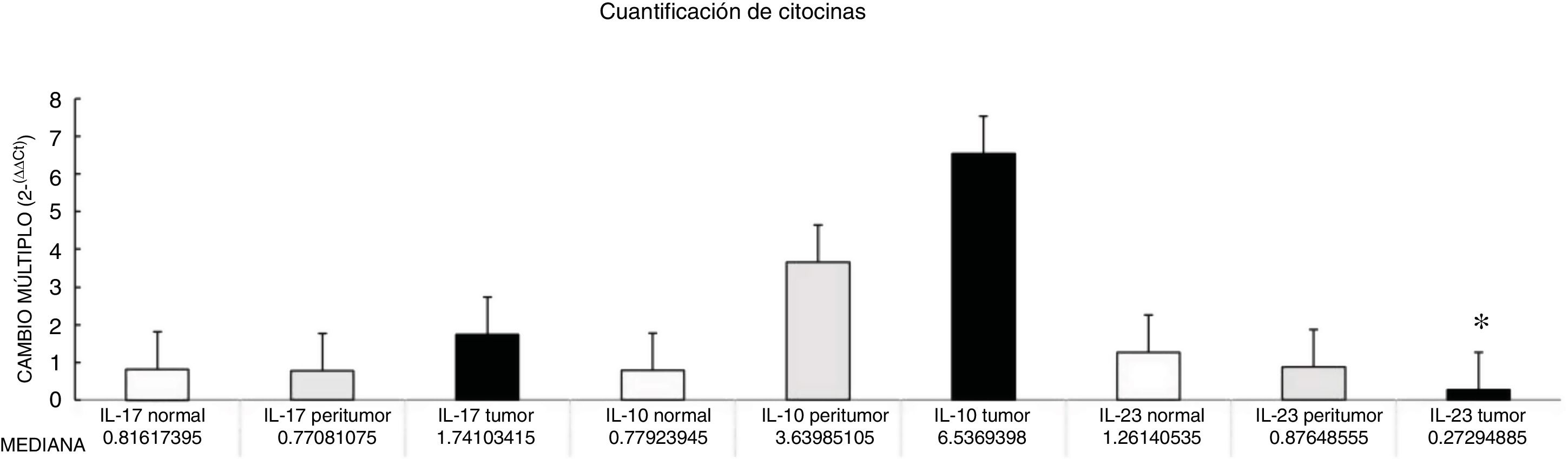
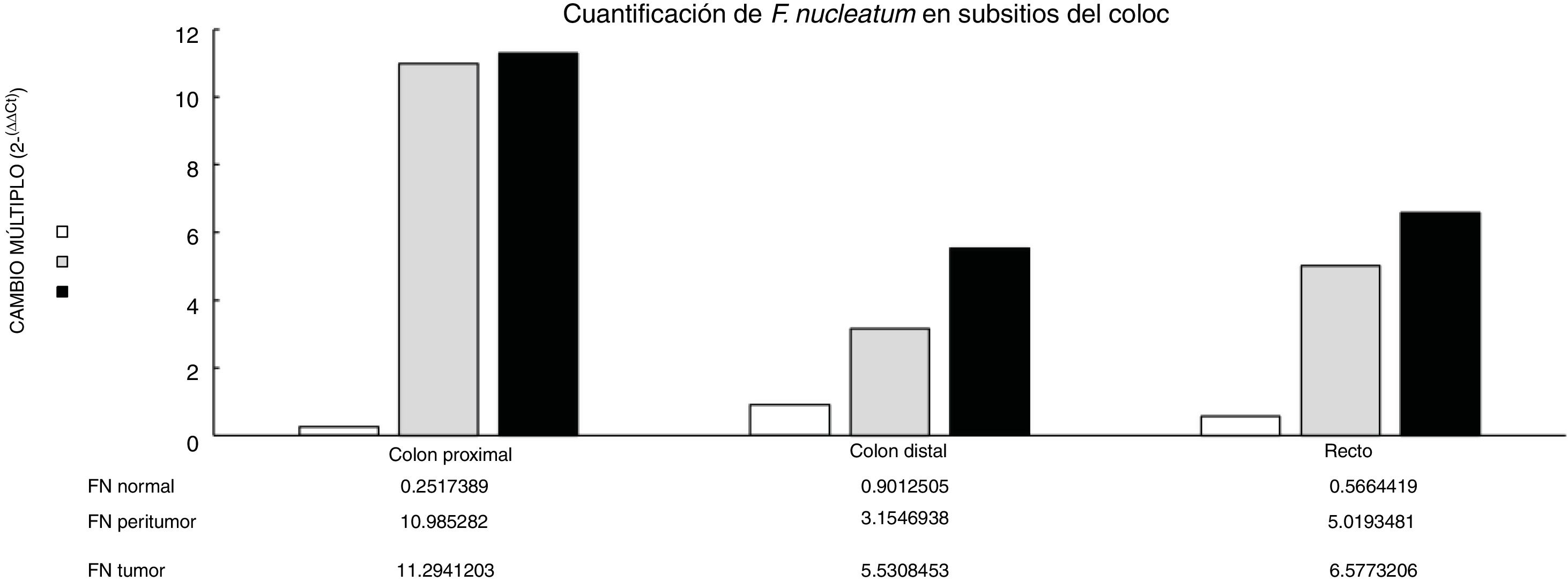
Por medio de la qPCR, pudimos confirmar que el cambio en el múltiplo de incremento para F. nucleatum fue significativamente mayor en el tejido enfermo (muestras de tumor y peritumor), independientemente de la etapa del tumor y su localización, en comparación con el tejido normal, en una cohorte mexicana con cáncer (fig. 1). Los detalles de los datos clínicos y la etapa del cáncer y su localización están resumidos en la tabla 1. Los niveles de F. nucleatum y citocina fueron cuantificados en las 30 muestras de CCR y en las respectivas muestras peritumorales y normales. Se encontró un aumento significativo de ADN bacteriano en las muestras tumorales (7.750 [5.792-10.469]). Se realizó un análisis emparejado de la cuantificación de F. nucleatum para el grupo de tumor, utilizando tejido normal (0.409 [0.251-0.817]) (tabla 2). Se observaron diferentes expresiones de niveles de F. nucleatum a lo largo del colon, de las cuales la más alta fue en el colon proximal, con una mediana de cambio múltiplo de incremento de 11.294 y 10.985 en las muestras de tumor y peritumor, respectivamente. Sin embargo, no se encontraron diferencias significativas entre las ubicaciones (p>0.05) (fig. 2). La interleucina 23 (IL-23) (0.272 [0.125-0.345]) fue significativamente menor en el tejido con tumor en comparación con las muestras normales (1.261 [0.509-1.750]) (fig. 3). No se encontró otra expresión significativa de niveles de citocina en nuestro estudio. En la tabla 2 se resumen los cambios múltiplo en los grupos de tumor y peritumor para F. nucleatum y citocinas, en comparación con las muestras normales. Los niveles bacterianos no estuvieron correlacionados significativamente con los niveles de citocinas en el tejido tumoral o el tejido peritumoral (tabla 3).
Datos clínicos
| Resumen de diagnóstico clínico | Cohorte mexicana |
|---|---|
| Número total de muestras de tejido | 90 |
| Sexo, n (masculino/femenino) | 18/12 |
| Edad, media±DE (años) | 65±10 |
| Ubicación, n (colon proximal/colon distal/recto) | 7/11/12 |
| Índice de masa corporal, media±DE (kg/m2) | 32.5±3.0 |
| Indicación de colonoscopía, n (sangrado/dolor abdominal/cambio en el hábito intestinal/pérdida de peso) | 12/4/9/5 |
| ACE (antígeno carcinoembrionario), media±DE (ng/ml) | 25±32 |
| Etapa, n (etapa I, etapa II, etapa III, etapa IV) | 3/10/11/6 |
ACE: antígeno carcinoembrionario; DE: desviación estándar.
El cambio en el múltiplo de incremento (2-ΔΔCt) de Fusobacterium nucleatum y citocinas en muestras de tejido tumoral y peritumoral en comparación con tejido normal
| IL-17 | IL-10 | IL-23 | F. nucleatum | |
|---|---|---|---|---|
| Tumoral/tejido normal | ||||
| Mediana CM | 1.741 | 6.536 | 0.272 | 7.750 |
| Rango CM | 0.632-2.875 | 1.383-13.336 | 0.125-0.345 | 5.792-10.469 |
| Valor p | 0.564 | 0.248 | 0.021* | 0.020* |
| Peritumoral/tejido normal | ||||
| Mediana CM | 0.770 | 3.639 | 0.876 | 4.087 |
| Rango CM | 0.403-0.868 | 0.032-22.935 | 0.064-2.796 | 1.062-9.725 |
| Valor p | 0.564 | 1.000 | 0.564 | 0.081 |
| Tumoral/peritumoral | ||||
| Mediana CM | 0.817 | 3.978 | 1.030 | 0.318 |
| Rango CM | 0.244-3.717 | 0.009-6.495 | 0.291-12.692 | 0.212-1.226 |
| Valor p | 0.309 | 0.564 | 0.773 | 0.248 |
CM: cambio en el múltiplo; IL: interleucina.
Prueba de suma de rangos de Wilcoxon.
Análisis de correlación entre el cambio en el múltiplo de las citocinas en las muestras normales y el cambio en el múltiplo de Fusobacterium nucleatum en las muestras tumorales y peritumorales
| Coeficiente de correlación (r) | Tumoral | Peritumoral |
|---|---|---|
| IL-17 | 0.80 | −0.20 |
| Valor de p | 0.80 | 0.20 |
| IL-23 | −0.80 | 0.20 |
| Valor de p | 0.20 | 0.80 |
| IL-10 | 0.80 | 0.80 |
| Valor de p | 0.20 | 0.20 |
IL: interleucina.
Prueba de correlación de Spearman.
* Valor de p<0.05 fue considerado estadísticamente significativo.
Se piensa que las alteraciones en la composición de la microbiota intestinal juegan un papel en el desarrollo del CCR4,5,20. Los resultados del presente estudio confirman, por primera vez en pacientes mexicanos, al igual que en reportes previos de Norteamérica, Europa y Asia6,7,10,21, que la F. nucleatum está sobrerrepresentada en el tejido tumoral en CCR, en comparación con el tejido normal. A pesar de que no existieron diferencias significativas entre los niveles de F. nucleatum y la ubicación del tumor, se observó un alto nivel de la bacteria en el colon proximal. Existen diferencias bien conocidas en características clínicas, patológicas y epidemiológicas entre los cánceres de colon proximal y distal22,23. Las mismas diferencias se observan entre la microbiota en el colon proximal y distal. Flynn et al. encontraron que las diferencias en la composición de la microbiota del colon proximal y distal en sujetos sanos podrían deberse a diferencias en la distribución de oxígeno a lo largo de la mucosa del colon. El colon proximal alberga principalmente bacterias aeróbicas en su mucosa, y al contrario, el colon distal alberga principalmente especies anaeróbicas24. Actualmente existe evidencia creciente de que varios factores de riesgo asociados con el desarrollo de CCR (tabaquismo, enfermedad inflamatoria intestinal, alto consumo de alcohol, consumo excesivo de carne roja, diabetes mellitus, obesidad y predisposición genética) afectan en gran medida la síntesis de la microbiota intestinal25. En consecuencia, algunas poblaciones bacterianas son minimizadas, mientras que otras bacterias que son colonizadoras raras del colon, como Fusobacterium y Lactococcus, muestran un comportamiento adaptativo al nuevo medio ambiente, con lo que se confirma la hipótesis del modelo de «conductor-pasajero bacteriano» que juega un papel clave en la patogénesis del CCR26. Además, algunos estudios sobre biofilms bacterianos de la mucosa del colon han revelado nuevo conocimiento sobre los diferentes mecanismos patogenéticos que subyacen la carcinogénesis del CCR entre las regiones del colon27. Los cánceres ubicados en las regiones derechas del colon (ciego, colon ascendente y flexura hepática) generalmente muestran una presencia substancial de biofilm28. Dejea et al. mostraron que el biofilm está asociado con el cáncer de colon humano y ligado a la ubicación del cáncer, con presencia de biofilm en virtualmente todos los adenomas y cánceres localizados en las regiones derechas del colon, mientras que los cánceres ubicados en las regiones izquierdas del colon (colon distal a la flexura hepática) raramente tienen biofilm28,29. Dichos biofilms bacterianos estaban relacionados con cambios epiteliales que caracterizan la progresión de la carcinogénesis, incluida la disminución de E-cadherina y niveles elevados de las citocinas angiogénicas y proinflamatorias30. Utilizando el modelo «conductor-pasajero bacteriano», se ha mostrado que la F. nucleatum causa un microambiente inflamatorio que es más favorable para el desarrollo del CCR, a diferencia de otras bacterias que colonizan el sitio del tumor6. La interpretación convincente de los datos antes mencionados es algo importante. Primero que nada, ¿la F. nucleatum es causa del CCR o consecuencia de la enfermedad? Hasta ahora, la creciente evidencia está a favor de la hipótesis de «causa», ya que nuevos datos han demostrado que la F. nucleatum indujo inicialmente lesiones precancerosas (p.ej., pólipos hiperplásicos y adenomas) que eventualmente progresaron a CCR9,31. Además, varios estudios patogénicos han apoyado el papel carcinogénico de F. nucleatum, el cual promueve una respuesta oncogénica e inflamatoria por medio de FadA, el principal factor de virulencia de F. nucleatum, enlazándose con E-cadherina y activando la vía de B-catenina32. Además, la presencia de F. nucleatum en los intestinos afecta las citocinas relacionadas con tumores involucradas en la progresión de tumores de CCR15,33. En las muestras tumorales, encontramos que la IL-23 estaba disminuida significativamente, en comparación con los tejidos normales, mientras que hubo elevación en IL-17 e IL-10, pero la diferencia con el tejido normal no fue significativa (fig. 1). Debido a la naturaleza transversal de nuestro estudio, el incremento en IL-17 apoya la mayoría de los estudios que consideran a dicha interleucina un promotor importante en la iniciación de tumor y progresión de CCR, por medio de la vía IL-23/IL-17, la cual juega un papel crítico en la patogénesis del CCR34–36. En nuestro estudio, hubo una disminución en IL-23, lo que nos lleva a suponer que su reducción durante el desarrollo del tumor fue debida al hecho de que funciona como un iniciador de la vía IL-23/IL-17, resultando en una elevación de IL-17. Grivennikov et al. demostraron que la señalización de IL-23 promovió el crecimiento y progresión tumoral, y el desarrollo de una respuesta tumoral de IL-17. La IL-23 se produce principalmente por células mieloides asociadas a tumor que probablemente son activadas por productos microbianos37. Recientemente, Kostic et al. reportaron que la F. nucleatum expandió selectivamente a células inmunes derivadas de mieloides en el CCR. Durante la progresión tumoral, células mieloides reactivas podrían mediar la inmunosupresión por medio de producción de IL-106. La IL-10 es conocida por ser una citocina antiinflamatoria potente38. Debido a su efecto inmunosupresor sobre células dendríticas y macrófagos, la IL-10 puede atenuar la presentación antígena, al igual que la maduración y diferenciación celular, permitiendo que las células tumorales evadan el mecanismo de vigilancia inmune39. Algunos estudios han mostrado que el miR-21 producido por la F. nucleatum elevó los niveles de IL-10 y prostaglandina E2 (PGE2) en células de CCR40, y McCoy et al. encontraron una relación positiva significativa entre la abundancia de F. nucleatum y la expresión de IL-10 en biopsias de mucosa rectal de pacientes con adenoma, en comparación con controles normales31. Nuestros resultados sugieren una expansión de la colonización de F. nucleatum en tejidos de CCR, fenómeno que podría llevar a mediadores proinflamatorios (citocinas) elevados, como la IL-10. Un estudio realizado por Proenca et al. examinó la influencia de la F. nucleatum en el adenoma colorrectal y el CCR sobre la expresión mediadora inflamatoria por medio de activación de miARN que contribuía a carcinogénesis colorrectal41. Si se llega a validar, el ADN de F. nucleatum en tejido de carcinoma colorrectal podría ser un biomarcador de pronóstico. Además, nuestro estudio podría ofrecer conocimiento para estudios futuros y el desarrollo de estrategias de prevención y tratamiento de CCR, por medio del abordaje de la microbiota.
El presente estudio ha tenido varias fortalezas y debilidades notables. Sus fortalezas incluyen el uso de ADN extraído de tejido congelado fresco, sin fijación de tejido, lo cual resulta en evaluación qPCR>99% exitosa (con base en la amplificación constante del gen de referencia GAPDH humano en todas las muestras tumorales, las muestras peritumorales y las muestras normales), y el hecho de que evaluamos la utilidad pronóstica de la medición del ADN de F. nucleatum en pacientes con CCR, reflejando las características principales en pacientes mexicanos. Una limitación importante fue el pequeño número de pacientes incluidos en el estudio (n=30). Se deben realizar pruebas en una muestra de mayor tamaño y además de la F. nucleatum y las citocinas, también se deben analizar más especies de bacterias intestinales.
ConclusiónEl presente estudio apoya la evidencia de que la presencia de F. nucleatum, como bacteria simbiótica en el conducto intestinal humano, está relacionada con el desarrollo del CCR. La F. nucleatum es aparentemente estimulada en el colon proximal para promover CCR por medio de diferentes mecanismos de virulencia, como la adherencia al epitelio intestinal y la inducción de respuestas inflamatorias e inmunes en el portador. Entre dichas respuestas están la síntesis y liberación de citocinas, incluida la activación de la vía de señalización IL-23/IL-17, lo cual lleva a la progresión de CCR. Por lo tanto, la F. nucleatum juega un papel importante en la carcinogénesis colorrectal y podría ser abordada para la prevención y tratamiento de CCR en el futuro.
FinanciaciónLos autores declaran que no recibieron financiación alguna con relación a este proyecto de investigación.
AutoríaH. Cuellar-Gómez diseñó y realizó la investigación y realizó el borrador del manuscrito; M.E. Ocharán-Hernández diseñó la investigación, contribuyó al análisis, y C. C. Calzada-Mendoza y D.A. Comoto-Santacruz supervisaron la investigación y contribuyeron al análisis.
Conflicto de interesesLos autores declaran no tener conflicto de intereses.
H. Cuellar-Gómez agradece y reconoce la beca del CONACyT para realizar sus estudios de posgrado.
Véase contenido relacionado en DOI: 10.1016/j.rgmx.2022.01.005, Valdovinos-Diaz M.A. Fusobacterium nucleatum en el carcinoma colorrectal: ¿asociación o causalidad?. Rev Gastroenterol Mex.2022;87:275–276.