Se sabe que Helicobacter pylori (H. pylori) es capaz de provocar inflamación crónica de la mucosa gástrica, que progresa lentamente a través de las etapas premalignas hasta llegar al adenocarcinoma gástrico (ACG) localizado; su pronóstico está estrechamente relacionado con la etapa en la que realiza el diagnóstico. El propósito de este estudio es determinar el costo-beneficio mediante la comparación de la esofagogastroduodenoscopia, la detección de pepsinógeno en suero o no realizar ningún cribado.
Material y métodosUtilizando cadenas de Markov y simulación de Monte Carlo se simularon los costos y los efectos de varias modalidades de detección para analizar el costo-beneficio obtenido de cada una. Para nuestra población, utilizamos los datos publicados de pacientes con cáncer gástrico, aplicables a la población mexicana.
ResultadosLos resultados se informaron en proporciones incrementales de costo-efectividad. La mejor estrategia fue buscar pepsinógeno en suero, seguido de una prueba de estrategia de examen endoscópico con vigilancia continua cada 3 años.
ConclusionesLa detección de pepsinógeno en suero, así como la detección endoscópica dirigida (y la vigilancia continua, si es necesario) para el cribado de ACG podría ser una intervención rentable en México a pesar de una prevalencia general de la enfermedad de baja a moderada.
Helicobacter pylori (H. pylori) is known to be capable of causing chronic inflammation of the gastric mucosa that slowly progresses through the premalignant stages, reaching localized gastric adenocarcinoma (GAC). Its outcome is closely related to the stage at which diagnosis is made. The aim of the present study was to determine cost-benefit by comparing esophagogastroduodenoscopy, serum pepsinogen detection, and no screening at all.
Material and methodsUtilizing Markov chains and Monte Carlo simulation, the costs and effects of various detection modalities were simulated to analyze the cost-benefit of each strategy. For our population, we used the published data of patients with gastric cancer, applicable to the Mexican population.
ResultsThe results were reported as incremental cost-effectiveness ratios. The best strategy was serum pepsinogen determination, followed by the strategy of endoscopic examination with continued monitoring every 3 years.
ConclusionsThe performance of serum pepsinogen serology and directed endoscopic examination (and continued monitoring, if necessary) for GAC screening could be a cost-effective intervention in Mexico, despite the low-to-moderate general prevalence of the disease.
El cáncer gástrico es la quinta neoplasia maligna más común y la tercera causa de muerte relacionada con cáncer en todo el mundo1,2. Actualmente, existen zonas del mundo donde la incidencia y mortalidad por adenocarcinoma gástrico (ACG) son particularmente altas, como en el caso de Asia Oriental, particularmente Corea, Mongolia y Japón, Europa del Este y países de Latinoamérica, como Chile, Costa Rica y Colombia3. En México, en el año 2017, las neoplasias malignas ocuparon el tercer lugar como causa de muerte, después de las enfermedades del corazón y diabetes mellitus4, así como el segundo lugar en el grupo de edad comprendido entre los 45 y los 64 años, después de la diabetes mellitus, comprendiendo, a su vez, el cáncer de estómago el segundo lugar de todas las neoplasias dentro de ese grupo de edad. Se establece que el ACG se desarrolla siguiendo un proceso de carcinogénesis de múltiples etapas. Dentro de este proceso, Helicobacter pylori (H. pylori) es capaz de provocar inflamación crónica de la mucosa gástrica, que progresa lentamente a través de las etapas premalignas de gastritis atrófica, metaplasia intestinal (MI) y displasia, hasta llegar al ACG localizado, para posteriormente diseminarse localmente y a distancia5. Su pronóstico está estrechamente relacionado con la etapa en la que se realiza el diagnóstico. La detección permite la detección de cáncer gástrico en etapas tempranas de carcinoma limitado solo a la mucosa o submucosa, con oportunidad de resecciones curativas; esto suele ser accesible mediante tratamiento endoscópico, como la disección endoscópica de la submucosa. Existen además intervenciones pobremente exploradas, como la estrategia de cribado mediante la medición de pepsinógeno en suero para detectar atrofia gástrica (AG), la cual podría resultar de utilidad para la prevención y el diagnóstico temprano del cáncer gástrico. En países con un riesgo intermedio de cáncer gástrico, la decisión sobre la detección endoscópica es menos clara y se necesitan análisis económicos para definir la mejor estrategia en términos de beneficio para la salud y uso de recursos económicos6,7.
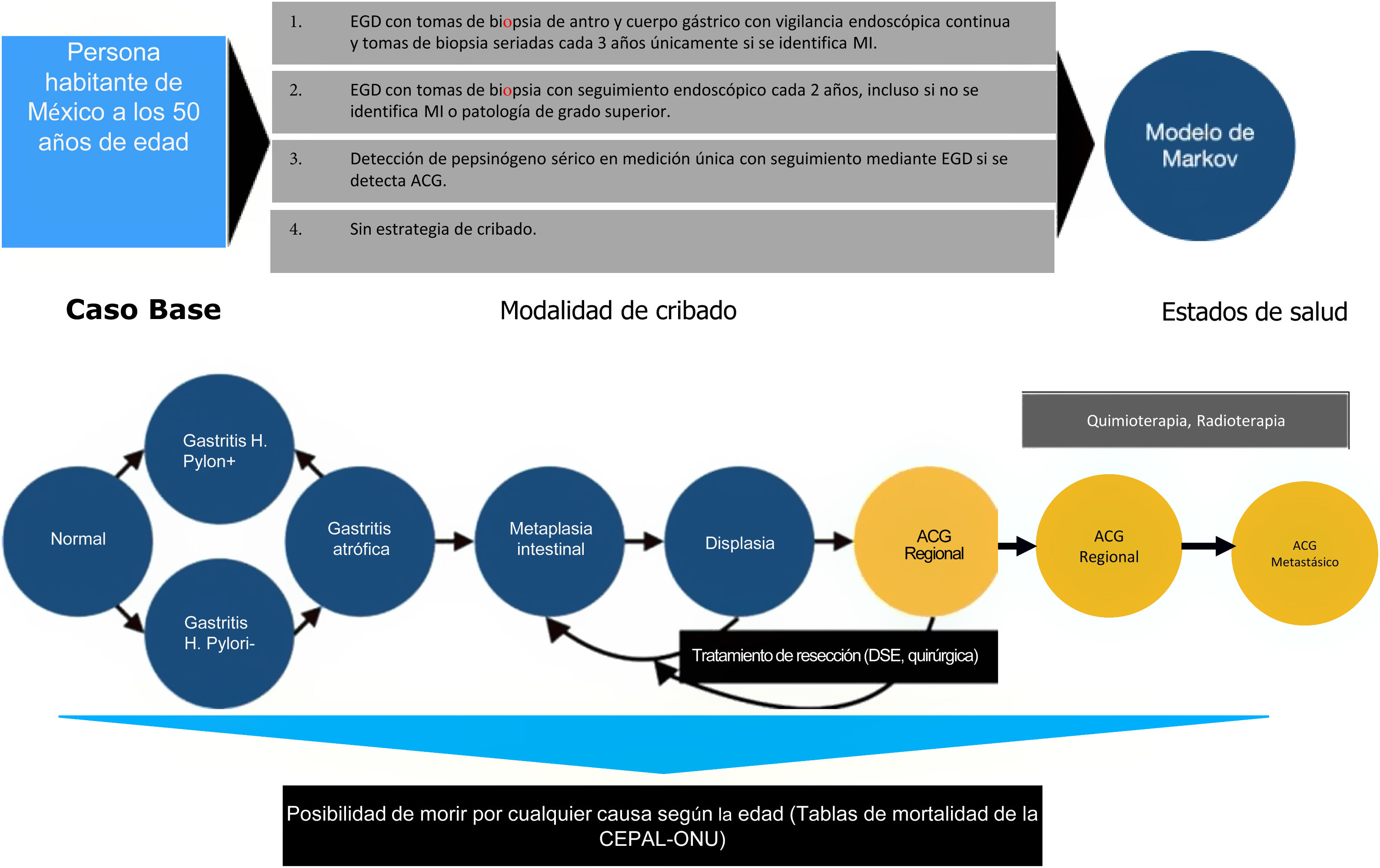
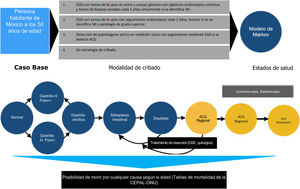
Materiales y métodosSe realizó un estudio de análisis económico del tipo análisis de costo-efectividad. Al ser un análisis de costo-beneficio, no se requiere población de estudio, se simuló un escenario base para el cribado de ACG a los 50 años de edad para la población mexicana. Los criterios de selección fueron los siguientes.
Criterios de inclusión:
- –
Artículos publicados en revistas indexadas.
- –
Publicaciones accesibles en las bases de datos de PubMed/MEDLINE, Ovid, Embase y Cochrane.
- –
Artículos en idiomas inglés y español.
- –
Artículos con las palabras clave y términos MeSH «Costs and cost analysis, Cost analysis, Early detection of cancer, Endoscopy procedures, Esophagogastroduodenoscopy, Gastrointestinal endoscopy, Gastric cancer, Helicobacter pylori, Markov chains, Neoplasm, Precancer, Preneoplasia, Pepsinogen, Standard direct cost, Stomach neoplasm» y sus equivalentes en español.
Criterios de exclusión:
- –
Artículos con datos epidemiológicos no aplicables a la población blanco.
- –
Documentos escritos en otro idioma que no sean español o inglés.
Los datos para las variables se obtuvieron de los datos de literatura publicada en revistas indexadas en inglés y español, las estadísticas del Instituto Nacional de Estadística y Geografía (INEGI) y los costos de «Costos unitarios por nivel de atención médica» del Instituto Mexicano del Seguro Social (IMSS), actualizados en 2019, publicado en el Diario Oficial de la Federación el 28 de diciembre del 20178, información obtenida a través de las páginas oficiales de Internet de las diferentes instituciones, y obtención de artículos en bases de datos: PubMed/MEDLINE, Ovid, Embase y Cochrane. Se hará el vaciado de variables en el programa Microsoft® Excel para Mac versión 16.22, para su posterior análisis y construcción de modelo estadístico utilizando el software TreeAge Pro 2019 R1.1 (TreeAge, Williamstown, MA, EE. UU.).
Se utilizó una simulación matemática de la historia natural del ACG, mediante el desarrollo de un modelo de proceso de decisión de transición de estado de Markov. El modelo de Markov fue desarrollado con base en la adaptación de modelos publicados previamente por otros autores, tomando como base los datos publicados aplicables a la población hispana, debido a la limitada cantidad de recursos en torno a la población de México9-11. Todos los individuos se incluían en el modelo a los 50 años con la posibilidad de transicionar entre diferentes estados de salud dependiendo de las diferentes probabilidades designadas para cada evento. Los diferentes estados de salud incluyeron: mucosa gástrica normal, gastritis (con o sin infección concomitante por H. pylori), AG, MI, displasia, ACG localizado asintomático (resecable), ACG regional asintomático, ACG metastásico asintomático, ACG localizado sintomático (resecable), ACG regional sintomático, ACG metastásico sintomático y muerte.
Comparando las estrategias con la no utilización de ninguna prueba de detección para ACG, evaluamos las siguientes estrategias de cribado de inicio a la edad de 50 años (dado que la mayor parte de los casos en el país se diagnostican en etapas avanzadas después de los 55 años)12:
- 1.
Endoscopia superior (esofagogastroduodenoscopia [EGD]) con tomas de biopsia de antro y cuerpo gástrico con vigilancia endoscópica continua y tomas de biopsia seriadas cada 3 años únicamente si se identifica MI (o manejo de resección de la lesión si se diagnostica una enfermedad más grave).
- 2.
EGD con tomas de biopsia con seguimiento endoscópico cada 2 años, incluso si no se identifica MI o enfermedad de grado superior.
- 3.
Detección de pepsinógeno en suero.
Se simuló una cohorte hipotética de individuos de 50 años en un horizonte temporal de 30 años con ciclos de un año de duración. La costo-eficacia de cada uno de los 4 algoritmos de detección descritos anteriormente se informó desde la perspectiva de la atención médica pública. Las medidas de resultados se informaron en términos de relaciones de costo-efectividad incrementales (RCEI o ICER por sus siglas en inglés; USD del 2019 por años de vida ajustados a calidad [AVAC] o QALY por sus siglas en inglés), con un umbral de disposición a pagar de $ 9,000 USD/QALY. No existe un consenso sobre la determinación de disposición a pagar en algún país, en EE. UU. por lo general se utiliza la disposición a pagar de $ 100,000 USD/QALY.
Análisis estadísticoSe realizó un análisis probabilístico de sensibilidad de Monte Carlo con 10,000 iteraciones utilizando distribuciones gamma para costos y distribuciones beta para probabilidades de transición y utilidades.
Consideraciones éticasAl tratarse de un estudio de análisis económico basado en datos epidemiológicos y de costos disponibles al público en general, y según la declaración de Helsinki I, 29.ª asamblea de la Asociación Médica Mundial (AMM) (Tokio, 1975), Helsinki II enmendada en la 35.ª AMM (Venecia, 1983) y 41.ª AMM (Hong-Kong, 1989), no fue requerida la aprobación de algún comité de ética.
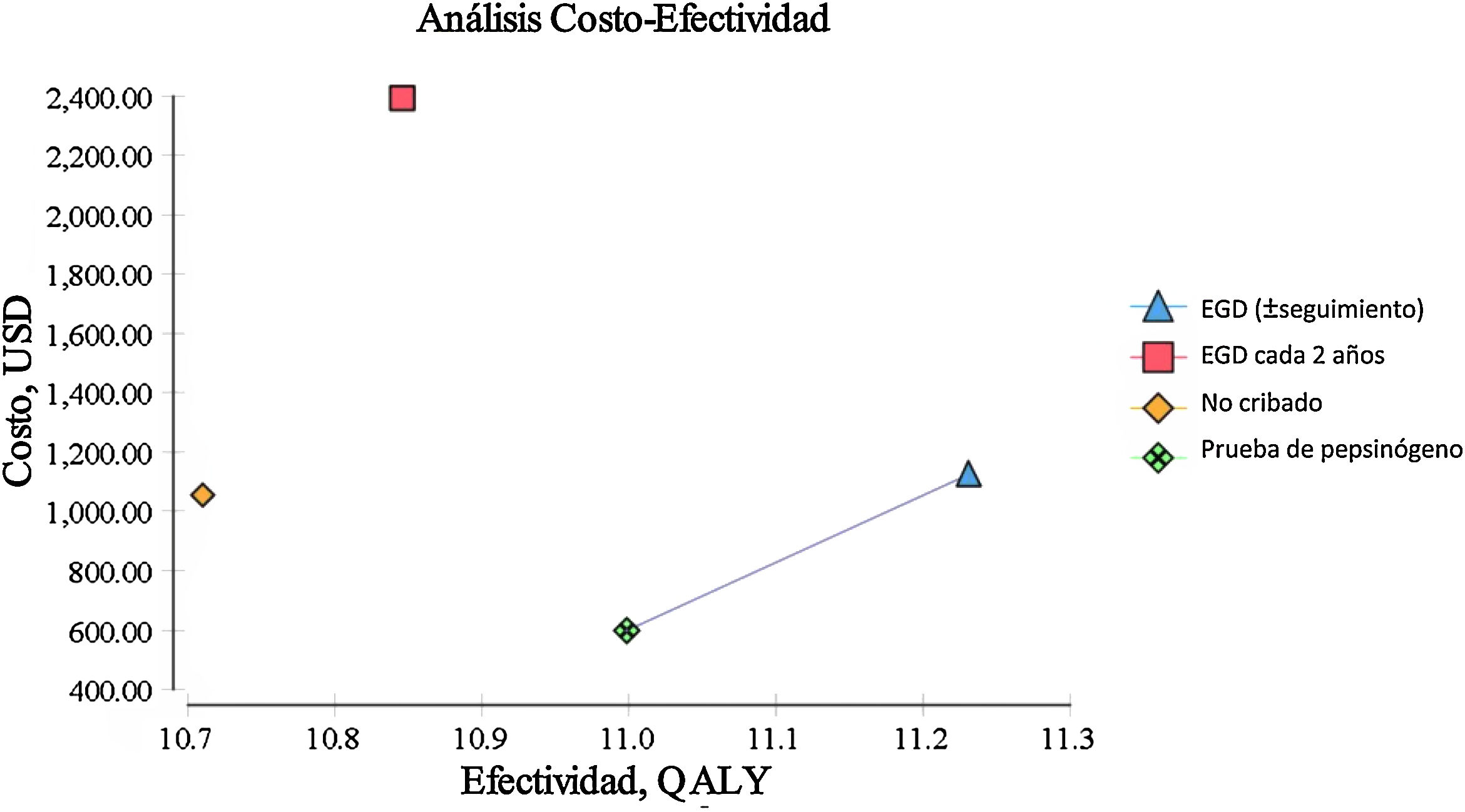
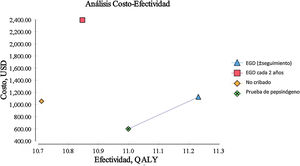
ResultadosEl examen endoscópico con vigilancia continua cada 3 años resultó costo-eficaz con una RCEI de 129.23/AVAC y un costo acumulado de $ 1,123.66, el cual resulta ligeramente mayor que el costo acumulado de la estrategia actual de no cribado de $ 1,056.25. La estrategia de búsqueda de pepsinógeno en suero para detectar AG tuvo una RCEI de $ –1,589.59/AVAC y un costo acumulado de $ 596.76, resultando menor que el de no cribado. La estrategia anterior presenta un fenómeno de dominancia sobre el no cribado en la población general.
El examen endoscópico repetido de manera bianual dio como resultados una RCEI de $ 9,798.85/AVAC y un costo acumulado de $ 2,391.30. Todas las estrategias mencionadas fueron comparadas de manera individual con la política actual de no cribado para cáncer gástrico, esto se resume en la tabla 1, en donde vemos que el RCEI está reportado en USD por AVAC; el RCEI podría no calcularse directamente a causa del redondeo aplicado. Todas las intervenciones fueron comparadas de forma individual con la estrategia de no cribado. AVAC y costos descontados al 3% anual. USD: dólares estadounidenses. AVAC: años de vida ajustados a calidad. RCEI: relación costo efectividad incremental: definido como el costo adicional de una estrategia específica dividido por su beneficio clínico adicional o efectividad incremental, en comparación con la estrategia de no cribado. (tabla 1) (fig. 1).
Análisis detallado del RCEI en la utilización de alguna técnica de cribado para ACG comparado con el no cribado
| Modalidad de cribado | Costo acumulado (USD) | Costo adicional (USD) | Efectividad (AVAC) | Efectividad incremental (AVAC) | RCEI (USD/AVAC) |
|---|---|---|---|---|---|
| No cribado | 1,056.25 | – | 10.7 | – | – |
| EGD (± seguimiento) | 1,123.66 | 67.41 | 11.22 | 0.52 | 129.23 |
| EGD cada 2 años | 2,391.3 | 1,335.05 | 10.84 | 0.14 | 9,798.85 |
| Prueba de pepsinógeno | 596.76 | 459.49 | 10.99 | 0.29 | 1,589.59 |
ACG: adenocarcinoma gástrico; AVAC: años de vida ajustados a calidad; EGD: esofagogastroduodenoscopia; RCEI: relación costo-efectividad incremental (definido como el costo adicional de una estrategia específica dividido por su beneficio clínico adicional o efectividad incremental, en comparación con la estrategia de no cribado); USD: dólar estadounidense.
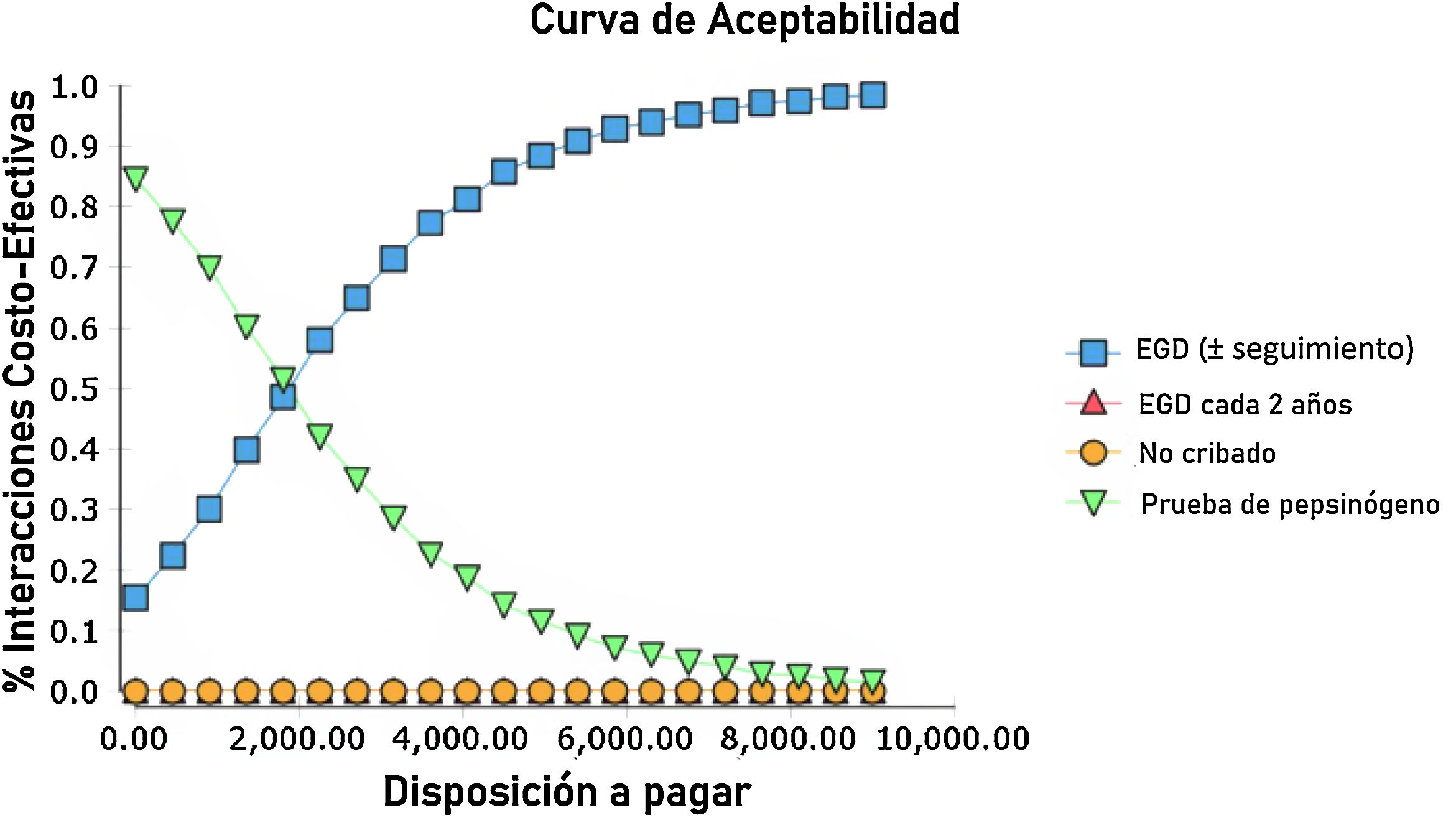
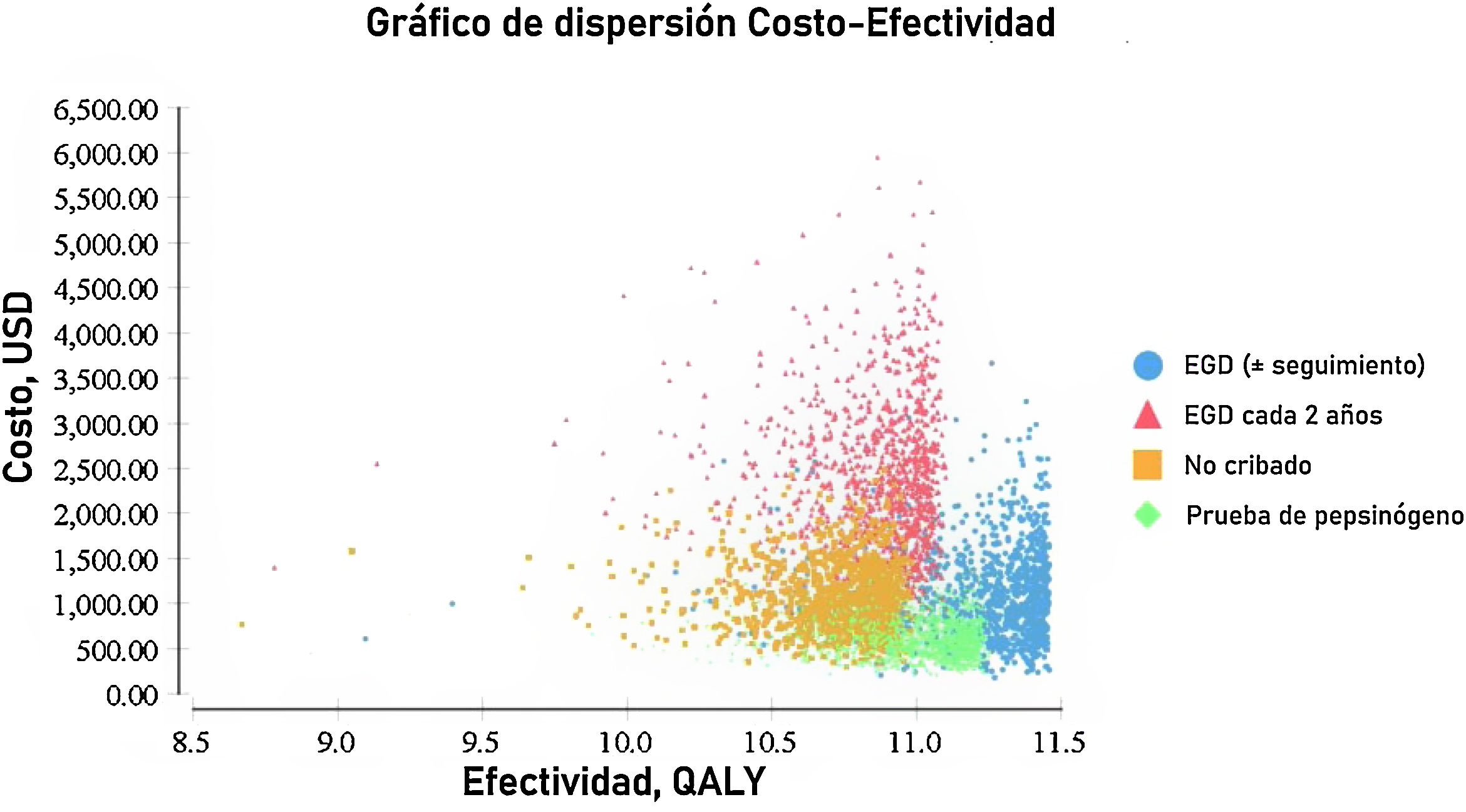
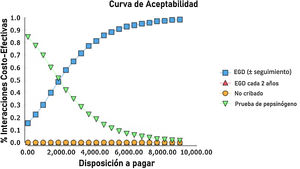
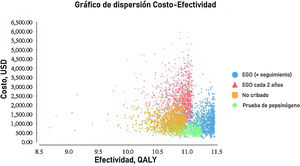
El análisis probabilístico de sensibilidad se derivó de la realización de 10,000 iteraciones en una simulación Monte Carlo para el modelo de Markov (fig. 1). Se generaron curvas de aceptabilidad del costo-efectividad con base en una disposición a pagar de $ 9,000 USD/AVAC, así como gráficos de dispersión para cada una de las estrategias (figs. 2 y 3).
Para nuestro escenario base de una persona sana, asintomática, originario de México, de 50 años de edad, tanto el examen endoscópico de ACG con vigilancia continua para la MI (o el manejo de lesiones más avanzadas con vigilancia posterior) como la prueba de pepsinógeno en suero resultaron costo-eficaces en el umbral predeterminado de disposición a pagar de $ 9,000/AVAC.
La única estrategia de nuestro análisis que no resultó costo-eficaz, para las variables y costos determinados con base en la población mexicana, fue el examen endoscópico repetido de manera bianual, ya que excede el umbral predeterminado de disposición a pagar de $ 9,000/AVAC y las cifras del actuar actual de no cribado.
Los resultados de la simulación Monte Carlo basado en el modelo de Markov mostraron que la estrategia que resultó con mejor costo-eficacia fue la búsqueda de pepsinógeno en suero, seguida de la prueba de la estrategia de examen endoscópico con vigilancia continua cada 3 años; ambas presentaron una costo-eficacia significativa con la disposición a pagar de $ 9,000 USD/AVAC, presentado costos inferiores a esto en el 100% de las iteraciones de la simulación Monte Carlo. La estrategia de examen endoscópico bianual resultó costo-eficaz en el 52% de las iteraciones de dicha simulación (fig. 4).
Descubrimos que incluso en México, siendo un país con prevalencia mucho menos elevada que la de algunos países asiáticos, realizar esfuerzos de detección endoscópica de lesiones malignas y premalignas o la detección serológica de pepsinógeno es una posibilidad rentable13,14. Cuando se selecciona a individuos en alto riesgo en la etapa asintomática (correspondiente al grupo de edad seleccionado en nuestro estudio) existe una mayor probabilidad de diagnóstico temprano de ACG susceptible de resección curativa.
La implementación de programas nacionales de cribado para ACG en países como Japón y Corea del Sur se ha correlacionado con un beneficio de mortalidad significativo. En tales países, la supervivencia general a 5 años es del 60 al 70% (y del 90 al 95% para el cáncer gástrico temprano) en comparación con el 20 al 30% antes de la implementación de tales estrategias, que son las cifras actuales en países como EE. UU. y México, donde no existen estrategias de cribado establecidas13,15,16.
Dado que las prácticas actuales de detección de cáncer gástrico en Japón y Corea del Sur incluyen endoscopia superior bianual, incluimos esto como una de las estrategias en nuestro modelo16; sin embargo, no resultó costo-eficaz en nuestra población, probablemente debido a la menor incidencia de ACG en nuestra población general y al mayor costo, producto de intervenciones repetidas en toda la población seleccionada.
Al igual que con cualquier modelo de proceso de decisión, la incidencia y la prevalencia de los estados de enfermedad y las tasas estimadas de progresión influyen en los resultados. Dada la escasa evidencia epidemiológica, la gran variabilidad de resultados y las tasas de progresión no bien descritas para la población mexicana, las tasas estimadas de progresión entre los estados de salud de nuestro estudio se encuentran basadas en publicaciones realizadas en EE. UU. enfocadas en la población hispana de dicho país, que no representa con precisión la incidencia y la progresión de la enfermedad, por ejemplo, la incidencia reportada en EE. UU. es de 13.3 casos por cada 100,000 habitantes en ese grupo étnico, mientras que datos de la Organización Mundial de la Salud reportan en México la incidencia de la enfermedad en la población mayor de 50 años es de 25 casos por cada 100,000 habitantes y de 5.8 en la población general, sin establecer un grupo de edad específico. Otra limitación de nuestro modelo es la contemplación de únicamente costos directos de atención médica sin incluir otros costos indirectos que podrían afectar de forma positiva a la costo-eficacia, que además fueron obtenidos de los «Costos unitarios por nivel de atención médica» del IMSS, con el objetivo de proveer una perspectiva en el ámbito de la salud pública y al ser la fuente de costos médicos más estandarizada en la salud pública de nuestro país con mayor variedad de procedimientos e intervenciones por nivel de atención. Sin embargo, cabe mencionar las ventajas de este estudio, incluido el detalle en el modelo de Markov, que considera manejo terapéutico y vigilancia continua después del mismo durante horizonte de tiempo de 30 años, acompañado de análisis probabilísticos y de sensibilidad que toman en cuenta la heterogeneidad presente en la literatura y la incertidumbre en las tasas de progresión en la historia natural de la enfermedad. Adicionalmente, se tomaron en cuenta la tasa de complicaciones endoscópicas y quirúrgicas, la probabilidad de no detectar las lesiones por medio de EGD o la determinación de pepsinógeno sérico y el riesgo de recurrencia después de la resección del cáncer gástrico temprano.
ConclusiónEncontramos que la detección de pepsinógeno en suero, así como la detección endoscópica dirigida (y la vigilancia continua, si se indica) para el cribado de ACG podría ser una intervención costo-efectiva en México a pesar de una prevalencia general de baja a moderada de la enfermedad. Debido a la disponibilidad de técnicas quirúrgicas curativas, así como a la creciente disponibilidad de opciones endoscópicas, el ACG es ahora una enfermedad potencialmente curable cuando se diagnostica en etapas tempranas. Así mismo es importante tener en cuenta que por medio de este no es posible detectar el cáncer gástrico de tipo difuso, el cual tiene mayor prevalencia en zonas urbanas. Además, en zonas no urbanizadas la medición del pepsinógeno es más difícil por falta de acceso al reactivo, lo que limita la detección del ACG, el cual es más prevalente en dichas zonas.
FinanciaciónEsta investigación no recibió ninguna subvención específica de agencias de financiamiento en los sectores público, comercial o sin fines de lucro.
Conflicto de interesesLos autores declaran que no existe ningún conflicto de intereses.