La endoscopia es el método más efectivo para identificar el adenocarcinoma gástrico (ACG). El cáncer gástrico de intervalo (CGI) es aquel ACG diagnosticado de 2 a 3 años posteriores a una endoscopia normal. Las características de esta entidad son desconocidas en nuestro medio. Se evaluaron características clínicas, histopatológicas, endoscópicas, tasa de presentación, consumo de inhibidores de bomba de protones (IBP) y sobrevida del CGI, y se comparó con los otros ACG.
MétodosEstudio retrospectivo analítico de cohorte prospectiva, realizado entre enero de 2012 y junio de 2018; evaluó 513 pacientes con ACG manejados en esta institución que tenían la endoscopia del diagnóstico de ACG y una endoscopia negativa para tumor en los últimos 3 años.
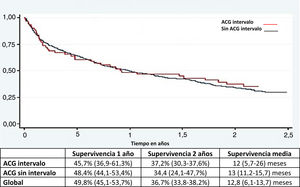
ResultadosSe evaluaron 513 pacientes con diagnóstico de ACG, 42 eran CGI (8.2%): 9 lesiones tempranas y 33 avanzados (79%). Los CGI fueron más pequeños (31 vs. 41mm; p<0.01), más planos y deprimidos (p<0.01), no tuvo asociación con el uso de IBP, pero sí con el antecedente de gastrectomía y anastomosis (p=0.02) y con la ausencia de signos de alarma (p<0.003). La localización más frecuente fue el cuerpo gástrico (52%) y el antro (26%). La supervivencia global a 2 años fue similar entre CGI y ACG (37.1 vs. 39.3%; p=0.72).
ConclusiónEl CGI representó el 8.2% de los ACG recién diagnosticados. La presencia de anastomosis y la ausencia de signos de alarma se relacionaron con CGI. La supervivencia global fue pobre y no tuvo diferencia con los otros ACG detectados.
Endoscopy is the most effective method for identifying gastric adenocarcinoma (GAC). Interval gastric cancer (IGC) is GAC that is diagnosed 2–3 years after a normal endoscopy. Its characteristics are unknown in the Colombian environment. The clinical, histopathologic, and endoscopic characteristics were evaluated, along with the presentation rate, proton pump inhibitor (PPI) use, and IGC survival rate, and compared with other types of GAC.
MethodsA retrospective, analytic study was conducted on a prospective cohort. It evaluated 513 patients with GAC treated at our institution, within the time frame of January 2012 and June 2018. The patients had endoscopic diagnosis of GAC and endoscopy within the past three years that was negative for tumor.
ResultsA total of 513 patients diagnosed with GAC were evaluated. Forty-two of the patients had IGC (8.2%): 9 early lesions and 33 advanced lesions (79%). The IGCs were smaller (31 vs. 41mm; P<.01), as well as flatter and more depressed (P<.01). There was no association with PPI use, but there was an association with a history of gastrectomy and anastomosis (P=.02), as well as the absence of red flags (P<.003). The most frequent locations were the gastric body (52%) and the antrum (26%). Overall two-year survival was similar between IGC and GAC (37.1 vs. 39.3%, P=.72).
ConclusionA total of 8.2% of recently diagnosed GAC were cases of IGC. The presence of anastomosis and the absence of red flags were related to IGC. Overall survival was poor and there were no differences from the other types of GAC detected.
Según cifras de GLOBOCAN de 2020, el adenocarcinoma gástrico (ACG) es el sexto cáncer más común y la tercera causa de muerte por cáncer en el mundo1. En Colombia a pesar de los grandes avances en técnicas de diagnóstico y tratamiento, la enfermedad frecuentemente es diagnosticada en estados avanzados y solo el 30% de los casos son candidatos para un tratamiento curativo2,3. Inversamente, se han informado de tasas de supervivencia a 5 años superiores al 70% para la enfermedad localizada o temprana en países orientales, principalmente con programas de detección temprana de la población4; esto enfatiza la importancia del diagnóstico temprano, pero que dependerá del riesgo local.
La esofagogastroduodenoscopia (EGD) con biopsia es la principal herramienta para detectar el ACG5; sin embargo, no siempre encuentra los cánceres existentes y su tasa de fallas ha sido examinada en varios estudios6. En 2014, un metaanálisis de Menon et al., encontraron que en el 11.3% se omite el diagnóstico de cáncer del tracto gastrointestinal superior en la EGD7.
Diferentes autores definen los ACG pasados por alto o cáncer gástrico de intervalo (CGI) como aquellos no diagnosticados mediante la EGD realizada dentro de los 3 años anteriores al diagnóstico; esto se basa en la hipótesis de que el AGC tiene un tiempo de duplicación de 2 a 3 años8. Sin embargo, estudios japoneses más recientes sugieren que estos tiempos varían de acuerdo a lo avanzado de la enfermedad, pasando de 16.6 meses para las lesiones tempranas a 7.6 meses para las más avanzadas9,10. En base a esta evidencia, diferentes estudios han investigado la tasa de CGI dentro de los 2, hasta 5 años previos al diagnóstico, encontrando tasas muy amplias entre el 4.6 y el 25.8%11–14.
Estrictamente hablando, el término de cáncer de intervalo se aplica para las lesiones neoplásicas no detectadas en el curso de un programa de tamización en poblaciones de riesgo, como los implementados en occidente para cáncer colorrectal (CCR) o los que se hacen en Corea o Japón para el cáncer gástrico. Así que este término no tendría cabida para las lesiones encontradas por fuera de estos programas, luego aquellas lesiones pasadas por alto en las endoscopias, más frecuentemente de carácter diagnóstico, en forma más pertinente y descriptiva deberían ser denominadas cáncer gástrico inadvertido o postendoscopia.
El término «cáncer gástrico de intervalo» se acuñó en Corea y Japón, donde tienen establecidos programas de detección de cáncer gástrico a nivel nacional. Para los médicos occidentales, el CCR de intervalo puede ser un término correspondiente más familiar15. Actualmente, se reconoce que una baja calidad de la colonoscopia es el factor más importante para la presentación del CCR de intervalo16, lo que se ha querido extrapolar al CGI y la EGD. La tasa exacta de ACG no diagnosticado o inadvertido durante las endoscopias no se ha establecido, estudios en Japón describen cifras altas del 25.8%12, en Reino Unido del 2.3 al 14%17, en Australia del 0.41%18, en EE. UU. del 5.5 al 11.5%19 y el 0.2% en Corea20, sin embargo, no se han precisado cuáles factores inducen al error al momento de diagnosticar un ACG, y son escasas y poco estandarizadas las publicaciones con las técnicas correctas para realizar una endoscopia de alta calidad y evitar su presentación.
El CGI es más común en tumores localizados en la parte media del estómago y en tumores con carcinoma indiferenciado20. Informes anteriores revelaron que el CGI era más frecuente en las series radiológicas gastrointestinales superiores en comparación con los estudios de endoscopia21.
El CGI incluye tanto las lesiones no vistas como las lesiones latentes. Las lesiones pasadas por alto se pueden disminuir con un examen meticuloso, como la cromoendoscopia y/o una nueva EGD con imágenes mejoradas y con una buena toma de biopsias, mientras que el desarrollo de lesiones latentes puede ser inevitable. El tratamiento antes del procedimiento con enzimas proteolíticas para evitar el moco, es otra opción para mejorar la visibilidad a la endoscopia22, aunque recientemente esto se ha cuestionado23 y su implementación no es rutinaria en los servicios de endoscopia. El control de calidad también es un problema. La experiencia del endoscopista puede influir en el desarrollo de CGI y estos deben estar atentos para evitar los puntos ciegos. Actualmente, la Sociedad Coreana de Endoscopia Gastrointestinal recomienda 8 imágenes estándar para tomar en la EGD que incluye solo 4 imágenes del estómago. Inicialmente, esto fue sugerido por las pautas europeas24.
El programa de tamizaje de Corea encontró que la atrofia de fondo y la metaplasia intestinal (MI) del estómago estaban relacionadas con el desarrollo de CGI. Es plausible que la irregularidad de la mucosa gástrica en la MI impida que los endoscopistas detecten un cáncer gástrico temprano25, por lo que cobran valor técnicas como la cromoendoscopia digital o vital, magnificación y un seguimiento más estrecho.
Los objetivos de este estudio son: 1) Determinar la tasa de cáncer gástrico de intervalo, 2) Establecer características demográficas de estos pacientes, 3) Evaluar sus características endoscópicas e histológicas y 4) Determinar la supervivencia del CGI, y compararlo con los otros ACG sin endoscopias previas negativas para neoplasia.
Materiales y métodosEstudio de la población y procedimientosSe evaluaron todos los pacientes con cáncer gástrico en el escenario de la consulta de uno de los autores entre enero de 2012 y julio de 2018. El criterio de inclusión fue el hallazgo de pacientes con diagnóstico histopatológico de ACG, realizado durante el período de estudio y contar con un año de seguimiento del paciente.
Criterios de exclusión fueron: una EGD incompleta o con un hallazgo anormal que sugiriera una neoplasia no corroborada por la biopsia.
Se revisó la historia clínica física y electrónica de todos los sujetos con ACG, incluyendo EGD negativas previas realizadas en otras instituciones.
Se evaluaron los aspectos demográficos (edad y sexo) y datos clínicos; la indicación de la EGD (disfagia, hematemesis, melena, vómitos y síndrome constitucional se consideraron síntomas de alarma); antecedentes de terapia con inhibidores de la bomba de protones (IBP) en los últimos tres meses, tanto para los pacientes con CGI como los pacientes con ACG sin endoscopia previa negativa; las características endoscópicas: tamaño de la lesión (en milímetros), presencia de ulceración, localización (unión gastroesofágica, fondo, cuerpo (con la incisura) y antro) y morfología del tumor (depresión, masa plana o sésil) se obtuvieron del informe de la endoscopia. Cuando se disponía de más de una EGD negativa, se seleccionó la más reciente para el análisis, desechando las endoscopias previas para ajustarse a los plazos en tiempo estipulados en los criterios de inclusión.
El subtipo histológico (adenocarcinoma intestinal o difuso) y el grado de diferenciación (indiferenciado, pobre, moderadamente o bien diferenciado) también se obtuvieron de los informes de patología.
La etapa del tumor se determinó según la décima edición del sistema TNM del American Joint Committee on Cancer. La supervivencia global se estableció a partir de la fecha del diagnóstico de ACG y la fecha de la muerte. Los sobrevivientes fueron censados en la fecha de la última visita médica.
Puntos del estudioEl CGI se definió como la proporción de pacientes con ACG que tuvieron una endoscopia negativa dentro de los 36 meses previos al diagnóstico. El objetivo principal fue evaluar la proporción y las características endoscópicas e histológicas del CGI. El objetivo secundario fue evaluar las diferencias en la supervivencia entre el CGI y ACG sin endoscopia previa negativa.
Análisis estadísticoLa media, la desviación estándar, la mediana y el rango se calcularon para las variables continuas, los conteos de frecuencia y los porcentajes para los datos categóricos. Se calcularon los intervalos de confianza (IC) del 95% para las proporciones mediante el método de Wilson. Los datos fueron analizados utilizando métodos paramétricos para datos continuos normalmente distribuidos (prueba t de Student) y métodos no paramétricos (prueba U de Mann-Whitney) para distribuciones continuas no distribuidas normalmente.
Para los datos categóricos se utilizaron las pruebas exactas de Chi-cuadrado y de Fisher. Con el fin de disminuir el riesgo de error de tipo I, solo se incluyeron en el análisis aquellas variables previamente informadas como factores de riesgo para el CGI o con una relación fisiopatológica plausible con CGI.
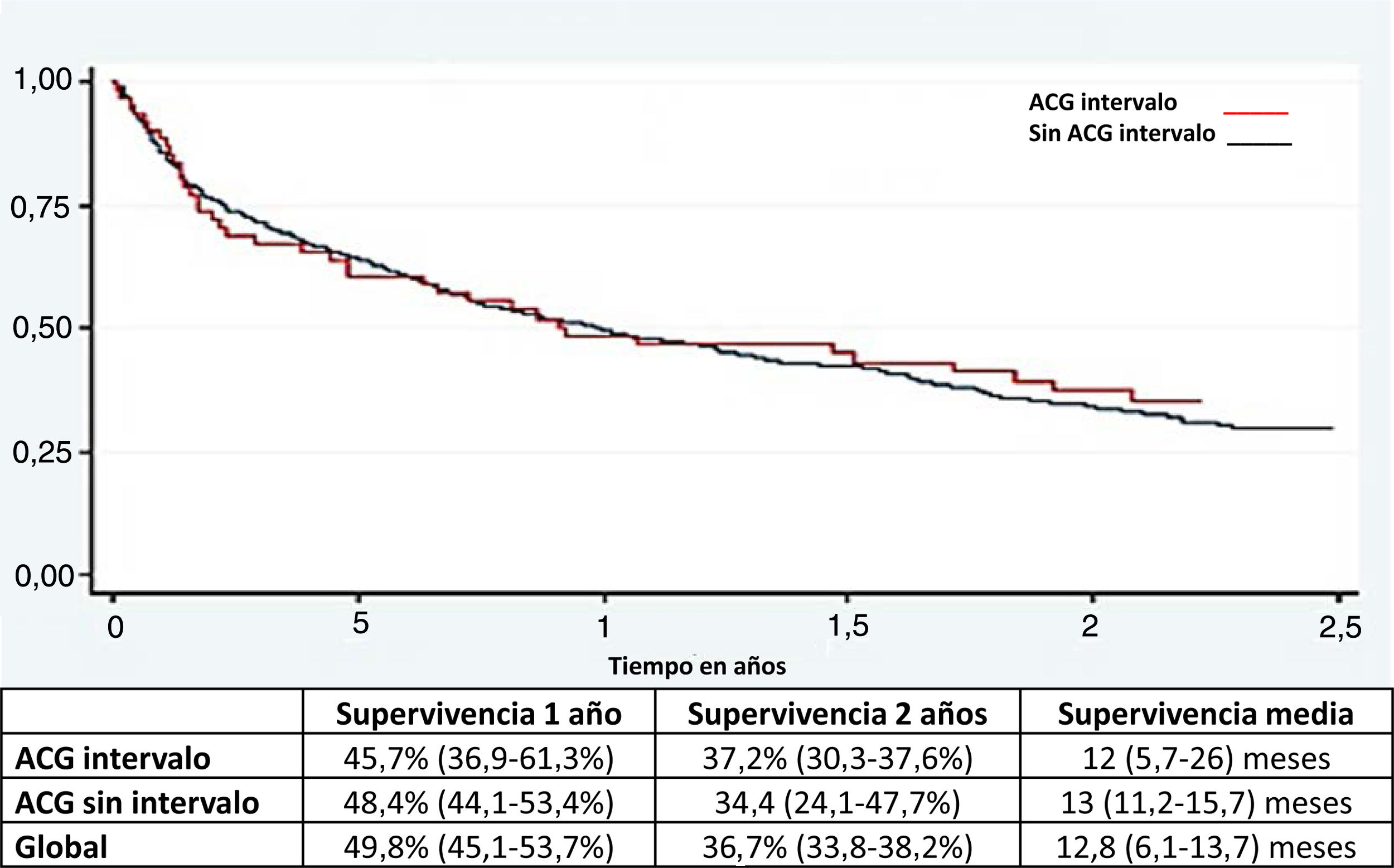
Las probabilidades de supervivencia a uno y 2 años se calcularon para CGI y ACG sin intervalo mediante el método de Kaplan-Meier. La prueba de log rank se utilizó para evaluar las diferencias de supervivencia global. Todos los análisis fueron de bilaterales (de 2 colas) y los valores de p inferiores a 0.05 se consideraron significativos. Todos los cálculos estadísticos se realizaron en la institución promotora, utilizando el software IBM SPSS® versión 24.
Consideraciones ÉticasLa investigación realizada en la institución de cancerología se clasificó de acuerdo con la declaración internacional de Helsinki, el informe de Belmont y la resolución colombiana 8430 de 1993 del ministerio de salud; título II, artículo 11 como una investigación sin riesgos biológicos, fisiológicos, psicológicos, y sociales. Además, se tuvo en cuenta la resolución colombiana 1995 de 1999 por la cual se establecen normas para el manejo de la historia clínica.
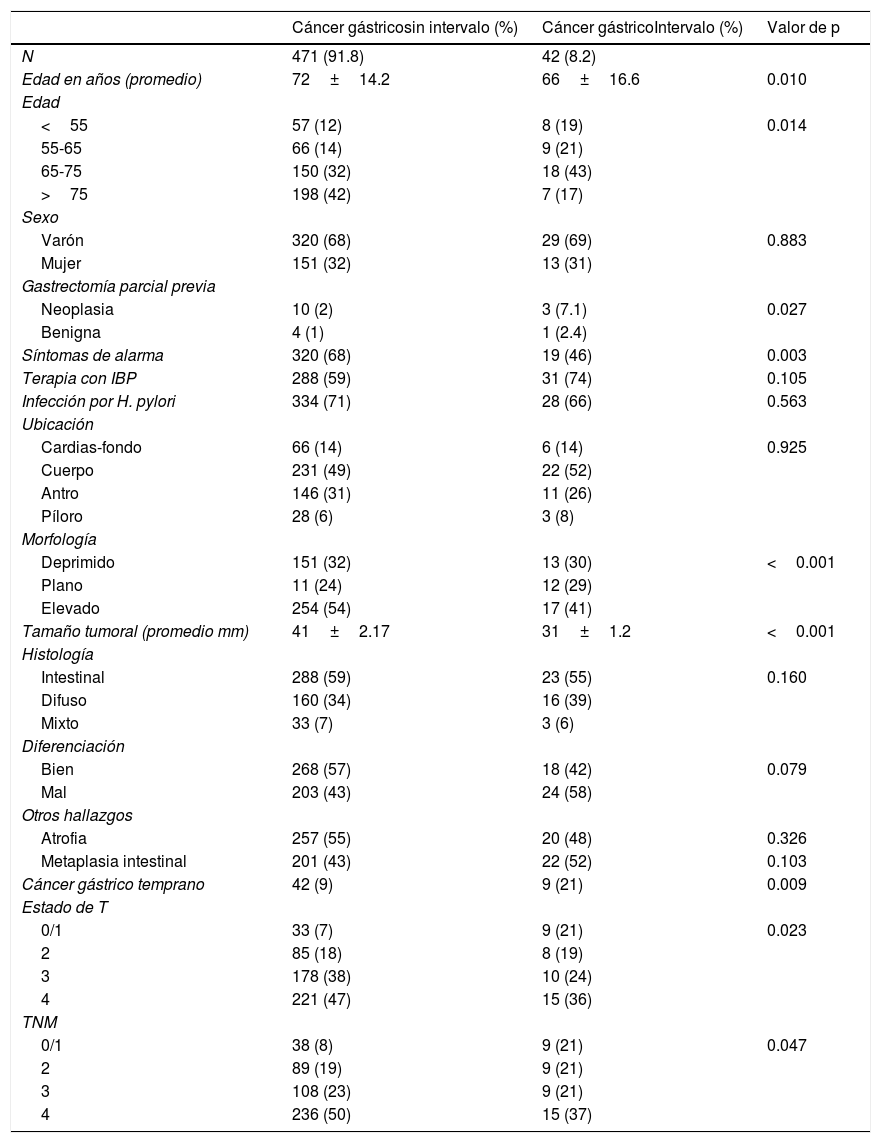
ResultadosDurante los 6.5 años del periodo de estudio, se evaluaron en consulta 631 pacientes con neoplasias gástricas de los cuales 513 eran ACG (81%). La mayoría de ellos eran varones (68%). Se identificó un número total de 42 pacientes con CGI, para una tasa global del 8.2%. La edad media del grupo con ACG detectado fue 72±14.2 años, mientras los de CGI el promedio de edad fue de 66±16.6 años. Las características de los dos grupos de pacientes se recogen en la tabla 1.
Características de los pacientes y proporción de pacientes que se habían sometido a una endoscopia en los 3 años anteriores al diagnóstico de cáncer gástrico
| Cáncer gástricosin intervalo (%) | Cáncer gástricoIntervalo (%) | Valor de p | |
|---|---|---|---|
| N | 471 (91.8) | 42 (8.2) | |
| Edad en años (promedio) | 72±14.2 | 66±16.6 | 0.010 |
| Edad | |||
| <55 | 57 (12) | 8 (19) | 0.014 |
| 55-65 | 66 (14) | 9 (21) | |
| 65-75 | 150 (32) | 18 (43) | |
| >75 | 198 (42) | 7 (17) | |
| Sexo | |||
| Varón | 320 (68) | 29 (69) | 0.883 |
| Mujer | 151 (32) | 13 (31) | |
| Gastrectomía parcial previa | |||
| Neoplasia | 10 (2) | 3 (7.1) | 0.027 |
| Benigna | 4 (1) | 1 (2.4) | |
| Síntomas de alarma | 320 (68) | 19 (46) | 0.003 |
| Terapia con IBP | 288 (59) | 31 (74) | 0.105 |
| Infección por H. pylori | 334 (71) | 28 (66) | 0.563 |
| Ubicación | |||
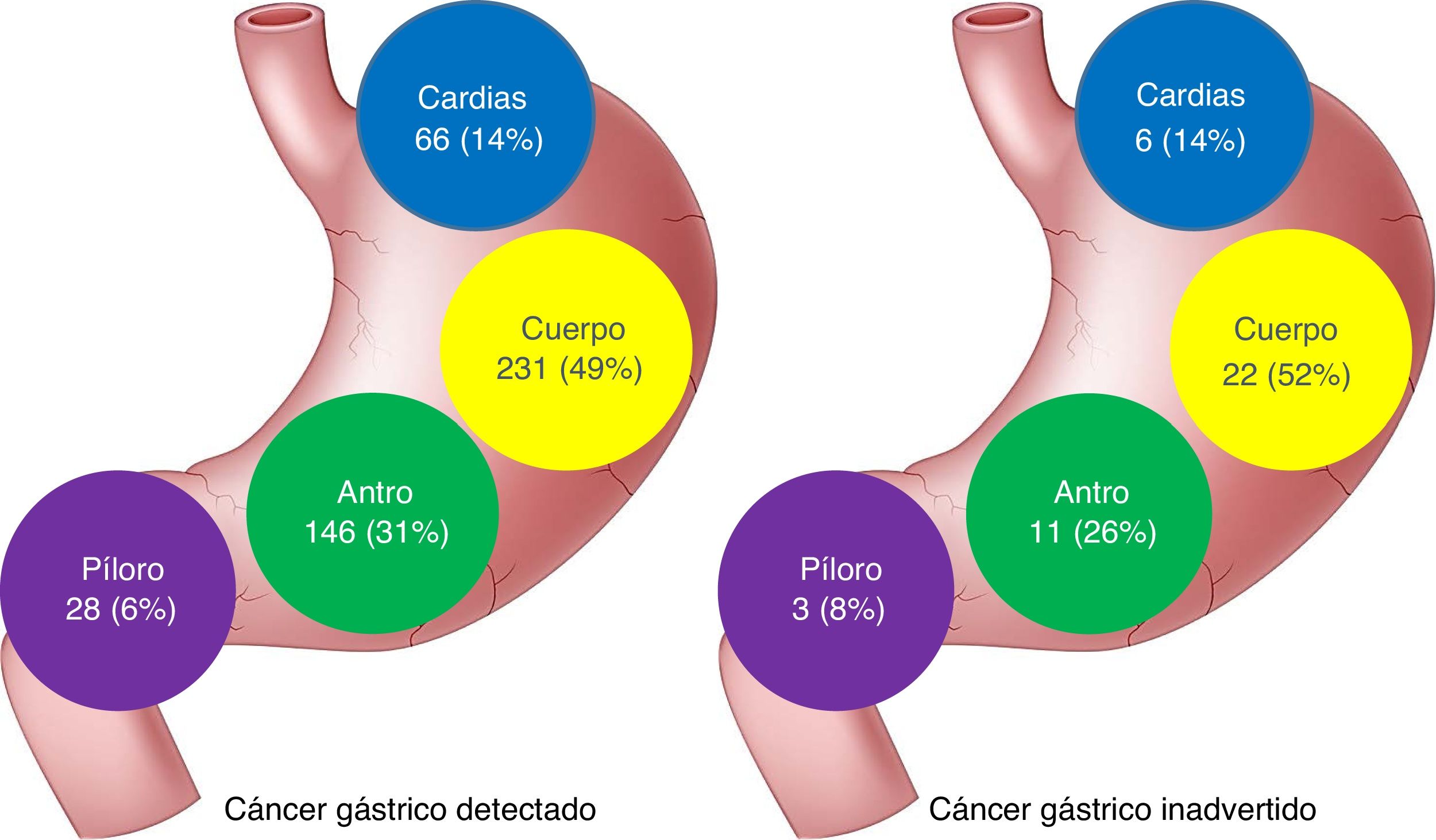
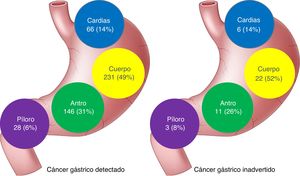
| Cardias-fondo | 66 (14) | 6 (14) | 0.925 |
| Cuerpo | 231 (49) | 22 (52) | |
| Antro | 146 (31) | 11 (26) | |
| Píloro | 28 (6) | 3 (8) | |
| Morfología | |||
| Deprimido | 151 (32) | 13 (30) | <0.001 |
| Plano | 11 (24) | 12 (29) | |
| Elevado | 254 (54) | 17 (41) | |
| Tamaño tumoral (promedio mm) | 41±2.17 | 31±1.2 | <0.001 |
| Histología | |||
| Intestinal | 288 (59) | 23 (55) | 0.160 |
| Difuso | 160 (34) | 16 (39) | |
| Mixto | 33 (7) | 3 (6) | |
| Diferenciación | |||
| Bien | 268 (57) | 18 (42) | 0.079 |
| Mal | 203 (43) | 24 (58) | |
| Otros hallazgos | |||
| Atrofia | 257 (55) | 20 (48) | 0.326 |
| Metaplasia intestinal | 201 (43) | 22 (52) | 0.103 |
| Cáncer gástrico temprano | 42 (9) | 9 (21) | 0.009 |
| Estado de T | |||
| 0/1 | 33 (7) | 9 (21) | 0.023 |
| 2 | 85 (18) | 8 (19) | |
| 3 | 178 (38) | 10 (24) | |
| 4 | 221 (47) | 15 (36) | |
| TNM | |||
| 0/1 | 38 (8) | 9 (21) | 0.047 |
| 2 | 89 (19) | 9 (21) | |
| 3 | 108 (23) | 9 (21) | |
| 4 | 236 (50) | 15 (37) | |
IBP: inhibidor de la bomba de protones.
No hubo diferencias en el sexo, aunque se observa el predominio descrito para los varones en esta enfermedad. Los pacientes con CGI presentan una edad menor que los pacientes con ACG detectados a la primera endoscopia (p=0.01).
Antecedentes clínicosLos síntomas de alarma (disfagia, hematemesis, melena, vómitos y síndrome constitucional) fueron más frecuente en los pacientes con ACG detectado a la primera endoscopia (68 vs. 46%, OR: 0.28; p=0.003) y fue menos frecuente en estos pacientes el antecedente de gastrectomías (p=0.027). A diferencia de lo sugerido en la literatura, el consumo de IBP o la infección por Helicobacter pylori (H. pylori) no mostraron un predominio en alguno de los grupos.
Aspectos endoscópicosEl intervalo de tiempo medio entre el la EGD negativa y el diagnóstico de CGI fue de 14.4 meses (rango: 2-34.6). Entre los 42 pacientes con CGI, el 45% (19/42) tuvieron una EGD negativa <1 año, el 22% (9/42) en 1-2 años y el 33% (14/42) en 2-3 años. La mediana del número de endoscopias negativas en el grupo de CGI fue de 1 (rango: 1-3). Los hallazgos más comunes en la EGD negativa fueron gastritis (31/42, 73%), MI (15/42, 36%), atrofia gástrica (19/42, 45%) y úlcera gástrica (12/42, 29%). Cuatro pacientes (4/42, 2%) tuvieron una EGD negativa informada como normal.
No se encontraron diferencias en la ubicación de las lesiones entre los 2 grupos de pacientes, aunque las lesiones no observadas tendieron a ubicarse más proximales (fig. 1).
En cuanto a la morfología, se encuentra un predominio de las lesiones planas y excavadas (úlceras) en el CGI (p<0.001). Los tumores en el CGI eran más pequeños que los ACG sin endoscopia negativa (31±1.2 vs. 41±2.17mm, OR: 0.98; p<0.001)
Hallazgos histológicosNo hubo diferencias significativas entre las variantes histológicas (p=0.160) ni en el grado de diferenciación entre los 2 grupos. El cáncer gástrico temprano fue más frecuentemente encontrado en los pacientes con endoscopias negativas previas (21 vs. 9%; p=0.009).
Ni la atrofia gástrica ni la MI representaron un marcador de riesgo para la presentación o no del CGI.
Estadificación de los tumoresEl compromiso en profundidad de los tumores fue mayor en los ACG sin endoscopia negativa que en los CGI, con T3-4 del 75 vs. 60% (p=0.023) Cabe destacar, sin embargo, que el 21% de los ACG diagnosticados en pacientes con una endoscopia negativa previa estaban en etapa 0 o I (etapas curables) en comparación con solo el 9% en pacientes que no tenían una endoscopia previa negativa (p=0.009). Del mismo modo, solo el 58% de los CGI estaban en etapa III o IV, en comparación con el 73% entre los pacientes que no habían tenido una endoscopia previa (p=0.047).
Análisis de supervivenciaNo hubo diferencia en la supervivencia general entre el CGI y el no CGI (fig. 2).
DiscusiónEste es el primer estudio en nuestro país que evalúa la tasa de CGI, en una cohorte de pacientes con diagnóstico de ACG, encontrándose una tasa intermedia (8.2%) con respecto a lo informado literatura mundial (4.6-14.3%)26. Es importante destacar la falta de una definición unificada de CGI, encontrando una heterogeneidad sustancial entre los autores, principalmente en cuanto al tiempo para determinar el intervalo de esta neoplasia.
Basado en el estudio histórico de Fujita8 que sugiere un tiempo de duplicación de 2 a 3 años para el ACG, la mayoría de los estudios han considerado un tiempo de intervalo de 6 meses a 3.5 años. Si se supone que el tiempo de duplicación para el cáncer de la mucosa es de 2 a 3 años, el ACG diagnosticado dentro de este intervalo después de una endoscopia normal podría haber sido pasado por alto en la EGD inicial.
A diferencia de lo informado en otras publicaciones14,27–29 encontramos que el tratamiento con IBP no fue un predictor independiente de endoscopia negativa. Se les atribuye a estos fármacos la curación parcial de la mucosa de las lesiones, lo que se daría en las lesiones menos avanzadas, sin embargo, en nuestro medio su consumo es masivo de allí que no encontráramos diferencias entre los grupos. Se ratifica en este estudio lo informado previamente14, respecto a la mayor incidencia de CGI en los pacientes con cirugía gástrica previa; gastrectomía subtotal por cáncer o por lesiones benignas. Una posible explicación es que la anatomía gástrica alterada puede haber contribuido a pasar por alto las lesiones. El sexo femenino, la edad más joven, el endoscopista no gastroenterólogo, los estudios sin sedación y el paciente con más comorbilidades se han postulado para aumentar la probabilidad de cáncer de tracto gastrointestinal superior omitido en estudios previos11,30,31.
La presencia de síntomas de alarma fue significativamente menor en el CGI en comparación con el diagnóstico ACG sin endoscopias previas negativas (46 vs. 68%; p<0.003), lo que es consistente con el hecho de que los CGI eran más pequeños (tamaño medio: 31±1.2 vs. 41±2.17mm, OR: 0.98; p<0.001) y se diagnosticaron en una etapa menos avanzada (cáncer gástrico temprano en 21 vs. 9%; p=0.009).
Encontramos que casi uno de cada 3 pacientes tenía una úlcera gástrica con EGD negativa, algunos de los cuales podrían ser ACG no diagnosticados adecuadamente. A estas úlceras se le deben realizar biopsias y reevaluarse después del tratamiento, incluida la erradicación de H. pylori cuando se indique, dentro de las 6-8 semanas32. La sensibilidad en el diagnóstico de ACG aumenta con el número de biopsias y, en el caso de una sospecha de malignidad, deben ser al menos siete biopsias de los bordes de la úlcera y la base33.
En nuestra cohorte, los CGI se encontraron con mayor frecuencia como lesiones planas o deprimidas y fueron más pequeños que los ACG sin endoscopias negativas, lo que podría haber contribuido a no ser observadas en la EGD. De acuerdo con la literatura disponible11,13,14,17,19,30,32,34,35, no se encontraron diferencias en el subtipo histológico o el grado de diferenciación. El estadio I se encontró en solo el 21% de CGI y el 76% de los pacientes fueron diagnosticados dentro de los 2 años después de la EGD negativa, lo que lleva a pensar que probablemente la mayoría de los CGI fueron «verdaderos», explicados por una lesión no reconocida, aunque la posibilidad de nuevas lesiones de rápido crecimiento sigue siendo plausible.
La ubicación más frecuente de CGI fue el cuerpo gástrico, sin encontrarse diferencias significativas con los ACG detectados primariamente. Contrariamente al CCR, donde el colon derecho ha demostrado ser un factor de riesgo para el cáncer de intervalo36,37, no parece haber una relación entre la ubicación y el CGI7,26.
Otro hallazgo importante fue que a pesar de que el CGI es diagnosticado cada vez más frecuentemente en las etapas I-II, la supervivencia a un año y 2 años sigue siendo desalentadora. Este hecho enfatiza la importancia del diagnóstico precoz y las consecuencias de omitir una lesión maligna.
Hay varias explicaciones posibles para el CGI. Estas incluyen limitaciones en la técnica de endoscopia y el reconocimiento de lesiones; supervisión inadecuada de los alumnos; error de muestreo (biopsias muy pocas o inexactas); falta de tolerancia del paciente al procedimiento o sedación inadecuada, lo que resulta en una evaluación mucosa pobre o incompleta; seguimiento inapropiado; y errores de interpretación histopatológica. La experiencia japonesa del cáncer gástrico enfatiza la importancia de la meticulosa EGD. Esto implica la preparación del paciente con un agente antiespumante combinado con un agente mucolítico para mejorar la visibilidad; inspección cuidadosa y sistemática del estómago con insuflación de aire adecuada para aplanar los pliegues gástricos; y extensa documentación fotográfica (>20 imágenes) para garantizar una visualización adecuada de todas las áreas del estómago38. Los ensayos clínicos de agentes antiespumantes y mucolíticos han demostrado que la administración de dichos agentes mejora la visualización de la mucosa39.
Un llamado a la acción podría hacerse con base en la tasa de CGI encontrada en esta serie, ya que la misma podría usarse como un indicador de calidad de la endoscopia digestiva alta11,30,31,40. Los indicadores de calidad han sido bien estudiados en la colonoscopia, mientras que dichos indicadores para la EGD, no se han estandarizado, lo que genera un espacio para una mayor investigación. En la investigación futura de los indicadores de calidad para la EGD, es posible que las tasas de fallas en la detección de los cánceres gastrointestinales superiores se evalúen como indicadores de calidad, después de unificar la definición del cáncer gástrico de intervalo.
Los factores claves para dicha mejora incluyen una mejor capacitación de los endoscopistas y un mayor avance de los endoscopios. El establecimiento de un sistema de capacitación mejorado para endoscopistas y el aseguramiento de la calidad de la endoscopia son esenciales para una detección más exitosa del cáncer gástrico con endoscopia41,42. Con respecto al avance de los endoscopios en la detección y el diagnóstico de los cánceres gastrointestinales superiores, se espera que la endoscopia mejorada con imágenes con/sin aumento contribuya a la mejora32. Se ha sugerido que la tasa de CGI va desde el 4.6 al 14.3% en los países occidentales26.
Desde la perspectiva de los recursos limitados de endoscopia, se requiere la estratificación del riesgo de las personas, en lugar de realizar una endoscopia de vigilancia dentro de los 3 años posteriores a la endoscopia anterior para todas las personas. Por lo tanto, se debe investigar cómo incorporar los factores de riesgo para el cáncer gástrico, como el estado de la infección por H. pylori43 y la gastritis atrófica con la MI44, tanto en los programas de detección como de vigilancia. Se justifica un gran estudio prospectivo que consideren estos factores.
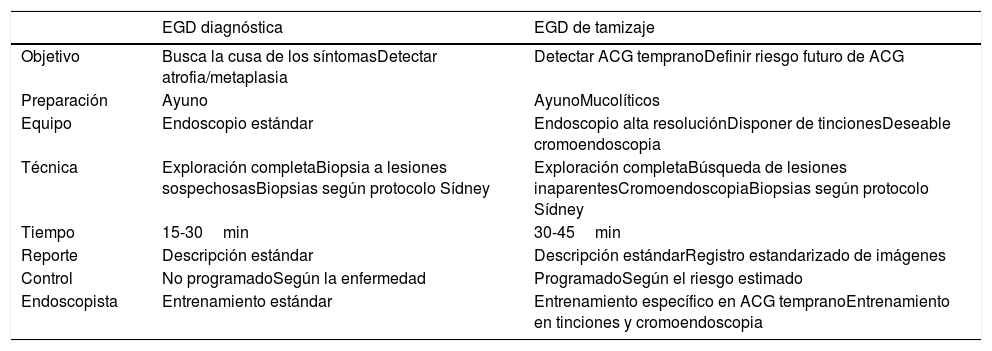
Se debe diferenciar por el endoscopista el tipo de endoscopia que realiza para mejorar la posibilidad de detectar lesiones gástricas incipientes o incluso premaligna, pare ello debe asumir una postura diferente ante una endoscopia diagnóstica habitual y una endoscopia de tamizaje, estos puntos se enfatizan en la tabla 2.
Diferencias entre la endoscopia diagnóstica y la de tamizaje para la detección de lesiones preneoplásicas o de ACG temprano
| EGD diagnóstica | EGD de tamizaje | |
|---|---|---|
| Objetivo | Busca la cusa de los síntomasDetectar atrofia/metaplasia | Detectar ACG tempranoDefinir riesgo futuro de ACG |
| Preparación | Ayuno | AyunoMucolíticos |
| Equipo | Endoscopio estándar | Endoscopio alta resoluciónDisponer de tincionesDeseable cromoendoscopia |
| Técnica | Exploración completaBiopsia a lesiones sospechosasBiopsias según protocolo Sídney | Exploración completaBúsqueda de lesiones inaparentesCromoendoscopiaBiopsias según protocolo Sídney |
| Tiempo | 15-30min | 30-45min |
| Reporte | Descripción estándar | Descripción estándarRegistro estandarizado de imágenes |
| Control | No programadoSegún la enfermedad | ProgramadoSegún el riesgo estimado |
| Endoscopista | Entrenamiento estándar | Entrenamiento específico en ACG tempranoEntrenamiento en tinciones y cromoendoscopia |
ACG: adenocarcinoma gástrico; EGD: esofagogastroduodenoscopia.
Este estudio tiene algunas limitaciones. Primero, el diseño observacional retrospectivo nos impidió recopilar información relevante, como el tiempo del examen gástrico, sedación y/o tolerancia al estudio, o los datos familiares y genéticos, entre otros. En segundo lugar, la falta de una base de datos de registro de cáncer a nivel nacional nos impidió determinar si un paciente con un EGD negativo en nuestra institución fue diagnosticado posteriormente con ACG en otros hospitales. Finalmente, el estudio puede tener poco poder para detectar una pequeña diferencia en la supervivencia debido al tamaño limitado de la muestra.
En conclusión, el CGI representó el 8.2% de todos los ACG atendidos en 6.5 años y probablemente surgió de un cáncer temprano no detectado en la mayoría de los casos. Las anastomosis pueden contribuir a omitir lesiones malignas y los bloqueadores de bomba no incrementaron su incidencia. El muestreo adecuado de la biopsia, el seguimiento de la curación de la úlcera son estrategias fácilmente disponibles para la práctica clínica diaria que podrían reducir la tasa de CGI y mejorar el pronóstico de ACG en los países occidentales. Para impactar esta tasa de CGI, hacemos un llamado a la mejor capacitación para los endoscopistas, una mayor investigación y desarrollo de la endoscopia en detección y diagnóstico, y el establecimiento de programas de vigilancia apropiados en sitios que así lo requieran. También es fundamental que cada endoscopista siempre considere el riesgo de pasar por alto lesiones importantes, y trate de lograr el mejor rendimiento en cada procedimiento endoscópico gastrointestinal superior.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
FinanciaciónNinguno de los autores declara haber recibido ningún tipo de financiación de alguna institución privada o pública para la realización de este trabajo.
Este estudio se realizó con el apoyo del Proyecto Sostenibilidad de la Vicerrectoría de Investigación de la Universidad de Antioquia, Medellín, Colombia.