El carcinoma hepatocelular (CHC) es el tumor primario más frecuente del hígado. La incidencia de CHC en hígado no cirrótico es del 15-20% de todos los CHC. El parénquima hepático no tumoral hace que el CHC no cirrótico sea una entidad clínica diferente. El objetivo fue describir la presentación, el tratamiento y los resultados predictivos de sobrevida de CHC en hígado no cirrótico en nuestra población.
Material y métodosEstudio retrospectivo de 13 años en pacientes con CHC no cirrótico, analizando características clínicas e índices biológicos de fibrosis/cirrosis (NAFLD, MELD, ALBI, APRI, CDS, FIB-4, GUCI, Lok), tratamiento y sobrevida.
ResultadosSe incluyeron 33 pacientes con CHC en hígado no cirrótico de 168 CHC (19.6%); edad promedio 67.3 años (51.5% hombres), 9.1% con virus de la hepatitis C y 27.3% con abuso de alcohol. El 20% tenía índices biológicos probables de fibrosis/cirrosis; el tamaño promedio tumoral fue 7.7cm y el 42.4% tenían alfafetoproteína>15ng/ml. Se clasificaron 52.5% Okuda II y 30.3% enfermedad avanzada (criterios de Milán). Se trataron 51.5% con resección hepática, 18,2% ablación por radiofrecuencia y 9,1% quimioembolización transarterial. La sobrevida global a 5 años fue de 55,4%. La resección hepática tuvo la mejor supervivencia a 5 años (72.7%). La edad>67 años y el aumento de alfafetoproteína se asoció con una menor sobrevida (p<0,05, log-rank).
ConclusionesEl CHC en hígado no cirrótico tiene unas características y sobrevida similar a otros sitios. La resección hepática tiene la mayor sobrevida. Los índices biológicos de fibrosis no fueron factores de riesgo para la sobrevida.
Hepatocellular carcinoma (HCC) is the most frequent primary tumor of the liver. HCC in the noncirrhotic liver accounts for 15-20% of all HCC. Noncirrhotic HCC is a clinically different entity because of the non-neoplastic liver parenchyma involved. Our aim was to describe the presentation, treatment, and predictive survival results of noncirrhotic HCC in Veracruz.
Material and methodA retrospective study, spanning 13 years, was conducted on patients with noncirrhotic HCC. It analyzed their clinical characteristics, fibrosis/cirrhosis biologic index (NAFLD, MELD, ALBI, APRI, CDS, FIB-4, GUCI, Lok) results, disease treatment, and survival.
ResultsFrom a total of 168 cases of HCC, 33 (19.6%) noncirrhotic patients were included in the study. Of those patients, the mean patient age was 67.3 years (51.5% men), 9.1% had hepatitis C virus infection, and 27.3% were alcoholics. Less than 20% of the patients had biologic indexes suggestive of fibrosis/cirrhosis. Mean tumor size was 7.7cm and 42.4% of the patients had alpha-fetoprotein levels>15ng/ml. A total of 52.5% of the tumors were classified as Okuda II and 30.3% of the patients had advanced disease (the Milan criteria). Liver resection was performed on 51.5% of the patients, radiofrequency ablation on 18.2%, and transarterial chemoembolization on 9.1%. The overall 5-year survival rate was 55.4%. Liver resection resulted in the best 5-year survival rate (72.7%). Age>67 years and elevated alpha-fetoprotein levels were associated with poorer survival (P<.05, log-rank).
ConclusionsThe characteristics and survival rate of HCC in the noncirrhotic liver were similar to those reported in other studies. Liver resection provided the highest survival rates. The liver fibrosis biologic indexes were not risk factors for survival.
El carcinoma hepatocelular (CHC) es el tipo más común de tumor primario de hígado en el mundo y el quinto y noveno cáncer en hombres y mujeres, respectivamente1. A nivel mundial, el principal factor de riesgo para el CHC es el virus de la hepatitis B (VHB)2. En Europa y América los principales factores de riesgo son el virus de la hepatitis C (VHC) crónica y el consumo de alcohol3.
La incidencia del CHC en hígado no cirrótico se estima alrededor del 15-20% de todos los CHC. Si la incidencia estimada de nuevos casos de CHC en todo el mundo es de 600,000 casos por año, podemos extrapolar una incidencia de 90,000-120,000 casos nuevos de CHC en hígado no cirrótico por año. La calidad «normal» del parénquima hepático no tumoral hace que el CHC en hígado no cirrótico sea una entidad diferente en cuanto a su epidemiología, presentación clínica, manejo y pronóstico4. Algunos reportes de CHC en hígado no cirrótico informaron una menor preponderancia masculina (proporción hombre/mujer: 1.3/2.1) en comparación con la contraparte cirrótica. La edad media es generalmente menos avanzada en pacientes no cirróticos que en cirróticos5.
La enfermedad por hígado graso no alcohólico es un trastorno metabólico caracterizado por esteatosis hepática macrovesicular mayor del 5% en individuos sin consumo significativo de alcohol, medicamentos hepatotóxicos u otras causas de esteatosis secundaria. Su espectro clínico incluye: esteatosis simple, esteatohepatitis, cirrosis y CHC. La enfermedad por hígado graso no alcohólico es la manifestación a nivel hepático del síndrome metabólico6. El CHC es una complicación tardía de la esteatohepatitis no alcohólica, incluso en hígado no cirrótico7.
El CHC no cirrótico generalmente se diagnostica cuando el tumor alcanza un tamaño que desencadena síntomas8. También se diagnostica de forma incidental mediante imagen o hallazgos anormales de laboratorio9. El nivel de alfafetoproteína (AFP) sérica considerado como diagnóstico de CHC (400ng/dl) es similar en pacientes cirróticos y no cirróticos, aunque la AFP>20ng/dl es menos frecuente en el CHC no cirrótico10,11.
La resección hepática (RH) es el tratamiento de elección en CHC no cirrótico debido al bajo riesgo de insuficiencia hepática después de la cirugía, y la menor recurrencia y menor morbimortalidad que en el hígado cirrótico. A pesar de una mayor carga tumoral, la función conservada del hígado no cirrótico generalmente ofrece la posibilidad de realizar resecciones grandes con bastante seguridad12,13.
Existen índices biológicos para establecer la fibrosis hepática en la enfermedad por hígado graso no alcohólico determinados séricamente y aceptables en términos de diagnóstico. Entre los más estudiados se encuentran el puntaje de fibrosis para hígado graso (NAFLD fibrosis score), el calculador de fibrosis 4 (FIB-4) y la relación aspartato aminotransferasa/plaquetas (APRI)6. Algunos de estos índices se han utilizado como predictores de resultados en el CHC, especialmente en pacientes sometidos a resección quirúrgica14–17. Otros índices, como el de albúmina-bilirrubina (ALBI), han sido propuestos para evaluar la reserva funcional hepática en pacientes sometidos a cirugía por CHC15. Junto a los anteriores, el índice de cirrosis discriminante (CDS), el índice de Lok y el índice de cirrosis de la Universidad de Gotemburgo (GUCI) han sido estudiados como factores pronósticos de sobrevida en los pacientes con CHC14,16–18.
Dado el patrón de presentación diferente del CHC no cirrótico, este estudio tuvo como objetivo describir las características de presentación, el tratamiento y la supervivencia del CHC no cirrótico en nuestra institución, aplicando los índices biológicos de fibrosis y reserva hepática como factores pronósticos de supervivencia del CHC en hígado no cirrótico.
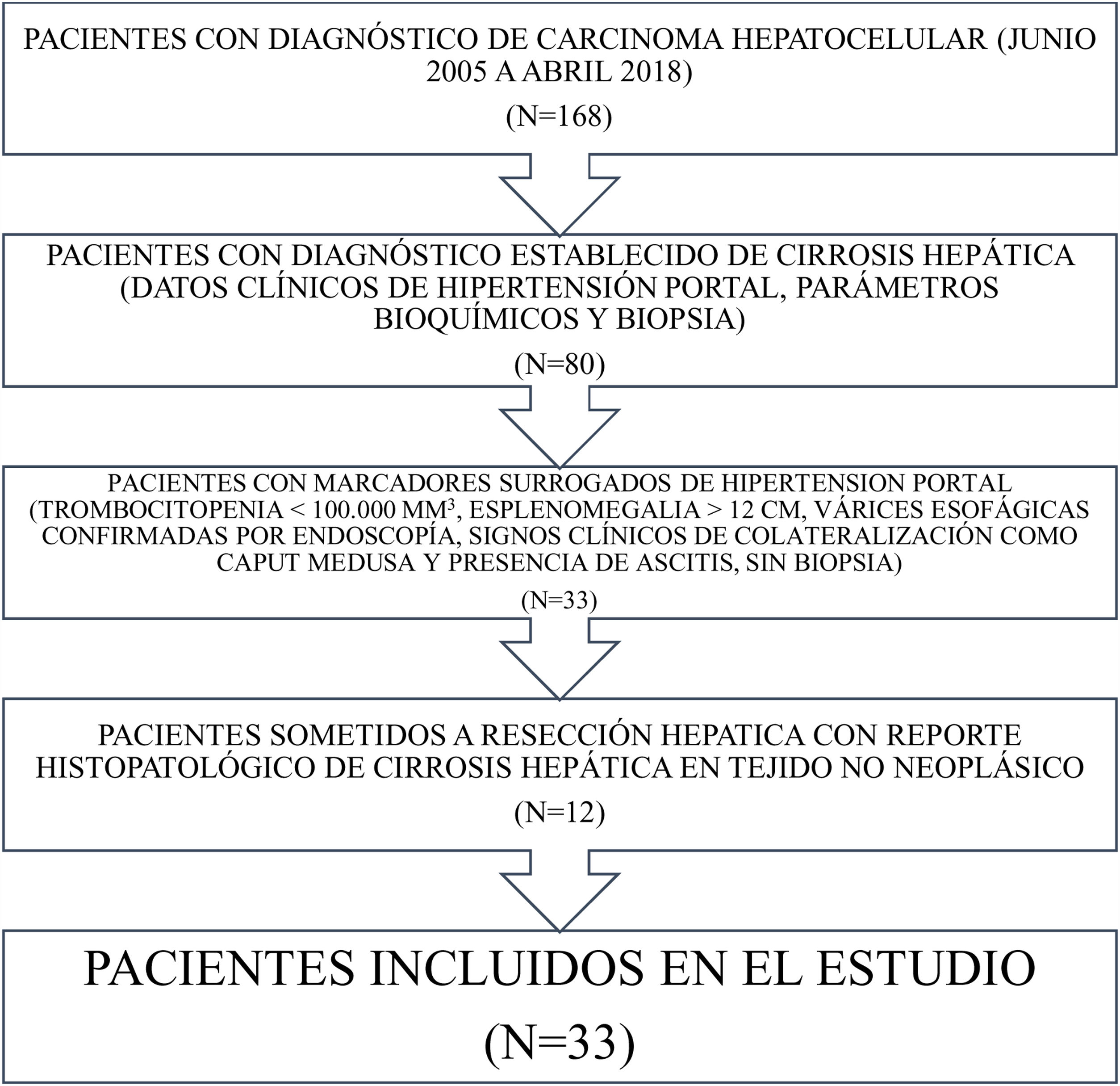
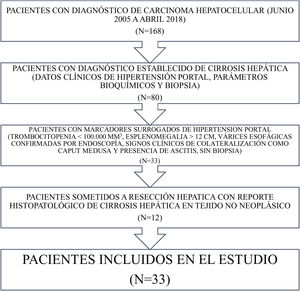
Material y métodosSe identificaron todos los pacientes con diagnóstico de CHC desde junio de 2005 hasta abril de 2018 en nuestra base de datos. Ciento sesenta y ocho pacientes con CHC fueron registrados durante ese periodo. Los pacientes con diagnóstico establecido de cirrosis hepática (datos clínicos de hipertensión portal, parámetros bioquímicos y biopsia) y aquellos que tuvieron marcadores subrogados de la misma (trombocitopenia<100,000mm3, esplenomegalia>12cm, varices esofágicas confirmadas por endoscopia, signos clínicos de colateralización y ascitis sin biopsia)19 fueron excluidos del estudio. Los pacientes sometidos a RH que tuvieron reporte histopatológico de cirrosis hepática en el tejido no neoplásico también fueron excluidos. Los demás pacientes fueron identificados e incluidos en el estudio (fig. 1).
Las variables analizadas incluyeron lo siguiente: edad, sexo, índice de masa corporal, comorbilidades (diabetes y/o hipertensión), hepatitis viral e ingesta con abuso de alcohol (consumo excesivo de alcohol: 4 bebidas para mujeres y 5 o más para hombres en aproximadamente 3h o bebiendo durante 5 o más días en el último mes)20. Se documentó la presencia de síndrome metabólico de acuerdo con los criterios de la American Heart Association y el National Heart, Lung, and Blood Institute21.
Los datos de laboratorio para el análisis incluyeron: hemoglobina, recuento de plaquetas, tiempo de protrombina, ratio internacional normalizada, alanina aminotransferasa, aspartato aminotransferasa, fosfatasa alcalina, bilirrubina total, albúmina sérica, creatinina sérica y AFP. Se calcularon los siguientes índices biológicos de fibrosis/cirrosis hepática en el momento del diagnóstico: NAFLD fibrosis score, APRI, FIB-4, índice de Lok, CDS, GUCI). Se clasificaron estos índices en grados: grado 1, fibrosis poco probable; grado 2, indeterminado, y grado 3, fibrosis/cirrosis altamente probable14. Además, se registró el ALBI como indicador de severidad de enfermedad hepática. El índice ALBI se categorizó en: grado 1, buena reserva hepática; grado 2, reserva intermedia, y grado 3, pobre reserva. Cuando se obtuvo, la fibrosis del tejido hepático no neoplásico se evaluó histopatológicamente mediante la puntuación de METAVIR22.
Diagnóstico y estadificación del carcinoma hepatocelularTodos los pacientes fueron diagnosticados a través de una tomografía computarizada, con criterios diagnósticos de CHC23 con o sin valor de AFP>200ng/ml. El diagnóstico de CHC se confirmó histológicamente mediante biopsia tumoral o muestra quirúrgica. Los pacientes con CHC fibrolamelar fueron excluidos del estudio. Se documentó: tamaño del tumor, número de tumores y trombosis de la vena porta. La metástasis se evaluó en imágenes (tomografía computarizada). Los pacientes se clasificaron de acuerdo con Okuda (tamaño del tumor>50%, ascitis presente, albúmina<3mg/dl, bilirrubina>3mg/dl; etapa i: sin factores adversos; etapa ii: 1-2 factores adversos; etapa iii: 3-4 factores adversos), según el Programa Italiano de Cáncer de Hígado (CLIP) (factores clínicos: estadio de Child-Pugh, número de nódulos tumorales y si el tumor se extiende hasta más del 50% del hígado, AFP y trombosis de la vena porta; se asignan 0-2 puntos y se obtiene una puntuación de 0-6)24 y los criterios de Milán (no avanzado: CHC único<5cm, 2 o 3 nódulos más grandes con un diámetro<3cm, sin ganglio linfático o extensión vascular ni metástasis a distancia; avanzado: tumor que supera los límites anteriores)25, sistemas de estadificación para el CHC.
El tratamiento activo se definió en: RH, ablación por radiofrecuencia (ARF) y quimioembolización transarterial (TACE). El uso de sorafenib también fue registrado. La sobrevida del paciente (meses) se determinó desde el momento del diagnóstico hasta la pérdida del seguimiento o la muerte.
Análisis estadísticoLos datos se expresan como media±desviación estándar y rango para variables continuas, y frecuencia y porcentaje para variables categóricas. La sobrevida de los pacientes se calculó mediante el método de Kaplan-Meier y se utilizó la prueba de log-rank para comparar las diferencias en la sobrevida. Las variables continuas se categorizaron para la sobrevida del paciente utilizando media y mediana con base en la asimetría de los datos. El análisis multivariado también se realizó con el modelo de regresión de riesgos proporcionales de Cox para ajustar el efecto de los factores de riesgo de confusión en la supervivencia del paciente. Las variables con valores de p≤0.1 se incluyeron en el análisis multivariado. Un valor de p<0.05 fue considerado estadísticamente significativo. Los datos se analizaron utilizando el software SPSS versión 25 (Chicago, IL, EE. UU.).
Consideraciones éticasEl estudio fue aprobado previamente por el comité de ética e investigación institucional local.
Los autores declaran que este artículo no contiene información personal que permita identificar a los pacientes, y no fue necesario pedir el consentimiento informado a los mismos.
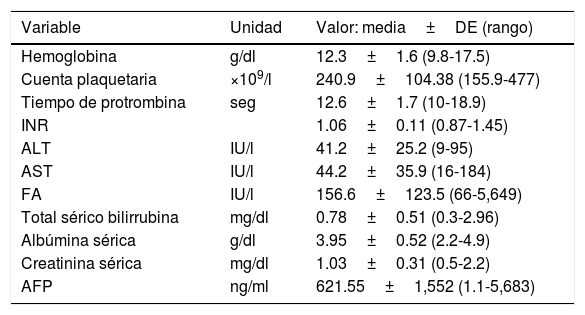
ResultadosTreinta y tres pacientes con CHC no cirrótico fueron incluidos en el estudio (fig. 1), 17 hombres (51.5%) y 16 mujeres (48.5%), para una incidencia de 19.6%. La edad media fue de 67.3±14.8 años (rango 29-88). La media del índice de masa corporal fue 26.2±4kg/m2 (rango 19.7-36). Diez pacientes (30.3%) tenían diabetes mellitus y 11 (33.3%) tenían hipertensión. Dos pacientes (6.1%) cumplían con los criterios de síndrome metabólico, igual que los que no tenían antecedentes de VHC o de ingesta de alcohol. Tres pacientes (9.1%) eran portadores de VHC y 9 (27.3%) tuvieron ingesta de alcohol en abuso, considerando así 21 pacientes (63.3%) con posible enfermedad por hígado graso no alcohólico. La tabla 1 muestra las principales características de laboratorio de los pacientes. No hubo diferencias significativas en los datos sociodemográficos entre los pacientes portadores de VHC, aquellos con ingesta de alcohol y los que tenían enfermedad por hígado graso no alcohólico.
Características de los laboratorios de los pacientes
| Variable | Unidad | Valor: media±DE (rango) |
|---|---|---|
| Hemoglobina | g/dl | 12.3±1.6 (9.8-17.5) |
| Cuenta plaquetaria | ×109/l | 240.9±104.38 (155.9-477) |
| Tiempo de protrombina | seg | 12.6±1.7 (10-18.9) |
| INR | 1.06±0.11 (0.87-1.45) | |
| ALT | IU/l | 41.2±25.2 (9-95) |
| AST | IU/l | 44.2±35.9 (16-184) |
| FA | IU/l | 156.6±123.5 (66-5,649) |
| Total sérico bilirrubina | mg/dl | 0.78±0.51 (0.3-2.96) |
| Albúmina sérica | g/dl | 3.95±0.52 (2.2-4.9) |
| Creatinina sérica | mg/dl | 1.03±0.31 (0.5-2.2) |
| AFP | ng/ml | 621.55±1,552 (1.1-5,683) |
ALT: alanino aminotransferasa; AFP: alfafetoproteína; AST: aspartato aminotransferasa; DE: desviación estándar; FA: fosfatasa alcalina; INR: ratio internacional normalizada.
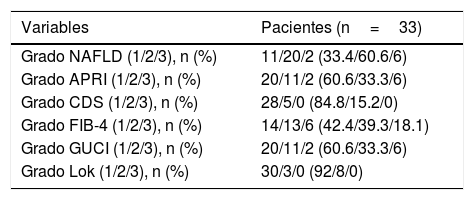
De acuerdo con los índices biológicos de fibrosis/cirrosis, menos del 20% de los pacientes se consideraron como grado 3 (fibrosis altamente probable/probable cirrosis) (tabla 2). Veintiún pacientes (66.6%) tuvieron grado 1 (reserva hepática adecuada), 11 pacientes (33.3%) grado 2 y un paciente (3.3%) grado 3 (pobre reserva hepática de acuerdo con el índice ALBI).
Índices biológicos de fibrosis/cirrosis
| Variables | Pacientes (n=33) |
|---|---|
| Grado NAFLD (1/2/3), n (%) | 11/20/2 (33.4/60.6/6) |
| Grado APRI (1/2/3), n (%) | 20/11/2 (60.6/33.3/6) |
| Grado CDS (1/2/3), n (%) | 28/5/0 (84.8/15.2/0) |
| Grado FIB-4 (1/2/3), n (%) | 14/13/6 (42.4/39.3/18.1) |
| Grado GUCI (1/2/3), n (%) | 20/11/2 (60.6/33.3/6) |
| Grado Lok (1/2/3), n (%) | 30/3/0 (92/8/0) |
APRI: aspartato transaminasa y plaquetas; CDS: índice de cirrosis discriminante; FIB-4: índice de elementos de fibrosis 4; GUCI: índice de cirrosis de la Universidad de Gotemburgo; NAFLD: non-alcoholic fatty liver disease («enfermedad por hígado graso no alcohólico»).
Grado 1: fibrosis poco probable; Grado 2: indeterminado; Grado 3: fibrosis muy probable/posible cirrosis).
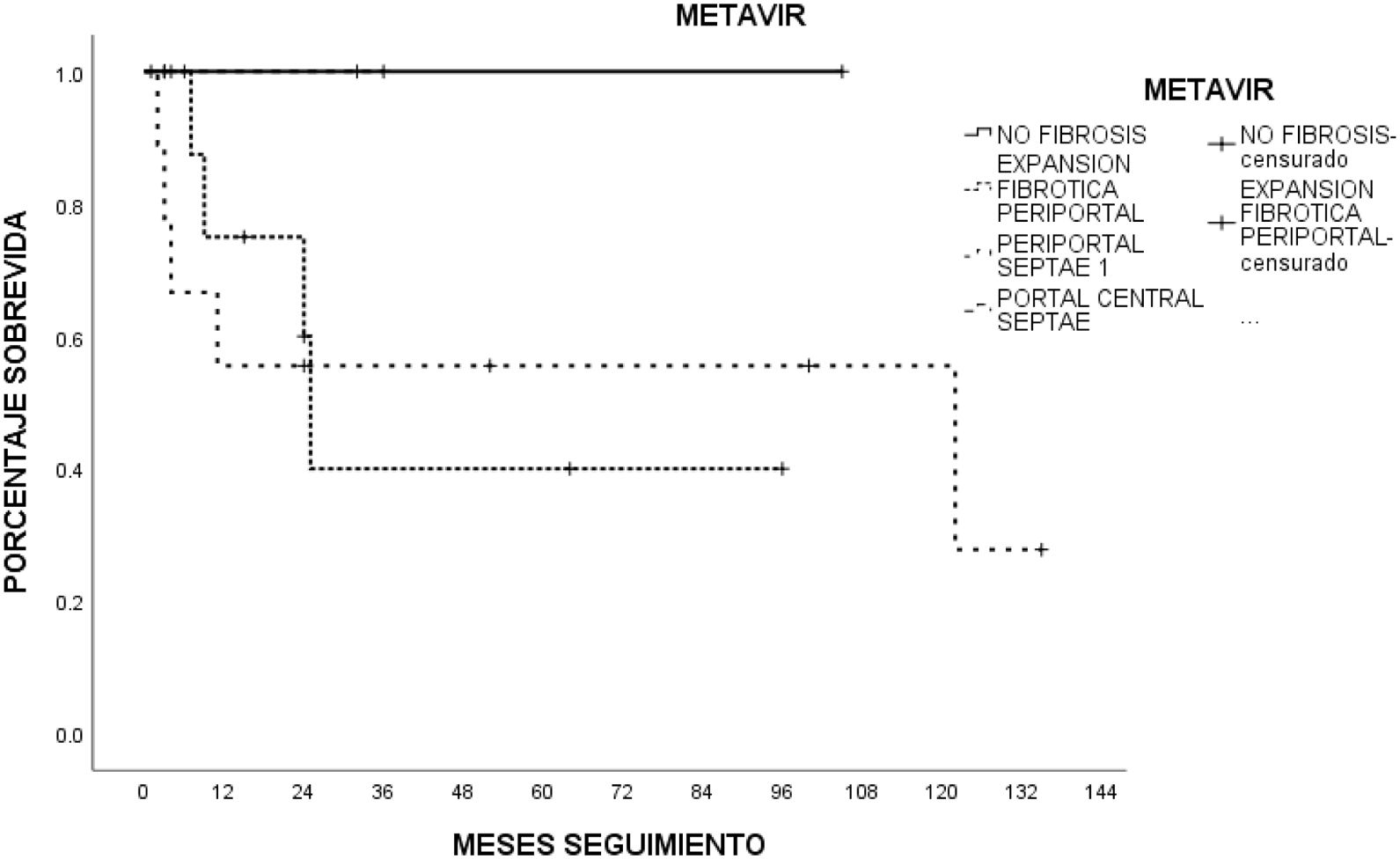
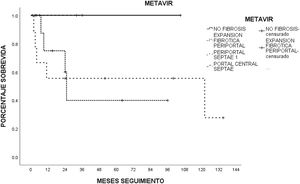
La histología hepática se determinó según la puntuación de fibrosis de METAVIR en 26 pacientes (78.7%). El puntaje más común fue la fibrosis portal leve fibrosa sin septos (F1) y la fibrosis portal moderada y pocos septos (F2) en 10 (46.2%) pacientes, seguidos de la fibrosis severa, con numerosos septos sin cirrosis (F3) en 4 (15.4%) pacientes, y sin fibrosis (F0) en 2 (7.7%) pacientes. La distribución de la escala METAVIR, de acuerdo con la etiología del daño hepático, se muestra en la tabla 3.
Escala METAVIR de acuerdo con la etiología del daño hepático en pacientes con biopsia (n=33)
| Causa (N) | F0, n (%) | F1, n (%) | F2, n (%) | F3, n (%) |
|---|---|---|---|---|
| EHGNA (17) | 2 (11.7) | 6 (35.2) | 5 (29.4) | 4 (23.4) |
| Hepatitis (3) | 0 | 0 | 3 (100) | 0 |
| Alcohol (6) | 0 | 4 (66.6) | 2 (33.3) | 0 |
EHGNA: enfermedad por hígado graso no alcohólico.
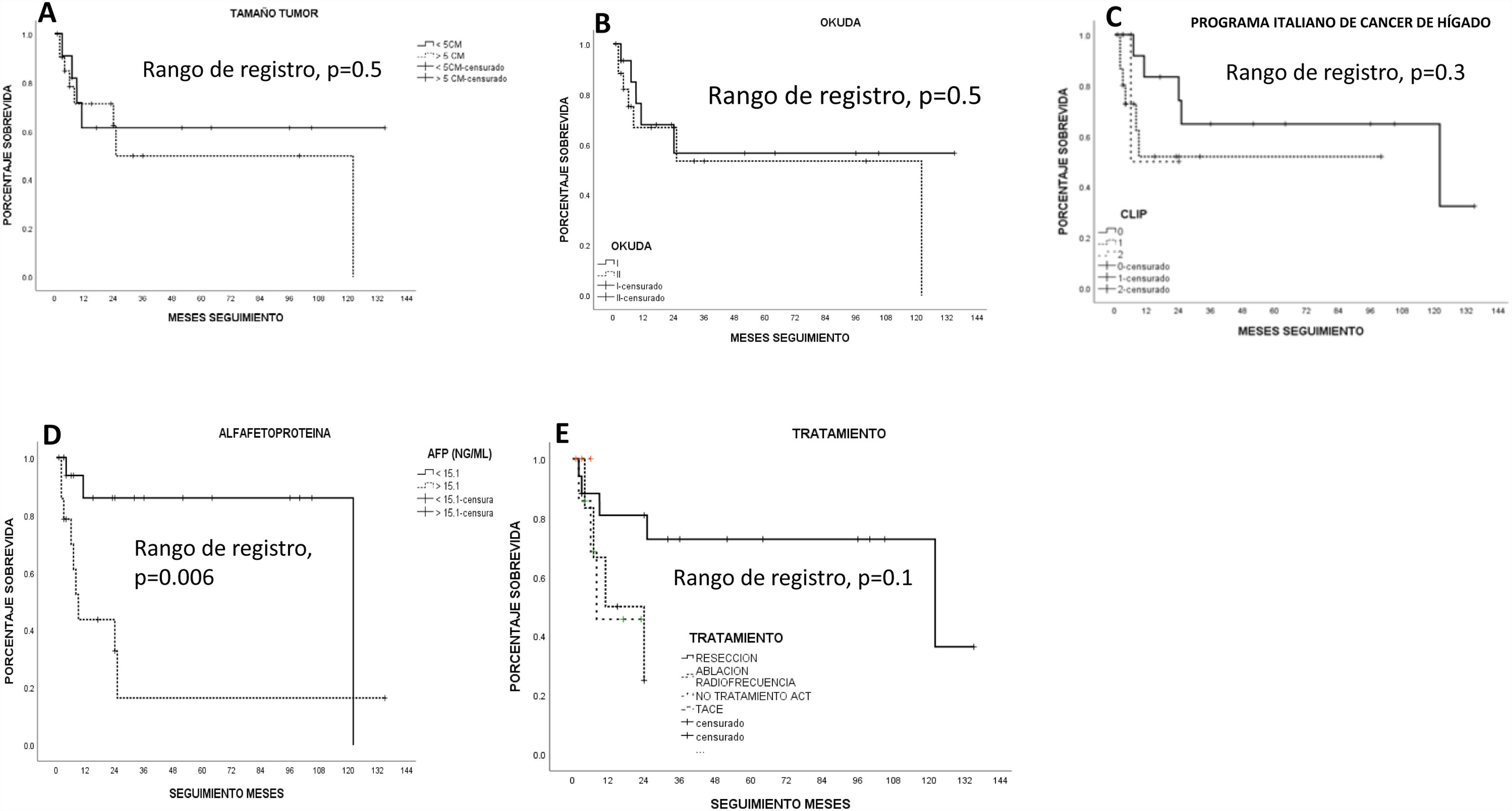
La mayoría de los pacientes (93.9%, n=31) tenían una lesión única, un paciente (3.3%) tuvo 2 lesiones y otro (3.3%) tenía 3 lesiones. El tamaño medio de la lesión mayor fue 7.7±2.9cm (rango 3-15) y solo 11 pacientes (33.3%) tenían un tumor de menos de 5cm de diámetro. Dos (6.6%) pacientes tenían trombosis de la vena porta y 42.4% (n=14) tenían un aumento de la AFP (>15ng/ml por laboratorio local). Dieciocho pacientes (48.5%) fueron clasificados como Okuda en etapa i y 15 pacientes (52.5%) fueron clasificados como Okuda en etapa ii. Según la clasificación de CLIP, 45.5% (n=15) fueron CLIP 0, 16 (48.5%) fueron CLIP 1 y un paciente (6.1%) fue CLIP 2. Solamente 10 pacientes (30.3%) tenían enfermedad no avanzada según los criterios de Milán.
El tratamiento activo se realizó en 26 (78.7%) pacientes: 17 (51.5%) se sometieron a RH, 6 (18.2%) a ARF y 3 (9.1%) a TACE. Las indicaciones de ARF fueron en su mayoría la edad avanzada (mayor de 70 años) ?4 pacientes? y la presencia de comorbilidades asociadas ?diabetes en 3 pacientes?. Todos los pacientes sometidos a TACE eran mayores de 70 años, con diabetes mellitus e hipertensión arterial como comorbilidades. Todas las RH se consideraron resecciones R0 (resección microscópica de margen negativo). Seis pacientes (18.18%) no recibieron tratamiento activo (RH, ARF o TACE) debido a: trombosis portal (n=2), caquexia (n=2), número de lesiones (3) (n=1) y metástasis extrahepática (parrilla costal) (n=1). La recurrencia en pacientes con RH fue de 11.7% (n=2), y de 33% (n=2) en aquellos con ARF (24±17.4 meses después del tratamiento). El tiempo medio de recurrencia fue de 22.8±15.3 meses (rango 14-50). Se administró sorafenib en 7 pacientes (21.2%): en 2 por recidiva después de RH, en otros 2 por recidiva después de ARF, en un paciente después de la TACE y en 2 pacientes en el tratamiento no activo.
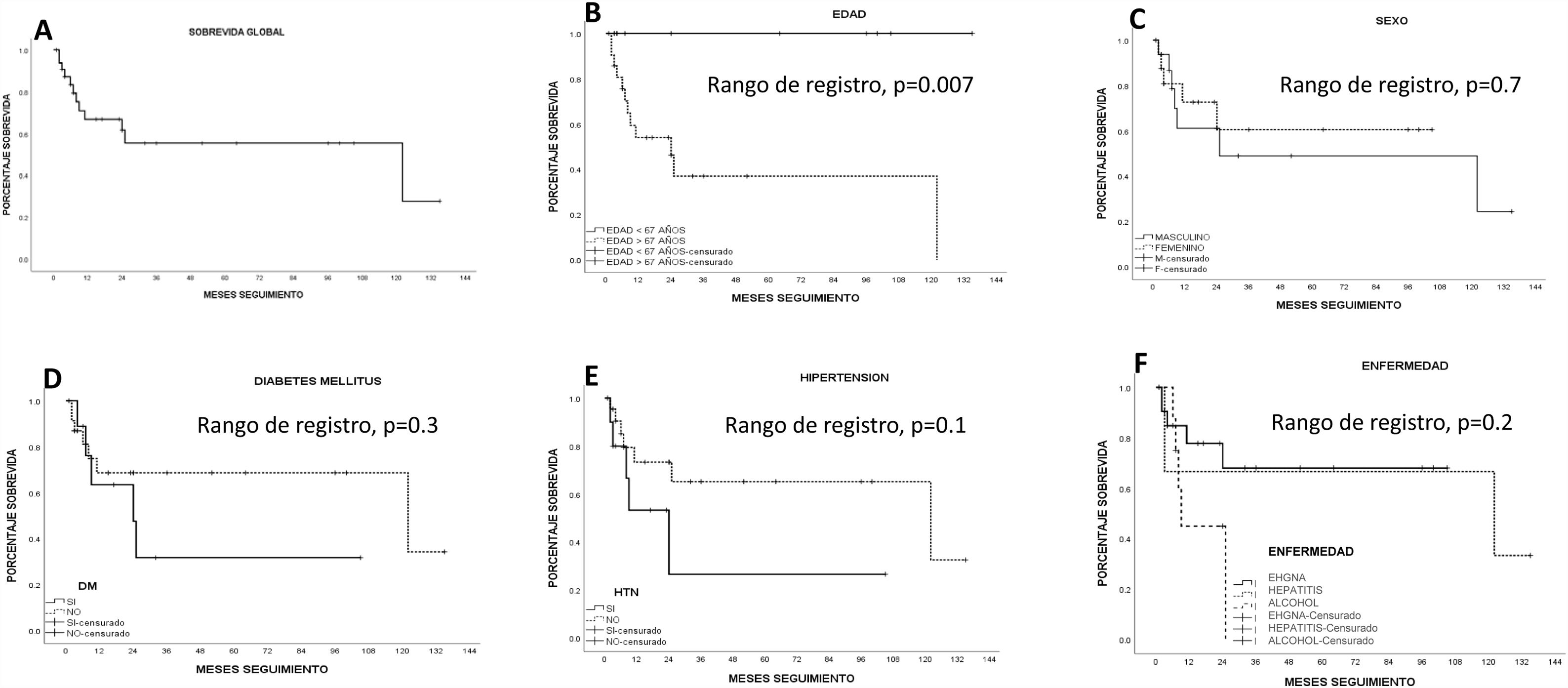
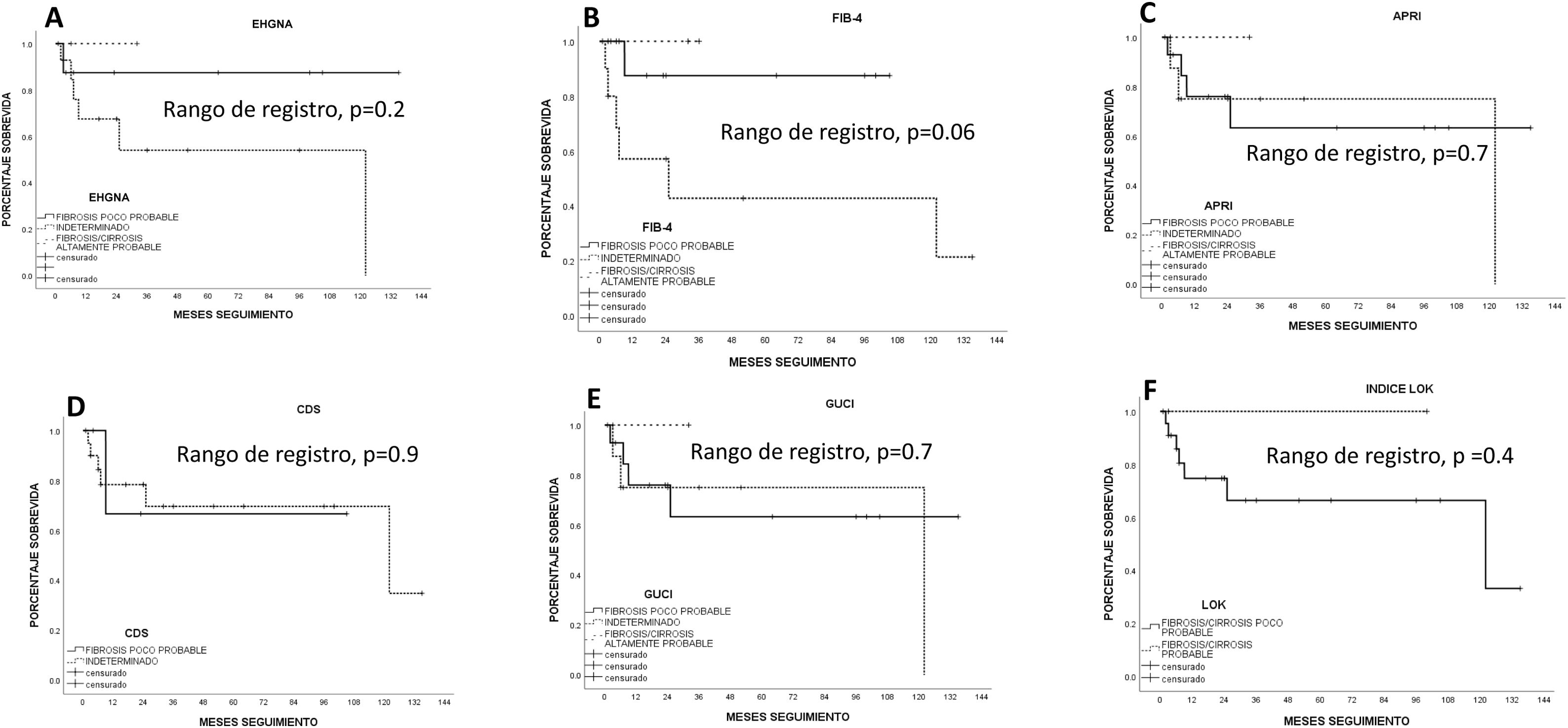
SobrevidaLa supervivencia media estimada por Kaplan-Meier en todos los pacientes fue de 76.1±12.5 meses (IC 95% 51.5-100.7) (66.8% a un año y 55.4% a 5 años). La RH ofreció la mejor supervivencia estimada (96.5±14.2 meses; IC 95% 68.6-124.4) frente a la ARF (15.6±4 meses; IC 95%: 7.7-23.5) y la TACE (13.6±3.8 meses; 95% IC 6.2-21.1); sin embargo, no alcanzó significación estadística (p=0.1, log-rank). Los pacientes mayores de 67 años tuvieron una sobrevida estadísticamente significativa menor que los menores de 67 años (p<0.05, log-rank). Los pacientes con mejor índice biológico FIB-4 tuvieron una tendencia estadística hacia una mejor sobrevida (p=0.06, log-rank). Ningún otro índice biológico de fibrosis/cirrosis tuvo influencia sobre la sobrevida de los pacientes.
Los pacientes con menor severidad de la enfermedad hepática (ALBI grado 1) tuvieron una mejor sobrevida que aquellos con mayor severidad de la enfermedad hepática (ALBI grado 2; un año: 26.9%, 5 años: no registro)a uno (90 y 68%, respectivamente) y 5 años (59 y 57%, respectivamente); sin embargo, no hubo significación estadística. Ni el grado de fibrosis determinado por biopsia ni las características tumorales influyeron en la sobrevida de los pacientes. Los pacientes con AFP>15ng/ml tuvieron una sobrevida estadísticamente significativa menor (p<0.05, log-rank). La sobrevida estimada por Kaplan-Meier de acuerdo con las variables examinadas se encuentra en las figuras correspondientes (figs. 2–5).
Sobrevida estimada por Kaplan-Meier según el índice biológico de fibrosis. A) Enfermedad por hígado graso no alcohólico (EHGNA). B) Índice de elementos de fibrosis 4 (FIB-4). C) AST/índice de plaquetas (APRI). D) Sistema de discriminación de cirrosis (CDS). E) Índice de cirrosis de la Universidad de Gotemburgo (GUCI). F) Índice de Lok. El índice de FIB-4 tuvo una tendencia estadística significativa (p=0.06).
El análisis de regresión de Cox no mostró significación estadística al examinar la edad (<67 años: p=0.61), la AFP>15ng/ml (p=0.65), el modelo FIB-4 (p=0.65) y el tratamiento (p=0.83).
DiscusiónLos resultados de nuestro estudio evidencian que el CHC no cirrótico tiene una incidencia, unas características clínicas y una sobrevida similares a las que ocurren en todo el mundo. Nuestro estudio observa diferencias, especialmente en la infección por el VHC, la tasa de diabetes mellitus y la recurrencia. Encontramos que el tratamiento quirúrgico tiene la mayor sobrevida en comparación con todos los tratamientos descritos en nuestros resultados, y que los pacientes de mayor edad y una AFP elevada tienen una menor sobrevida que el resto. Los índices biológicos de fibrosis/cirrosis hepática no se pudieron identificar como factores de riesgo para sobrevida.
La incidencia de CHC no cirrótico de nuestro estudio (20%) es similar a la descrita previamente en la literatura, aunque geográficamente puede variar desde un 5 hasta un 54%4,5,12.
La nula infección por VHB y el 27% por VHC es inversa a estudios orientales (VHB: 50-70% y VHC: 3-4%)9,14 y diferente a estudios europeos (VHB: 11-20% y VHC: 9-46%)5,12. En contrapartida, la diabetes mellitus (asociada a esteatohepatitis no alcohólica y posterior desarrollo de CHC)5 es más alta que las tasas descritas en los estudios chinos (20%)14 y españoles (3%) de CHC no cirrótico. Nuestra presencia de abuso en el consumo de alcohol es similar a otros centros europeos (20-27%)8,12. El desarrollo de CHC en un hígado enfermo complica el desarrollo natural de la enfermedad. El aumento de CHC en pacientes con enfermedad de hígado graso no alcohólico ha llegado a ser mencionado hasta 10 veces6. La enfermedad de hígado graso es una de las causas principales para referencia a trasplante hepático por la presencia de CHC26. Ante la posible presencia de hígado graso no alcohólico, debemos pensar en estrategias para hacer un mayor rastreo de esta enfermedad y su posible desarrollo hacia CHC.
Curiosamente, la presencia de fibrosis hepática histológica en nuestros resultados (95% aproximadamente combinando el puntaje de fibrosis METAVIR [F1-F3]) es alto en comparación con el 60-70% de fibrosis en poblaciones italianas y alemanas8,12, aunque hubo un 20% de nuestra población en la que no se analizó la histología no tumoral (una de las principales limitaciones de nuestro estudio). Sin embargo, los índices biológicos de fibrosis/cirrosis no tuvieron una correlación específica con nuestra histología debido a que, a excepción del FIB-4, la mayoría de los pacientes reflejan fibrosis poco probable o indeterminada hasta en un 80% de los casos, similar a otros estudios que han evaluado estos índices en pacientes con CHC14. Esta discrepancia entre los índices biológicos y el estudio histopatológico nos lleva a plantear una explicación bidireccional: mala lectura del tejido no neoplásico o alteraciones de parámetros bioquímicos causadas por el tumor mismo.
Las características de los tumores en nuestro estudio, como el tamaño, el número de lesiones, la trombosis de la vena porta, la AFP elevada y la evaluación de los criterios de Milán, son similares a las de otras series4,12,13. La RH es la mejor opción terapéutica y la única opción curativa para estos pacientes, como se ha demostrado anteriormente4,5,8,9,14. Sin embargo, no todos los pacientes se someterán a RH y a algunos se les ofrecerán otros tratamientos, como ARF y TACE, hasta en un 40 a 65%10,12. Pudimos realizar RH en el 51% de nuestros pacientes, ofreciéndoles la mejor sobrevida posible, como se demuestra en nuestros resultados al comparar la RH con otras terapias.
En general, la sobrevida a 5 años es aproximadamente del 50%, mejor que en pacientes cirróticos con CHC4,5,8–12,14. Algunos grupos han proclamado que el pronóstico de CHC no cirrótico se ve afectado cuando los pacientes tienen lesiones pequeñas sin invasión vascular4,14, nódulos satélites4, resecciones R04,8, edad del paciente8, diabetes14, estadio tumoral (por TNM)8,9, tamaño tumoral>10cm8, estadio tumoral más allá de los criterios de Milán10, AFP sérica elevada14, índice ALBI14 y recurrencia tumoral4–14. Alcanzamos una tasa de sobrevida a 5 años del 55% y encontramos que la edad avanzada del paciente (>67 años), la AFP sérica (>15ng/ml) y quizás el FIB-4 (p=0.06) se asociaron a una mala sobrevida en el análisis univariado (log-rank), pero estos hallazgos no fueron confirmados en el análisis multivariado. Desafortunadamente, debido a las limitaciones del diseño del estudio, tales como la naturaleza retrospectiva del mismo, el examen histopatológico incompleto de las muestras del tumor y que fue realizado por diferentes patólogos, no pudimos incluir otras características histopatológicas como la invasión vascular u otras formas de control del tejido no neoplásico.
Tuvimos una menor recurrencia del tumor (12%) en comparación con los porcentajes descritos anteriormente (27-73%)4,8,9,12 y esta recurrencia no tuvo un impacto estadísticamente significativo en la sobrevida, al contrario que otros estudios12,14. Nuestra naturaleza intensiva en términos de realización de RH de tipo R0 generó una tasa de recurrencia del 11%; sin embargo, la ARF tuvo un aumento de 3 veces en la recurrencia (33%), lo que incrementa las preocupaciones sobre sus indicaciones y uso en nuestra serie.
Finalmente, la información sobre CHC no cirrótico en la población mexicana es escasa. Las series mexicanas recientes de otros sitios solo hacen referencia a una tasa de 27-33% de CHC no cirrótico cuando se incluyen en el estudio27–30, sin una caracterización completa de este subconjunto de pacientes; y otros solo muestran la descripción detallada de CHC30 fibrolamelar, que es una entidad clínica diferente en términos de pronóstico y supervivencia.
ConclusionesNuestro estudio evidencia que el CHC en hígado no cirrótico tiene una incidencia, unas características clínicas y una sobrevida similares en comparación con otros. La RH tiene la mayor sobrevida. Ninguno de los índices biológicos de fibrosis hepática invasiva pudo asociarse como factor de riesgo en la sobrevida de los pacientes.
FinanciaciónLa presente investigación no ha recibido ayudas específicas provenientes de agencias del sector público, sector comercial o entidades sin ánimo de lucro.
Conflicto de interesesLos autores declaran no tener ningún tipo de conflicto de interés.
Véase contenido relacionado en DOI: https://doi.org/10.1016/j.rgmx.2020.05.003, Moctezuma-Velázquez, C. Comentario editorial sobre carcinoma hepatocelular en hígado no cirrótico: características clínicas y resultados en Veracruz, México. Rev Gastroenterol Mex.2021;86:1–3.