¿ Introducción
En un trabajo anterior se presentó un sistema estructurado de puntaje para el diagnóstico de la enfermedad celíaca (EC), el cual permitió la identificación de pacientes con EC oculta en una cohorte de sujetos adultos desnutridos y con historia de trastornos gastrointestinales crónicos. Mediante este sistema, los sujetos se pueden asignar a cualquiera de tres categorías, con base en la puntuación obtenida en seis apartados que cubren aspectos clínicos, histopatológicos, serológicos y nutricionales de la enfermedad. Con este sistema se demostró que 17.9% de los pacientes evaluados, tuvieron EC cuando el puntaje fue ≥ 9.1
El sistema presentado de puntaje diagnóstico ha estado en uso durante los últimos dos años en la práctica del Grupo Interdisciplinario de Atención Integral al Paciente Celíaco que opera en el Hospital Clínico Quirúrgico Hermanos Ameijeiras de La Habana, Cuba. Durante este tiempo se ha acumulado la experiencia necesaria para hacer una revisión crítica del mismo. Por otro lado y de forma coincidente, la introducción de las técnicas de detección de los alelos DQβ1*02 o DQβ1*0302 en esta institución ha ofrecido una oportunidad única para evaluar la aplicabilidad del sistema de puntaje propuesto de diagnóstico de la EC.
Al tomar en cuenta que la EC afecta a 1% de la población encuestada en cualquier locación geográfica;2-4 que 90% de los enfermos celíacos diagnosticados expresan el alelo DQβ1*02 y que 5.0% muestra el alelo DQβ1*0302;5,6 se puede suponer que los pacientes con los puntajes diagnósticos más elevados mediante el sistema desarrollado, se distinguirían por la mayor frecuencia de los alelos relacionados con la EC.
El objetivo del presente trabajo fue establecer la asociación existente entre los alelos DQβ1*02 o DQβ1*0302 o ambos y un sistema estructurado de puntaje para el diagnóstico de la enfermedad celíaca.
¿ Métodos
Todos los pacientes enviados al Grupo Interdisciplinario de Atención al Paciente Celíaco debido a la presencia de desnutrición, anemia y trastornos gastrointestinales crónicos de etiología no aclarada, fueron considerados para participar en este estudio. Este se llevó a cabo en el Hospital Clínico Quirúrgico Hermanos Ameijeiras de La Habana, Cuba, entre enero de 2008 y diciembre de 2010. Las acciones realizadas sobre los pacientes asistidos por el Grupo están contempladas en el correspondiente manual de prácticas médicas de la institución.7 En todos los casos se aseguró la confidencialidad de la información del paciente mediante sistemas apropiados de captura y almacenamiento de la historia clínica personal, en cumplimiento con normas previamente establecidas.8
Evaluación nutricional: De cada paciente se obtuvo un perfil nutricional, según lo previsto localmente por el Grupo Hospitalario de Apoyo Nutricional (GAN). El perfil nutricional comprendió el registro de la talla (en centímetros), el peso (en kilogramos), la circunferencia del brazo (CB, en centímetros) y los pliegues cutáneos (en milímetros). Las mediciones antropométricas se registraron con una exactitud de una décima y se calculó el índice de masa corporal (IMC = kg/m2). Los valores obtenidos de las dimensiones antropométricas se emplearon para establecer el estado nutricional de los pacientes.9 El perfil nutricional se completó con determinaciones hematológicas y bioquímicas de interés nutricional hechas en el laboratorio clínico del hospital donde opera el grupo interdisciplinario.10 La desnutrición se estableció con un valor del IMC menor de 18.5 kg/m2, una masa muscular esquelética (reconstruida del área muscular del brazo) menor de 30%, un tamaño de la grasa corporal (reconstruida de la suma de pliegues cutáneos) menor del valor mínimamente prescrito según el género (hombre menor de 25.0%; mujer menor de 30.0%) o pérdida de peso acompañada de repercusión funcional significativa sin importar la cuantía.9
Análisis histopatológico de la mucosa intestinal: Mediante endoscopia superior hecha por inmersión en agua en el Servicio de Endoscopia Digestiva, se tomaron muestras de mucosa de duodeno y yeyuno, con las que se prepararon las láminas histopatológicas correspondientes.7 En cada lámina se describieron las características de las vellosidades intestinales y la distribución de los linfocitos intraepiteliales.11
Ensayos serológicos: Los anticuerpos anti-gliadina y antitransglutaminasa se detectaron en muestras de suero o plasma mediante técnicas inmunoenzimáticas descritas previamente.12,13
Identificación de los alelos DQβ1*02 y DQβ1*0302: Se identificaron mediante técnicas de PCR-SSP.14,15 El ácido desoxirribonucléico (ADN) se extrajo mediante salting-out de los leucocitos contenidos en una muestra de 0.5 mL de sangre venosa del enfermo. Se aseguró la pureza del ADN extraído mediante el análisis espectrofotométrico pertinente.16 El ADN extraído y purificado fue digerido con 25 μL de enzima Taq polimerasa (AmpliCEN, Inglaterra). Los fragmentos resultantes se amplificaron en un termociclador (Minicycler, MJ Research, Inglaterra) con un protocolo de dos ciclos de 10 y 20 repeticiones respectivamente, en presencia de solución tampón TDMH (Tampón 10X Base: 0.668 mL; MgCl2 25 mM; Sacarosa 8.33%; dATP 100 mM; dCTP 100 mM; dGTP 100 mM; y dTTP 100 mM). Se utilizaron cebadores suministrados por el National Blood Service (Inglaterra). Cada mezcla de cebadores contenía como control interno un fragmento de 796 pb correspondiente al tercer intrón de DRB1. Finalmente, los fragmentos amplificados se resolvieron mediante electroforesis en gel de agarosa al 2% y se contrastaron con patrones ensayados en paralelo.17
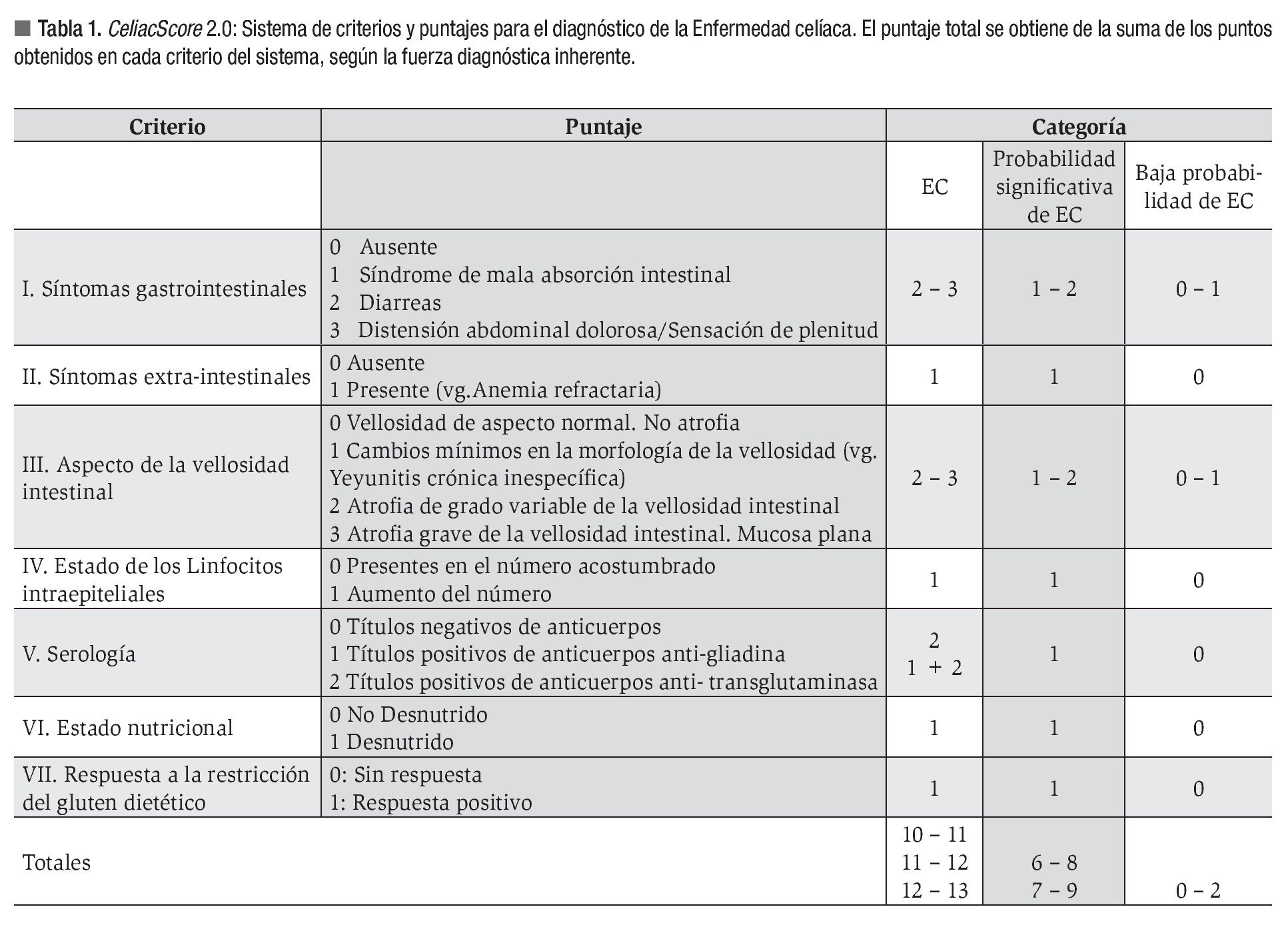
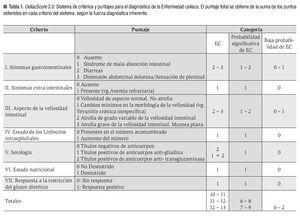
CeliacScore 2.0; actualización del Sistema de puntaje para el diagnóstico de la EC: El sistema CeliacScore 2.0 de puntaje diagnóstico de la EC se muestra en la (Tabla 1). En la versión actualizada, el sistema CeliacScore 2.0 comprende 19 criterios distribuidos en siete categorías clínicas, histopatológicas, serológicas y nutricionales.
Con respecto a la versión previa, la categoría III (hallazgos anatomopatológicos) se separó ahora en dos nuevas: a) categoría III: aspecto de la vellosidad intestinal, para evaluar la gravedad del daño de la mucosa; y b) categoría IV: estado de los linfocitos intraepiteliales, a fin de evaluar la distribución de los mismos en el epitelio. Las categorías subsiguientes se renombraron para acomodar los cambios realizados. La sospecha de EC sería entonces elevada si se observa una atrofia de vellosidades de grado variable (Puntajes: 2 - 3) junto con un aumento del número de linfocitos intraepiteliales (Puntaje: 1).
Aplicación del sistema CeliacScore 2.0: A cada paciente se le asignó un puntaje diagnóstico de EC mediante CeliacScore 2.0, con base en la fuerza semiótica de los hallazgos en cada apartado (Tabla 1). Se tuvo como síntoma gastrointestinal principal aquel que predominó en el momento de la evaluación del paciente. El síntoma extra-gastrointestinal se estableció ante la presencia en la historia clínica de entidades acompañantes a la sintomatología actual, sujeta a tratamiento y vigilancia médica como anemia refractaria, tiroiditis crónica, artritis reumatoide, otras colagenopatías y osteoporosis.
La EC se estableció ante un puntaje igual o mayor de 10, dado por los hallazgos siguientes: presencia de diarreas o distensión abdominal dolorosa (puntaje: 2 o 3); concurrencia de otras afecciones o entidades extra-gastrointestinales como anemia, tiroiditis u osteoporosis complicada con fractura patológica entre otras (puntaje: 1); atrofia de vellosidades moderada o grave (puntaje: 2 o 3); número aumentado de linfocitos intraepiteliales (puntaje: 1); títulos positivos de anticuerpos anti-transglutaminasa o títulos positivos de ambos anticuerpos (puntaje: 2 o 3); presencia de desnutrición (puntaje: 1); y respuesta satisfactoria a la retirada del gluten dietético (puntaje: 1) en concordancia con las pautas descritas previamente.18 La respuesta a la retirada del gluten dietético se definió como satisfactoria si ocurrió alivio sintomático importante (evaluado mediante una escala análoga), aumento de peso igual o mayor a una libra por semana un kilogramo por mes; mejoría de otros indicadores antropométricos de interés nutricional y títulos negativos de anticuerpos anti-transglutaminasa después de la retirada del gluten dietético. El término: "respuesta a la restricción del gluten dietético" contempla además, la realización de un reto con gluten después de al menos seis meses de obediencia dietética. En un paciente diagnosticado como celíaco en el que se conduzca el reto con gluten cabe esperar, después de la reintroducción del gluten dietético, títulos positivos de anticuerpos anti-transglutaminasa y reaparición de la sintomatología gastrointestinal.
La EC fue descartada ante un diagnóstico anterior de síndrome de mala absorción intestinal (puntaje: 1), cambios mínimos en la mucosa duodenoyeyunal o atrofia de vellosidades leve (puntaje: 1 ó 2), coexistiendo con títulos negativos de anticuerpos antitransglutaminasa. Debido a las características operacionales de la títulación de los anticuerpos antigliadina, se determinó que la presencia de títulos positivos de estos anticuerpos no inclinara al diagnóstico de la EC.
Procesamiento de los datos y análisis estadístico-matemático: Los datos sociodemográficos y clínicos del paciente, el perfil nutricional y los resultados de los procedimientos diagnósticos se almacenaron en un contenedor digital creado en Excel versión 7.0 para Office 2003 (Microsoft. Redmont, VA, USA). Los enfermos se distribuyeron según el puntaje asignado de la manera siguiente: a) Alta probabilidad de EC (10-13 puntos); b) Probabilidad intermedia de EC (6-9 puntos); y, c) Baja probabilidad de EC (menos de 6 puntos). La asociación entre el puntaje diagnóstico de EC y el resultado de la tipificación genética HLA se evaluó mediante técnicas de análisis estadístico basadas en la distribución Ji cuadrada.19 Adicionalmente, la serie de estudio fue filtrada según el puntaje diagnosticado, la presencia de los alelos DQβ1*02 o DQβ1*0302 o ambos y la fuerza de la asociación entre los descriptores empleados como filtros evaluada mediante el cálculo de la correspondiente OR razón de disparidad.20 Se fijó un nivel de p = 0.05 como estadísticamente significativo.19
¿ Resultados
De un total de 123 sujetos, 69 (56%) completaron el proceso diagnóstico necesario para la aplicación del sistema actualizado CeliacScore 2.0 e integraron el grupo de estudio. En este conjunto de enfermos la edad promedio fue de 38.6 ± 12.5 años, se observó una mayor proporción de mujeres (68%) y menores de 60 años (96%). Los enfermos se distribuyeron según el color de la piel en aquellos con piel blanca (83%), mestiza (16%) y negra (1.4%).
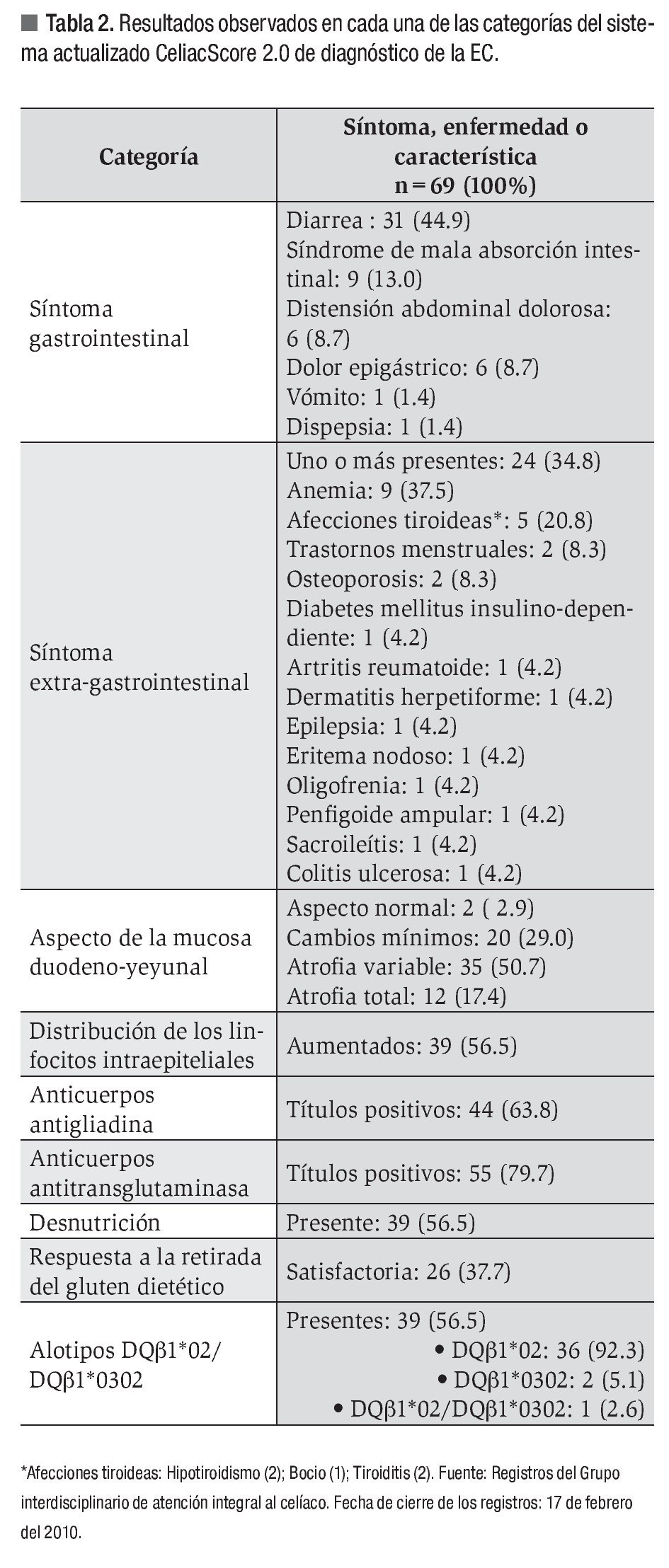
Las características clínicas, histopatológicas, serológicas y genéticas del grupo de estudio se muestran en la (Tabla 2). La diarrea fue el síntoma clínico prevalente. En 24 enfermos (35%), los síntomas digestivos concurrían con manifestaciones extraintestinales, entre las que destacaron: anemia y afecciones tiroideas (tiroiditis, hipotiroidismo y bocio). La atrofia de la mucosa de yeyuno se encontró en 12 pacientes (17%) y de grado variable en otros 35 (51%). Se observó un aumento del número de linfocitos intraepiteliales en 39 (56%) de los enfermos estudiados.
Se detectaron anticuerpos anti-gliadina positivos en 44 pacientes (64%) y anti-transglutaminasa positivos en 55 (80%). Se obtuvieron títulos positivos de ambos anticuerpos en 37 (54%). La desnutrición afectó a 39 (56%) de los enfermos. Veintiséis (38%) de los pacientes respondieron satisfactoriamente a la retirada del gluten dietético.
Los alelos DQβ1*02 y/o DQβ1*0302 se identificaron en 39 (56%) de los integrantes de la serie de estudio.
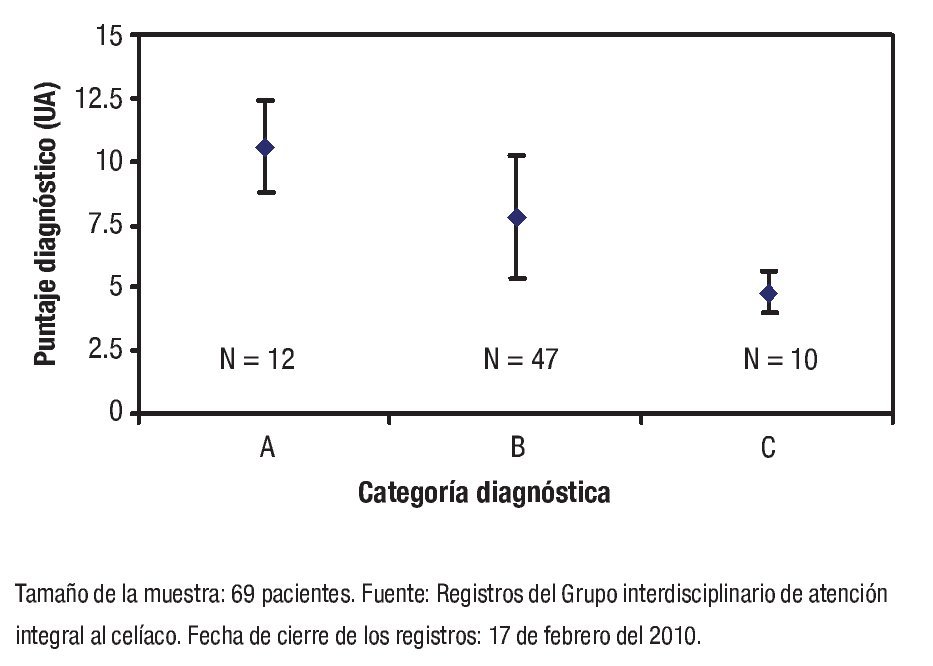
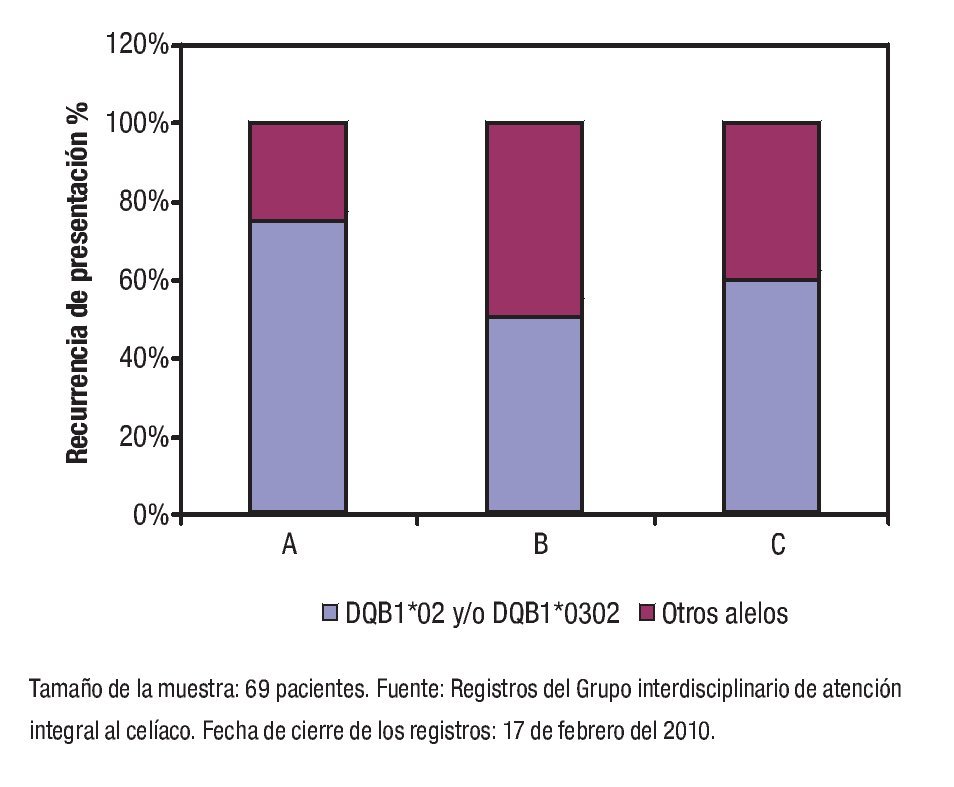
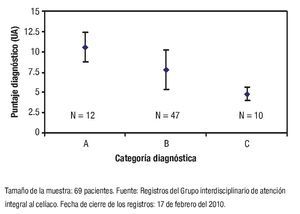
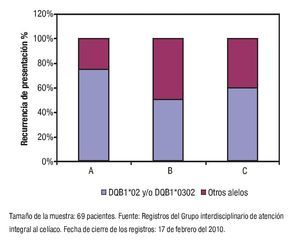
De acuerdo con el puntaje asignado, los enfermos se distribuyeron de la manera siguiente: a) Probabilidad elevada de EC en 12 (17%); b) Probabilidad intermedia de EC en 47 (68%); y, c) Probabilidad baja de EC en 10 (15%). El puntaje promedio calculado mediante el sistema Celiac-Score 2.0 fue de 7.8 ± 2.0. La distribución de los puntajes promedios según las diferentes categorías del sistema se muestra en la Figura 1. La Figura 2 muestra la distribución de los alelos DQb1*02 y DQb1*0302 en la serie de estudio según el puntaje diagnóstico de EC asignado. La prevalencia de los alelos asociados con la EC en cada categoría diagnóstica fue de la siguiente manera: a) Probabilidad elevada de EC en nueve (75%); b) Probabilidad intermedia de EC en 24 (51%); y, c) Probabilidad baja de EC en seis (60%). La distribución de los alelos DQβ1*02 y DQβ1*0302 fue independiente de las categorías del sistema CeliacScore 2.0 (Ji cuadrada = 2.3; p = 0.319).
¿ Figura 1. Distribución de los puntajes calculados mediante el sistema CeliacScore 2.0 según las diferentes categorías diagnósticas.
¿ Figura 2. Distribución de los alelos DQβ1*02 y DQβ1*0302 en la serie de estudio según el puntaje diagnóstico de EC asignado.
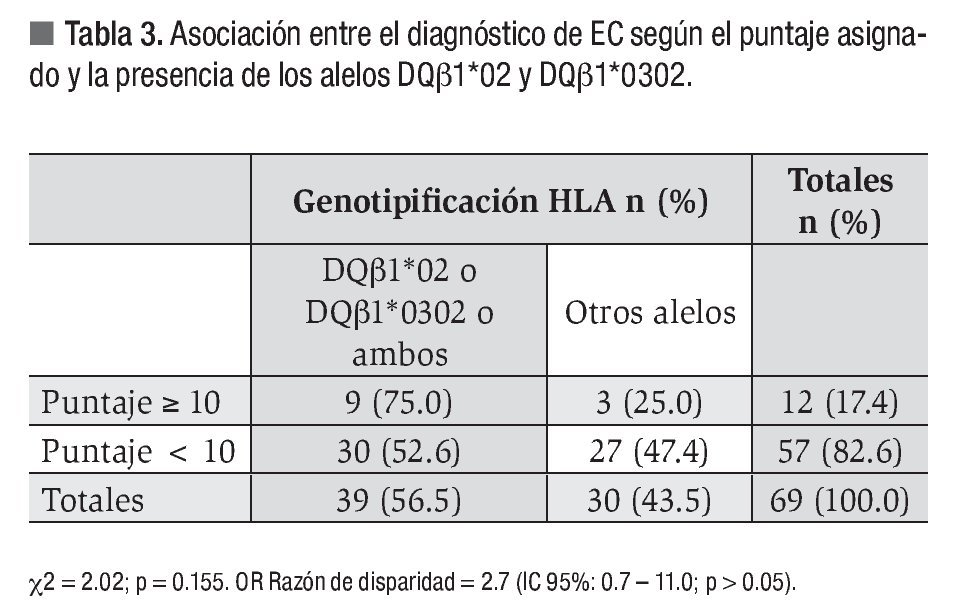
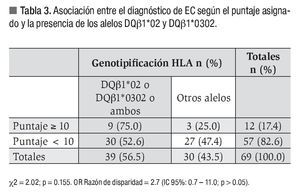
Finalmente, la Tabla 3 muestra la serie de estudio dividida de acuerdo al puntaje seleccionado para establecer el diagnóstico de EC y la presencia de los alelos DQbβ1*02 o DQβ1*0302. De los pacientes con puntajes iguales o mayores de 10, 75% presentaron los alelos relacionados con la EC. La presencia de los alelos DQβ1*02 o DQβ1*0302 o ambos fue 2.7 veces más probable en aquellos pacientes con puntajes iguales o mayores de 10. Sin embargo, la fuerza de la asociación no fue significativa (IC 95%: 0.7 - 11.0; p > 0.05).
¿ Discusión
Este trabajo ha servido para explorar las relaciones genotipo-fenotipo en la expresión de la EC. El diagnóstico de EC fue inmediato en las formas extremas de presentación, esto es, en aquellos pacientes desnutridos con una historia previa de trastornos gastrointestinales de etiología nunca aclarada que muestran atrofia de vellosidades concurrente con aumento del número de linfocitos intraepiteliales y títulos positivos de anticuerpos anti-transglutaminasa, que exhiben alivio sintomático y aumento de peso tras la retirada del gluten dietético.18
Ha resultado interesante comprobar que 75% de tales pacientes mostró los alelos DQβ1*02 o DQβ1*0302 o ambos asociados históricamente con esta enfermedad.5-6 También se pudo observar que la ocurrencia de los alelos DQβ1*02 o DQβ1*0302 o ambos era casi tres veces más probable en aquellos enfermos con puntajes mayores o iguales a 10. Estos hallazgos apoyan la hipótesis que ha guiado el estudio presente. Sin embargo, la fuerza de la asociación entre el puntaje diagnóstico asignado mediante el sistema CeliacScore 2.0 y los alelos relacionados con la EC fue débil, a juzgar del intervalo de confianza propio de la razón de disparidad.
Otros estudios conducidos en Cuba han evaluado la relación fenotipo-genotipo en la expresión de la EC. En el primero de ellos, hecho en el Servicio de Genética Molecular del Hospital Clínico Quirúrgico Hermanos Ameijeiras, la frecuencia de los alelos DQβ1*02 y DQβ1*0302 entre los celíacos diagnosticados de acuerdo con la gravedad del daño de la mucosa fue de 75%, similar a la observada en este trabajo.21 En el segundo de los estudios, conducido por el Centro de Ingeniería Genética y Biotecnología de La Habana, la frecuencia del alelo DQβ1*02 entre los celíacos conocidos con títulos positivos de los anticuerpos antitransglutaminasa fue de 90.2%, significativamente superior a la observada en la presente investigación.22 En el trabajo citado también se identificó el alelo DQα1*0501. En ambos casos, la fuerza de la asociación entre el diagnóstico de EC y la presencia alélica fue intensa (Primer estudio RM 5.9, IC 95%: 2.0 - 17.4; p <0 05 segundo estudio or 12 2 ic 95 : 6 - 57 0 i p <0 05
La independencia entre el puntaje diagnóstico asignado mediante el sistema CeliacScore 2.0 y la ocurrencia de los alelos DQβ1*02 y DQβ1*0302 podría explicarse de varias maneras. Es probable que en la categoría A del sistema diagnóstico se hayan incluido enfermos de entidades que pueden compartir los síntomas propios de la EC, como la infección por Helicobacter pylori,23,24 lo que podría afectar el resultado del sistema CeliacScore 2.0. Por otro lado, las pruebas diagnósticas empleadas en la identificación del enfermo celíaco han sido criticadas debido a las características operacionales de las mismas.24,25 El sistema CeliacScore 2.0 podría estar distorsionado por la inexactitud diagnóstica inherente a las pruebas de integra. Será necesario realizar estudios posteriores para evaluar las características operacionales de las diferentes pruebas propuestas para el diagnóstico de la EC que se incorporan en el sistema CeliacScore 2.0 tomando en cuenta el conocimiento de los alelos DQβ1*02 y DQβ1*030. También será necesario evaluar la concurrencia de otras entidades clínicas en la EC como la infección por Helicobacter pylori, por Giardia lamblia e incluso la inmunodeficiencia selectiva a IgA, por sólo mencionar algunas.
Sin embargo, la independencia entre el puntaje diagnóstico del sistema CeliacScore 2.0 y la ocurrencia de los alelos DQβ1*02 y DQβ1*0302 no debe interpretarse como la negación de la asociación genotipo-fenotipo reiteradamente demostrada para la EC, sino más bien como un recordatorio de la extraordinaria variedad de esta entidad. Por ello, no es posible establecer el diagnóstico de EC apelando a ideas aceptadas en el pasado.26 La presencia de los alelos DQβ1*02 y DQβ1*0302 en la mitad más uno de los enfermos con puntajes diagnósticos entre seis y nueve podría indicar la existencia de formas oligosintomáticas de la entidad, que muchas veces no se traducen en resultados concluyentes de las pruebas diagnósticas realizadas, lo que puede resultar en un diagnóstico diferido en el tiempo hasta tanto no se realicen los estudios genéticos. Por su parte, la ocurrencia de los alelos DQβ1*02 y DQβ1*0302 en 60% de los pacientes con una baja probabilidad de EC (puntaje igual o menor de cinco) alerta sobre la categoría EC silente, esto es, sujetos que portan la información genética que les confiere susceptibilidad de padecer la enfermedad, pero que en el momento del examen genético muestran pocos síntomas clínicos o consultan por epifenómenos no relacionados con la EC. Ya que el tratamiento de la EC se basa en la restricción del gluten dietético, podría ser difícil de aceptar tal prescripción por un sujeto ubicado en esta categoría. No obstante, estas personas deberían ser educadas en la necesidad de evaluación médica especializada regular para iniciar la intervención dietética terapéutica ante el recrudecimiento sintomático como se ha recomendado.27 Este estudio señala que el conocimiento de los alelos DQβ1*02 y DQβ1*0302 ha servido para validar un sistema de puntaje diagnóstico de la EC que integra pruebas histopatológicas y serológicas, observaciones clínicas y un ejercicio de evaluación nutricional.
Concluimos que los pacientes con los puntajes diagnósticos más altos se destacaron por una ocurrencia mayoritaria de los alelos DQβ1*02 y DQβ1*0302. Sin embargo, estos alelos también prevalecieron entre los enfermos con una probabilidad intermedia o baja de EC. El estado actual de la asociación genotipo-fenotipo en la EC es un recordatorio de la extraordinaria presentación de esta entidad y enfatiza la necesidad de la búsqueda activa de casos entre los adultos desnutridos que se presentan con una historia nunca aclarada de trastornos gastrointestinales.
Agradecimientos
Al Dr. Héctor Vega y a la Téc. Norma Turcás del Instituto de Gastroenterología de La Habana, a la Dra. Igrid García González, Dra. Karina Casanova Calero y a la estudiante Silvia Ódio Torres del Departamento de Genética Médica del Hospital Clínico Quirúrgico Hermanos Ameijeiras de La Habana. Al Dr. Yoandy Hernández Cañas del Servicio de Gastroenterología del Hospital Clínico Quirúrgico Hermanos Ameijeiras de La Habana. A los Dr. Julio Alfonso Rubí y Emilio Carpio Muñoz del CIGB Centro de Ingeniería Genética y Biotecnología, Sancti Spiritus, Cuba.
Correspondencia: Dr. Sergio Santana Porbén.
Apartado Postal 6192. Ciudad Habana 10600. Cuba.
Correo electrónico: ssergito@infomed.sld.cu
Recibido el 08 de junio de 2010;
aceptado el 30 de noviembre de 2010