El cáncer gástrico representa una de las neoplasias más frecuentes en el aparato digestivo y en la mayoría de los casos es el resultado de la progresión de lesiones premalignas. La detección oportuna de estas lesiones es relevante ya que un tratamiento oportuno brinda la posibilidad de curación. En nuestro país no existía un consenso respecto a la detección temprana del cáncer gástrico, por lo que la Asociación Mexicana de Gastroenterología reunió a un grupo de expertos y realizó el Consenso sobre detección y tratamiento del cáncer gástrico incipiente (CGI) para establecer recomendaciones de utilidad para la comunidad médica. En este consenso se utilizó la metodología Delphi y se emitieron 38 recomendaciones al respecto del CGI. El consenso define el CGI como aquel que al momento del diagnóstico se encuentra limitado a la mucosa y a la submucosa, independientemente de metástasis en ganglios linfáticos. En México, como otras partes del mundo, los factores asociados al CGI incluyen la infección por Helicobacter pylori, los antecedentes familiares, el tabaquismo y los factores dietéticos. Para el diagnóstico se recomienda utilizar cromoendoscopia, magnificación y equipos con luz mejorada. Un diagnóstico histopatológico preciso es invaluable para tomar de decisiones terapéuticas. El tratamiento endoscópico del CGI, ya sea disección o resección de la mucosa, debe ser preferido al manejo quirúrgico cuando se puedan obtener resultados semejantes en términos de curación oncológica. La vigilancia endoscópica se deberá de individualizar.
Gastric cancer is one of the most frequent neoplasias in the digestive tract and is the result of premalignant lesion progression in the majority of cases. Opportune detection of those lesions is relevant, given that timely treatment offers the possibility of cure. There is no consensus in Mexico on the early detection of gastric cancer, and therefore, the Asociación Mexicana de Gastroenterología brought together a group of experts and produced the “Mexican consensus on the detection and treatment of early gastric cancer” to establish useful recommendations for the medical community. The Delphi methodology was employed, and 38 recommendations related to early gastric cancer were formulated. The consensus defines early gastric cancer as that which at diagnosis is limited to the mucosa and submucosa, irrespective of lymph node metástasis. In Mexico, as in other parts of the world, factors associated with early gastric cancer include Helicobacter pylori infection, a family history of the disease, smoking, and diet. Chromoendoscopy, magnification endoscopy, and equipment-based image-enhanced endoscopy are recommended for making the diagnosis, and accurate histopathologic diagnosis is invaluable for making therapeutic decisions. The endoscopic treatment of early gastric cancer, whether dissection or resection of the mucosa, should be preferred to surgical management, when similar oncologic cure results can be obtained. Endoscopic surveillance should be individualized.
El cáncer gástrico es una de las neoplasias más frecuentes en el aparato digestivo y en la mayoría de los casos es el resultado de la progresión de lesiones premalignas. La detección oportuna de estas lesiones premalignas o incipientes es relevante, ya que un tratamiento oportuno brinda la posibilidad de curación y una mejor expectativa de vida. A pesar de que México es considerado un país con prevalencia intermedia para el cáncer gástrico, no existe una guía o consenso respecto a la detección de este tumor en sus etapas iniciales. Así, en enero del 2018, la Asociación Mexicana de Gastroenterología integró un grupo multidisciplinario de profesionales de la salud conformado por gastroenterólogos, endoscopistas, oncólogos, patólogos, radiólogos, cirujanos y un biomédico para que realizaran el Consenso sobre detección y tratamiento del cáncer gástrico incipiente (CGI) y se establecieran recomendaciones de utilidad para la comunidad médica.
De manera específica, el objetivo de este consenso fue preparar un documento actualizado sobre la epidemiología, el diagnóstico y el tratamiento del CGI con aplicación en la práctica médica en México. Las recomendaciones incluidas están basadas en una extensa revisión de la literatura y en la opinión consensuada de los especialistas participantes.
MétodosPara el desarrollo del consenso se utilizó el proceso Delphi1. Se designaron 3coordinadores (MEICh, FHI, MAT) y se invitó a 17 expertos de las especialidades relacionadas con el diagnóstico y el tratamiento del CGI. Los coordinadores realizaron una búsqueda exhaustiva en las siguientes bases de datos: CENTRAL (The Cochrane Central Register of Controlled Trials), MEDLINE (PubMed), EMBASE (Ovid), LILACS, CINAHL, BioMed Central y World Health Organization International Clinical Trials Registry Platform (ICTRP). La búsqueda comprendió el período del 1 de enero del 2008 al 31 de marzo del 2018. Los criterios de búsqueda incluyeron los siguientes términos: «gastric cancer» combinado con los siguientes términos: «early», «epidemiology», «incidence», «prevalence», «Mexico», «pathophysiology», «Helicobacter pylori», «metaplasia», «diagnosis», «differential diagnosis», «treatment», «endoscopy», «therapy», «management», «review», «guidelines» y «meta-analysis», y sus equivalentes en español. Toda la bibliografía se puso a disposición de los integrantes del consenso.
Posteriormente, los coordinadores elaboraron 60 enunciados, los cuales se sometieron a una primera votación anónima por vía electrónica (1 a 5 de marzo del 2018), cuya finalidad fue evaluar la redacción y el contenido de los enunciados. Los participantes del consenso emitieron su voto considerando las siguientes respuestas: a) totalmente de acuerdo; b) parcialmente de acuerdo; c) incierto; d) parcialmente en desacuerdo, y e) totalmente en desacuerdo.
Terminada la primera votación, los coordinadores realizaron las modificaciones correspondientes. Los enunciados que alcanzaron un acuerdo total >75% se mantuvieron y los que tuvieron un desacuerdo total> 75% se eliminaron. Los enunciados que tuvieron ≤ 75% de acuerdo total y ≤ 75% de desacuerdo total se revisaron y reestructuraron. Los enunciados revisados se sometieron a una segunda votación anónima por vía electrónica (18 al 27 de abril del 2018). Como parte de esta votación, además de la redacción y el contenido, cada enunciado fue evaluado de acuerdo con el grado de recomendación y la calidad de la evidencia para sustentar dicha recomendación. Esto se realizó empleando el sistema Grading of Recommendations Assessment, Development, and Evaluation (GRADE)2. En el sistema GRADE, la calidad de la evidencia no se califica únicamente sobre la base del diseño o la metodología de la investigación, sino que se juzga en función de una pregunta claramente planteada con relación a una variable de desenlace también claramente formulada3. Sobre estas bases, la evidencia puede ser alta, moderada, baja o muy baja. El sistema GRADE también establece la fuerza de las recomendaciones en fuerte o débil, a favor o en contra de la intervención o del enunciado. Es importante mencionar que el sistema GRADE se utilizó en el caso de pruebas diagnósticas e intervenciones terapéuticas. Como se muestra en la tabla 1, el sistema GRADE se expresa empleando un código que usa letras mayúsculas para clasificar la calidad de la evidencia, seguidas de un índice numérico para indicar la fuerza de la recomendación a favor o en contra de la intervención o el enunciado.
Código del sistema GRADE
| Calidad de la evidencia | Código |
|---|---|
| Alta | A |
| Moderada | B |
| Baja | C |
| Muy baja | D |
| Fuerza de la recomendación | |
| Fuerte a favor de la intervención | 1 |
| Débil a favor de la intervención | 2 |
| Débil en contra de la intervención | 2 |
| Fuerte en contra de la intervención | 1 |
Adaptado de la Oñate-Ocaña et al.3.
Los resultados de la tercera votación se presentaron el día 23 de mayo del 2018 en una reunión presencial realizada en las oficinas de la Asociación Mexicana de Gastroenterología, en la Ciudad de México. En esta reunión, los enunciados que obtuvieron un acuerdo> 75% fueron ratificados. Aquellos enunciados que no alcanzaron un 75% se discutieron y se volvieron a votar. Una vez establecidos todos los enunciados del consenso, los coordinadores elaboraron el presente manuscrito, el cual fue revisado y aprobado por todos los miembros del consenso.
ResultadosDe forma inicial, los coordinadores propusieron 60 enunciados. En la primera votación, 2 enunciados fueron eliminados por no alcanzar consenso y de acuerdo con las recomendaciones 16 fueron sintetizados, de tal manera que la segunda votación se realizó sobre 42 enunciados. Así pues, en la reunión presencial se mostró un total de 42 enunciados, 37 (88%) para ratificarse y 5 (12%) para volver a ser votados. Después de la reunión presencial se fusionaron 4 enunciados, de tal manera que el consenso final está formado por 38 recomendaciones. A continuación, se presentan las recomendaciones finales y los resultados de la votación.
Definición e incidencia de cáncer gástrico incipiente1. CGI es aquel que en el momento del diagnóstico se encuentra limitado a la mucosa y a la submucosa, independientemente de metástasis en ganglios linfáticos.
Acuerdo alcanzado: 96% totalmente de acuerdo, 4% parcialmente en desacuerdo.
El concepto original del CGI se estableció en Japón en 1962 por la Sociedad Japonesa de Endoscopia y se definió como una neoplasia gástrica que podía ser tratada exitosamente con cirugía4. Posteriormente, se estableció la definición de este primer enunciado, es decir un adenocarcinoma restringido a la mucosa o mucosa y submucosa. Esta definición fue adoptada por el Centro Nacional de Cáncer Japonés, la Asociación Japonesa de Cáncer Gástrico y la Sociedad Japonesa de Gastroenterología y Endoscopia5. El estadio TNM del CGI es T1 y cualquier N16. Estos tumores tienen un mejor pronóstico en comparación con otros estadios, con sobrevida libre de enfermedad del 90%. Una pequeña proporción de estos pacientes tiene afección de nódulos linfáticos, con una incidencia del 2 al 3% para los limitados a la mucosa y del 20 al 30% de los que tienen invasión submucosa7. Los factores de riesgo para las metástasis a nódulos linfáticos son la edad> 60 años, el tipo macroscópico deprimido, la ulceración, el tamaño mayor a 2 a 3cm, el tipo histológico indiferenciado, la invasión linfática, la invasión submucosa profunda (> 500μm) y el fenotipo gástrico mucinoso5.
2. La incidencia del CGI es del 15 al 57% de los casos de adenocarcinoma gástrico, dependiendo del área geográfica y de los programas de cribado. La incidencia del CGI en México se desconoce.
Acuerdo alcanzado: 82% totalmente de acuerdo, 6% parcialmente de acuerdo, 6% incierto, 6% parcialmente en desacuerdo.
En diversas series a nivel mundial se estima que entre el 15 y el 57% de los casos de adenocarcinoma gástrico puede detectarse en una etapa temprana o incipiente8-11. Esto es dependiente de la población estudiada, por ejemplo, es mayor en países asiáticos y también está en relación con la realización de programas de cribado en la población general.
En México, no contamos con estadísticas ni programas de detección temprana que nos permitan establecer la incidencia del CGI. En el Hospital General de México, en una serie de 63 casos quirúrgicos, ninguno tuvo clasificación T1 del TNM12. En un reporte de 863 casos del Instituto Nacional de Cancerología, solo el 3.1% de los pacientes estaban en estadio 1 al diagnóstico13. De 588 casos operados en el Centro Médico Nacional Siglo XXI, solamente el 1.5% estaba en estadio IA y el 3.7% en estado IB14.
Epidemiología y factores de riesgo para cáncer gástrico3. México es un país de riesgo intermedio para el desarrollo de adenocarcinoma gástrico. Este tumor es la cuarta causa de cáncer a nivel mundial y la tercera causa de muerte por cáncer en México en individuos mayores de 20 años.
Acuerdo alcanzado: 93% totalmente de acuerdo, 7% parcialmente de acuerdo.
De acuerdo con GLOBOCAN, el adenocarcinoma gástrico es la cuarta causa de cáncer a nivel mundial y la tercera causa de muerte por cáncer en México en individuos mayores de 20 años15. De acuerdo con la evidencia epidemiológica, México es considerado un país con incidencia intermedia (entre 10 y 20 casos por 100,000 habitantes) para cáncer gástrico16. Sin embargo, es importante reconocer que hay diferencias entre las diversas regiones del país. Por ejemplo, en un estudio Sánchez-Barriga17 informó de que Chiapas presentó la mayor tasa de mortalidad por cáncer gástrico en el período 2000-2012. Por otra parte, de acuerdo con otro estudio firmado por Gómez-Dantés et al.18 en Guerrero, Oaxaca, y Chiapas, el cáncer gástrico ocupa un lugar más alto en incidencia y mortalidad en la lista de los primeros 10 tumores malignos.
4. La incidencia del adenocarcinoma gástrico en México en 2013 fue de 13.5/100,000 habitantes y en los últimos años ha ido disminuyendo.
Acuerdo alcanzado: 82% totalmente de acuerdo, 18% parcialmente de acuerdo.
El carcinoma colorrectal ha desplazado al cáncer gástrico como la principal neoplasia gastrointestinal en hospitales de concentración de la Ciudad de México, ya que la incidencia del cáncer gástrico ha disminuido en el período de 1978 al 201219. Aunque en México carecemos de sistemas sólidos que nos permitan conocer la incidencia exacta de los distintos tumores, los datos con que contamos reportan que en 2013 en México la tasa de incidencia de cáncer gástrico estandarizada por edad fue de 13.5/100,000 habitantes19. En México, las tasas de mortalidad por cáncer gástrico ajustadas por edad disminuyeron de 7.5 a 5.6 por 100,000 habitantes entre los años 2000 y 201218.
5. Los tipos histológicos del adenocarcinoma gástrico con base en la clasificación de Lauren son el intestinal, el difuso y las formas mixtas. El tipo intestinal es más frecuente en áreas de alta incidencia y en individuos de mayor edad, mientras que el tipo difuso ocurre en áreas de baja incidencia y en individuos más jóvenes.
Acuerdo alcanzado: 88% totalmente de acuerdo, 6% parcialmente de acuerdo, 6% incierto.
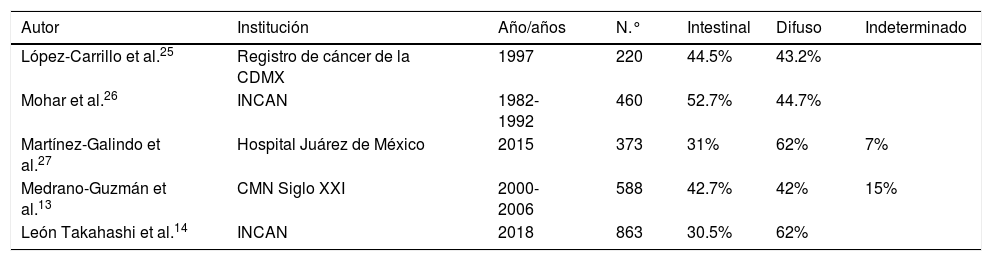
En la actualidad, hay varias clasificaciones histológicas del cáncer gástrico, las más importantes son las de Lauren20, Nakamura et al.21, Ming22, Goseki et al.23 y de la Organización Mundial de la Salud (OMS)24. De acuerdo con estas clasificaciones y con estudios epidemiológicos, se reconoce que el cáncer gástrico tipo intestinal es más frecuente en áreas de alta incidencia y en individuos de mayor edad, mientras que el tipo difuso ocurre en áreas de baja incidencia y en individuos más jóvenes. México, al igual que en otras partes del mundo, tiene una distribución similar. En la tabla 2 se muestra la distribución de los tipos histológicos de adenocarcinoma gástrico en diversas instituciones de salud en México13,14,25-27.
Tipos de adenocarcinoma en diferentes instituciones de México
| Autor | Institución | Año/años | N.° | Intestinal | Difuso | Indeterminado |
|---|---|---|---|---|---|---|
| López-Carrillo et al.25 | Registro de cáncer de la CDMX | 1997 | 220 | 44.5% | 43.2% | |
| Mohar et al.26 | INCAN | 1982-1992 | 460 | 52.7% | 44.7% | |
| Martínez-Galindo et al.27 | Hospital Juárez de México | 2015 | 373 | 31% | 62% | 7% |
| Medrano-Guzmán et al.13 | CMN Siglo XXI | 2000-2006 | 588 | 42.7% | 42% | 15% |
| León Takahashi et al.14 | INCAN | 2018 | 863 | 30.5% | 62% |
CDMX: Ciudad de México; INCAN: Instituto Nacional de Cancerología; CMN: Centro Médico Nacional.
6. Los familiares de primer grado de individuos con cáncer gástrico tienen un riesgo incrementado de presentar esta neoplasia.
Acuerdo alcanzado: 88% totalmente de acuerdo, 6% parcialmente de acuerdo, 6% incierto.
Aunque la mayoría de los adenocarcinomas gástricos son esporádicos, el 10% tiene una agregación familiar28. Los pacientes con cáncer gástrico tienen 2 a 3 veces más frecuentemente una historia familiar de cáncer gástrico29. La asociación familiar del cáncer gástrico puede ser secundaria a una exposición ambiental compartida o una verdadera susceptibilidad genética30. En comparación con individuos no infectados por Helicobacter pylori (H. pylori) y sin historia familiar de cáncer gástrico, los individuos tanto con historia familiar como infección con H. pylori CagA+ tuvieron una razón de momios (RM) de 16 (IC del 95%: 3.9-66.4) para cáncer gástrico excepto del cardias, pero la infección y la historia familiar se correlacionaron con el riesgo de cáncer de manera independiente31.
7. Algunos síndromes genéticos se asocian al desarrollo del cáncer gástrico, como el cáncer gástrico hereditario difuso, el síndrome de Lynch, el cáncer hereditario de mama y ovario, y la poliposis adenomatosa familiar.
Acuerdo alcanzado: 93% totalmente de acuerdo, 7% parcialmente de acuerdo.
El cáncer gástrico difuso hereditario es un tumor poco frecuente y es causa del 2% de todo el cáncer gástrico. Se debe a mutaciones de líneas germinales del gen de la E-caderina y sigue un patrón autosómico dominante de alta penetrancia32. El síndrome de Lynch es una alteración autosómica dominante causada por mutaciones germinales de los genes de reparación de errores de apareamiento como MSH2, MLH1, MSH6 y PMS2, con un riesgo del 13% de cáncer gástrico33. Los pacientes con poliposis familiar adenomatosa tienen riesgos del 0.5% en EE. UU. hasta el 15.5% en individuos japoneses33,34.
8. Se han detectado polimorfismos genéticos de nucleótidos únicos asociados al cáncer gástrico que incluyen: IL-1B e IL-1RN, TNF-α, reductasa de metilentetrahidrofolato y Cyp2e1, entre otros.
Acuerdo alcanzado: 93% totalmente de acuerdo, 7% parcialmente de acuerdo.
Existen polimorfismos en genes específicos que se han relacionado con el desarrollo de cáncer gástrico. El polimorfismo de TNF-α está asociado con un riesgo significativo de cáncer gástrico35. El genotipo IL1RN*22 incrementa consistentemente el riesgo de lesiones precancerosas gástricas36. Así mismo se han descrito otros polimorfismos como: reductasa de metilentetrahidrofolato y Cyp2e137-39. La prevalencia de estos genotipos en población mexicana se desconoce.
9. La infección de la mucosa gástrica por H. pylori se considera el factor de riesgo principal para el adenocarcinoma gástrico de tipo intestinal. La disminución de la infección es uno de los factores asociados a la disminución en la incidencia del cáncer gástrico intestinal en varias regiones en el mundo.
Acuerdo alcanzado: 88% totalmente de acuerdo, 6% parcialmente de acuerdo, 6% incierto.
La disminución de la infección por H. pylori es uno de los factores que se considera asociado a la disminución en la incidencia de cáncer gástrico en varias regiones en el mundo. Y aunque en las áreas rurales de México, Costa Rica, Honduras, Nicaragua, Chile y Colombia la prevalencia de H. pylori es alta (entre el 70.1 y el 84.7% ambas cifras en México), la prevalencia del cáncer en estas regiones es muy variable40, es decir, hay áreas de alta prevalencia de H. pylori con no tan alta prevalencia de cáncer gástrico. La variación genética de los factores de virulencia de H. pylori puede explicar las diferencias de las propiedades patogénicas de las cepas, lo que contribuye a la explicación de la discrepancia entre el número de infectados en una población y el porcentaje de los que desarrollan cáncer gástrico41.
10. Otros factores de riesgo bien reconocidos para cáncer gástrico son: el tabaquismo, el consumo de alcohol, de carne procesada y de nitrosaminas, la infección por el virus del Epstein-Barr y el consumo elevado de sal. Específicamente, en el adenocarcinoma del cardias, el índice de masa corporal es elevado.
Acuerdo alcanzado: 82% totalmente de acuerdo, 18% parcialmente de acuerdo.
El tabaquismo, como en otras neoplasias, se considera un factor de riesgo predominante en cáncer gástrico. El riesgo de cáncer gástrico en fumadores es de 1.62 en hombres (IC del 95%: 1.50-1.75) y 1.20 en mujeres (IC del 95%: 1.01-1.43)42. En Latinoamérica se ha establecido un riesgo de cáncer gástrico de 1.47 (IC del 95%: 1.19-1.81) en fumadores43. En un metaanálisis de estudios de varios países, se determinó el riesgo del consumo de alcohol para desarrollar cáncer gástrico con una RM de 1.39 (IC del 95%: 1.20-1.61)44.
El consumo de carne procesada se ha asociado al desarrollo de cáncer gástrico con un riesgo estimado de 1.67 (1.36-2.05) y 1.76 (1.51-2.05) en estudios de casos y controles para la carne roja y la carne procesada, respectivamente, aunque sin significación en estudios de cohortes45. En Latinoamérica, el riesgo se ha calculado en 1.64 (IC del 95%: 1.08-2.48)43. En un metaanálisis de 49 estudios (19 para nitratos, 19 para nitritos y 11 para N-nitrosodimetilamina), se mostró que los nitratos ingeridos en altas cantidades tuvieron una significación estadística débil pero positiva para la reducción del cáncer gástrico, mientras que los nitritos y la N-nitrosodimetilamina parecen incrementar el riesgo, aunque los resultados son muy heterogéneos y se requiere mayor evidencia para poder afirmar el papel de estas sustancias en el cáncer gástrico46. En pacientes mexicanos, el virus de Epstein-Barr se detectó en el 10.67% de muestras de cáncer gástrico, el 1.36% de muestras de controles sin tumor y el 8% de muestras de gastritis no atrófica47. El consumo elevado de sal se ha asociado al desarrollo de cáncer gástrico. En Latinoamérica, el riesgo se ha estimado en 2.24 (IC del 95%: 1.53-3.29)43. En un metaanálisis de 41,791 individuos, se encontró que el peso no está asociado al riesgo de cáncer gástrico, con excepción del cáncer gástrico localizado en el cardias, con riesgo para sobrepeso de 1.21 (IC del 95%: 1.03-1.42) y para obesidad de 1.82 (IC del 95%: 1.32-2.49)48.
11. Los siguientes se consideran factores de protección para el desarrollo de cáncer gástrico: ejercicio, consumo de capsaicina a dosis bajas, consumo de vegetales frescos, refrigeración de alimentos y niveles altos de selenio.
Acuerdo alcanzado: 82% totalmente de acuerdo, 18% parcialmente de acuerdo.
El riesgo de cáncer gástrico es aproximadamente del 13% menor en los individuos más activos físicamente en comparación con los individuos menos activos49. En un metaanálisis de 10 estudios con 2,452 casos y 3,996 controles, se determinó que el consumo de capsaicina en dosis bajas-moderadas protege del cáncer gástrico (RM 0.55, p=0.003) y las dosis altas promueven su desarrollo (RM 1.94 p=0.0004)50. Un estudio realizado en México sugiere que el consumo de cantidades moderadas a altas de capsaicina podría interactuar de manera sinérgica incrementando el riesgo de cáncer gástrico en sujetos genéticamente susceptibles (portadores del alelo IL1B-31C) infectados con las cepas más virulentas de H. pylori (CagA+)51. Un metaanálisis demostró que el consumo elevado de vegetales frescos disminuye el riesgo de cáncer gástrico (RM 0.62, IC del 95%: 0.46-0.85) pero los vegetales encurtidos incrementan el riesgo (RM 1.28, IC del 95%:1.06-1.53)52. La ingestión de cítricos reduce en un 13% el riesgo de cáncer gástrico, incluso el cáncer del cardias gástrico53. En un estudio transversal de casos y controles sobre factores de riesgo realizado en Veracruz, México, en el análisis multivariado, la refrigeración de los alimentos fue un factor protector contra el cáncer gástrico (RM 6.58, IC del 95%; 1.78-24.32; p=0.005)54. Los niveles altos de selenio también se han asociado a un riesgo disminuido de cáncer gástrico55.
DiagnósticoAunque el CGI es un hallazgo endoscópico detectado en pacientes con factores de riesgo, como los mencionados en los enunciados del 6 al 10, es importante destacar que frecuentemente también puede encontrarse en pacientes a los que se les realiza un estudio endoscópico por síntomas dispépticos. En este contexto, y de acuerdo con el consenso mexicano de dispepsia, la endoscopia debe realizarse en todo paciente con dispepsia no investigada que presente síntomas y signos de alarma (anemia, pérdida de peso, evidencia de sangrado de tubo digestivo) o falla a un tratamiento inicial orientado al síntoma predominante. Aunque el rendimiento diagnóstico de la endoscopia en pacientes con síntomas persistentes o refractarios no ha sido establecido en nuestro medio, realizar el estudio de diagnóstico en este contexto es lo más recomendable en el momento actual56.
12. La endoscopia convencional con luz blanca no puede detectar y caracterizar de manera precisa al CGI. Por tal motivo, es necesario el uso de cromotinción (p. ej., índigo carmín) o de tecnologías de imagen endoscópica mejorada (p. ej., NBI).
Calidad de la evidencia: B1.
Fuerza de la recomendación: fuerte a favor.
Acuerdo alcanzado: 82% totalmente de acuerdo, 18% parcialmente de acuerdo.
Existe evidencia que demuestra que los hallazgos endoscópicos utilizando luz blanca (endoscopia convencional) para la caracterización de las lesiones pre malignas como gastritis atrófica, metaplasia e incluso el patrón folicular tiene una pobre correlación con los hallazgos histológicos57,58. Así, el uso de nuevas técnicas endoscópicas como la cromotinción y el de imágenes endoscópicas mejoradas (imagen de banda estrecha o «NBI» por sus siglas en inglés) ha demostrado una mejor correlación histológica. Por ejemplo, las tinciones con el ácido acético o el índigo carmín tienen una mejor capacidad para el diagnóstico de lesiones sospechosas de corresponder con metaplasia y displasia59,60. El empleo de endoscopia de magnificación (con o sin cromotinción) también incrementa la sospecha diagnóstica (véanse los enunciados 12 y 15)61. Es importante mencionar que el empleo de estas técnicas necesita una capacitación adecuada, consume más tiempo y su disponibilidad en muchos centros es limitada.
13. Previa limpieza de saliva y otros artificios con dimeticona y n-acetil-cisteína, el uso de equipo de endoscopia de alta resolución con/sin magnificación es preferido para la detección óptima de la lesión incipiente.
Calidad de la evidencia: C1.
Fuerza de la recomendación: fuerte a favor.
Acuerdo alcanzado: 75% totalmente de acuerdo, 15% parcialmente de acuerdo, 15% incierto.
Para el diagnóstico endoscópico de las lesiones gástricas incipientes, el paciente debe someterse a una preparación adecuada, que consiste en beber una solución con agua, un agente mucolítico y un detergente 30 min antes del procedimiento. El uso de esta preparación permite una mejor observación de la mucosa gástrica, identificar mejor las lesiones y guiar mejor la toma de biopsias así como la resección o disección de la mucosa62.
En Japón, se usa una fórmula que contiene: 100ml de agua con 20,000 U Pronase (proteasas de Streptomyces griseus), 1g de bicarbonato de sodio y 10ml de dimetil polisiloxano (20mg/ml). En caso de no contar con Pronase, se puede usar una solución alternativa con: 100ml de agua, 2ml de acetilcisteína (200mg/ml) y 0.5ml (40mg/ml) de dimeticona. En México, se puede emplear 7 pastillas efervescentes de 600mg de acetilcisteína y 80 gotas de dimeticona suspensión de 100mg/ml (4ml) en un litro de agua inyectable, se administran 100ml al paciente 20 min antes del estudio y el resto se utiliza para la limpieza de residuos durante el estudio. Es imprescindible que el endoscopista pueda establecer un diagnóstico diferencial entre las lesiones benignas y las malignas. Para tales fines, la endoscopia de magnificación es una herramienta poderosa que permite un diagnóstico correcto de las neoplasias superficiales en la mucosa del esófago, estómago e intestino (véase el enunciado 15).
14. Las características morfológicas del CGI y sus formas combinadas deben reportarse de acuerdo con los criterios de la clasificación de París.
Calidad de la evidencia: B1.
Fuerza de la recomendación: fuerte a favor.
Acuerdo alcanzado: 82% totalmente de acuerdo, 18% parcialmente de acuerdo.
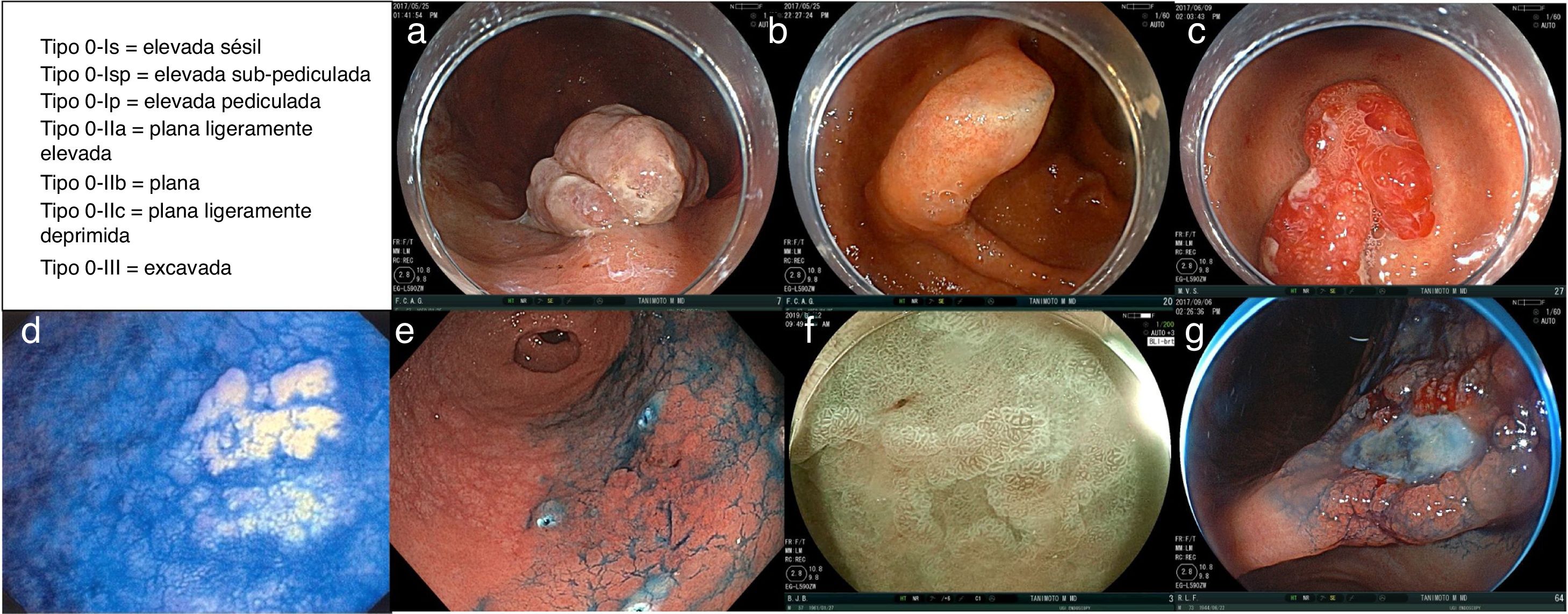
En París, un grupo internacional de endoscopistas, cirujanos y patólogos consensaron, revisaron y validaron la utilidad y la relevancia clínica de la clasificación endoscópica japonesa de las lesiones neoplásicas superficiales del tracto gastrointestinal63. La descripción macroscópica consensada para las variantes de las lesiones neoplásicas superficiales o incipientes tipo 0 del tracto digestivo se dividen en (fig. 1):
- –
tipo 0-is=elevada sésil;
- –
tipo 0-isp=elevada subpediculada;
- –
tipo 0-ip=elevada pediculada;
- –
tipo 0-iia=plana ligeramente elevada;
- –
tipo 0-iib=plana;
- –
tipo 0-iic=plana ligeramente deprimida;
- –
tipo 0-iii=excavada.
Ejemplo representativos de diversas lesiones neoplásicas superficiales o incipientes tipo 0. a) Lesión tipo 0-is (elevada sésil). b) Lesión tipo 0-isp (elevada subpediculada). c) Lesión tipo 0-ip (elevada pediculada). d) Lesión tipo 0-iia (plana ligeramente elevada). e) Lesión tipo 0-iib (plana). f) Lesión tipo 0-iic (plana ligeramente excavada). g) Lesión tipo 0-iii (no polipoide y excavada).
Imágenes cortesía Dr. Miguel Ángel Tanimoto Licona.
15. Para determinar los márgenes de un CGI idealmente se deben usar endoscopios con tecnologías de imagen endoscópica mejorada (p. ej., cromoendoscopia digital como: láser azul, banda estrecha) y posteriormente se usa cromotinción endoscópica (p. ej., índigo carmín 0.2% con/sin ácido acético 1.5%).
Calidad de la evidencia: B1.
Fuerza de la recomendación: fuerte a favor.
Acuerdo alcanzado: 82% totalmente de acuerdo, 18% parcialmente de acuerdo.
El uso de tecnologías de imagen endoscópica mejorada (p. ej., cromoendoscopia digital como: láser azul, banda estrecha) permiten una mejor caracterización de las lesiones sospechosas58-62. La NBI puede mejorar la observación del patrón microvascular y la estructura microsuperficial de la mucosa gastrointestinal. La combinación de NBI con la magnificación es una herramienta útil para visualizar con claridad la mucosa y delimitar de forma más precisa las lesiones64.
En algunos casos después de una inspección completa con tecnologías de imagen endoscópica mejorada, puede ser necesario utilizar la cromotinción. Como se mencionó anteriormente, la cromotinción implica la aplicación uniforme de un colorante sobre la mucosa gástrica para caracterizar cualquier irregularidad sutil de la mucosa65. Los colorantes de contraste como el índigo carmín se acumulan en las depresiones de la lesión y acentúan su borde y la topografía de superficie.
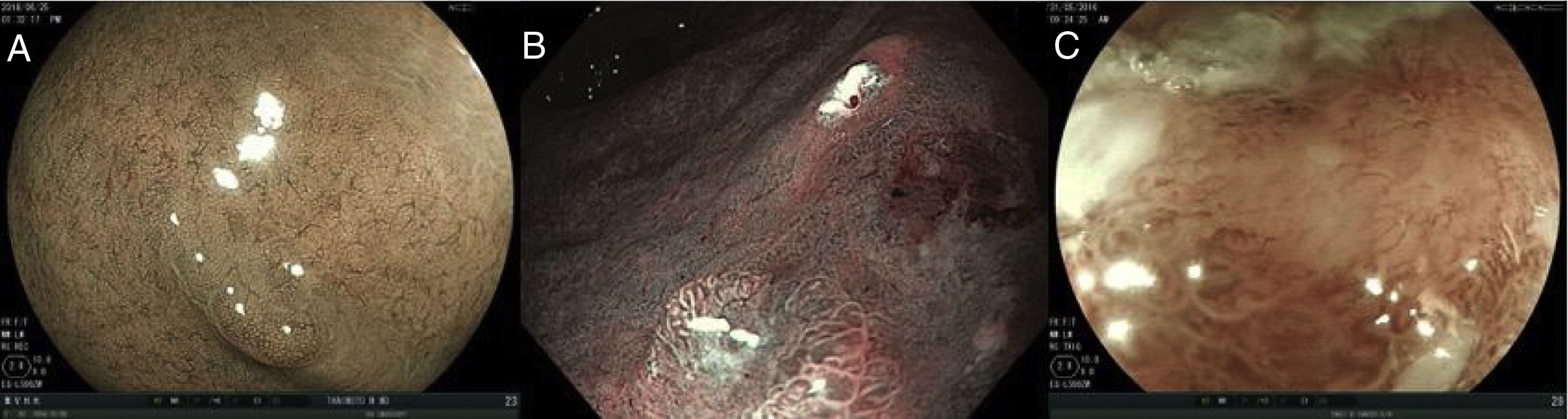
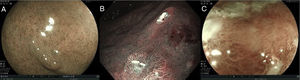
Para detectar y caracterizar un CGI con tecnologías de imagen endoscópica mejorada es necesario evaluar 3características principales tanto en la mucosa, como en los microcapilares:
- a.
Si el patrón de la superficie de la mucosa es: 1) regular, 2) irregular, y 3) aberrante o ausente.
- b.
Si los microcapilares son: 1) regulares, 2) irregulares, y 3) aberrantes o ausentes.
En la figura 2 se muestran ejemplos de los patrones antes descritos.
Ejemplos de lesiones gástricas utilizando tecnologías de imagen endoscópica mejorada que evalúa las características de la mucosa y los microcapilares. a) Patrón mucoso regular. b) Patrón mucoso irregular. c) Patrón mucoso aberrante o ausente.
Imágenes cortesía Dr. Miguel Ángel Tanimoto Licona.
16. La atrofia, la metaplasia intestinal y la displasia de bajo grado en la mucosa gástrica son factores de riesgo para CGI, mientras que la displasia de alto grado es una lesión precursora del mismo.
Calidad de la evidencia: B1.
Fuerza de la recomendación: fuerte a favor.
Acuerdo alcanzado: 88% totalmente de acuerdo, 12% parcialmente de acuerdo.
Un factor de riesgo consiste en la asociación de la presencia de una característica y la evolución hacia un resultado determinado. Por otro lado, una lesión precursora es un estado patológico que evoluciona directamente hacia una enfermedad, sin un paso intermedio66. La atrofia es una pérdida de las glándulas del epitelio gástrico que se presenta como 2variantes principales: a) desaparición de glándulas que son reemplazadas por fibrosis de la lámina propia, y b) reemplazo de las glándulas nativas por metaplasia. La metaplasia intestinal es la conversión reversible de un tipo epitelial maduro a otro maduro, como una respuesta de adaptación67. En el estómago, se reemplazan las células columnares por células de morfología intestinal y se caracterizan por tener células caliciformes que contienen moco, células de Paneth y de absorción. Estas características no se presentan en la mucosa sana gástrica, por lo que son fáciles de distinguir. Por otro lado, la displasia gástrica es una lesión precursora del cáncer gástrico. Las clasificaciones de Padua, Viena y la OMS se desarrollaron para superar las discrepancias entre los diagnósticos patológicos occidentales y japoneses y para proporcionar una clasificación universalmente aceptada de la neoplasia epitelial gástrica68. La evidencia sugiere que los pacientes con displasia de alto grado tienen un alto riesgo de progresión a carcinoma o carcinoma sincrónico. También se ha informado que los pacientes con displasia de bajo grado tienen menor riesgo de progresión a carcinoma65,66. Sin embargo, debido a las marcadas discrepancias histológicas entre las biopsias endoscópicas obtenidas con pinzas de biopsia, se recomienda la corroboración por un segundo patólogo experto antes de la resección endoscópica de estas lesiones, particularmente en presencia de otros factores de riesgo como: tamaño, morfología deprimida, eritema superficial, irregularidad, úlcera o erosión e histología tubulovellosa o vellosa69. Así mismo, la erradicación de H. pylori después de la resección endoscópica en pacientes con displasia parece reducir la incidencia de lesiones metacrónicas61,65,66.
17. Para evaluar adecuadamente la gastritis, atrofia o metaplasia intestinal por H. pylori, se deben obtener muestras mediante endoscopia de acuerdo con el protocolo de Sídney actualizado.
Calidad de la evidencia: A2.
Fuerza de la recomendación: débil a favor.
Acuerdo alcanzado: 88% totalmente de acuerdo, 12% parcialmente de acuerdo.
Este enunciado es similar a las recomendaciones emitidas por el IV Consenso mexicano para el diagnóstico y tratamiento de la infección por Helicobacter pylori70. Se recomienda seguir el protocolo de Sídney actualizado para un muestreo eficiente que incluye toma de 5biopsias: de curvatura mayor (2) y menor (2) a nivel de cuerpo gástrico y antro a 3cm del píloro, además de una biopsia de incisura (1), esta última con el fin de maximizar la identificación de lesiones premalignas71. La gravedad y la extensión de estas lesiones permite determinar en qué pacientes es necesario realizar vigilancia endoscópica, utilizando los sistemas de estadificación OLGA y OLGIM (Operative Link on Gastritis Assessment y Operative Link on Gastric Intestinal Metaplasia, por sus siglas en inglés) que estratifican el riesgo de adenocarcinoma gástrico con base en la gravedad y la extensión topográfica de la gastritis atrófica y la metaplasia intestinal, respectivamente72,73. Los sistemas OLGA y OLGIM están avalados por la Sociedad Europea de Endoscopia Gastrointestinal (ESGE) y el grupo Europeo de Estudio del Helicobacter pylori (EHSG)61. La atrofia en el sistema OLGA se clasifica en una escala de 4 niveles (0-3) de acuerdo con la escala del sistema Sídney69. Por su parte, la escala OLGIM tiene los mismos niveles de clasificación, pero evalúa la metaplasia intestinal en lugar de la atrofia. La escala OLGIM tiende a reemplazar al sistema OLGA para detectar pacientes con alteraciones gástricas que tienen potencial premaligno y básicamente reemplaza la puntuación de atrofia con una evaluación solo de metaplasia intestinal68-71. La estadificación de la gastritis organiza los fenotipos histológicos de la gastritis a lo largo de una escala de riesgo progresivamente creciente de cáncer gástrico, desde el más bajo (etapa 0) hasta el más alto (etapa iv)69-71.
18. Los sistemas para el diagnóstico de la gastritis OLGA y OLGIM principalmente en etapa iii y iv pueden ser útiles para categorizar el riesgo de progresión hacia cáncer gástrico.
Calidad de la evidencia: C1.
Fuerza de la recomendación: fuerte a favor.
Acuerdo alcanzado: 75% totalmente de acuerdo, 12% parcialmente de acuerdo, 12.5% incierto.
Aunque hay múltiples publicaciones respecto al uso de estos esquemas de clasificación de las gastritis, no existe un acuerdo sobre su utilidad. Esos sistemas son más populares en Europa y en Estados Unidos; en México, son poco conocidos. Por otra parte, estudios han demostrado que el coeficiente de correlación kappa para OLGA entre patólogos experimentados y patólogos generales es bajo para el diagnóstico de gastritis atrófica (k=0.04 a 0.12), por lo que su evaluación no es confiable74,75. En contraste, el sistema de evaluación OLGIM es más reproducible, ya que el coeficiente de correlación de kappa varía entre 0.68-0.70. Un metaanálisis reciente apoya la importancia de utilizar los sistemas OLGA/OLGIM principalmente en la etapa iii/iv, como se menciona en el enunciado 1776.
19. El diagnóstico de la estirpe histológica del CGI debe reportarse de acuerdo con la clasificación de Lauren.
Calidad de la evidencia: B1.
Fuerza de la recomendación: fuerte a favor.
Acuerdo alcanzado: 88% totalmente de acuerdo, 12% parcialmente de acuerdo.
La clasificación histopatológica tradicional de Lauren (intestinal o de tipo difuso) refleja de manera más clara las características epidemiológicas y clínicas del cáncer gástrico. Esta clasificación es útil en la práctica clínica y ayuda a decidir la extensión de la resección gástrica para el cáncer gástrico20. Todavía no se ha demostrado si las nuevas clasificaciones que dividen al cáncer gástrico en subtipos moleculares distintos pueden contribuir a definir la estrategia de una terapia onco-quirúrgica más personalizada77.
20. El diagnóstico del grado de displasia en las lesiones gástricas incipientes debe reportarse de acuerdo con la clasificación de Viena modificada.
Calidad de la evidencia: B1.
Fuerza de la recomendación: fuerte a favor.
Acuerdo alcanzado: 88% totalmente de acuerdo, 12% parcialmente de acuerdo.
La OMS reiteró recientemente la clasificación de la displasia/neoplasia intraepitelial78. Reconociendo el uso generalizado tanto de la «displasia» como de la «neoplasia intraepitelial», utiliza estos términos como sinónimos. La clasificación de Viena modificada que en el 2000 reunió a 31 patólogos de 12 países diferentes79 concluyó que las neoplasias gastrointestinales epiteliales se deben de clasificar en:
- –
C1. Negativo para neoplasia/displasia intraepitelial.
- –
C2. Indefinido para neoplasia/displasia intraepitelial.
- –
C3. Neoplasia intraepitelial de bajo grado/displasia.
- –
C4. Neoplasia intraepitelial de alto grado/displasia.
- –
C5. Neoplasia invasiva intramucosa/carcinoma intramucoso.
El sistema de clasificación de la displasia de Viena se desarrolló para estandarizar la definición de la displasia y la neoplasia gástricas entre los patólogos japoneses y occidentales. El carcinoma se diagnostica en Japón con base en los cambios en la citología y la arquitectura del tejido sin tomar en cuenta la invasión; en cambio, en Occidente, se basa en la invasión a la lámina propia, lo que enfatiza a la invasión como un indicador del potencial metastásico.
21. Los pacientes con diagnóstico de neoplasia/displasia de bajo grado en ausencia de lesión endoscópica deben tener endoscopia de seguimiento un año después del diagnóstico.
Calidad de la evidencia: C1.
Fuerza de la recomendación: fuerte a favor.
Acuerdo alcanzado: 82% totalmente de acuerdo, 18% parcialmente de acuerdo.
El riesgo de cáncer gástrico en pacientes con displasia de bajo grado es similar o incluso considerablemente mayor que el riesgo de cáncer después de la extirpación de adenomas colónicos o en pacientes con esófago de Barrett, o en aquellos con enfermedad inflamatoria intestinal de larga duración80-82. En comparación con los pacientes con displasia de alto grado, los pacientes con displasia de bajo grado parecen mostrar un menor riesgo (del 7%) de progresar a carcinoma invasivo (IC del 95%: 6-8%)83-85. Por lo tanto, parece estar indicada la vigilancia endoscópica a intervalos regulares, aunque la rentabilidad requiere una evaluación adicional86,87. Cuando la endoscopia repetida con biopsia de vigilancia confirma la presencia de displasia de bajo grado, se justifica la vigilancia continua. El tiempo es discutible, sin embargo, la mayoría de las series recomiendan al menos un estudio de seguimiento al año después del diagnóstico81-85. Cuando la displasia de bajo grado no se puede confirmar durante la reevaluación endoscópica, no se ha definido por cuánto tiempo se debe continuar con la vigilancia.
De gran importancia es el hecho de que las displasias de bajo grado y alto grado pueden presentarse como lesiones endoscópicamente visibles, deprimidas o elevadas, pero también pueden presentarse como lesiones diminutas o planas, que pueden ser aisladas o multifocales80,88,89. Por lo tanto, la desaparición de la displasia o su supuesta desaparición, mediante sucesivas biopsias tomadas por técnicas de videoendoscopia durante los procedimientos de seguimiento, no descarta la posible progresión al cáncer invasivo90-92. En caso de lesiones endoscópicas evidentes, se recomienda la resección completa como se menciona en la sección de tratamiento.
22. El diagnóstico de displasia de alto grado en ausencia de lesión endoscópica debe ser corroborado con un segundo patólogo experto y, de ser concordante, el paciente debe ser enviado a centros con experiencia.
Calidad de la evidencia: C2.
Fuerza de la recomendación: débil a favor.
Acuerdo alcanzado: 92% totalmente de acuerdo, 8% parcialmente de acuerdo.
La evidencia sugiere que los pacientes con displasia de alto grado tienen un alto riesgo de progresión a carcinoma o carcinoma sincrónico61,72. Sin embargo, debido a las marcadas discrepancias histológicas entre las biopsias endoscópicas obtenidas con fórceps, se recomienda la corroboración por un segundo patólogo experto antes de la resección endoscópica de estas lesiones, particularmente en presencia de otros factores de riesgo como: tamaño, morfología deprimida, eritema superficial, irregularidad, úlcera o erosión e histología tubulovellosa o vellosa66,72. Debido a que el tratamiento de estas lesiones requiere de un entrenamiento y equipo especial (véase la sección de Tratamiento), y la disponibilidad de expertos en nuestro país es limitada, se recomienda la referencia de estos pacientes a centros especializados. Así también, se reconoce la necesidad de programas de capacitación y entrenamiento en las técnicas que se describen más adelante.
23. No existe evidencia científica para vigilar a pacientes con atrofia/metaplasia intestinal leve a moderada limitada al antro gástrico.
Calidad de la evidencia: D2.
Fuerza de la recomendación: débil a favor.
Acuerdo alcanzado: 82% totalmente de acuerdo, 18% parcialmente de acuerdo.
Se desconoce cuál es el riesgo de progresión anual de los pacientes con atrofia o metaplasia limitadas al antro gástrico, por lo que otros consensos internacionales no recomiendan la vigilancia de estos pacientes61. Sin embargo, el riesgo de cáncer gástrico es mayor en pacientes con metaplasia intestinal de tipo incompleto, en aquellos con afección tanto de antro como de cuerpo gástrico. El control endoscópico pudiera estar justificado en los pacientes con metaplasia intestinal con al menos una de siguientes condiciones: 1) extensión de la metaplasia intestinal> 20% de la superficie del estómago; 2) metaplasia intestinal de tipo incompleto; 3) familiar de primer grado de pacientes con cáncer gástrico, y 4) fumadores93. De acuerdo con el consenso del grupo europeo, en sujetos con lesiones extensas en antro gástrico la vigilancia puede realizarse 3 años después de establecido el diagnóstico inicial61.
24. En México se sugiere escrutinio en sujetos con familiares de primer grado con el antecedente de cáncer gástrico.
Calidad de la evidencia: D2.
Fuerza de la recomendación: débil a favor.
Acuerdo alcanzado: 82% totalmente de acuerdo, 18% parcialmente de acuerdo.
Como se menciona en el enunciado 6, el antecedente de cáncer gástrico puede tener una agregación familiar. Así pues, es razonable afirmar que los familiares en primer grado de pacientes con cáncer gástrico deberían de someterse a un programa de escrutinio. Sin embargo, no existe ninguna recomendación ni guía al respecto de cuándo o como iniciar el escrutinio. Se ha propuesto, en otras poblaciones, el uso de métodos diagnósticos no invasivos, como el diagnóstico serológico de H. pylori asociado a niveles séricos bajos de pepsinógeno (PG). Esta prueba puede predecir la extensión de la atrofia gástrica y ser útil para determinar cuáles individuos podrían tener riesgo de CGI. La mejor evidencia sobre el riesgo asociado con lesiones gástricas premalignas y estos métodos no invasivos proviene de estudios de cohortes bien diseñados, preferiblemente con tiempos de seguimiento prolongados, que incluyen un gran número de pacientes y con un pequeño número de pérdidas durante el seguimiento. Por ejemplo, Zullo et al94. realizaron un estudio de cohorte de 6,983 pacientes durante 4.7 años y encontraron que los pacientes con H. pylori positivo con un PG-I <70 ng/ml y una relación PG-I/II <3.0 tenían un cociente de riesgo (HR) para el cáncer gástrico de 6.0 (IC del 95%: 2.4-14.5); en pacientes con H. pylori negativo con el mismo perfil de PG, el HR aumentó a 8.2 (3.2-21.5). En una cohorte de 100 pacientes seguidos durante 3 años, se demostró que la combinación de metaplasia intestinal incompleta y una relación PG-I/PG-II <3 se asoció significativamente a la progresión a displasia, con un HR de 13.9 (1.6-122.1) en comparación con pacientes con gastritis atrófica crónica o metaplasia intestinal completa95. A pesar de estos estudios positivos, no tenemos evidencia en México de su uso y excepto investigar y tratar la infección por H. pylori en familiares de primer grado de pacientes con historia de cáncer gástrico96, no tenemos evidencia que apoye el uso de endoscopia o pruebas serológicas.
Tratamiento25. Una vez confirmado el diagnóstico de CGI, se debe ofrecer el tratamiento curativo individualizado para cada paciente, ya sea mediante endoscopia o cirugía.
Calidad de la evidencia: C1.
Fuerza de la recomendación: fuerte a favor.
Acuerdo alcanzado: 88% totalmente de acuerdo, 12% parcialmente de acuerdo.
El CGI debe ser tratado tan pronto se diagnostica para evitar su progresión y lograr su curación. Se puede ofrecer a los pacientes el tratamiento endoscópico o quirúrgico en forma indistinta, ya que no hay estudios que hayan demostrado, de manera objetiva, que el pronóstico o la calidad de vida de los pacientes con CGI sean diferentes con uno u otro tratamiento97.
En un metaanálisis reciente de 19 estudios que agruparon a 6,118 pacientes con CGI tratados, ya fuera con resección endoscópica de la mucosa (REM) o con cirugía, se encontró que el tratamiento endoscópico se asocia a una evolución y sobrevida semejantes al manejo quirúrgico, aunque ofrece las ventajas de menor tiempo de procedimiento, menor estancia hospitalaria y menores costos y complicaciones; sin embargo, también presenta una mayor incidencia de recurrencia local y de lesiones metacrónicas favorecidas por la permanencia del órgano en el paciente98.
26. El tratamiento endoscópico debe realizarse en aquellos pacientes con lesiones cuyo tamaño permita la resección completa en una sola pieza y que además tengan una probabilidad muy baja de tener metástasis ganglionares.
Calidad de la evidencia: C1.
Fuerza de la recomendación: fuerte a favor.
Acuerdo alcanzado: 82% totalmente de acuerdo, 18% parcialmente de acuerdo.
El tratamiento endoscópico del CGI, en cualquiera de sus variantes, debe ser preferido al manejo quirúrgico cuando se puedan obtener resultados semejantes en términos oncológicos de curación. Además de las ventajas anteriormente mencionadas, otra de las ventajas del manejo endoscópico es la preservación de la totalidad del órgano, lo que abona a una adecuada calidad de vida para los pacientes93. El tratamiento endoscópico debe ser realizado en pacientes con un riesgo muy bajo de metástasis ganglionares ya que, por ser una terapéutica local, no permite su extirpación. El riesgo de adenopatías es del 1% para lesiones pT1a y de menos del 3% en lesiones pT1b99. El tratamiento endoscópico del CGI idealmente deber ser realizado solamente en centros de referencia con alta experiencia en estas técnicas.
27. Las técnicas endoscópicas sugeridas para la extirpación del CGI son la REM y la disección endoscópica de la submucosa (DESM).
Acuerdo alcanzado: 88% totalmente de acuerdo, 12% parcialmente de acuerdo.
La REM implica la separación de la lesión de la submucosa subyacente mediante la inyección de algún líquido o mediante succión, o con una combinación de ambas, para posteriormente resecarla mediante un asa de polipectomía93. Por otra parte, la DESM es la técnica mediante la cual la mucosa que rodea una lesión es resecada mediante un cuchillo electro quirúrgico seguido de la disección de la submucosa debajo de la lesión100. La técnica endoscópica debe ser elegida sobre la base de las condiciones generales del paciente, las características de la lesión, la experiencia del endoscopista y los recursos de la unidad de endoscopia en cada institución.
28. La DESM es superior a la REM en el tratamiento endoscópico del CGI.
Calidad de la evidencia: B1.
Fuerza de la recomendación: fuerte a favor.
Acuerdo alcanzado: 92% totalmente de acuerdo, 8% parcialmente de acuerdo.
En diferentes metaanálisis de estudios retrospectivos se demostró que la DESM es significativamente más efectiva que la REM para lograr la resección en una sola pieza de las lesiones (92% vs. 52%, RR de 9.69, IC del 95%: 7.74-12.13), así como para la resección completa (82% vs. 42%, RR de 5.66, IC del 95%: 2.92-10.96) y también para la resección curativa (RR de 3.28, IC del 95%: 1.95-5.54)95,101,102. A pesar de que se han reportado algunas complicaciones durante el procedimiento como la hemorragia (RR de 2.16, IC del 95%: 1.14-4.09) y perforación con un 4% para DESM vs. 1% para REM (RR de 4.67, IC del 95%: 2.77-7.87), la hemorragia fue similar en ambos grupos, con un 9% de incidencia, con una mortalidad por cualquier causa con RR de 0.65 (IC del 95%: 0.08-5.38). Los autores del estudio concluyen que la DESM es superior a la REM cuando se realiza por endoscopistas experimentados93-98.
29. El tratamiento endoscópico está indicado en tumores intramucosos diferenciados (cT1a) con un diámetro menor a 2cm.
Calidad de la evidencia: C1.
Fuerza de la recomendación: fuerte a favor.
Acuerdo alcanzado: 82% totalmente de acuerdo, 18% parcialmente de acuerdo.
El tipo macroscópico del tumor no es tan importante como sí lo es el hallazgo de ulceración en la lesión93. En algunos casos, se pueden considerar algunas excepciones a esta afirmación basándose en las llamadas indicaciones extendidas para DESM, cuando en ausencia de infiltración vascular sugieren que la probabilidad de metástasis ganglionares es muy baja93. Las indicaciones extendidas son:
- –
Adenocarcinomas de tipo intestinal mayores de 2cm de diámetro no ulcerados (cT1a UL–).
- –
Adenocarcinomas de tipo intestinal ulcerados menores a 3cm de diámetro (pT1a UL+).
- –
Adenocarcinomas de tipo difuso no ulcerados menores a 2cm de diámetro (pT1a UL–).
30. La evaluación de curación se basa en el análisis de la estirpe histológica de la pieza resecada, sus márgenes laterales, la profundidad de la invasión expresada en μs si ha llegado a la submucosa y la presencia o ausencia de infiltración linfovascular.
Calidad de la evidencia: C1.
Fuerza de la recomendación: fuerte a favor.
Acuerdo alcanzado: 88% totalmente de acuerdo, 12% parcialmente de acuerdo.
El reporte de la pieza resecada debe ser realizado por un patólogo experto y se debe reportar la profundidad, los márgenes y la invasión vascular, que como se indicó anteriormente reduce la posibilidad de metástasis ganglionares. Se recomienda que se reporten de la siguiente manera:
- –
Adenocarcinoma intramucoso de tipo intestinal, mayor de 2cm de diámetro, sin ulceración.
- –
Adenocarcinoma intramucoso de tipo intestinal, menor a 3cm de diámetro con ulceración.
- –
Adenocarcinoma intramucoso difuso, menor de 2cm de diámetro, sin ulceración.
- –
Adenocarcinoma submucoso de tipo intestinal (sm1, <500μm debajo de la muscularis mucosae) menor de 3cm de diámetro.
31. En caso de que el tratamiento endoscópico se considere como no curativo en la revisión histopatológica está indicada la resección quirúrgica adicional dado el riesgo de metástasis ganglionares.
Calidad de la evidencia: C2.
Fuerza de la recomendación: débil a favor.
Acuerdo alcanzado: 94% totalmente de acuerdo, 6% parcialmente de acuerdo.
Cuando la lesión resecada en bloque es un adenocarcinoma de tipo difuso, no ulcerado, menor de 2cm de diámetro, sin permeación linfática y vascular, con márgenes quirúrgicos negativos, se considera como resección curativa93.
En caso de que el tratamiento endoscópico se considere como no curativo en la revisión histopatológica, está indicada la resección quirúrgica adicional dado el riesgo de metástasis ganglionares. Sin embargo, en algunos casos de resección no curativa de lesiones diferenciadas, cuyo único criterio de no curación sea la resección en partes o la presencia de bordes laterales positivos, se puede hacer un nuevo intento de resección endoscópica con base en los criterios de cada hospital, repetir la DESM, utilizar la diatermia e incluso no considerar la terapia endoscópica. En un estudio de 102 pacientes con tumor residual en los márgenes laterales o verticales después de REM (n=10) o DESM (n=92) se reportó una tasa de tumor residual o recurrente del 33.3% (34/102)103. De ellos, 17 lesiones residuales en 46 pacientes fueron inmediatamente tratadas mediante nueva resección endoscópica o cirugía y otras 17 lesiones recurrentes en 56 pacientes fueron vigiladas con endoscopia por 17 meses (2-70). En un análisis univariado se encontró que la presencia de úlcera, la dirección de la lesión en el margen de resección y la longitud de la lesión en el margen lateral se asocian a la incidencia de tumor residual o recurrente. En un análisis multivariado, la longitud total en centímetros de la lesión en el margen lateral es el único factor independiente para este riesgo (RR 2.05, IC del 95%: 1.22-3.44, p=0.006)99.
32. Cuando se logra la curación del CGI mediante DESM, el riesgo de recurrencia local se reporta del 0.2 al 1.1%, con una sobrevida de los pacientes entre el 92 y el 99.9% a los 5 años.
Acuerdo alcanzado: 94% totalmente de acuerdo, 6% parcialmente de acuerdo.
En un estudio de 472 pacientes con 570 lesiones de CGI se encontró una tasa de resección en una sola pieza del 97.7% para las lesiones tratadas con DESM, con un tiempo promedio del procedimiento de 47 min (8-345). La incidencia de márgenes laterales positivos fue del 3.7% y del 3.4% para los márgenes verticales. La recurrencia local fue del 1.1% y los tumores metacrónicos se observaron en el 7.8% de los pacientes104. En otro estudio en pacientes con lesiones extirpadas con base en las indicaciones extendidas (mencionadas en el enunciado 29), se dio seguimiento durante 5 años a 1,205 pacientes con resecciones curativas, encontrando recurrencia de tumor en el 0.2% una tasa de muerte relacionada al cáncer del 0.2%105. Finalmente, en otro estudio con 1,956 pacientes y 2,210 lesiones de CGI que fueron extirpadas mediante DESM y en quienes se lograron curaciones completas sin márgenes positivos, fueron seguidos en tiempo promedio de 83.3 meses observando solamente 2 recurrencias y una sobrevida general a 5 años del 92.6% y sobrevida específica para la enfermedad del 99.9%106.
33. Las principales complicaciones de la DESM son la hemorragia y la perforación.
Acuerdo alcanzado: 82% totalmente de acuerdo, 18% parcialmente de acuerdo.
Dos son las complicaciones mayores de la DESM, la hemorragia y la perforación. La hemorragia relacionada a esta técnica se divide de acuerdo con el momento de presentación en 2tipos: intraoperatoria, en el momento de la resección y retardada, cuando se presenta después de la resección en forma de melena o hematoquecia107. Lograr la hemostasia durante la hemorragia intraoperatoria es muy importante para asegurar el éxito del procedimiento y se puede utilizar el mismo electrocauterio o grapas endoscópicas, aunque estos pueden interferir con el proceso de resección. Por su parte, la hemorragia retardada que se presenta entre el 1.8-15% puede ser tratada de diferentes maneras con base en la experiencia y recursos del endoscopista y su centro de trabajo103,108. Los factores de riesgo para esta hemorragia son la edad mayor de 80 años, la ingesta de antiagregantes plaquetarios, el sitio de la resección en cuerpo o antro y el tamaño de la lesión resecada (> 40mm).
En lo que respecta a la perforación, se reporta que puede ocurrir entre el 1.2 y el 4.5% de las DESM104. Los factores asociados con la perforación son el tamaño de la lesión, la extensión de la resección, la presencia de úlceras y la localización de la lesión en el cuerpo y fondo gástricos104,109.
En caso de que se presente una perforación, se debe intentar cerrar inicialmente con una grapa aplicada por endoscopia. Si este cierre es exitoso, se coloca una sonda nasogástrica y se deja al paciente en ayuno, iniciando algún antibiótico de amplio espectro. Si no se logra el cierre o se sospecha peritonitis, se debe solicitar la valoración de un cirujano93.
34. Para disminuir el riesgo de complicaciones después del tratamiento endoscópico del CGI, se recomienda utilizar inhibidores de la bomba de protones (IBP) a dosis habituales.
Calidad de la evidencia: C1.
Fuerza de la recomendación: fuerte a favor.
Acuerdo alcanzado: 88% totalmente de acuerdo, 12% parcialmente de acuerdo.
Aunque parece lógico pensar en el uso de los IBP para disminuir el riesgo de sangrado y favorecer la cicatrización, la evidencia al respecto es escasa. Por ejemplo, en un estudio prospectivo y aleatorizado que incluyó a 143 pacientes con CGI tratados mediante DESM, se dividieron en 2grupos que recibieron rabeprazol 20mg diarios (IBP) y cimetidina 800mg diarios (ARH2) durante 8 semanas110. El objetivo primario del estudio fue determinar la incidencia de hemorragia digestiva que necesitara terapéutica endoscópica y que tuviera un descenso de hemoglobina mayor a 2 g/dl. La hemorragia se presentó en 4 pacientes en el grupo IBP y en 11 del grupo ARH2. El análisis multivariado demostró que el uso de IBP redujo el riesgo de hemorragia, con un RR de 0.47 (IC del 95%: 0.22-0.92; p=0.028).
35. En pacientes infectados por H. pylori, una vez resecado el CGI, se debe dar tratamiento de erradicación con base en las guías actualizadas para cada región y país.
Calidad de la evidencia: A1.
Fuerza de la recomendación: fuerte a favor.
Acuerdo alcanzado: 88% totalmente de acuerdo, 12% parcialmente de acuerdo.
En México, recientemente se publicó el IV Consenso para el diagnóstico y el tratamiento de la infección por Helicobacter pylori y ahí se plasman las recomendaciones más actuales al respecto68. Recomendamos al lector revisar ese documento.
Un tema controversial, ya que algunos estudios retrospectivos y de reporte de casos informan que la erradicación de H. pylori no afecta el desarrollo de cáncer gástrico metacrónico111,112. En contraste, un estudio aleatorizado demostró que la erradicación de la bacteria después de la resección de un cáncer gástrico disminuyó la incidencia anual de cáncer gástrico metacrónico del 2-3% a aproximadamente el 1%113.
36. Después del tratamiento endoscópico del CGI, se recomienda vigilancia con endoscopia cada 6 a 12 meses a pesar de haberse obtenido evidencia histopatológica de resección curativa con la intención de detectar algún cáncer gástrico metacrónico.
Calidad de la evidencia: C1.
Fuerza de la recomendación: fuerte a favor.
Acuerdo alcanzado: 82% totalmente de acuerdo, 18% parcialmente de acuerdo.
Se define como cáncer gástrico metacrónico la lesión neoplásica localizada distante del sitio del CGI original en un período de vigilancia de un año. Después del tratamiento quirúrgico del cáncer gástrico, la incidencia acumulada para el cáncer gástrico metacrónico es del 0.9 al 3.0%114-116. En la resección endoscópica, la incidencia es mayor por la presencia del estómago. No existen estudios que comparen directamente los resultados entre la vigilancia a 6 meses y la vigilancia a 12 meses. Hay un estudio que reporta que la vigilancia anual permite el tratamiento de hasta el 95% de los cánceres gástricos metacrónicos110-112. Sin embargo, no importa si pueda tratarse de una lesión nueva, una lesión previa en fase preclínica no detectable o incluso una lesión que ya existía y pasó desapercibida, los consensos al respecto concluyen que todas deben ser consideradas como un cáncer sincrónico no detectado117. Así pues, posterior a la resección de un CGI, se recomienda la realización de vigilancia endoscópica en intervalos que pueden variar entre 6 y 12 meses después110-114.
37. El uso de quimioterapia adyuvante no se recomienda en los casos en que se hayan logrado criterios curativos del CGI.
Calidad de la evidencia: C1.
Fuerza de la recomendación: fuerte a favor.
Acuerdo alcanzado: 94% totalmente de acuerdo, 6% parcialmente de acuerdo.
La combinación de quimioterapia adyuvante en algunos casos de CGI extirpados mediante la técnica de REM puede reducir la recurrencia y mejorar la calidad de vida de los pacientes. En un estudio realizado en 112 pacientes con CGI (IA-IB) que se aleatorizaron a recibir ya fuera solo REM o REM asociada a quimioterapia (5 fluorouracilo + oxaliplatino) se demostró que, aunque no hubo diferencia en la incidencia de complicaciones, sí hubo una diferencia estadísticamente significativa con respecto a la recurrencia del CGI a favor del grupo con terapia combinada, además de mejor salud mental y emocional (p <0.05). Sin embargo, al emplear la técnica de DESM los estudios han demostrado que una vez logrados los criterios de curación no hay necesidad de implementar el manejo con quimioterápicos118.
38. La resección quirúrgica abierta o por laparoscopia está indicada en la mayoría de los casos en que no se ha logrado la resección curativa por endoscopia dado el alto riesgo de metástasis ganglionares.
Calidad de la evidencia: C1.
Fuerza de la recomendación: fuerte a favor.
Acuerdo alcanzado: 94% totalmente de acuerdo, 6% parcialmente de acuerdo.
Cuando una lesión extirpada no cumple con los criterios absolutos o extendidos de resección curativa debe ser considerada como no curativa93. Los criterios para resección curativa basada en criterios extendidos son:
- –
Adenocarcinoma intramucoso de tipo intestinal, mayor a 2cm de diámetro, sin ulceración.
- –
Adenocarcinoma intramucoso de tipo intestinal, menor a 3cm de diámetro con ulceración.
- –
Adenocarcinoma intramucoso difuso, menor a 2cm de diámetro, sin ulceración.
- –
Adenocarcinoma submucoso de tipo intestinal (sm1, <500μm debajo de la muscularis mucosae) menor de 3cm de diámetro.
En ese caso, debe ofrecerse al paciente el manejo quirúrgico abierto o por laparoscopia por el alto riesgo de metástasis ganglionares93. Sin embargo, en algunos casos de resecciones no curativas de adenocarcinomas, sobre todo por positividad en márgenes laterales, se puede repetir la DESM, usar diatermia o incluso no dar ningún tratamiento en casos en donde la morbimortalidad del acto quirúrgico supera los beneficios de calidad de vida y sobrevida del paciente93.
ConclusionesEste primer consenso mexicano sobre la detección y el tratamiento del CGI emite 38 recomendaciones al respecto. El consenso define el CGI como aquel que en el momento del diagnóstico se encuentra limitado a la mucosa y a la submucosa, independientemente de metástasis en ganglios linfáticos. Si bien no existen datos epidemiológicos, en México, como en otras partes del mundo, los factores asociados a CGI incluyen la infección por H. pylori, los antecedentes familiares, el tabaquismo y los factores dietéticos. Para el diagnóstico del CGI se recomienda utilizar cromoendoscopia, magnificación y equipos con luz mejorada. El diagnóstico histopatológico es sumamente importante, ya que ayuda a determinar el tratamiento. El tratamiento endoscópico del CGI, resección de la mucosa o DESM, debe ser preferido al manejo quirúrgico cuando se puedan obtener resultados semejantes en términos oncológicos de curación. La vigilancia endoscópica se deberá de individualizar.
FinanciaciónEste consenso se realizó con el apoyo de la Asociación Mexicana de Gastroenterología, que permitió la participación, la transportación y el hospedaje durante la votación presencial. Los autores no recibieron honorarios.
Conflicto de interesesDra. María Eugenia Icaza-Chávez es o ha sido ponente de Takeda, Asofarma y Mayoly Spindler.
Dr. Miguel Ángel Tanimoto-Licona es o ha sido ponente de Takeda.
Dr. Francisco Huerta-Iga es miembro del consejo asesor de Asofarma y es o ha sido ponente de Asofarma, Takeda y Astra-Zeneca.
Dr. José María Remes-Troche es miembro del consejo asesor de Takeda y Asofarma. Recibió fondos para la investigación por Sanfer y Asofarma. Ponente para Takeda, Asofarma, Alfa-Wassermann, Carnot, Menarini y Astra-Zeneca.
Dr. Ramón Isaías Carmona-Sánchez: es o ha sido ponente para Asofarma, Astra-Zeneca y Chinoin.
Dr. Arturo Ángeles Ángeles declara no tener conflictos de interés.
Dr. Francisco Bosques-Padilla es o ha sido ponente para Takeda, Abbvie y UCB.
Dr. Juan Manuel Blancas Valencia es o ha sido ponente para Chinoin.
Dr. Guido Grajales Figueroa declara no tener conflictos de interés.
Dr. Oscar Víctor Hernández Mondragón declara no tener conflictos de interés.
Dra. Angélica I. Hernández-Guerrero declara no tener conflictos de interés.
Dr. Miguel Ángel Herrera Servín declara no tener conflictos de interés.
Dr. Fidel David Huitzil Meléndez declara no tener conflictos de interés.
Dr. Kenji Kimura Fujikami declara no tener conflictos de interés.
Dr. Eucario León-Rodríguez declara no tener conflictos de interés.
Dr. Heriberto Medina-Franco declara no tener conflictos de interés.
Dr. Miguel Ángel Ramírez-Luna declara no tener conflictos de interés.
Dra. Clara Luz Sampieri declara no tener conflictos de interés.
Dra. Beatriz Vega-Ramos declara no tener conflictos de interés.
Dr. Alejandro Zentella Dehesa declara no tener conflictos de interés.