La encefalopatía hepática (EH) es una complicación frecuente en pacientes con cirrosis hepática y se asocia a una alta tasa de mortalidad. Los costos atribuidos al manejo de pacientes con cirrosis son especialmente elevados debido a complicaciones como la EH puesto que prolongan los días de estancia hospitalaria. Actualmente para el tratamiento de la EH, existen diferentes fármacos de los cuales los principales son la lactulosa, L-ornitina, L-aspartato (LOLA) y ciertos antibióticos, especialmente la rifaximina-α (RFX). Aunque muchos de ellos han demostrado ser efectivos en mayor o menor medida, es importante contar con información que permita discernir sobre uno y otro con el objetivo de individualizar el tratamiento al paciente y elegir la mejor opción en diferentes escenarios. Por lo anterior, el objetivo de este estudio fue analizar la evidencia sobre las ventajas y desventajas del uso individual o en combinación de los 3 principales tratamientos de la EH, específicamente su eficacia en los diferentes grados, su impacto en la calidad de vida, profilaxis y reducción de costos.
Hepatic encephalopathy is a frequent complication in patients with cirrhosis of the liver and is associated with a high mortality rate. Costs attributed to the management of patients with cirrhosis are especially high due to complications, such as hepatic encephalopathy, given that they increase the number of days of hospital stay. Different drugs are currently used to treat hepatic encephalopathy, and the main ones are lactulose, L-ornithine L-aspartate (LOLA), and certain antibiotics, especially rifaximin-α (RFX). Even though many of them have been shown to be effective to greater or lesser degrees, it is important to understand the differences between them, so that every patient receives individualized treatment and the best option is chosen, in accordance with the different clinical scenarios. Thus, the aim of the present study was to analyze the evidence on the advantages and disadvantages of the individual or combined use of the 3 main treatments for hepatic encephalopathy, specifically taking into consideration their different degrees of efficacy, their impact on quality of life, prophylaxis, and cost reduction.
La cirrosis hepática es la cuarta causa de muerte en la población mexicana, siendo causada principalmente por la infección por el virus de la hepatitis C y la enfermedad hepática alcohólica1. Se ha proyectado que hacia el año 2020 existirán aproximadamente 1.5 millones de casos de hepatopatía crónica que serán susceptibles de desarrollar serias complicaciones como hipertensión portal, ascitis y encefalopatía hepática (EH)2.
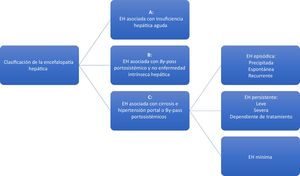
La EH es una complicación grave de los pacientes con cirrosis hepática descompensada, siendo consecuencia de insuficiencia hepática o por cortocircuitos portosistémicos, o ambos y que se manifiesta como alteraciones neuropsiquiátricas (fig. 1)3,4. Esta complicación afecta de manera importante la calidad de vida de quienes la padecen y es asociada con alta mortalidad.
Clasificación de la encefalopatía hepática (EH).
La encefalopatía hepática persistente (EHP) se considera a partir del grado II de la clasificación West Haven y su severidad dependerá de un mayor grado por dicha clasificación. La encefalopatía hepática mínima (EHM) es caracterizada por alteraciones cognitivas leves solo detectadas mediante pruebas psicométricas y será considerada como tal cuando el paciente tenga grado I de la clasificación de West Haven.
En 2011 en Italia, de una base de datos nacional con 2,678,462 pacientes hospitalizados de diferentes regiones del país, 381 (0.014%) de dichas hospitalizaciones se debieron a EH, de los cuales el 21% de estos murieron en el primer internamiento y el otro 5.8% murió durante el resto del 2011. De aquellos que no fallecieron, el 42% se hospitalizó nuevamente en el curso del mismo año, la mayoría por recaída de EH5. Hallazgos similares se informaron en una revisión de 8,766 adultos internados por EH en hospitales de los Estados Unidos: la mortalidad fue del 5 al 17% pero aumentó al 40% en los casos de EH grave, mientras que otro 40% se hospitalizó nuevamente por EH en el curso de un año6. Por otra parte, la EH puede ser un importante factor de mortalidad independiente de otras complicaciones relacionadas con cirrosis o incluso de falla orgánica extrahepática. Lo anterior fue observado más recientemente por Bajaj et al. en un estudio con más de 1,500 pacientes hospitalizados por EH grado III o IV quienes tuvieron una mayor mortalidad hospitalaria a los 30 días, independientemente de la falla de órganos extrahepáticos7.
Para el estudio y mejor abordaje clínico de la EH esta se clasifica en 3 principales categorías según su causa, de acuerdo con el consenso de Viena del 2002 (fig. 1)8,9. La categoría C agrupa la EH espontánea, donde se subclasifica de acuerdo con su inicio clínico; la EH mínima (EHM), la cual agrupa trastornos neurocognitivos subclínicos solo identificados por pruebas neuropsicológicas; y la EH persistente (EHP), que en contraste a la anterior esta es franca o manifiesta y se subclasifica como grave si cuenta con criterios de la clasificación de West Haven. Por último, se puede clasificar como dependiente de tratamiento cuando los síntomas inician al momento de suspender el tratamiento de la EH9,10. El término EH recurrente se reserva para aquellos pacientes que presentan 2 episodios de EH episódica en un año, independientemente de que existan o no factores desencadenantes. Finalmente, esto también permite diferenciar los costos atribuidos a la EH según su severidad.
De acuerdo con las guías de práctica clínica europeas y americanas sobre el manejo de la EH, las opciones terapéuticas que han mostrado mejores resultados son la lactulosa, siendo esta el tratamiento de primera línea, la rifaximina-α (RFX) y la sal estable de los aminoácidos ornitina y aspartato, L-ornitina L-aspartato (LOLA)4. En contraste, las guías mexicanas son menos ilustrativas con respecto a las diferentes estrategias terapéuticas; por ejemplo, mientras que desde 2009 la Asociación Mexicana de Gastroenterología distingue la lactulosa como el tratamiento de primera línea para cualquiera grado de EH, vía enteral o por enemas, seguido de RFX, LOLA o metronidazol en su algoritmo de tratamiento11, además de presentar evidencia de otros medicamentos sin comparar la efectividad entre uno y otro, la guía de práctica clínica de la Secretaría de Salud del 2013, a pesar de presentar evidencia sobre la efectividad de la RFX y LOLA en la EHP y del desuso en el que ha caído la neomicina y las condiciones en las que debe usarse el metronidazol, esta sigue recomendando el uso de neomicina y metronidazol como tratamiento de segunda línea para aquellos pacientes que no responden a la lactulosa o lactitol12.
Por lo anterior, el objetivo del presente trabajo es realizar una revisión de la evidencia más actual sobre la eficacia de la RFX en comparación con lactulosa y LOLA en la mejoría de diferentes aspectos de la EH, entre los que incluimos la disminución de costos asociados al tratamiento y hospitalización, la eficacia en los diferentes grados de EH, la eficacia en la prevención de recaídas, la disminución de accidentes por caídas, la mejoría del estado cognitivo y calidad de vida en pacientes con la EHM, el apego al tratamiento y finalmente su utilidad en otras complicaciones de la hepatopatía crónica (tabla 1).
Comparación de la eficacia de la rifaximina en diferentes variables de la EHP
| Comparación metaanálisis | Intervención terapéutica | Mejoría clínica/Resolución de la EHP | Reducción de la mortalidad | Profilaxis primaria | Profilaxis secundaria | Impacto sobre la calidad de vida | Tolerabilidad/Perfil de seguridad | Costo-efectividad |
|---|---|---|---|---|---|---|---|---|
| Jiang et al., 200849 | RFX vs. lactulosa | RFX=lactulosa en el tratamiento de cuadro agudo y crónico | No medido | No medido | No medido | No medido | RFX>lactulosa (especialmente cuando el principal efecto secundario por lactulosa fue dolor abdominal) | No medido |
| Eltawil et al., 201248 | RFX vs. lactulosa RFX vs. antibióticos (neomicina y paromomicina) | RFX=lactulosaRFX=otros antibióticos | No medido | No medido | No medido | RFX>lactulosa y antibióticos en el desempeño de las pruebas psicométricas | RFX>lactulosa y antibióticos | No medido |
| Wu et al., 201387 | RFX vs. lactulosa | RFX=lactulosa | No medido | No medido | No medido | RFX>lactulosa y antibióticos en el desempeño de las pruebas psicométricas | RFX>lactulosa y antibióticos | No medido |
| Kimer et al., 201488 | RFX vs. placebo RFX vs. lactulosa RFX vs. otros antibióticos | RFX>placeboRFX>lactulosaRFX>otros antibióticos | RFX>placeboRFX>lactulosaRFX>otros antibióticos | No medido | RFX>placeboRFX>lactulosaRFX>otros antibióticos | No medido | RFX>placeboRFX>lactulosaRFX>otros antibióticos | RFX>placeboRFX>lactulosaRFX>otros antibióticosRFX>placebo/No intervenciónLactulosa (monoterapia)>RFX (monoterapia) |
| Zhu et al., 201589 | Comparación de aminoácidos, RFX, lactulosa, LOLA | Todas las intervenciones>ninguna | LOLA>aminoácidos, lactulosa, RFX | No medido | No medido | No medido | Misma tolerabilidad para todas las intervenciones | No medido |
| Thumburu et al., 201790 | Comparación de lactulosa, LOLA, RFX, probióticos y aminoácidos en tratamiento individual y/o combinado | No medido | No medido | LOLA>placeboLactulosa>placeboProbiótico>placeboRFX=placeboNinguna intervención fue superior entre ellas | No medido | No medido | No medido | No medido |
| Wang et al., 201950 | Lactulosa+RFX vs. lactulosa (monoterapia) | Lactulosa+RFX>lactulosa | Lactulosa+RFX>lactulosa | No medido | No medido | Lactulosa+RFX>lactulosa | Lactulosa + RFX=lactulosa | Lactulosa+RFX >lactulosa (disminución de 10 hospitalizaciones) |
En esta tabla se pueden encontrar los resultados de los metaanálisis sobre diferentes intervenciones de la RFX y otras terapias para la EHP. Se compara la eficacia de estos tratamientos en diferentes escenarios.
>: superior a; =: igual a; EHP: encefalopatía hepática persistente; LOLA: L-ornitina, L-aspartato; RFX: rifaximina; RFX/lactulosa: terapia combinada de rifaximina y lactulosa.
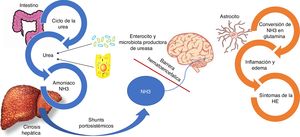
A pesar de que en los últimos 20-30 años ha habido un rápido progreso en la comprensión de las bases fisiopatológicas de la EH, la falta de correlación directa entre los factores patogénicos y la gravedad de la EH dificulta la selección de una terapia adecuada. Aun así, la mayoría de los tratamientos actualmente disponibles tienen como objetivo reducir los niveles de amoniaco (NH3)13,14.
Aunque existen otros factores envueltos en la fisiopatología de esta condición, tales como citocinas inflamatorias, y depósito de manganeso en los ganglios basales, el NH3 es aún considerado el principal factor para desarrollar EH15. Este último es producido a partir del nitrógeno, especialmente por la acción de la enzima glutaminasa ubicada en los enterocitos del intestino delgado y el colon, así como por la acción de la gran cantidad de bacterias productoras de ureasa que son parte de la microbiota intestinal. En circunstancias normales el NH3 se metaboliza en el hígado y luego se elimina por el riñón y en menor medida, por los músculos (fig. 2)16.
Fisiopatología de la encefalopatía hepática.
El amoniaco (NH3) está compuesto por nitrógeno e hidrógeno y es derivado principalmente del metabolismo proteico. En circunstancias normales el NH3 es convertido en urea para ser eliminado por los riñones y músculo-esquelético. Paralelamente, un cuarto de la urea producida del ciclo de la urea es enviada al intestino, donde es convertida en NH3 especialmente por la acción de la enzima glutaminasa ubicada en los enterocitos del intestino delgado y el colon, así como por la acción de la gran cantidad de bacterias productoras de ureasa que son parte de la microbiota intestinal. En el contexto de insuficiencia hepática, como es el caso de los pacientes con cirrosis hepática, el proceso del metabolismo del NH3 se ve interrumpido dando como resultado el incremento del NH3. Adicionalmente, los shunts portosistémicos pueden ayudar al incremento circulante del NH3 el cual atraviesa la barrera hematoencefálica y se metaboliza en los astrocitos por la glutamina sintetasa, que convierte el NH3 y el glutamato en glutamina. La acumulación de glutamina en los astrocitos crea un gradiente osmótico, lo que resulta en la inflamación de los astrocitos y la generación de especies reactivas de oxígeno. Estudios de imagen han demostrado edema cerebral incluso en pacientes con encefalopatía hepática mínima, el cual se relaciona con deterioro cognitivo.
En los pacientes con cirrosis, la disfunción hepática altera el metabolismo hepático del NH3 y la hipertensión portal provoca la derivación de la sangre portal rica en NH3 a la circulación sistémica. En el cerebro, el NH3 atraviesa la barrera hematoencefálica y se metaboliza en los astrocitos por la glutamina sintetasa, que convierte el NH3 y el glutamato en glutamina15. La acumulación de glutamina en los astrocitos crea un gradiente osmótico, lo que resulta en la inflamación de los astrocitos y la generación de especies reactivas de oxígeno, lo que contribuye a la disfunción cerebral observada en la EH (fig. 2)17,18.
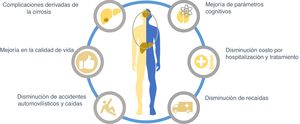
Aunque en general los objetivos del tratamiento de la EH son resolver el cuadro agudo, disminuir la mortalidad y acortar la duración de la hospitalización, después hay que prevenir las recaídas y nuevos internamientos ya que el tratamiento es costoso, por lo tanto, debe intentarse disminuir los costos de la atención médica manteniendo la mejor eficacia. Por otro lado, deben considerarse también aquellos tratamientos que mejoren la calidad de vida de los pacientes con EH y que puedan actuar sobre otras complicaciones de la cirrosis hepática (fig. 3).
Objetivos del tratamiento de la encefalopatía hepática (EH).
El tratamiento de la cirrosis hepática debe incluir un manejo integral de la EH. Para ello es importante considerar que un gran porcentaje de los pacientes con cirrosis desarrollarán algún grado de EH, para lo cual puede iniciarse tratamiento de prevención primaria con el fin de mejorar su calidad de vida, evitar accidentes, dependencia de cuidadores y hospitalizaciones. En aquellos pacientes que ya desarrollaron EH y fueron hospitalizados debe considerarse el tratamiento que disminuya el tiempo de hospitalización.
La EHM es caracterizada por un deterioro neurocognitivo asociado con una pobre calidad de vida incrementando además el riesgo de desarrollar EHP10. De hecho, estos pacientes ya muestran alteraciones cerebrales significativas que se pueden demostrar por resonancia magnética antes de progresar hacia algún grado más severo de EH. Estos cambios se correlacionan con la presencia de edema cerebral en pacientes con EHM, quienes luego de ser tratados mejoran su estado cognitivo a través de un mejor desempeño en diferentes pruebas psicométricas aplicadas19. Lo anterior sirve como ejemplo de que debe tratarse la EHM, la cual es aún subestimada10,20.
A pesar de los efectos negativos que tiene la EHM, la falta de tratamiento también radica en su falta de diagnóstico, el cual se realiza mediante la aplicación de pruebas psicométricas. De las anteriores destacan la escala psicométrica de EH (psychometric hepatic encephalopathy score [PHES]), pruebas de control inhibitorio (Inhibitory Control Test [ICT]) y la frecuencia de fusión de parpadeo (critical flicker frequency [CFF])21,22.
Las pruebas anteriores no solo permiten el diagnóstico de la EHM, además permiten determinar la falta de funciones cognitivas importantes que suponen para el paciente vivir en un estado de discapacidad en sus actividades diarias23. Aquellos pacientes con EH son propensos a sufrir accidentes automovilísticos y caídas frecuentes durante la deambulación. Respecto a esta última, estas se deben al deterioro de funciones neuromotoras para posteriormente complicarse con fracturas secundarias a osteoporosis por desnutrición, hipogonadismo e insuficiencia hepática24.
En relación con los accidentes automovilísticos, en 2004 se llevó a cabo un estudio prospectivo para evaluar la capacidad de conducción a través de pruebas de conexión numérica, pruebas de reacción y símbolos en pacientes con EHM, el cual concluyó que los pacientes no estaban capacitados para conducir un vehículo25. Posteriormente se llevó a cabo otro estudio donde se evidenció que una alta proporción de pacientes con EHM con un bajo desempeño en las ICT sufrieron más accidentes automovilísticos que aquellos pacientes sin EHM (17% vs. 0.0%, p=0.0004)26. Dado el potencial riesgo de muerte por dichos accidentes y los costos que representa para el paciente es recomendable tratar a los pacientes con EH de forma temprana. Para demostrar lo anterior, se llevó a cabo un estudio durante 8 semanas en 42 pacientes que se aleatorizaron para recibir placebo o RFX durante todo el estudio con el objetivo de valorar el desempeño de estos pacientes en simuladores de conducción tras el tratamiento. Adicionalmente se evaluó la calidad de vida de los pacientes y sus habilidades cognitivas utilizando el perfil de impacto de la enfermedad (Sickness Impact Profile [SIP]). Se llegó a la conclusión de que los pacientes con EHM mejoran significativamente el rendimiento del simulador de conducción después del tratamiento con RFX, en comparación con el placebo27.
Por otro lado, el tratamiento con lactulosa también ha beneficiado a esta población. El tratamiento por 3 meses con lactulosa en el contexto de EHM mejora tanto el desempeño cognitivo como la calidad de vida, lo cual nuevamente se puede demostrar mediante la aplicación de pruebas de completar figuras, pruebas de conexión numérica, pruebas de diseño de bloques y cuestionario SIP para el caso de la evaluación de la calidad vida28.
Si se compara la lactulosa con la RFX en la EHM, se pueden encontrar resultados contradictorios, desde aquellos que apoyan el uso de alguno de los 2 hasta aquellos que no encuentran inferioridad o superioridad entre ellos. Al respecto, un estudio en India con 351 pacientes con EHM comparó la efectividad de la RFX (tableta de 400mg 3 veces día) versus lactulosa (30-120ml/día) en la calidad de vida utilizando nuevamente cuestionarios SIP. A los 3 meses de tratamiento se encontró una reducción de la EHM en el 73.3% de los pacientes con RFX y en el 69.1% del grupo tratado con lactulosa. Aunque ambos tratamientos mejoraron la calidad de vida, no se pudo establecer la no inferioridad de la RFX sobre la lactulosa ya que el margen de no inferioridad preespecificado (−5%) se encontró dentro del intervalo de confianza (IC) bilateral del 90% de la diferencia. Sin embargo, el grupo tratado con lactulosa presentó cuadros de flatulencia significativamente altos con respecto a los pacientes con RFX29.
Finalmente, desde el punto de vista farmacogenómico, existe diferencia significativa entre lactulosa y RFX en la que reducen los costos derivados por la EHM. Actualmente existe evidencia que apunta a que la lactulosa es la mejor opción de costo-efectividad. De hecho, si bien el tratamiento con RFX en la EHM reduce costos en comparación con ninguna otra intervención, al compararla con la lactulosa no tuvo ningún beneficio costo-ahorrador30.
En cuanto a la combinación de RFX/lactulosa, esta es superior al manejo individual con cualquiera de las 2 opciones, revirtiendo la EHM en 3 meses y evitando recaídas hasta por 6 meses31.
Sobre el uso de LOLA, un metaanálisis que incluyó 8 ensayos clínicos aleatorizados concluyó igualmente la eficacia de este tratamiento versus placebo tanto en le EHP como en la EHM y con la misma efectividad que la lactulosa32. Dos ensayos clínicos aleatorizados compararon las 3 opciones terapéuticas versus placebo, pero no entre ellas. Actualmente no hay estudios que comparen LOLA y RFX en la EHM33,34.
En conclusión, el objetivo principal del tratamiento de la EHM es la prevención de accidentes y hospitalización que mejoran la calidad de vida de los pacientes desde el punto de vista cognitivo, económico y funcional. Con la evidencia encontrada parece no haber diferencias entre la RFX y la lactulosa para alcanzar los objetivos mencionados29. Sin embargo, aunque parece haber un menor costo con la lactulosa, la RFX es mejor tolerada por los pacientes, lo cual fue puesto de manifiesto por Bajaj et al en 201035. Lo anterior es importante para poder asegurar un buen apego al tratamiento, por ello se debe considerar también el estado del paciente para poder discernir entre una opción u otra. En cuanto al uso de LOLA, aunque en efecto no ha demostrado ser superior a la lactulosa y RFX, dada su seguridad puede considerarse en combinación con cualquiera de las otras 2 opciones o incluso como apoyo nutricional junto con los aminoácidos de cadena ramificada, los cuales también han demostrado mejorar los resultados de las pruebas psicométricas de los pacientes con EHM36,37.
Encefalopatía hepática persistenteLa EHP se asocia con una mayor tasa de hospitalización, mortalidad y calidad de vida deficiente38. Su manejo también debe dirigirse a la educación del paciente y de los familiares, evitar la progresión de la enfermedad hacia grados más severos (tabla 1) y la adherencia al tratamiento39.
El grado I de la EH se caracteriza por falta de alteraciones de conciencia, menor capacidad de atención y leve asterixis o temblor. El grado II, donde ya puede considerarse EHP, se caracteriza por letargo, desorientación y evidente asterixis. El grado III consiste en somnolencia, desorientación con un comportamiento extraño y rigidez muscular con clonus e hiperreflexia, mientras que el grado IV consiste en coma franco. Todo ello de acuerdo con los criterios de West Haven40.
El primer paso en el tratamiento de la EHP es identificar y tratar las causas precipitantes, que incluyen el manejo de la hipovolemia, sangrado gastrointestinal, infección, el uso excesivo de diuréticos, diarrea, vómitos, hiponatremia, hipopotasemia o hipercalcemia, el estreñimiento, uso de benzodiacepinas y el incumplimiento de la terapia indicada.
Un metaanálisis del 200441 evaluó 22 ensayos clínicos con el objetivo de comparar el desempeño de los disacáridos no absorbibles en el manejo de la EHP contra placebo, ninguna intervención o antimicrobianos. En comparación con placebo o ninguna intervención, la lactulosa y el lactitol parecieron reducir el riesgo de no mejorar la EH (riesgo relativo, 0.62; IC del 95%, 0.46 a 0.84). Sin embargo, no fueron superiores al compararse con los antibióticos, los cuales incluyeron neomicina, ribostamicina, vancomicina y RFX. Es importante mencionar que, a diferencia de la RFX, los otros 3 antibióticos han caído bastante en desuso, principalmente por sus efectos secundarios37.
Además, el tratamiento con lactulosa también ayudó a la prevención de EH recurrente y en la reducción del riesgo de eventos adversos graves por insuficiencia hepática, hemorragia por várices, peritonitis bacteriana espontánea, síndrome hepatorrenal y, en última instancia, sobre la mortalidad42.
El uso de la RFX también está documentado en el tratamiento de la EH manifiesta, especialmente para los cuadros agudos. El primer estudio multicéntrico de la RFX fue en 1993 donde además de su efectividad se probó que es un fármaco bien tolerado43; especialmente a corto plazo, tanto si se compara con la lactulosa como con otros antibióticos44. En cuanto al tratamiento a largo plazo y prevención de recaídas, parece no haber diferencia entre la RFX y los disacáridos45.
Recientemente Bass et al.46 realizaron un ensayo aleatorizado, doble ciego, controlado con placebo que incluyó 299 pacientes que estaban en remisión por EH recurrente para recibir ya sea RFX, a una dosis de 550mg 2 veces al día (140 pacientes), o placebo (159 pacientes) durante 6 meses. El 13.6% de los pacientes en el grupo de RFX tuvieron una recaída por EH, en comparación con el 22.6% de los pacientes en el grupo de placebo, para una relación de riesgo de 0.50 (IC del 95%, 0.29 a 0.87; p=0.01). Sin embargo, más del 90% de los pacientes en ambos grupos recibieron terapia concomitante con lactulosa.
Tal como en la EHM al compararse con la lactulosa, la RFX parece tener al menos la misma eficacia47,48 y aunque esta efectividad puede depender de si el tratamiento es a corto o largo plazo, la RFX sigue siendo mejor tolerada, presenta menores efectos secundarios y es la que más reduce los niveles de NH345,49.
Por el contrario, la combinación de RFX/lactulosa es más eficaz que la lactulosa sola en el tratamiento de la EH manifiesta. Al compararse esta combinación versus lactulosa sola, se puede llegar a una disminución de la mortalidad (23.8% vs. 49.1%, respectivamente) y una reducción del tiempo de hospitalización de 5.8 días vs. 8.2 días, respectivamente.50,86.
Mientras que el uso de la RFX y/o lactulosa parecen ser las mejores opciones, el tratamiento únicamente con LOLA no está lo suficientemente sustentado para considerarse como de primera línea. De hecho, su efectividad en la EH manifiesta solo se ha observado en los grados menos severos (grado II) de la EHP y en la EHM51–53.
Finalmente, en relación con otros tratamientos, en un metaanálisis sobre el uso del zinc, los ensayos disponibles que se estudiaron tuvieron resultados heterogéneos y no pudieron medir resultados críticos como la calidad de vida, lo que dificulta la capacidad de llegar a conclusiones sobre el valor de los suplementos orales como el zinc en el tratamiento de la EH. Además, estaba disponible poca información sobre la importancia clínica de las diferentes formulaciones de zinc utilizadas en los ensayos54.
Prevención de recaídas y profilaxisEl tratamiento profiláctico de la EH puede dividirse en primaria y secundaria. Para el caso de la prevención primaria, que consiste en evitar la aparición de un primer evento de EH en pacientes con cirrosis, existen pocos estudios al respecto. Por el contrario, la prevención secundaria tiene como objetivo evitar un cuadro de EH posterior a uno previo52.
Recientemente se comparó el uso de lactulosa, LOLA y RFX respectivamente como prevención primaria para la EH en pacientes son sangrado variceal. De hecho, las probabilidades de desarrollar EH manifiesta se correlacionan particularmente con el sangrado variceal agudo. En comparación con la lactulosa, RFX y LOLA fueron superiores para prevenir la EH manifiesta en este grupo de pacientes. Adicionalmente, ambos fármacos fueron mejor tolerados que la lactulosa puesto que el 54.4% de los pacientes tratados con esta presentaron diarrea severa55.
Para el caso de la prevención primaria, los disacáridos no absorbibles son efectivos en comparación con ninguna intervención56. Tanto la lactulosa como el lactitol mostraron la misma efectividad. Sin embargo, al compararse con otras opciones se obtienen resultados diferentes57.
En el contexto de prevención secundaria, la lactulosa a dosis de 30-60ml de 2 o 3 dosis divididas al día es también bastante efectiva y puede evitar la recaída de EH manifiesta hasta por 14 meses. Cabe destacar que es posible valorar la probabilidad de recaída mediante pruebas psicométricas, en donde un pobre desempeño en 2 o más pruebas puede establecer pauta para cambiar de tratamiento58,59.
El uso de probióticos también ha mostrado buen resultado para la prevención primaria y es incluso equiparable con la lactulosa. Los probióticos pueden llegar a evitar recaídas por EH hasta por 11 meses y disminuir de forma significativa los niveles de NH3 en 3 meses60.
La RFX también ha sido probada como profilaxis secundaria, la cual evita la recurrencia de la EH por 6 meses a una dosis de 550mg 2 veces al día46. Recientemente se comparó el tratamiento de LOLA versus placebo como profilaxis secundaria, demostrando la efectividad de este tratamiento para la prevención de recaídas. Sin embargo, diversos estudios avalan que la combinación de lactulosa/RFX es superior como profilaxis61.
Impacto en la calidad de vida y reducción de costosComo se ha descrito previamente, la calidad de vida de los pacientes con EHM es deficiente. Sin embargo, lo anterior no se limita solo a la EHM, sino que los pacientes con EH manifiesta persisten con alteraciones cognitivas incluso después de haber sido resuelto el cuadro agudo. De hecho, el riesgo de padecer EHM es mayor en aquellos pacientes que previamente presentaron un cuadro de EH manifiesta62.
En realidad, pareciera que el deterioro cognitivo de los pacientes con cirrosis es permanente. En estudios sobre la EHM donde los cambios en la calidad de vida son más sutiles que los encontrados en pacientes con EH manifiesta previa, los cuestionarios sobre la calidad de vida específicos para enfermedades hepáticas o los cuestionarios genéricos más largos, como el SIP, pueden ser mejores para encontrar diferencias. Los cambios en la calidad de vida son importantes para predecir resultados clínicamente relevantes, como la recurrencia de la EH, las hospitalizaciones y la muerte en pacientes ambulatorios con cirrosis63.
Además de las alteraciones cognitivas, los pacientes con EH usualmente tienen alteraciones del sueño64 y requieren de cuidadores para sus funciones diarias. Adicionalmente, por cada episodio de EH los pacientes se vuelven cada vez más dependientes65.
Con lo que respecta a la lactulosa, los estudios en la EHM han demostrado una mejora en la calidad de vida, especialmente en la función cognitiva. Sin embargo, pocos estudios han abordado este tema en la EHP28,66.
En cuanto a la RFX, en 2011 se llevó a cabo el estudio RIME para evaluar el impacto de este medicamento en la calidad de vida y mejoría de las funciones cognitivas. En él se aleatorizaron 98 pacientes para recibir RFX (1,200mg día) o placebo por 8 semanas y posteriormente fueron evaluados con test psicométricos y SIP. El 75.5% de los pacientes en el grupo tratado con RFX remitieron el cuadro de EH y tuvieron mejores puntajes en las pruebas psicométricas y cuestionarios SIP en comparación con el 20% del grupo placebo66. Paralelamente otro estudio en ese mismo año observó que la RFX a dosis de 550mg 2 veces al día mejoró la calidad de vida de los pacientes con EH recurrente. Esto fue medido por el cuestionario de enfermedad hepática crónica (CLDQ), el cual fue aplicado cada 4 semanas durante los 6 meses que duró el estudio. Sin embargo, es importante tomar en cuenta que se permitió la administración de lactulosa concomitante en los pacientes con RFX67.
También en 2011, se reportó un estudio sobre el uso de LOLA en 191 pacientes con EH. Nuevamente para medir el efecto sobre la calidad de vida se utilizó el cuestionario CLDQ. La intervención consistió en 3 sobres diarios de 6g de LOLA durante 8 semanas; el tratamiento mejoró notablemente todos los dominios evaluados por el cuestionario, en particular la fatiga, y fue bien tolerado en el 97% de los pacientes68.
Hasta un 80% de los pacientes con cirrosis experimentan EH y la mayoría tienen un alto riesgo de recurrencia. Hay varios factores que se deben considerar al desarrollar un enfoque rentable para el manejo de las EH, como el cumplimiento del paciente, los efectos adversos de las terapias con medicamentos y los costos-beneficios relativos de la terapia.
Los principales agentes farmacológicos utilizados para el tratamiento y la prevención de la EH se asocian comúnmente con los efectos adversos gastrointestinales. Si bien estas reacciones adversas son comunes, pueden ser molestas y pueden llegar al incumplimiento por parte del paciente, lo cual aumentaría el riesgo de EH. Además, el agente de primera línea como es la lactulosa requiere la autodosificación, que puede llegar a ser confusa para el paciente. Este requisito aumenta el riesgo de efectos adversos graves.
La EH impone una carga económica importante para el paciente, el cuidador, el sistema de salud y la sociedad. La EH no solo tiene un impacto negativo en la morbimortalidad del paciente, sino que también afecta el funcionamiento psicológico, social y la calidad de vida en general. Puede afectar la capacidad del paciente para trabajar, lo que resulta en una reducción de la productividad y pérdida de salarios. Un paciente con EH puede requerir hospitalización, lo que representa una proporción sustancial de los costos asociados a la EH. La prevención temprana es importante para minimizar los costos sociales y económicos asociados.
Los pacientes con EH, independientemente de la ubicación geográfica, representan una carga económica importante para la infraestructura de atención médica, y las hospitalizaciones anuales para los pacientes con EH pueden ser bastante costosas para el sistema de salud. La duración media de la estancia hospitalaria relacionada con la EH osciló entre 5.9-9 días69,70.
En los Estados Unidos los costos directos de la enfermedad hepática crónica fueron más de $2,000 millones de dólares americanos (USD), mientras que los costos indirectos fueron más de $450 millones de USD. La EH, como se ha mencionado, contribuye a esta carga económica debido principalmente a la hospitalización, que tiene costos de $30,000USD/hospitalización. Además, el 22% de los pacientes que son dados de alta generalmente son llevados a hogares de ancianos o centros de rehabilitación, lo que aumenta los costos totales. En relación con esto, es la RFX la que parece superar a la lactulosa, pues, aunque es más costosa que la lactulosa, se ha demostrado que la RFX reduce las tasas de hospitalización, tiene un mejor perfil de efectos adversos y aumenta el cumplimiento del paciente representando además un ahorro de costos/paciente/año de más de $3,000USD en comparación con la terapia con lactulosa71.
Estudios sugieren que el inicio de la terapia con RFX podría llevar a una disminución de la estancia hospitalaria72. Además, los ahorros en costos estimados para RFX versus lactulosa, si bien se basan en estimaciones publicadas de los números afectados, respaldan la idea de reducir el riesgo de hospitalización en pacientes con EH. Esto reduciría significativamente la carga económica para los sistemas de salud. Lo importante es que los costos incrementados de la RFX son superados por los ahorros potenciales en los costos de atención médica73.
La literatura sugiere que la RFX puede proporcionar un mejor control de los síntomas y a su vez puede reducir no solo los costos relacionados con la hospitalización y la duración de la estancia hospitalaria, sino también otros costos relacionados con la atención médica, especialmente si el uso de la RFX se traduce en una menor necesidad de seguimiento ambulatorio. Para los pacientes recibiendo, el tratamiento RFX 550mg 2 veces al día versus RFX 400mg 3 veces al día, el primer esquema demostró ser más rentable que el régimen de 3 veces al día74.
Si comparamos con el tratamiento de la lactulosa, esta se asoció con un mayor número de hospitalizaciones, así como una mayor duración y costos de hospitalización75. Un estudio retrospectivo en un solo centro de Estados Unidos indicó que el uso de lactulosa después de la hospitalización inicial se asoció con la rehospitalización en los siguientes 90 días, mientras que el uso de RFX después de la hospitalización no se asoció significativamente con el riesgo de reingreso hospitalario en 90 días76. En otro estudio, el uso de recursos sanitarios disminuyó significativamente después del inicio de la RFX en comparación con antes de su inicio77.
Además, se ha mostrado una baja incidencia de HE en el tratamiento a largo plazo cuando se agrega RFX a la terapia con lactulosa en la práctica clínica78. Al igual que todos los agentes antibacterianos, se ha notificado diarrea asociada a Clostridium difficile con el tratamiento de RFX, aunque con baja frecuencia. Sin embargo, esto no se ha convertido en un problema de seguridad importante en el tratamiento a largo plazo. Por lo tanto, existe una gran cantidad de evidencia que muestra que la adición de RFX a la terapia estándar con lactulosa produce reducciones significativas en la utilización de los recursos sanitarios a largo plazo.
El estudio de Stauch et al.79 demostró ventajas claras del uso de LOLA en comparación con placebo al lograr la mejoría de la encefalopatía asociada a daño hepático crónico. Este estudio se considera pionero, dado que no existen estudios sobre costo-efectividad comparando estos esquemas de tratamiento. Poo et al.80 publicaron un estudio comparativo para evaluar la respuesta terapéutica con lactulosa y LOLA asignando 10 pacientes a cada grupo. Los autores demostraron que ambos medicamentos son útiles en el manejo de la encefalopatía por incremento de amonio, sin embargo, la respuesta en los parámetros del estado mental, en las pruebas de conexión numérica, en el score de asterixis y en la actividad electroencefalográfica, fue mejor en el grupo tratado con LOLA.
En una revisión retrospectiva, de un solo centro, de 137 pacientes que recibieron lactulosa con una duración media de 27±6 meses después de su primer evento de EH, se encontró que el 75% de los pacientes experimentaron recurrencia de EH después de 9±1 meses. Treinta y nueve (28.5%) pacientes tuvieron recurrencia de EH asociada con la falta de adherencia a la lactulosa, principalmente como resultado de efectos adversos gastrointestinales35.
Por otro lado, es importante mencionar la evidencia contrapuesta sobre la superioridad de uno y otro fármaco81. La RFX, pese a su costo elevado, es la mejor tolerada y la que más reduce los costos por hospitalización82,83. Adicionalmente, este antibiótico puede usarse en otras complicaciones de la cirrosis hepática más allá de la HE, tales como la ascitis con deterioro de la función renal al aumentar la tasa de filtración glomerular y la excreción urinaria de sodio84, y en pacientes con ascitis y peritonitis bacteriana espontánea85,86.
A lo anterior pueden agregarse nuevas propiedades que no muestran las otras opciones frente a la RFX, como son los efectos antiinflamatorios y los cambios en la microbiota fecal más allá de solo disminuir la producción de NH3. Esto es importante dado que los pacientes con cirrosis tienen una alta incidencia de disbiosis y alteración en la composición de los ácidos biliares que en última instancia se asocian con la severidad de la enfermedad87.
ConclusionesCaracterizada por períodos de deterioro cognitivo de gravedad variable, la EH es una complicación frecuente de la enfermedad hepática crónica y una causa frecuente de hospitalización y morbimortalidad en esta población de pacientes. Hasta el 70% de los pacientes con cirrosis pueden tener algún grado de EH. Todos los tratamientos actuales han demostrado ser eficaces en diferentes grados de la EH, incluso su uso es mejor que no tratar a aquellos pacientes con EHM, los cuales han sido motivo de discusiones sobre si deben ser tratados o no, mismo tema en el que LOLA podría jugar un papel importante al ser el medicamento con menos efectos secundarios y mejor tolerado.
Por otro lado, actualmente el tratamiento de primera línea para los pacientes con EH son los disacáridos no absorbibles, como la lactulosa, incluso para prevenir la EH recurrente. Sin embargo, para muchos pacientes es difícil de tolerar debido a sus efectos secundarios, principalmente gastrointestinales. En contraste, la RFX ha mostrado al menos la misma efectividad que la lactulosa, pero en comparación con atributos que la hacen particularmente especial entre los que destacan 1) reducción de la estancia hospitalaria, 2) reducción de la mortalidad, 3) profilaxis secundaria, 4) mayor perfil de seguridad y tolerabilidad, 5) mejor desempeño en las pruebas psicométricas en pacientes con EHM y pacientes que resolvieron el cuadro agudo de EH manifiesta. Aunque pocos metaanálisis incluyen la combinación de RFX/lactulosa, en los ensayos clínicos que comparan esta intervención versus RFX o lactulosa como monoterapia, la combinación de estos fármacos es incluso superior.
En conclusión, el tratamiento de la EH debe considerarse en el manejo integral del paciente con cirrosis, incluso ante la sospecha de EHM, debe realizarse una evaluación adecuada e iniciar tratamiento lo antes posible para mejorar la calidad de vida del paciente. Dado que los tratamientos aquí mencionados en general han demostrado ser efectivos, lo más importante será individualizar el tratamiento a cada paciente, puesto que, si no tolera por ejemplo la lactulosa, sería mejor iniciar tratamiento con RFX. Aunque la RFX tiene un precio mayor que el de la lactulosa, esta disminuye el tiempo de estancia hospitalaria y mejora de forma significativa el estado cognitivo del paciente, lo que resulta en una opción con mayor costo-efectividad que la lactulosa. En contraste, otras opciones como LOLA y lactulosa pueden ser mejores que la RFX para la prevención primaria. Respecto al uso de LOLA sola, esta sigue siendo una opción viable para aquellos pacientes con EHM siempre y cuando respondan adecuadamente y si el tratamiento con lactulosa ha fallado, además de que individualmente sí ha mostrado ser superior que la RFX para la prevención de EHP. Estudios y metaanálisis también han abogado por la combinación de LOLA con probióticos, siendo esta superior al uso individual de LOLA, pero aun inferior a la lactulosa y RFX para el tratamiento del cuadro agudo.
Finalmente, la combinación de RFX y lactulosa sí ha demostrado ser la mejor opción de tratamiento tanto en profilaxis como en el tratamiento de EHP.
Responsabilidades éticasConsentimiento informadoEl presente estudio no requirió de la aplicación de algún tipo de consentimiento informado puesto que es una revisión bibliográfica.
Protección de personas y animalesNo se llevó a cabo ningún estudio en personas o animales al ser un estudio de revisión bibliográfica.
Confidencialidad de la informaciónNo se manejó ningún tipo de información sensible ya que al ser una revisión de artículos publicados, no se requirió el acceso a información de pacientes, por ejemplo, expedientes clínicos.
Debido a lo anterior no se requirió que el presente estudio fuera evaluado por el comité de ética de la Fundación Clínica Médica Sur.
FinanciaciónEl presente estudio no requiero ningún tipo de apoyo financiero.
AutoríaN. Méndez-Sánchez es principal investigador, quien colaboró con el diseño del estudio, revisó la literatura y el contenido manuscrito. A.C. Frati-Munari concibió la idea del trabajo, colaboró en el diseño del estudio y revisó el contenido del manuscrito. J. Contreras-Carmona y C.E. Coronel-Castillo revisaron la literatura, colaboraron en el diseño del estudio y escribieron el manuscrito. M. Uribe colaboró en el diseño del estudio, revisó la literatura y la calidad del manuscrito.
Conflicto de interesesLos autores declaran no tener ningún conflicto de interés.
Este estudio fue apoyado por Fundación Clínica Médica Sur.