La manga gástrica laparoscópica (MGL) es la cirugía bariátrica más realizada en el mundo. Sin embargo, sus complicaciones y fallas del procedimiento están aumentado.
ObjetivosDeterminar los motivos de falla de MGL y observar los resultados de conversión a bypass gástrico, comparándolos con bypass gástrico primario.
Material y métodosSe consultaron pacientes con falla de MGL, operados de cirugía de conversión a bypass gástrico asistido por robot y laparoscópico (técnica híbrida). Los resultados y el seguimiento por falla de pérdida de peso (FPP) se compararon con pacientes operados de bypass gástrico laparoscópico primario (BGLp).
ResultadosTrece pacientes se operaron de conversión por FPP, 3por enfermedad de reflujo gastroesofágico (ERGE) intratable y 2por estenosis gástrica. No hubo diferencias entre las características preoperatorias de los pacientes con FPP y BGLp antes del bypass gástrico. Treinta y seismeses después de la cirugía, el porcentaje de exceso de peso perdido fue mayor en BGLp que en FPP (54.17±12.48 vs. 69.17±23.73, respectivamente; p=<0.05). El ERGE intratable, los síntomas por estenosis gástrica y las comorbilidades mejoraron después de la cirugía de conversión.
ConclusiónLa cirugía de conversión permite pérdida de peso aceptable a 36 meses de seguimiento y favorece la remisión de las comorbilidades. Además, resuelve los síntomas de ERGE refractaria y de estenosis gástrica.
Laparoscopic sleeve gastrectomy (LSG) is the most widely performed bariatric surgery worldwide but complications and failed procedures are on the rise.
AimsTo determine the reasons for failed LSGs and report the results of conversion to gastric bypass surgery, comparing the outcomes with those of primary gastric bypass surgery.
Materials and methodsPatients with failed LSG that underwent conversion to gastric bypass surgery through a robotic-assisted and laparoscopic (hybrid) technique were evaluated. Outcomes and follow-up related to weight loss failure (WLF) were compared with those in patients that underwent primary laparoscopic gastric bypass (pLGB) surgery.
ResultsRevisional surgery was performed on 13 patients due to WLF, on 3 patients because of refractory gastroesophageal reflux disease (GERD), and on 2 patients due to gastric stricture. There were no differences between the preoperative characteristics of the patients with WLF before undergoing conversion to gastric bypass and the patients that underwent pLGB surgery. At postoperative month 36, the percentage of excess weight loss was greater in the patients that underwent pLGB surgery, than in those with WLF that underwent conversion to gastric bypass (69.17±23.73 vs. 54.17±12.48, respectively; P<0.05). Refractory GERD, symptoms due to gastric stricture, and comorbidities all improved after the revisional surgery.
ConclusionRevisional surgery resulted in acceptable weight loss at 36 months of follow-up and favored comorbidity remission. In addition, it resolved symptoms of refractory GERD and gastric stricture.
La obesidad es un problema de salud y sus comorbilidades son de difícil control solo con tratamiento médico. La cirugía bariátrica es el único tratamiento que ha demostrado la exitosa pérdida de exceso de peso y la resolución de comorbilidades1. En los últimos años la manga gástrica laparoscópica (MGL) se ha convertido en el procedimiento más realizado en el mundo, debido a su simplicidad técnica, incidencia aceptable de complicaciones, pérdida de peso efectiva y resolución de comorbilidades sin modificar la integridad del tubo digestivo2.
El incremento en el número de MGL realizadas es seguido de un incremento en el número de casos de falla o complicaciones, debido principalmente a falla de pérdida de peso (FPP) o reganancia de peso, estenosis gástrica y enfermedad por reflujo gastroesofágico (ERGE) refractario. La FPP se relaciona con causas anatómicas, como resección incompleta del fondo gástrico y dilatación de cuerpo gástrico. En algunos casos la falla ocurre en ausencia de alteración anatómica y se debe a desórdenes alimenticios o nulo apego a las indicaciones del equipo multidisciplinario; la reganancia de peso se asocia a nula mejoría de comorbilidades. La ERGE refractaria es provocada por la disrupción de los mecanismos antirreflujo, hernia hiatal no detectada durante cirugía y el 26% de los pacientes desarrollará síntomas nuevos de ERGE posterior a MGL1,3. La estenosis gástrica posterior a MGL tiene una incidencia del 0.35%, provoca obstrucción gástrica, incapacidad para progresar con dieta de líquidos a sólidos, y vómitos1.
Algunos reportes indican que la cirugía de conversión por falla de la MGL es necesaria en el 5-11% de los casos y el bypass gástrico en Y de Roux ha sido propuesto como tratamiento adecuado4,5. Sin embargo, los resultados de cirugía bariátrica de revisión aún son escasos y, en la mayoría de los reportes previos, el seguimiento es de 3o menos años. No existe un consenso para el procedimiento ideal después de falla de MGL y la decisión de intervención subsecuente se basa en preferencias individuales5,6.
El objetivo del presente trabajo es evaluar las indicaciones y resultados de nuestra experiencia en la cirugía de conversión a bypass gástrico asistida por robot y laparoscópica (técnica híbrida) en pacientes con falla de MGL. Se comparan los resultados de pacientes operados por FPP con pacientes con bypass gástrico laparoscópico primario (BGLp).
MétodosSelección de pacientesEl presente estudio fue aprobado por el Comité de Ética e Investigación del Centro Médico Nacional 20 de Noviembre (folio número 054.2018), según la Declaración de Helsinki. Se realizó un estudio retrospectivo utilizando la base de datos de todos los pacientes operados de MGL con antecedente de falla del procedimiento, intervenidos mediante cirugía de conversión a bypass gástrico entre enero de 2007 y octubre de 2014. Todas las cirugías fueron ejecutadas por 2cirujanos certificados en cirugía bariátrica (MRJ y BAR), así como por cirujanos con entrenamiento de alta especialidad. Nuestros pacientes antes de cirugía primaria o de revisión cumplieron el mismo protocolo prequirúrgico y seguimiento postoperatorio. Los criterios de inclusión y exclusión se enlistan a continuación.
Criterios de inclusión- •
Pacientes > 18 años.
- •
Asistencia a consultas, seminario informativo y grupo de ayuda.
- •
IMC> 35 con comorbilidades (hipertensión, diabetes mellitus, apnea obstructiva de sueño) o IMC>40 sin comorbilidades.
- •
Prueba de embarazo negativa.
- •
Clasificación de la American Society of Anesthesiology entre 1 y 3, valoración preoperatoria de equipo multidisciplinario (psiquiatría, nutrición, endocrinología y medicina interna) sin contraindicación.
- •
Capacidad para entender las instrucciones nutricionales y completar los estudios preoperatorios. Para la aprobación de cirugía primaria o de revisión, el paciente debía demostrar apego nutricional y disminución de por lo menos el 7% del exceso de peso.
- •
Sin contraindicación para MGL basada en hallazgos clínicos, endoscópicos y de serie esófago gastroduodenal (no se realiza MGL en caso de sintomatología y evidencia positiva para reflujo, esofagitis y hernia hiatal). En caso de infección con Helicobacter pylori, se da tratamiento de erradicación.
- •
Descontrol de trastorno mental, como ansiedad, depression, etc.
- •
Esquizofrenia o psicosis.
- •
Embarazo planeado en los siguientes 18 meses.
- •
Enfermedad endocrinológica descontrolada (síndrome de Cushing, hipotiroidismo).
- •
Trastorno de alimentación descontrolado como bulimia nerviosa, atracón.
- •
Hospitalización 2años previos en psiquiatría, intento suicida.
- •
La decisión del tipo de cirugía primaria dependió del consenso del comité multidisciplinario hospitalario.
Se define FPP a la pérdida de peso insuficiente, al porcentaje de exceso de peso perdido (%EWL)<50% 24 meses después de la cirugía o a la persistencia de IMC>35kg/m2 y nula remisión de comorbilidades. La reganancia progresiva de peso se define como la reganancia de>25% EWL del nadir. La ERGE refractaria se caracteriza por dolor epigástrico y síntomas de reflujo sin alivio después de 3meses del uso de inhibidores de la bomba de protones. La estenosis gástrica provoca síntomas de disfagia y vómitos persistentes en el periodo postoperatorio inmediato; los estudios muestran sitio de estenosis con o sin dilatación esofágica. Los pacientes con FPP fueron comparados con pacientes consecutivos operados de BGLp, dentro del mismo periodo de tiempo del estudio, con base en su edad, peso, IMC previo a bypass y seguimiento completo de por lo menos 36 meses (fig. 1). De acuerdo con el seguro médico institucional, solo los pacientes con FPP fueron convertidos por cirugía asistida por robot. El peso ideal fue calculado de acuerdo con las formulaciones establecidas por la American Society for Metabolic and Bariatric Surgery7. El porcentaje del peso total perdido (%TWL) y el %EWL fueron calculados basándose en el peso previo a MGL y se calcularon a los 2, 6, 12, 24 y 36 meses después de la cirugía de conversión o BGLp.
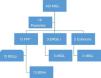
Flujograma de pacientes convertidos a bypass gástrico por falla de manga.
BGHr: bypass gástrico híbrido robótico; BGLp: bypass gástrico laparoscópico primario; cBGL: conversión a bypass gástrico laparoscópico; ERGi: enfermedad por reflujo gastroesofágico intratable; FPP: falla de pérdida de peso; MGL: manga gástrica laparoscópica.
La presencia y resolución de comorbilidades después de cirugía bariátrica se definió como remisión cuando los parámetros de glucosa, presión arterial y lípidos eran normales en ausencia de medicamentos; mejoría era la reducción significativa de las comorbilidades y disminución del número de medicamentos. Sin cambios era la ausencia de remisión o mejoría, según se describió anteriormente7.
Las complicaciones postoperatorias tempranas son las que ocurren dentro de los primeros 30 días después de la cirugía y las tardías ocurren después de 30 días y dentro de los 12 meses siguientes. La clasificación de Clavien-Dindo fue utilizada para graduar las complicaciones8.
Técnica quirúrgicaMGL. La cirugía se realiza de manera laparoscópica. Se preserva el antro gástrico y la resección gástrica con engrapadora lineal empieza en los 4-6cm prepilóricos. La calibración se realizó con sonda de 32 Fr y se reforzaba la línea de grapas con material no absorbible. A partir de 2010, de acuerdo con el Consenso Internacional de Expertos en Manga Gástrica9, la calibración se realiza con sondas de 36 Fr y no hay reforzamiento de línea de grapas.
Conversión a bypass gástrico en Y de Roux. La conversión de MGL a bypass gástrico consiste en realizar un «reservorio gástrico» de 30-45ml, resección del estómago entre la segunda y tercera arcada de vasos gástricos, asa alimentaria de Roux antecólica de 100cm y asa biliar de 100-150cm. La cirugía laparoscópica y asistida por robot se realizan de la misma manera. En nuestro centro hospitalario las cirugías de conversión se ejecutan con asistencia robótica mediante un procedimiento híbrido, como ha sido descrito por Jung10. El reservorio gástrico y la medición de las asas intestinales se hacen por vía laparoscópica. El sistema quirúrgico da Vinci Si® se coloca sobre la cabeza del paciente para la gastroyeyuno anastomosis (GYA) y la yeyunoyeyuno anastomosis con técnica lineal. La GYA laterolateral se aborda en la pared gástrica posterior, se utiliza una sonda de 34 Fr para la calibración, mientras se cierra el canal común de enterotomía con sutura continua y esta es insuflada para la prueba hidroneumática. La yeyunoyeyuno anastomosis laterolateral se ejecuta de manera proximal a la GYA en forma de omega y el cierre de enterotomía, con sutura continua. Finalmente, el asa en omega es dividida entre las 2anastomosis. Los espacios mesentéricos y de Petersen son cerrados de manera rutinaria.
La dieta líquida se inicia en el segundo día de postoperado; no se realizan estudios de imagen rutinarios en busca de fugas. En caso de no presentarse complicaciones, el paciente es egresado al tercer día. Todos los pacientes son revisados en consulta externa a los 1, 3, 6 y 12 meses; después de forma anual. Todos los pacientes reciben suplementación vitamínica.
Análisis estadísticoLos resultados cuantitativos son expresados en promedios y desviación estándar con rangos; las variables categóricas son representadas como número de casos (n) y porcentajes. Se empleó la prueba de t de Student para comparar los promedios de las variables cuantitativas de manera apropiada. Las variables cuantitativas fueron evaluadas utilizando la prueba de χ2, cuando era apropiado. En todos los casos, un valor de p<0.05 fue considerado significativo. Todos los cálculos se hicieron con el programa GraphPad Prism 7.
ResultadosEn nuestra base de datos, identificamos a 420 pacientes operados de MGL en nuestro centro hospitalario de referencia; de los cuales, 18 pacientes (4.28%) fueron convertidos a bypass gástrico por falla del procedimiento. Trece pacientes (72%) presentaron FPP, 3por ERGE refractaria (17%) y 2por estenosis gástrica (11%). Su promedio de edad fue 47.38±7.32 años y el 94% fueron mujeres. Antes de la MGL, el peso promedio e índice de masa corporal (IMC) fue de 127.96 (100-160) kg y 50.21 (38.16-64.58) kg/m2. Los hallazgos endoscópicos previos a MGL fueron: estudio normal (39%, n=7), antro gástrico hiperémico (27.7%, n=5), infección por Helicobacter pylori positiva (33.3%, n=6). Los pacientes con Helicobacterpylori recibieron 14 días de tratamiento de erradicación con lansoprazol (30mg cada 12 h), claritromicina 500mg cada 12 h, amoxicilina (1 g cada 12 h). Se confirmó la erradicación con prueba de aliento en el 65% de los pacientes y en el 35% se repitió otro estudio endoscópico e histológico. La serie esófago-gastroduodenal no mostró reflujo gastroesofágico ni hernia hiatal. No se realizó pHmetría esofágica rutinaria previamente a MGL.
Pacientes con falla por pérdida de peso vs. bypass gástrico laparoscópico primarioEl 61% de los pacientes convertidos por FPP presentaron superobesidad (IMC>50). La tabla 1 muestra las características basales de pacientes con FPP y de BGLp. No hubo diferencias en ambos grupos, en promedio de edad, peso, IMC, comorbilidades antes de bypass gástrico y todos los pacientes completaron 36 meses de seguimiento. No se realizó la cirugía de conversión o primaria hasta que el paciente demostrara apego a las indicaciones nutricionales. El 61.5% de los pacientes logró un promedio de 8.5% de pérdida de exceso de peso y el resto cumplió con solo el 7%. Los hallazgos endoscópicos y por serie esófago-gastroduodenal en pacientes con FPP mostraron: sin dilatación de manga gástrica (53%), algún grado de esofagitis sin metaplasia de Barrett (24%), dilatación de manga gástrica (15%) y fondo gástrico retenido (8%). Ningún paciente presentó hernia hiatal.
Características demográficas basales y comorbilidades de pacientes con FPP y BGLp
| Variable | FPP | BGLp | p* |
|---|---|---|---|
| N (%) | 13 (72) | 13 (100) | _ |
| Edad (años) | 48.15±7.1 (36-60) | 49.61±8.4 (30-60) | 0.6397 |
| Peso ac o BGLp | 104.56±16.7 (84-12,340) | 115.3±18.7 (89- 148) | 0.1371 |
| IMC ac o BGLp | 42.39±6.4 (33.34-58.33) | 42.34±6.3 (35.31-58.97) | 0.9850 |
| Sexo M/F | 0/13 | 4/9 | NA |
| Peso antes de MGL (kg) | 130.89±21.2 (102–160) | NA | NA |
| IMC antes de MGL (kg/m2) | 52.74±7.5 (40.65–64.58) | NA | NA |
| Intervalo ac (meses) | 51.76±16.8 (31-96) | NA | NA |
| Reganancia del nadir (kg) | 12.48±5.8 (3-21) | NA | NA |
| EWL ac en % | 38.41±9.5 (19.6-49.63) | NA | NA |
| TWL ac en % | 19.85±5.9 (9.6-7.5) | NA | NA |
| Comorbilidades | - | - | <0.05 |
| Hipertensión, n (%) | 9 (69) | 2 (15) | NS |
| Gonartrosis, n (%) | 4 (30) | 1 (7) | NS |
| Dislipidemia, n (%) | 3 (23) | 1 (7) | NS |
| Diabetes mellitus tipo 2, n (%) | 2 (15) | 5 (38) | NS |
| Resistencia a insulina, n (%) | 2 (15) | 3 (23) | NS |
| AOS, n (%) | 2 (15) | 2 (15) | NS |
| Síndrome metabólico, n (%) | 1 (7) | 3 (23) | NS |
| Lumbalgia, n (%) | 1 (7) | 0 | NS |
| Incontinencia, n (%) | 1 (7) | 0 | NS |
| Balón intragástrico previo, n (%) | 1 (7) | 1 (7) | NS |
| IVC, n (%) | 0 | 1 (7) | NS |
Valores en promedio±desviación estándar (rangos) y números (%).
ac: antes de conversión; AOS: apnea obstructiva del sueño; BGLp: bypass gástrico laparoscópico primario; EWL: exceso de peso perdido; F: femenino; IMC: índice de masa corporal; IVC: insuficiencia venosa crónica; M: masculino; NA: no aplicable; NS: no significativo; TWL: peso total perdido.
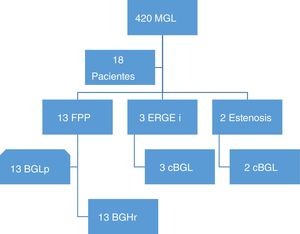
El promedio de intervalo de tiempo antes de conversión para los pacientes con FPP fue de 52 meses. La fig. 2 muestra el seguimiento a 3 años de la pérdida de peso después del bypass gástrico. El %EWL fue mayor para los pacientes de BGLp que en los pacientes con FPP (69.17±23.73 vs. 54.17±12.48, respectivamente; p≤0.05). Los pacientes con FPP lograron disminuir su IMC un promedio de 7.75 puntos, pero no fue mayor en comparación con los 12.21 puntos de pacientes con BGLp. El promedio del %TWL fue similar en ambos grupos FPP y BGLp, 25.9±10.4 (18.62-33.33) vs. 26.8±9.1 (7.48-36.49), respectivamente.
El tiempo quirúrgico fue más prolongado en el procedimiento híbrido robótico que en el primario (200.62±69 vs. 168.46±38 min, respectivamente; p=0.1837). Tampoco hubo diferencias en el tiempo de hospitalización entre ambos procedimientos (4.5±2 días para el híbrido robótico vs.6.07±7 días para el BGLp; p=0.5658).
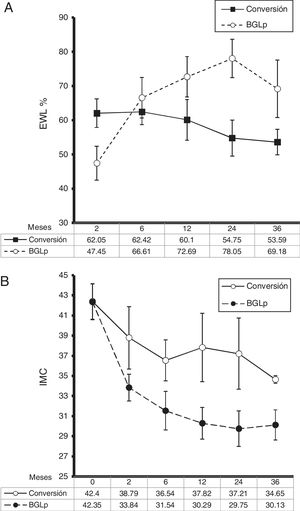
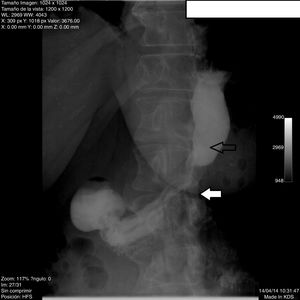
Pacientes con enfermedad por reflujo gastroesofágico intratable y estenosis gástricaPosterior a MGL, 3pacientes presentaron ERGE intratable (n=3/420, 0.71%) y 2, estenosis gástrica (n=2/420, 0.47%). Todos los pacientes de ERGE intratable fueron mujeres; un hombre y una mujer presentaron estenosis gástrica. El promedio de edad y el intervalo en meses antes de la conversión en estos pacientes fue de 45.4±8.2 (33-54) años y 17.2±8 (11-31) meses, respectivamente. Antes de MGL su promedio de peso e IMC fue de 120.4±17.8 kg (100-143.6) y 43.6±4.3 kg/m2 (38.16-48.51) y antes de la cirugía de conversión de 73.4±16.8 kg (50-97) y 26.5±5.8 kg/m2 (23.1-34.38), respectivamente. La sintomatología principal de los pacientes con ERGE intratable fue pirosis y regurgitación; no se presentaron síntomas extraesofágicos. De forma previa a la cirugía de conversión, todos los pacientes recibieron 3meses de tratamiento con omeprazol (20mg vía oral cada 12 h), sin mejoría de los síntomas. La pHmetría presentó un promedio del índice de DeMeester de 28.93 (21.3-40.2). Los hallazgos endoscópicos y de estudio contrastado en estos pacientes mostraron algún grado de esofagitis (grado B de Los Ángeles, n=2) más hernia hiatal (75%) (fig. 3) y algún grado de esofagitis (grado C de Los Ángeles, n=1) con dilatación de manga gástrica (25%). Ningún paciente presentó metaplasia de Barrett por histología. Después de la cirugía de conversión se resolvieron los síntomas de ERGE sin que ninguna de las pacientes requiriera tratamiento con inhibidores de la bomba de protones. El 33% de los pacientes completó un seguimiento de 12 meses y logró un IMC de 27.6 kg/m2 y un 84.6% de EWL.
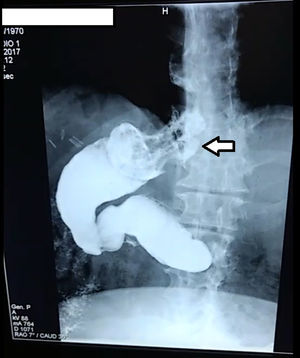
La serie esófago-gastroduodenal y la endoscopia mostraron estenosis en la incisura angularis en todos los pacientes de estenosis gástrica. Antes de la cirugía de conversión, se les dio tratamiento con dilataciones endoscópicas a través de balón; entre 2 y 5 sesiones fueron realizadas sin éxito por el grado de estenosis (fig. 4). Tras la conversión, el 50% de los pacientes completó un seguimiento de 36 meses y alcanzó un IMC de 34.28 kg/m2 y un 58.3% de EWL. En todos los pacientes se resolvieron los síntomas de obstrucción gástrica.
ComplicacionesNo hubo mortalidad postoperatoria en los pacientes. Dos pacientes de cirugía de conversión y 2de cirugía primaria desarrollaron eventos adversos mayores y un paciente de cada grupo requirió reintervención debido a hernia interna (clasificación de Clavien-Dindo grado IIIb). En ningún paciente se presentaron complicaciones asociadas con fuga, ulceración o estenosis de la GYA. Las complicaciones tardías fueron anemia leve por deficiencia de hierro, la cual se debió a falta de apego a las dosis indicadas de multivitamínico, que se recuperaron con fumarato ferroso vía oral (tabla 2).
Complicaciones tempranas y tardías después de cirugía de conversión y BGLp
| Pacientes | Abordaje | Temprana o tardía | Complicación | Manejo | Estancia (días) | Clasificación C/D |
|---|---|---|---|---|---|---|
| BGLp, n=1, (7.6%) | L | Temprana | Taquicardia ventricular | Ablación con catéter | 30 | Grado IIIa |
| BGLp, n=1, (7.6%) | L | Tardíaa | Hernia interna espacio de Petersen | EIMI | 6 | Grado IIIb |
| BGLp, n=1, (7.3%) | L | Tardía | Deficiencia de hierro, anemia leve | Suplementaciónb | Ambulatorio | Grado II |
| ERGE refractario n=1, (5.3%) | L | Tardía | Deficiencia de hierro, anemia leve | Suplementaciónb | Ambulatorio | Grado II |
| Estenosis gástrica n=1, (5.3%) | L | Temprana | Sangrado del sitio de trócar | Conservador, transfusión | 10 | Grado II |
| FPP n=1, (5.3%) | HR | Tempranaa | Hernia interna espacio de Petersen | EIMI | 6 | Grado IIIb |
BGLp: bypass gástrico laparoscópico primario; C/D: Clavien-Dindo; EIMI: exploración intestinal de mínima invasión; ERGE: enfermedad de reflujo gastroesofágico; FPP: falla de pérdida de peso; HR: híbrido robótico; L: laparoscópico.
La remisión de comorbilidades fue lograda en solo el 11% (2/18) de los pacientes después de MGL; el resto de los pacientes presentó algún grado de mejoría, por lo que la recurrencia de comorbilidades no fue indicación de conversión. El número de remisión de comorbilidades y la disminución significativa de medicamentos aumentó después de la conversión a bypass gástrico, especialmente en hipertensión y diabetes mellitus tipo 2 (tabla 3).
Seguimiento de la evolución de las comorbilidades y medicamentos después de cirugía de conversión
| Comorbilidades | Antes de conversión | Después de conversión (promedio de seguimiento a 36 meses) | p* |
|---|---|---|---|
| Hipertensión, n (%) | 11 (61) | 4 (22) | 0.0180 |
| N.° de medicamentos para hipertensión, promedio±DE | 1.5±0.6 | 0.3±0.5 | 0.0002 |
| Diabetes mellitus tipo 2, n (%) | 4 (22) | 1 (5.5) | 0.148 |
| N.° de medicamentos para diabetes, promedio±DE | 1.25±0.5 | 0.25±0.5 | 0.03 |
| Dislipidemia, n (%) | 3 (16) | 2 (11) | 0.629 |
| N.° de medicamentos para dislipidemia promedio±DE | 1.33±0.5 | 0.66±0.5 | 0.2302 |
| ERGE refractaria, n (%) | 3 (16) | 0 | <0.05 |
| Obstrucción gástrica debido a ES, n (%) | 2 (12) | 0 | <0.05 |
Resultados en promedio±desviación estándar.
DE: desviación estándar; ERGE: enfermedad por reflujo gastroesofágico; ES: estenosis gástrica.
La MGL se inició como primera etapa de la derivación biliopancreática con switch duodenal (BPD/DS) en pacientes de riesgo, principalmente por superobesidad. Sin embargo, muchos pacientes obtuvieron adecuada pérdida de peso y no fue necesaria una segunda etapa; la MGL fue el principal procedimiento restrictivo para superobesidad11,12. En años anteriores en nuestra institución se consideraba la MGL como la mejor opción para estos pacientes. Después de nuestro seguimiento a largo plazo, encontramos que más del 60% de los pacientes con FPP padecían superobesidad. Revisamos 13estudios con seguimiento de conversión de manga gástrica a bypass gástrico (tabla 4). Al igual que en nuestros pacientes, en 4estudios, los pacientes con FPP tenían IMC>50 kg/m2 antes de la MGL. No está completamente establecido cuál es el mejor procedimiento primario para superobesidad y, en estudios comparativos recientes, el bypass gástrico presenta los mejores resultados13.
Estudios previos de cirugía de conversión de MGL a BG
| Características de estudio | Características antes de conversión | Técnica quirúrgicaComplicaciones | Resultados y seguimiento posterior a conversión |
|---|---|---|---|
| Quezada et al.12016Junio 2005-abril 2015N: 50Sexo: 8/42 (F, 84%)Edad: 39.8±8.4 años | IMC aMG: 36.4 (34-40) kg/m2IMC ac: 35.4 (33.9-37.9) kg/m2Motivos de Conversión: FPP (n=28, 56%), ERGE (n=16, 32%), estenosis (n=6, 12%)Intervalo ac: 49 (24-67) mesesIncidencia de conversión BG/MG: sin datos | GYA: manualAsa biliopancreática: 30-30 cmAsa alimentaria: 150 cmComplicaciones: estenosis GYA (n=2), colitis pseudomembranosa (n=1), Total 3/50, 6% | Promedio de seguimiento: 36 meses (75%)IMC dc: 28.6 (24-36) kg/m2% de EWL: 66.9 (26-90)Resolución de ERGE: 63%Resolución de estenosis: 100% |
| Iannelli et al.32016Octubre 2005-diciembre 2013N: 40Sexo: 9/31 (F, 77.5%)Edad: 40.2 (20-61) años | IMC aMG: 47.5 (37.6-66) kg/m2IMC ac: 39.3 (26.3-52.7) kg/m2Motivos de conversión: FPP (n=29, 72.5%), ERGE (n=11, 27.5%), recidiva comorbilidades (n=1, 2.5%)Intervalo ac: 32.6 (8-113) mesesIncidencia de conversión a BG/MG: 40/430 (9.3%) | GYA: manualAsa biliopancreática: 50 cmAsa alimentaria: 150 cmComplicaciones: cirugía abierta (n=3), estenosis GYA (n=4), absceso intraabdominal (n=1), hernia (n=1), hernia interna (n=1), total 9/40, 22.5% | Promedio de seguimiento: 18.6 meses (100%)IMC dc: 30.8 (20.8-44.1)% de EWL: 64 (24.1-103)Resolución de ERGE: 100%Resolución de comorbilidades: 100% |
| Casillas et al.42016Febrero 2009-junio 2014N: 48Sexo 2/46 (F, 96%)Edad: 44 (23-65) años | IMC aMG 45.9 kg/m2IMC ac: 36.8 (27-52) kg/m2Motivos de conversión: ERGE+FPP (n=16, 33.3%), ERGE (n=14, 29.2%), FPP (n=11, 22.9%), estenosis (n=4, 8.3%), ERGE+DM2 recurrente (n=2, 4.1%), fuga gastrocutánea crónica (n=1, 2%)Intervalo ac: 26 (2-60) mesesIncidencia de conversión a BG/MG: 36/2794 (1.2%) | GYA: grapeo linealAsa biliopancreática: 40 a 50 cmAsa alimentaria: 100cmComplicaciones: intolerancia V.O (n=6), sangrado PO (n=2), estenosis GYA (n=3), recidiva de hernia hiatal (n=1), dolor abdominal crónico (n=1), persistencia de fuga gastrocutánea (n=1)Total: 10/40, 20.8% | Promedio de seguimiento: 24 (0-48) mesesIMC dc: sin datos% EWL: 16.4Resolución de ERGE: 97%Resolución de estenosis: 100%Mejoría de DM2: 50%Resolución de fístula: 0% |
| Malinka et al.52017Enero 2009-julio 2013N: 32Sexo: 10/22 (F, 68.7-5)Edad: 42.8±11.5 (18-62) años | IMC aMG: 49.4±5.3 (48-62) kg/m2IMC ac: 40.9±5.6 (28.8-48)Motivos de conversión: ERGE (n=21, 65.6%), FPP (n=11, 34.3%), recidiva de comorbilidades (n=1, 2.5%)Intervalo ac: 595±369.9 díasIncidencia de conversión a BG/MG: 32/239 (13.3%) | GYA: grapeo linealAsa biliopancreática: 50 cmAsa alimentaria: 150 cmComplicaciones: ninguna | Promedio de seguimiento: 36 (87%) mesesIMC dc: 33.4±5.9 (23.5-43.6) kg/m2% EWL: 52.0±40.3 (−10-163.6)Resolución de ERGE: 57%Resolución de comorbilidades: 100% |
| Carmeli et al.112015Diciembre 2006-noviembre 2012N: 10 de 19Sexo: 3/7 (F, 70%)Edad: 45.3±16.3 años | IMC aMG: 44.5±5.1 kg/m2 / 51.4±11 kg/m2 (BPD/DS)IMC ac: 39.8±5.7 kg/m2 / 43.3±6.1 (BPD/DS)Motivos de conversión: FPP (n=10, 52.6%),FPP (n=9, 42.7% conversión a BDP/DS)Intervalo antes dc: 36.2±17.4 mesesIncidencia de Conversión a BG/MG: sin datos | GYA: manual en dos planosAsa biliopancreática: 50-70 cmAsa alimentaria: 150 cmComplicaciones: úlcera marginal (n=1), total 1/10, 10%Complicaciones BPD/DS: Deficiencia de vitamina A (n=1), fuga de anastomosis (n=1), total 2/9, 22% | Promedio de seguimiento: 16±9 meses/30.8±23;5 meses (BPD/DS)IMC dc: 30±4.8 kg/m2/30.2±6.7 kg/m2 (BPD/DS)% EWL: 66.6±33.9% EWL con BD/DS: 80.3±40.3 |
| Abdemur et al.122016Enero 2004-agosto 2014N: 30Sexo: 7/23 (F, 73.6%)Edad: 50.3±13.8 años | IMC aMG: 40.7±5 (34-50) kg/m2IMC ac: 33.3±4 kg/m2Motivos de conversión: fuga (n=12, 40%), ERGE (n=9, 30%); FPP (n=7, 23%), estenosis (n=2, 7%)Intervalo antes dc: 43.6±27.5 (12 días a 80 meses)Incidencia de conversión a BG/MG: 30/1,118 (2.7%) | GYA: grapeo linealAsa biliopancreática: 30-50 cmAsa alimentaria: 100cmComplicaciones: hematoma de YYA (n=1), úlcera anastomótica (n=2), refuga (n=1), colección subhepática (n=1), obstrucción intestinal (n=1), total: 6/30, 20% | Promedio de seguimiento: 18.3±15.8 (3-49) mesesIMC dc: 28.6±4.8 (21.9-37.1) kg/m2% EWL: 76.5±30.7 (28.8-116.3)Resolución de ERGE: 66%Resolución de estenosis: 100%Resolución de fuga: 91% |
| Poghosyan et al.142016Marzo 2007-diciembre 2014N: 34Sexo: 8/26 (F. 76.5%)Edad: 44.4±12 años | IMC aMG: 53±11.5 kg/m2IMC ac: 44.7±9.8 kg/m2Motivos de conversión: FPP (n=31, 91.1%), ERGE (n=3, 8.8%)Intervalo ac: 32 (7.8-69) mesesIncidencia de conversión a BG/MG: 34/622 (5.4%) | GYA: manual (n=5) o grapeo circularAsa biliopancreática: sin datosAsa alimentaria: sin datosComplicaciones: lesión intestinal (n=1), fuga GYA (n=1), hernia del sitio de trócar (n=2), perforación de úlcera anastomótica (n=1, LAPE por dolor abdominal (n=1), total: 6/32, 18.7% | Promedio de seguimiento: 36±23 (44%) mesesIMC dc: 40.9±8.5 kg/m2% EWL: 63.1±36.2Resolución de ERGE: 100% |
| Langer et al.162010Diciembre 2002- septiembre 2009N: 8Sexo 4/4 (F, 50%)Edad: sin datos | IMC aMG: 46.9 (39.8-72.3) kg/m2IMC ac: sin datosMotivos de conversión: FPP (n=5, 62.5%), ERGE (n=3, 37.5%)Intervalo ac: 33 (15-70) mesesIncidencia de conversión a BG/MG: 8/73 (11%) | GYA: grapeo circular (n=7), grapeo lineal (n=1)Asa biliopancreática: 80 cmAsa alimentaria: 150 cmComplicaciones: fuga GYA (n=1), total: 1/8, 12.5% | Promedio de seguimiento: FPP 25.2 (1-52) meses, ERGE 26 (2-62) mesesIMC dc: sin datos% EWL: 67±31Resolución de ERGE: 100% |
| Parmar et al.182017Agosto 2012-agosto 2015N: 22Sexo: 6/16 (F, 72.7%)Edad: 51 (32-70) años | IMC aMG: 53.1 kg/m2IMC ac: 43.3 kg/m2Motivos de conversión: FPP (n=11, 50%), ERGE (n=10, 45.5%)Intervalo antes dc: sin datosIncidencia de conversión a BG/MG: 22/399 (5.5%) | GYA: grapeo linealAsa biliopancreática: 50cmAsa alimentaria: 150 cmComplicaciones: obstrucción intestinal por hernia interna (n=1), úlcera marginal (n=4), dolor abdominal y persistencia de ERGE (n=1), dolor abdominal (n=1), persistencia de ERGE (n=1), total: 8/22, 36.3% | Promedio de seguimiento: 16 mesesIMC dc: 40.8 (32.3-48.1) kg/m2% EWL: 46 (32.3-57.7)Resolución de ERGE: 80% |
| Felsenreich et al.232016Enero 2003-diciembre 2005N: 17Sexo: 5/12 (F, 73%)Edad: 40.4 (15-66) años | IMC aMG: 48.9±9.4 kg/m2IMC ac: 39.8±6.3 kg/m2Motivos de conversión: FPP (n=11, 64.7%), ERGE (n=6, 35.3%)Intervalo ac: FPP 48 (24-84) meses, ERGE 24 (12-84) mesesIncidencia de conversión a BG/MG: 17/53 (32%) | GYA: sin datosAsa biliopancreática: sin datosAsa alimentaria: sin datosComplicaciones: fuga GYA (n=2), total: 2/17, 11.7% | Promedio de seguimiento: 130 (120-152) mesesIMC dc: 35.5±6.9% EWL: 53.5±26.6Resolución de ERGE: 100% |
| Yorke et al.242017Mayo 2013-diciembre 2015N: 18Sexo: 5/13 (F, 77%)Edad: 41.7±10.6 años | IMC aMG: 50.5±12 kg/m2IMC ac: 43.1±9 (31.1-60.5) kg/m2Motivos de Conversión: FPP (n=9, 65.3%), ERGE (n=7, 26.1%), BG en 2 etapas (n=2, 8.6%)Intervalo antes de conversión: 41.8±12.5 mesesIncidencia de conversión a BG/MG: 18/273 (6.5%) | GYA: grapeo circularAsa biliopancreática 30-50 cmAsa alimentaria: 100-110 cmComplicaciones: deficiencia de hierro (n=2), conversión a cirugía abierta (n=2), infección de herida quirúrgica (n=3), sangrado PO y transfusión (n=1), úlcera anastomótica (n=2), total: 10/18, 55.5% | Promedio de seguimiento: 21.1±11.3 mesesIMC dc: 36.4±9 kg/m2% EWL: 52.8±32.7Resolución de ERGE: 75% |
| El Chaar et al.252017Enero 2010-diciembre 2014N: 9 de 12Sexo: F, 79.5%Edad: 44 (23-62) años | IMC aMG: 39.2 (33.7-51.9) kg/m2IMC ac: 29.4 (25.5-34.3) kg/m2Motivos de conversión: ERGE (n=6, 50%), FPP (n=3, 25%)Intervalo antes dc: 29 (20-41) mesesIncidencia de conversión a BG/MG: 9/630 (5.5%) | GYA: sin datosAsa biliopancreática: sin datosAsa alimentaria: sin datosComplicaciones: ninguna | Promedio de seguimiento: 3 mesesIMC dc: 24.4 (24.1-31.9) kg/m2% EWL: 75 (49-113)Resolución de ERGE: ? |
| Gautier et al.262013Junio 2005-diciembre 2010N: 18Sexo: sin datosEdad: 40.9 (24-55) años | IMC aMG: 55 (38-72) kg/m2IMC ac: 40.9 (28-48) kg/m2Motivos de conversión: FPP (n=9, 50%), ERGE (n=6, 33.3%), Persistencia DM2 (n=3, 16.7%)Intervalo antes dc: 23.8 (4.3-51) mesesIncidencia de Conversión a BG/MG: 18/114 (15.7%) | GYA: manual en 2 planosAsa biliopancreática: 70 cmAsa alimentaria: 120-150 cmComplicaciones: lesión de intestino delgado (n=1), total 1/18, 5.5% | Promedio de seguimiento: 15.5±1.9 (2.6-31.1) mesesIMC dc: 35.8 (24-42.6) kg/m2% EWL: 61.7 (34.2-103.2)Resolución de ERGE: 100%Resolución de DM2: 75% |
ac: antes de conversión; aMG: antes de manga gástrica; BG: bypass gástrico; dc: después de conversión; DM2: diabetes mellitus de tipo 2; ERGE: enfermedad por reflujo gastroesofágico; EWL: exceso de peso perdido; FPP: falla de pérdida de peso; GYA: gastroyeyuno anastomosis; IMC: índice de masa corporal; MG: manga gástrica.
Se requiere cirugía de conversión por falla o complicación del procedimiento entre el 5.5 y el 20%5,8,14. En la revisión, encontramos 6,745 MGL realizadas, 264 conversiones a BGL, entre 8 y 50 casos por estudio, el 3.9% de la población afectada. Los motivos más frecuentes de conversión fueron FPP (9/13), ERGE intratable (3/13) y fugas (1/13). La incidencia de conversión fue del 1.2-32% y nuestros resultados se encuentran dentro de ese rango (4.28%).
La pérdida de la restricción y el aumento de volumen alimenticio causan dilatación de la manga gástrica14. La resección gástrica inadecuada, la dilatación de manga y la formación de neofondo son las causas anatómicas para la FPP5,15. Sin embargo, existen casos sin alteración anatómica con FPP. En nuestro estudio, el 53% de los pacientes no presentaron alteración anatómica; 5pacientes convertidos por FPP del estudio de Langer y uno de Casillas tampoco presentaron dilatación de la MGL4,16. En estos casos, los factores conductuales, como pobre adherencia a los cambios del estilo de vida y dieta, deben ser la causa en la FPP5.
La falta de seguimiento a largo plazo y la pérdida de este son limitantes en los resultados de cirugía bariátrica. En la tabla 4, se observa que el mayor seguimiento posterior a cirugía de conversión fue de 10 años en un solo estudio; el resto presentó pobre seguimiento de 3 a 36 meses. El cambio en el IMC posterior a conversión fue de 3 a 14.5 puntos; el mejor %EWL fue de 76.5 y el más bajo de 16.4. En nuestros resultados, el promedio de %EWL después de 52 meses posterior a MGL fue 38.4 vs. 53.5%, 36 meses después de la conversión. Se considera un %EWL>50 a los 2años de la cirugía bariátrica como cirugía exitosa; la cirugía de conversión fue aceptable nuestros pacientes. Sin embargo, el BGLp logra mayor %EWL, como se observa en este y otros estudios5,15-17. Carmeli et al. compararon la pérdida de peso posterior a conversión de derivación biliopancreática con switch duodenal (BPD/DS) vs. bypass gástrico y encontraron mejor pérdida de peso con BPD/DS, técnica que requiere mayor curva de aprendizaje y presenta más complicaciones postoperatorias11,18.
El ERGE refractario posterior a MGL es provocado por la disrupción de mecanismos antirreflujo y por la ley de Laplace (elevación de presión intragástrica). Con la pérdida de peso y de grasa visceral, la herniación de la MGL se hace más pronunciada4,14. Uno de nuestros pacientes con ERGE intratable sin hernia hiatal previa a MGL presentó migración de fondo gástrico muy evidente (fig. 2). Sigue siendo controversial el ERGE posterior a MGL: en una revisión sistemática se demostró el incremento de la prevalencia de ERGE en 4 estudios y en 7, su mejoría19. Hendricks muestra que la incidencia de ERGE denovo es mayor del 3% y la exacerbación de los síntomas en del 1% de los pacientes con diagnóstico previo y el 4% de 919 pacientes requirió conversión a RYGB20. Es importante saber que los estudios que examinan la incidencia de ERGE posterior a MGL tienen muchas limitaciones y fallas de diseño. Primero, la técnica quirúrgica de MGL no está estandarizada; diferentes técnicas resultan en tamaños variables de manga (fondo residual y estenosis de incisura), lo anterior influye en el ERGE postoperatorio. Segundo, la verdadera incidencia de ERGE en pacientes posterior a MGL es desconocida, ya que no se someten de manera rutinaria a estudios de impedancia o pHmetría. Tercero, muchos pacientes desarrollan síntomas gastrointestinales no específicos, como regurgitación, distensión, dolor torácico, los cuales son atribuidos erróneamente a ERGE intratable sin estudios confirmatorios objetivos18. La resolución de los síntomas de ERGE intratable después de la conversión a bypass gástrico en nuestros pacientes fue efectiva; en la revisión, 12estudios mostraron resolución de ERGE entre el 57 y el 100% de efectividad, sin necesidad de mayor medicación en 100 pacientes (tabla 4).
La incidencia de estenosis gástrica posterior a MGL es del 0.1-3.9%19. En nuestro estudio representa el 0.47% de todos los casos. Shnell et al. demostraron la efectividad de dilataciones con balón a través de endoscopia, con éxito del 44%15. A nuestros pacientes se les realizaron entre 2 y 6 sesiones de dilataciones sin mejorar la obstrucción, debido al segmento largo de estenosis en la incisura. La cirugía de conversión resolvió los síntomas de estenosis gástrica. En la revisión, en 3estudios se realizó conversión por estenosis gástricas en 12 pacientes, en los que se resolvió la obstrucción gástrica.
La tendencia general es que la pérdida de peso es ligeramente inferior y la resolución de comorbilidades, como diabetes mellitus tipo 2, es menor con la MGL21. La recidiva de comorbilidades no fue motivo de conversión en ninguno de nuestros pacientes, ya que presentaron algún grado de mejoría y disminución de medicamentos posterior a MGL. Treinta y seismeses después de la conversión, algunos de nuestros pacientes lograron remisión de hipertensión y diabetes mellitus tipo 2. En 4estudios de la revisión, la recidiva de comorbilidades, especialmente de diabetes mellitus tipo 2, fue motivo de conversión en 7 pacientes, que llegaron a remisión entre el 50 y el 100% después de la conversión.
Existen diferentes técnicas para realizar el BGHr, entre ellas el procedimiento totalmente robótico y el híbrido. El tipo de técnica depende del posicionamiento del robot (Docking) y de la manera de abordar la GYA. Se realiza el procedimiento totalmente robótico al completar la GYA de manera manual o con la engrapadora robótica (EndoWrist Stapler®). Los procedimientos híbridos abordan alguna parte por vía laparoscópica y otra de manera robótica10.
En los estudios revisados se presentó mayor incidencia de complicaciones que en la cirugía primaria (10-55 vs. 5-12%)5,22. Las complicaciones más frecuentes en 264 conversiones fueron: úlcera anastomótica (n=10), estenosis GYA (n=7), fuga GYA (n=5), sangrado (n=4), hernia interna (n=3) y absceso o colección (n=2). Las técnicas de GYA manual y circular se asociaron con más complicaciones de úlcera o estenosis comparadas con técnica lineal (5 vs. 3 estudios). La cirugía asistida por robot tiene como finalidad facilitar la cirugía y mejorar los resultados. En nuestra institución se superó la curva de aprendizaje y se tiene la mayor experiencia con un procedimiento híbrido. En nuestros resultados no se presentaron complicaciones relacionadas con fugas, úlceras ni estenosis de GYA, a excepción de hernia interna (n=1), por lo que creemos que es la técnica más segura para pacientes que necesitarán cirugía de conversión.
El presente estudio tiene limitaciones, como falta de estandarización en técnica de MGL, su naturaleza retrospectiva, que es difícil aleatorizar, y la escasez de casos, ya que pocos fueron intervenidos por conversión. Con un mayor seguimiento se observaría si estos pacientes presentarán reganancia de peso o si se lograrían las metas esperadas a largo plazo.
En conclusión, después de la cirugía de conversión de MGL a bypass gástrico se logró pérdida de peso aceptable, sin ser mejor que BGLp. Los síntomas por ERGE refractaria, estenosis gástrica y la resolución de comorbilidades fueron mejores con la cirugía de conversión. No se pueden elaborar conclusiones definitivas por la muestra pequeña de pacientes. Se debe manejar un número mayor de MGL con falla y más estudios que muestren cuál es la mejor opción para estos pacientes.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que los procedimientos seguidos se conformaron a las normas éticas del comité de experimentación humana responsable y de acuerdo con la Asociación Médica Mundial y la Declaración de Helsinki.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes y se ha preservado en todo momento su anonimato.
Derecho a la privacidad y consentimiento informadoLos autores han obtenido el consentimiento informado de los pacientes o sujetos referidos en el artículo. Este documento obra en poder del autor de correspondencia.
FinanciaciónNo se recibió patrocinio alguno para realizar este artículo.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.