¿ Introducción
La incidencia del adenocarcinoma del esófago ha aumentado en los países occidentales y Latinoamérica en la última década. También se han observado cambios epidemiológicos en el cáncer colorrectal y el cáncer gástrico que cada vez con mayor frecuencia se observa en jóvenes. Estos cambios epidemiológicos han hecho evidente la necesidad de desarrollar programas de escrutinio y vigilancia así como de incluir técnicas para el diagnóstico y tratamiento del cáncer gastrointestinal incipiente en la práctica clínica cotidiana.
La resección endoscópica de la mucosa (REM) se desarrolló con el propósito de preservar la función gastrointestinal íntegra después de resecar una lesión en la mucosa del aparato digestivo, además de obtener especímenes más grandes que permitieran un diagnóstico histopatológico preciso.1-4 En Japón se han desarrollado diversas técnicas para la REM que se dividen en tres modalidades: REM con endoscopio de doble canal, REM por aspiración y disección endoscópica de la submucosa.1,4-10 La primera técnica desarrollada fue la REM con endoscopio de doble canal. En 1980, Takekoshi desarrolló un método denominado polipectomía endoscópica con doble asa ("EDSP", por sus siglas en inglés).1 En 1984 el Dr. Tada aplicó una técnica, la más difundida en todo el mundo para esta modalidad terapéutica, denominada biopsia por denudación ("Strip biopsy") o "inyectar, elevar y cortar". Para realizarla, se inyecta solución salina en la lesión para elevarla y hacerla susceptible de corte con un asa de polipectomía.1,2,4 En 1994, Inatsuchi implementó la técnica con cuatro endoclips que permitían elevar la lesión para hacerla susceptible de corte.1
La segunda técnica desarrollada fue la REM por aspiración. En 1992, Inoue desarrolló la técnica denominada REM con "cap" ("EMRC" por sus siglas en inglés), consiste en una resección de la mucosa, utilizando un anillo transparente, similar al usado para la ligadura de várices, con el propósito de succionar la lesión y hacerla susceptible de corte mediante un asa de polipectomía.1,7,8 En 1993, Masuda, describió una modificación de la técnica anterior, denominada REM con ligas ("EMRL" por sus siglas en inglés), en la que se succiona la lesión dentro del anillo transparente con ligas, se dispara una liga para atrapar la lesión y después se corta con un asa de polipectomía.1,7,8 En 1995, Torii aplicó otra variante con anillos plásticos oblicuos y de diferentes diámetros para resecar por aspiración.1,7,8 En 1993, Hirao combinó la solución salina con epinefrina, en dilución 1:10000, para elevar la lesión y hacerla susceptible de corte por aspiración.1,2
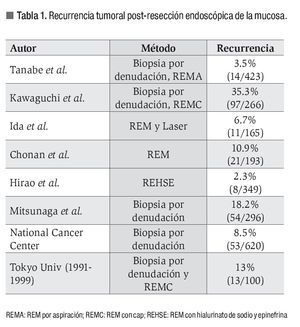
Debido a la relativa sencillez de las técnicas con inyección de solución salina y epinefrina para elevar las lesiones y hacerlas susceptibles de corte por técnicas de resección endoscópica como la biopsia por denudación y la REM por aspiración con ligas, su uso se ha globalizado a lo largo de 30 años.1-6 Sin embargo, la recurrencia local post-REM, varía de 2.3% a 35.3%,1,6-10 dependiendo del método utilizado en las diferentes series japonesas (Tabla 1). Estas técnicas tienen limitaciones en función del tamaño y localización de la lesión. Idealmente se requiere que el asa de polipectomía pueda abrazar a la lesión en su totalidad, ya que, en general, estas modalidades solamente permiten la resección por partes, como en la difundida técnica de biopsia por denudación6. Para evitar estos inconvenientes y resecar en bloque sin importar el tamaño de la lesión, se desarrolló la disección endoscópica de la submucosa (DESM), así como los diferentes dispositivos para realizarla.1,6,8,9 Esta técnica es una nueva alternativa terapéutica para el cáncer gastrointestinal incipiente (T1mN0), con mínimo riesgo de invasión más allá de la submucosa o metástasis a ganglios linfáticos confirmado por ultrasonido endoscópico en lesiones de 2 cm o más.8-10
Se conoce que en casos bien seleccionados de cáncer incipiente en esófago, estómago, intestino delgado o colon, la disección endoscópica de la submucosa puede reemplazar a la cirugía y otras modalidades terapéuticas como son la láser, radioablación, crioterapia y mucosectomía por aspiración, con o sin ligas, por sus tasas de recurrencia.
La peristalsis, las angulaciones y lo estrecho o delgado de las paredes del tracto gastrointestinal, son factores que dificultan la óptima posición del endoscopio durante la DESM, lo que hace más frecuente algunas complicaciones, como la perforación y hemorragia en esófago, intestino delgado y colon, cuando se comparan con el estómago.10-11 Este hecho hace que los modelos animales sean un recurso invaluable para el entrenamiento in vivo inicial.
El objetivo de esta revisión es la difusión en nuestro medio de los requerimientos y dispositivos para el entrenamiento, así como las indicaciones y contraindicaciones de la disección endoscópica de la submucosa (DESM).
¿ Material y métodos
Se realizó una búsqueda en el portal electrónico PubMed de 2005 a 2009, sobre todos los artículos publicados en idioma inglés que exploraran la seguridad y eficacia de la DESM en lesiones gastrointestinales por cáncer incipiente. Se emplearon las siguientes palabras clave: training, indications, devices, endoscopic mucosal resection (entrenamiento, indicaciones, dispositivos y disección endoscópica de la submucosa). Se seleccionaron publicaciones originales en extenso, artículos de revisión, guías de asociaciones médicas, revisiones técnicas, capítulos en syllabus de congresos médicos y consensos sobre el tema escritos en inglés. En forma adicional se consultaron referencias extraídas mediante búsqueda manual de los artículos resultados de la selección en éste repositorio electrónico.
¿ Resultados
Se recuperaron 371 artículos para análisis; de los que 250 fueron excluidos, ya que no eran artículos de revisión (se trataba de resúmenes o reporte de casos). Se eliminaron otros 96 por no contar con acceso al texto completo. Se incluyeron 25 que completaron los criterios de búsqueda. De acuerdo con la revisión realizada, se analizaron: indicaciones para la DESM en esófago, estómago y colon, soluciones para elevar la mucosa, dispositivos de corte, unidad electro-quirúrgica, técnica para la DESM y requisitos para el entrenamiento en DESM.
DESM en esófago, estómago, colon y recto: Para establecer la profundidad de invasión en la lesión y el riesgo de metástasis a ganglios linfáticos se divide en tercios a la mucosa (m1, m2, m3) y submucosa (sm1, sm2, sm3).1-10 Los criterios para la DESM, son el resultado de numerosas investigaciones japonesas de los últimos 50 años, mismas que se resumen a continuación:
Esófago. En el cáncer escamoso que se limita a m1 y m2 el riesgo de metástasis a ganglios linfáticos es menor de 2%, mientras que para el que invade m3 o sm1 aumenta de 8% a 19%, y cuando infiltra sm2 o sm3, el riesgo es mayor a 40%. Para el adenocarcinoma confinado a la mucosa el riesgo de invasión a ganglios linfáticos es de 1% a 3%.
No existen diferencias en el riesgo de metástasis a ganglios linfáticos entre adenocarcinoma y cáncer escamoso después de invasión a la submucosa.
Las indicaciones absolutas de DESM en cáncer escamoso son: a) lesiones superficiales (m1 o m2); b) limitadas (menores de 3 cm o de menos de 3/4 de la circunferencia), y; c) escasas (una a cuatro lesiones).
Las indicaciones relativas son: a) lesiones hasta m3 o sm1; b) extensas (mayores de 3 cm o más de 3/4 de la circunferencia), y; c) múltiples (más de cinco lesiones).10-13
Estómago. Las indicaciones absolutas para DESM en estómago son: a) carcinoma bien diferenciado limitado a la mucosa y no ulcerado sin importar su tamaño; y b) carcinoma bien diferenciado limitado a la mucosa menor de 30 mm con cicatriz de úlcera.
Gotoda y colaboradores,10-13 del Centro Nacional de Cáncer en Japón, demostraron que no se observan metástasis a ganglios linfáticos y por tanto también son candidatos a DESM dos grupos de pacientes. Primer grupo: a) carcinoma bien diferenciado y mínima invasión submucosa; b) tamaño de la lesión menor de 3 cm; c) sin invasión linfática o vascular, y; c) menos de 500 µm de infiltración (menor que sm1). El segundo grupo son pacientes con: a) carcinoma indiferenciado; b) sin úlcera; c) sin invasión linfática o vascular, y; d) con tamaño de la lesión menor de 3 cm. La nomenclatura de los tipos de lesión se muestra en la Tabla 2.
Colon y recto. La DESM puede realizarse en colon en lesiones con mayor infiltración a la submucosa que requieren un diagnóstico histopatológico preciso a través de resección en bloque. A pesar de lo anterior, el riesgo de metástasis a ganglios linfáticos en colon sólo ocurre después de invasión a la submucosa y es directamente proporcional a la profundidad de ésta. El valor de corte para la profundidad de la invasión que se considera en la DESM del colon y recto, está dividido de acuerdo a la opinión de dos grupos de expertos (500 µm para unos y 1000 µm para otros autores). Sin embargo, los mejores indicadores del riesgo de metástasis son la invasión vascular y linfática dentro o en la periferia de la lesión.
La DESM está indicada en: a) lesiones con diámetro mayor de 20 mm con patrón de los cuellos glandulares para endoscopia de magnificación desarrollados por Kudo tipo III L (tubular grande), III S (tubular pequeña), IV (cerebroide) o V de bajo grado (sin estructura); b) tumores no granulares de expansión lateral, en particular aquellos del tipo plano superficialmente deprimido.
Son indicaciones relativas para DESM en colon: a) tumores deprimidos mayores de 10 mm; b) tumores submucosos, y; c) tumores con fibrosis secundaria a biopsia u otras causas.
Por último, se considera infiltración submucosa extensa y no candidatos a DESM por el alto riesgo de metástasis a ganglios linfáticos a los pacientes con: a) tumores con patrón de los cuellos glandulares de Kudo tipo V de alto grado (sin estructura), y; b) signo de ausencia de elevación "non-lifting sign".2,10,13
Las Indicaciones para DESM en esófago, estómago, colon y recto se resumen en la Tabla 3.
Soluciones para elevar la mucosa13-16
Con el propósito de elevar la lesión y hacerla susceptible de corte, se han usado diversas soluciones:
1. Solución salina hipertónica a 3.8% y solución glucosada al 10% con el inconveniente de que ambas causan lisis celular.
2. Solución salina isotónica con hialurinato de sodio, epinefrina e índigo carmín. Esta solución es la que proporciona el mayor tiempo de elevación de la mucosa; sin embargo el hialourinato no está disponible en todos los centros hospitalarios, por lo tanto, debe reservarse para los casos de DESM más difíciles.17
3. Solución salina isotónica con glicerol, epinefrina e índigo carmín. Esta solución también ha demostrado un tiempo prolongado de elevación de la mucosa además de ser económica.15
Por último, de entre las diferentes soluciones comerciales utilizadas en Japón para elevar la mucosa durante la DESM, la más usada es la salina isotónica diluida con epinefrina (1:10,000) y 0.5 cc de índigo carmín.15,16 Se inyectan entre 10 mL y 30 mL, lo que depende del tamaño de la lesión con objeto de elevar y separar a la submucosa del plano muscular, según sea necesario, durante el procedimiento; o bien cuando dicha elevación es insuficiente para continuar con la disección. Es importante mencionar que el empleo de demasiada infiltración, puede obstaculizar una disección exitosa, porque interfiere con la adecuada observación del corte circunferencial inicial que delimita el margen de la lesión y orienta la dirección del corte.
1. Dispositivos de corte. Existen diferentes tipos de navajas; sin ellas, no hubiera sido posible la DESM. Estas navajas siguen evolucionando con el propósito de evitar complicaciones, facilitar el procedimiento y favorecer la difusión y uso de esta técnica a nivel mundial. Algunos ejemplos de este material de corte son:
2. Navaja con punta aislada "IT-knife2" KD-611L (Olympus Optical, Tokyo, Japón).
En 1995, el Dr. Hosokawa, en el Centro Nacional de Cáncer en Tokyo en Japón, desarrolló la primera navaja para DESM con punta aislada, conocida como "IT-knife".
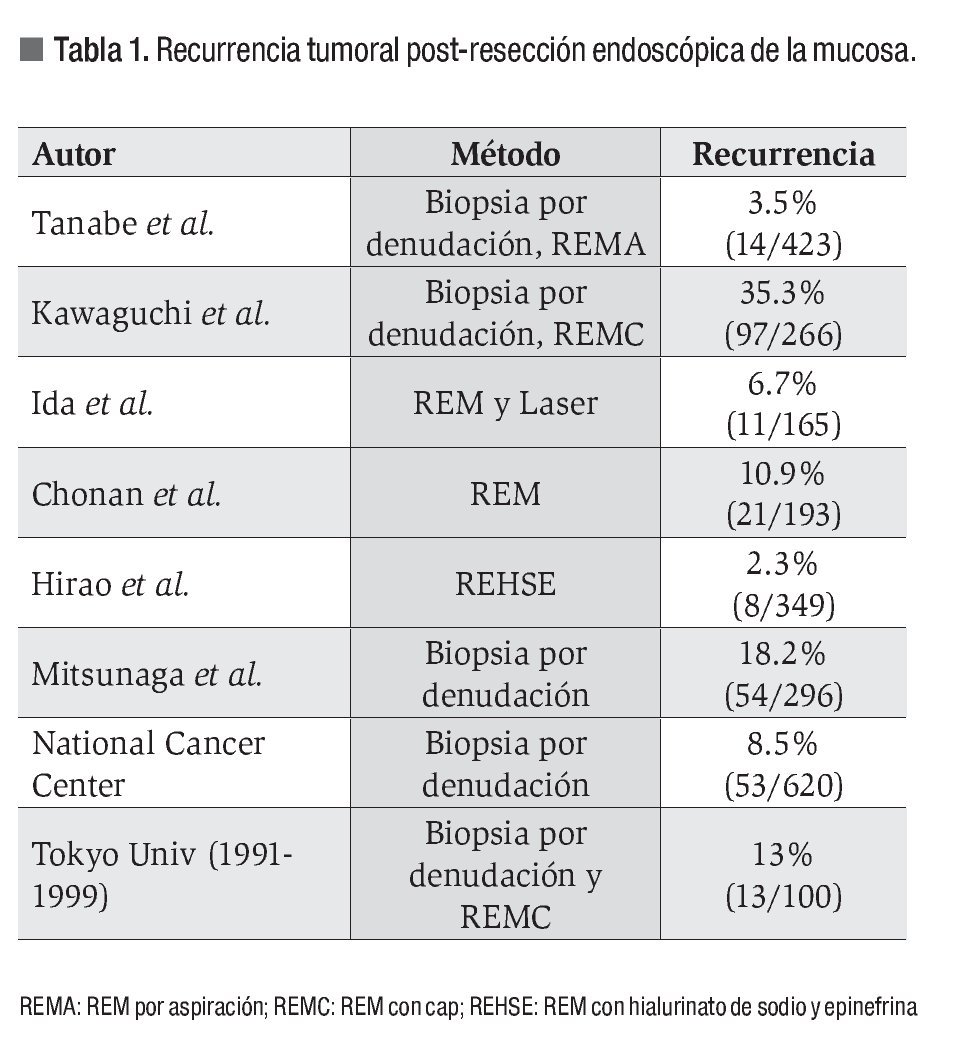
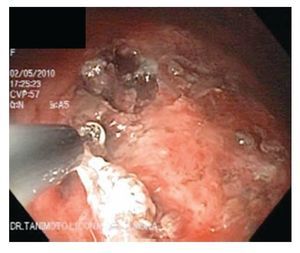
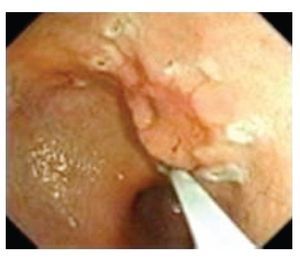
Debido a que era indispensable una posición horizontal forzada para cortar con el IT-knife, esta fue modificada y se dio origen a la "IT-knife2" (Figura 1). Esta navaja, también de forma tubular, tiene como novedad una terminación triangular.
¿ Figura 1. Navaja de punta aislada IT2 (KD-611L) disecando lesión gástrica.
También está aislada en la punta con una media esfera de cerámica. El triángulo en la base de la media esfera de la IT-knife2, permite enganchar la mucosa antes del corte así como el abordaje vertical, evitando perforaciones en manos experimentadas.1,6,9,10
3. Navaja de gancho "Hook knife" KD-620LR (Olympus Optical, Tokyo, Japón). En el año 2000, el Dr. Oyama implementó la navaja de gancho en el hospital central Saku de Nagano, Japón. La navaja de gancho (Figura 2) se usa principalmente en esófago. Es de forma tubular, con una punta angulada de un milímetro que resulta mejor al de la navaja de aguja, porque permite enganchar y jalar la mucosa antes del corte. El anillo transparente y suave que se coloca en la punta del endoscopio -transparent soft cap- D-201-11804 (Olympus Optical, Tokyo, Japón), aumenta el margen de seguridad durante el corte cuando la mucosa que entra al anillo es seccionada en la dirección deseada con un movimiento rotatorio del endoscopio. 1,6,9,10
¿ Figura 2. Navaja de gancho Hook-knife (KD-620LR), disecando lesión esofágica.
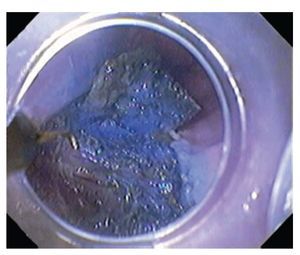
4. Navaja con punta flexible "Flex knife" KD-630L (Olympus Optical, Tokyo, Japón). También en el año 2000, Yahagi desarrolló la navaja flexible (Figura 3) en el hospital Toranomon de la Universidad de Tokyo, Japón. Tiene una longitud ajustable y el catéter plástico que recubre la navaja, termina con un anillo circular que frena la salida abrupta de la navaja para prevenir perforación y permitir un mejor control de la profundidad del corte. 1,6,9,10
¿ Figura 3. Navaja de punta flexible Flex (KD-630L) disecando lesión en colon.
5. Navaja de triángulo "Triangle knife" KD-640L (Olympus Optical, Tokyo, Japón). La punta triangular de está navaja puede usarse para coagulación y corte. Su diseño permite operarla en cualquier dirección. En 2009, Inoue del hospital Nothern Yokohama de la Universidad Showa, desarrolló una variante del procedimiento original de Pasricha de la Universidad de Stanford, usando está navaja para realizar miotomía en pacientes con acalasia, denominado miotomía endoscópica por esófago ("POEM" por sus siglas en inglés). 1,6,9,10
6. Navaja de punta de bola "Dual knife" KD-650L (Olympus Optical, Tokyo, Japón). Es una de las navajas más recientes. Se usa tanto en el tracto digestivo alto como bajo; su pequeña punta circular de cerámica, permite enganchar la mucosa durante el corte y previene perforaciones en diferentes posiciones en manos experimentadas. También se puede usar para marcar los bordes de la lesión y para hemostasia.18
Unidad electroquirúrgica
La nueva unidad de alta frecuencia ESG-100 (Olympus Optical, Tokyo, Japón), permite al endoscopista seleccionar la cantidad de watts (unidad de poder, por ejemplo, 20W). Dependiendo del procedimiento en cuestión (corriente de corte o de coagulación), también se selecciona entre diversos programas pregrabados para coagulación y corte (por ejemplo, forcecoag2 o softcut2), de acuerdo con las preferencias del endoscopista y de la dificultad técnica. Está moderna unidad electroquirúrgica, a través de sus diferentes programas, evita quemaduras transmurales, favorece el corte y la coagulación adecuados en manos experimentadas.
Técnica para la DESM
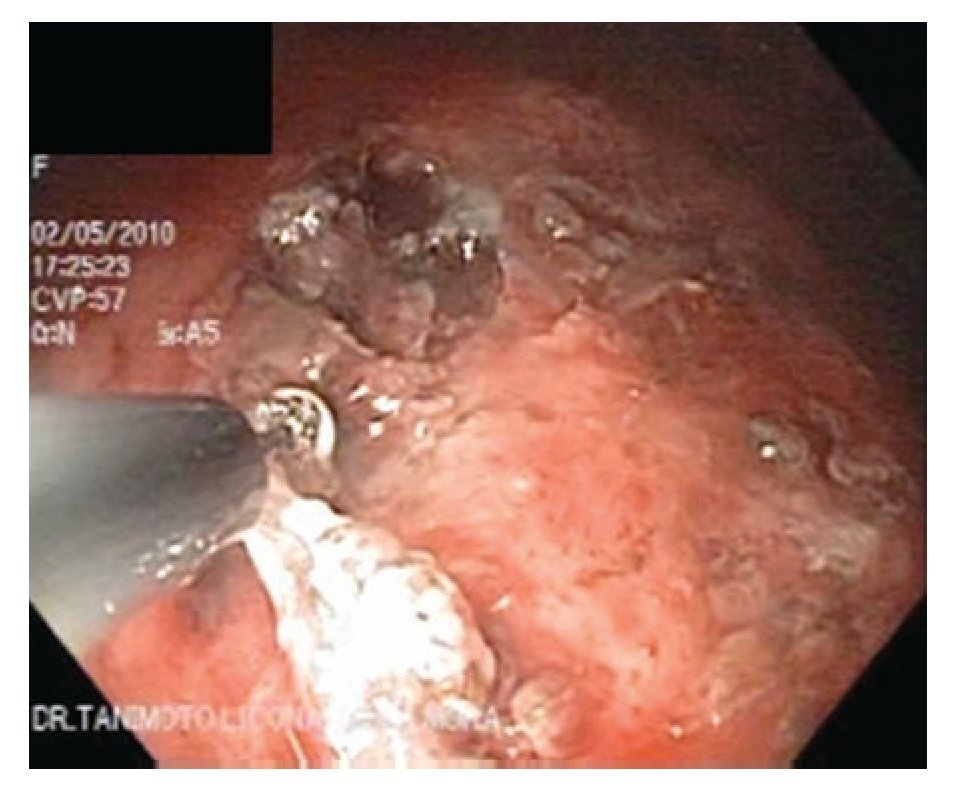
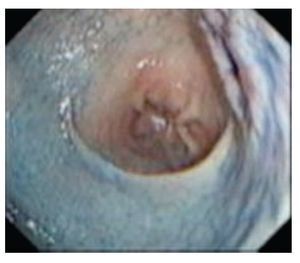
a) Con el catéter aspersor PW-5V-1 (Olympus Optical, Tokyo, Japón), la lesión y su periferia se limpian vigorosamente de saliva, moco y detritus con dimetil-polisiloxano y se aplica índigo carmín para definir por contraste los márgenes de la lesión (Figura 4).
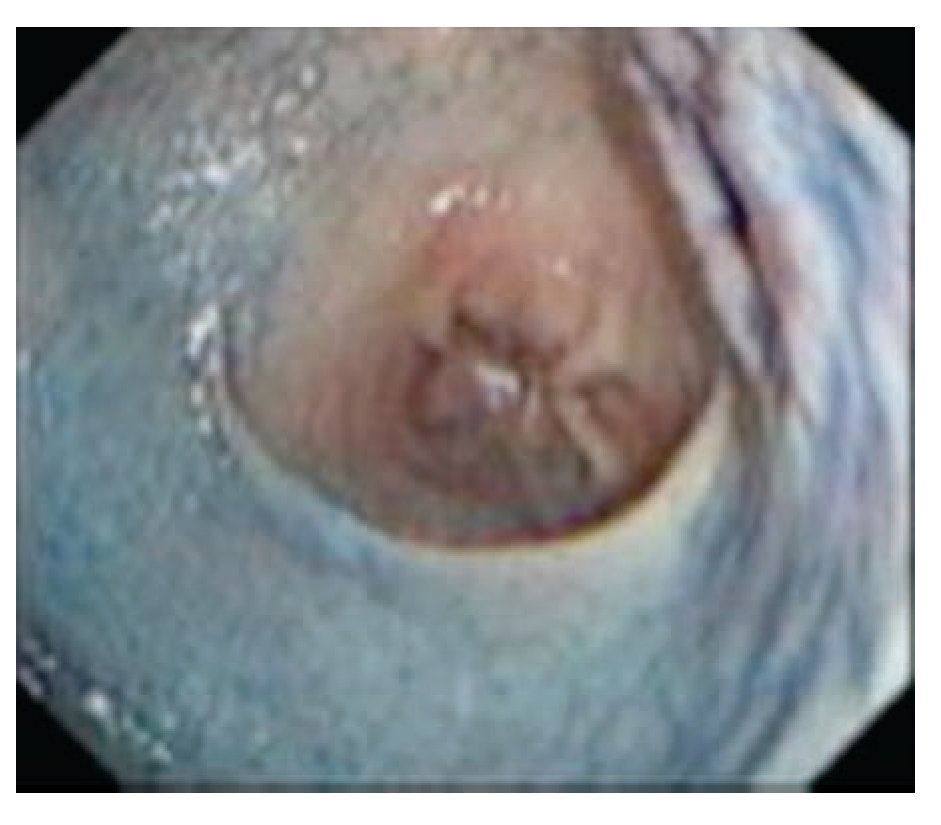
¿ Figura 4. Cáncer gástrico incipiente en pared posterior del cuerpo (Lesión tipo IIa+IIc) con índigo carmín.
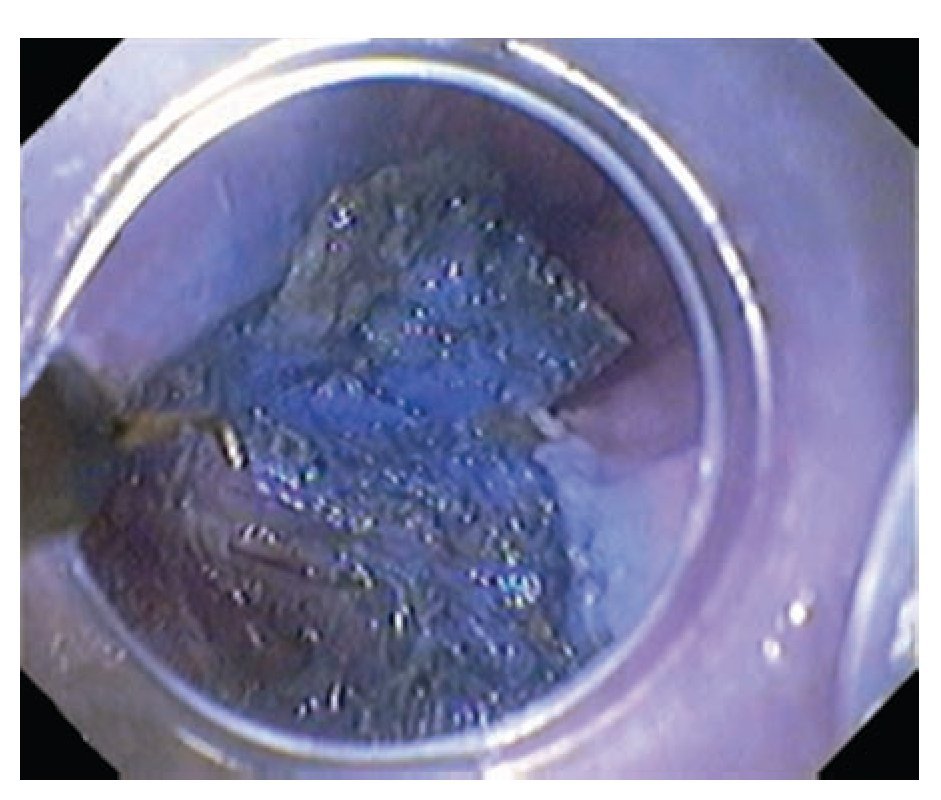
b) Con la navaja de punta KD-10Q-1 (Olympus Optical, Tokyo, Japan) y corriente de coagulación, se marcan puntos por fuera del margen de la lesión para delimitarla (Figura 5) y se aplica otro punto adicional para diferenciar la zona oral de la anal que permita orientar el espécimen al concluir la disección. Debido a que los márgenes en las lesiones del colon son más nítidos después de aplicar índigo carmín, en Japón pasan del punto "a" directo al punto "c"; sin embargo, en caso de lesiones mayores de 2 cm que abarquen toda la circunferencia intestinal, pueden ser útiles las marcas mencionadas.
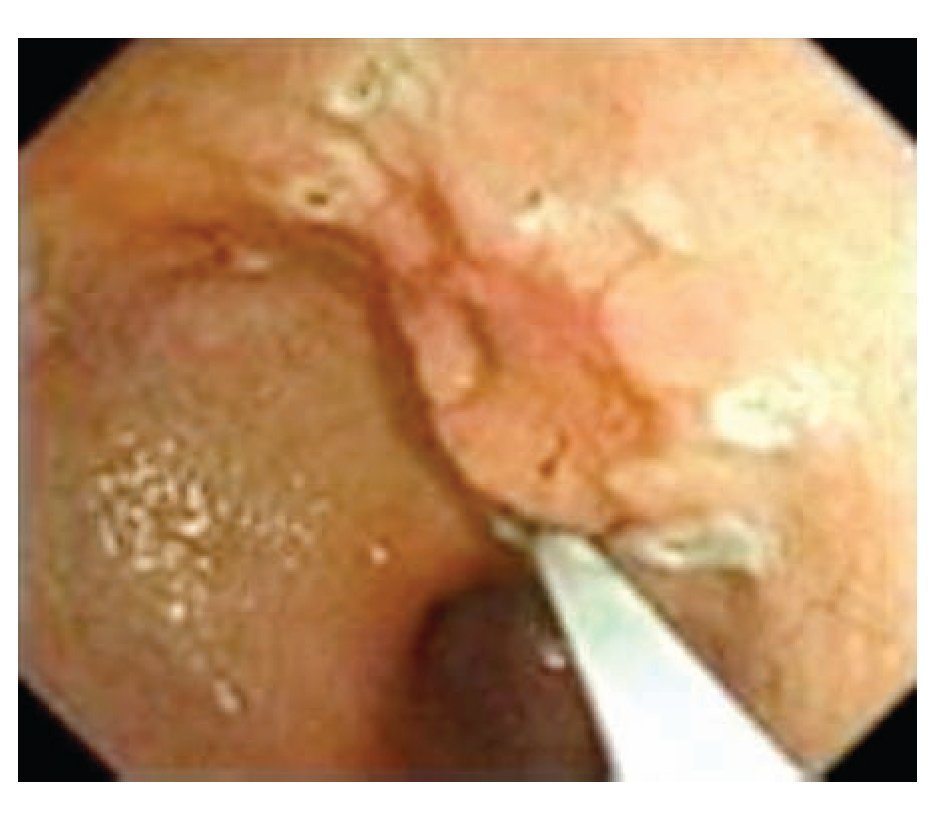
¿ Figura 5. Marcado de la periferia de la lesión.
c) Se inyecta solución salina con epinefrina (1:10000) e índigo carmín para elevar la periferia de lesión.
d) Con corriente de corte y la navaja elegida, de acuerdo con las preferencias del endoscopista o al órgano en cuestión (esófago, estómago, intestino delgado o colon), se diseca una circunferencia por fuera de las marcas descritas en el punto b.
e) Se extrae el endoscopio para colocar el anillo transparente en la punta del endoscopio y se regresa frente a la lesión. Antes de iniciar la DESM, y durante el procedimiento, se inyecta la solución descrita en el punto "c" para elevar la lesión según sea requerido.
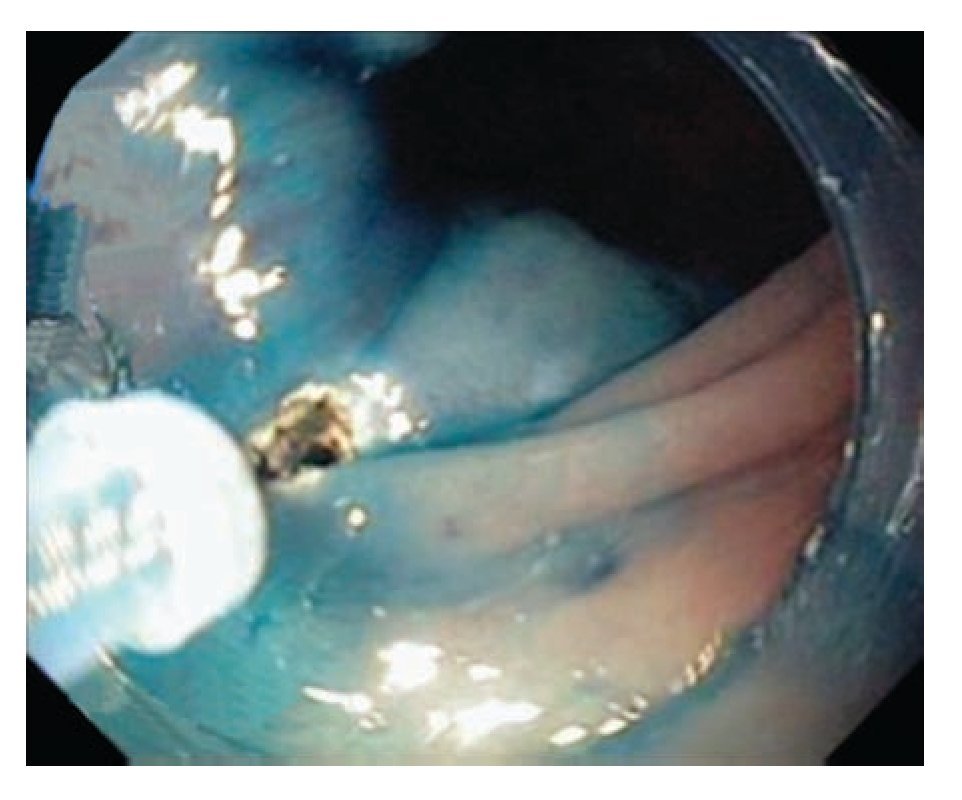
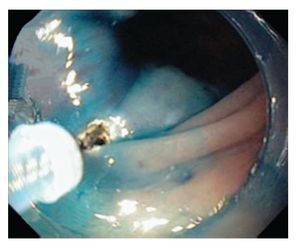
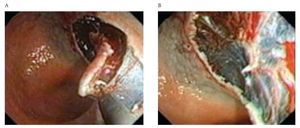
f) Se procede con la DESM, de tal manera que la gravedad ayude a orientar la dirección del corte (Figura 6). Durante el procedimiento, es indispensable levantar la mucosa disecada antes de continuar con el corte, para coagular con la navaja los pequeños vasos o bien con la pinza de coagulación Coagrasper FD-410LR (Olympus Optical, Tokyo, Japan) en caso de vasos de mayor calibre. Este procedimiento evita que la sangre interfiera con la disección y también evita el sangrado post-DESM.
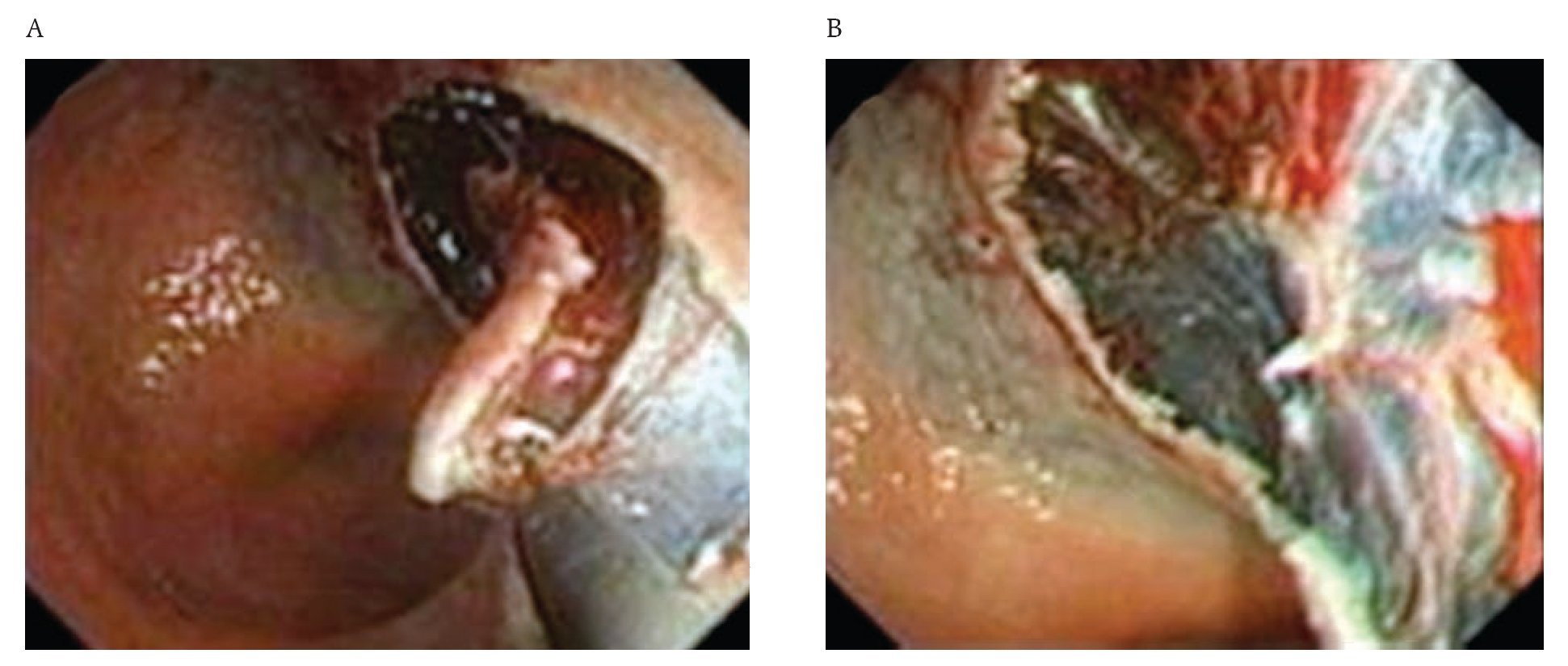
¿ Figura 6. A) Navaja con punta de cerámica IT-knife2 (KD-611L), disecando lesión gástrica y, B) después de de disecar la lesión gástrica.
g) Finalmente, para cumplir con el propósito por el cual fue creado este procedimiento, la orientación y el manejo de la pieza resecada, así como su preparación en cortes perpendiculares cada 2 mm, permiten una interpretación histopatológica adecuada que asegura tanto la profundidad como los bordes libres de lesión. Con este propósito, al concluir la DESM, se extrae el espécimen y se fija con agujas en corcho. También se confirma que la disección se realizó por fuera de los puntos del margen y se orienta la lesión para su preparación y corte previa al estudio histopatológico.1,6,9,10,18,19
Requisitos para el entrenamiento en DESM
El entrenamiento en esta técnica, debe ser tutorial y sólo puede iniciarse después de concluir el entrenamiento sobre los dispositivos (catéter aspersor, hemoclips, entre otros); técnicas (cromoendoscopia) y tecnologías (magnificación, imagen de banda angosta [NBI]) para identificar y tratar el cáncer incipiente en esófago, estómago, intestino delgado y colon.
Una vez cubierto lo anterior son necesarios un mínimo de 30 procedimientos de DESM en modelos animales in vivo (Figura 7) antes de iniciar la segunda parte del entrenamiento, primero como ayudante del experto y después, asistido por el experto en pacientes.
¿ Figura 7. Entrenamiento del procedimiento con modelos animales in vivo.
Debido a la coordinación necesaria entre el endoscopista y sus asistentes, otro aspecto que influye en el éxito de este procedimiento es la capacitación adecuada de cada miembro del equipo que participará en la DESM. En particular, el asistente también debiera ser experto en el procedimiento.20-26
En resumen, podemos afirmar que en los últimos 50 años, desde la definición del cáncer gastrointestinal incipiente en Japón, se han desarrollado nuevas tecnologías para su diagnóstico y tratamiento. Conforme ha disminuido la tasa de complicaciones en estos procedimientos endoscópicos, han aumentado nuestras expectativas. Al mismo tiempo, la enseñanza de la disección endoscópica de la submucosa, ha tomado un carácter más formal y por tanto se pretende que el endoscopista que la realiza tenga un conocimiento adecuado sobre las indicaciones, contraindicaciones y complicaciones, así como del manejo terapéutico adecuado de estas. Es necesario estar entrenado en los dispositivos, técnicas y tecnologías, para identificar y tratar el cáncer gastrointestinal incipiente antes de iniciar el entrenamiento tutorial en la disección endoscópica de la submucosa. No se debe intentar este procedimiento sin un entrenamiento tutorial adecuado, debido a que complicaciones tales como perforación y sangrado son más frecuentes durante la disección endoscópica de la submucosa, aún en manos experimentadas. De la misma manera que la técnica nunca debe anticiparse a la clínica; la habilidad o la tecnología o ambas son necesarias pero no reemplazan al entrenamiento o a la experiencia. Son necesarios centros de entrenamiento formal y estudios multicéntricos en América que permitan superar la curva de aprendizaje y para que este procedimiento pueda incorporarse en nuestra práctica clínica cotidiana.
¿ Agradecimientos
El autor agradece a la Asociación Mexicana de Gastroenterología su invitación para realizar la presente revisión. A la JICA (Japan International Coperation Agency), Agencia de Cooperación Internacional de Japón y al profesor Rikiya Fujita, por su entrenamiento en el hospital Fujigaoka de la Universidad Showa en Yokohama, Japón (1999-2001). A Olympus Japan/America y a Olymex por la donación de las navajas y equipo para el centro de entrenamiento de la Organización Mundial de Gastroenterología en el Instituto Nacional de Ciencias Médicas y Nutrición Salvador Zubiran. Al laboratorio Asofarma, por la donación de hialurinato de sodio (Meiji Seika Kaisha, Tokyo, Japón) necesario en este protocolo de investigación.
Correspondencia: Dr. Miguel A. Tanimoto.
Médica Sur, Puente de Piedra No. 150 Torre I Consultorio 402, Colonia Toriello Guerra. C.P. 14050,
México, D. F. Teléfonos: (55) 56 65-9188 Fax: 56 66-5982.
Correo electrónico: matanimoto@prodigy.net.mx