La infección por el virus de la hepatitis C (VHC) es un problema de salud pública a nivel mundial asociado a una gran morbimortalidad. En el caso del trasplante hepático, la demanda de órganos continúa siendo mayor que la oferta. Este problema ha llevado a tomar en consideración el uso de órganos de donadores con VHC positivos en receptores negativos.
Gracias al advenimiento de los antivirales de acción directa (AAD), los cuales han mostrado ser altamente efectivos para la curación del virus, ha sido posible procurar y utilizar órganos de donadores con infección por el VHC para ser trasplantados. En este artículo se hace una breve revisión de la evidencia actual del uso de órganos provenientes de pacientes infectados por el VHC.
Hepatitis C virus (HCV) infection is a worldwide public health problem associated with significant morbidity and mortality. In the context of liver transplantation, the demand for organs continues to exceed the supply, prompting the consideration of using organs from HCV-positive donors in HCV-negative recipients. The introduction of direct-acting antivirals (DAAs), which have demonstrated great efficacy in eradicating the virus, has made transplantation of organs from donors with HCV infection possible. The present article provides a brief review of the current evidence on the use of organs from HCV-infected patients.
La infección por el virus de la hepatitis C (VHC) es un problema de salud pública a nivel mundial, asociado a gran una morbimortalidad. Según las estimaciones de la Organización Mundial de la Salud (OMS) en 2022, alrededor de 58 millones de personas padecen infección crónica por el VHC a nivel mundial, con una incidencia aproximada de 1.5 millones de nuevas infecciones cada año1.
En México, según el Registro Nacional de Estadística y Geografía (INEGI)2, la cirrosis hepática fue la quinta causa de mortalidad en los varones y la séptima en las mujeres en el año 2022, y la única cura disponible al momento es el trasplante hepático ortotópico (THO). En el país, existen diferentes retos para el trasplante, entre los que se encuentran una baja tasa de donación, donadores con órganos marginales, la prevalencia de hígado graso entre los donantes, aunado a una discrepancia significativa entre la demanda y la oferta de órganos, por lo que el uso de órganos de donantes infectados por el VHC podría ser de ayuda3. El usar órganos de estas características se requiere del acceso universal a los antivirales de acción directa (AAD), México es un país en el que se podría implementar esta estrategia, ya que el trasplantar órganos de donantes positivos de VHC, en receptores negativos, requiere el tratamiento con estos fármacos3. Esta medida ha demostrado resultados similares a los trasplantes realizados con órganos de donantes negativos para el VHC.
Por otro lado, la epidemia de consumo de opioides es de gran importancia, puesto que conlleva una alta tasa de mortalidad. En el periodo del 1996 al 2019, se han reportado aproximadamente 500,000 decesos secundarios a sobredosis por opioides4. Esta epidemia ha afectado principalmente a América del Norte, especialmente a EE. UU. y, en los últimos años, a Canadá4.
En México, la prevalencia estimada de consumo de opioides en la población general es inferior al 1%. Se conoce que los varones menores de 45 años son los más afectados y en particular se reporta el consumo, en los estados cerca a la frontera con EE. UU. Dado que el uso y abuso de drogas intravenosas, conlleva el riesgo de infección, transmisión y desarrollo por el VHC, se considera que, a largo plazo, estos pacientes pueden ser donadores de órganos (debido a los fallecimientos asociados al abuso), por lo que es importante tenerlos en consideración. Hay que recordar, además, que, durante la evolución del consumo de opioides, más de uno de cada 3 usuarios de drogas que son negativos para el VHC previo a su uso desarrollarán la infección en el siguiente año5.
Nuestro objetivo fue realizar una revisión de la evidencia actual sobre el impacto de trasplantar órganos de donadores positivos para el VHC en receptores negativos.
Tipo de donación de órganosEn el caso del trasplante de órganos sólidos, la demanda sigue superando la oferta, lo que resulta en una tasa de mortalidad considerable en los pacientes en lista de espera, ya que aproximadamente el 25% de los pacientes son removidos o mueren anualmente6. Esta situación ha obligado a la búsqueda de diferentes alternativas y no sólo a pacientes con muerte encefálica. Entre estas opciones se encuentran los donantes en asistolia controlada (Maastricht III y IV), los donantes vivos, los órganos divididos (split) y los órganos de donantes con infecciones virales crónicas, especialmente hepatitis C. Este último grupo representó el 9.7% de los hígados donados en 2019, y ha experimentado un aumento en los últimos años7.
Impacto de los antivirales de acción directaLa llegada de los AAD produjo una revolución en el panorama del manejo de la hepatitis C8, ya que estos medicamentos han demostrado ser altamente efectivos, logrando una tasa de respuesta viral sostenida (RVS) superior al 95%, independientemente del grado de fibrosis hepática y genotipo viral. Esto ha llevado al desarrollo de programas de erradicación del virus en todo el mundo.
Es bien conocido que la recurrencia del VHC después de un THO es prácticamente inevitable en los pacientes infectados, y de no tratarse, puede conducir a la pérdida del injerto. Sin embargo, los AAD han tenido un impacto significativo en todas las etapas de la enfermedad hepática, ya que el lograr una RVS en pacientes con una enfermedad hepática avanzada, estabiliza la enfermedad, puede retrasar el trasplante e incluso se ha observado una reducción considerable en el número de pacientes con cirrosis por el VHC en la lista de espera para trasplante hepático9.
La alta eficacia y tolerabilidad de los antivirales actualmente disponibles, permite considerar el uso de órganos de donantes positivos para el VHC que anteriormente no hubieran sido considerados como viables. Esto ha llevado a un incremento del porcentaje de este tipo de donantes, pasando del 7 al 17% desde 201510, lo que plantea nuevos desafíos y consideraciones éticas11.
Efecto del uso de drogas y virus de la hepatitis CLa epidemia del uso de opioides es sumamente preocupante, con una concentración notable en EE. UU. y Canadá en los últimos años. Se considera que desde 2013 está aconteciendo la tercera ola de este problema, a expensas del uso de opioides sintéticos. En 2009, la mortalidad por consumo de drogas superó la mortalidad por accidentes automovilísticos, y entre 1996 y 2019 se registraron más de 500,000 muertes relacionadas con opioides. Es importante destacar que, a partir de 2012, el número de usuarios de opioides aumentó a 255 millones aproximadamente, con una mortalidad de 11,000 personas por año, independiente de la edad, del sexo, de la raza o de la etnia4.
Un estudio publicado en los EE. UU. durante 2017 reveló que aproximadamente 11.4 millones de estadounidenses afirmaron haber consumido drogas en el último año. Vale la pena destacar que el 4.2% de la población tenía solo 12 años de edad, y la mortalidad relacionada fue de 47,000 personas12.
Históricamente, México se ha considerado como un país con baja prevalencia de consumo de drogas. Sin embargo, en los últimos años existen datos que demuestran un aumento en el consumo de opioides, asociado a la producción. Según la Encuesta Nacional de Consumo de Drogas, Alcohol y Tabaco (ENCODAT) realizada en 2016-2017, la prevalencia de uso de opioides fue inferior al 1%, con mayor riesgo en los varones que en las mujeres y el grupo de edad más afectado fue de 18 a 34 años13.
La epidemia del uso de opioides se ha asociado con un aumento en las infecciones de transmisión parenteral, incluyendo la hepatitis C. Se sabe que más del 30% de las personas que no están infectadas al inicio terminan siendo positivas después de un año de ser usuarios de drogas intravenosas (UDI)4. El desarrollo de esta infección conlleva un mayor riesgo de mortalidad. Asimismo, se ha observado un incremento en el número de donantes infectados, pasando del 1.1 al 13.7% en el año 201714. Estos donantes tienden a ser jóvenes y previamente sanos, lo que permite obtener órganos en excelentes condiciones15.
En México, se está reproduciendo este fenómeno de abuso de opioides, lo que podría llevar a problemas similares a los descritos en EE. UU. y Canadá12. Un estudio realizado en UDI en zonas fronterizas de México (Tijuana y Ciudad Juárez) y EE. UU. encontró una prevalencia general de anticuerpos contra el VHC del 94.6% y contra el virus de la inmunodeficiencia humana (VIH) del 2.8%16.
Donantes con virus de la hepatitis C positivosPara comprender el alcance del uso de órganos de donantes con VHC positivos, se tiene que recalcar que existen 2 grupos de pacientes infectados. Primeramente, está el grupo Ab+/RNA+, que está compuesto por aquellos con anticuerpos y RNA+ para el VHC o anticuerpos positivos y prueba de ácido nucleico (NAT) positiva (Ab+/NAT+). El segundo grupo está formado por aquellos con anticuerpos positivos y RNA negativo (Ab+/RNA−)17. La relevancia de esto recae en que el grupo de donadores con Ab+/RNA−, tiene viremia negativa y el riesgo de transmisión de la enfermedad es nulo11. Sin embargo, la mayoría de los estudios realizados antes del año 2013 reportaron como «donadores positivos» aquellos basados solamente en la prueba de anticuerpos positivos. De tal manera, que se desconoce la proporción de pacientes que tenían viremia.
El uso de órganos de donantes Ab+/RNA+ ha sido considerado durante muchos años en los trasplantes de órganos sólidos. Sin embargo, dado todos los efectos adversos ocasionados por el interferón (IFN) y una baja RVS (inferior al 50%), la implementación de esta terapéutica dio resultados subóptimos. Con el incremento actual en la necesidad de THO y la alta tasa de curación con los AAD, la posibilidad de utilizar órganos de UDI y VHC positivos se presenta como una gran oportunidad para incrementar el número de donantes.
La alta prevalencia de Ab+ en ciudades fronterizas de México como Tijuana y Ciudad Juárez debe ser considerada como una opción para incrementar el número de trasplantes de órgano sólido en los diferentes programas de nuestro país17. Dado que los UDI que fallecen por sobredosis a menudo son jóvenes y con pocas o nulas comorbilidades, se pudieran considerar como candidatos idóneos para la donación de órganos17.
Los criterios utilizados en los diferentes estudios para la evaluación de los órganos de donantes con VHC positivos son variables. En algunos depende solo de la experiencia del cirujano, ya que un órgano se puede considerar viable simplemente por su aspecto macroscópico. Sin embargo, también existen estudios con criterios más estrictos en los que a todos los órganos considerados se les realizó una biopsia hepática basal, considerándose como un órgano adecuado el tener fibrosis menor a 2 (<F2) o esteatosis menos al 10%. Además, otro criterio determinante es que los donadores debían ser negativos para otros virus como el VIH o el virus de la hepatitis B (VHB). Asimismo, mientras que no existen contraindicaciones respecto a la edad del donador, en diversos estudios la mayoría han sido pacientes menores a 60 años18–20.
Ventajas en costos de usar órganos de donadores con virus de la hepatitis C positivosLas ventajas de usar órganos de donadores positivos para el VHC no solo se ve reflejado en los programas de THO. El ejemplo más claro es en trasplante renal, tomando en cuenta que el tiempo desde el inicio de la diálisis de un paciente al trasplante puede ser en promedio 4 años en países desarrollados como Canadá o EE. UU., mientras que en México esto puede ser aún mayor. El utilizar órganos con VHC y Ab+/RNA+ puede incrementar el acceso a un trasplante, pero además puede disminuir de forma significativa el tiempo en lista de espera (años), con excelentes resultados en la función del injerto, lo que convierte a esta, en una estrategia costo-efectiva a mediano y largo plazo. En nuestro país se han hecho estudios de análisis de costos en la población con enfermedad renal crónica, comparando la terapia de reemplazo contra el trasplante renal. El resultado a 3 años de seguimiento fue una reducción significativa de más del 60% de los costos a favor del trasplante21. Otro estudio analizó el costo-beneficio a 5 años de seguimiento, donde se comparó la estrategia de aceptar un injerto con Ab+/RNA+ en pacientes con enfermedad renal crónica negativos para el VHC, y después del procedimiento recibir un esquema de AAD. Dicha intervención fue efectiva y menos costosa ($138,000.00 USD) con 4.8 años de vida, comparado con la estrategia de continuar en diálisis y mantenerse en lista de espera hasta obtener un órgano sin riesgos, y significó un costo de más del 200% ($329,000.00 USD) con 4.7 años de vida22.
En el caso de los pacientes con cirrosis hepática, se sabe que el grado de descompensación es proporcional a los costos de la atención. En un estudio donde se analizaron los costos por atención anual promedio en USD en el Instituto Mexicano de Seguridad Social (IMSS), el grupo Child-Pugh A fue de $4,269, Child-Pugh B $16,949.63, y finalmente para el grupo de Child-Pugh C fue de $30,249.25 y el costo aproximado a lo largo de la vida de un paciente con cirrosis fue de $ 65,520.1923. El incremento en el número de donantes y como consecuencia en el número de THO, no solo impacta en la supervivencia y el tiempo en lista de espera, sino que además puede reducir significativamente los altos costos reportados en la atención de la enfermedad hepática avanzada en los sistemas de salud pública en México.
Ventajas de aceptar donantes virus de la hepatitis C positivos en receptores negativos en trasplante hepáticoComo se mencionó, los AAD confieren una alta tasa de curación del VHC en la población general como en la población trasplantada, pero cabe recalcar, que presentan efectos secundarios e interacciones medicamentosas mínimas, por lo que es considerado un tratamiento seguro posterior al trasplante24. Todo esto ha permitido que en los últimos años se acumule una amplia experiencia en el THO con donantes Ab+/RNA+. Verbigracia, en el estudio realizado por Cotter et al.; donde analizaron una cohorte de pacientes que se sometieron a trasplante de enero 2008 a enero 2018, se observó que la supervivencia global y del injerto a uno y 2 años de órganos de donantes con Ab+/RNA+ fue similar a la de donantes no virémicos25.
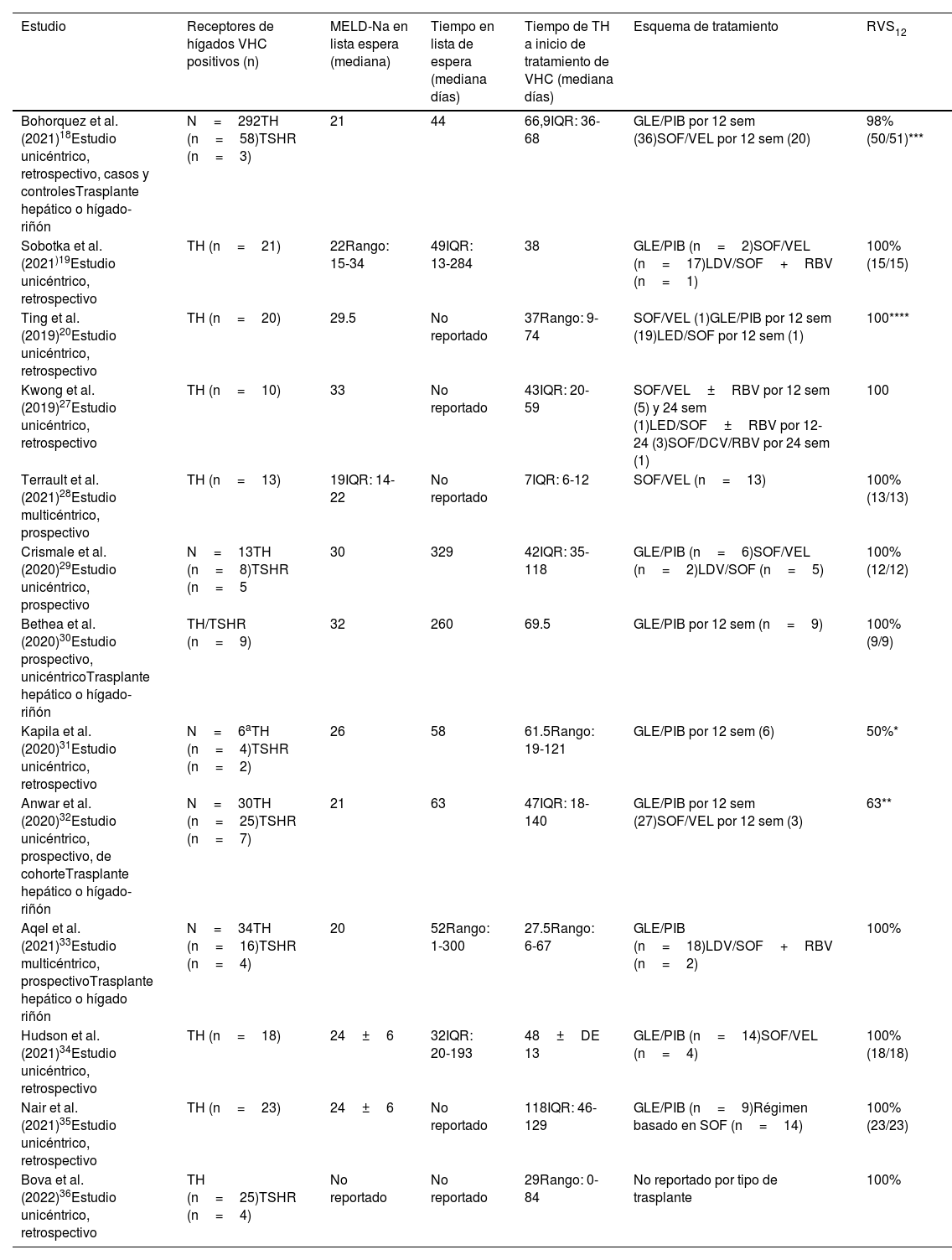
Adicionalmente, en una revisión sistemática donde se incluyeron 15 estudios realizados en EE. UU. y Europa con un tamaño de muestra de más de 1,900 pacientes, no hubo una diferencia en la supervivencia global y del injerto. Se sabe que a pesar de que los injertos infectados pueden tener una menor RVS y mayores costos por tratamientos adicionales, mejoran la supervivencia en pacientes graves en lista de espera, especialmente con MELD mayor a 20 o incluso >28 puntos26. En la tabla 1, se resume el impacto de los AAD en THO de donadores positivos (D+)/receptor negativos (R−) para el VHC.
Trasplante hepático de donadores con VHC positivos en receptores negativos. Ensayos publicados
| Estudio | Receptores de hígados VHC positivos (n) | MELD-Na en lista espera (mediana) | Tiempo en lista de espera (mediana días) | Tiempo de TH a inicio de tratamiento de VHC (mediana días) | Esquema de tratamiento | RVS12 |
|---|---|---|---|---|---|---|
| Bohorquez et al. (2021)18Estudio unicéntrico, retrospectivo, casos y controlesTrasplante hepático o hígado-riñón | N=292TH (n=58)TSHR (n=3) | 21 | 44 | 66,9IQR: 36-68 | GLE/PIB por 12 sem (36)SOF/VEL por 12 sem (20) | 98%(50/51)*** |
| Sobotka et al. (2021)19Estudio unicéntrico, retrospectivo | TH (n=21) | 22Rango: 15-34 | 49IQR: 13-284 | 38 | GLE/PIB (n=2)SOF/VEL (n=17)LDV/SOF+RBV (n=1) | 100%(15/15) |
| Ting et al. (2019)20Estudio unicéntrico, retrospectivo | TH (n=20) | 29.5 | No reportado | 37Rango: 9-74 | SOF/VEL (1)GLE/PIB por 12 sem (19)LED/SOF por 12 sem (1) | 100**** |
| Kwong et al. (2019)27Estudio unicéntrico, retrospectivo | TH (n=10) | 33 | No reportado | 43IQR: 20-59 | SOF/VEL±RBV por 12 sem (5) y 24 sem (1)LED/SOF±RBV por 12-24 (3)SOF/DCV/RBV por 24 sem (1) | 100 |
| Terrault et al.(2021)28Estudio multicéntrico, prospectivo | TH (n=13) | 19IQR: 14-22 | No reportado | 7IQR: 6-12 | SOF/VEL (n=13) | 100%(13/13) |
| Crismale et al. (2020)29Estudio unicéntrico, prospectivo | N=13TH (n=8)TSHR (n=5 | 30 | 329 | 42IQR: 35-118 | GLE/PIB (n=6)SOF/VEL (n=2)LDV/SOF (n=5) | 100%(12/12) |
| Bethea et al. (2020)30Estudio prospectivo, unicéntricoTrasplante hepático o hígado-riñón | TH/TSHR (n=9) | 32 | 260 | 69.5 | GLE/PIB por 12 sem (n=9) | 100%(9/9) |
| Kapila et al. (2020)31Estudio unicéntrico, retrospectivo | N=6aTH (n=4)TSHR (n=2) | 26 | 58 | 61.5Rango: 19-121 | GLE/PIB por 12 sem (6) | 50%* |
| Anwar et al. (2020)32Estudio unicéntrico, prospectivo, de cohorteTrasplante hepático o hígado-riñón | N=30TH (n=25)TSHR (n=7) | 21 | 63 | 47IQR: 18-140 | GLE/PIB por 12 sem (27)SOF/VEL por 12 sem (3) | 63** |
| Aqel et al. (2021)33Estudio multicéntrico, prospectivoTrasplante hepático o hígado riñón | N=34TH (n=16)TSHR (n=4) | 20 | 52Rango: 1-300 | 27.5Rango: 6-67 | GLE/PIB (n=18)LDV/SOF+RBV (n=2) | 100% |
| Hudson et al.(2021)34Estudio unicéntrico, retrospectivo | TH (n=18) | 24±6 | 32IQR: 20-193 | 48±DE 13 | GLE/PIB (n=14)SOF/VEL (n=4) | 100%(18/18) |
| Nair et al. (2021)35Estudio unicéntrico, retrospectivo | TH (n=23) | 24±6 | No reportado | 118IQR: 46-129 | GLE/PIB (n=9)Régimen basado en SOF (n=14) | 100%(23/23) |
| Bova et al. (2022)36Estudio unicéntrico, retrospectivo | TH (n=25)TSHR (n=4) | No reportado | No reportado | 29Rango: 0-84 | No reportado por tipo de trasplante | 100% |
AAD: antivirales de acción directa; DCV: daclatasvir; DE: desviación estándar; GLE: glecaprevir; IQR: rango intercuartílico; PIB: pibrentasvir; RBV: ribavirina; RVS12: respuesta viral sostenida semana 12; sem: semanas; SOF: sofosbuvir; TH: trasplante hepático; TSHR: trasplante simultáneo hígado-riñón; VEL: velpatasvir; VHC: virus de la hepatitis C.
Es importante recalcar que debido a la ola de tratamientos con AAD, la población infectada y que recibió tratamiento con RVS, va a presentar Ab+ para el VHC. Sin embargo, la viremia o NAT siempre serán negativos. Esta distinción es importante, ya que la transmisión del virus es inusual en los donantes con una prueba de NAT negativos. Si bien, raramente se han reportado casos de transmisión, esto se debe probablemente a una infección aguda en aquellos que se encontraban en un periodo de ventana37.
Actualmente, se ha demostrado que la supervivencia global y del injerto proveniente de donadores con infección de VHC ha mejorado con el uso de AAD, incluso teniendo una supervivencia comparable a aquellos trasplantados de donadores negativos para la infección. No obstante, es imprescindible informar siempre al potencial receptor sobre los riesgos y beneficios de esta estrategia17,38 mediante un consentimiento informado, tomando en cuenta que la información proporcionada se impartirá por personal capacitado, de forma clara y sencilla, sin coerción, y permitiendo al receptor ejercer su autonomía, ya que es posible que no todos los pacientes acepten este tipo de donación de órganos. En un estudio realizado en EE. UU. se demostró que, a pesar de las ventajas mencionadas, solo el 46% de los pacientes aceptó un órgano de un donante positivo para el VHC, y de estos solo el 60% sabía que la enfermedad era curable39.
Acceso de los antivirales de acción directaDesde el 2010, la Asamblea Mundial de la Salud reconoció a las hepatitis virales como un problema de salud pública, por lo que la OMS estableció el Programa Mundial contra la hepatitis C con el fin de lograr la erradicación a través de diversas estrategias.
En este contexto, México creó el Programa de Acción Específico de Prevención, Diagnóstico y Tratamiento de la Hepatitis C, 2016-2018, para lograr estos objetivos a mediano plazo. Gracias a esto, desde 2016 en México se cuenta con esquemas de tratamientos efectivos contra el VHC de acceso universal, por lo cual, esto hace posible la consideración de la estrategia de donación de órganos de pacientes infectados40. Sin embargo, actualmente en el país no existe una política pública sólida para aceptar el uso de estos órganos, lo cual constituye un reto que depende no solo del Centro Nacional de Trasplante (CENATRA), si no, también de cada centro y comité de trasplantes autorizados.
Impacto de donadores del virus de la hepatitis C positivos en receptores negativos en trasplante no hepáticoLas ventajas no solo existen en el caso del THO, sino que también se ha demostrado la eficacia de utilizar donadores del VHC positivo en receptores negativos en trasplante de otros órganos como riñón, corazón, pulmón, entre otros.
Trasplante renalEn el 2017 se describió el primer estudio que incluyó a 10 pacientes, en donde se utilizaron injertos renales virémicos en receptores sin viremia. Una de las ventajas obtenidas fue el corto tiempo de elegibilidad en lista de espera, donde solo fueron 58 días. Los 10 pacientes recibieron AAD con un esquema basado en elbasvir y grazoprevir y todos alcanzaron una RVS. Además, la función del injerto fue excelente a los seis meses de seguimiento41.
En otro estudio de 10 pacientes, estos recibieron un órgano de donadores con el VHC. La mediana de tiempo de espera al trasplante fue de solo 30 días y la terapia con AAD se inició antes del trasplante, continuándose por 12 semanas. En este estudio, el 100% de los pacientes (n=10) lograron una RVS, y sin efectos adversos graves relacionados con el tratamiento o la inmunosupresión42.
Trasplante de corazónEn trasplante de corazón también existe evidencia que demuestra la seguridad de utilizar estos órganos infectados por el VHC. En un estudio de Schlendorf et al., se incluyeron a 13 pacientes con trasplante cardíaco que recibieron un órgano de donadores del VHC positivo. De estos, 9 desarrollaron viremia después del trasplante y el tratamiento con AAD se inició una vez que los pacientes egresaron y se mantuvieron clínicamente estables. Ocho de los 9 alcanzaron una RVS a las 12 semanas después de terminar el esquema, y uno falleció por una embolia pulmonar. En el seguimiento a 6 meses, ninguno de los pacientes presentó eventos secundarios relacionados con el VHC o el tratamiento de erradicación43.
En otro estudio realizado por Kilic et al., el objetivo fue comparar los resultados de trasplante cardíaco de donadores del VHC positivos contra donadores del VHC negativos. Se incluyeron 7,889 pacientes que recibieron un trasplante cardíaco en el periodo del 2016 a 2018 en 128 centros de EE. UU., donde 343/7,889 (4.4%) de los trasplantes se realizaron de donantes del VHC positivos. La supervivencia global a un año fue similar entre los grupos (90.2 vs. 91.1%; p=0.86), y la tasa de rechazo al año fue no diferente entre los grupos (22.1 vs. 21.1%; p=0.84), demostrando la seguridad de utilizar estos órganos44.
Trasplante de pulmónSimilar al resto de los órganos, en un estudio donde se incluyeron 8 pacientes con trasplante cardíaco y 36 pacientes con trasplante de pulmón de donadores con VHC positivos, estos recibieron el tratamiento con AAD unas horas después del procedimiento, con una duración de cuatro semanas, logrando una RVS y una supervivencia a 6 meses de seguimiento del 100%45.
En otro estudio que incluyó 22 casos de trasplante de pulmón que recibieron un órgano con VHC positivo, la RVS fue del 100% y la supervivencia a 6 meses de seguimiento fue del 95%46.
Otros órganosExisten reportes de trasplante de páncreas solo o simultáneos de páncreas y riñón, especialmente en pacientes con diabetes tipo 1, así como trasplantes multivisceral, con un incremento en el número de procedimientos del 2.5 al 15% en los últimos años. En estos se han obtenido resultados muy similares al resto de los otros órganos, con un impacto en reducir el tiempo en lista de espera y una supervivencia global superior al 90% a un año de seguimiento47–49.
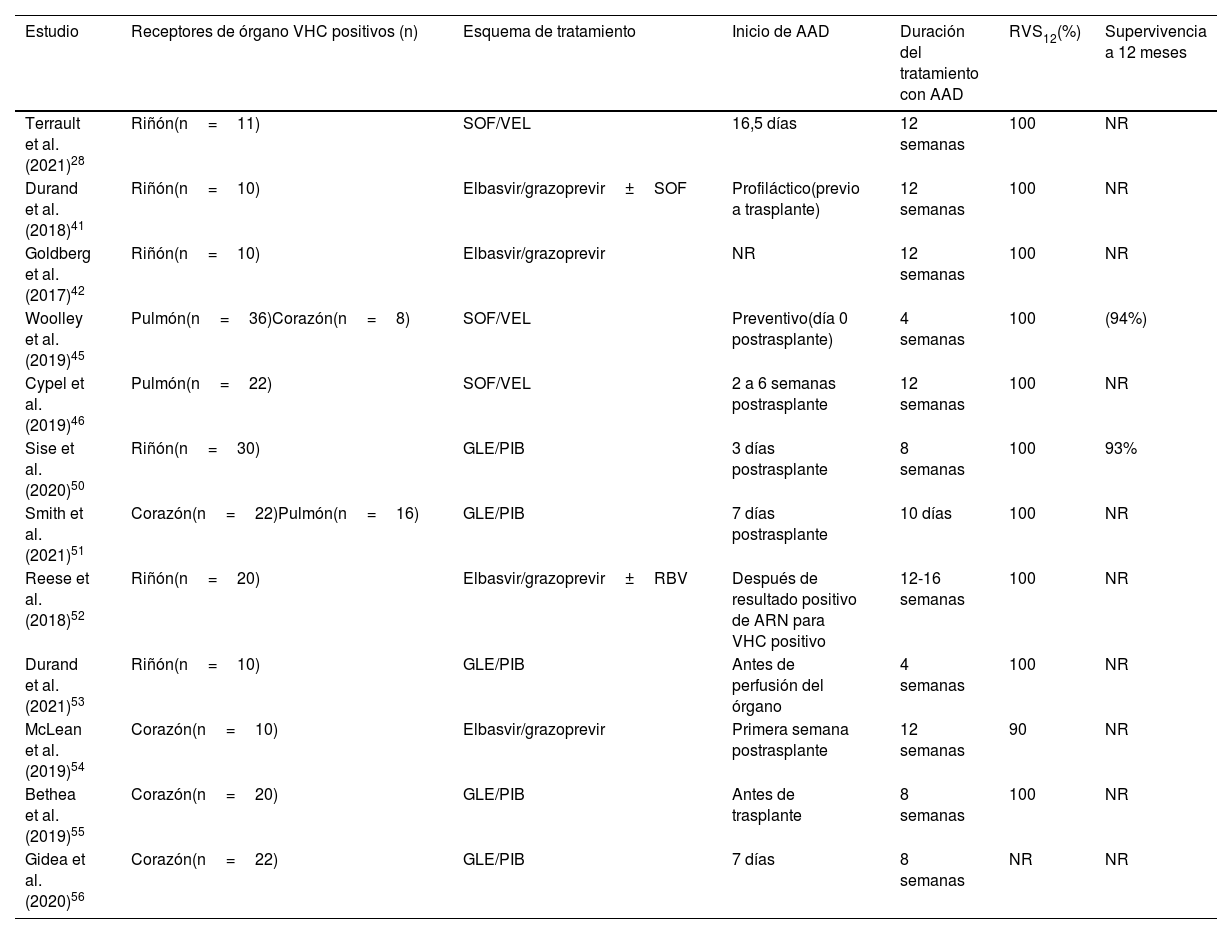
En la tabla 2, se resumen los esquemas de AAD en trasplante no hepático de D+/R− para el VHC.
Trasplantes de órganos de donantes VHC positivos en receptores negativos. Ensayos publicados
| Estudio | Receptores de órgano VHC positivos (n) | Esquema de tratamiento | Inicio de AAD | Duración del tratamiento con AAD | RVS12(%) | Supervivencia a 12 meses |
|---|---|---|---|---|---|---|
| Terrault et al. (2021)28 | Riñón(n=11) | SOF/VEL | 16,5 días | 12 semanas | 100 | NR |
| Durand et al. (2018)41 | Riñón(n=10) | Elbasvir/grazoprevir±SOF | Profiláctico(previo a trasplante) | 12 semanas | 100 | NR |
| Goldberg et al. (2017)42 | Riñón(n=10) | Elbasvir/grazoprevir | NR | 12 semanas | 100 | NR |
| Woolley et al. (2019)45 | Pulmón(n=36)Corazón(n=8) | SOF/VEL | Preventivo(día 0 postrasplante) | 4 semanas | 100 | (94%) |
| Cypel et al. (2019)46 | Pulmón(n=22) | SOF/VEL | 2 a 6 semanas postrasplante | 12 semanas | 100 | NR |
| Sise et al. (2020)50 | Riñón(n=30) | GLE/PIB | 3 días postrasplante | 8 semanas | 100 | 93% |
| Smith et al. (2021)51 | Corazón(n=22)Pulmón(n=16) | GLE/PIB | 7 días postrasplante | 10 días | 100 | NR |
| Reese et al. (2018)52 | Riñón(n=20) | Elbasvir/grazoprevir±RBV | Después de resultado positivo de ARN para VHC positivo | 12-16 semanas | 100 | NR |
| Durand et al. (2021)53 | Riñón(n=10) | GLE/PIB | Antes de perfusión del órgano | 4 semanas | 100 | NR |
| McLean et al. (2019)54 | Corazón(n=10) | Elbasvir/grazoprevir | Primera semana postrasplante | 12 semanas | 90 | NR |
| Bethea et al. (2019)55 | Corazón(n=20) | GLE/PIB | Antes de trasplante | 8 semanas | 100 | NR |
| Gidea et al. (2020)56 | Corazón(n=22) | GLE/PIB | 7 días | 8 semanas | NR | NR |
AAD: antivirales de acción directa; DCV: daclatasvir; GLE: glecaprevir; NR: no reportado; PIB: pibrentasvir; RBV: ribavirina; RVS12: respuesta viral sostenida semana 12; SOF: sofosbuvir; VEL: velpatasvir; VHC: virus de la hepatitis C.
Los diferentes regímenes de tratamiento para el VHC con AAD tienen numerosas ventajas, las cuales incluyen un periodo corto de duración (12 semanas), pocos efectos adversos y una alta tasa de curación. Con la gran disparidad que existe entre los pacientes con necesidad de trasplante de un órgano y la disponibilidad de estos, muchos programas de trasplante en el mundo han optado por el uso de órganos de donadores por el VHC positivos, en vista de la alta tasa de respuesta a los AAD38.
Trasplante hepáticoEn múltiples estudios se ha demostrado la eficacia y seguridad de los AAD en el periodo postrasplante en receptores de donadores con VHC y RNA positiva. Las guías internacionales recomiendan un inicio temprano del tratamiento, de preferencia en la primera o segunda semana después del trasplante, cuando el paciente está clínicamente estable. Los esquemas pangenotípicos recomendados actualmente incluyen dosis diaria de la combinación de glecaprevir (300mg) y pibrentasvir (120mg) o sofosbuvir (400mg) y velpatasvir (100mg) por 12 semanas de duración, ambos disponibles en México (tabla 3)57.
Esquemas de tratamiento con AAD en receptores de órganos de donadores VHC positivos
| Esquema | Inicio del tratamiento | Duración del tratamiento | |
|---|---|---|---|
| Trasplante hepático | Glecaprevir/pibrentasvirSofosbuvir/velpatasvir | Primeras 2 semanas después del THO | 12 semanas |
| Trasplante de otros órganos | Glecaprevir/pibrentasvirSofosbuvir/velpatasvir | Pre-trasplante o día 0 postrasplante | 8 semanas12 semanas |
AAD: antivirales de acción directa; VHC: virus de la hepatitis C; THO: trasplante hepático ortotópico.
Diversos estudios han explorado los desenlaces en THO de donadores con viremia de VHC positiva. En el estudio de Kwong et al. Reportaron en 2019 los resultados de 10 receptores negativos para VHC que recibieron un órgano de donadores con VHC y RNA positivo. De estos, el 100% lograron una RVS con diferentes esquemas de AAD, con una duración entre 12 a 24 semanas. La mediana de tiempo desde el trasplante hasta el inicio del tratamiento fue de 43 días (rango intercuartil [IQR]: 20-59 días). Llamó la atención que hubo una tasa más alta de eventos de rechazo agudo postrasplante (30%) durante o después del tratamiento, posiblemente relacionado a las interacciones con los inmunosupresores o cambios en el perfil inmunológico posterior a la erradicación del VHC. Sin embargo, no hubo pérdidas del injerto o muertes reportadas en el seguimiento a 380 días (IQR: 263-433)27.
En otro estudio unicéntrico, se incluyeron a 61 trasplantados de donadores virémicos y se compararon con 231 receptores de órganos de donadores no virémicos. Solo 56/61 pacientes del grupo de estudio recibieron terapia antiviral; el tratamiento se inició en una mediana de tiempo de 66 días después del trasplante. Se reportó una mortalidad de cuatro pacientes (6.5%) durante el primer año de seguimiento, no relacionada con el VHC o el tratamiento. De los 51 pacientes con información completa del tratamiento, el 64% fueron tratados con glecaprevir y pibrentasvir y el 36% recibieron sofosbuvir y velpatasvir. Se logró una RVS en el 100% de los pacientes a las 12 semanas, y solo un paciente (<2%) requirió terapia de rescate a base de sofosbuvir, velpatasvir y voxilaprevir posterior a una recaída viral. No hubo diferencias significativas entre los receptores de donadores virémicos para el VHC comparado con donadores no virémicos en desenlaces clínicos como rechazo celular agudo, deterioro de la función renal o supervivencia global y del injerto18.
En otro ensayo clínico, prospectivo, multicéntrico, se incluyeron 13 pacientes negativos para el VHC que recibieron un órgano de donadores con RNA positivo. Los receptores fueron tratados por 12 semanas de sofosbuvir y velpatasvir. La mediana de tiempo entre el trasplante y el inicio del tratamiento antiviral fue de 7 días. El 100% de los pacientes lograron una RVS. En este estudio se reportaron eventos adversos graves en cuatro pacientes (31%) como rechazo mediado por anticuerpos, cardiomiopatía idiopática, esclerosis biliar intrahepática y enfermedad de injerto contra huésped (que resultó en la muerte del paciente), aunque no queda claro si estos eventos fueron relacionados con el virus o el tratamiento28.
Contrario a lo que sucede en el trasplante de otros órganos, en THO no se recomienda el uso de esquemas antivirales cortos de menos de 12 semanas, debido al gran reservorio del VHC en el órgano trasplantado. Lo más importante es erradicar el virus. Existen publicaciones de reportes de casos de complicaciones extrahepáticas como lesión renal aguda en el primer mes debido a una glomerulonefritis focal proliferativa asociada al VHC58. Esto ejemplifica el riesgo de desarrollar algunas manifestaciones en el periodo postrasplante propias del VHC. Otras complicaciones menos frecuentes, como alteraciones inmunológicas, principalmente rechazo, aunque se requieren de más estudios para evaluar el riesgo real, recalcando la importancia de una vigilancia estrecha durante el seguimiento de estos pacientes.
Trasplante de otros órganosEn el caso de trasplante no hepático, se recomienda iniciar los diferentes tratamientos con AAD de dos maneras. La primera es de forma profiláctica, previo a conocer los resultados del RNA viral, generalmente antes del trasplante o en el día 0 postrasplante. Alternativamente, se puede ofrecer el tratamiento de manera preventiva, en donde este se inicia desde el día 0 hasta la primera semana posterior al trasplante. Los 2 esquemas pangenotípicos utilizados actualmente son la combinación de glecaprevir (300mg) y pibrentasvir (120mg) durante 8 semanas, o sofosbuvir (400mg) y velpatasvir (100mg) durante 12 semanas (tabla 3)57.
En el estudio THINKER, se incluyeron 10 receptores de riñón negativos para el VHC que recibieron un órgano de donantes con viremia positiva y genotipo 1. Todos fueron tratados durante 12 semanas con elbasvir y grazoprevir, consiguiéndose una RVS del 100% y sin efectos adversos graves59.
En el ensayo MYTHIC, un estudio prospectivo y multicéntrico en donde se incluyeron 30 receptores negativos para el VHC que recibieron un trasplante renal de donadores virémicos, mediante el inicio temprano (dentro de los 3 días postrasplante) del tratamiento con glecaprevir y pibrentasvir por un tiempo de 8 semanas, se alcanzó una RVS en el 100% de los casos. Además, no hubo eventos adversos significativos relacionados con el tratamiento50. Al año, la supervivencia fue del 93% (sin decesos relacionados con el tratamiento o el virus) y la función del órgano fue excelente (creatinina media de 1.17; IQR: 1.02-1.38mg/dl)60.
En el trasplante cardiaco, un estudio con 22 receptores que recibieron un órgano de donantes con viremia positiva para el VHC evaluó el esquema de AAD con glecaprevir y pibrentasvir durante 8 semanas de tratamiento, iniciado entre los días 6 y 11 después del trasplante, una vez desarrollada la viremia. Dos pacientes tuvieron una interrupción transitoria del tratamiento de 3 días debido a hiperbilirrubinemia. Al comparar los receptores de órganos virémicos de VHC con los no virémicos, no se encontraron diferencias en la supervivencia global ni en el desarrollo de complicaciones como el rechazo61.
En trasplantes de órganos torácicos, un estudio que incluyó a 38 receptores, 22 para trasplante de corazón y 16 para un trasplante pulmonar, se inició tratamiento con glecaprevir y pibrentasvir al detectarse una viremia positiva posterior al trasplante, en promedio de 7 días para los receptores de corazón y 3 días para los de pulmón. El 100% de los pacientes lograron la RVS, a pesar de que se interrumpió el tratamiento en dos casos debido al desarrollo de hiperbilirrubinemia. Uno de los pacientes reinició el tratamiento pocos días después de la suspensión, mientras que el otro solo recibió un esquema de tratamiento de 10 días51.
El objetivo de iniciar el tratamiento con AAD en receptores de órganos no hepáticos negativos para el VHC que reciben un trasplante de donantes virémicos es comenzar lo más pronto posible para minimizar la duración de la viremia en el receptor y así evitar el desarrollo de hepatitis aguda y otras complicaciones no hepáticas.
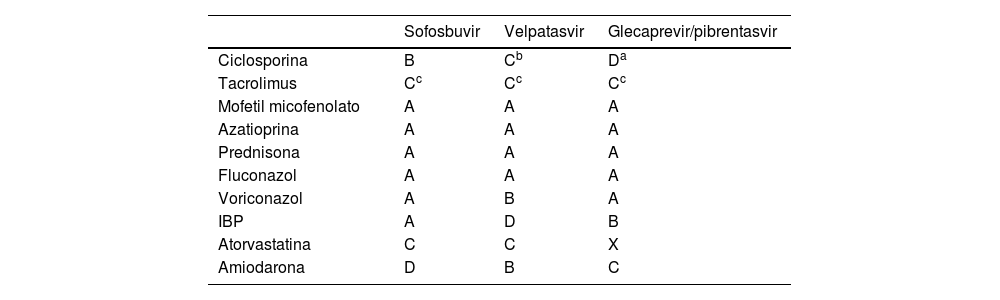
Interacciones de los esquemas de antivirales de acción directa en el trasplanteEn la población postrasplantada, es importante tener en cuenta las posibles interacciones entre fármacos al elegir el esquema de tratamiento. La mayoría de los AAD son metabolizados por el citocromo P450 3A (CYP3A), lo que puede dar lugar a interacciones con los inmunosupresores.
En el caso del esquema de glecaprevir y pibrentasvir, se debe tener precaución debido a las posibles interacciones con los inhibidores de calcineurina, especialmente la ciclosporina. A dosis altas de 400mg o más, la ciclosporina puede aumentar hasta 5 veces la concentración sérica de glecaprevir. Por lo tanto, no se recomienda esta combinación en pacientes que requieren dosis estables de ciclosporina mayores a 100mg al día. En cuanto a las concentraciones séricas de tacrolimus, esta también puede aumentar por un factor de 1.45, pero no se recomienda ajustar la dosis. En caso de darse de manera concomitante, se recomienda realizar una monitorización frecuente y ajustar la dosis según sea necesario (tabla 4)57,62.
Interacciones de los esquemas de AAD en la población trasplantada
| Sofosbuvir | Velpatasvir | Glecaprevir/pibrentasvir | |
|---|---|---|---|
| Ciclosporina | B | Cb | Da |
| Tacrolimus | Cc | Cc | Cc |
| Mofetil micofenolato | A | A | A |
| Azatioprina | A | A | A |
| Prednisona | A | A | A |
| Fluconazol | A | A | A |
| Voriconazol | A | B | A |
| IBP | A | D | B |
| Atorvastatina | C | C | X |
| Amiodarona | D | B | C |
Caracterización de interacciones: A, no se conoce; B, menor: puede tener mínimos efectos clínicos y no requerir modificación; C, moderada: puede exacerbar la condición clínica o requerir modificaciones en el tratamiento; D, mayor: puede causar daño o requerir manejo; X, contraindicada.
AAD: antivirales de acción directa; IBP: inhibidor de bomba de protones.
Las interacciones no se limitan solo a los inmunosupresores, sino que también se deben verificar con otros fármacos utilizados en la población trasplantada, y se deben realizar ajustes o cambios según corresponda.
A continuación, se agrega un enlace donde se pueden consultar todas las interacciones de los AAD con otros fármacos: (https://hep-druginteractions.org/checker).
Evaluación global en México para utilizar órganos de donantes de virus de la hepatitis C positivosActualmente, en México no existen centros que realicen o hayan realizado trasplantes de donadores del VHC positivos. Con la experiencia acumulada hasta el momento, los trasplantes de donadores con hepatitis C positivos en receptores negativos seguidos de la terapia AAD proveen una excelente supervivencia global y del injerto, teniendo en cuenta que la evidencia es limitada en algunas áreas5. En casos muy bien seleccionados, parece ser una estrategia eficaz y bien tolerada. Sin embargo, la seguridad de la terapia AAD postrasplante es esencial y los pacientes deben conocer los potenciales riesgos, incluyendo la falla al tratamiento, recalcándose que este riesgo es menor que la mortalidad en lista de espera.
Al 06 de enero del 2023, el CENATRA reportó en su registro que existen 160,406 pacientes en lista de espera para trasplante renal, 241 para trasplante hepático y 40 para trasplante cardíaco63. Consideramos que el uso de órganos de donantes del VHC con Ab+/RNA+ en México podría ser una opción factible en uno de los países de América Latina con una menor tasa de donación y trasplantes en general3, teniendo en cuenta que aún faltan más estudios por realizar.
Retos en el futuroConocemos que existen muchos obstáculos en la utilización de órganos de donantes VHC positivos, que se extienden desde el concepto ético hasta diferentes puntos controversiales. Por otro lado, a considerar es el acceso a los AAD que, a pesar de ser universal en México, aún no está claro cuál es el mejor momento para iniciar el tratamiento posterior al trasplante, aunque, una ventaja son los pocos efectos secundarios e interacciones con la inmunosupresión. Actualmente, con la evidencia que tenemos hasta el momento, concluimos que las ventajas sobrepasan a los riesgos. Por lo tanto, no debe limitarse la utilización de estos órganos en un país como México, donde la donación y el número de trasplantes realizado por año están por debajo de las necesidades.
ConclusionesLa utilización de órganos de donantes con VHC positivos es una gran oportunidad para incrementar el número de trasplantes de órganos sólidos. Con la experiencia acumulada hasta la actualidad, la alta tasa de curación con los AAD y la excelente supervivencia global y del injerto a 6 y 12 meses, utilizar estos órganos es una opción real en países como México donde la tasa de mortalidad por cirrosis excede la tasa de donación de órganos en general.
FinanciaciónEl presente estudio no recibió patrocinio.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.