La incontinencia fecal es el paso involuntario o la incapacidad de controlar la descarga de materia fecal a través del ano, siendo una condición que deteriora significativamente la calidad de vida de los sujetos que la padecen, ya que afecta la imagen corporal, la autoestima e interfiere con las actividades cotidianas favoreciendo el aislamiento social. En nuestro país no existe una guía o consenso al respecto, por lo que la Asociación Mexicana de Gastroenterología reunió a un grupo multidisciplinario (gastroenterólogos, neurogastroenterológos y cirujanos), para que realizaran el Consenso mexicano sobre incontinencia fecal y se establecieran recomendaciones de utilidad para la comunidad médica.
Las recomendaciones emitidas fueron a través de 35 enunciados que se presentan en este documento. Se reconoce que la incontinencia fecal es una entidad frecuente, y cuya incidencia se incrementa conforme aumenta la edad, sin embargo, es poco reconocida. La fisiopatología de la incontinencia es compleja y multifactorial y en la mayoría de los casos existe más de un factor de riesgo asociado. Respecto al diagnóstico, se considera que, si bien no existe un estándar de oro, la combinación de pruebas que evalúen la estructura (p. ej., ultrasonido endoanal) y la función (manometría anorrectal) se debe de recomendar en todos los casos. El tratamiento debe ser también multidisciplinario, y se recomiendan medidas generales, fármacos (lidamidina, loperamida), y en casos seleccionados intervenciones no farmacológicas como la terapia de biorretroalimentación. De igual manera, el tratamiento quirúrgico debe ofrecerse a los pacientes seleccionados y debe ser brindado por los expertos.
Fecal incontinence is the involuntary passage or the incapacity to control the release of fecal matter through the anus. It is a condition that significantly impairs quality of life in those that suffer from it, given that it affects body image, self-esteem, and interferes with everyday activities, in turn, favoring social isolation. There are no guidelines or consensus in Mexico on the topic, and so the Asociación Mexicana de Gastroenterología brought together a multidisciplinary group (gastroenterologists, neurogastroenterologists, and surgeons) to carry out the «Mexican consensus on fecal incontinence» and establish useful recommendations for the medical community.
The present document presents the formulated recommendations in 35 statements. Fecal incontinence is known to be a frequent entity whose incidence increases as individuals age, but one that is under-recognized. The pathophysiology of incontinence is complex and multifactorial, and in most cases, there is more than one associated risk factor. Even though there is no diagnostic gold standard, the combination of tests that evaluate structure (endoanal ultrasound) and function (anorectal manometry) should be recommended in all cases. Treatment should also be multidisciplinary and general measures and drugs (lidamidine, loperamide) are recommended, as well as non-pharmacologic interventions, such as biofeedback therapy, in selected cases. Likewise, surgical treatment should be offered to selected patients and performed by experts.
La incontinencia fecal (IF), es el paso involuntario o la incapacidad de controlar la descarga de materia fecal a través del ano, es una condición que deteriora significativamente la calidad de vida de los sujetos que la padecen, ya que afecta la imagen corporal, la autoestima e interfiere con las actividades cotidianas favoreciendo el aislamiento social. En nuestro país no existe una guía o consenso al respecto, por lo que la Asociación Mexicana de Gastroenterología reunió a un grupo multidisciplinario (gastroenterólogos, neurogastroenterológos y cirujanos colorrectales), para que realizaran el Consenso mexicano sobre incontinencia fecal y se establecieran recomendaciones de utilidad para la comunidad médica.
De manera específica, el objetivo de este consenso fue preparar un documento actualizado sobre la epidemiología, el diagnóstico y el tratamiento de la IF con aplicación práctica en México. Las recomendaciones incluidas están basadas en una extensa revisión de la literatura y en la opinión consensuada de los especialistas participantes.
MétodosSe utilizó el proceso Delphi para el desarrollo del consenso tal y como se ha descrito previamente1. Se designaron 2 coordinadores generales y 2 coordinadores asociados (JMRT, ECA, KRGZ y OGM) y se invitaron 13 expertos. Los coordinadores realizaron una búsqueda exhaustiva en las siguientes bases de datos: CENTRAL (The Cochrane Central Register of Controlled Trials), MEDLINE (PubMed), EMBASE (Ovid), LILACS, CINAHL, BioMed Central y World Health Organization International Clinical Trials Registry Platform (ICTRP). La búsqueda comprendió el período del 1 de enero de 2010 al 31 de diciembre de 2021. Los criterios de búsqueda incluyeron los siguientes términos: «incontinencia fecal» combinado con los siguientes términos: «epidemiology», «incidence», «prevalence», «Mexico», «pathophysiology», «diarrhea», «surgery», «diagnosis», «differential diagnosis», «treatment», «antibiotics», «therapy», «treatment», «neurostimulation», «biofeedback», «management», «review», «guidelines» y «meta-analysis», y sus equivalentes en español. Toda la bibliografía se puso a disposición de los miembros del consenso.
Posteriormente, los coordinadores elaboraron 33 enunciados, los cuales se sometieron a una primera votación anónima vía electrónica (1 de junio al 15 de julio de 2022) cuya finalidad fue evaluar la redacción y el contenido de los enunciados. Los participantes del consenso emitieron su voto considerando las siguientes respuestas: a) totalmente de acuerdo, b) parcialmente de acuerdo, c) incierto, d) parcialmente en desacuerdo y e) totalmente en desacuerdo.
Terminada la primera votación, los coordinadores realizaron las modificaciones correspondientes. Los enunciados que alcanzaron un acuerdo total >75% se mantuvieron y los que tuvieron un desacuerdo total >75% se eliminaron. Los enunciados que tuvieron ≤75% de acuerdo total y ≤75% desacuerdo total se revisaron y reestructuraron. Los enunciados revisados se sometieron a una segunda votación anónima por vía electrónica (1 de agosto al 15 de agosto de 2022). De acuerdo a los comentarios de la segunda votación los enunciados revisados se sometieron para una tercera votación (22 de septiembre de 2002 de forma híbrida) donde, además de la redacción, a cada uno de los enunciados se les estableció un grado de recomendación y se evalúo la calidad de la evidencia para sustentar dicha recomendación empleando el sistema «Grading of Recommendations Assessment, Development and Evaluation» (GRADE)2. En el sistema GRADE, la calidad de la evidencia no se califica únicamente con base en el diseño o la metodología de la investigación, sino que se juzga en función de una pregunta claramente planteada con relación a una variable de desenlace también claramente formulada3. Sobre estas bases, la evidencia puede ser alta, moderada, baja o muy baja. El sistema GRADE también establece la fuerza de las recomendaciones en fuerte o débil, a favor o en contra de la intervención o del enunciado. Es importante mencionar que la fuerza de la recomendación solo se establece en el caso de pruebas diagnósticas e intervenciones terapéuticas. Como se muestra en la tabla 1, el sistema GRADE se expresa empleando un código que usa letras mayúsculas para hablar de la calidad de la evidencia, seguidas de un índice numérico para indicar la fuerza de la recomendación a favor o en contra de la intervención o enunciado.
Código del sistema GRADE
| Calidad de la evidencia | Código |
|---|---|
| Alta | A |
| Moderada | B |
| Baja | C |
| Muy baja | D |
| Fuerza de la recomendación | |
| Fuerte a favor de la intervención | 1 |
| Débil a favor de la intervención | 2 |
| Débil en contra de la intervención | 2 |
| Fuerte en contra de la intervención | 1 |
Fuente: adaptado de Oñate-Ocaña y Ochoa-Carrillo3.
En esta reunión, los enunciados que obtuvieron un acuerdo >75% fueron ratificados. Aquellos enunciados que no alcanzaron un 75% de acuerdo en las votaciones previas se discutieron con la finalidad de tratar de llegar a un consenso o en caso contrario eliminarlos; y se volvieron a votar. Una vez establecidos todos los enunciados del consenso, los coordinadores elaboraron el presente manuscrito, el cual fue revisado y aprobado por todos los miembros del consenso.
ResultadosDe forma inicial, los coordinadores propusieron 33 enunciados. En la primera votación 12 enunciados (36%) fueron revisados por no alcanzar consenso, pero ninguno fue eliminado.
La segunda votación se realizó sobre 33 enunciados y de acuerdo con los resultados de la segunda votación solo 2 enunciados (6%) no alcanzaron consenso, y se propuso agregar un enunciado sobre la fisiopatología de la IF. Para la tercera votación se presentaron 34 enunciados. Al final de esta última votación, se decidió dividir un enunciado en 2, de tal manera que al final quedaron un total de 35 enunciados consensuados.
A continuación, se presentan los enunciados finales y los resultados de la votación.
Aspectos generales, epidemiología y factores de riesgoLa IF se define como el paso involuntario de material fecal sólida o líquida, y aunque la presencia de episodios frecuentes (al menos dos en los últimos 3 meses), afectan considerablemente la calidad de vida, para algunos autores un solo episodio en ausencia de diarrea es suficiente para ser considerado como relevante4,5. De acuerdo con sus características clínicas, la IF puede clasificarse en 3 tipos: 1) incontinencia pasiva (incapacidad de retener materia fecal sólida); 2) incontinencia de urgencia (incapacidad para contener la evacuación), y 3) escape o fuga fecal (caracterizado por manchado debido a la salida de pequeñas cantidades de heces después de una evacuación normal). Frecuentemente, estos 3 subtipos pueden traslaparse. Es importante distinguir clínicamente los 3 tipos, ya que nos orientará a guiar el tratamiento6. Cada uno de estos subtipos cuenta con características específicas; en la incontinencia pasiva existe una pérdida de la sensibilidad rectal con o sin daño en los esfínteres; en la incontinencia de esfuerzo puede deberse a una incapacidad del recto para retener las heces o lesiones en el esfínter anal externo (EAE); y la fuga fecal, se encuentra asociada con alteraciones de la sensibilidad rectal4.
La prevalencia global de la IF varía entre 7-15% (rango: 2-35%) en promedio en países occidentales7. En EE. UU., la prevalencia en adultos no institucionalizados de acuerdo a la encuesta de salud «National Health and Nutrition Examination Survey» (NHANES) es del 8.3%, y varía si el criterio es incontinencia a líquidos (prevalencia: 6.2%), sólidos (1.6%) y/o escape (3.1%)8. Una encuesta electrónica realizada en EE. UU., Canadá y el Reino Unido en 5,931 sujetos, encontró una prevalencia global del 16.1%7. Al aplicar los criterios de Roma IV, esta fue del 3.3%, pero la misma aumentó al utilizar criterios de temporalidad menos estrictos: el 70.2% cuando se presentan menos de 2 episodios al mes y el 29.8% con menos de 6 meses de evolución9.
Estudios epidemiológicos estiman que la IF afecta al 2% de la población menor de 65 años, al 10% de la población mayor de 65 años y hasta 50% de todos los pacientes que residen en asilos10. En México, de acuerdo al estudio SIGAME, se encontró una prevalencia del 4.7% en la población general con una edad media de 49.5+13 años, predominando el sexo femenino en el 67%11. En el estudio epidemiológico global realizado por la fundación de Roma en más de 73,000 sujetos en los 5 contenientes reportó una prevalencia del 1.6% y que en mayores de 65 años esta puede ser de hasta el 2.3%12.
Los factores de riesgo asociados a la IF son múltiples4,13, y los enunciados al respecto se mencionan a continuación y se resumen en la tabla 2.
Factores de riesgo para la incontinencia fecal
| Factor de riesgo | Calidad de la evidencia | Razón de momios |
|---|---|---|
| Edad avanzada | Alta | RM aumenta 1.3 por cada década |
| Trauma obstétrico | Alta | |
| Parto vaginal | RM de 1.27 | |
| Número de embarazos | RM de 1.29, 1.66, 1.75, 1.75 y 1.84 para 1, 2, 3, 4 y 5 embarazos | |
| Uso de fórceps | RM de 9 | |
| Episiotomía | RM de 2.18 | |
| Desgarro perineal grado 3-4 | RM de 2 | |
| Multiparidad | RM de 1.66 | |
| Productos macrosómicos | RM de 1.24 | |
| Patología y cirugía anorrectal | Alta | RM de 2.3 |
| Cirugía de rectocele | RM de 4.9 | |
| Hemorroidectomía | RM de 2.4-3.0 | |
| Esfinterotomía | — | |
| Fisura anal | RM de 1.2 | |
| Absceso anal | RM de 1.1 | |
| Fístula anal | RM de 2.5 | |
| Sexo femenino | Moderada | RM de 1.7-2.0 |
| Coexistencia de incontinencia urinaria | Moderada | RM de 2.06-3.5 |
| Síndrome de intestino irritable | Moderada | RM de 1.95-4.8 |
| Obesidad | Baja | RM de 1.1 mayor por cada unidad de IMC por arriba del peso ideal |
| Traumatismo lumbosacro | Baja | |
| Si condiciona incapacidad para moverse | RM de 2.54 | |
| Si condiciona incapacidad para vestirse | RM de 4.03 | |
| Si condiciona incapacidad para ir al baño | RM de 7.37 | |
| Diabetes de larga evolución | Baja | RM entre 1.3-3.5 |
| Colecistectomía | Baja | RM de 4.2 |
| Comorbilidades gastrointestinales | Muy baja | |
| Colitis ulcerativa | RM de 2.63 | |
| Enfermedad de Crohn | RM de 2.44 | |
| Enfermedad celíaca | RM de 2.84 | |
| Sexo anal | Controversial | |
| Mujeres | RM de 1.5 | |
| Varones | RM de 2.8 | |
| Depresión | Controversial | RM de 2.28 |
| Enfermedades neurológicas | Muy baja | RM de 1.84 |
| Uso de terapia de reemplazo hormonal | Controversial | RM de 1.26-1.32 |
IMC: índice de masa corporal; RM: razón de momios.
Fuerza de la recomendación: —
Calidad de la evidencia: B
Acuerdo alcanzado: el 76.5% totalmente de acuerdo, el 5.9% parcialmente de acuerdo, el 11.8% incierto y el 5.9% parcialmente en desacuerdo.
El sexo femenino es un predictor independiente de IF, debido principalmente a factores únicos como número de embarazos, partos o maniobras ginecológicas durante el trabajo de parto. Sin embargo, la prevalencia en varones se encuentra subestimada debido a menor búsqueda de apoyo médico, e incluso algunos estudios epidemiológicos a larga escala, incluyendo el NHANES han reportado tasas similares: 8.9 en mujeres vs. 7.7% en varones8,9,14. Varios factores de riesgo independientes de IF se han descrito en mujeres, incluyendo edad avanzada, diarrea crónica, evacuaciones líquidas, comorbilidades múltiples e incontinencia urinaria9.
Conforme aumenta la edad, el riesgo para padecer incontinencia fecal es mayorFuerza de la recomendación: —
Calidad de la evidencia: A
Acuerdo alcanzado: el 94.1% totalmente de acuerdo y el 5.9% parcialmente de acuerdo.
La edad avanzada es el factor de riesgo mejor establecido de la IF. Se ha reportado una progresión lineal asociada a la edad tanto en varones como en mujeres, de manera que conforme avanza la edad existe un riesgo mayor de IF15. Esta asociación persiste tras ajustar otros factores como estado de salud, enfermedades crónico-degenerativas y nivel de actividad. Un estudio poblacional encontró que la razón de momios (RM) aumenta 1.3 veces por cada década de vida16, y la encuesta NHANES observó que la prevalencia aumentaba del 2.6% por debajo de 29 años, al 15.3% por arriba de los 709. El proyecto epidemiológico de Rochester fue un estudio de casos y controles que comparó 176 mujeres con IF con un grupo control similar, y encontró que el 88% de los casos de IF empezaban por arriba de los 40 años de edad17. Un estudio realizado en 64,559 mujeres con un rango de edad entre 62-87 años, reportó una prevalencia de IF a líquidos y/o sólidos del 9% en el grupo entre los 62-64 años, y que aumentaba al 17% en el grupo entre 85 y 87 años de edad. En este grupo el factor que mejor correlacionó fue incontinencia urinaria (IU), cuya prevalencia fue del 63% en el grupo con IF18. La prevalencia de IF en población mayor muestra variaciones de acuerdo con el lugar de residencia, y varía del 15-20% en adultos mayores ambulatorios, del 18-33% en adultos hospitalizados, y hasta del 50-70% de residentes en asilos19,20. Este último grupo tiene diversos factores de riesgo que pueden agravar la condición, incluyendo menor actividad física, pérdida de la movilidad y capacidad de autocuidado, menor acceso a baño, además de estreñimiento funcional, cambios en la alimentación y menor ingestión de líquidos y fibra11,12. Existe menor evidencia respecto a incidencia de IF, pero al menos 2 estudios han descrito que en adultos mayores de 65 años, en el primero la tasa de incidencia a 4 años fue del 17%, con el 6% de desarrollo mensual, y en el segundo la tasa fue del 7% a 10 años de la evaluación inicial21,22. Los factores de riesgo asociados fueron IU, desarrollo de urgencia, diarrea, sensación de evacuación incompleta, e historia de radiación a pelvis. Otros factores asociados a edad avanzada e IF son: menopausia, terapia hormonal postmenopausia, cambios en el piso pélvico relacionados con la edad y neuropatía de pudendos20,23.
La obesidad/sobrepeso puede ser un factor de riesgo para incontinencia fecalFuerza de la recomendación: —
Calidad de la evidencia: CAcuerdo alcanzado: el 82.4% totalmente de acuerdo y el 17.6% parcialmente de acuerdo.
Se ha descrito una prevalencia de IF del 67% en mujeres con obesidad mórbida, y de entre el 16-63% en mujeres referidas para cirugía bariátrica24. En el estudio de Rochester, el análisis multivariado encontró una RM de 1.1 mayor (1.004-1.1) por cada unidad de índice de masa corporal (IMC) por arriba del peso ideal17. En otro trabajo en mujeres mayores de edad, el IMC aumentó en forma modesta el riesgo de IF, con una RM de 1.4 cuando el IMC era mayor a 35, comparado con un IMC entre 21 y 2324; en este estudio, una menor actividad física correlacionó con obesidad, aumentando el riesgo a 1.58 veces. Se ha descrito también que adultos sometidos a cirugía bariátrica, especialmente a derivación (bypass) gastro-yeyunal, esta incrementa el riesgo de IF tanto a líquidos (48% mujeres, 42% varones), como a sólidos (21% mujeres, 30% varones), y que un programa estructurado de reducción de peso disminuye la frecuencia de episodios de IF del 47.4 al 28.1%25. Sin embargo, no todos los estudios confirman esta asociación26,27. Un trabajo que comparó 201 pacientes con IF: 67 pacientes obesos con 134 controles no obesos, no encontró diferencias significativas entre ambos grupos en términos de severidad sintomática ni calidad de vida, e incluso sugiere que el grupo con obesidad tiene mejor función anorrectal y que los síntomas están más relacionados con la consistencia de las heces26. Otro trabajo prospectivo en 51,708 mujeres, no encontró mayor riesgo de IF en obesidad, aunque aquellas con actividad física moderada tuvieron un riesgo 25% menor de IF27.
El trauma obstétrico (desgarro perineal, fórceps, episiotomía) es un factor de riesgo determinante para la incontinencia fecalFuerza de la recomendación: —
Calidad de la evidencia: A
Acuerdo alcanzado: el 94.1% totalmente de acuerdo y el 5.9% parcialmente de acuerdo.
Uno de los factores anatómicos más importantes que condicionan IF es la lesión obstétrica del esfínter anal. Se ha descrito una prevalencia mayor de IF en mujeres con historia de partos vaginales, particularmente aquellos en los que se utilizó algún instrumento o maniobra para facilitar la expulsión vaginal, al compararse con mujeres sin historia de parto9,15,18,20. Un estudio encontró una prevalencia del 15.1% en mujeres con >4 partos vs. 5.9% en aquellas sin partos previos. En este estudio el número de partos no se asoció significativamente a IF tras ajustar a edad (p=0.09) o a otros factores de riesgo (p=0.57). El número de embarazos también aumenta el riesgo para IF, con RM de 1.29, 1.66, 1.75, 1.75 y 1.84 para 1, 2, 3, 4 y 5 embarazos, respectivamente24. Las maniobras de extracción del producto también pueden aumentar el riesgo de IF, particularmente el uso de fórceps, el cual según el estudio va desde 1.3 hasta 9 veces mayor riesgo (RM: 9.0; IC 95%: 5.6-14.4)6,15,28. La segunda maniobra durante el embarazo que incrementa el riesgo de IF es la episiotomía. Hasta el 56.2% de mujeres con IF reportan historia de episiotomía, la cual se asocia a 2.18 veces más riesgo y hasta el 15% reportaron laceración obstétrica severa previo al inicio de síntomas, con duración sintomática mayor a un año después del procedimiento en el 86% de los casos28. Aunque se ha reportado que la edad promedio de inicio de IF con historia de trauma obstétrico es 55 años, la mayoría de las pacientes experimenta IF temporal posparto: el 18% de las mujeres que habían sufrido daño de tercer grado (que involucra al EAE), y el 29% de cuarto grado (que involucra al EAE y al esfínter anal interno [EAI]) desarrollaron IF en promedio 24 años después de su primer parto, con una RM de al menos 24,14. Se considera que el daño inicial obstétrico es el primero de una serie de factores acumulados asociados a daño estructural perianal, que involucra daño al nervio pudendo, descenso perineal excesivo, y debilidad del esfínter anal que finalmente pueden desembocar en IF4,14,15,18,20,28,29.
La cirugía anorrectal (esfinterotomía, fístula, hemorroidectomía) aumenta el riesgo de incontinencia fecal por daño estructural al piso pélvicoFuerza de la recomendación: —
Calidad de la evidencia: A
Acuerdo alcanzado: el 82.4% totalmente de acuerdo y el 17.6% parcialmente de acuerdo.
De manera similar a lo que ocurre con el trauma obstétrico en mujeres, los procedimientos quirúrgicos que involucran lesiones cercanas al esfínter anal incrementan el riesgo de IF tanto en varones como en mujeres. Se ha descrito un riesgo mayor en pacientes sometidos a diversos procedimientos quirúrgicos anorrectales, que van desde hemorroidectomía, esfinterotomía anal, dilatación anal, o cirugías que involucran anastomosis íleo-anales, con tasas de prevalencia de hasta el 40% en este último grupo6,30,31. En el estudio de Rochester, el análisis multivariado encontró un riesgo mayor de IF en pacientes sometidos a corrección de rectocele, con una RM de 4.9 (1.3-19)16. En un estudio que comparó variables asociadas a IF en varones y mujeres, las cirugías asociadas a riesgo aumentado de IF fueron: cirugía transanal (37%); terapia para cáncer de próstata (14.7%) y cirugía lumbosacra por daño espinal (14.7%) y, al comparar defectos esfinterianos se observó una menor prevalencia en varones (35 vs. 70%, p=0.004)22. En un estudio realizado en México, por Charúa et al.31 se demostró que el 6.5% de los pacientes que se someten a esfinterotomía lateral parcial desarrollan un grado mínimo de IF a los 3 meses del postoperatorio.
La incontinencia urinaria puede coexistir en pacientes con incontinencia fecalFuerza de la recomendación: —
Calidad de la evidencia: B
Acuerdo alcanzado: el 88.2% totalmente de acuerdo y el 11.8% parcialmente de acuerdo.
La IF se asocia con frecuencia y en forma significativa con incontinencia urinaria (IU) tanto en mujeres como en varones. Hasta el 41% de las mujeres con IF reportan asociación con IU, con una RM que va de 2.06 a 3.526. Se ha reportado que más del 30% de las mujeres embarazadas reportan IU durante el segundo y tercer trimestres del embarazo, o durante los primeros 3 meses posteriores al parto y el 25% de ellas, presentan IF durante el tercer trimestre, y hasta el 25% continúan con síntomas durante los meses siguientes o incluso hasta un año después del parto32. Algunos estudios epidemiológicos han reportado una asociación entre IF e IU: el 1.9% (1.5-2.4%) de los pacientes con IU reportan IF: el 1.1% en varones y el 2.7% en mujeres9. En forma inversa, la IU correlaciona en forma fuerte con IF: el 63% de mujeres con IF tienen IU al menos una vez al mes comparado con el 45% de controles sin IU18.
El trauma lumbar y/o sacro se asocian con la incontinencia fecalFuerza de la recomendación: —
Calidad de la evidencia: C
Acuerdo alcanzado: el 94.1% totalmente de acuerdo y el 5.9% parcialmente de acuerdo.
Se ha descrito una asociación entre IF e historia de traumatismo en región lumbo-sacra. Entre los mecanismos descritos se incluyen algunos con asociación directa como neuropatía periférica, radiculopatía lumbosacra o a nivel de cauda equina, compresión medular, y pérdida del reflejo ano-cutáneo, o bien en forma indirecta, particularmente asociada a pobre movilidad15,29,30. Un estudio en varones con IF reportó que el 37.8% tenían historia de traumatismo o cirugía lumbosacra, o bien alguna malformación a nivel espinal, aunque el trabajo no investigó o especificó relación causa/efecto. La incapacidad para movilizarse se ha asociado a 2.54 veces más riesgo de IF, la incapacidad para vestirse 4.03 veces, y la incapacidad para usar el baño por cuenta propia hasta 7.37 veces33.
La diabetes mellitus de larga evolución (en especial en los pacientes con inadecuado control glucémico) es un factor de riesgo para la incontinencia fecalFuerza de la recomendación: —
Calidad de la evidencia: C
Acuerdo alcanzado: el 94.1% totalmente de acuerdo y el 5.9% parcialmente de acuerdo.
La diabetes mellitus (DM) es una condición que en forma crónica puede asociarse a complicaciones como neuropatía visceral e hiposensibilidad rectal, que pueden incrementar el riesgo de IF. Se ha descrito un mayor riesgo de IF en diabéticos de larga evolución, tanto en varones como en mujeres. La encuesta NHANES reportó una prevalencia de IF mayor en pacientes diabéticos que en población general (18.1 vs. 8.4%)9. Los factores de riesgo asociados a IF en DM en 7 estudios fueron: edad avanzada (RM: 1.3), depresión (RM: 2.0), IU (RM: 3.5) y pobre estado general (RM: 1.9)34. Otro estudio en mujeres mayores con IF también encontró un riesgo mayor en DM, así como en DM asociada a hipertensión arterial y tabaquismo, con un RM entre 1.2 y 1.728. Se han descrito varios mecanismos fisiopatológicos asociados a desarrollo de IF en DM, particularmente neuropatía visceral, la cual al asociarse a hiposensibilidad rectal, aumenta en 3.3 veces el riesgo de IF en sujetos con DM18,35. Adicionalmente se reconoce que la afectación neurológica de los pacientes con DM no está limitada a solo en sistema nervioso periférico y sus vías aferentes, sino que también existen alteraciones en vías eferentes además en el procesamiento del sistema nervioso central lo que explica en conjunto la hiperexcitabilidad (conducción aferente), cambios en la percepción sensorial (hiper e hiposensibilidad), cambios en la motilidad (conducción eferente) tanto con incremento (diarrea) como decremento (estreñimiento) además de cambios en el control neuromuscular en especial de la región anorrectal y alteraciones del procesamiento (encefalopatía diabética) en pacientes con DM de larga evolución4.
La diarrea poscolecistectomía puede considerarse un factor de riesgo asociado para la incontinencia fecalFuerza de la recomendación: —
Calidad de la evidencia: C
Acuerdo alcanzado: el 76.5% totalmente de acuerdo y el 23.5% parcialmente de acuerdo.
Entre un 10-20% de los pacientes sometidos a colecistectomía desarrollan diarrea asociada a ácidos biliares (DAB)36. Se ha descrito en general que los pacientes con diarrea crónica tienen una prevalencia 3 veces mayor de IF que sujetos sin diarrea, y esto incluye a condiciones como enfermedad inflamatoria intestinal, enfermedad celíaca, síndrome de intestino irritable (SII) y DAB17,37. En la mayoría de los estudios que evalúan DAB asociada a otras condiciones, la evidencia es indirecta debido a la baja disponibilidad de pruebas diagnósticas, y a la rápida respuesta a secuestradores de ácidos biliares36. Uno de los pocos estudios que evalúa asociación directa entre colecistectomía e IF es el estudio epidemiológico de Rochester, en el cual el análisis multivariado encontró que la colecistectomía previa se asociaba a IF, con una RM de 4.2 (1.2-15)17. Un problema con la DAB es la implementación de pruebas para su diagnóstico. Se cuenta con diferentes pruebas como el SeHCAT, que incluye radiación, la medición en suero de C4, que es un producto de la síntesis de ácidos biliares, elevada en condiciones de diarrea por exceso de sales biliares (DESB) y la medición de factor de crecimiento de fibroblastos 19 (FCF-19) que tiene un papel de inhibir la producción de sales biliares, por lo tanto, se encuentra disminuido en pacientes con DESB y tiene una correlación inversa con C438. Desafortunadamente, en México su disponibilidad es limitada.
La incontinencia fecal puede coexistir en pacientes con síndrome de intestino irritable, en especial en los que tienen el subtipo diarrea (SII-D)Fuerza de la recomendación: —
Calidad de la evidencia; C
Acuerdo alcanzado: el 76.5% totalmente de acuerdo y el 23.5% parcialmente de acuerdo.
Entre el 60-62% de los pacientes SII, presentan al menos un episodio de IF a lo largo de su vida39. Una encuesta poblacional en Australia con 396 pacientes, reportó que el 33% tuvieron algún trastorno funcional digestivo asociado a IF, y en SII, la prevalencia fue del 11-12% de los cuales reportaron IF37. En el previamente citado análisis multivariado del proyecto epidemiológico de Rochester, el SII se asoció a un riesgo mayor de IF (RM: 4.8; IC 95%: 1.6-14), y diarrea crónica 53 veces más (6.1-471)17. Otro estudio realizado en conjunto entre EE. UU. y Suecia con 168 pacientes con SII por criterios de Roma III, reportó una prevalencia de IF (>1 vez al mes) en SII en el13.7% (Suecia) y el 19.7% (EE. UU.)40. La proporción aumentó hasta el 29.8 y el 43.4% al quitar el criterio de frecuencia mensual. Otro trabajo con 500 pacientes con SII (Roma III) evaluó la prevalencia de IF en los diferentes subtipos de SII, y observaron una prevalencia mayor en los subtipos mixto (SII-M) y predominio de diarrea (SII-D), aunque uno de cada 3 pacientes con predominio de estreñimiento (SII-E) también presentó IF: 65.2% (SII-D), 63.7% (SII-M) y 37.9 (SII-E)41. Un estudio observacional con 1,454 pacientes (71% mujeres, Roma III), reportó una prevalencia de escape fecal del 8.5%, y en el análisis de regresión logística tanto el SII (RM: 1.95) como la diarrea funcional (RM: 1.90) incrementaron el riesgo de padecer IF (6, 19-22)42. Finalmente, un trabajo que trató de elucidar los mecanismos fisiopatológicos asociados a SII en IF encontró en el análisis multivariado una fuerte asociación con paridad (p=0.007), partos vaginales (p=0.049), laceraciones obstétricas (p=0.007), urgencia fecal (p=0.005), diarrea (p=0.008), e histerectomía (p=0.004), pero no con episiotomía, prolapso o IU43.
Otros factores de riesgo a considerarseExiste evidencia limitada o controversial, con respecto a algunos factores de riesgo que pudieran asociarse a la IF, y que, aunque no fueron votados en el consenso se hará mención al respecto. Por ejemplo, existen resultados inconsistentes acerca de que si el tener relaciones sexuales anales puede ser un factor de riesgo; algunos estudios muestran que el sexo anoreceptivo se asocia con presiones disminuidas en el canal anal en reposo, pero las presiones totales son normales y no condiciona IF44. Otros estudios reportan que la IF es más frecuente en mujeres que practican sexo anal45. Sin embargo, estudios más recientes describen que el riesgo de IF depende de la frecuencia con la que se práctica (más de una vez por semana), coexistencia con síndrome de inmunodeficiencia adquirida (sida) y prácticas como la introducción del puño («fisting»)46. En la encuesta de los Institutos Nacionales de Salud de los Estados Unidos en más de 4,000 sujetos se establece que la RM para desarrollar IF en sujetos que practican sexo anal es de 1.5 en mujeres y 2.8 en varones47.
La demencia y otros trastornos neurológicos que condicionan disfunción neurogénica como esclerosis múltiple o mielitis transversa pueden asociarse a la IF, pero la evidencia es escasa18. Algunas enfermedades gastrointestinales coexistentes como la colitis ulcerativa, la enfermedad de Crohn y la enfermedad celíaca, se han asociado a la IF en algunos estudios17,18.
La fisiopatología de la incontinencia fecal es compleja y multifactorial. Más del 80% de los pacientes tienen más de una alteración, por lo que es importante tratar de determinar en lo posible la fisiopatología para proveer un tratamiento personalizadoFuerza de la recomendación: —
Calidad de la evidencia: B
Acuerdo alcanzado: el 94.1% totalmente de acuerdo y el 5.9% parcialmente de acuerdo.
La fisiopatología de la IF es heterogénea y en más del 80% de los casos existen más de un mecanismo relacionado (tabla 3)13. Cada individuo puede presentar varios de los mecanismos fisiopatológicos y es de esperar que, a mayor número de estos, mayor sea a frecuencia y gravedad con que se presentan los episodios de IF. En términos generales los factores fisiopatológicos que llevan a la IF se pueden agrupar de la siguiente manera29:
- a)
Los factores anatómicos/estructurales involucran lesión del aparato muscular esfinteriano, alteraciones en recto (inflamación, laxitud), alteraciones en el músculo puborrectal (lesión directa) y alteraciones neurológicas (daño a la inervación tanto periférica, p. ej., neuropatías como central, p. ej., lesión medular).
- b)
Los factores funcionales incluyen cambios en la sensibilidad rectal por diversas causas y problemas de la dinámica de la defecación (defecación disinérgica), esta última impidiendo una adecuada expulsión de las heces.
- c)
Las heces disminuidas en consistencia, asociadas o no a urgencia por defecar y un tránsito intestinal acelerado por diversas etiologías (infecciosas, sobrecrecimiento bacteriano, exceso de sales biliares) pueden llevar a episodios más frecuentes de IF.
- d)
Las causas misceláneas como alteraciones de la función cognitiva (demencia), trastornos psiquiátricos (psicosis), uso de fármacos (alteraciones de la sensibilidad rectal y cambios en el tránsito intestinal), así como el exceso en el consumo de hidratos de carbono fermentables que pueden llevar a diarrea y a episodios de IF.
Mecanismos fisiopatológicos de la incontinencia fecal
| Categoría | Causa | Efecto |
|---|---|---|
| Anormalidades estructurales | ||
| Musculares | ||
| EAI | Trauma o lesión (p. ej., esfinterotomía), atrofia | Pérdida del reflejo de muestreo |
| EAE | Trauma o lesión (p. ej., lesión obstétrica), atrofia (envejecimiento) | Debilidad del esfínter |
| Músculo puborectal | Trauma o lesión (p. ej., desgarros, descenso perineal excesivo), atrofia | Debilidad del esfínterÁngulo anorrectal obtuso |
| Recto | Anormalidades de la mucosa, inflamación debida a radiación, CUCI, Crohn | Pérdida del acomodamientoPérdida de sensaciónHipersensibilidad |
| Nervios | ||
| Nervio pudendo | Neuropatía debida a lesión obstétrica/quirúrgica | Debilidad del esfínterPérdida sensitivaReflejos anormales |
| Nervios autonómicos, médula espinal, SNC | Trauma (pelvis, médula espinal, espalda, cabeza) | Reflejos dañados |
| Enfermedades neurológicas (p. ej., esclerosis múltiple, accidente vascular cerebral) | Pérdida sensorial | |
| Enfermedades sistémicas (p. ej., diabetes) | Pérdida del acomodamientoMiopatía secundaria | |
| Anormalidades funcionales | ||
| Sensaciones anorrectales | Trauma obstétrico o quirúrgico | Pérdida de alerta sobre las heces |
| Lesiones del SNC y periférico | Agnosia rectoanal | |
| Impactación fecal | Defecación disinérgica | Sensación dañada |
| Retención fecal con rebosamiento | ||
| Características de las heces | ||
| Volumen y consistencia | Infección, CUCI, Crohn, SII, medicamentos, metabólicas | Diarrea y apremioTransporte rápido de hecesAcomodamiento dañado |
| Irritantes | Mala absorción de sales biliares, laxantes | Diarrea |
| Retención/heces duras | Defecación disinérgica/medicamentos | Retención fecal con desbordamiento |
| Misceláneos | ||
| Medicamentos | AnticolinérgicosLaxantesMedicamentos antidepresivos | EstreñimientoDiarreaSensación alterada |
| Intolerancia a alimentos | Lactosa/fructosa/sorbitolCafeína | Malabsorción/diarrea/gasesRelajación del tono del esfínter |
| Función cognitiva/movilidad alterada | Envejecimiento, demencia, invalidez | Cambios multifactoriales |
CUCI: colitis ulcerativa crónica inespecífica; EAE: esfínter anal externo; EAI: esfínter anal interno; SII: síndrome de intestino irritable; SNC: sistema nervioso central.
Una evaluación individualizada de todos estos aspectos fisiopatológicos llevará a un mejor entendimiento del problema y al planteamiento de modalidades de tratamiento efectivas para mejorar a estos pacientes.
DiagnósticoEvaluación clínicaEl primer paso para la evaluación de la IF es establecer una buena relación médico/paciente. Se debe obtener una historia clínica detallada ya que, por lo general, los pacientes son reacios a admitir sus síntomas y se sugiere que todos los sujetos con diarrea, estreñimiento u otros problemas anorrectales sean interrogados intencionadamente sobre la presencia de IF4,6. Una evaluación del tiempo y duración, la naturaleza (es decir, incontinencia de gases, heces líquidas o sólidas) y su impacto en la calidad de vida es importante. El uso de toallas sanitarias u otros dispositivos y la capacidad de discriminar entre heces formadas, no formadas y gas deben ser documentados. Es importante interrogar sobre los factores de riesgo mencionados previamente, las hábitos higiénico/dietéticos, así como la coexistencia de comorbilidades. El uso de cuestionarios y escalas clínicas, así como de calidad de vida pueden proporcionar información adicional sobre la frecuencia de las deposiciones, la cantidad (es decir, cantidad pequeña, mediana o grande), el tipo de fuga y la presencia de urgencia para proporcionar un índice de la gravedad de los síntomas.
Los cuestionarios clínicos (escala de Wexner, FISS, etc.) son útiles para ayudar a establecer el diagnóstico, dar seguimiento y establecer la severidad de la incontinencia fecalFuerza de la recomendación: fuerte a favor
Calidad de la evidencia: B1
Acuerdo alcanzado: el 88.2% totalmente de acuerdo y el 11.8% parcialmente de acuerdo.
Los cuestionarios clínicos han demostrado utilidad en la evaluación inicial de pacientes con IF, así como para evaluar la respuesta al tratamiento durante el seguimiento de estos y además correlacionan directamente con la calidad de vida48. El uso de estos cuestionarios se ha evaluado en diferentes escenarios e intervenciones terapéuticas, y a pesar de que todas miden de manera concreta parámetros similares, pueden existir algunas diferencias entre ellos. Un estudio que evaluó de manera prospectiva la escala de St. Marḱs, la escala de Wexner, la escala de Pescatori y la del American Medical System, encontró una buena correlación entre ellas (r=0.79, p<0.001), a excepción de la escala de la American Medical System, ya que cambiaron al evaluar la respuesta al tratamiento (p=0.09) y las 3 restantes correlacionaron bien para la medición de la respuesta al tratamiento (r=0.94, p<0.001) por lo que reafirma la utilidad de estas herramientas49.
Basado en el uso de estas escalas, se ha propuesto incluso que son útiles para evaluar el grado de respuesta posterior a una intervención. Un estudio realizado en la Clínica Mayo, evaluó el uso de una escala denominada Fecal Incontinence Severity Score (FISS) antes y después del tratamiento con clonidina o placebo. Con este cuestionario, se observó que el grado de satisfacción de los pacientes era mayor cuando se obtenía un cambio en el cuestionario (respuesta clínica) en ≥50% al final de la intervención50. A partir de esto se ha planteado que estos cuestionarios deben aplicarse y definir cambios que se asocien a mejoría clínica en pacientes sometidos a los diversos tratamientos para la IF51.
Se recomienda el uso de escalas de calidad de vida (FIQLI, etc.) en la evaluación de todos los pacientes con incontinencia fecalFuerza de la recomendación: fuerte a favor
Calidad de la evidencia: B1
Acuerdo alcanzado: el 100% totalmente de acuerdo.
Las escalas de calidad de vida son importantes en evaluar el estado inicial de un paciente con IF, así como también evaluar la respuesta a los tratamientos de este problema dado el gran impacto negativo que esta enfermedad confiere. Existen 3 tipos de escalas de calidad de vida que se han empleado en para evaluar este problema: 1) escalas de calidad de vida generales, que evaluar todos los dominios, 2) escalas especializadas, centradas en abordar aspectos relacionados con depresión o ansiedad y 3) escalas específicas, que abordan situaciones relacionadas directamente con la IF y su impacto en calidad de vida52. Cada una de estas tiene debilidades y fortalezas dependiendo de lo que se quiera conocer en la persona con IF. La IF per se, afecta los dominios relacionados con la vida social, la conducta en respuesta a este problema y los problemas relacionados con el afecto (sensación de pena, vergüenza). El instrumento más utilizado para evaluar los aspectos de la calidad de vida específicos de la IF es el FIQLI que puede ser usada en población adulta y tiene validaciones en diferentes partes del mundo y evalúa 5 aspectos como fisiología, cognición, comportamiento, afecto y social53. Los instrumentos que evalúan calidad de vida no representan por sí misma una valoración de la gravedad del problema, pues esta recopila información más relacionada con cómo es que el sujeto, en este caso con IF, lidia, se adapta o se abstiene de hacer actividades de su vida diaria54.
Sin duda los cuestionarios de calidad de vida ayudan a entender las conductas adoptadas por los pacientes con IF, y de esta manera abordar y tratar el problema de una manera que mejore las esferas más afectadas, siendo la solución, no necesariamente relacionada con el tratamiento de la IF, si no con el apoyo que se brinda a estos pacientes para afrontar de mejor forma su problema.
El tacto rectal es una maniobra indispensable y útil en la evaluación de los pacientes con incontinencia fecalFuerza de la recomendación: fuerte a favor
Calidad de la evidencia: B1
Acuerdo alcanzado: el 94.1% totalmente de acuerdo y el 5.9% parcialmente de acuerdo.
El examen físico es crucial en evaluación de la IF para definir la anatomía y función basal. Previo a la realización del tacto rectal, la inspección perineal detallada permite identificar la presencia de cicatrices, rupturas de la piel, adelgazamiento del cuerpo perineal, suciedad, fístulas, hemorroides y/o prolapso de la mucosa. El tacto rectal es una exploración esencial en la evaluación de problemas gastrointestinales y anorrectales, pero cobra mayor énfasis en la evaluación de pacientes con IF. El tacto rectal es necesario y debe de realizarse de forma rutinaria en todos los pacientes con IF y debe de incluir la evaluación de la longitud del canal anal, el tono del esfínter en reposo y en contracción, y la coordinación recto anal. La sensibilidad perianal también debe evaluarse. El reflejo ano cutáneo examina la integridad de la conexión entre los nervios sensitivos y la piel, las neuronas intermedias en los segmentos S2, S3 y S4 de la médula espinal y la inervación motora del EAE. La ausencia de este reflejo sugiere daño neuronal ya sea aferente o eferente.
Aunque el tacto rectal es una maniobra crucial, para recalcar su relevancia y la poca práctica de esta maniobra, en los EE. UU. se realizó una encuesta en estudiantes de medicina, en la que se encontró que solo el 17% refirieron nunca haber realizado esta maniobra durante su entrenamiento y el 48% estaban inseguros de los hallazgos que recopilaron55. Los hallazgos más importantes de un tacto rectal como la evaluación de la presión en reposo y el incremento de la fuerza a la maniobra de contracción ayudan a dilucidar los mecanismos fisiopatológicos que llevan a la IF. Existen barreras para realizar esta exploración, pero la mayoría de ellas provienen del médico y no del paciente. Realizar esta exploración ayuda de manera determinante a mejorar el abordaje diagnóstico de los pacientes56. Al compararse los hallazgos de un tacto rectal con aquellos recabados por la manometría anorrectal, se ha determinado que el tacto rectal tiene una adecuada correlación con la maniobra de contracción voluntaria (κ=0.418, p=0.006), pero baja para la presión de reposo (κ=0.079, p=0.368) en los pacientes con IF57. Para disinergia defecatoria, que puede coexistir con la IF e incluso ser un mecanismo que lleve a desarrollar este problema, el tacto rectal ha demostrado ser sensible y específico para encontrar esta alteración con una sensibilidad del 75% y una especificidad del 87%58.
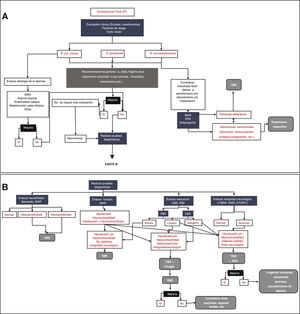
Pruebas diagnósticasExisten varias pruebas que pueden emplearse en la valoración de un paciente con IF. La selección de dichas pruebas dependerá de los factores etiológicos, la gravedad de los síntomas, el impacto en la calidad de vida y la edad del paciente. En las figuras 1A y B se establece un algoritmo diagnóstico/terapéutico recomendado por este grupo de consenso.
Algoritmo diagnóstico para la incontinencia fecal.
A) Abordaje inicial y manejo de primera intención propuesto para todos los pacientes con incontinencia fecal (IF). MAR: manometría anorrectal; PEB: prueba de expulsión con balón; SIBO: small intestinal bacterial overgrowth (sobrepoblación bacteriana); TBR: terapia de biorretroalimentación. B) Pruebas diagnósticas. No existe una sola prueba sino se consideran complementarias. EMG: electromiografía; ETS/ETL: estimulación transacra/estimulación translumbar; IRM: imagen de resonancia magnética; LTMNP: latencia terminal motora del nervio pudendo; SNS: neuroestimulación sacra; USE: ultrasonido endoanal.
Fuerza de la recomendación: fuerte a favor
Calidad de la evidencia: B1
Acuerdo alcanzado: el 88.2% totalmente de acuerdo y el 11.8% parcialmente de acuerdo.
Desde su implementación a principios de la década de 1990, el ultrasonido endoanal (USE) ha sido considerado el estándar de oro para el diagnóstico morfológico especialmente de defectos del canal anal, EAI y EAE en pacientes con IF, ya que es posible la evaluación de lesiones (cicatrices o defectos) o disminución del espesor; completo o parcial (atrofia) del esfínter, además de ser un estudio ampliamente disponible y bien tolerado59. El USE es una prueba que ha mejorado con el tiempo, brindando actualmente la posibilidad de tener imágenes tridimensionales (USE-3D), que permiten la detección de pequeñas lesiones del esfínter que de otra manera pasarían desapercibidas o serían malinterpretadas, ya que la separación natural del músculo puborrectal suele confundirse con una rotura del esfínter, además el USE en cuarta dimensión (4D) permite la determinación de medidas de longitud, grosor, área y volumen mediante la producción de un volumen digital que puede visualizarse desde cualquier plano, y se muestra como imágenes multiplanares o mediante secciones tomográficas, lo que permite una visualización más precisa de los defectos. Recientemente ha surgido el ultrasonido transperineal, el cual puede proporcionar información adicional, especialmente en mujeres, pero está limitado por el ángulo diagonal de visión. Varios estudios publicados en la última década han demostrado una correlación significativa entre el USE-3D y los hallazgos del ultrasonido transperineal cuando se utiliza para la detección de lesiones del esfínter anal, sin embargo, esta prueba aún no ha sido estandarizada60–62. Es importante destacar que el USE es el mejor método para la visualización del EAI, además, su sensibilidad y precisión en la identificación de lesiones del esfínter son objeto de debate y dependen del operador. Una serie de 51 pacientes reportó una buena concordancia inter observador para el diagnóstico de lesiones del EAI y discrepancia entre observadores de hasta 5mm cuando evaluaron el grosor del EAE. Por lo tanto, si se sospecha de lesiones difíciles de definir por USE o atrofia del EAE, se debe realizar una resonancia magnética endoanal63. Aunque es una prueba que puede estar fácilmente disponible, es importante reconocer que es una prueba operado dependiente.
En caso de estar disponible los estudios de resonancia magnética son útiles en la evaluación de los pacientes con incontinencia fecalFuerza de la recomendación: débil a favor
Calidad de la evidencia: B2
Acuerdo alcanzado: el 76.5% totalmente de acuerdo y el 23.5% parcialmente de acuerdo.
La resonancia magnética (MRI, por sus siglas en inglés) endoanal es una modalidad de diagnóstico relativamente no invasiva y sin exposición a radiación que permite evaluar la atrofia o los defectos del complejo del esfínter anal, así como el movimiento global del piso pélvico en tiempo real64. La MRI es más sensible para identificar lesiones del EAE, ya que debido al contraste permite una buena distinción entre músculos, cicatrices y tejido adiposo debido a que tienen diferentes intensidades de señal en las imágenes ponderadas en T2, facilitando la identificación de atrofia local, algo que no es posible con el USE, y proporciona una descripción más precisa acerca de la extensión y estructuras afectadas en lesiones complejas, con una sensibilidad del 89% y una especificidad del 94% además de diferenciar entre un desgarro o cicatriz del EAE65. La MRI puede obtener imágenes de 360° insertando la bobina en el canal anal (endocoil) o mediante una imagen de matriz de fase externa66. Un estudio retrospectivo de 22 mujeres sometidas a reparación del esfínter reportó que la MRI endoanal fue superior al USE para el diagnóstico de lesiones del EAE. Ninguna de las técnicas mostró ventaja para el diagnóstico de dichas lesiones67.
Adicionalmente, la defecografía por resonancia magnética se utiliza para evaluar el movimiento anorrectal y los compartimentos del piso pélvico en tiempo real durante la defecación y contracción. Las indicaciones principales para la defecografía por resonancia magnética son identificar problemas obstructivos estructurales o «funcionales» en pacientes con IF y síntomas refractarios68.
A pesar de sus beneficios, los estudios por resonancia magnética no están ampliamente disponible, son costosos y están contraindicados en pacientes con dispositivos o hardware incompatibles con la MRI.
La manometría anorrectal es una prueba indispensable, y debe de realizarse en todos los pacientes con incontinencia fecalFuerza de la recomendación: fuerte a favor
Calidad de la evidencia: B1
Acuerdo alcanzado: 100% totalmente de acuerdo.
La manometría anorrectal (MAR) es una de las herramientas diagnósticas mejor establecidas para evaluar la función motora y la sensibilidad anorrectal en pacientes con IF, y para muchos autores representa el estándar de oro para evaluar la función recto anal. Aunque existen factores como la función del reservorio rectal, la forma de las heces, el esfuerzo defecatorio adecuado, así como la capacidad cognitiva o física, especialmente en varones y mujeres que no presentan evidencia de lesión en el esfínter anal, la disfunción del esfínter anal continúa siendo uno de los mecanismos fisiopatológicos más importantes en la IF. La MAR permite evaluar la función motora determinando, si el tono en reposo (que refleja la función del EAI) y la presión de contracción (que refleja la función del EAE) están dentro o fuera del rango normal. La introducción de la MAR de alta resolución (MAR-AR) y/o alta definición (MAR-AD) han aumentado la resolución espacial para la obtención de datos y proporcionar una visualización continua de la actividad acerca de la presión del recto y del canal anal. Para facilitar la comparación de los hallazgos diagnósticos entre centros, el Grupo de Trabajo Internacional de Fisiología Anorrectal (IAPWG, por sus siglas en inglés) en 2018 publicó un consenso que propone un protocolo práctico y estandarizado para la realización, terminología e interpretación de la MAR denominado, Clasificación de Londres69.
Existen distintos hallazgos manométricos que pueden estar relacionados con la IF, como la reducción de la presión anal en reposo,(hipotonía) y la reducción de la presión de contracción voluntaria (hipocontractilidad). Estas alteraciones se clasifican como trastornos mayores del tono y la contractilidad anal; sin embargo, hasta hace poco, la prevalencia de la disfunción motora del esfínter anal, diagnosticado por MAR en pacientes con IF era incierta. Rasijeff et al.70 publicaron una revisión sistemática y metaanálisis en el que se reporta que la disfunción del esfínter anal fue el hallazgo fisiopatológico más prevalente. Según los resultados combinados, el 44% de las mujeres y el 27% de los varones tenían hipotonía anal, el 69% de las mujeres y el 36% de los varones tenían hipocontractilidad anal. Estos resultados respaldan el concepto de que la disfunción de barrera (ya sea de origen neurológico/funcional o estructural) es la principal causa de la IF en las mujeres. Por otro lado, solo una minoría de los varones presentó disfunción motora del esfínter anal; por lo que, en este grupo en particular, se deben considerar otros mecanismos (supra esfinterianos). Sin embargo, es posible que las medidas de tono en reposo y presión de contracción carezcan de sensibilidad para transmitir todos los grados de disfunción del esfínter anal, por lo que deben tomarse en cuenta estos factores a la hora de su interpretación. En México, cada vez es más accesible y existen múltiples centros de referencia para derivar a los pacientes con IF que requieran una MAR.
Se recomienda la evaluación de la sensibilidad rectal (mediante manometría y/o baróstato) en todos los pacientes con incontinencia fecalBaróstatoFuerza de la recomendación: fuerte a favor
Calidad de la evidencia: B1
Acuerdo alcanzado: 100% totalmente de acuerdo.
Aunque la disfunción del esfínter anal es la causa más común de IF, el papel de la disfunción sensorial es clave en el abordaje de estos pacientes. Las pruebas para evaluar la sensibilidad rectal, como el baróstato rectal o la distensión simple con globo son fundamentales, ya que con frecuencia las alteraciones sensoriales y/o la función biomecánica alterada (generalmente evaluada mediante la medición de la complacencia rectal) se encuentran en casos de IF, lo que justifica la evaluación de la función sensorial. El baróstato, es un sistema computarizado que permite la distensión de un globo, impulsado por presión y adaptable, que proporciona un método mucho más rápido para provocar la percepción sensorial rectal, la cual se evalúa registrando cada uno de los tres umbrales sensoriales reportados por el paciente: volumen de la primera sensación detectable, sensación de urgencia para evacuar y sensación de malestar o dolor (volumen máximo tolerable) y un cuarto umbral (volumen de urgencia sostenida) el cuál es opcional59.
La hiposensibilidad rectal (elevación de los umbrales sensoriales por arriba del rango normal) se ha relacionado con frecuencia en pacientes con IF71. Además, se ha reportado que es un predictor de peor pronóstico en cuanto a los resultados en el tratamiento de la IF ya sea con biorretroalimentación o cirugía. A pesar de ello, la presencia de hiposensibilidad rara vez se tiene en cuenta al tomar decisiones sobre el manejo médico o quirúrgico. Por otro lado, la hipersensibilidad puede ser el resultado de la alteración en la distensibilidad («compliancia») rectal, sensibilización de las vías periféricas extrínsecas y/o disfunción de los mecanismos centrales aferentes, o anomalías en los procesos perceptuales y de comportamiento que causan hipervigilancia. Esto a menudo lleva a incontinencia de urgencia, asociada con la incapacidad para posponer la defecación72.
MARFuerza de la recomendación: débil a favor
Calidad de la evidencia: C2
Acuerdo alcanzado: 100% totalmente de acuerdo.
Los cambios en la sensación rectal también pueden afectar la continencia. Se recomienda la determinación rutinaria de la sensibilidad rectal, la cual puede realizarse durante la MAR al distender manualmente un globo, asegurado al catéter del equipo de MAR y se registran los volúmenes necesarios para producir la serie de sensaciones rectales. La hipersensibilidad (mayor percepción sensorial) y la hiposensibilidad (disminución de la percepción sensorial) se clasifican como trastornos mayores de la sensibilidad, de acuerdo con la Clasificación de Londres y ambos pueden afectar significativamente la continencia. La alteración en la sensibilidad rectal, especialmente en presencia de hipotonía o hipocontractilidad anal, puede llevar a la incontinencia debido a la inhibición refleja del EAI antes de que el paciente perciba la presencia de heces en el recto68,69. Esto puede ser uno de los mecanismos más importantes para algunos pacientes que presentan principalmente incontinencia pasiva73. Un reciente metaanálisis reportó una mayor prevalencia de hiposensibilidad rectal en varones en comparación con las mujeres mientras que la hipersensibilidad rectal fue más prevalente en mujeres que en varones70.
La electromiografía es una prueba complementaria que aporta información útil en los pacientes con incontinencia fecal severa, en especial cuando existe sospecha de daño neuronalFuerza de la recomendación: débil a favor
Calidad de la evidencia: C2
Acuerdo alcanzado: el 88.2% totalmente de acuerdo y el 11.8% parcialmente de acuerdo.
La electromiografía anal (EMG) es una prueba neurofisiológica que se utiliza para evaluar la función anorrectal, particularmente la función del músculo estriado del EAE y puborrectal, además de evaluar los potenciales de denervación-reinervación (indicativos de lesiones neurales)68. Si bien actualmente se utiliza con menos frecuencia en la práctica clínica debido a la introducción de medidas menos invasivas, sigue siendo una herramienta importante para evaluar la función neurofisiológica anorrectal, ya que debido a que las ramas del nervio pudendo se encargan de aportar la inervación sensitiva y motora al piso pélvico, estas son vulnerables a lesiones por estiramiento (durante el tercer trimestre, la segunda etapa del parto y el parto vaginal asistido con fórceps), incrementando el riesgo de denervación del EAE e IF. Por lo general, la EMG siempre se realiza junto con otras pruebas diagnósticas (p. ej., manometría anorrectal) para evaluar de manera global los mecanismos fisiopatológicos involucrados y ayudar en la planificación del tratamiento; esta técnica también puede ser útil para la realización de terapia de reentrenamiento.
En los pacientes con incontinencia fecal severa y daño neuronal, en caso de estar disponibles, se sugiere el uso de pruebas que evalúan la integridad nerviosa (latencia de nervios pudendos, estimulación magnética transacra y/o translumbar)Latencia de nervios pudendosFuerza de la recomendación: débil a favor
Calidad de la evidencia: C2
Acuerdo alcanzado: el 76.5% totalmente de acuerdo, el 17.6% parcialmente de acuerdo y el 5.9% incierto.
La prueba de latencia motora terminal del nervio pudendo mide la integridad neuromuscular entre la porción terminal del nervio pudendo y el EAE, esta prueba es relativamente fácil de realizar, pero no está disponible en todos los centros, lo cual es su principal limitación, además es importante tener en cuenta que su correlación con los síntomas clínicos es controvertida y un resultado normal no excluye neuropatía, así mismo los valores dependen del operador y no están estandarizados, por lo cual no debe ser utilizada como única prueba en la investigación de daño neuronal74.
Estimulación magnéticaFuerza de la recomendación: débil a favor
Calidad de la evidencia: D2
Acuerdo alcanzado: el 76.5% totalmente de acuerdo, el 17.6% parcialmente de acuerdo y el 5.9% incierto,
La llegada de la estimulación magnética mínimamente invasiva de los plexos nerviosos lumbares y sacros ha permitido evaluar las vías espino/anorrectales que controlan la función neuronal anorrectal en pacientes con IF y lesión de médula espinal. Un estudio75 reveló que el 65% de pacientes con IF y lesión de la médula espinal presentaban retraso en la conducción, con una prevalencia dos veces mayor para neuropatía anal. Además, se ha reportado que los potenciales motores evocados translumbares y transacros del recto y del ano proporcionan una mejor delimitación de las lesiones neuromusculares periféricas en individuos con IF y lesiones de la médula espinal en comparación con la latencia de nervios pudendos. Se recomienda realizar la estimulación magnética en pacientes con IF y daño medular ya que es estudio seguro y proporciona información valiosa sobre los mecanismos neurofisiopatológicos que podrían explicar la disfunción anorrectal.
TratamientoEn la tabla 4 se resumen las recomendaciones emitidas respecto al tratamiento de este consenso.
Recomendaciones respecto al tratamiento de la incontinencia fecal
| Intervención | Fuerza de la recomendación | Calidad de la evidencia | Disponibilidad en México |
|---|---|---|---|
| Medidas higiénico-dietéticas | |||
| Valoración dietética incluyendo restricción de alimentos como cafeína e hidratos de carbono fácilmente fermentables | Fuerte a favor | C1 | Sí |
| Uso de formadores de bolo (Psyllium plántago) | Débil a favor | C2 | Sí |
| Tratamiento farmacológico | |||
| Antidiarreicos (loperamida, lidamidina) | Fuerte a favor | C1 | Sí |
| Colestiramina | Débil a favor | D2 | Sí |
| (a veces escasa) | |||
| Tratamientos no farmacológicos | |||
| Terapia de biorretroalimentación | Fuerte a favor | B1 | Sí (escasa) |
| Dispositivos para impedir la defecación (tapones anales, pesarios) | Débil a favor | D2 | Sí (muy escasa) |
| Inyección de dextranómero sódico | Débil en contra | C2 | No |
| Radiofrecuencia | Débil en contra | C2 | Sí (muy escasa) |
| Neuroestimulación sacra | Débil a favor | B2 | Sí (escasa) |
| Neuroestimulación transcutánea del nervio tibial posterior | Débil a favor | D2 | Sí (muy escasa) |
| Neuroestimulación percutánea del nervio tibial posterior | Débil a favor | C2 | Sí (muy escasa) |
| Neuroestimulación magnética translumbar repetitiva | Débil a favor | D2 | No |
| Inyección de prótesis de poliacrilonitrilo | |||
| Tratamiento quirúrgico | — | — | Sí (muy escasa) |
| Esfinteroplastia | Fuerte a favor | C1 | Sí |
| Esfínteres artificiales, bioesfínteres, terapia regenerativa de células madre | — | D— | No |
| Colostomía | Débil a favor | C2 | Sí |
IF: incontinencia fecal.
Códigos de calidad de evidencia y fuerza de la recomendación de acuerdo con la tabla 1. A: alta; B: moderada; C: baja; D: muy baja. 1: fuerte a favor o en contra; 2: débil a favor o en contra; —: no hay evidencia suficiente.
Fuerza de la recomendación: fuerte a favor
Calidad de la evidencia: B1
Acuerdo alcanzado: el 100% totalmente de acuerdo.
El objetivo del tratamiento en los pacientes con incontinencia es restaurar la continencia y mejorar la calidad de vida. Como se menciona en el enunciado 11, en la mayoría de los casos existe más de un mecanismo fisiopatológico implicado y es importante la identificación de estos para desarrollar un tratamiento individualizado en cada paciente. Así pues, la propuesta terapéutica involucrará medidas generales, dietéticas, farmacológicas, no farmacológicas y/o quirúrgicas, las cuales deberán de ser proporcionadas por un grupo multidisciplinario que incluyan gastroenterólogos, neurogastroenterológos, nutriólogos, fisioterapeutas y cirujanos, según sea el caso. Así pues, antes de considerar terapia farmacológica o tratamientos quirúrgicos, a todos los pacientes se les debe ofrecer medidas de apoyo que incluyen modificaciones dietéticas (ver más adelante), adecuada higiene de la piel (uso de humectantes, protectores cutáneos o una combinación de ambos, tienen efectos beneficiosos para prevenir y tratar la dermatitis asociada a la incontinencia en comparación con el uso de jabón y agua), técnicas para mejorar la evacuación, el uso programado del baño, ejercicios del piso pélvico para fortalecer la musculatura y manejo de las enfermedades concomitantes13.
Medidas higiénico-dietéticasSe debe de realizar una valoración dietética para identificar alimentos (p. ej., lactosa, café, azúcares no absorbibles, etc.) que se asocian con episodios y/o crisis de incontinencia fecalFuerza de la recomendación: fuerte a favor
Calidad de la evidencia: C1
Acuerdo alcanzado: el 100% totalmente de acuerdo.
El consumo de cafeína o alimentos que contienen azúcares fácilmente fermentables (lactosa, disacáridos, rafinosa, sorbitol, fructosa) se ha relacionado con síntomas de IF en especial con evacuaciones líquidas y urgencia fecal. Por lo tanto, una dieta reducida en la ingesta de estos alimentos se ha recomendado. Si bien la existencia de evidencia es limitada, la calidad es suficiente para emitir una recomendación a favor. Por ejemplo, en un estudio con 65 pacientes a los que se les recomendó seguir una dieta baja en alimentos fácilmente fermentables (FODMAP), el 65% de estos reportaron una reducción significativa mientras llevaron la dieta76. Estos resultados son similares a los reportados por pacientes que sufren SII con predominio de diarrea (SII-D)77. Para esta intervención dietética, es óptimo que los pacientes consulten con un gastroenterólogo y un nutricionista o dietista registrado para recibir instrucciones y monitorear los síntomas. El seguimiento regular con los profesionales de la salud permite que los pacientes incorporen los cambios adecuados en su estilo de vida de manera exitosa78.
Se recomienda el uso de fibras que aumentan el bolo fecal (Psyllium plantago) en pacientes con incontinencia fecal y evacuaciones líquidas o semilíquidasFuerza de la recomendación: débil a favor
Calidad de la evidencia: C2
Acuerdo alcanzado: el 94.1% totalmente de acuerdo y el 5.9% parcialmente de acuerdo.
Los suplementos de fibra como el psyllium son con frecuencia recomendados en un intento de incrementar el volumen de las heces y reducir las heces líquidas13. En una revisión sistemática que examinó los efectos de la fibra en IF, se concluye que la suplementación con 25g de psyllium o de goma arábiga mejora la consistencia de las heces y produce menos evacuaciones líquidas en comparación con placebo79. En otro estudio se demostró que el psyllium, pero no la goma guar ni la metilcelulosa disminuye la gravedad de los síntomas asociados a IF80. Recientemente, se reporta en un ensayo clínico controlado con 43 pacientes, los efectos de la suplementación con psyllium en comparación con una dieta baja en FODMAP81. No hubo una diferencia estadísticamente significativa en la proporción de respondedores al tratamiento (>50% de reducción en los episodios de IF en comparación con el inicio) durante las semanas 1-4 del tratamiento (el 38.9% en la dieta baja en FODMAP, el 50% en el grupo de psyllium, p=0.33). Sin embargo, los sujetos en el grupo de psyllium informaron una mayor reducción en los episodios generales de IF, mientras que el grupo de la dieta baja en FODMAP informó mejoría en la gravedad de la IF y la calidad de vida.
Es importante mencionar también que el uso de fibra es útil pacientes con manchado fecal, el cual la mayor parte de las veces es secundaria a un estreñimiento por rebosamiento82.
Tratamiento farmacológicoSe recomienda el uso de antidiarreicos (loperamida, lidamidina) en los pacientes con incontinencia fecal y diarreaFuerza de la recomendación: fuerte a favor
Calidad de la evidencia: C1
Acuerdo alcanzado: el 94.1% totalmente de acuerdo y el 5.9% parcialmente de acuerdo.
Existen varios medicamentos para controlar la diarrea en los pacientes con IF (p,. ej., loperamida, difenoxilato con atropina, agentes anticolinérgicos y clonidina) ya que retardan el tránsito colónico, disminuye la secreción de líquido intestinal, aumentar la absorción y mejoran la presión y tono del esfínter anal13. De acuerdo con la revisión de Cochrane la loperamida, el difenoxilato más atropina y la codeína mejoran significativamente los síntomas, ayudan a restaurar la continencia fecal, reducen la urgencia fecal y disminuyen el uso de pañales83. La loperamida 4mg/3 veces al día, o de difenoxilato de atropina 5mg/4 veces al día pueden ayudar temporalmente en pacientes con diarrea e IF. Se ha descrito que la loperamida, incluso puede mejorar la sensibilidad rectal84. Otros agentes que han sido probados con menor eficacia son la fenilefrina tópica, lidamidina, amitriptilina, y el valproato de sodio.
Se sugiere el uso de colestiramina como coadyuvante en los pacientes con incontinencia fecal severa, en especial aquellos con diarrea por malabsorción de sales biliaresFuerza de la recomendación: débil a favor
Calidad de la evidencia: D2
Acuerdo alcanzado: el 82.4% totalmente de acuerdo y el 17.6% parcialmente de acuerdo.
Los pacientes con diarrea e IF secundaria a malabsorción de sales biliares pueden beneficiarse del uso de resinas intercambiadoras de iones como colestiramina o colestipol. En un estudio en donde 21 pacientes recibieron colestiramina junto con terapia de biorretroalimentaciòn (TBR) se demostró que la administración de esta produjo una disminución en la frecuencia de las deposiciones (p<0.01), mejoró la consistencia de las heces (p=0.001) y el número de episodios de incontinencia (p<0.04) en comparación con un grupo de pacientes que solo recibieron TBR85. La dosis promedio de colestiramina utilizada fue de 3.6g; 13 sujetos (62%) requirieron ajuste de dosis y 7 (33%) sujetos informaron efectos secundarios menores.
Tratamientos no farmacológicosEn los pacientes con incontinencia fecal que no responden a manejo conservador deben recibir biorretroalimentación como primera línea ya que esta terapia es inocua y proporciona múltiples beneficiosFuerza de la recomendación: fuerte a favor
Calidad de la evidencia: B1
Acuerdo alcanzado: el 88.2% totalmente de acuerdo y el 11.8% parcialmente de acuerdo.
La terapia de bioretroalimentación TBR es un tratamiento seguro y efectivo, mejora los síntomas de IF, restaura la calidad de vida y objetivamente mejora la fisiología anorrectal86. Por lo tanto, en los pacientes con IF secundaria a debilidad del aparato muscular esfinteriano con o sin anormalidades sensitivas del recto, debe de considerarse como una medida terapéutica de primera línea. De acuerdo con el grupo de expertos de las asociaciones Americanas y Europeas de Neurogastroenterología la evidencia para recomendar la TBR tiene un Grado IIB86. El principio de la TBR radica en la adquisición de nuevas conductas a través del proceso de ensayo y error. Si esta nueva conducta se refuerza repetidamente, la posibilidad de éxito se incrementa considerablemente. Los objetivos de la TBR son: a) mejorar la fuerza del esfínter anal, b) mejorar la coordinación entre los músculos del piso pélvico y el esfínter anal y c) mejorar la percepción anorrectal. Debido a que cada objetivo requiere un método especifico de entrenamiento, el tratamiento debe de individualizarse en cada paciente de acuerdo con el mecanismo fisiopatológico predominante. Se recomiendan al menos 6 sesiones, cada una de ellas cada 15 días, además de que después de cada sesión se instruya al paciente para la realización de ejercicios del piso pélvico en casa (ejercicios de Kegel). Es importante mencionar que los ejercicios del piso pélvico por si solos no deben considerarse TBR, y de forma aislada no han demostrado beneficio en el manejo de la IF87.
La efectividad de la TBR sobre los síntomas de la IF varía entre el 64-89%13. Los estudios a largo plazo demuestran que la TBR disminuye la frecuencia de las heces y el número de episodios de IF, incrementa la calidad de vida, así como las presiones del esfínter anal y la capacidad rectal88. El estudio que ha demostrado a más largo plazo la eficacia de la TBR, es el del grupo australiano de Mazor et al.89 donde en una cohorte de 89 pacientes, más de la mitad reportaban control de los síntomas de IF hasta por más de 7 años. Recientemente se ha descrito que la urgencia fecal, es uno de los síntomas que mejoran de forma significativa con la TBR90. Curiosamente, los ensayos aleatorizados han comparado la biorretroalimentación con diferentes enfoques de tratamiento, como el ejercicio del suelo pélvico, el asesoramiento y la educación, pero no hay ensayos controlados aleatorios que comparen la biorretroalimentación con la terapia simulada. Una limitante de la TBR es su disponibilidad y la necesidad de realizarse en medio hospitalario. Sin embargo, recientemente se han descritos dispositivos y protocolos utilizando equipos ambulatorios que demuestran que este tipo de TBR ambulatoria es igual de efectiva que la TBR convencional91.
También es importante mencionar que la presencia de IF grave, neuropatía severa de los nervios pudendos, lesiones esfinterianas extensas y la coexistencia de enfermedades neurológicas sistémicas, alteraciones cognitivas importantes (p. ej., demencia) son factores asociados a una pobre respuesta con TBR. En México existen algunos centros de referencia para la realización de esta terapia, y es importante formar personal capacitado para que esta técnica se disemine más en el país.
En los pacientes seleccionados que no responden a medidas conservadoras y biorretroalimentación el uso de dispositivos para impeder la defecación (tapones anales, pesarios, etc.) pudieran ser útiles ya que mejoran la calidad de vida. Sin embargo, su disponibilidad en nuestro país es limitadaFuerza de la recomendación: débil a favor
Calidad de la evidencia: D2
Acuerdo alcanzado: el 88.2% totalmente de acuerdo, el 5.9% parcialmente de acuerdo y el 5.9% incierto.
Los tapones anales son dispositivos mecánicos de barrera y existen de muchos tipos, con evidencia clínica limitada y sin disponibilidad en nuestro país. De acuerdo con la revisión más actualizada de Cochrane los datos disponibles sugieren que los tapones anales pueden ser difíciles de tolerar92. Sin embargo, si se toleran, pueden ser útiles para prevenir la incontinencia. Los tapones podrían entonces ser útiles en un grupo seleccionado de personas, ya sea como sustituto de otras formas de tratamiento o como una opción de tratamiento adyuvante. Los más destacados en la literatura son Renew®, Peristeen®, Protec® y Eclipse®. Renew® es un inserto anal de silicona desechable. En un estudio con 30 pacientes con IF, el 20% no le gustó el dispositivo, el 23% no mostró cambios y el 12% informó empeoramiento de los síntomas de la IF. Sin embargo, el 57% de los pacientes deseaba continuar usando el dispositivo93. En un segundo estudio, se utilizó el dispositivo Renew® en 15 pacientes con una bolsa ileoanal. El 53% de ellos encontró el dispositivo Renew® aceptable y el 40% lo consideró efectivo94. Peristeen®, es un dispositivo que se introduce dentro del canal anorrectal y previene la fuga accidental al actuar como un tapón absorbente. Este dispositivo es similar a un supositorio y está cubierto por una membrana transparente que se disuelve al contacto con la humedad del recto mucosa, lo que permite que el dispositivo se expanda para formar un tapón y evitando la fuga de líquido o heces. Su eficacia es cercana al 50%, pero hasta el 70% refiere molestias al utilizarlo95,96. ProTect® es un dispositivo médico relativamente simple, diseñado para pacientes seleccionados que sufren de FI severa. Consiste en un catéter de silicona flexible con un globo inflable que sella el recto en la unión anorrectal, actuando como un tapón anal97. La parte proximal del catéter incorpora dos contactos que monitorean el recto en busca de heces. El paciente es alertado de una evacuación intestinal inminente y, por lo tanto, de un posible accidente fecal, a través de un pitido. Al igual que los otros dispositivos, aunque mejora la calidad de vida de algunos pacientes y la frecuencia de la IF, no todos lo toleran. Es más útil en el control de evacuaciones semiformadas98. El dispositivo de control intestinal vaginal Eclipse® es un globo que se inserta en la vagina y actúa como una barrera mecánica (pesario), comprimiendo la pared anterior del recto. Se debe seleccionar el globo del tamaño correcto para cada paciente, y se requiere destreza manual para desinflar, inflar, insertar y retirar el dispositivo. Se han descrito dos series de casos con mejoría que varía entre el 50 y el 86%, y si bien no se han reportado efectos adversos relevantes, hasta el 21% de las pacientes reportan incomodidad vaginal99,100.
Es importante mencionar, que pacientes con incontinencia pasiva para pequeñas cantidades de heces pueden beneficiarse de los tapones de algodón perianales (toallas o «pads») para absorber la humedad y reducir el paso incontrolado de gas. Sin embargo, no hay estudios formales sobre esta intervención.
La evidencia para el uso de la inyección de sustancias (dextranómero sódico) o prótesis en los pacientes con incontinencia fecal es controversial, por lo que no recomendamos su usoFuerza de la recomendación: débil en contra
Calidad de la evidencia: C2
Acuerdo alcanzado: el 82.4% totalmente de acuerdo, el 11.8% parcialmente de acuerdo y el 5.9% incierto.
Con el fin de aumentar la presión de reposo del canal anal, la inyección submucosa o en el espacio interesfinteriano de varias sustancias o prótesis (GateKeeper®, SphinKeeper®) han sido probadas para el manejo de la IF. La eficacia ha variado dependiendo del producto ensayado, pero pocos estudios han comparado las sustancias contra otras inyecciones simuladas. Hasta el momento, la inyección de microesferas dextranómeras estabilizadas con ácido hialurónico (NASHA Dx®) es el único producto aprobado por la Administración de Alimentos y Medicamentos (FDA) para la IF y que ha mostrado una diferencia significativa frente a placebo13,101. De hecho, se reporta una reducción de más del 50% del número de episodios de IF en el 52% de los pacientes que recibieron NASHA Dx® comparado vs. el 31% de los pacientes que recibieron placebo101. Sin embargo, en un estudio posterior no hubo diferencia significativa en el número de episodios de IF, ni en la mejoría en la calidad de vida en el grupo de pacientes que recibieron el agente inyectable vs. un procedimiento simulado102. Aunque se han informado un gran número de efectos adversos, la mayoría de ellos no son graves (proctalgia, fiebre y hemorragia rectal). Es importante mencionar que esta intervención no está disponible en nuestro país.
Recientemente se ha descrito el uso de la inyección de prótesis hechas de Hyexpan (poliacrilonitrilo, SphinKeeper™) que es un material autoexpandible con «memoria de forma», y que, tras 48 h del implante, las prótesis se expanden absorbiendo fluidos fisiológicos y aumentan su volumen hasta el 730% de su tamaño original102. Gracias al efecto «memoria de forma», las prótesis vuelven a su forma inicial siguiendo el movimiento de los esfínteres anales. La eficacia y la seguridad de SphinKeeper® se ha demostrado en algunos ensayos clínicos con tamaños de muestra limitados. Esta técnica podría ser útil mínimamente invasivo eficaz y seguro en el tratamiento de la IF como terapia de segunda línea si fallan las terapias conservadoras. Si bien, esta técnica está disponible en México, es importante mencionar que antes de emitir una recomendación clínica, son necesarios más y mejores ensayos.
No se recomienda el uso de radiofrecuencia (procedimiento Secca®) en los pacientes con incontinencia fecalFuerza de la recomendación: débil en contra
Calidad de la evidencia: C2
Acuerdo alcanzado: el 88.2% totalmente de acuerdo y el 11.8% parcialmente de acuerdo.
El procedimiento Secca® consiste en la aplicación de energía de radiofrecuencia controlada por temperatura (465kHz, 2-5W) sobre todos los cuadrantes del canal anal4,30. Se ha propuesto que el calor liberado induce la contracción del tejido y la remodelación del canal anal mediante la formación de fibrosis retráctil, con la subsecuente deposición de colágeno induciendo así la contracción en el EAI103,104. Aunque los estudios iniciales reportan mejoría de la IF y la calidad de vida, estudios más recientes muestran resultados contradictorios y a largo plazo su eficacia parece disminuir rápidamente a lo largo del tiempo105,106.
La neuroestimulación sacra se recomienda en los pacientes con incontinencia fecal de moderada a grave, que han fallado a biorretroalimentaciónFuerza de la recomendación: débil a favor
Calidad de la evidencia: B2
Acuerdo alcanzado: el 94.1% totalmente de acuerdo y el 5.9% parcialmente de acuerdo.
La estimulación continua del nervio sacro (SNS) se ha convertido en un tratamiento para los pacientes que sufren de al menos un episodio IF a la semana (moderada a grave), y que no responde a terapias conservadoras o a la TBR13,95. Las indicaciones para la SNS incluyen: IF idiopática sin lesión esfinteriana, pacientes con IF e IU, lesiones perineales postobstétricas (desgarros del esfínter anal o neuropatía del pudendo) e IF de origen neurológico, ya sea central o periférico107. Al parecer la estimulación sacra mejora los reflejos medulares somato/simpáticos, pero también tiene cierto efecto a nivel central, mejorando la plasticidad neuronal108. Dado que los resultados de la reparación quirúrgica de la IF muestran un deterioro durante un seguimiento de 5 años, la SNS se ha sugerido como una alternativa válida o un complemento de la reparación quirúrgica en el tratamiento de la IF en pacientes que presentan una lesión del esfínter109.
Este tratamiento estimula los nervios sacros de forma permanente a través de un electrodo implantado en contacto con el nervio que sale del agujero sacro. El dispositivo está configurado en 2 etapas. La primera etapa, llamada evaluación de los nervios periféricos, es un período de prueba. De 2 a 3 semanas, el electrodo se implanta, cerca de la raíz S3, y se vincula a un estimulador externo. En esta etapa los parámetros de estimulación se ajustan (frecuencia e intensidad) hasta obtener los efectos deseados. La segunda etapa, implica la implantación definitiva de un generador de impulsos debajo de la piel, se realiza solo si el paciente tiene una reducción del 50% de los episodios de IF con la primera etapa. En general, de acuerdo con una revisión reciente de la literatura, la SNS parece ser eficaz en aproximadamente el 60-70% de los pacientes que sufren de IF que han fallado al manejo conservador110. En el meta análisis en red más reciente se encontró que la SNS mejoró la puntuación de incontinencia, mejora la capacidad para diferir la defecación, produce una mejoría en la mayoría de los dominios SF-36 y FIQL, y mejores presiones anales medias111. El efecto terapéutico persiste en el tiempo, a pesar de una reducción del 10% en la eficacia durante los primeros 5 años. Los eventos adversos más comunes son dolor e infección en el sitio de inserción que ocurre hasta en el 10% de los pacientes.
Esta terapia de neuroestimulación está disponible en nuestro país, y una limitante es su elevado costo. Sin embargo, en otros países ha demostrado ser costo/benéfica112. En términos de costo-beneficio, la SNS puede variar dependiendo de varios factores, como el costo del procedimiento, la efectividad del tratamiento y los resultados individuales de cada paciente. Algunos estudios han demostrado que la SNS puede ser efectiva para mejorar los síntomas en ciertos casos, lo que podría resultar en una mejora significativa en la calidad de vida de los pacientes. Sin embargo, es importante tener en cuenta que la SNS no es la primera línea de tratamiento. Por lo general, se recomienda después de que otras opciones de tratamiento más conservadoras, como cambios en la dieta, fisioterapia o medicamentos, no hayan sido efectivas. Además, el costo del procedimiento, que incluye la cirugía para implantar el dispositivo y su mantenimiento a largo plazo, puede ser significativo.
En general, el costo/beneficio de la SNS debe ser evaluado individualmente. Es importante considerar factores como la gravedad de los síntomas, los resultados esperados, los costos involucrados y las opciones de tratamiento alternativas antes de tomar una decisión informada sobre la elección del tratamiento.
La neuroestimulación del tibial posterior (transcutánea, percutánea) representan una opción que pudiera ser útil en algunos pacientes con incontinencia fecalEstimulación percutáneaFuerza de la recomendación: débil a favor
Calidad de la evidencia: C2
Acuerdo alcanzado: el 100% totalmente de acuerdo.
Estimulación transcutáneaFuerza de la recomendación: débil a favor
Calidad de la evidencia: D2
Acuerdo alcanzado: el 100% totalmente de acuerdo.
Es una técnica sencilla, no invasiva y poco costosa. Existen dos métodos de estimulación: percutánea, usando electrodos de agujas, y transcutánea utilizando electrodos de superficie adhesivas. Se colocan dos electrodos en la vía nerviosa del tibial posterior, y se conectan a un neuroestimulador que puede ser controlado por el paciente. El mecanismo implicado en el tratamiento sigue siendo poco conocido, pero sin duda implica inferencias acerca de que la estimulación mejora o afecta reflejos somato/simpáticos. A pesar de que hay solo unos pocos estudios publicados con resultados, esta técnica (percutánea) se describe que reduce los episodios de IF entre el 63 al 82% de los pacientes tratados, con un seguimiento que va de uno a 30 meses113,114. La evidencia con estimulación transcutánea no muestra diferencia en comparación con placebo115. De acuerdo con los meta-análisis más recientes95 la estimulación percutánea del nervio tibial posterior es eficaz para reducir el número medio de episodios de IF por semana, sin embargo, la gravedad y la calidad de vida no son significativamente diferentes cuando se compara con placebo. Además, aunque los estudios muestran una reducción significativa en los episodios de IF por semana, el estudio que tiene el mayor tamaño de muestra falló para demostrar que esta terapia reduce en más del 50% los episodios de IF por semana. Esto debería ser tomado en cuenta, en caso de optar por esta terapia. Además, hasta el momento, no existe un consenso en relación con la duración del tratamiento, la estimulación de frecuencia / ritmo o la necesidad de repetir el tratamiento. Sin embargo, esta técnica puede ser recomendada para pacientes que no responden a las otras técnicas no invasivas o que sufren de IF.
La neuroestimulación magnética translumbosacra pudiera ser útil en algunos pacientes con incontinencia fecalFuerza de la recomendación: débil a favor
Calidad de la evidencia: D2
Acuerdo alcanzado: el 100% totalmente de acuerdo.
El advenimiento de la prueba de estimulación magnética anorrectal translumbosacra (TAMS) que utiliza estimulación magnética mínimamente invasiva de los plexos nerviosos lumbares y sacros para registrar los potenciales evocados motores (MEP) anales y rectales ha permitido una mejor detección de neuropatía en pacientes con IF75. Utilizando este mismo dispositivo y partiendo de la hipótesis que la terapia de neuroestimulación magnética translumbar repetitiva (TNMT) en una o más frecuencias podrían mejorar significativamente los síntomas de IF a través de producir neuroplasticidad, el grupo del Dr. Rao ha explorado la eficacia de esta intervención116. En el estudio piloto, los autores incluyeron a 31 pacientes que fueron aleatorizados para recibir 6 sesiones de tratamientos TNMT semanales que consistían en 600 estimulaciones magnéticas repetitivas en cada uno de los 2 sitios lumbares y 2 sacros con una frecuencia de 1, 5 o 15Hz. Se compararon los diarios de heces, los índices de gravedad de la IF, la neurofisiología anorrectal y la función sensoriomotora y la calidad de vida (QOL). Los resultados fueron positivos ya que se demostró que esta terapia mejora significativamente los síntomas de IF a corto plazo, y la frecuencia de 1Hz fue en general mejor que 5 y 15Hz. Tanto la neuropatía anorrectal como la fisiología mejoraron significativamente. Así pues, este representa ser un tratamiento prometedor, novedoso, seguro, eficaz y no invasivo para la IF. El mecanismo de acción propuesto es que puede mejorar la excitabilidad neural periférica como la central117.
Tratamiento quirúrgicoLos pacientes con IF grave que han fallado al tratamiento médico o con grandes defectos del esfínter son los que se benefician del tratamiento quirúrgico. Sin embargo, la evaluación preoperatoria cuidadosa y detallada para determinar la etiología de la IF es la piedra angular en la selección de dichos pacientes. A continuación, se mencionan los enunciados respecto al tratamiento quirúrgico.
La esfinteroplastia es el mejor tratamiento quirúrgico para la reparación de defectos estructurales recientes (lesiones >90°, pero <150°) en los pacientes con incontinencia fecalFuerza de la recomendación: fuerte a favor
Calidad de la evidencia: C1
Acuerdo alcanzado: el 88.2% totalmente de acuerdo y el 11.8% parcialmente de acuerdo.
La esfinteroplastia (reparación quirúrgica en donde los extremos separados del esfínter son juntados o superpuestos y suturados juntos para que cicatricen) demuestra resultados buenos a excelentes en la mayoría de los pacientes que presentan una masa residual muscular adecuada118. Habitualmente si existen defectos mayores a 150 grados es difícil poder realizar esta técnica. El éxito con este procedimiento varía entre el 35-70%119. A pesar de que el 70-80% de los pacientes reportan mejoría inicial, a largo plazo la mejoría disminuye hasta un 50%. Las tasas de complicaciones postoperatorias son generalmente bajas y se reporta más comúnmente infección de la herida del 6 al 35%118. Dentro de los factores que deben tomarse en cuenta para asegurar un resultado exitoso están: a) que exista integridad neuromuscular (incluyendo integridad de los nervios pudendos) y contracción voluntaria clínicamente detectable; b) si ha fallado la reparación primaria, debe esperarse un mínimo de tres meses antes de intentar una segunda esfinteroplastia; c) no debe resecarse el tejido cicatricial de los músculos dañados; d) no deben separarse el esfínter interno y externo, y e) no es necesaria una colostomía protectora.
Aunque los esfínteres artificiales, los bio-esfínteres y la inyección de células madre representan opciones prometedoras, siguen siendo terapias en evaluación, por lo que no se puede emitir una recomendaciónFuerza de la recomendación: —
Calidad de la evidencia: D
Acuerdo alcanzado: el 82.4% totalmente de acuerdo, el 11.8% parcialmente de acuerdo y el 5.9% incierto.
Recientemente se ha descrito el uso de un esfínter anal magnético que se compone de un sistema de perlas magnéticas que crea una presión negativa alrededor de las estructuras que las rodea, en este caso del esfínter anal120. El dispositivo está hecho de bolas magnéticas unidas por hilos de titanio, durante la defecación, las perlas se separan, permitiendo el paso de las heces. En 2012, Wong et al.120 informaron los resultados de un estudio no aleatorizado mostrando ser tan eficaz como la estimulación del nervio sacro en la mejora de los síntomas y calidad de vida. Por otra parte, la morbilidad fue similar con ambas técnicas. A largo plazo la eficacia de esta intervención se reporta que es de cerca del 50%; sin embargo, a pesar de que los resultados son prometedores, la eficacia del esfínter anal magnético debe ser confirmada en estudios más amplios y con mejores diseños metodológicos121.
Una terapia innovadora (terapia regenerativa) descrita recientemente es el uso de células madre derivadas de músculo o de tejido adiposo que se inyectan directamente en el esfínter122. Del 2017 a la fecha, hay 3 estudios que han evaluado esta terapia y demuestran que el número medio de episodios de IF por semana es menor que el placebo en las primeras 4 semanas, pero el efecto se va perdiendo a lo largo de las siguientes semanas123–125. Aunque los hallazgos son prometedores, son necesarios más y mejores estudios al respecto.
Otra técnica que también lleva décadas en desarrollo es la implantación peri-anal de un esfínter diseñado mediante bioingeniería126. El proceso de desarrollo de un esfínter anal bioingenierizado generalmente implica el cultivo de células especializadas en el laboratorio y su posterior incorporación en una matriz estructural que proporciona un soporte físico para las células y permite su crecimiento y diferenciación en un tejido funcional similar al esfínter anal. Es importante tener en cuenta que los esfínteres anales bioingenierizados aún se encuentran en etapas de desarrollo y no están ampliamente disponibles como opción de tratamiento. La investigación en este campo continúa y se están llevando a cabo estudios clínicos para evaluar la seguridad y eficacia de estos dispositivos.
En los pacientes con incontinencia fecal severa que no respondieron a otros tratamientos, se sugiere un estoma terminal, ya que representa una buena opción que evita complicaciones y mejora la calidad de vidaFuerza de la recomendación: débil a favor
Calidad de la evidencia: C2
Acuerdo alcanzado: el 94.1% totalmente de acuerdo y el 5.9% parcialmente de acuerdo.
La derivación fecal mediante la creación de una colostomía o ileostomía ofrece un tratamiento definitivo para la IF en pacientes que han fracasado o no son aptos para tratamientos conservadores, particularmente en pacientes con daño en la médula espinal. A pesar de las implicaciones estéticas y del pensamiento popular, en muchos pacientes la calidad de vida mejora significativamente después de este procedimiento. En un estudio ejemplar, el 83% de 69 sujetos sintieron que un estoma restringía su vida «un poco» o «nada», mientras que 84% «probablemente» o «definitivamente» escogerían tener un estoma (comparado al tratamiento previo); aún más, la satisfacción global con el estoma fue calificada como 9/10127. Sin embargo, esta opción debe de individualizarse, p, ej., en pacientes con lesiones neurológicas graves sin duda esta puede ser una buena opción. Esta decisión debe ser conjunta con el paciente y sus cuidadores y debe de considerarse la morbimortalidad asociada a este procedimiento.
Otras terapiasOtras intervenciones no consideradas en los enunciados por su eficacia limitada, evidencia controversial y uso en situaciones especiales se mencionan a continuación.
La irrigación transanal (ITA) se recomienda en pacientes que sufren de enfermedades neurológicas crónicas graves (como sección medular) como terapia adyuvante de segunda además de las medidas dietéticas y tratamiento médico128. El objetivo es vaciar el colon mediante el riego regular, esto logrado mediante el uso de un catéter que tiene un balón rectal inflable para formar un sistema hermético. Este método mejora la IF, entre el 40 y el 75% de los pacientes que sufren de enfermedades neurológicas crónicas128. También ayuda a mejorar la calidad de vida de los pacientes, aumentando su independencia, y parece disminuir el riesgo de IU. Sin embargo, este tratamiento solo puede funcionar si el paciente y su familia están comprometidos. Basado en el mismo principio que la ITA, el riego anterógrado (procedimiento de Malone) tiene como objetivo restaurar la continencia al mantener el colon vacío. El procedimiento consiste en realizar una cecostomía y colocar una sonda que permita a los pacientes llevar a cabo irrigaciones del colon por ellos mismos. Con esta técnica entre el 80 y el 90% de los pacientes reportan tener una «pseudo» continencia, sin embargo, algunas de las complicaciones obligan a explantar del dispositivo129. Este método también ha demostrado ser eficaz cuando se combina con un esfínter urinario artificial en pacientes que sufren de incontinencia doble. Incluso en la actualidad se ha descrito la realización de cecostomías por vía endoscópica con resultados similares, aunque son necesarios más estudios respecto a esta novedosa técnica129.
Si el esfínter anal está gravemente dañado, se puede construir un neo-esfínter mediante del reforzamiento del esfínter existente con músculo esquelético autólogo, frecuentemente el músculo gracilis (graciloplastia dinámica) y/o los glúteos, acompañada de neuroestimulación. El éxito de estos procedimientos varía entre el 42 y el 85%, siendo los eventos adversos más comunes la infección (28%), mal funcionamiento del estimulador (15%) y dolor en las piernas (13%). En la actualidad ya no se recomienda este procedimiento130.
ConclusionesEn el presente consenso, se han emitido recomendaciones para el apropiado diagnóstico y tratamiento de la IF en México. Se reconoce que la IF es una entidad frecuente y cuya incidencia se incrementa conforme aumenta la edad, sin embargo, es poco reconocida. La fisiopatología de la incontinencia es compleja y multifactorial y en la mayoría de los casos existe más de un factor de riesgo asociado. Respecto al diagnóstico, se considera que, si bien no existe un estándar de oro, la combinación de pruebas que evalúen la estructura (p,. ej., ultrasonido endoanal) y la función (manometría anorrectal) se debe de recomendar en todos los casos. El tratamiento debe ser también multidisciplinario y se recomiendan medidas generales, fármacos (lidamidina, loperamida, colestiramina) y en casos seleccionados intervenciones no farmacológicas como la TBR. De igual manera, el tratamiento quirúrgico debe ofrecerse a pacientes seleccionados y brindado por expertos.
Responsabilidades éticasDebido a que este es un documento de consenso, basado en la mejor evidencia científica publicada, y no se trata de un estudio de investigación sobre pacientes, no aplicó el solicitar a los pacientes el consentimiento informado para recibir el tratamiento para participar en la investigación.
No se realizó experimento alguno en animales y/o humanos.
Dada la naturaleza descriptiva del documento y al ser un documento de posición de la asociación, no se requirió de la autorización de ningún comité de ética.
Los autores declaran que este artículo no contiene información personal que permita identificar a los pacientes.
FinanciaciónEste consenso se realizó con el apoyo de la Asociación Mexicana de Gastroenterología que permitió la participación, transportación y hospedaje durante la votación presencial. No se recibieron honorarios.
Conflicto de interesesDr. José María Remes-Troche y el Dr. Enrique Coss-Adame han sido ponentes para Medtronic. Los demás autores no reportan conflicto de intereses relacionados con la escritura del presente trabajo.