La colangiopancreatografía retrógrada endoscópica (CPRE) está asociada con la generación de respuesta inflamatoria aguda, la melatonina tiene una variedad de efectos inmunomoduladores y antioxidantes probados de manera experimental en patología pancreatobiliar.
ObjetivoEl objetivo del estudio fue evaluar los efectos de la administración periprocedimiento de melatonina sobre la respuesta inflamatoria y peroxidación lipídica asociada a la realización de CPRE.
MétodosEn este ensayo clínico se incluyó a 37 pacientes con riesgo alto de coledocolitiasis, se aleatorizaron para recibir melatonina o placebo periprocedimiento (CPRE). Se midió la concentración sérica de factor de necrosis tumoral alfa (FNT-alfa), interleucina-6 (IL-6), factor de crecimiento endotelial vascular (FCEV), peroxidación lipídica, amilasa y pruebas de funcionamiento hepático 24 h antes y después del procedimiento.
ResultadosNo encontramos diferencia entre las concentraciones séricas de FNT alfa (melatonina: 153.8 vs. 149.4ng/mL; placebo: 103.5 vs. 107.3ng/mL), IL-6 (melatonina: 131.8 vs. 133.3ng/mL; placebo: 177.8 vs. 197.8ng/mL) y FCEV (melatonina: 157.3 vs. 157.8pg/mL; placebo: 97.3 vs. 97.8pg/mL), o en peroxidación lipídica (melatonina: 39.2 vs. 72.3μg/mL; placebo: 66.4 vs. 90.5μg/mL) preprocedimiento vs. posprocedimiento en ninguno de los 2 grupos (p>0.05). Posterior a la CPRE, los niveles de aspartato aminotransferasa, alanina aminotransferasa y bilirrubina total disminuyeron significativamente solo en el grupo de melatonina (p<0.05). La administración de melatonina es segura y tolerada.
ConclusionesLa melatonina es segura y tolerada en pacientes que van a CPRE, pero no parece afectar las concentraciones de citocinas proinflamatorias o peroxidación lipídica en humanos.
Endoscopic retrograde cholangiopancreatography (ERCP) is associated with an acute inflammatory response and melatonin has a variety of immunomodulatory and antioxidant effects studied experimentally in pancreatobiliary pathology.
AimsThe aim of our study was to evaluate the effects of peri-procedural administration of melatonin on the inflammatory response and lipid peroxidation associated with ERCP.
MethodsIn this proof-of-concept clinical trial, 37 patients with a high probability of choledocholithiasis were randomized to receive peri-procedure (ERCP) melatonin or placebo. We measured the serum concentration of tumor necrosis factor-alpha (TNF-alpha), interleukin-6 (IL-6), vascular endothelial growth factor (VEGF), lipid peroxidation, amylase, and liver function tests 24h before and after the procedure.
ResultsWe found no pre-procedure or post-procedure differences between the melatonin group or the placebo group (P>.05) in the serum concentrations of TNF-alpha (melatonin: 153.8 vs. 149.4ng/m; placebo: 103.5 vs. 107.3ng/ml), IL-6 (melatonin: 131.8 vs. 133.3ng/ml; placebo: 177.8 vs. 197.8ng/ml), or VEGF (melatonin: 157.3 vs. 157.8pg/ml; placebo: 97.3 vs. 97.8pg/ml), or in relation to lipid peroxidation (melatonin: 39.2 vs. 72.3μg/ml; placebo: 66.4 vs. 90.5μg/ml). After ERCP, a significant decrease in the AST, ALT, and total bilirubin levels was found only in the melatonin group (P<.05). The administration of melatonin was safe and tolerable.
ConclusionsMelatonin is safe and tolerable in patients undergoing ERCP, but it does not appear to affect inflammatory cytokine concentrations or lipid peroxidation.
La pancreatitis aguda (PA) es una complicación temida de la colangiopancreatografía retrógrada endoscópica (CPRE) que puede darse hasta en un 30% de pacientes de alto riesgo1,2. Los factores de riesgo establecidos para la pancreatitis post-CPRE incluyen edad joven, sexo femenino, historial de pancreatitis post-CPRE, disfunción del esfínter de Oddi, tiempo de canulación>10min y pasaje de la guía o del medio de contraste al conducto pancreático2,3. Se han propuesto como mecanismos potenciales responsables de la pancreatitis post-CPRE el espasmo del esfínter, edema, lesión enzimática, infección o la manipulación mecánica2,3. El desarrollo de un estado inflamatorio agudo y la activación de citocinas podrían modular estos mecanismos y contribuir a una lesión pancreática. La CPRE ha sido considerada como un modelo útil para el estudio de la respuesta de la fase aguda en la PA3,4. Después de la CPRE, son comunes las elevaciones de amilasa y citocinas inflamatorias, como el factor de necrosis tumoral alfa (FNT-alfa) y la interleucina-6 (IL-6), y podrían predecir el desarrollo de PA4-6. Se ha establecido en estudios experimentales que estas citocinas, así como un estado de estrés oxidativo, contribuyen a la patofisiología de PA7,8.
Los ensayos clínicos han demostrado que la colocación de un stent en el conducto pancreático y la terapia farmacológica con fármacos antiinflamatorios no esteroideos pueden reducir la incidencia de pancreatitis post-CPRE9,10. Se han estudiado distintos agentes como candidatos potenciales para la modulación de la respuesta inflamatoria y el estrés oxidativo asociados con la CPRE10,11. Sin embargo, la búsqueda para alternativas seguras y eficaces sigue siendo un campo de investigación activo.
La melatonina es una indolamina endógena multifuncional producida en la glándula pineal, clásicamente asociada con la regulación del ritmo circadiano. Su administración en humanos es segura y bien tolerada12. Los estudios clínicos y experimentales han mostrado que la melatonina tiene potentes efectos antiinflamatorios y antioxidantes, modulando el FNT-alfa, la IL-6 y la producción de radicales libres13-15. Adicionalmente, una buena cantidad de evidencia experimental indica que la melatonina puede reducir la lesión pancreática, la inflamación sistémica y el estrés oxidativo en modelos de animales de PA16,17.
El objetivo de este estudio fue investigar los efectos de la melatonina en la hiperamilasemia inducida post-CPRE y las elevaciones en los marcadores inflamatorios y de estrés oxidativo.
Materiales y métodosPacientes y procedimientosEl ensayo clínico fue aleatorizado, doble ciego y controlado con placebo. Se aprobó el protocolo de estudio por el comité de ética local y todos los participantes firmaron un formulario de consentimiento informado de acuerdo con la Declaración de Helsinki. Incluimos a 37 pacientes consecutivos que fueron ingresados al Hospital Universitario Dr. José E. González de la Universidad Autónoma de Nuevo León en el plazo de marzo a julio del 2013 con sospecha de coledocolitiasis y programados para la CPRE.
Se sospechó de coledocolitiasis al presentarse los pacientes con dolor abdominal superior y manifestaciones clínicas (p. ej., fiebre, ictericia), un patrón colestásico de lesión hepática, dilatación del conducto biliar común (CBC) (> 6mm) o visualización de lito o litos en el CBC en el ultrasonido transabdominal. Los sujetos del estudio fueron identificados al ser ingresados por residentes de gastroenterología, basados en evaluaciones de las variables clínicas, radiológicas y bioquímicas.
Los criterios de inclusión eran edad mayor de 18 años y una alta probabilidad de coledocolitiasis en el momento de ingreso, de acuerdo con el criterio de la American Society for Gastrointestinal Endoscopy 201018. Los criterios de exclusión incluyeron a pacientes que tenían síndrome de respuesta inflamatoria sistémica (definido por la presencia de 2 o más criterios: frecuencia cardiaca>90 latidos/min, temperatura<36 o>38°C, conteo de glóbulos blancos<4,000 o>12,000/mm3, una frecuencia respiratoria>20min), PA o pancreatitis no resuelta, colangitis, tener un historial de cualquier enfermedad reumatológica o inflamatoria, pacientes embarazadas o que estén amamantando, pacientes con un historial de sensibilidad a la melatonina, o aquellos con un historial de intubación orotraqueal y ventilación mecánica.
Se llevaron a cabo las CPRE por un gastroenterólogo con experiencia y que desconoció la asignación de los pacientes. La indicación para la CPRE en todos los pacientes era tener una alta probabilidad de coledocolitiasis. Se diagnosticó y calificó el desarrollo de pancreatitis siguiendo los criterios de consensos publicados9. El puntaje para el riesgo de la CPRE para pancreatitis post-CPRE se obtuvo utilizando una herramienta validada que fue publicada por Friedland et al.19 Para todos los procedimientos, bajo una inducción de midazolam y sedación por propofol, se utilizaron un procesador de video de alta resolución Pentax EPK-1000 (NJ, EE. UU.) y un duodenoscopio Pentax ED-3430 TK (NJ, EE. UU.) con un esfinterotomo de triple luz Wilson, Cook Medical Inc. (Winston, Salem, Carolina del Norte, EE. UU). Se realizó una esfinterotomía en todos los pacientes.
Se recolectaron muestras sanguíneas de los pacientes elegibles sometidos a la CPRE 24h antes (basal) y 24h después del procedimiento. Se almacenaron las muestras séricas a −70°C hasta su análisis. Se administró la melatonina (10mg) sublingualmente en 14 pacientes en 5 dosis (cada dosis separada por 8h), comenzando 10h antes del procedimiento y hasta 24h después del procedimiento de la CPRE (una dosis total de 50mg). Otro grupo de 16 pacientes recibió el placebo correspondiente y funcionó como el grupo control.
Pruebas de laboratorioLas pruebas de función hepática (PFH), amilasa, FNT-a, IL-6, factor de crecimiento endotelial vascular (FCEV) y peroxidación lipídica se midieron en las muestras sanguíneas de todos los pacientes. Las PFH y amilasa se midieron utilizando métodos bioquímicos estándar. Los niveles séricos de FNT-alfa, IL-6 y FCEV se midieron a través de las valoraciones de inmunosorbentes ligados a enzimas de acuerdo con las instrucciones del fabricante (Pre-ProTech México; ELISA ASYS Hitech GmbH Expert Plus UV G020151). La peroxidación lipídica se midió utilizando un kit de ensayo colorimétrico (método TBARS, Cayman Chemicals, Ann Arbor, Michigan 48108, EE. UU.), el cual expresa la peroxidación lipídica como concentraciones de malondialdehído (MDA).
La hiperamilasemia asintomática se definió como un valor posprocedimiento arriba del límite normal superior (LNS) de nuestro laboratorio (100 UI) si el valor preprocedimiento era normal, o como cualquier incremento si el valor preprocedimiento estaba arriba del LNS y si no habían síntomas de PA.
Métodos estadísticosEl criterio de valoración primario fue determinar los efectos de la melatonina en la hiperamilasemia inducida post-CPRE y las elevaciones en los marcadores inflamatorios y de estrés oxidativo. El desenlace secundario fue determinar la ocurrencia de complicaciones post-CPRE y el efecto sobre las enzimas hepáticas entre los grupos.
Se empleó un procedimiento aleatorizado restringido para controlar la probabilidad de obtener una secuencia de asignación con un desequilibrio de tamaño de muestra no deseado en los grupos de intervención. Se utilizó bloqueo, empleando una relación de uno a uno hasta que se alcanzó un total de 40 individuos, para asegurar que los grupos fueran del mismo tamaño. Un individuo externo no involucrado en el cuidado de los pacientes del ensayo clínico y no presente en el lugar del estudio fue responsable para la asignación y preparación del medicamento y sus contenedores. Se utilizaron contenedores numerados secuencialmente, sellados y opacos para transportar los fármacos. Todos los contenedores eran inalterables, con peso idéntico y apariencia similar. Una enfermera se encargó de administrar el medicamento. El medicamento consistió en píldoras blancas de 5mg con tamaño, forma, textura y sabor similares. Los pacientes que participaron en el ensayo, los proveedores de atención médica y aquellos que evaluaron los resultados desconocían la asignación de la intervención. No se hicieron cambios a los métodos una vez comenzado el ensayo clínico.
Análisis estadísticoTodos los análisis estadísticos se valoraron utilizando el programa SPSS (SPSS versión 17.0; SPSS Inc., Chicago, EE. UU.). Se realizaron comparaciones estadísticas entre los grupos utilizando la prueba t de Student (cuando las variables se encontraban distribuidas de manera normal), la prueba U de Mann-Whitney (para variables distribuidas en forma anormal) o la prueba de Wilcoxon (2 muestras relacionadas), conforme fuese requerido. Otras variables categóricas (reportadas como el porcentaje de la frecuencia de ocurrencia), como sexo, hiperamilasemia y comorbilidades se compararon utilizando la prueba de la χ2. Todos los parámetros fueron expresados como la media±desviación estándar o la mediana y el rango intercuartílico (RIC), como fuera necesario. Se consideró estadísticamente significativo un valor p<0.05.
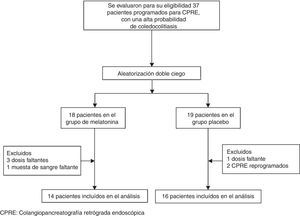
ResultadosPacientesDe marzo del 2013 a julio del 2013, se evaluó para su elegibilidad a 37 pacientes con una alta probabilidad de coledocolitiasis y programados para CPRE (fig. 1). Se excluyó a 7 pacientes y los 30 pacientes elegibles restantes con alta probabilidad de coledocolitiasis fueron incluidos. El grupo de melatonina consistió de 14 pacientes con una edad promedio de 35.3±17.3 años y 12 (85.7%) de ellos eran mujeres. El grupo placebo estaba conformado de 16 pacientes con una edad promedio de 36.3±15.3 años y 14 (87.5%) de ellos eran mujeres. El resto de las características demográficas basales eran comparables entre los 2 grupos (tabla 1).
Características demográficas
| Grupo | Melatonina n=14 | Placebo n=16 | p |
|---|---|---|---|
| Edad, años | 35.3±17.3 | 36.3±15.3 | 0.86 |
| Mujeres (%) | 12 (85.7) | 14 (87.5) | 0.89 |
| IMC (kg/m2) | 25.3±4.8 | 27.3±6.6 | 0.25 |
| Comorbilidades | |||
| DM (%) | 2 (14.3) | 4 (25.0) | 0.47 |
| HT (%) | 2 (14.3) | 2 (12.5) | 0.89 |
| Stent pancreático (%) | 1 (7.1) | 2 (12.5) | 0.63 |
| Intentos de canulación | 2.1±1.2 | 2.1±1.3 | 0.90 |
| Coledocolitiasis (%) | 7 (50.0) | 8 (50.0) | 1.00 |
| Puntaje de riesgo CPRE | 2.6±2.7 | 1.7±1.8 | 0.37 |
La información se muestra en valores absolutos (%) y en media ± desviación estándar.
CPRE: colangiopancreatografía retrógrada endoscópica; DM: diabetes mellitus; HT: hipertensión; IMC: índice de masa corporal.
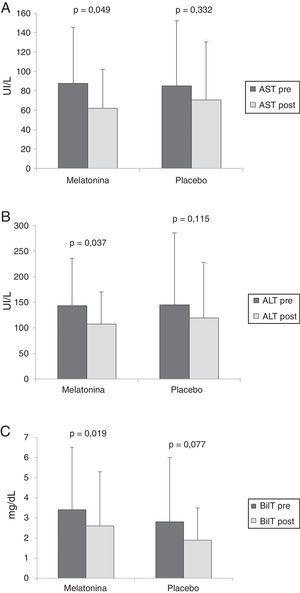
No hubo diferencia significativa entre los grupos de melatonina y placebo en los valores AST preprocedimiento (87.5±57.8 vs. 85.2±66.9 UI/L, p=0.924), ALT (143.4±91.9 vs. 144.8±140.8 UI/L, p=0.976) o bilirrubina total (3.4±3.1 vs. 2.8±3.1mg/dL, p=0.591). Después de 24h, se encontró una disminución significativa en los valores AST, ALT y bilirrubina total únicamente en el grupo de melatonina (fig. 2). Sin embargo, no hubo diferencia entre los grupos en los valores posprocedimiento de AST, ALT o bilirrubina total (p>0.05).
Pre-CPRE (barras oscuras) y post-CPRE (barras claras) valores AST (A), valores ALT (B) y valores BilT (C) en los grupos de melatonina y placebo.
Los resultados están expresados como media, con barras de errores representando la desviación estándar.
ALT: alanina aminotransferasa; AST: aspartato aminotransferasa; BilT: bilirrubina total.
Siete (43.7%) pacientes en el grupo placebo y 6 (42.8%) en el grupo de melatonina desarrollaron hiperamilasemia definida anteriormente, p=0.960. Se observó un incremento significativo en los valores de la mediana (RIC) de niveles de amilasa después de CPRE en ambos el grupo de melatonina (pre-CPRE 54.0 [23.7] vs. post-CPRE 87.0 [64.5], p=0.004) y el grupo placebo (pre-CPRE 101.0 [75.0] vs. post-CPRE 107.0 [125.0], p=0.008). Sin embargo, no se registró diferencia en los niveles de amilasa pre y post-CPRE entre los grupos (p>0.05).
Citocinas y peroxidación lípidicaLos resultados completos del FNT-alfa, IL-6 y peroxidación lipídica (MDA) se muestran en la tabla 2. No hubo diferencia en las concentraciones séricas entre los grupos pre o posprocedimiento en ninguno de los marcadores estudiados, a excepción de los valores FCEV, que fueron significativamente mayores en el grupo de melatonina comparado con el grupo placebo. Se encontró únicamente una tendencia hacia el incremento de MDA (p=0.09) al compararse los niveles pre y posprocedimiento en el grupo de melatonina.
Citocinas y peroxidación lipídica
| Grupo | Melatonina n=14 | Placebo n=16 | ||
|---|---|---|---|---|
| pre-ERCP n =14 | post-ERCP n =14 | pre-ERCP n=16 | post-ERCP n=16 | |
| TNF-alfa (ng/mL) | 153.8±11.3 | 149.4±12.1 | 103.5±53.4 | 107.3±53 |
| IL-6 (ng/mL) | 131.8±44.9 | 133.3±44.7 | 177.8±204.0 | 197.8±246.8 |
| MDA (μg/mL) | 39.2±16.8 | 72.3±50.8a | 66.4±66.3 | 90.5±78 |
| FCEV (pg/mL) | 157.3±36.5 | 157.8±39.4 | 97.3±45.9b | 97.8±47.9c |
La información se muestra en media ± desviación estándar.
CPRE: colangiopancreatografía retrógrada endoscópica; FCEV: factor de crecimiento endotelial vascular; FNT: factor de necrosis tumoral; IL: interleucina; MDA: malondialdeído.
Un paciente en el grupo placebo desarrolló pancreatitis post-CPRE. No se registraron efectos adversos menores o mayores relacionados con la melatonina o el placebo en este estudio.
DiscusiónEn nuestro conocimiento, este es el primer ensayo clínico prospectivo, aleatorizado, doble ciego y controlado por placebo que evalúa los efectos de la melatonina sobre la inflamación pancreática en humanos después de la CPRE. No encontramos diferencias en los cambios de mediadores inflamatorios a las 24h después de la CPRE con el uso de la melatonina. Un solo paciente desarrolló pancreatitis post-CPRE (en el grupo placebo), pero nuestro estudio no estuvo diseñado ni contó con poder suficiente para encontrar un efecto sobre esta variable. Los niveles séricos de AST, ALT y bilirrubina disminuyeron significativamente a las 24h en el grupo de melatonina y no en el grupo placebo, lo cual podría indicar un efecto hepatoprotector. Sin embargo, la diferencia fue pequeña y es de significación clínica incierta.
Durante la PA, un desequilibrio entre mediadores proinflamatorios y antiinflamatorios, liberación de las citocinas, y un estrés oxidativo incrementado participan como efectores de lesiones locales y sistémicas8,20. Estas alteraciones inflamatorias, así como diferentes grados de hiperamilasemia, también se asocian con CPRE y sus complicaciones relacionadas. En un estudio donde 70 pacientes son sometidos a CPRE hubo elevaciones séricas tempranas (dentro de las primeras 24h) de IL-6 y proteína C reactiva en aquellos pacientes que desarrollaron pancreatitis post-CPRE4. Otro estudio de 45 pacientes sometidos a la CPRE mostró resultados similares, con elevaciones tempranas de IL-6 y FNT-alfa, ocurriendo en pacientes con complicaciones6.
De acuerdo con la puntuación de Friedland et al.19, estudiamos a un grupo homogéneo de pacientes de bajo riesgo, bajo la suposición de que hasta en casos asintomáticos la estimulación de la cascada inflamatoria durante la CPRE podría ser el signo inicial responsable del desarrollo de complicaciones como la pancreatitis. Este paradigma podría ser utilizado para estudiar tanto la respuesta de la fase aguda como las intervenciones terapéuticas relevantes. En modelos experimentales que pudieron parcialmente mimetizar algunas de las alteraciones relacionadas con la CPRE, la ligación del ducto biliar indujo lesiones hepáticas colestásicas y un estrés oxidativo incrementado, y estos cambios fueron mejorados por la melatonina21. Sin embargo, en nuestro estudio no se observaron cambios relevantes en las concentraciones séricas de IL-6 y FNT-alfa después de la CPRE en ninguno de los 2 grupos. Encontramos niveles pre y posprocedimiento más bajos de FCEV en el grupo placebo, en comparación con el grupo de melatonina, pero ningún cambio dentro de los grupos, el cual podría ser atribuido a la CPRE o a un efecto de la melatonina. Se sabe que el FCEV sérico está incrementado en modelos experimentales en ratas22 y la melatonina podría incrementar la expresión de FCEV en la curación de una úlcera gástrica en un modelo de rata23. Sin embargo, ha sido mostrada la reducción en la expresión de FCEV a causa de melatonina en una variedad de células humanas, incluyendo células cancerígenas pancreáticas y hepáticas, haciendo poco probable un efecto dependiente de melatonina en nuestro estudio24,25. Una dosificación inadecuada y un único periodo de observación (24h posprocedimiento) podría también ser la causa de nuestros resultados negativos.
En nuestro estudio, las únicas variables que parecieron ser afectadas por la melatonina fueron la ALT, la AST y la bilirrubina total, que tuvieron una reducción en sus niveles posprocedimiento. Aunque especulamos con que las disminuciones en estos parámetros post-CPRE podrían indicar la resolución de una lesión hepatocelular inducida por colestasis, la significación clínica de este hallazgo es desconocida. Sin embargo, existen receptores de melatonina en el hígado y se ha mostrado que la administración de melatonina reduce la lesión hepatocelular inducida por colestasis, así como elevaciones de transaminasa y bilirrubina, en modelos experimentales de ligadura del conducto biliar26,27. Estudios de medición secuencial o la inclusión de pacientes de alto riesgo son necesarios para la confirmación de un beneficio biomecánico, si es que existe alguno.
La melatonina en dosis terapéuticas y fisiológicas actuando como un destructor de radicales libres reduce cada paso en la peroxidación lipídica y promueve la producción de antioxidantes endógenos. También reduce la producción de FNT-alfa, IL-6, prostaglandinas y óxido nítrico (NO)28. Estudios de toxicidad han mostrado que la melatonina exógena es segura y tolerable, sin efectos tóxicos o de limitante de dosis discernibles12. Se han publicado estudios clínicos que exploran las propiedades inmunomodulatorias de la melatonina. La melatonina podría reducir los niveles circulantes de NO y citocinas proinflamatorias en neonatos sépticos, cambios que fueron acompañados por desenlaces mejorados13. En pacientes adultos que fueron sometidos a cirugía aórtica, se asoció la melatonina perioperatoria con niveles reducidos de estrés oxidativo14. En nuestro estudio, no observamos efectos secundarios perianestésicos algunos ni somnolencia excesiva, y concluimos que la administración de melatonina era segura y tolerable, de acuerdo con otros estudios en humanos que utilizaron dosis similares29.
Nuestros resultados negativos son sorprendentes teniendo en cuenta la evidencia indirecta disponible. Se ha propuesto un papel fisiológico para la melatonina en la función pancreática. Existen receptores de melatonina en el tejido pancreático y la melatonina puede modular la secreción y el flujo sanguíneo17. En modelos experimentales, los efectos protectores de la melatonina son mayores por la noche, correspondiendo al ritmo circadiano y a niveles endógenos más altos de melatonina30. Adicionalmente, un estudio reciente mostró que niveles bajos de melatonina endógena en pacientes con PA se correlacionaron con un aumento en la severidad de la enfermedad31. También hay estudios que indican que la melatonina puede ser pancreoprotectora. Qi et al. fueron los primeros en mostrar que la melatonina podría reducir lesiones de tejidos en un modelo experimental de PA inducida por ceruleína en ratas16. El incremento en los niveles endógenos de melatonina llevó a la disminución de la severidad de PA inducida por ceruleína, así como disminuciones de FNT-alfa32. Se ha mostrado que el suplemento de melatonina induce una disminución en lesiones de tejido, marcadores inflamatorios y fallo multiorgánico en otros modelos de animales de PA, tales como la administración de L-arginina33, lesión por isquemia pancreática con reperfusión34, ligadura del conducto pancreático35 y administración de taurocolato36. La reducción en la producción de radicales libres, peroxidación lipídica y lesión mitocondrial, y los incrementos en antioxidantes endógenos, tales como la glutatión, también han sido demostrados en modelos de PA después de la administración de melatonina37. Otros estudios sobre PA también han mostrado modulación en la producción de FNT-alfa e IL-6 por melatonina38. La melatonina parece ser pancreoprotectora a través de la modulación de múltiples vías inflamatorias. Sin embargo, no encontramos evidencia de que la melatonina pueda modular la producción de citocinas inflamatorias o la peroxidación lipídica en el contexto de la CPRE.
Las limitaciones presentes en el diseño de nuestro estudio podrían explicar esta discrepancia, tales como dosis única, tamaño de muestra pequeña, medición única de variables bioquímicas y los criterios de valoración bioquímicos (en vez de criterios de valoración clínicos, tales como pancreatitis post-CPRE). La melatonina sí parece ser segura y tolerable (no se reportaron sucesos adversos o somnolencia excesiva) en pacientes sometidos a CPRE, pero no encontramos un efecto significativo de la melatonina en concentraciones de citocinas inflamatorias o peroxidación lipídica en la dosis estudiada. No se conoce la significación de los efectos aparentemente benéficos en las transaminasas y bilirrubinas. Se requiere de ensayos clínicos mayores utilizando distintas dosis y periodos de evaluación, así como poblaciones diferentes (de alto riesgo), para determinar si la melatonina puede reducir la incidencia de pancreatitis post-CPRE o la severidad de PA.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que los procedimientos seguidos se conformaron a las normas éticas del comité de experimentación humana responsable y de acuerdo con la Asociación Médica Mundial y la Declaración de Helsinki.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores han obtenido el consentimiento informado de los pacientes y/o sujetos referidos en el artículo. Este documento obra en poder del autor de correspondencia.
FinanciamientoNo se recibió patrocinio de ningún tipo para llevar a cabo este estudio/artículo.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.