El 50% de las hemorragias del intestino delgado son causadas por angiectasias del intestino delgado (AID) y la tasa de recurrencia es del 80%. Su tratamiento endoscópico es difícil. Algunos estudios han informado efectos beneficiosos del octreótido en angiectasias del tubo digestivo, pero ninguno ha evaluado su eficacia en las AID.
ObjetivoInvestigar la efectividad del octreótido en la prevención de la recurrencia hemorrágica de las AID.
Material y métodosDieciséis pacientes con sangrado por AID fueron asignados a un tratamiento con octreótido 100μg/24h SC por al menos 6 meses. Esta cohorte se comparó con un grupo de 36 pacientes no tratados. El desenlace primario fue la tasa de recurrencia hemorrágica y los secundarios fueron el número de reingresos hospitalarios, muerte relacionada con el sangrado, y efectos adversos.
ResultadosSe administró octreótido durante 10.5±8.4 meses. El seguimiento fue de 12.9±17.3 y 15.3±17.7 meses en pacientes tratados y no tratados (p=0.09). Al final del seguimiento, el sangrado recurrente se produjo en 4 (25%) pacientes del grupo tratado y en 26 (72.2%) del grupo no tratado (p=0.002). La probabilidad acumulada de permanecer libre de hemorragia recurrente al año fue del 79% vs. 44.2% y a los 2 años, del 79% vs. 34.6% en el grupo tratado y no tratado, respectivamente (p=0.05). De acuerdo con el análisis de regresión logística múltiple, el tratamiento fue variable protectora. Los eventos adversos ocurrieron en 6 pacientes. En uno de ellos fueron eventos mayores (6.25%).
ConclusionesEstos resultados sugieren que el tratamiento con octreótido podría ser eficaz para prevenir las hemorragias recurrentes por AID.
Fifty percent of small bowel bleeding is caused by angioectasia and the rebleeding rate due to small bowel angioectasia (SBA) is 80%. Its endoscopic treatment is difficult. Beneficial effects of octreotide on gastrointestinal angioectasia have been described, but no studies have reported its efficacy in SBA.
AimOur aim was to investigate the effectiveness of octreotide in the prevention of rebleeding due to SBA.
Material and methodsSixteen patients with bleeding caused by SBA were assigned to treatment with octreotide 100μg/24h SC, for at least 6 months, and compared with a non-treatment group of 36 patients. The primary outcome was the rebleeding rate, and the secondary outcomes were the number of hospital readmissions, bleeding-related death, and adverse effects.
ResultsOctreotide was administered for 10.5±8.4 months. Follow-up was 12.9±17.3 months and 15.3±17.7 months, in the treatment and non-treatment groups, respectively (p=0.09). At the end of follow-up, 4 (25%) treatment group patients and 26 (72.2%) non-treatment group patients presented with rebleeding (p=0.002). In the treatment group and non-treatment group, the cumulative probability of remaining rebleeding-free at one year was 79% vs 44.2%, and 79% vs 34.6% at 2 years, respectively (p=0.05). Through the multiple logistic regression analysis, treatment was the protective variable. Six patients presented with adverse events. One of those patients (6.25%) had a major adverse event.
ConclusionsOur results suggest that treatment with octreotide could be efficacious in the prevention of rebleeding due to SBA.
Las angiectasias gastrointestinales (AGI) son malformaciones vasculares compuestas por capilares arteriales o venosas dilatadas y tortuosas, usualmente menores de 5mm de diámetro y localizadas en la mucosa y la submucosa del tracto gastrointestinal1.
Las angiectasias pueden ocurrir en cualquier segmento del tracto digestivo, pero son más frecuentes en el intestino delgado (57 a 80%), en particular en el duodeno y en el yeyuno, seguidas del colon (44%) y el estómago (32%)2,3. Son responsables del 5% de todas las hemorragias gastrointestinales y del 50% de las hemorragias de intestino delgado4. La recurrencia hemorrágica es muy frecuente (80%). La mayoría de los pacientes se vuelven dependientes de transfusiones sanguíneas y de infusiones de hierro parenterales y presentan un deterioro significativo en su calidad de vida5.
El tratamiento actual es muy diverso debido a la falta de lineamientos terapéuticos. La coagulación con argón plasma endoscópica (CAP) es el tratamiento más común6. La angiografía selectiva con embolización y la resección quirúrgica son utilizadas solo en casos selectos, especialmente cuando el tratamiento endoscópico falla o existe inestabilidad hemodinámica7.
El diagnóstico y tratamiento de las angiectasias de intestino delgado (AID) es difícil debido a la inaccesibilidad. Frecuentemente, las lesiones son múltiples y están distribuidas de manera difusa8,9. Los resultados a largo plazo de la terapia endoscópica no son los deseables10,11. En una revisión sistemática de 24 artículos que involucra a 490 pacientes con AGI que recibieron tratamiento endoscópico, se encontró una tasa de recurrencia hemorrágica similar a la de pacientes sin tratamiento12. En consecuencia, se han explorado tratamientos que produzcan efectos sistémicos en las angiectasias.
Recientemente, medicamentos con actividad antiangiogénica, como la talidomida13,14, y análogos de la somatostatina, como el octreótido de liberación inmediata y el octreótido de liberación prolongada (octreótido-LAR), han sido utilizados15–20. Se ha sugerido que el tratamiento con octreótido es beneficioso para reducir la recurrencia hemorrágica a mediano y largo plazo en AGI. Sin embargo, casi todos los estudios que se han publicado hasta el momento son análisis no comparativos, de pocos pacientes, y ninguno de ellos ha evaluado la eficacia del octreótido, especialmente en pacientes con AID.
Lo antes mencionado nos llevó a realizar un estudio en pacientes con hemorragia secundaria a AID, para evaluar de manera prospectiva los efectos sobre la recurrencia hemorrágica del tratamiento con octreótido versus sin tratamiento.
Materiales y métodosPacientesSe incluyó en el estudio a pacientes referidos a nuestra unidad, entre enero de 2012 y enero de 2018, con hemorragia aguda o crónica debido a AID, y diagnosticados por medio de videocápsula endoscópica (VCE). La angiectasia fue definida como la presencia de una o múltiples lesiones, de forma irregular o en forma de estrella, con una superficie plana y un diámetro mayor de 2mm. Los criterios endoscópicos para definir la angiectasia hemorrágica fueron la presencia de lesiones con hemorragia activa, lesiones con estigma de hemorragia reciente o la ausencia de otras fuentes potenciales de hemorragia. Las angiectasias fueron clasificadas como segmentarias, cuando se localizaban en un segmento del intestino delgado, diseminadas, cuando se localizaban en más de un segmento y como únicas o múltiples, cuando una o más lesiones eran encontradas, respectivamente. Con base en las características endoscópicas, las angiectasias fueron clasificadas utilizando un método propuesto anteriormente por nuestro grupo, Tipo 1: lesiones con hemorragia activa no pulsátil; Tipo 2: lesiones sin hemorragia activa, pero con estigma de hemorragia reciente manifestada como úlcera central, coágulo adherente o detrito de sangre adyacente; Tipo 3: lesiones parcheadas de color rojo brillante; Tipo 4: lesiones parcheadas de color rojo pálido1.
Las historias médicas de los pacientes fueron revisadas y seleccionamos a pacientes adultos con hemorragia gastrointestinal aguda o crónica, anemia (definida por niveles de hemoglobina en plasma <10g/dL y niveles de hierro en suero <60μg/dL), con necesidad de transfusiones sanguíneas o infusiones de hierro parenteral y sangre visible u oculta en heces y en quienes el último episodio hemorrágico hubiese sucedido menos de una semana anterior a la realización de VCE. Fueron excluidos los pacientes con procedimientos incompletos de VCE, sin seguimiento documentado o angiectasias en el estómago o el colon; pacientes tratados con talidomida, CAP, angiografía selectiva con embolización o cirugía; pacientes con diabetes mellitus de difícil tratamiento (glucosa en sangre >140mg/dL o HbAlc>7%) o colecistolitiasis asintomática; además de pacientes que se negaron a participar en el estudio.
TratamientoLos pacientes del estudio fueron hospitalizados y posteriormente dados de alta y divididos en dos grupos. Un grupo fue conformado por los pacientes tratados con administración subcutánea (SC) de octreótido 100μg/24h. Cada ampolleta multidosis de octreótido contenía 1mg/5ml. El medicamento fue administrado al paciente ambulatorio y el paciente o un familiar recibieron instrucciones para su aplicación. El otro grupo consistió en pacientes que no recibieron tratamiento y fue utilizado para la comparación. Dichos pacientes no fueron tratados debido a la decisión de su médico referente o debido a que el medicamento no estaba disponible en sus lugares de residencia.
SeguimientoEl seguimiento fue llevado a cabo a lo largo de visitas subsecuentes al hospital de forma mensual durante 6 meses, después cada 3 a 6 meses, hasta el final del estudio, el cual fue determinado por recurrencia hemorrágica, efectos adversos mayores, muerte, pérdida de seguimiento o exclusión del análisis.
Se realizaron exámenes clínicos y pruebas de sangre (hemoglobina sérica, hematocritos, glucosa, creatinina, hierro y pruebas de función hepática) en cada visita. Cuando los pacientes no asistieron a su consulta fueron contactados por teléfono.
DesenlacesEl desenlace principal fue la recurrencia hemorrágica, definida como la presencia de al menos uno de los siguientes parámetros: disminución de hemoglobina >2g/dL en comparación con los valores de línea de base; sangre visible en heces; necesidad de transfusión sanguínea (niveles séricos Hb<8g/dL) y necesidad de hierro parenteral (hematocritos <25%).
Los desenlaces secundarios fueron el número de reingresos hospitalarios, muerte relacionada con hemorragia, cumplimiento de tratamiento y efectos adversos mayores y menores.
La recurrencia hemorrágica y la tolerancia al medicamento fueron consideradas para evaluar la efectividad del tratamiento.
Análisis estadísticoLas variables continuas fueron expresadas como medias y desviaciones estándar y las variables discontinuas como medianas, rangos y proporciones relativas. Las diferencias entre los grupos fueron analizadas utilizando la prueba t de Student para las variables cuantitativas, y la prueba de chi cuadrada y la prueba exacta de Fisher para las variables no cuantitativas. La probabilidad acumulativa de permanecer libre de recurrencia hemorrágica fue calculada por medio de la curva de Kaplan-Meier y las diferencias fueron analizadas por medio de la prueba de Mantel-Cox.
Se utilizó el método de regresión logística multivariada proporcional (regresión de Cox), para determinar las variables predictivas independientes de la recurrencia hemorrágica. Se calcularon los intervalos de confianza al 95% y un valor de p de dos colas ≤0.05 fue considerado estadísticamente significativo. El análisis estadístico se realizó utilizando el paquete estadístico SSPS versión 25.0.
Consideraciones éticasEl protocolo fue aprobado por el Comité de Ética de la Facultad de Medicina de la Universidad Autónoma de Nuevo León. Se obtuvo el consentimiento informado de todos los pacientes y el estudio no fue financiado por ninguna industria farmacéutica.
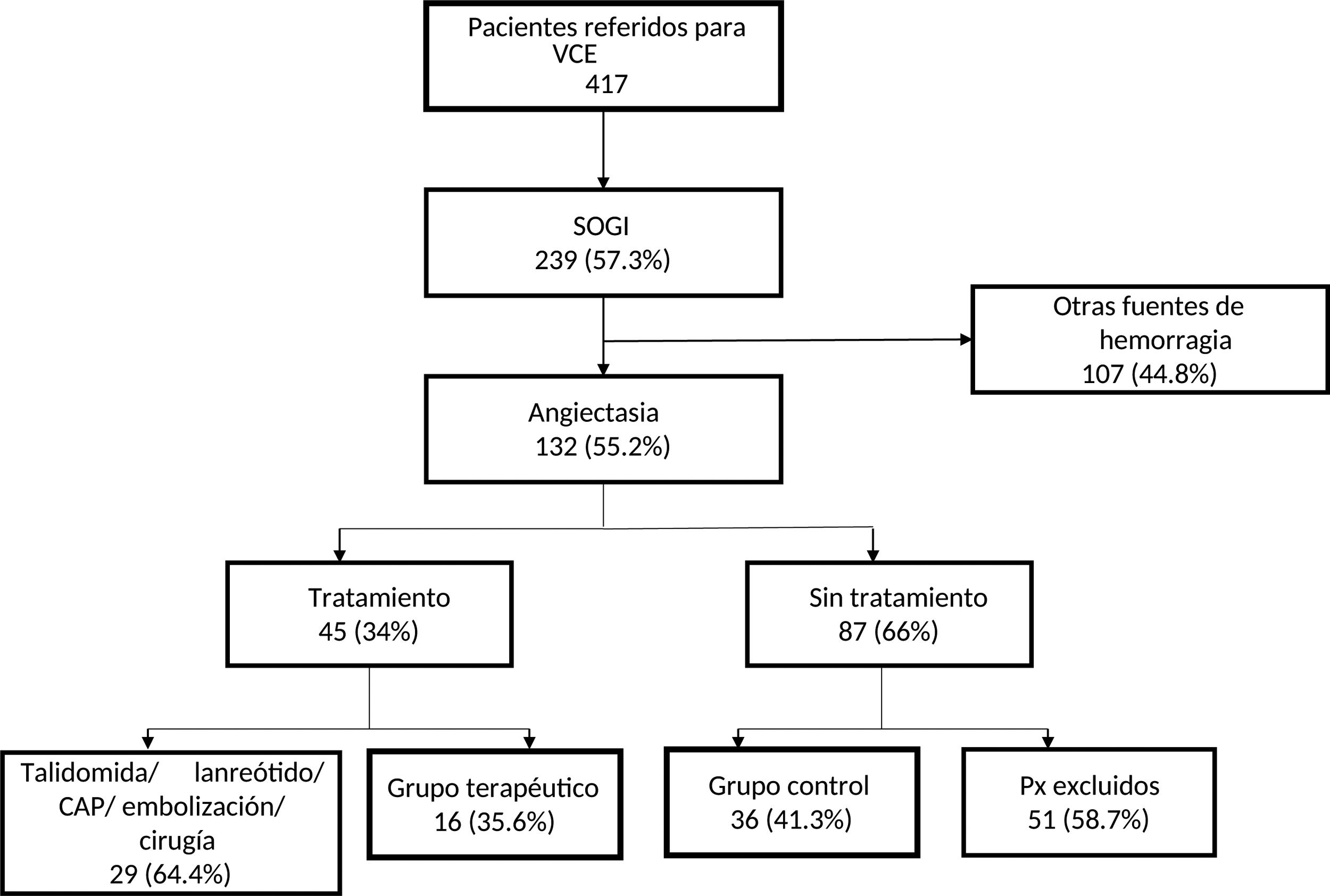
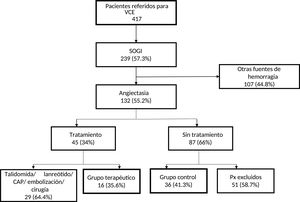
ResultadosPacientesDe los 132 pacientes con AID, 16 fueron asignados a tratamiento con octreótido de liberación inmediata; 36 pacientes sin tratamiento fueron utilizados como grupo control. Los 80 pacientes restantes no fueron incluidos, por alguna de las siguientes razones: 29 habían recibido otros tratamientos (talidomida, lanreótido, CAP, angiografía selectiva con embolización o resección quirúrgica) y 51 pacientes sin tratamiento no cumplieron los criterios de inclusión o no tuvieron seguimiento (fig. 1). Sin embargo, los pacientes excluidos eran demográfica y clínicamente similares a los que participaron en el estudio.
Características de los pacientesLa edad promedio de los pacientes con tratamiento fue ligeramente mayor que la de los individuos sin tratamiento (73.5±13.3 vs. 66.1±6.6 años, respectivamente). No existieron diferencias significativas entre los dos grupos respecto al sexo, número de individuos >70 años, el tiempo de evolución de hemorragia y sus manifestaciones clínicas, y la cantidad y tipo de comorbilidades. Las características endoscópicas de las angiectasias también fueron similares (tabla 1). El octreótido fue administrado durante un tiempo medio de 10.5±8.4 meses (rango 6-24 meses).
Características demográficas y clínicas de los pacientes previamente a la inclusión en el estudio
| Características | Grupo controln=36 | Grupo tratamienton=16 | Valor p* |
|---|---|---|---|
| Edad | 66.1±13.3 [42-95] | 73.5±6.6 [64-84] | 0.01 |
| >70 años | 15 (42.8) | 10 (62.5) | 0.16 |
| Mujeres | 20 (55.6) | 8 (50) | 0.38 |
| Comorbilidades | |||
| Enfermedad renal crónica | 2 (5.6) | 1 (6.3) | 0.67 |
| Enfermedad hepática crónica | 1 (2.8) | 0 | 0.69 |
| Enfermedad valvular cardiaca | 0 | 0 | 1 |
| Enfermedad isquémica cardiaca | 7 (19.4) | 3 (18.8) | 0.63 |
| Diabetes mellitus | 10 (27.8) | 6 (37.5) | 0.52 |
| Uso de AINE/medicamentos antiplaquetarios | 10 (27.8) | 3 (18.8) | 0.73 |
| Más de una comorbilidad | 16 (44.4) | 11 (68.7) | 0.10 |
| Características clínicas hemorrágicas previas al VCE | |||
| Tiempo de evolución | 29.1±38.9 [1-186] | 28.3±31.1 [2-108] | 0.47 |
| Sangrado visible | 20 (55.6) | 11 (68.8) | 0.54 |
| Niveles de hemoglobina en plasma (g/dL) | 6.72±1.76 | 6.9±2.1 | 0.69 |
| Número de pacientes con transfusión | 29 (80.6) | 13 (81.3) | 0.63 |
| Número de unidades de sangre transfundida/paciente | 4.4±4.7 | 3.8±4.3 | 0.38 |
| Número de pacientes con transfusión de hierro IV | 14 (38.9) | 10 (62.5) | 0.14 |
| Número de EGD/pacientes | 2±1.6 | 1.6±0.7 | 0.94 |
| Número de colonoscopías/paciente | 1.5±1.4 | 1.3±0.4 | 0.79 |
| Hallazgos VCE | |||
| Múltiples lesiones | 36 (100) | 16 (100) | 1.0 |
| Distribución difusa | 13 (36.1) | 6 (37.5) | 0.58 |
| Tipo 1 | 7 (19.4) | 2 (12.5) | 0.70 |
| Tipo 2 | 4 (11.1) | 4 (25) | 0.23 |
| Tipo 3 | 16 (44.4) | 8 (50) | 0.76 |
| Tipo 4 | 9 (25) | 2 (12.5) | 0.46 |
AINE: medicamentos antiinflamatorios no esteroides; EGD: esofagogastroduodenoscopía; IV: intravenoso; VCE: videocápsula endoscópica.
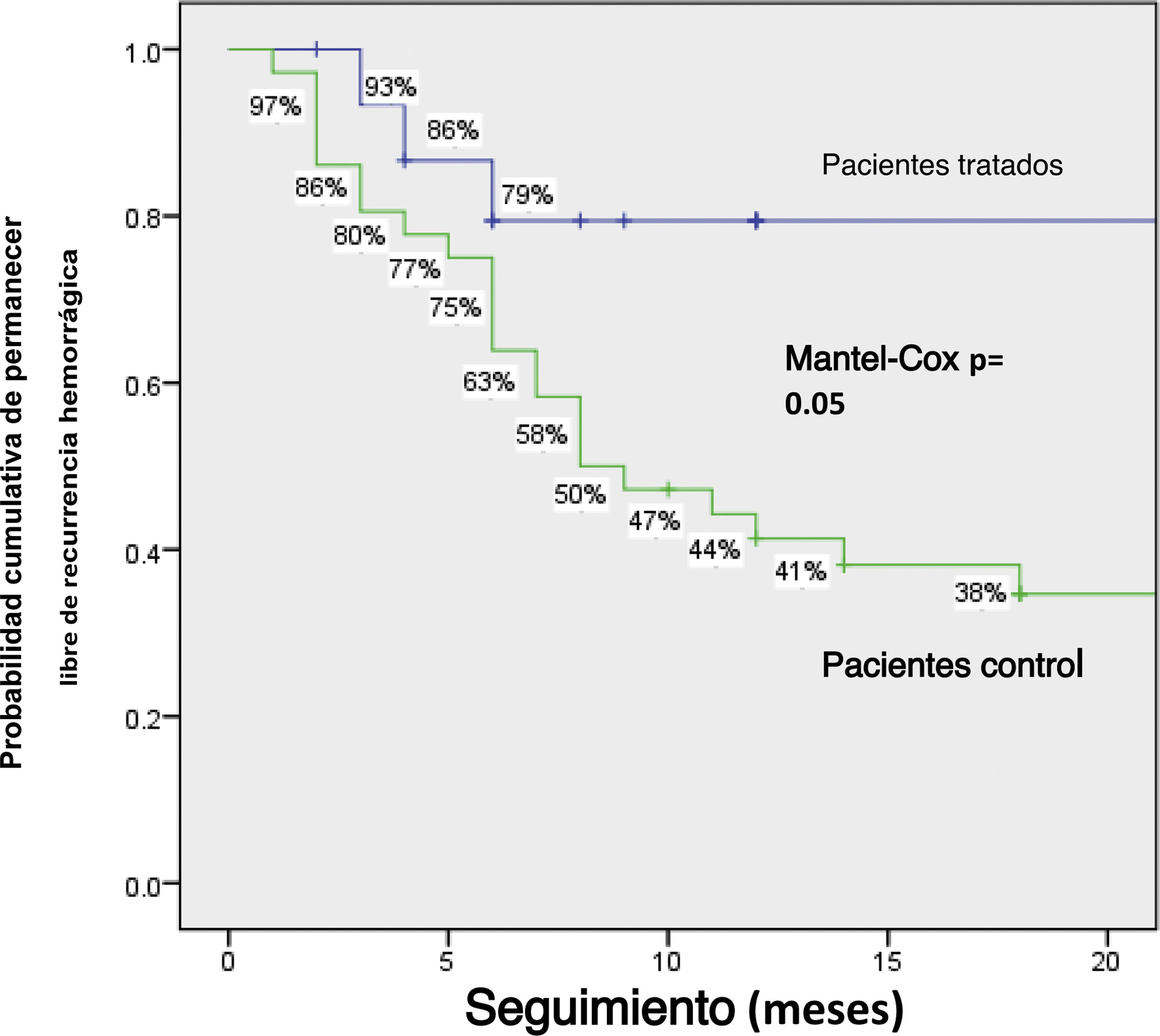
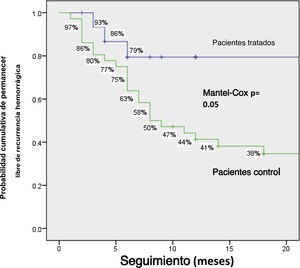
En total, los pacientes tratados tuvieron tasas de recurrencia hemorrágica menores que los pacientes sin tratamiento: 4/16 (25%) vs. 26/36 (72.2%), p=0.002, respectivamente. Los pacientes tratados presentaron menor reducción de hemoglobina en suero (25% vs. 58.3%, p=0.037), menor necesidad de transfusión sanguínea (6.3% vs. 38.9%, p=0.021) y menos reingresos hospitalarios (6.3% vs. 36.1%, p=0.04). No existieron diferencias significativas entre los dos grupos respecto a la presencia de sangre visible en heces, necesidad de hierro parenteral o muertes relacionadas con hemorragia (tabla 2). La probabilidad acumulativa de permanecer libre de hemorragias en la comparación entre el grupo con tratamiento y el grupo sin tratamiento a 1año fue del 79% vs. 44.2%, y 79% vs. 34.6% a 2años, respectivamente (p=0.05) (fig. 2).
Características de la recurrencia hemorrágica
| Manifestación de la recurrencia hemorrágica | Grupo controln=36 | Grupo tratamienton=16 | Valor p* |
|---|---|---|---|
| Duración de tratamiento, en meses | 10.5±8.4 [6-24] | ||
| Seguimiento, en meses | 15.3±17.7 [1-78] | 12.9±17.3 [6-75] | 0.09 |
| Tasa de recurrencia hemorrágica | 26 (72.2) | 4 (25.0) | 0.002 |
| Disminución en Hb >2g/dL | 21 (58.3) | 4 (25.0) | 0.037 |
| Sangrado visible | 8 (22.2) | 1 (6.3) | 0.245 |
| Necesidad de transfusión sanguínea | 14 (38.9) | 1 (6.3) | 0.021 |
| Necesidad de infusión de hierro | 12 (33.3) | 3 (18.8) | 0.340 |
| Reingresos hospitalarios | 13 (36.1) | 1 (6.3) | 0.040 |
| Muerte | 3 (8.3) | 0 | 0.544 |
Los análisis de regresión logística múltiple mostraron que el tratamiento con octreótido fue protector contra la recurrencia hemorrágica (CR: 0.013, IC 95% 0.001-0.235, p=0.003) (tabla 3).
Análisis de regresión proporcional multivariada de las variables predictoras independientes de la recurrencia hemorrágica
| Variable | CR | IC 95% | Valor p |
|---|---|---|---|
| Edad | 0.894 | 0.774-1.033 | 0.129 |
| Índice de masa corporal | 0.856 | 0.679-1.080 | 0.190 |
| Comorbilidades | |||
| Enfermedad renal crónica | 0.063 | 0.001-4.069 | 0.193 |
| Enfermedad cardiaca | 2.008 | 0.159-25.365 | 0.590 |
| Uso de AINE/medicamentos antiplaquetarios | 0.425 | 0.040-4.563 | 0.480 |
| Más de una comorbilidad | 1.097 | 0.059-20.389 | 0.951 |
| Características clínicas | |||
| Número de unidades transfundidas/paciente | 0.994 | 0.797-1.241 | 0.960 |
| Número de pacientes con infusión de hierro IV | 2.282 | 0.359-14.513 | 0.382 |
| Videocápsula endoscópica | |||
| Manchas irregulares rojo brillante | 0.322 | 0.040-2.559 | 0.284 |
| Manchas irregulares rojo pálido | 0.230 | 0.024-2.210 | 0.203 |
| Tratamiento con análogos de la somatostatina | 0.013 | 0.001-0.235 | 0.003 |
AINE: antiinflamatorios no esteroides; CR: cociente de riesgo; IC: intervalo de confianza; IV: intravenoso.
La adherencia al tratamiento fue del 100%. En 6 pacientes ocurrieron eventos adversos (37.5%). Estos fueron menores y transitorios en 5 de dichos pacientes (diarrea en 2, cefalea en 2 y dolor abdominal leve en 1) y mayor en un caso (6.25%) (dolor abdominal intratable, 4 meses posteriores a iniciado el tratamiento), lo cual forzó la suspensión del tratamiento. Este paciente no presentó hemorragia gastrointestinal, pero la terapia fue considerada fallida, con respecto al análisis, por lo que la efectividad total resultante del tratamiento fue de 11/16 (68.7%).
Discusión y conclusionesLos resultados del presente estudio sugieren que el octreótido redujo la recurrencia hemorrágica debida a AID. En total, el 25% de los pacientes tratados presentaron recurrencia hemorrágica, en comparación con el 72.2% del grupo control (p=0.002). La probabilidad acumulativa a 1 y 2 años de permanecer libre de recurrencia hemorrágica fue significativamente más alta en los pacientes con tratamiento, a pesar del hecho de que eran de mayor edad que los pacientes sin tratamiento. Además, el análisis de regresión logística múltiple mostró que el tratamiento con octreótido fue protector en contra de la hemorragia. Los datos sugieren que el octreótido también fue efectivo en sujetos mayores, lo cual es relevante, dado que dichos individuos son más afectados por la AID.
Los resultados de nuestro estudio confirman los de otros reportes publicados (tabla 4)15–24. En un estudio no comparativo que incluyó a 17 pacientes tratados con 300μg/d de octreótido, SC, por 6 meses, se observó que el 82.3% de dichos pacientes tuvieron una reducción significativa en tratamientos para anemia15. En otros estudios, dosis de 10 a 20mg/mes de octreótido-LAR, IM, por 3 a 12 meses, produjeron una respuesta completa en el 50 a 70% de los pacientes, definida como una disminución en episodios hemorrágicos, en niveles bajos de hemoglobina en sangre, en necesidad de transfusiones y en el número de hospitalizaciones17–20,25. En un estudio reciente de doble ciego de fase II, aleatorizado y no comparativo, la administración de 60mg de pasireotida (un análogo de la somatostatina con afinidad por el receptor de somatostatina 5, 40 veces mayor que el octreótido), IM, cada mes, disminuyó significativamente la necesidad de transfusiones en pacientes con hemorragia recurrente debida a AID, en comparación con placebo26.
Estudios prospectivos y controlados que evalúan la eficacia de análogos de la somatostatina en pacientes con hemorragia gastrointestinal debido a angiectasia
| Autor (año) | Diseño | N | Tratamiento | Seguimiento (meses) | Resultados |
|---|---|---|---|---|---|
| Nardone et al. (1999)15 | Cohorte | 17 | Octreótido SC 100μg/8h por 6 meses | 12 | Las tasas de respuesta completa, respuesta parcial y sin respuesta fueron del 59%, 23% y 18%. Sin efectos secundarios significativos |
| Junquera et al. (2007)16 | Cohortes,Rx vs. P | 65 (Rx: 30 vs. C: 35) | Octreótido SC 50μg/12h por 12-24 meses | 13 (12-36) | Recurrencia hemorrágica: Rx=23% vs. C=48% (p=0.04). Efectos adversos mayores: Rx=3.1% vs. P=2.6% |
| Scaglione et al. (2007)17 | Cohorte | 13 | Octreótido IM 10mg/mes por 12 meses | 33 (12-60) | Las tasas de respuesta completa, respuesta parcial y sin respuesta fueron del 69%, 8% y 23%. Sin efectos secundarios significativos |
| Molina et al. (2009)18 | Cohorte | 11 | Octreótido IM 20mg/mes | 15 (5-48) | Pacientes con comorbilidades graves. El tratamiento disminuyó la necesidad de transfusiones y hospitalizaciones relacionadas con hemorragia |
| Bon et al. (2012)19 | Cohorte | 15 | Octreótido IM 20mg/mes por 12 meses | 14 (10-36) | Rx disminuyó significativamente las recurrencias hemorrágicas, la necesidad de transfusiones e incrementó los niveles séricos de Hb. Efectos secundarios raros |
| Holleran et al. (2016)20 | Cohorte | 24 | Octreótido IM 20mg/meses por 3 meses | 8 (3-17) | Las tasas de respuesta completa, respuesta parcial y sin respuesta fueron del 70%, 20% y 10%, respectivamente. Eventos adversos, 30% |
| Benamouzig et al. (2018)26 | DCANC | 22 (Rx: 10 vs. P: 12 | Pasireotida-LAR 60mg/mes por 6 meses | 6 (6-12) | Rx disminuyó significativamente la necesidad de transfusiones. Rx=83% vs. P=25% |
| Presente estudio | Cohortes,Rx vs. No Rx | 52 (Rx: 16 vs. C: 36) | Octreótido SC 100μg/díaDuración Rx: 10.5±8.4 meses | 10.5 (1-78) | Recurrencia hemorrágica: Rx=25% vs. C=72.2% (p=0.002). Efectos adversos mayores: Rx=10.5%. Efectividad general: 68.4% |
C: controles; DCANC: doble ciego, aleatorizado, no comparativo; Hb: hemoglobina; IM: intramuscular; LAR: siglas en inglés de acción prolongada (long-acting release); P: placebo; Rx: tratamiento; SC: subcutánea.
A pesar de que se han publicado numerosos estudios terapéuticos sobre el octreótido en pacientes con angiectasias, la mayoría de ellos no son comparativos o tienen un número pequeño de pacientes. Un estudio comparativo realizado por Junquera et al., similar al nuestro, incluyó a 65 pacientes con AID. Treinta pacientes fueron tratados con dosis bajas de octreótido (50μg/12h), SC, por un periodo de un año, y 35 pacientes recibieron placebo. Demostraron una reducción de recurrencia hemorrágica en los pacientes tratados (23% vs. 48%, p=0.043) y la tolerancia al medicamento fue buena16.
De manera importante, el nuestro es el primer estudio que se refiere exclusivamente a la hemorragia causada por AID, lo cual es relevante por las siguientes razones: a) el intestino delgado es el sitio más común de las angiectasias en el tracto digestivo (57-80%); b) las lesiones son frecuentemente múltiples y distribuidas en segmentos grandes del intestino; c) la recurrencia hemorrágica es más alta, en comparación con las angiectasias en otros segmentos digestivos (80%); d) la mayoría de las lesiones son inaccesibles para terapia endoscópica27. Muchos pacientes se han vuelto dependientes de transfusiones sanguíneas e infusiones de hierro parenteral y han tenido múltiples reingresos hospitalarios, con lo que su calidad de vida se deteriora significativamente. Por lo tanto, los tratamientos con un efecto sistémico son altamente necesarios.
El octreótido y el lanreótido son análogos de somatostatina, y se piensa que tienen múltiples efectos farmacológicos que involucran la fisiopatología de las angiectasias. Tienen efectos hemodinámicos en la circulación esplácnica, produciendo una reducción en la presión portal y en el flujo sanguíneo mesentérico28. También inhiben la angiogénesis al bloquear factores bioquímicos que promueven la proliferación vascular, como VEGF, b-FGF e IGF1k29–31. Estimulan la relajación del músculo intestinal, lo cual lleva a una disminución de la obstrucción crónica de las venas submucosas32,33. La desaparición o la reducción de tamaño de las angiectasias ha sido reportada durante el tratamiento con octreótido15.
El octreótido es altamente resistente a la degradación enzimática y tiene una prolongada vida media plasmática en humanos34. En el presente estudio, las dosis bajas de octreótido parecieron ser efectivas. El efecto benéfico podría ser atribuido a alguna de las múltiples acciones descritas anteriormente que ejerce sobre las angiectasias. La dosis utilizada en el estudio de Junquera et al., que es similar a la que utilizamos en nuestro estudio, fue reportada como efectiva16. Utilizamos una dosis baja para reducir los costos de tratamiento dado que el octreótido es costoso en México. Además, no incrementamos la dosis de octreótido en pacientes con recurrencia hemorrágica. El incremento en la dosis podría haber rescatado algunos de los pacientes que no respondieron. En general, el medicamento fue bien tolerado. La mayoría de los eventos adversos fueron transitorios y la suspensión del tratamiento fue necesaria solamente en un caso.
El octreótido requiere de administración SC diaria, lo cual podría dificultar la adherencia al tratamiento. Sin embargo, el octreótido-LAR (de acción prolongada) administrado IM cada mes puede resolver esta desventaja.
Las limitaciones de nuestro estudio incluyen el hecho de que fue un estudio en un solo centro; no fue un ensayo controlado aleatorizado; no se utilizó placebo y las evaluaciones no fueron ciegas; el tamaño de la muestra fue pequeño, con seguimiento insuficiente en algunos de los pacientes tratados. Sin embargo, en nuestra opinión, la fuerza del desenlace primario (recurrencia hemorrágica) hace a los resultados confiables.
En conclusión, los resultados de nuestro estudio sugieren que el octreótido es efectivo para prevenir la recurrencia hemorrágica debida a AID. El medicamento fue bien tolerado y estuvo asociado con una disminución de reingresos hospitalarios relacionados con hemorragia. Las bajas dosis de octreótido utilizadas en nuestro estudio podrían incrementar la adherencia al tratamiento, resultando en menos eventos adversos y, en consecuencia, reduciendo los costos de la terapia. Sin embargo, los ensayos controlados, multicentro, aleatorizados, de doble ciego y con muestras grandes de pacientes son necesarios para confirmar la efectividad terapéutica en ese contexto. La razón costo-beneficio y el impacto en la calidad de vida también deben ser evaluados.
FinanciaciónNo se recibió financiación con relación al presente estudio/artículo.
Conflicto de interesesLos autores declaran no tener conflicto de intereses.