El estreñimiento crónico idiopático (ECI) impacta de manera negativa la calidad de vida e incrementa los costos de los sistemas de salud. La lubiprostona estimula la secreción de fluido intestinal, lo cual facilita el paso de las heces y alivia síntomas asociados. La lubiprostona ha estado disponible en México desde 2018, pero su eficacia clínica no ha sido estudiada en una población mexicana.
ObjetivoEvaluar la eficacia de la lubiprostona, por medio de la observación de los cambios en la frecuencia de evacuaciones espontáneas completas (EEC), después de una semana de tratamiento con 24μg de lubiprostona oral dos veces al día, al igual que su seguridad, después de cuatro semanas de tratamiento.
EstudioEstudio aleatorizado, doble ciego, controlado con placebo, en 211 adultos con ECI en México.
ResultadosEl incremento de frecuencia de EEC tras una semana de tratamiento fue significativamente más alto en el grupo de lubiprostona que en el grupo placebo (media: 4.9 [DE: 4.45] vs. 3.0 [3.14], p=0.020). Los criterios de valoración secundarios de eficacia revelaron una proporción significativamente más alta de frecuencia EEC/semana en el grupo lubiprostona a las semanas 2, 3 y 4. Hubo una mejor respuesta dentro de 24 horas de la primera dosis de lubiprostona vs. placebo (60.0% vs. 41.5%; OR: 2.08 [IC95%: 1.19, 3.62], p=0.009), y el grupo de lubiprostona también presentó mejoría significativa respecto al pujo, la consistencia de las heces, la inflamación abdominal y el índice de satisfacción. Los principales eventos adversos fueron trastornos gastrointestinales en 13 (12.4%) de los sujetos tratados con lubiprostona y 4 (3.8%) de los sujetos control.
ConclusionesNuestros datos confirman la eficacia y la seguridad de la lubiprostona para el tratamiento del ECI en una población mexicana. El tratamiento con lubiprostona induce alivio de los síntomas más molestos asociados con la constipación.
Chronic idiopathic constipation (CIC) negatively impacts quality of life and increases healthcare costs. Lubiprostone stimulates the secretion of intestinal fluid, in turn facilitating the passage of stools and alleviating associated symptoms. Lubiprostone has been available in Mexico since 2018, but its clinical efficacy has not been studied in a Mexican population.
AimTo evaluate the efficacy of lubiprostone, assessed by changes in spontaneous bowel movement (SBM) frequency after one week of treatment with 24μg oral lubiprostone (b.i.d.), as well as its safety, over four weeks of treatment.
StudyRandomized, double-blind, placebo-controlled study on 211 adults with CIC in Mexico.
ResultsThe increase in SBM frequency, after one week of treatment, was significantly higher in the lubiprostone group than in the placebo group (mean: 4.9 [SD: 4.45] vs. 3.0 [3.14], P=.020). Secondary efficacy endpoints revealed a significantly higher proportion of SBM frequency/week in the lubiprostone group at weeks 2, 3, and 4. There was a better response within 24hours after the first dose with lubiprostone vs. placebo (60.0% vs. 41.5%; OR: 2.08, [95%CI: 1.19, 3.62], P=.009) and the lubiprostone group also had significant improvement, with respect to straining, stool consistency, abdominal bloating, and satisfaction index. The main adverse events were gastrointestinal disorders in 13 (12.4%) lubiprostone-treated subjects and 4 (3.8%) control subjects.
ConclusionsOur data confirm the efficacy and safety of lubiprostone for the treatment of CIC in a Mexican population. Lubiprostone treatment induces relief from the most bothersome symptoms associated with constipation.
El estreñimiento crónico idiopático (ECI) es definido como el paso infrecuente o difícil de heces, con síntomas asociados como distensión abdominal e incomodidad, pujo al defecar y heces duras o escíbalos. Para realizar el diagnóstico de ECI se deben descartar condiciones incidentes que pudieran explicar los síntomas, como una dieta baja en fibra, un estilo de vida sedentario, fármacos (en particular analgésicos opiáceos y antidepresivos anticolinérgicos) y trastornos metabólicos, neuromusculares e intestinales, al igual que presión abdominal baja o atonía muscular1,2. En el ECI los síntomas se presentan en parte por una motilidad colónica anormal que retrasa el tránsito del contenido intestinal y evita el vaciado rectal. La prevalencia de constipación es altamente variable (del 2% al 30%) y depende de muchos factores, incluida la ubicación geográfica, la etnicidad, el sexo, el estatus socioeconómico y los criterios de diagnóstico utilizados3. En México se reporta que el 14.4% de la población adulta sufre de constipación crónica4. El impacto que el ECI tiene en la calidad de vida es evidente, al igual que los costos asociados a la condición. Actualmente, muchas terapias farmacológicas están disponibles para tratar el ECI y se puede considerar su utilización en conjunto con modificaciones alimentarias y de estilo de vida. Los laxantes osmóticos (polietilenglicol y lactulosa), los estimulantes (bisacodilo y picosulfato de sodio), los agentes serotoninérgicos (tegaserod, prucaloprida) y los agentes prosecretores (secretagogos, como la lubiprostona, la linaclotida y la plecanatida) están entre las terapias farmacológicas con perfiles de eficacia y seguridad establecidos5. Un número significativo de estudios que sustentan la utilidad terapéutica de la lubiprostona en particular han sido realizados. La lubiprostona es un metabolito de ácido graso bicíclico, análogo de la prostaglandina E1, que activa el canal2 de iones de cloruro (CIC-2), localizado en la membrana apical de las células epiteliales intestinales, y actúa como estimulante de secreción de fluidos a la luz intestinal6,7. La activación del canal CIC-2 causa un incremento de iones de cloruro (C1−) y una subsiguiente secreción de fluidos en la luz, sin alterar las concentraciones de sodio o de potasio. Al incrementar la secreción de fluidos intestinales, la lubiprostona facilita el paso de heces y alivia los síntomas asociados al ECI. La absorción sistémica de la lubiprostona es virtualmente nula y su único metabolito medible, M3, no es farmacológicamente activo, por lo que el riesgo de toxicidad sistémica e interacción potencial con otros fármacos es mínima.
Por otro lado, los canales CIC-2 juegan un importante papel en la restauración de los complejos de uniones estrechas y en la recuperación de la función de barrera dentro del cuerpo. Se ha demostrado que la lubiprostona estimula la recuperación de la función de la barrera de mucosa en estudios ex vivo del intestino y el colon, por medio de la restauración de complejos de uniones estrechas6,8. Los perfiles de eficacia y de seguridad de la lubiprostona han sido descritos en numerosos ensayos clínicos y el nivel de evidencia sustenta su inclusión en las recomendaciones clínicas de tratamiento para el ECI4,9-12. La lubiprostona ha mostrado una eficacia superior a placebo, incrementando la frecuencia de heces en la primera semana (5.69 vs. 3.46; p=0.0001), reduciendo el pujo y mejorando la consistencia de heces durante todas las semanas (p≤0.0003)13, al igual que incrementando el número de evacuaciones espontáneas completas (EEC) en la primera semana (5.89 vs. 3.99; p=0.001)14. La Food and Drug Administration (FDA) aprobó en 2006 a la lubiprostona para ser utilizada en pacientes con ECI y la European Medicines Agency (EMA) la aprobó en 2012. Sin embargo, es limitada la evidencia clínica de ensayos controlados en población mexicana utilizando fármacos para manejar el estreñimiento.
Realizamos un ensayo de fase 3, aleatorizado, a doble ciego, controlado con placebo, para evaluar la eficacia y la seguridad de 24μg de lubiprostona dos veces al día en sujetos mexicanos con ECI. Mientras que nuestro ensayo clínico fue realizado para sustentar el registro de la lubiprostona en México, nuestros resultados proporcionan evidencia adicional sobre la eficacia y la seguridad de la lubiprostona en la población mexicana, la cual estaba subrepresentada en estudios previos.
Materiales y métodosDiseño de estudio y participantesRealizamos un ensayo de fase3, aleatorizado, a doble ciego, controlado con placebo, en 10 sitios distintos en México, con mexicanos adultos (edad >18 años), con estreñimiento funcional, según los criterios de RomaIII, y antecedentes de estreñimiento definido como frecuencia de EEC <3 veces por semana en promedio, durante ≥6 meses15. Excluimos a sujetos que presentaban constipación debida a causas secundarias (medicación, hipotiroidismo, depresión) o a aquellos que tenían sospecha o confirmación de trastornos orgánicos de intestino grueso o cirugía gastrointestinal en los tres meses previos a la selección.
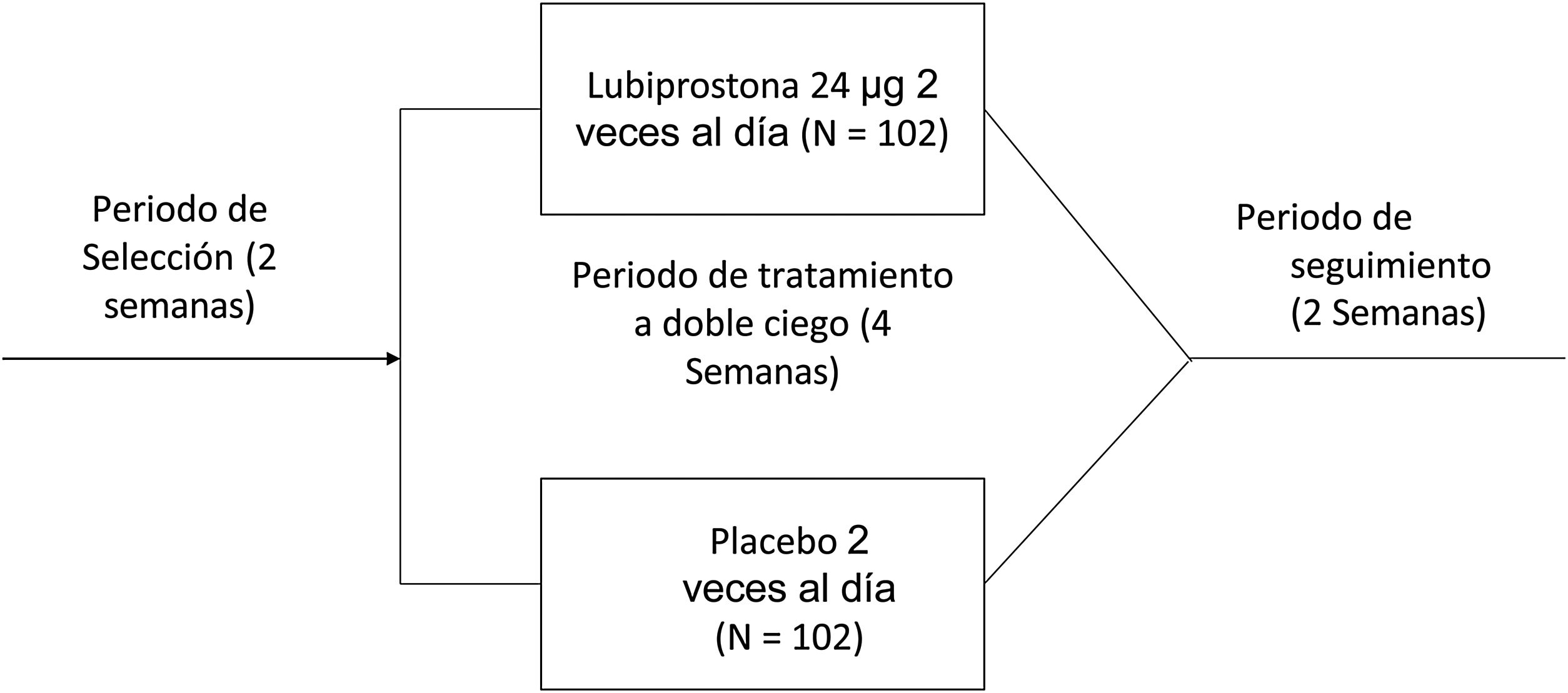
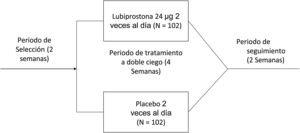
El estudio consistió en un periodo de selección de 14 días para confirmar los síntomas de estreñimiento y un periodo subsiguiente de tratamiento a doble ciego de 4 semanas (28 días), durante el cual los sujetos elegibles fueron aleatorizados a una razón de 1:1 para recibir 24μg de lubiprostona dos veces al día o placebo. El estudio fue realizado entre mayo de 2016 y abril de 2017.
Intervenciones del estudioUna vez obtenido el consentimiento informado y previo a la aleatorización, todos los participantes completaron un periodo de selección de dos semanas sin laxantes, para registrar la frecuencia de sus defecaciones en un diario y poder confirmar constipación. Durante ese tiempo, se utilizó medicamento de rescate (una tableta de bisacodilo 5mg o fármaco equivalente, o un supositorio de glicerina o fármaco equivalente, para quienes no respondieron al bisacodilo o su equivalente) si el sujeto no presentó EEC por tres días consecutivos. Los sujetos cuya constipación fue confirmada durante el periodo de selección fueron aleatorizados para un periodo de tratamiento a doble ciego de cuatro semanas y recibir lubiprostona o placebo, administrados en una cápsula dos veces al día, con comidas. Se les pidió a los participantes suspender el uso de cualquier laxante y fármacos prohibidos (incluidos suplementos alimenticios de fibra) y no cambiar su dieta o estilo de vida, incluido su consumo habitual de cafeína y alcohol, durante todo el estudio. Después de comenzar el periodo de tratamiento, los participantes regresaron al sitio del estudio los días 8, 15 y 29 para la evaluación de la frecuencia de EEC, de la consistencia de heces, del pujo, de síntomas abdominales y de calidad de vida. Después se les dio seguimiento durante 2 semanas adicionales para determinar los desenlaces de seguridad cuando no se administró tratamiento (fig. 1).
Los medicamentos concomitantes prohibidos incluyeron fármacos con efectos anticolinérgicos (excepto bromuro de ipratropio o cualquiera de sus formas de atomización nasal o inhaladas), opioides, antiespasmódicos, inhibidores de la colinesterasa, medicamentos antidiarreicos, medicamentos para el estreñimiento (p.ej., linaclotida), agentes procinéticos gastrointestinales, agentes laxantes (p.ej., PEG 3350), al igual que remedios homeopáticos, antidepresivos tricíclicos, o cualquier fármaco conocido por sus propiedades de alivio o causa de constipación o síntomas de constipación.
Criterios de valoración y análisisEl principal criterio de valoración fue un incremento en la frecuencia de EEC en la semana1. Los criterios secundarios incluyeron la frecuencia de EEC en las semanas2-4; el número de sujetos que presentaron una EEC dentro de las primeras 24 horas de la primera dosis; y el grado medio de pujo, consistencia de heces (escala de heces de Bristol), síntomas abdominales (distensión e incomodidad evaluadas con una escala de 5 puntos [una puntuación elevada indicando síntomas más severos)]) y calidad de vida (establecida por medio del Cuestionario para la Evaluación del Estreñimiento-Calidad de Vida [PAC-QoL, por sus siglas en inglés] en las semanas 1-4).
Criterios de valoración de seguridadLos criterios de valoración de seguridad evaluaron la frecuencia y la intensidad de eventos adversos, al igual que su relación con el tratamiento. El conjunto de análisis de seguridad (SAS, por sus siglas en inglés) incluyó información sobre todos los pacientes que tomaron al menos una dosis del fármaco en estudio o placebo.
Análisis estadísticoEl tamaño de la muestra fue calculado de 204 (102 sujetos en cada grupo), con base en los siguientes supuestos: asignación igual, poder del 90%, alfa de dos colas de 0.05, frecuencias medias de EEC de placebo y tratamiento de 4 y 5.9, respectivamente, una desviación estándar común de 4EEC en la semana1 (utilizando la prueba de Wilcoxon-Mann-Whitney) y una tasa de deserción asumida del 3% para el día 4. Las estimaciones de respuesta a placebo y tratamiento estuvieron basadas en un estudio previo realizado por Sucampo Pharmaceuticals en EE.UU (Protocolo No. RTU/0211SC0131).
Consentimiento informado y consideraciones éticasEl presente estudio fue realizado en cumplimiento de las regulaciones nacionales y de acuerdo con los principios de la Declaración de Helsinki y la Conferencia Internacional sobre la Guía de Armonización Tripartita para las Buenas Prácticas Clínicas. El protocolo del estudio y sus documentos fueron aprobados por el Comité Institucional de Investigación y Ética y por la autoridad nacional regulatoria (Comisión Federal para la Protección contra Riesgos Sanitarios, COFEPRIS), con número de registro 153300410A0196/2016. El estudio fue registrado en clinicaltrials.gov (NCT02729909).
Previo al registro, todos los participantes recibieron información completa sobre el estudio y su participación. Todos los participantes firmaron un consentimiento informado escrito.
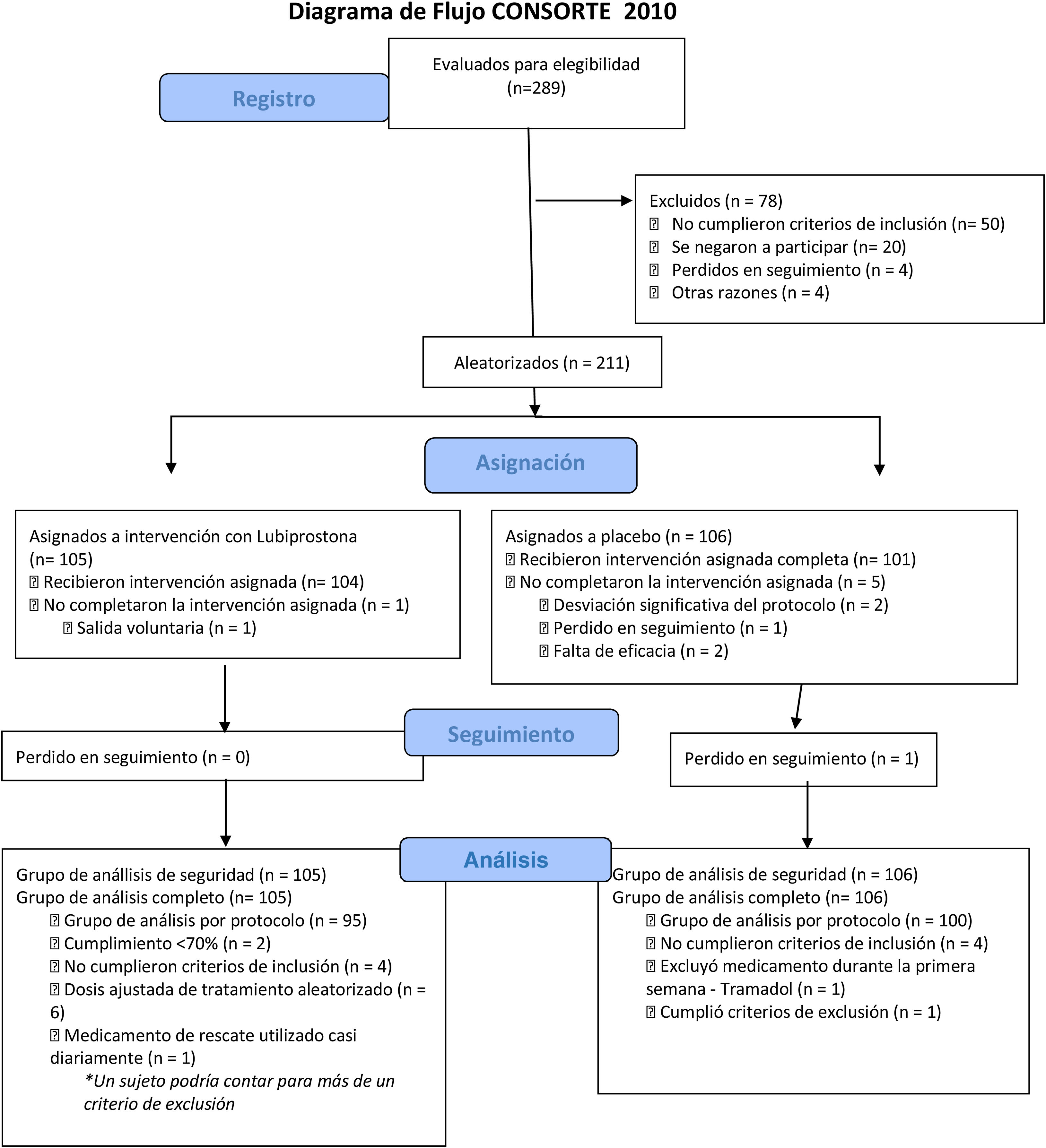
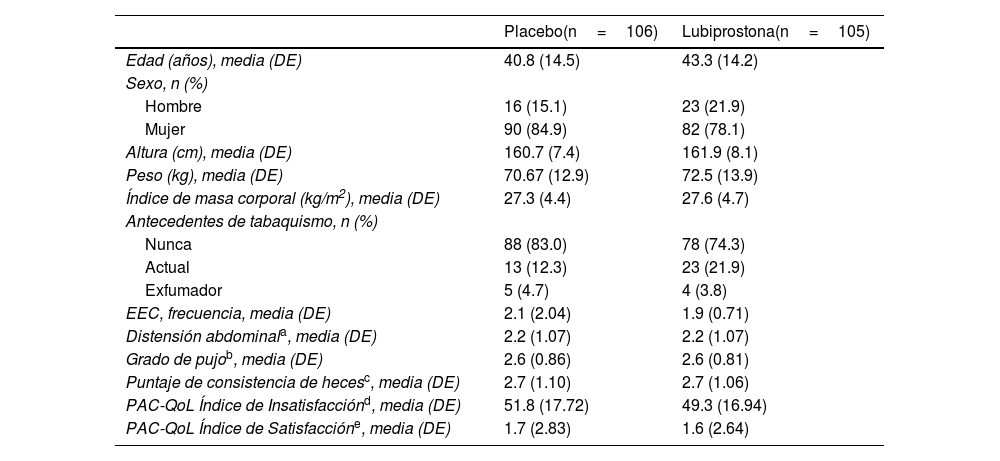
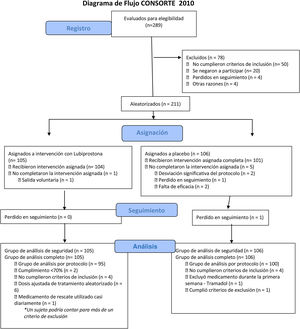
ResultadosParticipantesUn total de 211 participantes se registraron para el estudio y recibieron al menos una dosis del medicamento o placebo; 105 (49.8%) sujetos fueron aleatorizados al grupo de lubiprostona y 106 (50.2%) al grupo placebo, representando la población con intención de tratar (ITT). Los resultados se muestran en esta sección. Seis sujetos descontinuaron el estudio (uno del grupo de lubiprostona y 5 del grupo placebo). La distribución de los sujetos se muestra en la figura 2 y las características demográficas de línea de base se presentan en la tabla 1. No se encontraron diferencias entre los grupos en las características de línea de base.
Características demográficas de línea base de los sujetos
| Placebo(n=106) | Lubiprostona(n=105) | |
|---|---|---|
| Edad (años), media (DE) | 40.8 (14.5) | 43.3 (14.2) |
| Sexo, n (%) | ||
| Hombre | 16 (15.1) | 23 (21.9) |
| Mujer | 90 (84.9) | 82 (78.1) |
| Altura (cm), media (DE) | 160.7 (7.4) | 161.9 (8.1) |
| Peso (kg), media (DE) | 70.67 (12.9) | 72.5 (13.9) |
| Índice de masa corporal (kg/m2), media (DE) | 27.3 (4.4) | 27.6 (4.7) |
| Antecedentes de tabaquismo, n (%) | ||
| Nunca | 88 (83.0) | 78 (74.3) |
| Actual | 13 (12.3) | 23 (21.9) |
| Exfumador | 5 (4.7) | 4 (3.8) |
| EEC, frecuencia, media (DE) | 2.1 (2.04) | 1.9 (0.71) |
| Distensión abdominala, media (DE) | 2.2 (1.07) | 2.2 (1.07) |
| Grado de pujob, media (DE) | 2.6 (0.86) | 2.6 (0.81) |
| Puntaje de consistencia de hecesc, media (DE) | 2.7 (1.10) | 2.7 (1.06) |
| PAC-QoL Índice de Insatisfacciónd, media (DE) | 51.8 (17.72) | 49.3 (16.94) |
| PAC-QoL Índice de Satisfaccióne, media (DE) | 1.7 (2.83) | 1.6 (2.64) |
DE: desviación estándar; EEC: evacuaciones espontáneas completas.
La distensión abdominal se describe utilizando una escala de 5 puntos que va de 0 (nula: sin distensión abdominal) a 4 (muy grave: distensión abdominal extremadamente fuerte).
El grado de pujo se describe usando una escala de 5 puntos que va de 0 (sin pujo) a 4 (pujo muy fuerte).
El puntaje de consistencia de heces se describe usando una escala de 7 puntos donde los valores menores indican heces más duras.
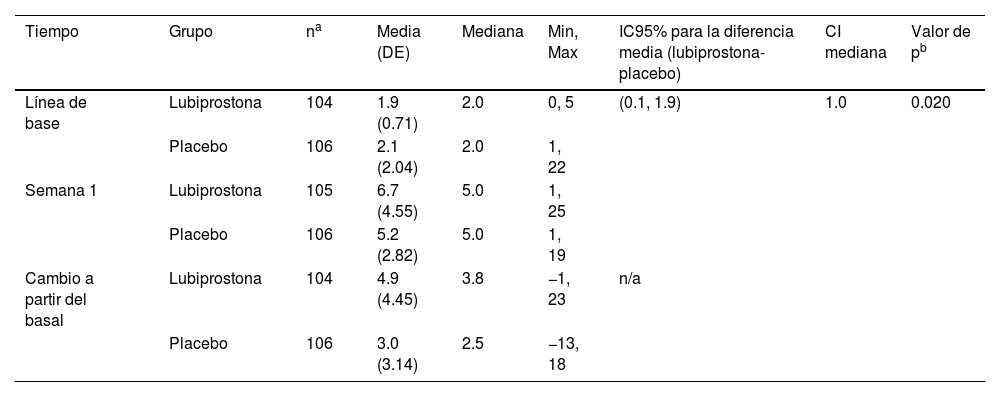
El aumento en la frecuencia media (desviación estándar [DE]) de EEC a la semana 1 respecto a la línea de base fue significativamente mayor en el grupo de lubiprostona (4.9 [4.45]) en comparación con el grupo placebo (3.0 [3.14]) (p=0.020) (tabla 2).
Frecuencia de las evacuaciones espontáneas completas (EEC) a la primera semana (prueba de van Elteren)
| Tiempo | Grupo | na | Media (DE) | Mediana | Min, Max | IC95% para la diferencia media (lubiprostona-placebo) | CI mediana | Valor de pb |
|---|---|---|---|---|---|---|---|---|
| Línea de base | Lubiprostona | 104 | 1.9 (0.71) | 2.0 | 0, 5 | (0.1, 1.9) | 1.0 | 0.020 |
| Placebo | 106 | 2.1 (2.04) | 2.0 | 1, 22 | ||||
| Semana 1 | Lubiprostona | 105 | 6.7 (4.55) | 5.0 | 1, 25 | |||
| Placebo | 106 | 5.2 (2.82) | 5.0 | 1, 19 | ||||
| Cambio a partir del basal | Lubiprostona | 104 | 4.9 (4.45) | 3.8 | −1, 23 | n/a | ||
| Placebo | 106 | 3.0 (3.14) | 2.5 | −13, 18 |
IC95%: intervalo de confianza al 95%; DE: desviación estándar; n/a: no aplica.
El análisis secundario de eficacia reveló un mayor número de EEC/semana en el grupo de lubiprostona a las semanas 2, 3 y 4. Todas las diferencias fueron estadísticamente significativas en comparación con el grupo placebo (media [DE] en lubiprostona vs. placebo a la semana 2: 6.9 [4.40] vs. 5.5 [2.80], p=0.043; semana 3: 7.6 [4.53] vs. 5.9 [3.87], p=0.003; y semana 4: 7.1 [4.30] vs. 5.6 [3.52], p=0.013).
El número de sujetos que respondió con una EEC dentro de las primeras 24 horas de la primera dosis también fue mayor con el tratamiento con lubiprostona versus placebo (63/105 [60.0%] vs. 44/106 [41.5%]; OR 2.08, [IC95%: 1.19, 3.62], p=0.009).
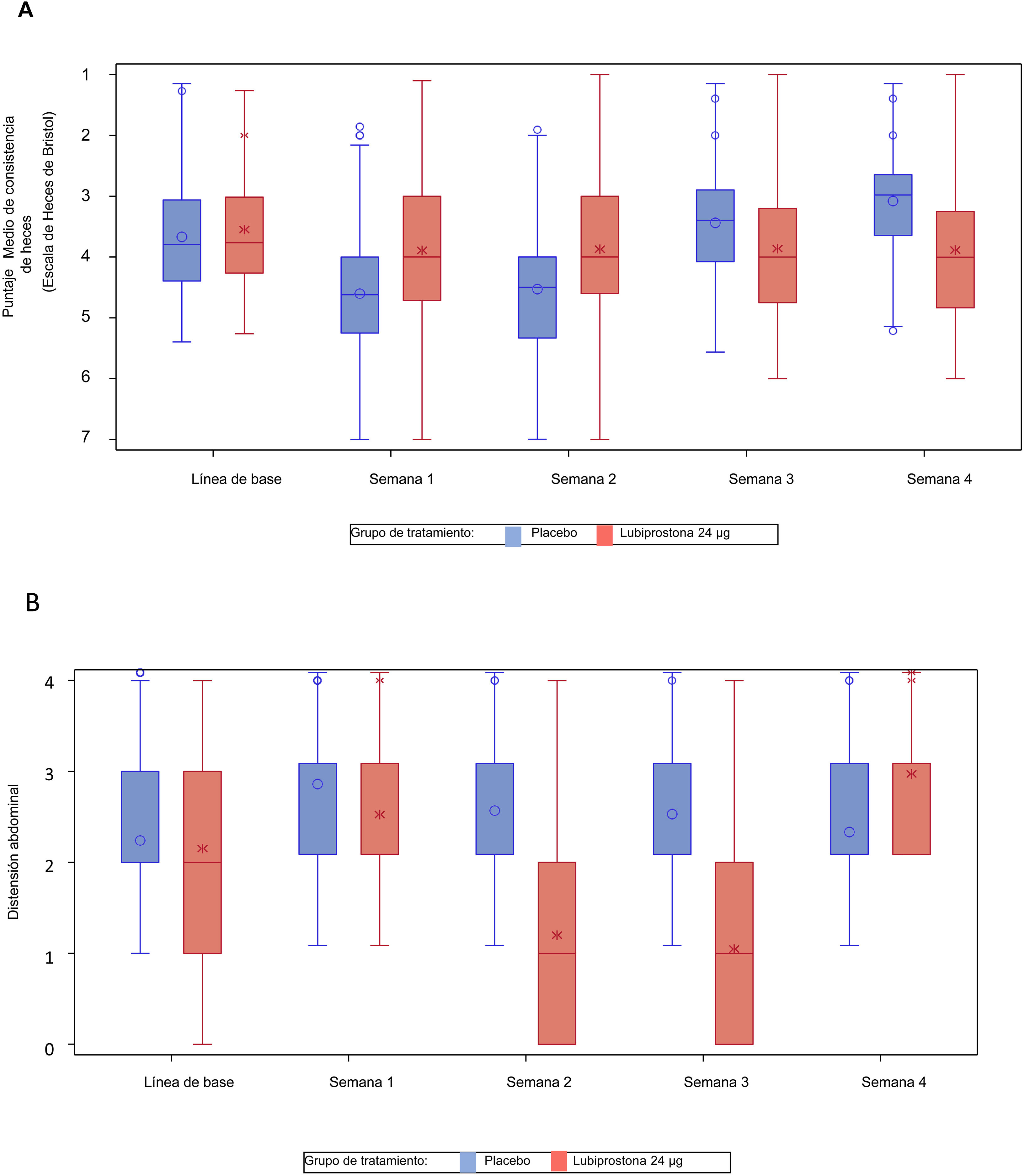
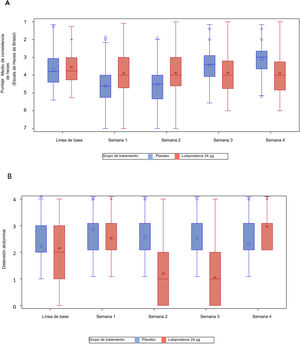
También se observó una reducción significativa en el grado medio de pujo con el tratamiento con lubiprostona a las semanas 1, 2, 3 y 4 (media [DE] en lubiprostona vs. placebo a la semana 1: 4.1 [1.3] vs. 3.4 [1.08], p<0.001; semana 2: 4.1 [1.13] vs. 3.5 [1.05], p<0.001; semana 3: 4.1 [1.12] vs. 3.5 [0.93], p<0.001; y semana 4: 4.1 [1.19] vs. 3.6 [0.93], p<0.001) (fig. 3A).
Se observaron también mejoras estadísticamente significativas (cambio respecto a línea de base) en consistencia de heces, evaluado por medio de la Escala de Heces de Bristol, mostrando un cambio semanal positivo en la escala con el tratamiento de lubiprostona a las semanas 1, 2, 3 y 4 (media [DE] en lubiprostona vs. placebo a la semana 1: +2.0 [0.88] vs. +1.6 [0.85], p=0.001; semana 2: +1.8 [0.93] vs. +1.5 [0.89], p=0.004; semana 3: +1.6 [0.92] vs. +1.3 [0.82], p=0.024; y semana 4: +1.5 [0.86] vs. +1.2 [0.92], p=0.010) (fig. 3B).
Se observaron reducciones significativas en la distensión y el malestar abdominal con el tratamiento con lubiprostona. Esta mejoría fue estadísticamente significativa a las semanas 3 y 4 (distensión abdominal media [DE] con lubiprostona vs. placebo a la semana 3: 1.0 [1.01] vs. 1.4 [0.93], p<0.001; semana 4: 0.9 [0.94] vs. 1.2 [0.98], p=0.004).
El índice de satisfacción (evaluado mediante el malestar abdominal) fue más elevado a las semanas 2 y 4 para el grupo de tratamiento con lubiprostona, en comparación con el grupo placebo (media [DE] en lubiprostona vs. placebo a la semana 2: 7.3 [3.78] vs. 5.2 [3.68], p<0.001; semana 4: 9.0 [3.98] vs. 6.5 [4.43], p<0.001).
Se realizó un análisis exploratorio para determinar el número de EEC por semana con sensación de evacuación completa. Los resultados mostraron un mayor número de EEC/semana con sensación de evacuación completa a las semanas 1, 2, 3 y 4 comparando lubiprostona con placebo, pero sin significancia estadística (no se muestran los datos).
Medicamento de rescateUn total de 38 pacientes requirieron de medicamento de rescate (más de 72h sin EEC): 19 (50%) en el grupo placebo y 19 (50%) en el grupo de lubiprostona (p>0.05). Los dos medicamentos utilizados principalmente para rescate en ambos grupos fueron supositorios de glicerina (placebo 13 [59.1%]; lubiprostona: 17 [70.8%], p>0.05) y bisacodilo 5mg (placebo: 2 [9.1%]; lubiprostona: 2 [8.3%], p>0.05).
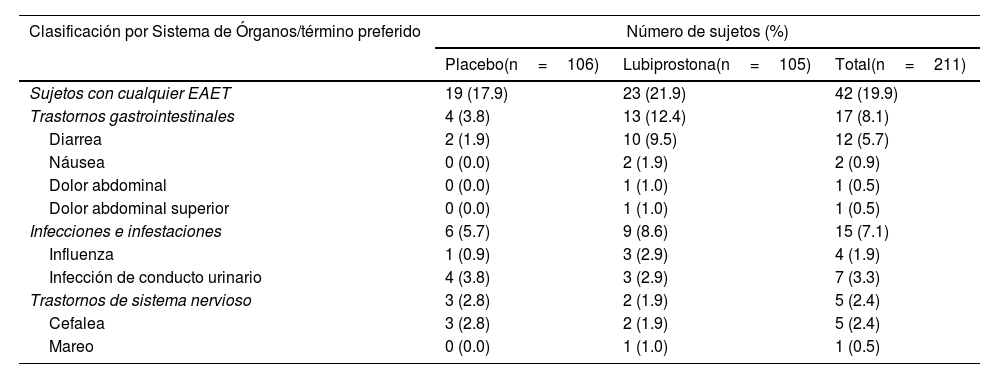
Criterios de valoración de seguridadCuarenta y dos sujetos (19.9%) reportaron un total de 63 eventos adversos emergentes con el tratamiento (EAET): 23 sujetos (21.9%) en el grupo lubiprostona y 19 (17.9%) en el grupo placebo (tabla 3). No se presentaron muertes ni eventos adversos graves durante el estudio. Los mayores números de eventos adversos fueron reportados por 17 sujetos (8.1%) en Trastornos Gastrointestinales de la Clasificación por Sistema de Órganos (SOC, por sus siglas en inglés) (reportados por 13 [12-4%] y 4 [3.8%] sujetos en los grupos de lubiprostona y placebo, respectivamente) e Infecciones e Infestaciones SOC (15 sujetos (7.1%); 9 (8.6%), y 6 (5.7%) en los grupos lubiprostona y placebo, respectivamente). No existieron eventos adversos que requirieran la interrupción del tratamiento o el abandono del estudio.
Eventos adversos emergentes con el tratamiento (EAET) por Clasificación por Sistema de Órganos (SOC, por sus siglas en inglés) y término preferido (TP)
| Clasificación por Sistema de Órganos/término preferido | Número de sujetos (%) | ||
|---|---|---|---|
| Placebo(n=106) | Lubiprostona(n=105) | Total(n=211) | |
| Sujetos con cualquier EAET | 19 (17.9) | 23 (21.9) | 42 (19.9) |
| Trastornos gastrointestinales | 4 (3.8) | 13 (12.4) | 17 (8.1) |
| Diarrea | 2 (1.9) | 10 (9.5) | 12 (5.7) |
| Náusea | 0 (0.0) | 2 (1.9) | 2 (0.9) |
| Dolor abdominal | 0 (0.0) | 1 (1.0) | 1 (0.5) |
| Dolor abdominal superior | 0 (0.0) | 1 (1.0) | 1 (0.5) |
| Infecciones e infestaciones | 6 (5.7) | 9 (8.6) | 15 (7.1) |
| Influenza | 1 (0.9) | 3 (2.9) | 4 (1.9) |
| Infección de conducto urinario | 4 (3.8) | 3 (2.9) | 7 (3.3) |
| Trastornos de sistema nervioso | 3 (2.8) | 2 (1.9) | 5 (2.4) |
| Cefalea | 3 (2.8) | 2 (1.9) | 5 (2.4) |
| Mareo | 0 (0.0) | 1 (1.0) | 1 (0.5) |
Un evento adverso emergente con el tratamiento (EAET) se define como un EA cuya fecha de inicio ocurre después de la primera dosis de fármaco de estudio por medio de la visita de seguimiento.
Los sujetos con uno o más eventos adversos dentro del nivel de un término del Diccionario Médico para Actividades Regulatorias (MedDRA, por sus siglas en inglés) son contados solamente una vez en ese nivel. Los porcentajes se basan en el número de sujetos en el grupo de seguridad para cada grupo de tratamiento.
Los términos SOC están ordenados alfabéticamente y los TP están organizados en orden descendente de frecuencia en el grupo lubiprostona.
El Diccionario MedDRA (Versión 20.0 Mixto) fue utilizado para codificar los eventos adversos.
En general, todos los eventos adversos fueron leves y transitorios. La diarrea fue más frecuentemente reportada en el grupo de lubiprostona que en el grupo placebo (10 sujetos [9.5%] vs. 2 sujetos [1.9%], respectivamente) y fue a menudo descrita como relacionada con la administración del fármaco de estudio. Las infecciones e infestaciones reportadas incluyeron infecciones del conducto urinario (3 sujetos [2.9%] en el grupo de lubiprostona y 4 sujetos [3.8%] en el grupo placebo) e influenza (3 sujetos [2.9%] en el grupo de lubiprostona y 1 sujeto [0.9%] en el grupo de placebo). Todos los EAET fueron considerados independientes de la administración del fármaco. Los eventos adversos comunes reportados como relacionados al fármaco fueron congruentes con el perfil de seguridad conocido de la lubiprostona y no se identificaron nuevos signos de seguridad en el presente estudio.
DiscusiónSe ha reportado previamente que la lubiprostona es segura y efectiva para el tratamiento de la ECI. Nuestro estudio realizado en sujetos mexicanos con ECI mostró que 24μg de lubiprostona dos veces al día era más efectivo que el placebo, medido con la frecuencia de EEC a la primera semana de tratamiento, lo cual fue el criterio de valoración primario. Dicha mejoría estadísticamente significativa fue sostenida a lo largo del periodo de 4 semanas. Johanson et al.13 reportaron una mejoría significativa en los síntomas asociados con la constipación que fue replicada por Barish et al.14. Nosotros corroboramos en el presente estudio la mejoría sostenida respecto de la línea de base, en síntomas que incluyeron pujo, consistencia de heces, distensión abdominal e incomodidad. Estos síntomas fueron estadísticamente significativos a las semanas 1, 2, 3 y 4 para pujo y consistencia de heces, a las semanas 1, 3 y 4 para distensión abdominal y a las semanas 3 y 4 para malestar abdominal.
Respecto a la mejoría de síntomas asociados con estreñimiento (dolor abdominal, malestar abdominal), dichos síntomas disminuyeron significativamente en el grupo tratado con lubiprostona y podrían estar relacionados con cambios en los mediadores inflamatorios intestinales locales que son modificados cuando el tránsito intestinal se incrementa. Observamos a lo largo del estudio una mejoría importante en la Escala de Heces de Bristol en pacientes que recibieron lubiprostona, en comparación con placebo, revelando un ablandamiento de las heces como otro beneficio del uso de la lubiprostona.
Nuestro estudio es el primero que estudia la eficacia y la seguridad de la lubiprostona en una población latinoamericana, y de manera interesante, la incidencia de eventos adversos fue menor que la reportada en estudios previos realizados en otras poblaciones13,14.
El hecho de que los cambios en las condiciones intraluminales locales pueden afectar al microbioma, trayendo cambios subsiguientes en los mediadores inflamatorios que pudieran impactar en los parámetros subjetivos evaluados no puede ser descartado. Se requiere de estudios adicionales para determinar el papel de la lubiprostona en la formación del microbioma intestinal y sus implicaciones clínicas.
La lubiprostona fue bien tolerada y los eventos adversos comúnmente reportados fueron congruentes con su perfil de seguridad conocido. De manera interesante, la incidencia de náusea en el grupo de lubiprostona fue menor, en comparación con lo reportado en estudios previos. La relevancia de esto deberá ser determinada por medio de una cuidadosa y continua evaluación de los pacientes en tratamiento con el fármaco.
A pesar de que no fue un criterio de valoración primario de nuestro estudio, el análisis exploratorio de los EEC por semana con sensación de evacuación completa reveló la mejoría sostenida de la lubiprostona a lo largo del estudio, proporcionando información para estudios clínicos futuros que pudieran realizarse utilizando dicho parámetro como un criterio de valoración primario.
Aunque el presente estudio se realizó utilizando los criterios diagnósticos de RomaIII para la constipación, los cambios implementados en los criterios de RomaIV no modificarían prácticamente ninguno de los parámetros de admisión o evaluación de este trabajo, por lo que nuestros resultados pueden ser considerados válidos y útiles bajo la definición actual (RomaIV), pero podrían ser reevaluados en detalle en caso de cambios futuros en los criterios diagnósticos y terapéuticos para ECI.
Una de las limitaciones de nuestro estudio fue su duración, pero un estudio similar de hasta 48 semanas mostró que los mayores cambios ocurrieron dentro de las primeras seis semanas y que los desenlaces no se modificaron mucho posteriormente16. Además, la prevalencia de EEC (aquellos que proporcionan satisfacción de vaciado completa, en ausencia de uso de laxantes) no fue evaluada como desenlace, dado que apenas recientemente se propuso como un criterio de eficacia. Por lo tanto, deberá ser considerado para estudios futuros sobre la eficacia de tratamientos para ECI.
Respecto a la seguridad, el hecho de que ningún participante desertó del presente estudio por razones relacionadas con la seguridad fue relevante. También, en comparación con estudios previos11,13,14, en nuestro estudio se presentó un menor número de participantes con náuseas.
En conclusión, nuestros datos son consistentes con los de reportes previos, lo cual muestra que la lubiprostona, a una dosis de 24μg dos veces al día, fue un tratamiento seguro y efectivo para la constipación en la población mexicana, confirmando su utilidad como tratamiento para ECI.
FinanciamientoEl presente estudio fue financiado por Takeda Development Center Americas INC. Se recibió apoyo en escritura médica por parte de iLS Clinical Research SC y financiado por Takeda México.
ReconocimientoEl apoyo en escritura médica, comentarios técnicos y formato de manuscrito fue proporcionado por Carlos A. Díaz-Tufinio e iLS Clinical Research, S.C., bajo la supervisión de los autores.
Conflicto de interesesE. Coss-Adame ha sido parte del Consejo Consultivo de Takeda y Asofarma. Ha sido consultor para Alfasigma, Takeda México, Asofarma México. También ha sido ponente para Alfasigma, Takeda México, Carnot, Sanfer y Endomédica.
J.M. Remes Troche ha sido parte del Consejo Consultivo de Takeda y Asofarma. Ha sido consultor para Alfasigma, Takeda México, Asofarma México, Biocodex y Sanfer. También ha sido ponente para Alfasigma, Takeda México, Carnot, Sanfer y Endomédica.
R. Flores Rendón no tiene conflicto de intereses.
J. L. Tamayo de la Cuesta no tiene conflicto de intereses.
Miguel Ángel Valdovinos Díaz ha sido parte del Consejo Consultivo de Takeda y Biocodex. Ha sido ponente para Takeda, Carnot, Mayoly y Biocodex.
El financiamiento, diseño, realización, supervisión y reporte del presente estudio fue parte de los patrocinadores, Takeda Development Center America Inc. y Takeda México, S.A. de C.V. Mauricio Rodríguez-Álvarez e iLS Clinical Research, S.C proporcionaron apoyo en escritura médica bajo la guía de los autores, y fue financiado por Takeda México, S.A. de C.V. siguiendo los lineamientos de las Buenas Prácticas de Publicación (GPP3, por sus siglas en inglés).