La esteatosis pancreática es un hallazgo incidental radiológico en pacientes asintomáticos, cuya importancia clínica es poco clara. Objetivo primario: estudiar la prevalencia de esteatosis pancreática (EP) en pacientes consecutivos, registrados en nuestro hospital, en quienes se realizó tomografía axial computada (TAC) de abdomen y pelvis, excluyendo enfermedades pancreáticas conocidas. Objetivo secundario: revisar la asociación de EP con datos demográficos, clínicos y con esteatosis hepática (EH).
Material y métodosEstudio observacional en pacientes adultos con TAC de abdomen y pelvis. Definiciones: A) la densidad del tejido fue medida en unidades Hounsfield (UH) en 5 áreas de 1cm2 del páncreas, 3 en el bazo y en los segmentos VI y VII del hígado; B) páncreas graso: promedio de páncreas-promedio de bazo <−10UH; C) hígado graso: densidad <40UH. Registramos los datos epidemiológicos y de laboratorio de pacientes. La asociación de estos factores con la presencia de EP fue analizada con el software SPSS versión 24.0, considerando p<0.05 significativo.
ResultadosSe encontró EP en 61 de los 203 pacientes (30%). Los individuos con EP tuvieron significativamente mayor edad e índice de masa corporal. No encontramos asociación significativa con el resto de parámetros estudiados, tampoco con EH (55 pacientes). Ninguno de los pacientes tenía síntomas atribuibles a una enfermedad de páncreas exocrino.
ConclusionesInfiltración grasa de páncreas es un hallazgo frecuente en TAC, cuya importancia clínica es incierta. El envejecimiento de la población y el aumento de la obesidad subrayan la necesidad de futuros estudios sobre EP.
Pancreatic steatosis is an incidental radiologic finding in asymptomatic patients, and its clinical importance is unclear. Primary aim: to study the prevalence of pancreatic steatosis (PS) in consecutive patients registered at our hospital, that underwent computed axial tomography (CAT) scanning of the abdomen and pelvis, excluding known pancreatic diseases. Secondary aim: to review the association of PS with the demographic and clinical data of the patients, as well as with hepatic steatosis (HS).
Materials and methodsAn observational study was conducted on adult patients that had CAT scans of the abdomen and pelvis. Definitions: a) tissue density was measured in Hounsfield units (HU) in five 1cm2 areas of the pancreas, three areas of the spleen, and in segments VI and VII of the liver; b) fatty pancreas: a difference <–10 HU between the mean pancreas and mean spleen densities; and c) fatty liver: density <40 HU. We registered the epidemiologic and laboratory data of the patients. The association of those factors with the presence of PS was analyzed using SPSS version 24.0 software, and statistical significance was set at a p<0.05.
ResultsOf the 203 patients, PS was found in 61 (30%). The patients with PS were significantly older and had a higher body mass index. We found no significant association with the rest of the parameters studied, nor with HS (55 patients). None of the patients had symptoms attributable to a disease of the exocrine pancreas.
ConclusionsFatty infiltration of the pancreas is a frequent finding in CAT scans, and its clinical importance is unclear. Aging of the population and the increase in obesity underline the need for future studies on PS.
En 1933 Ogilvie observó aumento de contenido de grasa e hipertrofia de islotes de Langerhans en el 17% de personas con obesidad comparado con el 7% en individuos con peso normal1. Olsen, en 1978, describió, en material de autopsias, infiltración grasa en páncreas que era mayor en personas de edad más avanzada2. La infiltración grasa de páncreas fue descrita también como hallazgo en imágenes radiológicas3,4, pero ni la nomenclatura, ni su importancia clínica está clara: por largo tiempo fue considerada como una condición inocua. Sin embargo, en las últimas décadas su asociación con obesidad1 y síndrome metabólico5 la han convertido en foco de múltiples observaciones e investigaciones6–11. A lo largo de los años, muchos términos se han ocupado para referirse a la acumulación de grasa en el páncreas. La incertidumbre en cuanto a nomenclatura refleja también los diferentes conceptos: desde la infiltración grasa asociada a obesidad, que no implica mayor daño de páncreas, a través de reemplazo graso de células acinares hasta la esteatopancreatitis no alcohólica (EPNA), que lleva el concepto de la enfermedad potencialmente progresiva.
La incidencia de sobrepeso y obesidad ha aumentado de forma alarmante a nivel mundial, estimándose prevalencias del 33.8% en Estados Unidos (2007-2008)12. En Chile, Berrios et al. en 1990 describieron obesidad en el 19.6% de los hombres y en el 30.8% de mujeres en la Región Metropolitana13. A nivel nacional la obesidad aumentó del 23.2% en 2003 al 34.4% en 2016 en la población general14. La obesidad se asocia a enfermedades con alto impacto en salud pública, tales como síndrome metabólico, enfermedades cardiovasculares y diversos tipos de cáncer15–17. La obesidad se asocia también a infiltración grasa e inflamación en diferentes órganos incluyendo el hígado (esteatosis hepática [EH], esteatohepatitis no alcohólica [EHNA]), músculo esquelético, corazón y páncreas18,19.
Para determinar la presencia de esteatosis pancreática (EP) se han utilizado tres métodos imagenológicos principales: ecografía abdominal, tomografía axial computada (TAC) y la resonancia nuclear magnética (RNM) abdominal, cada uno con criterios particulares sin que existan consensos internacionales definitivos que hayan unificado criterios. Se ha demostrado adecuada correlación histológica de infiltración grasa pancreática e imagenológica con TAC abdominal20.
La prevalencia de páncreas graso es poco conocida a nivel mundial. Su prevalencia estimada fue del 16% en China21 en una publicación de 2014, aumentando al 30% en 201622. No se dispone de datos nacionales en Chile.
El objetivo primario de este estudio fue determinar la prevalencia de EP en pacientes adultos en quienes se realizó TAC de abdomen y pelvis, excluyendo enfermedades pancreáticas conocidas. Como objetivos secundarios, se revisó la asociación de EP con datos demográficos, clínicos y con EH.
Material y métodosEstudio observacional, descriptivo, retrospectivo, en el que se analizaron los TAC de abdomen y pelvis realizados entre los meses de abril y mayo de 2015 en el Hospital Clínico Universidad de Chile. Fueron incluidos todos los pacientes adultos consecutivos quienes disponían de ficha clínica en nuestro hospital. Se consideraron como criterios de exclusión: edad menor de 15 años, enfermedades pancreáticas (pancreatitis aguda y crónica, cáncer de páncreas) y enfermedades hepáticas (cirrosis, EHNA, etc.) conocidas.
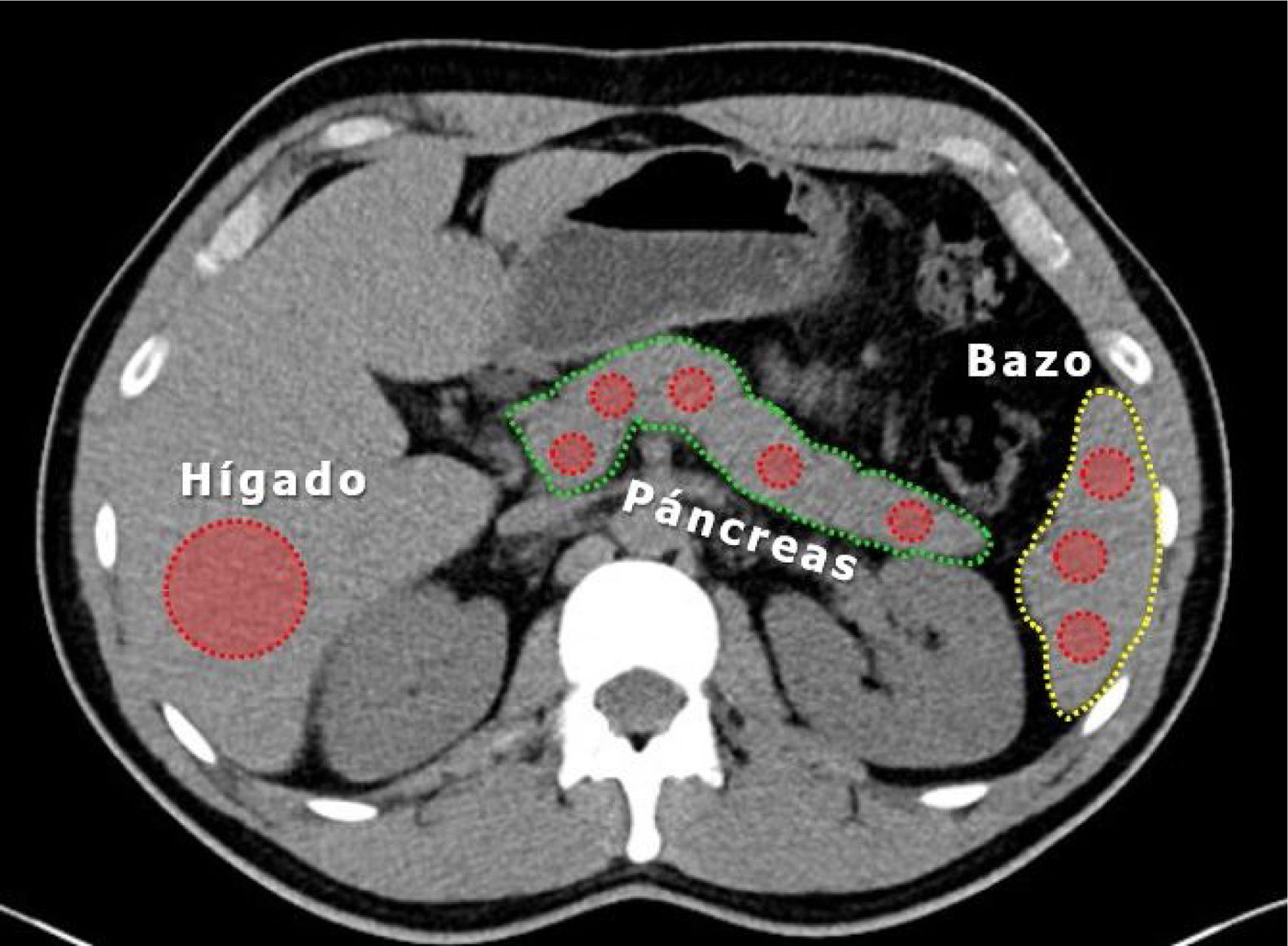
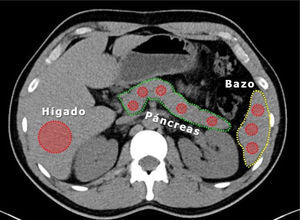
Medición de densidad de páncreas e hígadoLa densidad pancreática fue determinada durante la fase sin contraste de TAC20 en 5 áreas diferentes de aproximadamente 1cm2 (proceso uncinado, cabeza, cuello, cuerpo y cola) mediante unidades Hounsfield (UH) y se comparó con la densidad de bazo medido en 3 áreas aleatorias diferentes; se calculó el promedio de mediciones en ambos órganos. Paralelamente se midió la densidad de parénquima hepático en un ROI (region of interest) extenso a nivel de segmentos VI y VII (fig. 1).
Criterio de EP: densidad páncreas–densidad bazo <−10UH.
Criterio de EH: densidad hepática <40UH10.
Variables incluidasLos datos fueron extraídos de la ficha clínica de los pacientes. Se incluyeron variables demográficas (edad, sexo) y variables clínicas (índice de masa corporal [IMC], antecedente de diabetes mellitus [DM], valores de glucemia y perfil lipídico al momento del examen). El estado nutricional del paciente se definió en base al IMC (kg/m2): bajo peso (<18.5), normopeso (18.5-24.9), sobrepeso (25-29.9) y obesidad (>30).
Los datos medidos y calculados fueron registrados en una tabla Excel.
Análisis estadísticoLas variables categóricas fueron expresadas como valor absoluto y porcentaje, mientras que las variables cuantitativas como promedio±desviación estándar o mediana y rango, dependiente de si su distribución fue o no normal.
La distribución normal de los datos fue evaluada con la prueba de Shapiro-Wilk y se evaluaron diferencias entre los grupos a través de la prueba de Kruskal-Wallis o U de Mann-Whitney y el posterior análisis post-hoc de diferencias múltiples. Para variables categóricas se utilizó la prueba de proporciones, chi-cuadrado o prueba de Fisher según corresponda (p<0.05). Se utilizó el coeficiente de correlación de Spearman entre la EP y edad e IMC. Los análisis fueron realizados con el software estadístico SPSS IBM Corp. Released 2016. IBM SPSS Statistics for Windows, Version 24.0. Armonk, NY (EE.UU.): IBM Corp.
Consideraciones éticasLa investigación cumple con la normativa vigente en investigación bioética. Los autores declaran que este artículo no contiene información personal que permita identificar a los pacientes. El proyecto y la revisión retrospectiva de registros clínicos fueron aprobados por el Comité de Ética del Hospital Clínico Universidad de Chile (HCUCh N° 023 de agosto de 2015).
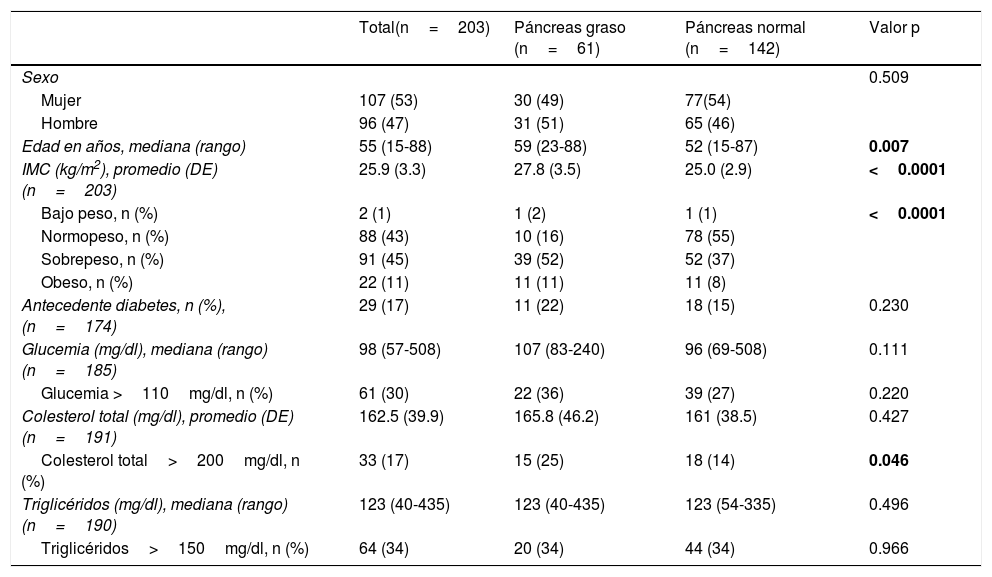
ResultadosSe incluyeron 203 pacientes (1 TAC/paciente), con una edad mediana de 55 años (rango 15-88); 96 (47%) eran mujeres. Un 44% de pacientes tuvo peso normal, 29 pacientes tenían diabetes conocida. En la tabla 1 se presentan las características demográficas y clínicas. Los motivos de consulta para realizarse TAC abdominal durante el período descrito fueron dolor abdominal en un 31%, cólico renal en un 29%, sospecha de neoplasia en un 10%, control posquirúrgico en un 7%, sospecha de apendicitis en un 6%, y otras causas en un 17%.
Características demográficas, clínicas y exámenes de laboratorio de los pacientes evaluados con TAC de abdomen según densidad del páncreas
| Total(n=203) | Páncreas graso (n=61) | Páncreas normal (n=142) | Valor p | |
|---|---|---|---|---|
| Sexo | 0.509 | |||
| Mujer | 107 (53) | 30 (49) | 77(54) | |
| Hombre | 96 (47) | 31 (51) | 65 (46) | |
| Edad en años, mediana (rango) | 55 (15-88) | 59 (23-88) | 52 (15-87) | 0.007 |
| IMC (kg/m2), promedio (DE) (n=203) | 25.9 (3.3) | 27.8 (3.5) | 25.0 (2.9) | <0.0001 |
| Bajo peso, n (%) | 2 (1) | 1 (2) | 1 (1) | <0.0001 |
| Normopeso, n (%) | 88 (43) | 10 (16) | 78 (55) | |
| Sobrepeso, n (%) | 91 (45) | 39 (52) | 52 (37) | |
| Obeso, n (%) | 22 (11) | 11 (11) | 11 (8) | |
| Antecedente diabetes, n (%), (n=174) | 29 (17) | 11 (22) | 18 (15) | 0.230 |
| Glucemia (mg/dl), mediana (rango) (n=185) | 98 (57-508) | 107 (83-240) | 96 (69-508) | 0.111 |
| Glucemia >110mg/dl, n (%) | 61 (30) | 22 (36) | 39 (27) | 0.220 |
| Colesterol total (mg/dl), promedio (DE) (n=191) | 162.5 (39.9) | 165.8 (46.2) | 161 (38.5) | 0.427 |
| Colesterol total>200mg/dl, n (%) | 33 (17) | 15 (25) | 18 (14) | 0.046 |
| Triglicéridos (mg/dl), mediana (rango) (n=190) | 123 (40-435) | 123 (40-435) | 123 (54-335) | 0.496 |
| Triglicéridos>150mg/dl, n (%) | 64 (34) | 20 (34) | 44 (34) | 0.966 |
DE: desviación estándar; IMC: índice de masa corporal.
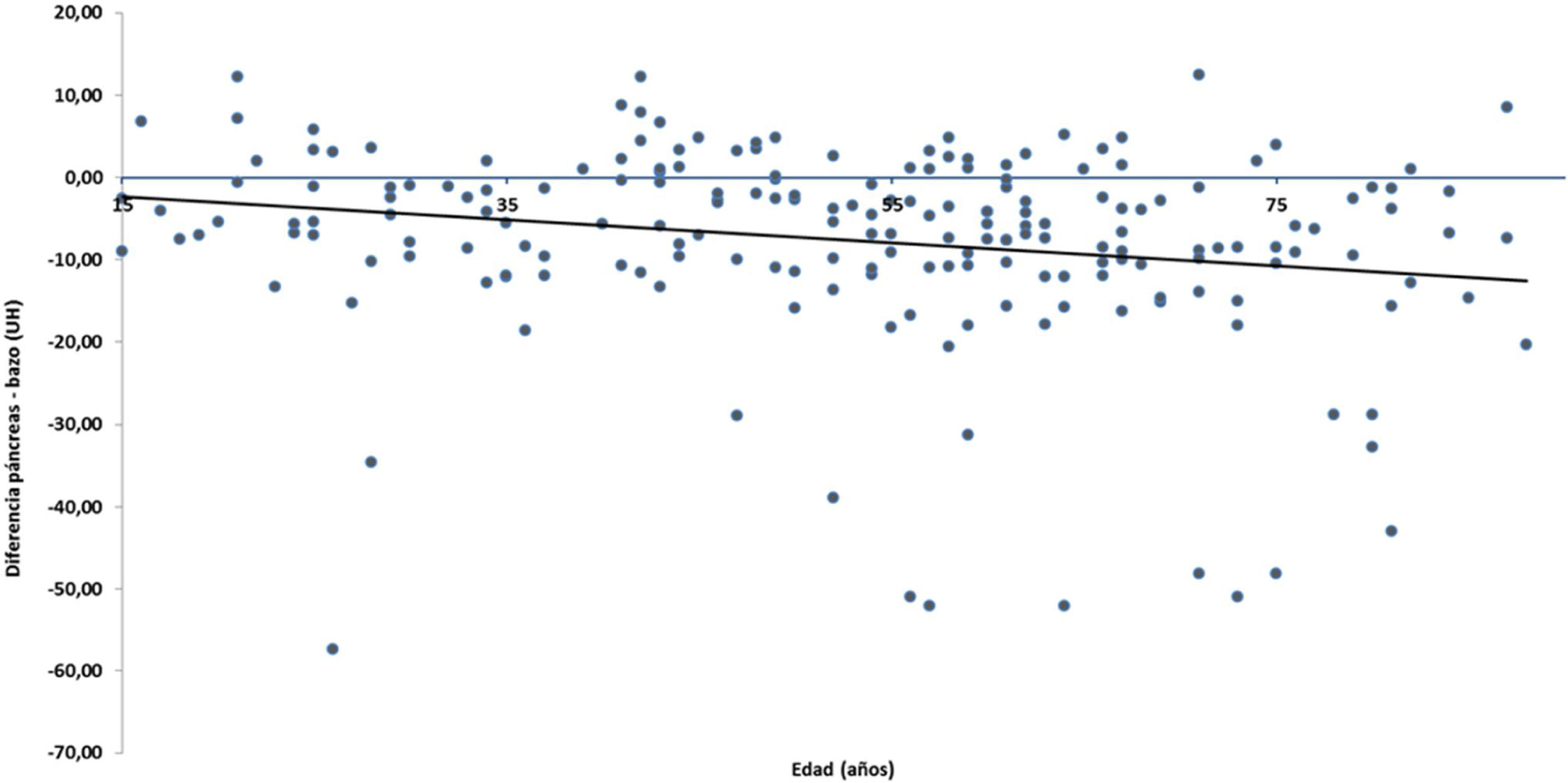
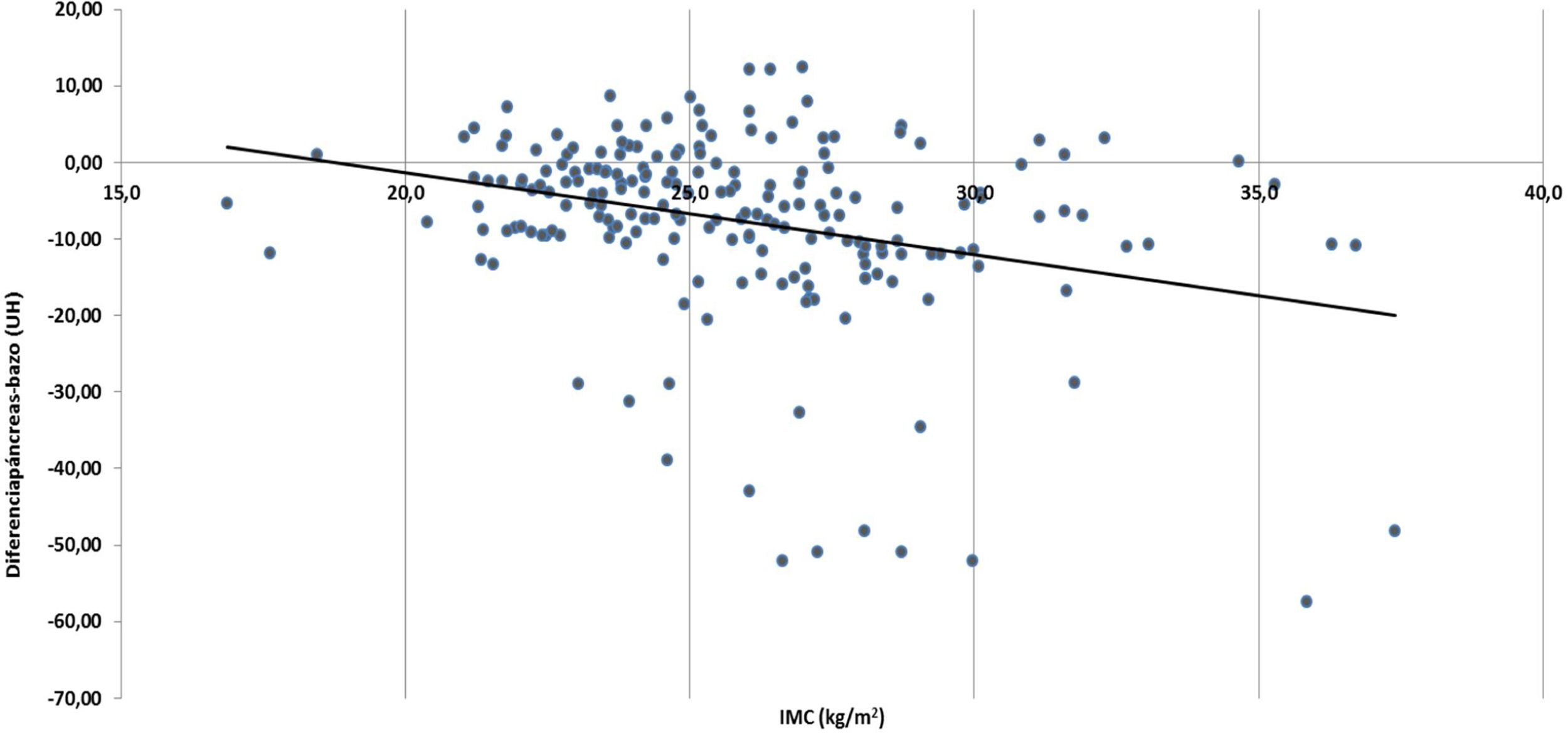
La diferencia de densidad páncreas–bazo fue menor de −10UH en 61 pacientes (30%) (tabla 1). No se encontró diferencia entre hombres y mujeres. Examinando la correlación entre el valor numérico de diferencia de densidad páncreas-bazo y la edad, se encontró una correlación significativa, los valores más bajos fueron más frecuentes con el avance de la edad (fig. 2) (coeficiente de Spearman r=−0.23396, p=0.00078). Analizando la presencia de EP, se observó una correlación significativa: los pacientes portadores de EP fueron significativamente mayores que los de densidad pancreática normal (tabla 1). La EP también se correlacionó significativamente con el aumento del IMC (coeficiente de Spearman r=−0.29581, p<0.0001) (fig. 3). Los pacientes con páncreas graso tuvieron IMC significativamente mayor (tabla 1). La diabetes fue algo más frecuente en los pacientes con EP que en individuos con páncreas normal, pero sin alcanzar diferencia significativa; al igual, tampoco observamos asociación significativa entre EP y niveles elevados de colesterol y triglicéridos, o de glucemia (tabla 1).
La densidad hepática fue menor de 40UH, compatible con EH en 55 casos (27%), siendo la frecuencia de EP similar a la EH en el grupo total de pacientes. En los 61 casos con EP (P-B<−10UH), se encontró EH asociada en 19 pacientes (31%) (tabla 2). Aunque la EH en individuos con EP fue más frecuente que en el grupo con páncreas normal, y la EP también fue algo más frecuente en individuos portadores de EH (34% vs. 28% en pacientes sin EH), la asociación del compromiso de ambos órganos no fue significativa.
Discusión y conclusiónEl objetivo principal de nuestro trabajo fue estudiar la frecuencia de EP en una cohorte de pacientes chilenos sin enfermedad pancreática, centrar la atención sobre esta entidad poco conocida, cuya importancia clínica y fisiopatológica es sujeto de un creciente número de investigaciones. A diferencia del diagnóstico por imagen de EH, la presencia de EP se describe solo excepcionalmente en informes radiológicos. La primera dificultad radica en los criterios diagnósticos de EP mediante la detección de infiltración grasa por imagen. No hay mayor dificultad en el diagnóstico, cuando el páncreas entero está reemplazado por grasa, como en algunos casos raros de fibrosis quística23 o síndrome Johanson-Blizzard24. Tampoco es difícil el diagnóstico por imagen de lipomas de páncreas, donde existe un reemplazo completo focal, circunscrito del parénquima pancreático por grasa, donde en la mayoría de los casos se logra evitar así cirugías innecesarias25. Los criterios morfológicos de diferentes grados de infiltración grasa en las imágenes de TAC son claros: el páncreas es hipodenso en comparación con el bazo. Sin embargo, el valor numérico de corte que determina el grado mínimo de esteatosis significativa no está claramente definido: aunque no existe un valor de corte numérico generalmente consensuado26 algunos autores aceptan una diferencia páncreas-bazo <−5UH10, mientras que otros consideran un cociente páncreas/bazo <0.727. Singh et al. describieron en individuos sanos un contenido de grasa hasta del 6.2%28, otros aceptaron como el umbral histológico de EP significativo un contenido de grasa>10.4%29. Kim et al.20 describieron una excelente correlación entre el contenido de grasa medido en histología y los parámetros obtenidos por TAC. Al revisar el gráfico publicado por estos autores, el 10% del contenido de grasa coincide con una P-B −10UH y una P/B 0.8. Por esta razón elegimos el criterio de P-B<−10UH: una diferencia menor (−5UH) incluiría casos inciertos, mientras que el cociente 0.7 dejaría afuera individuos con EP.
Existen escasos estudios que hayan analizado la prevalencia de EP y a nuestro conocimiento no existe ninguno en Chile. Un estudio reciente realizado en China en 1,190 sujetos sometidos a examen médico, usando ecografía abdominal como instrumento diagnóstico, describe una prevalencia del 30.7% con correlación significativa con obesidad, diabetes y síndrome metabólico22. Esta asociación está descrita en múltiples estudios, tanto clínicos5 como anatomopatológicos30. En una revisión sistemática y metaanálisis realizado por Singh et al.28 estimaron que la prevalencia global de EP es de aproximadamente el 33%. Observaron que la EP tiene asociaciones significativas con hipertensión arterial, diabetes mellitus tipo 2 y el síndrome metabólico28. Una de las teorías más aceptadas indica que la EP contribuye a una pérdida progresiva de la masa de células beta que afecta su función, promoviendo la aparición de diabetes11,31,32.
En nuestra serie observamos una frecuencia similar de EP. Nuestras observaciones confirman el aumento de probabilidad de EP en relación con la edad y con el IMC. Es previsible que continúe el envejecimiento de la población en las siguientes décadas. Además, la vida sedentaria y la falta de equilibrio entre la ingesta y el gasto calórico favorece el aumento de la obesidad. Datos recientes confirman el aumento de la obesidad infantil en Chile al 24% a los 6 años, 15% a los 14 años y aun considerablemente más en adolescentes mayores de 15 años, con una prevalencia global de obesidad del 34%14. La obesidad está asociada a un estado proinflamatorio; por otro lado, la inflamación de bajo grado favorece la acumulación de grasa33.
No pudimos confirmar asociación significativa entre EP y diabetes, aunque observamos más diabéticos entre los individuos con EP. El valor elevado de colesterol, pero no de los triglicéridos, fue más frecuente entre los portadores de EP. La asociación fue débil; sin embargo, no conocemos datos del eventual tratamiento con estatinas, frecuente en la población mayor.
La importancia clínica de EP es todavía incierta. Hace 40 años, en trabajos del grupo de Bordalo, presentaron imágenes histológicas demostrando una secuencia de infiltración grasa - fibrosis - pancreatitis crónica en alcohólicos34,35, pero su teoría no fue aceptada ampliamente. Solo recientemente se publicó evidencia acerca de la EP como factor de riesgo en el desarrollo de pancreatitis crónica, aun independiente del consumo del alcohol36 y un reporte de 3 casos portadores de pancreatitis crónica avanzada, donde los autores plantean la importancia etiológica de dislipidemia y EPNA37. Cabe enfatizar que ninguno de nuestros pacientes tenía enfermedad clínicamente manifiesta del páncreas exocrino.
Los datos sobre la asociación de EPNA y EHNA son variables: algunos autores describieron compromiso simultáneo de hígado y páncreas19 en sus pacientes, mientras que otros no38. En EHNA la grasa se acumula dentro de los hepatocitos; en el páncreas, en cambio, la acumulación de grasa ocurre dominantemente en los espacios inter- o intralobulares, dejando indemnes las células exo- y endocrinas. Sin embargo, alteraciones morfológicas y funcionales de los islotes están descritas en varios trabajos en obesos, aun en prediabetes y en particular en sexo masculino39. La secreción disminuida de insulina aumenta la acumulación ectópica de grasa, incluyendo el páncreas, que a su vez deteriora más la función de células beta, completando un círculo vicioso. En nuestro trabajo, la asociación entre el compromiso hepático y pancreático fue débil e inconsistente. Tomando en cuenta lo descrito previamente, existiendo compromiso simultáneo de hígado y páncreas, hay un riesgo mayor de la progresión de EHNA por el deterioro de la función endocrina del páncreas, con la consecuente aparición de diabetes.
En nuestro estudio se observó una prevalencia alta de EPNA en estudios radiológicos no seleccionados, realizados por patologías extrapancreáticas. Este número elevado señala que la infiltración grasa del páncreas no provoca sintomatología clínica, molestias abdominales en la inmensa mayoría de los individuos, tampoco produce insuficiencia exo- y endocrina clínicamente manifiesta. Por otra parte, si solo una minoría de EPNA genera un daño progresivo hacia una enfermedad crónica, compromiso del páncreas endo- y exocrino, esta prevalencia elevada presta importancia epidemiológica a la detección precoz y seguimiento de la EP. Solo un seguimiento largo de individuos portadores de EP puede responder a la pregunta: ¿Progresa la EP hacia un daño pancreático crónico, aunque solo en una minoría de los casos, similar al hígado?
Este estudio tiene ciertas limitaciones. Es un estudio unicéntrico, en el cual no se hizo selección de los sujetos incluidos. El estudio fue realizado en una población muy concreta de pacientes con síntomas abdominales, lo que puede asociarse a sesgo, al no ser extrapolables los resultados a la población general. Por su carácter retrospectivo, falta información en relación con otras enfermedades concomitantes de los pacientes, medicamentos y consumos de alcohol y tabaco, que podrían haber sido relevantes en el análisis.
En conclusión, en el presente estudio observamos EP asintomática con alta frecuencia en pacientes que se realizaron TAC de abdomen en 2 meses consecutivos en nuestro hospital. La EP se asocia en forma significativa con mayor edad y aumento de IMC. Su prevalencia está creciendo paralelamente con el envejecimiento de la población y con el aumento de la obesidad. Se requiere atención dedicada a su existencia tanto de parte de los radiólogos como de los diabetólogos y gastroenterólogos. Solo estudios prospectivos pueden aclarar la evolución del páncreas graso, sus consecuencias sobre la función pancreática exo- y endocrina.
FinanciaciónLa presente investigación no ha recibido ayudas específicas provenientes de agencias del sector público, sector comercial o entidades sin ánimo de lucro.
Conflicto de interesesLos autores declaran no tener conflicto de interés.



![Correlación esteatosis pancreática (diferencia páncreas-bazo [UH]) y edad (años). Correlación esteatosis pancreática (diferencia páncreas-bazo [UH]) y edad (años).](https://static.elsevier.es/multimedia/03750906/0000008800000002/v2_202305231132/S0375090621001129/v2_202305231132/es/main.assets/thumbnail/gr2.jpeg?xkr=ue/ImdikoIMrsJoerZ+w97o/wdEXW47bqlyT1CqG6R0=)
![Correlación esteatosis pancreática (diferencia páncreas-bazo [UH]) e IMC (kg/m2). Correlación esteatosis pancreática (diferencia páncreas-bazo [UH]) e IMC (kg/m2).](https://static.elsevier.es/multimedia/03750906/0000008800000002/v2_202305231132/S0375090621001129/v2_202305231132/es/main.assets/thumbnail/gr3.jpeg?xkr=ue/ImdikoIMrsJoerZ+w97o/wdEXW47bqlyT1CqG6R0=)

