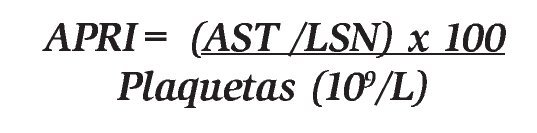¿ Introducción
La hepatitis crónica por virus C (VHC) es considerada como una de las enfermedades infecciosas más frecuentes y de mayor morbi-mortalidad a nivel mundial.1-3
Considerando que la progresión a cirrosis es una característica de las enfermedades crónicas del hígado, la determinación del grado de fibrosis hepática (FH) constituye uno de los principales factores que determina el pronóstico y el manejo de la hepatitis viral crónica.4 En los pacientes con hepatitis crónica por VHC, la evaluación de fibrosis e inflamación es crucial para determinar la progresión de la lesión y definir el tratamiento.5,6
El estudio histopatológico de la biopsia hepática (bxH) es actualmente el método de referencia para evaluar el grado de fibrosis e inflamación;7 sin embargo, la bxH es un procedimiento invasivo, que no está exento de riesgo, lo cual ha limitado su mayor aplicación en la práctica clínica.8
En años recientes se han propuesto diferentes alternativas indirectas pero no invasivas para evaluar el grado de fibrosis e inflamación hepática,9,10que incluyen la obtención de modelos a partir de la combinación de varios parámetros bioquímicos (índice de la relación AST/plaquetas [APRI]; índice de Forns [IF]), o por medición de diferentes biomarcadores en suero (índice de fibrosis o fibrotest) o en aliento (prueba en aliento con metacetina);11 así como mediante estudios de imagen (tomografía axial computada) o a partir de la evaluación de la rigidez del hígado por medio de ultrasonido (elastrografía).12
El APRI o índice de la relación AST/plaquetas fue descrito por Wai y colaboradores13 en pacientes con hepatitis crónica por VHC sin tratamiento previo. El índice de Forns es un sistema de puntaje que combina edad, gamma-glutamil-traspeptidasa (GGT), colesterol y el número de plaquetas.14
El objetivo del presente estudio fue evaluar el IF y APRI para predecir la presencia de fibrosis en pacientes mexicanos con diagnóstico de hepatitis crónica por VHC.
¿ Métodos
Pacientes: Se estudiaron 178 pacientes con hepatitis crónica por virus C. El diagnóstico se estableció por la presencia de anticuerpos para virus de la hepatitis C (VHC, ELISA de tercera generación) y detección del ácido ribonucléico del VHC (PCR Cobas Amplicor, versión 2.0, Roche Molecular systems, WTC, México D.F). Para establecer el grado de inflamación y de fibrosis se evaluó el índice de actividad histológica de la biopsia hepática.
Se excluyeron los pacientes con antecedente de tratamiento antiviral previo o actual; enfermedad hepática crónica concomitante (alcohol, virus de hepatitis B, autoinmune); enfermedades graves del sistema cardiovascular, pulmonar o renal; enfermedades malignas de cualquier origen; alteraciones en la coagulación; trasplante hepático. También se excluyeron pacientes que no contaban con pruebas bioquímicas completas para evaluación funcional hepática o cuya biopsia hepática fue catalogada como de "mala calidad" (ver descripción en el siguiente apartado).
A todos los pacientes se les tomó una muestra de sangre en ayuno mínimo de 12 horas para la medición de las pruebas bioquímicas hepáticas (aminotransferasas, bilirrubinas, tiempos de coagulación, albúmina, globulinas, colesterol y plaquetas) las cuales fueron analizadas en el equipo Modular Analytics P marca ROCHE/HITACHI (2010 F. Hoffmann-La Roche, Ltd).
Biopsia hepática e Histopatología hepática: La biopsia hepática se realizó bajo la técnica convencional. Se utilizó Tru-Cut y en algunos casos pistola automática (Bard®); el espécimen se fijo en formalina a 10% y fue procesada bajo la técnica habitual; posteriormente fueron teñidas con hematoxilina-eosina, PAS con diastasa (ácido periódico de Schiff) y tricrómico de Masson.15 Todas las biopsias fueron evaluadas por un patólogo con experiencia en hepatología, quien estuvo cegado a los resultados clínicos y de laboratorio. La FH fue evaluada de acuerdo a la escala de Knodell, en una escala de 0 a 4: (F0 = sin fibrosis; F1 = fibrosis portal; F3 = puentes de fibrosis; F4 = cirrosis).16
Para evaluar la calidad de la biopsia se utilizaron los criterios de Regev: cuando la biopsia tuvo una longitud mayor o igual que 15 mm, cinco o más espacios porta y un solo fragmento, se consideró óptima; una biopsia entre 10 y 15 mm de longitud, con menos de 5 espacios porta o fragmentada se consideró como biopsia de "calidad regular"; y si fue menor a 10 mm de longitud se consideró de "mala calidad".17
Índice de Forns (IF): Para calcular el IF se utilizaron cuatro variables: edad (años cumplidos), niveles de GGT (UI/L), colesterol (mg/dL) y conteo plaquetario (109/L); el cálculo se llevó a cabo utilizando la fórmula propuesta por Forns y colaboradores en 2002, la cual se describe a continuación:14
IF = 7.811 - 3.131.ln (plaquetas) + 0.781.ln (GGT) + 3.467.ln (edad) - 0.014 (colesterol).
Índice APRI: Para calcularlo se utilizan dos mediciones bioquímicas, AST (UI/L) y conteo plaquetario (109/L). Se calculó utilizando la fórmula propuesta por Wai y colaboradores en 2003:13
Análisis estadístico: Las características demográficas se describen en términos de promedios (± una desviación estándar), mediana (intervalos) y porcentajes. Se realizaron curvas de características operativas para el receptor (curva COR) para la obtención de los puntos de corte para cada uno de los índices. Se evaluó sensibilidad (Sn), especificidad (Sp), valor predictivo positivo (VPP), y valor predictivo negativo (VPN). El punto de corte óptimo de cada uno de los índices se definió como el punto con la mayor sensibilidad y especificidad para identificar a los pacientes con diferentes grados de fibrosis. Un paciente fue clasificado como positivo cuando el valor del índice fuer mayor al valor de corte óptimo establecido. Para establecer el diagnóstico de fibrosis hepática, se consideró el resultado de la escala de Knodell. El análisis se realizó utilizando el paquete SPSS para Windows (versión 17.0; SPSS, Chicago, IL, USA).
¿ Resultados
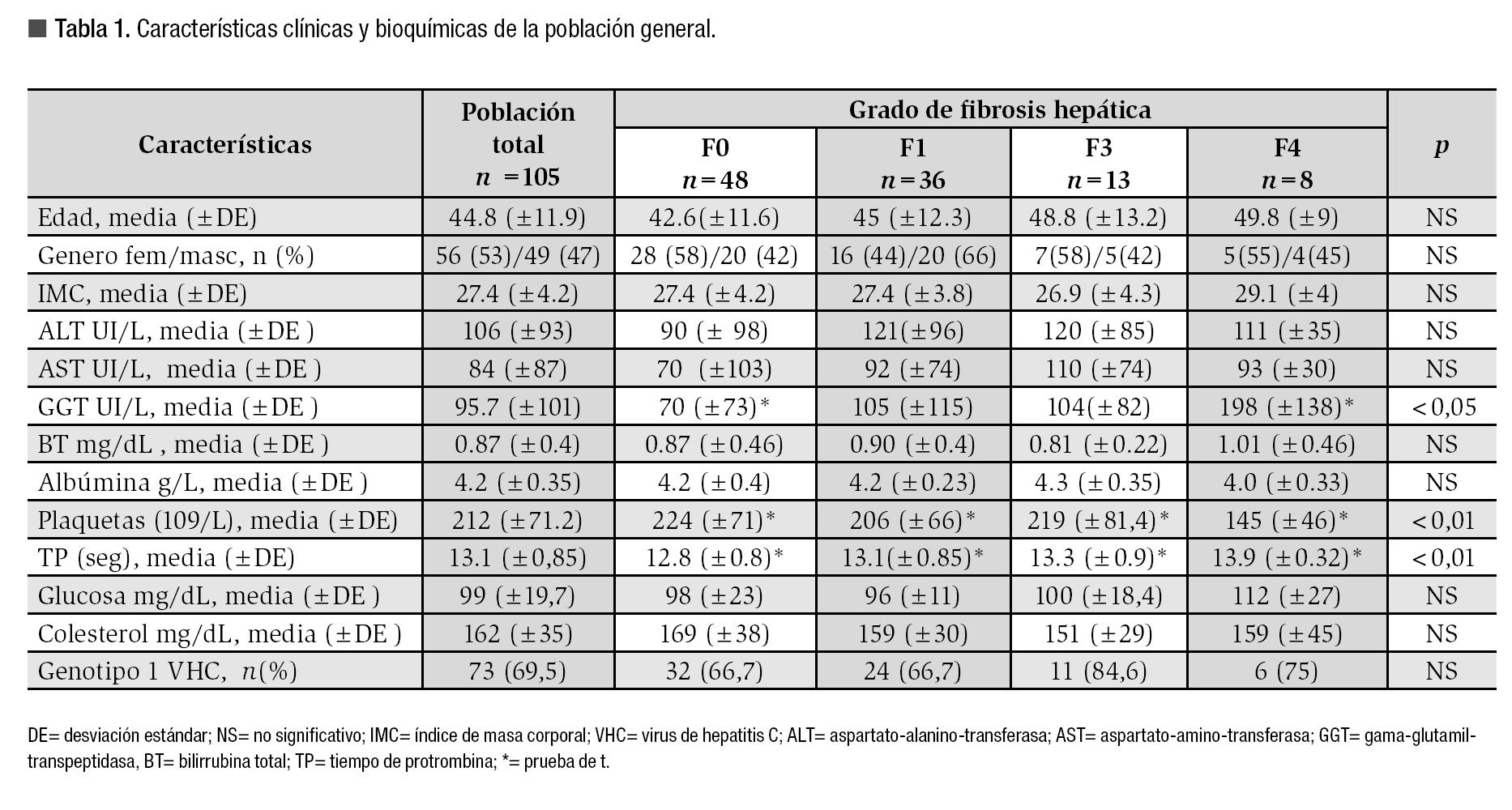
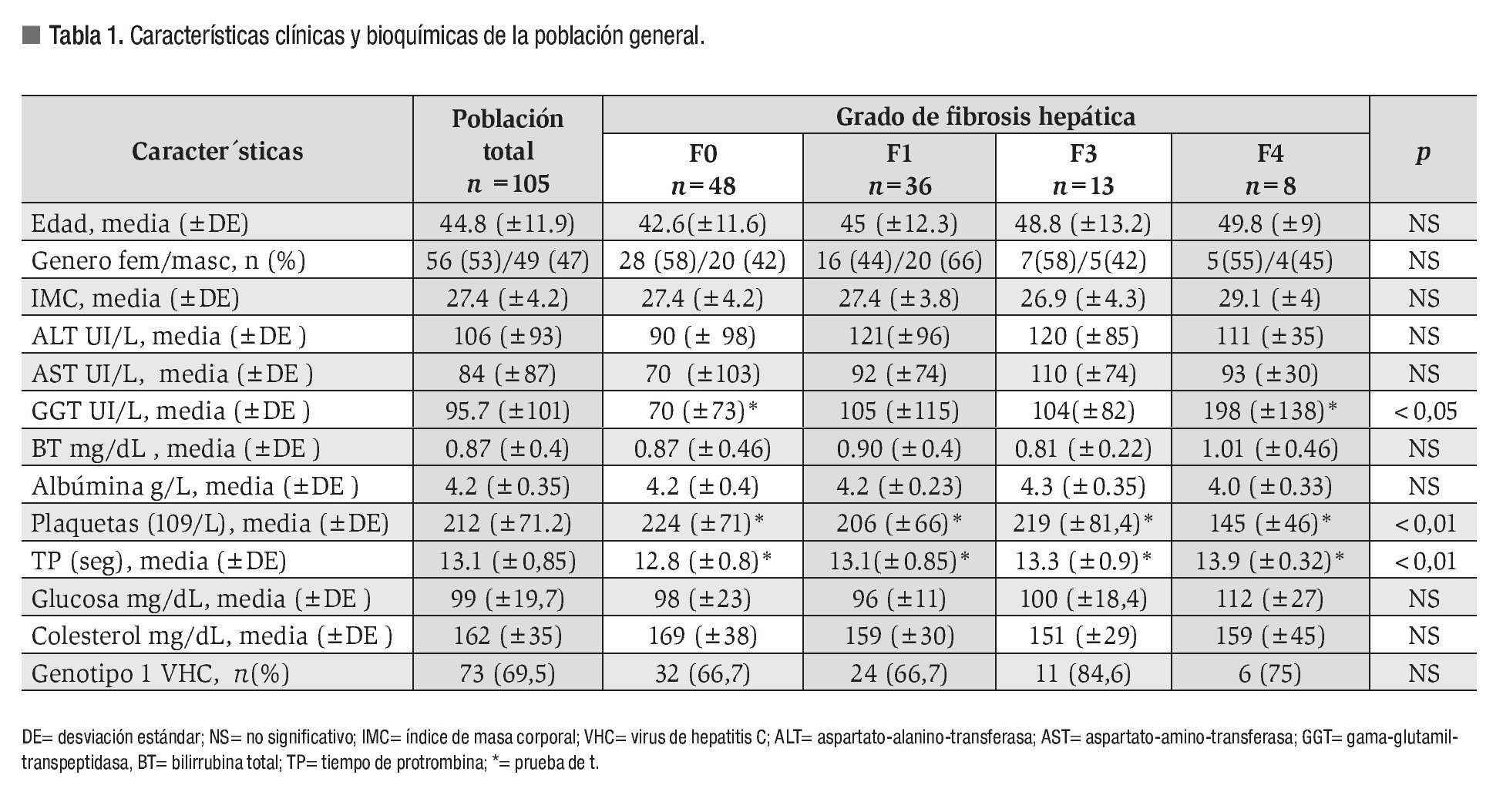
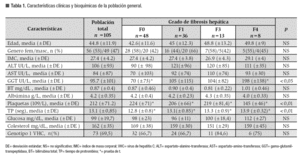
De los 178 pacientes estudiados, se incluyeron 105 pacientes con edad promedio de 44.8 ±11.9 años; 56 mujeres y 49 hombres. Se excluyeron 73 casos: por enfermedad hepática concomitante (n = 45), pruebas bioquímicas incompletas (n = 22) y biopsia hepática de "mala calidad" (n = 6). Las características demográficas y los resultados de laboratorio de la población, se resumen en la Tabla 1.
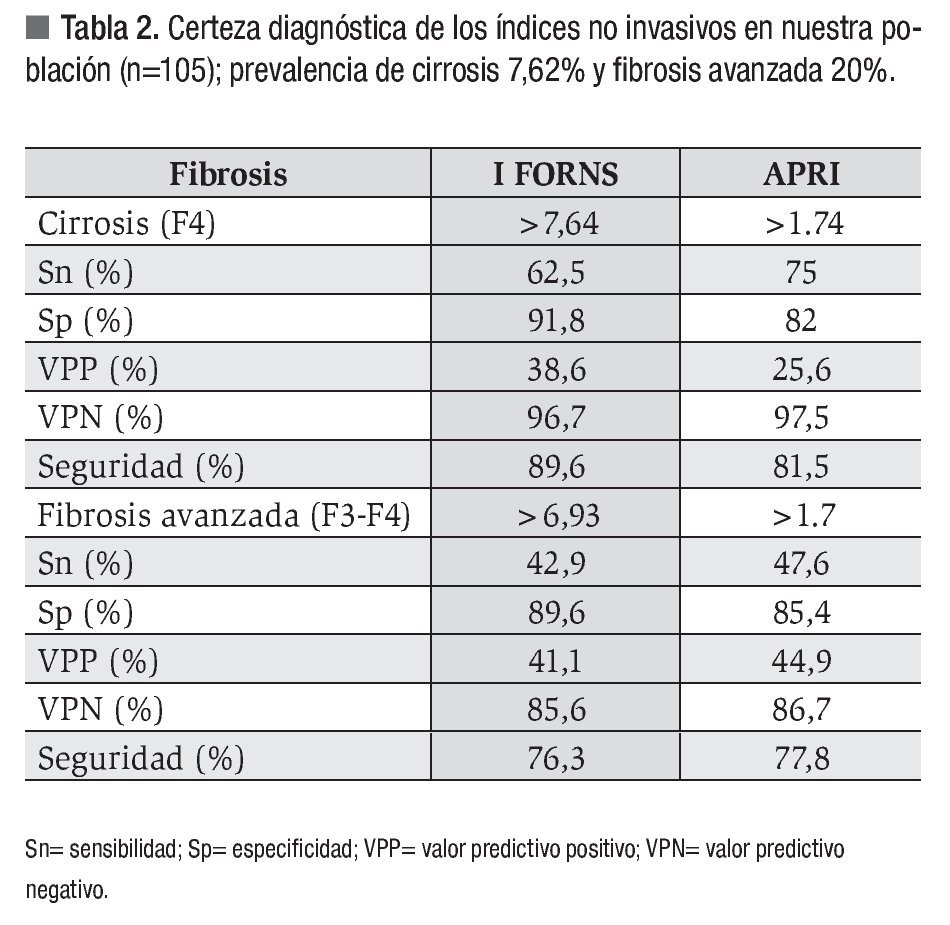
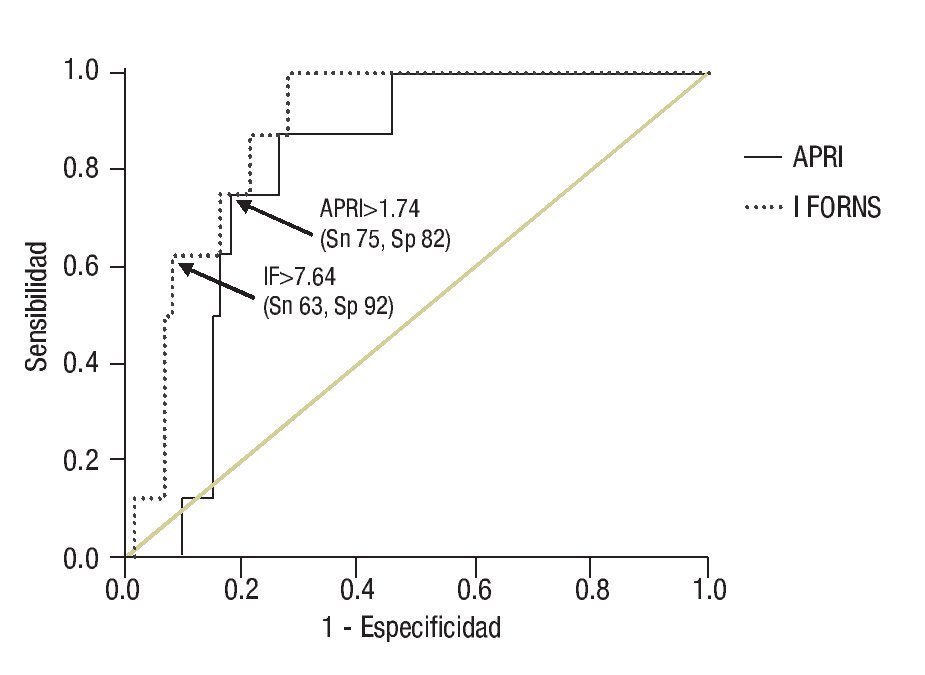
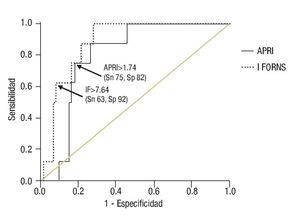
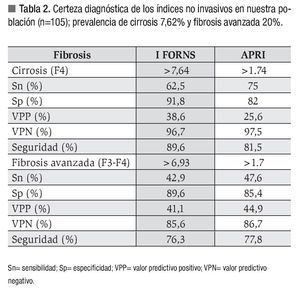
Con base a la escala de Knodell, se estableció el diagnóstico de ausencia de fibrosis (F0) n= 48, fibrosis portal (F1) n = 36, puentes de fibrosis (F3) n = 13 y cirrosis (F4) n = 8.La curva COR para el IF reveló que el mejor punto de corte para predecir cirrosis (F4) fue mayor que 7.64, con Sn 62.5% y Sp 91.8%, con un ABC de 0.881 (Figura 1). Considerando el punto de corte mayor que 6.9, la Sp disminuyó a 86.9%. El APRI mayor que 1.74 pudo predecir F4 con Sn 75% y Sp 82%, con un ABC de 0.799. Considerando el punto de corte mayor que 1.5, la Sp disminuyó a 78.7% (Tabla 2).
¿ Figura 1. Muestra la curva COR con los valores del IF y APRI para predecir la presencia de cirrosis (F4) en paciente con hepatitis crónica por VHC (n = 105). El ABC para el IF es 0.881 y para el APRI es 0.799.
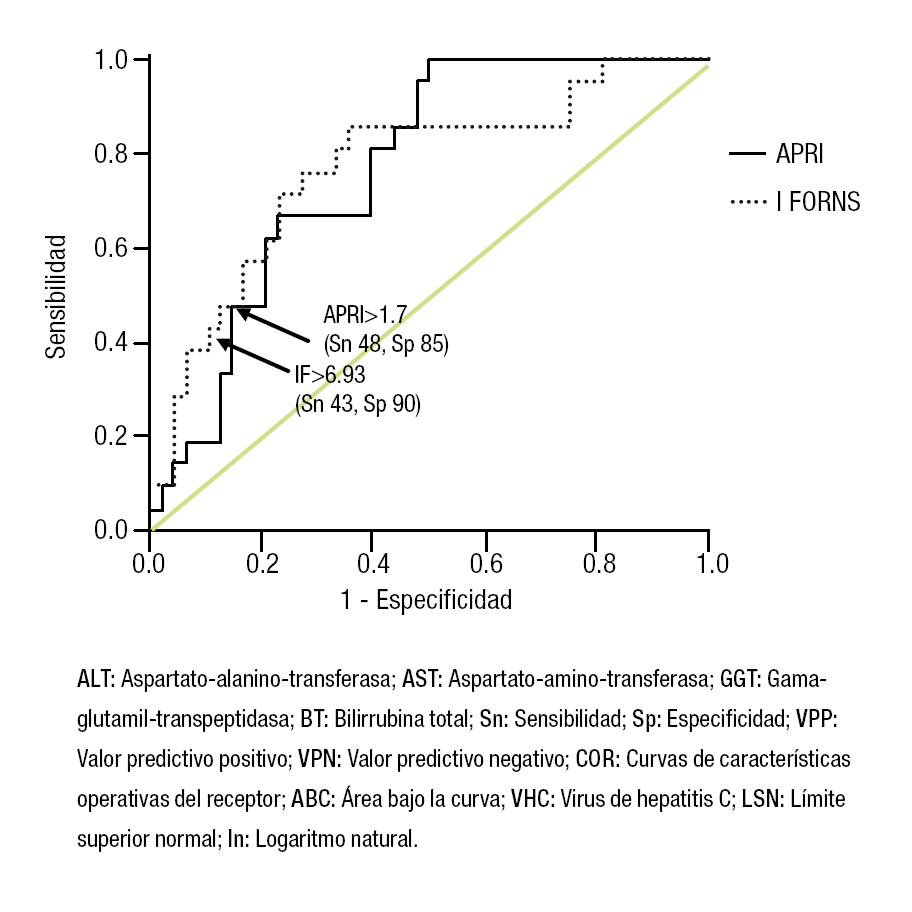
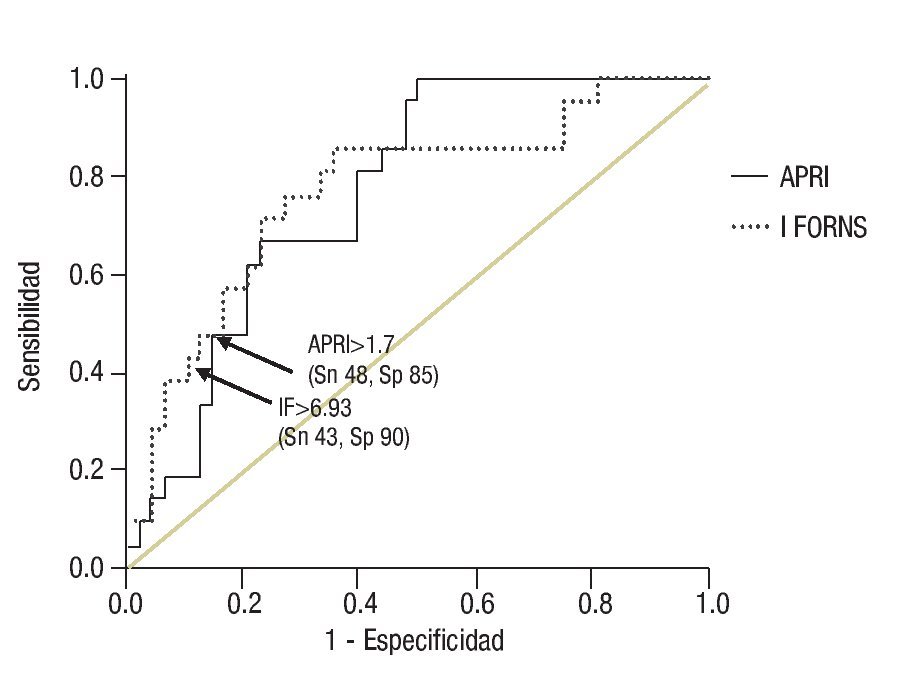
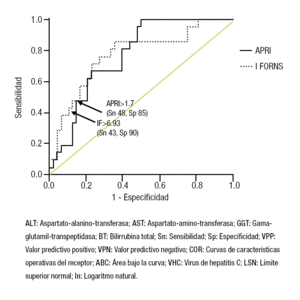
La curva COR para el IF y predecir fibrosis avanzada (F3-F4), reveló que el mejor punto de corte fue mayor que 6.93, con Sn 42.9% y Sp 89.6%, con un ABC de 0.772. El APRI mayor que 1.7 pudo predecir F3-F4 con Sn 47.6% y Sp 85.4%, con un ABC de 0.768 (Figura 2).
¿ Figura 2. Muestra la curva COR con los valores del IF y APRI para predecir la presencia de fibrosis avanzada (F3-F4) en paciente con hepatitis crónica por VHC (n = 105). El ABC para el IF es 0.772 y para el APRI es 0.768.
En fibrosis portal (F1), la curva COR para el IF reveló que el mejor punto de corte para predecir F1 fue menor que 3.8, con Sn 75% y Sp 33%, con un ABC de 0.541. El APRI menor que 0.5, pudo predecir F1 con Sn 75% y Sp 33%, con un ABC de 0.554.
¿ Discusión
Considerando el punto de corte mayor que 6.9, referido originalmente por Forns y colaboradores, la Sp disminuye a 86.9%. Considerando el punto de corte mayor que 1.5, referido por Wai y colaboradores, la Sp disminuye a 78.7%.
Los resultados del presente estudio confirman la utilidad de los índices de Forns y APRI para predecir con aceptable grado de certeza la presencia de cirrosis o de fibrosis avanzada en pacientes con hepatitis crónica por VHC, pero muestran su limitación para predecir fibrosis incipiente.
Es importante mencionar que los puntos de corte obtenidos a partir de las curvas COR en este grupo de pacientes difieren de los informados originalmente por sus autores,13,14 probablemente debido a la diferencia en los métodos y equipos utilizados para la medición de las variables bioquímicas incluidas en los índices.
La situación anterior confirma la importancia de llevar a cabo estudios de validación y por consiguiente la obtención de sus propios puntos de corte en cada centro, donde se pretenda utilizar los índices de fibrosis como herramientas para la selección e inclusión de pacientes con hepatitis crónica por VHC a diferentes esquemas de tratamiento.
Comparando los resultados de las curvas COR, se observó un mejor desempeño del IF en comparación al índice APRI para la predicción de cirrosis y fibrosis avanzada, hallazgo que también se ha reportado en estudios previos.18 Probablemente la inclusión de un mayor número de variables en el IF, expliquen parcialmente su mejor rendimiento en la predicción de fibrosis avanzada y cirrosis.
En nuestro estudio el IF obtuvo una mejor especificidad para detectar cirrosis y fibrosis avanzada (91.8% y 89.6%, respectivamente) que el índice APRI (82% y 85.4%, respectivamente). Ambos índices alcanzaron un valor predictivo negativo para cirrosis mayor a 96% y >85% para fibrosis avanzada, pero la especificidad para identificar fibrosis portal (F1) fue baja.
Estudios similares han sido reportados aunque evaluando únicamente el índice APRI, una revisión sistemática sobre la exactitud diagnóstica del índice APRI encontró que en 22 estudios la sumatoria de la curva COR para fibrosis significativa y cirrosis fue de 0.76 y 0.82, respectivamente.19
Loaeza-del Castillo y colaboradores,20 evaluaron el índice APRI en pacientes mexicanos con hepatitis C, hepatitis autoinmune y enfermedad por hígado graso no alcohólico, y encontraron que en el subgrupo de hepatitis C (n = 164) la curva COR para fibrosis significativa fue de 0.776 y para cirrosis 0.830, con sensibilidad de 89% y especificidad de 70.9%. Otros estudios como el reportado por Shin y colaboradores,21 han evaluado también el índice APRI en un subgrupo de pacientes con hepatitis crónica B encontrando una curva COR de 0.86 para fibrosis avanzada. Finalmente McGoogan y colaboradores22 evaluaron el APRI en población pediátrica con resultados limitados, la curva COR fue de 0.71 y 0.52 para fibrosis y cirrosis, respectivamente.
Ninguno de los índices de evaluación indirecta de fibrosis hepática ha demostrado ser útil en la identificación de fibrosis incipiente y por lo tanto su utilidad se limita a identificar aquellos pacientes con mal pronóstico para el tratamiento debido a su avanzado grado de fibrosis. En cambio en los pacientes con hepatitis crónica por VHC, que de acuerdo a los índices se excluya la presencia de fibrosis avanzada, la biopsia hepática sigue siendo la mejor prueba de referencia para conocer el grado de fibrosis antes de iniciar el tratamiento antiviral.23,24
La inclusión del estudio histopatológico como método de referencia no está exento de sesgos; tanto por el posible error de lectura, pero principalmente por error de muestreo del tejido hepático, considerando que en la hepatitis C el daño hepático no es uniforme. Para tratar de minimizar el efecto de estos sesgos en el presente estudio la lectura de las biopsias las realizó un solo patólogo y para garantizar la calidad de las mismas se utilizó los criterios de Regev.
Entre las limitaciones del estudio se podría mencionar la selección de los pacientes por tratarse de un centro de referencia que probablemente no representa a la población general y finalmente la inclusión de un número muy pequeño de pacientes con cirrosis (F4).
En el presente estudio, el porcentaje de sujetos con fibrosis avanzada fue 20% y con cirrosis 7.6%, distribución similar a la población de estudio de Forn y colaboradores,14 que informaron 26% con fibrosis avanzada y 6% con cirrosis. En cambio el grupo de pacientes incluidos en el estudio de Wai y colaboradores,13 49% tenían fibrosis avanzada y 16% cirrosis. Esta situación también puede influir en los resultados de evaluación de los índices. Por ejemplo, la disminución observada en los valores de predicción del índice APRI pudo estar determinada en el presente estudio, tanto por la distribución de los pacientes por grado de fibrosis y así como por la similar concentración de AST entre los grupos con diferentes grados de fibrosis.
Recientemente, Castera y colaboradores25 han propuesto algoritmos combinando métodos serológicos no invasivos y elastografía, evaluando su rendimiento en la identificación de fibrosis hepática y principalmente evitando con dicho algoritmo la realización de biopsias hepáticas en 50% de los pacientes con fibrosis significativa y en 70% de los casos con cirrosis, uno de los objetivos futuros de estos modelos y algoritmos en la aplicación clínica.
Los resultados del presente estudio sugieren un mejor rendimiento del IF en comparación al índice APRI para predecir fibrosis avanzada, en pacientes con hepatitis crónica por virus C. Se requiere la realización de otros estudios que comparen el rendimiento de los índices de Forns y APRI y de otros métodos no-invasivos como fibrotest, prueba en aliento con metacetina y elastografía, en la predicción de fibrosis hepática para su valoración y potencial inclusión en la práctica clínica.
¿ Agradecimientos y declaraciones
Proyecto realizado con el Apoyo del FIS/IMSS/ PROT/546.
Correspondencia: M. en I. C. Nayeli Xochiquetzal Ortiz Olvera.
Ave. Cuauhtémoc 330, Colonia Doctores, Delegación Cuauhtémoc. CP. 06725.
Teléfono: 0155 5627 6900 ext. 21565 21566.
Correo electrónico: nayelixoortiz@yahoo.com.mx
Recibido el 26 de agosto de 2010;
aceptado el 9 de octubre de 2010.