¿ Introducción
Los simuladores han sido ampliamente utilizados como método de enseñanza ya que reproducen situaciones especialmente difíciles o poco frecuentes. La coordinación cerebro-ojo-mano es indispensable para el desarrollo de las destrezas en la endoscopia gastrointestinal. Los simuladores biológicos permiten el entrenamiento y el desarrollo de las destrezas en los endoscopistas.1,2
Existen diferentes tipos de simuladores para el desarrollo de habilidades y destrezas.3-7 En el estudio realizado por Ramírez-Solís y colaboradores.2 en simuladores biológicos inanimados se observó que es factible la realización de lesiones del tracto gastrointestinal con una similitud de 94% para lesiones submucosas, 86.5% para lesiones sangrantes y 88.2% para compresiones extrínsecas. El uso de estos simuladores permite la práctica de habilidades para describir lesiones, así como realizar procedimientos terapéuticos sin limitar el número de ocasiones en que puede llevarse a cabo, así como conocer y manejar las complicaciones potenciales de los mismos. Los simuladores biológicos han sido utilizados para la resección endoscópica de la mucosa (REM), disección endoscópica de la submucosa (DES), drenaje de pseudoquistes pancreáticos, manejo de coledocolitiasis y lesiones sangrantes.
El cáncer gástrico incipiente está limitado a la mucosa o submucosa (T1) independientemente de la presencia de ganglios linfáticos.8 El tratamiento endoscópico (resección endoscópica de la mucosa [REM] y disección endoscópica de la submucosa [DES]) es el manejo estándar en lesiones gástricas incipientes.9,11 Tiene una eficacia es similar a la cirugía, es mínimamente invasivo y con menor costo,12 además permite la valoración histológica de la pieza para planeación de tratamientos subsecuentes y seguimiento.13 La REM tiene como limitante el tamaño de la lesión (lesiones mayores de 15 mm requieren resección fragmentada con una interpretaciones patológicas errónea y mayor tasa de recurrencia).14-17 La DES permite la resección en bloque de lesiones de mayor tamaño.18-23
El objetivo de este estudio fue evaluar el uso de modelos biológicos inanimados en el entrenamiento endoscópico para el desarrollo de destrezas en las cuatro diferentes fases (marcaje, inyección, precorte y disección) de la DES.
¿ Métodos
Se llevó a cabo este estudio experimental en junio de 2009 en el Instituto Nacional de Cancerología. Se seleccionaron en forma no aleatoria a cinco endoscopistas entrenados con conocimiento teórico pero sin experiencia previa en la técnica de DES. Durante la evaluación recibieron asesoramiento continuo por un tutor. Evaluamos las cuatro fases del procedimiento en cuanto a: éxito técnico, complicaciones, tiempo (en cada fase y total), autoevaluación de la destreza y evaluación por el tutor.
Diseño: Diseño experimental sin grupo control en un modelo biológico inanimado para evaluar el desarrollo de destrezas. Se evaluaron los siguientes puntos:
A. Habilidades Manuales
B. Curva de aprendizaje para las cuatro fases:
a. Marcaje de lesiones,
b. Técnica de inyección submucosa,
c. Precorte y
d. Disección Submucosa con IT-Knife 2
C. Tasa de éxito
D. Complicaciones (perforación) y su manejo Cada una de estas destrezas fue medida en forma independiente por los tutores y por los mismos participantes (auto-evaluación) con una escala visual análoga de Likert de 10-puntos. Todas las fases fueron medidas (minutos) para construir la curva de aprendizaje.
Sujetos: Cinco endoscopistas entrenados con más de cinco años de experiencia. Cada participante practicó la técnica de DES en lesiones gástricas simuladas entre 10 mm a 20 mm localizadas sobre la cara posterior del cuerpo gástrico en modelo animal inanimado (estómago de cerdo). Al final de cada fase de la sesión de entrenamiento, las destrezas de cada alumno fueron evaluadas para todas las técnicas por el tutor y mediante la auto-evaluación. El alumno recibió retro-alimentación del tutor que incluyó un análisis detallado de la técnica.
Tutor: Endoscopista con entrenamiento teórico y práctico en DES con 30 procedimientos realizados en modelos biológicos y pacientes.
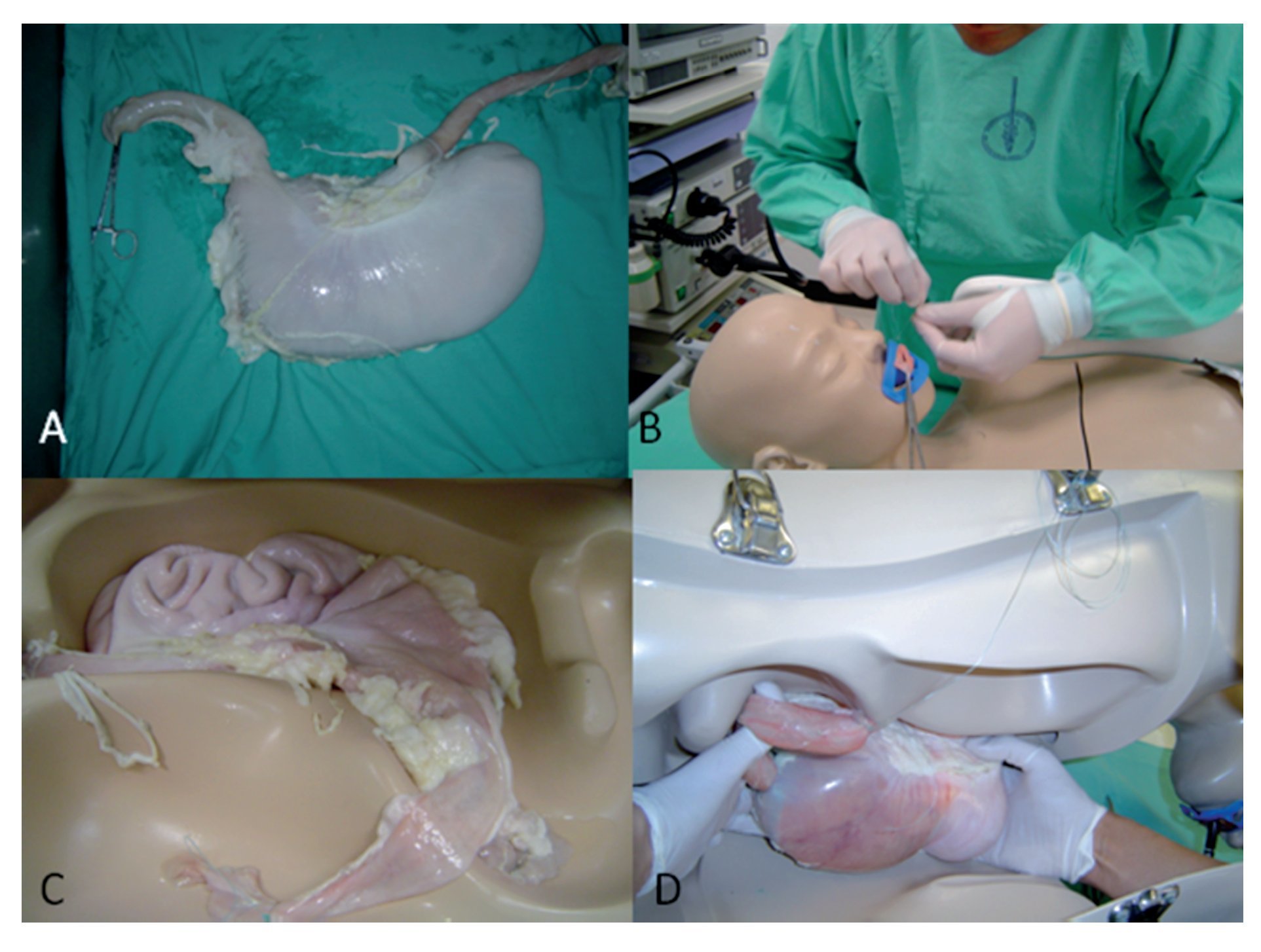
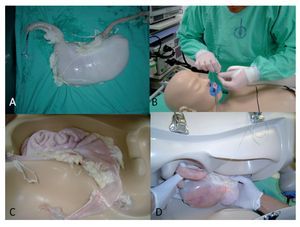
Preparación de las lesiones: Se obtuvieron bloques de órganos de abdomen superior de cerdos (esófago, estómago, duodeno y epiplón mayor) del rastro. Posteriormente, se simularon lesiones ovales, elevadas o ligeramente elevadas, sin depresión de 10 mm a 20 mm de diámetro en el estómago. La preparación de las lesiones se llevó a cabo en la Unidad de Endoscopia en el Instituto Nacional de Cancerología de la Ciudad de México. El bloque de abdomen superior fue colocado dentro de un maniquí Olympus modelo Olyver 1. En todos los casos, los procedimientos endoscópicos se realizaron en las primeras seis horas de haber preparado los modelos (Figura 1).
¿ Figura 1 A. Preparación de tejido B. Fijación al maniquí C. Montaje del bloque de órganos D. Montaje final.
Materiales: Se usó un videoendoscopio diagnóstico (GIF 100; Olympus America Corp, Melville, NY) de uso exclusivo para animales, unidad electroquirúrgica (ACC 300; ERBE Corp., Mariella, Ga), accesorios endoscópicos: cuchillo aguja diseñado para precorte Olympus, hemoclips, agujas para inyección, IT knife2.
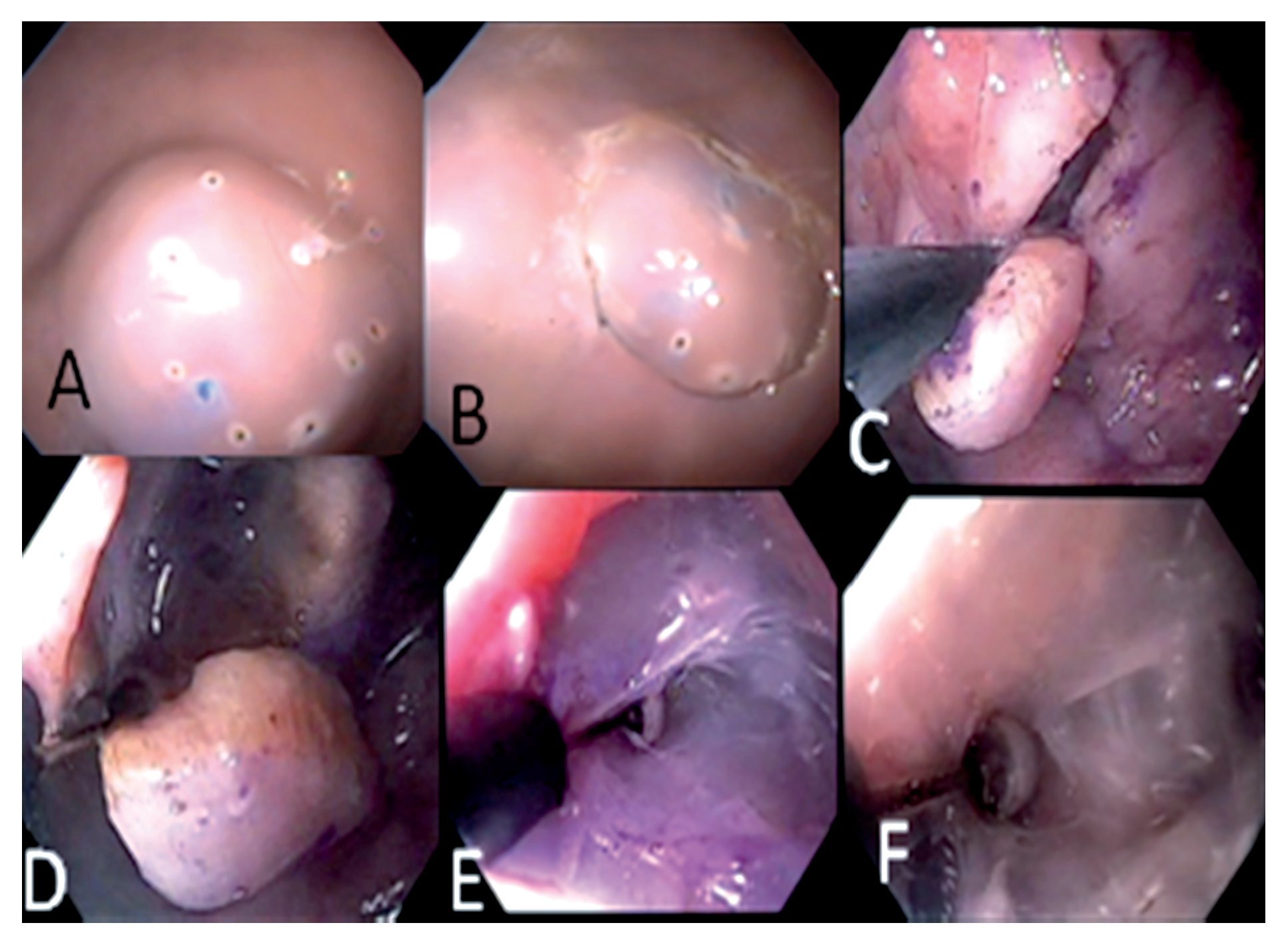
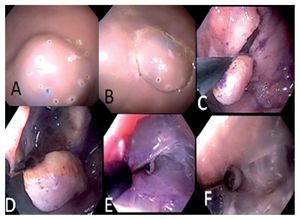
Evaluación de destrezas: Se evaluaron las cuatro fases de la DES que se describen a continuación: 1. Marcaje de lesiones: consistió en la colocación de marcas cada 5 mm mediante electrocoagulación bipolar en sentido horario alrededor de la lesión en forma circular. Fue medida en escala ordinal de uno a 10 puntos (uno es peor y 10 mejor), así como el tiempo requerido. Se evaluaron los errores y la necesidad de asistencia por el tutor. La precisión y redondez del círculo alrededor de la lesión tuvo mayor valor que la rapidez de realización. (Figura 2A)
¿ Figura 2 A. Inyección y marcaje B. Precorte C-F. Disección de plano submucoso.
2. Inyección: consistió en la preparación y prueba de la aguja de escleroterapia, la técnica de inyección de la submucosa en forma oblicua para elevar la lesión en forma satisfactoria. El tiempo requerido fue medido. (Figura 2A). Se utilizó solución salina con índigo carmín para inyección submucosa.
3. Precorte: Consistió en conectar adecuadamente el generador de corriente, la selección correcta de la fuente de poder y su intensidad, el uso adecuado de los comandos, así como la realización del corte en forma circular igual o mayor de 2 mm por fuera de la línea de marcas. Se realizó con el cuchillo de precorte Olympus. El tiempo requerido fue medido. (Figura 2B)
4. Disección submucosa: consistió en realizar la disección submucosa mediante IT-Knife 2® de Olympus, se evaluó por el tutor que el operador mantuviera el plano submucoso y el tiempo de la disección. La precisión y la cantidad del bloque obtenido por fuera del la línea de marcaje del círculo alrededor de la lesión tuvo mayor valor que la rapidez de realización. El tiempo requerido fue medido. (Figura 2C-F)
Además se evaluaron los siguientes parámetros:
Perforación: consistió en evaluar la presencia de esta complicación en el bloque de tejido.
Márgenes libres de tumor: consistió en observar las marcas previas íntegras después del corte.
Clips para el manejo de la perforación: consistió en colocar uno o varios clips sobre el sitio de perforación y evaluar el tiempo promedio y el éxito técnico. Se midieron en forma independiente: preparar-activar, montar, identificar sitio de perforación, posicionamiento del endoscopio y liberación.
El promedio global de las cuatro fases de la DES y cada una de ellas fueron calculados en el puntaje final.
Estadística: Se realizó estadística descriptiva con medidas de tendencia central (promedio y desviaciones estándar). Se realizó análisis de varianza para la diferencia entre grupos (tiempo en minuto por fase). Se calculó la correlación Momento-Producto de Pearson para el tamaño de la lesión y el tiempo global del procedimiento.
¿ Resultados
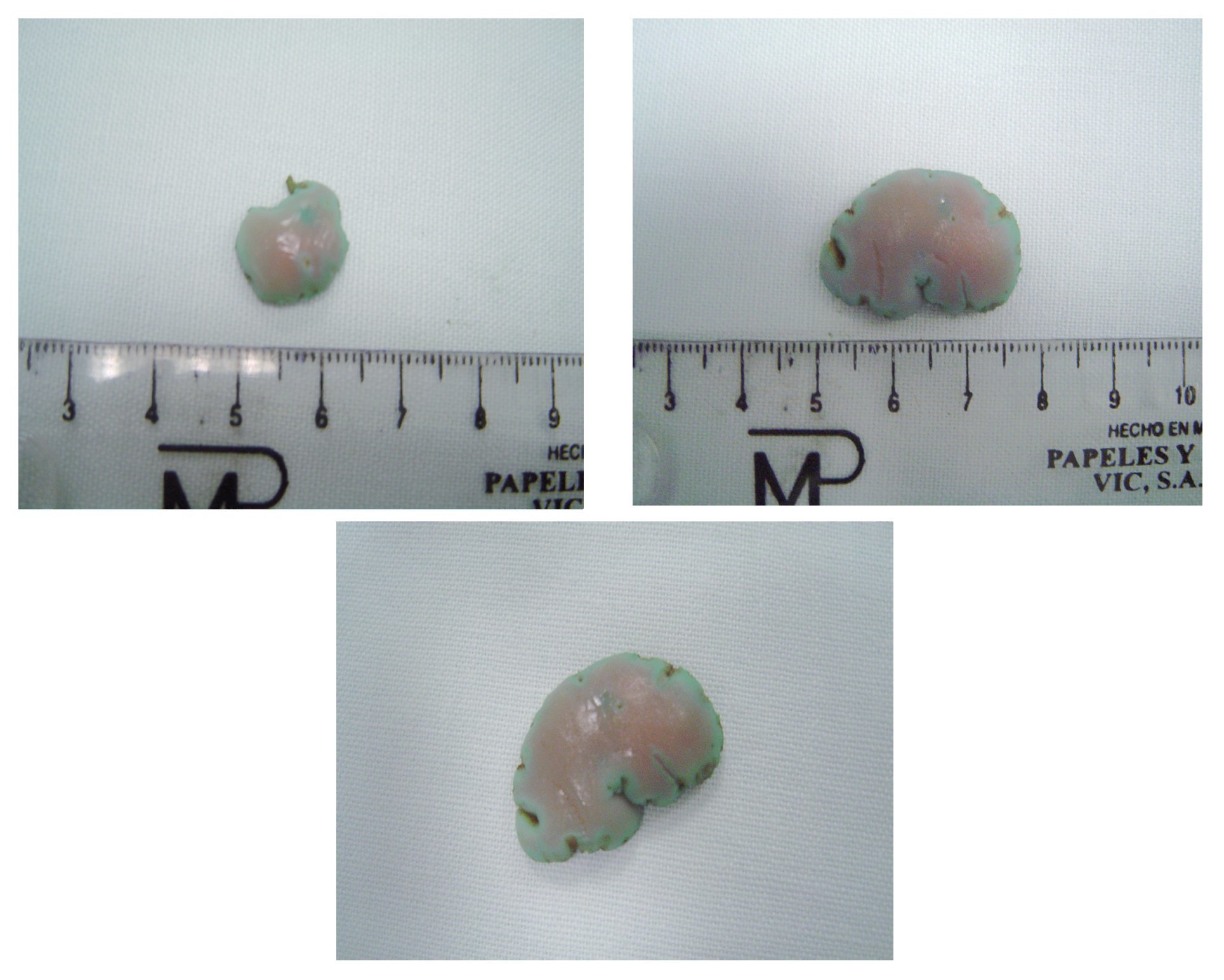
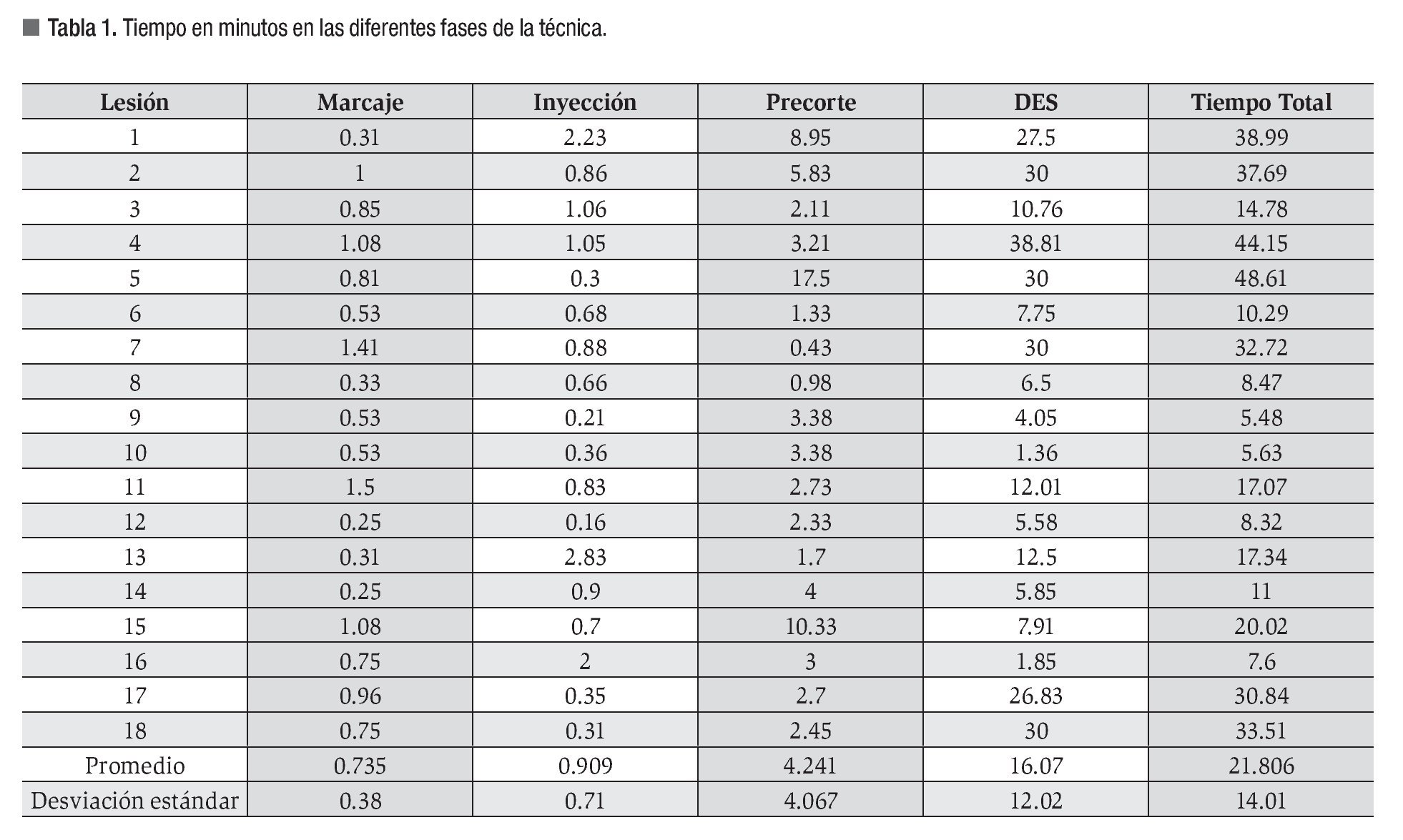
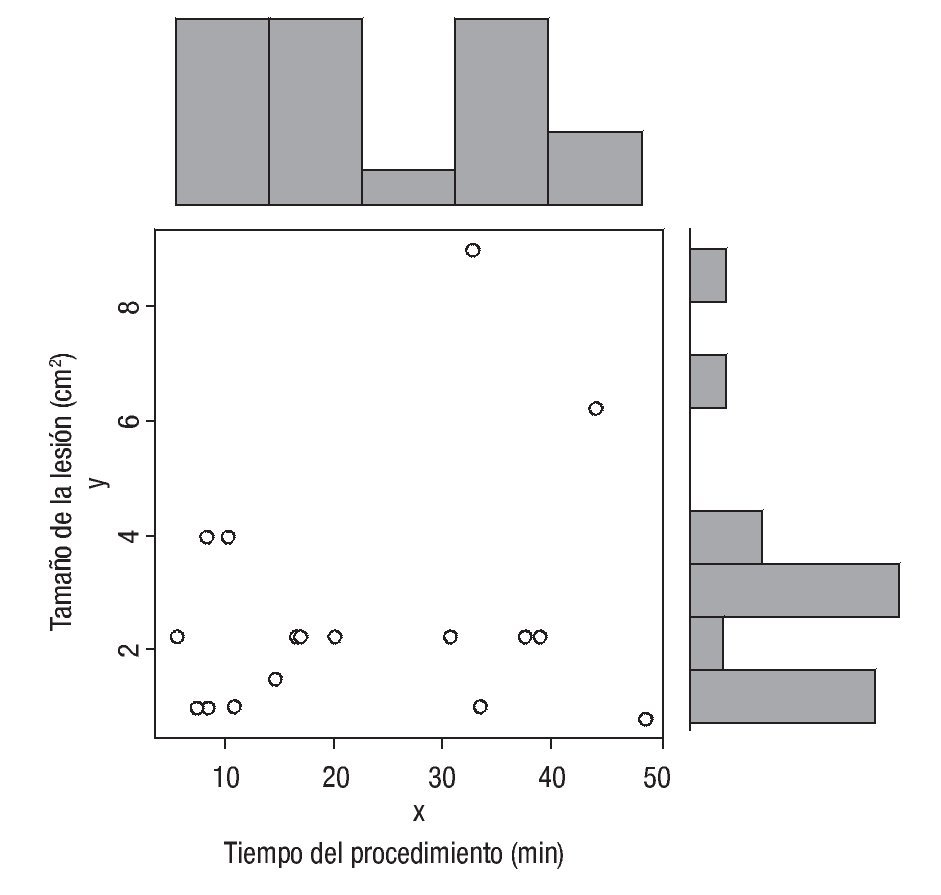
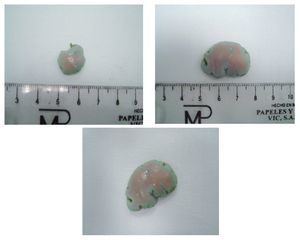
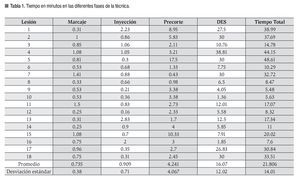
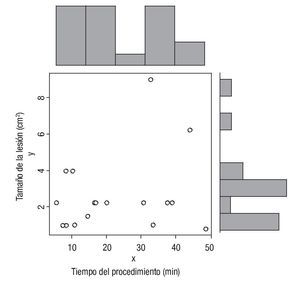
Fueron resecadas 18 lesiones entre 10 mm a 20 mm con un área promedio de superficie de mucosa gástrica de 2.64 ± 2 cm2 (Figura 3) en un tiempo promedio global de 21.8 ± 14.01 min (5.48 - 48.61). Las lesiones se localizaron en la pared posterior del cuerpo gástrico. El tiempo promedio en minutos para realizar el procedimiento en cada fase fue: 0.73 ± 0.3 para el marcaje, 0.9 ± 0.7 para la inyección, 4.2 ± 4.0 para el precorte y 16.0 ± 12.0 para la disección submucosa. (p = 0 .0001) (Tabla 1). La evaluación por el endoscopista (autoevaluación) y la evaluación del tutor tuvieron una correlación fuertemente positiva para las diferentes fases del procedimiento, y en promedio se calificó como una destreza moderadamente satisfactoria. La correlación entre el tamaño de la lesión y el tiempo total del procedimiento fue 0.23 (p = 0.35) (Figura 4). Las fases tres y cuatro mostraron mayor variabilidad en cuanto a tiempo de realización y no tuvo correlación positiva con el tamaño de la lesión (fase tres de 0.34, p = 0.15, fase cuatro de 0.37, p = 0.12) En 16/18 (88.9%) de las lesiones resecadas se observaron las marcas colocadas, indicando una resección completa.
¿ Figura 3. Lesiones resecadas.
¿ Figura 4. Correlación entre el tamaño de la lesión y el tiempo total en minutos durante el procedimiento.
Se presentó una perforación (5.88%) durante la fase cuatro y se colocó satisfactoriamente un endoclip con el cierre de la lesión. Debido a las características del modelo no pudieron evaluarse complicaciones como la hemorragia.
¿ Discusión
Los simuladores reproducen situaciones difíciles ofreciendo un entrenamiento similar al obtenido durante la situación real a una fracción del costo. Los de tipo biológico permiten el entrenamiento y el desarrollo de las destrezas en los endoscopistas.1 Recientemente se han publicado estudios sobre competencia técnica en endoscopia en los que se demuestra la necesidad de contar un número determinado de procedimientos.2 Los primeros simuladores endoscópicos mecánicos no eran adecuados para un entrenamiento real, por lo que se han desarrollado modelos biológicos y digitales.1 Existen dos simuladores digitales, AccuTouch® y GI Mentor®, en estos, las características tridimensionales y táctiles se reproducen de manera digital y ha sido ampliamente utilizado para entrenamiento en endoscopia diagnóstica.3 Los modelos biológicos en endoscopia se utilizan desde hace más de 30 años, inicialmente se utilizaban animales vivos anestesiados.4 Entre los modelos biológicos, el modelo de Erlangen conocido como EASIE® (Erlangen Active Simulator for Interventional Endoscopy) ha tenido gran aceptación. En este modelo se utiliza el tracto gastrointestinal y biliopancreático de cerdos obtenidos del rastro y se coloca dentro de un maniquí con estructura humana. Esto permite eliminar algunos de los problemas éticos sobre el uso de animales para investigación médica.5,6 Los modelos biológicos han mostrado gran utilidad en el entrenamiento de destrezas de endoscopia terapéutica.7
Ramírez-Solís y colaboradores2 informaron de la factibilidad de fabricar lesiones digestivas en simuladores biológicos inanimados con similitud con la realidad de 94% para lesiones submucosas, 86.5% para lesiones sangrantes y 88.2% para compresiones extrínsecas. El uso de estos modelos permite la práctica de habilidades para describir lesiones, así como realizar procedimientos terapéuticos sin limitar el número de ocasiones en que puede llevarse a cabo, así como conocer y manejar las complicaciones potenciales de los mismos.
Sin embargo, una de las dificultades del modelo porcino seleccionado para este estudio es la espesa capa de moco que dificulta las diferentes fases, independientemente de la preparación previa del bloque; el modelo canino disminuye este inconveniente pero tiene restricciones para su uso.
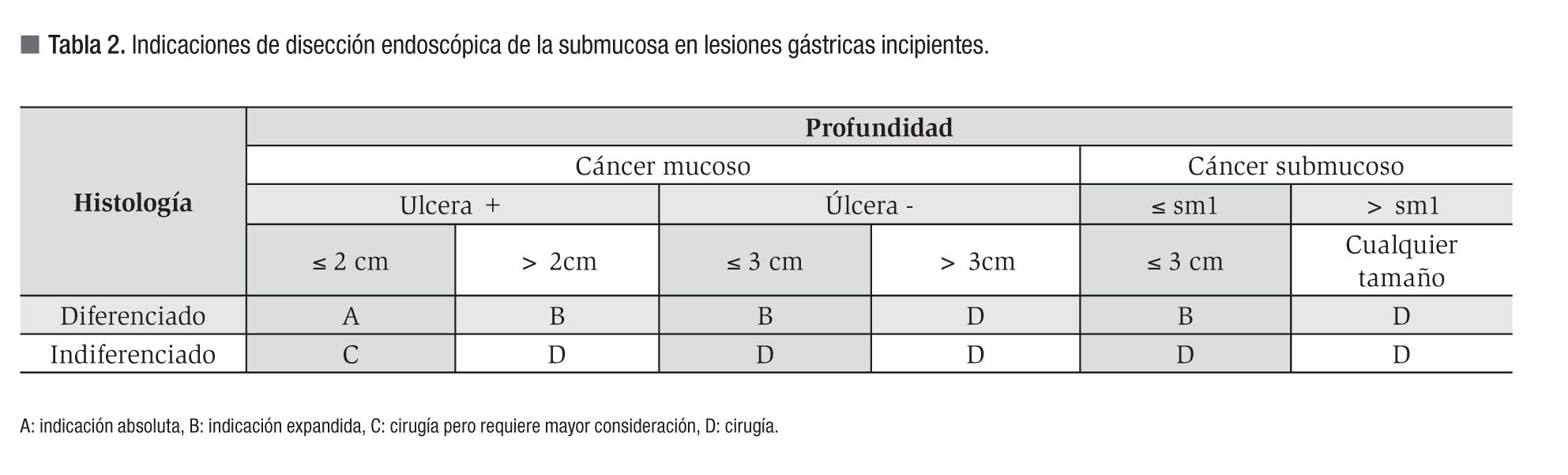
La resección endoscópica puede llevarse a cabo mediante REM o DES. La REM tiene como limitante el tamaño de la lesión, ya que cuando es mayor de 15 mm se debe realizar una resección fragmentada que puede condicionar valoración patológica errónea o mayor tasa de recurrencia.14-17 Debido a esto se desarrollo la técnica de disección endoscópica de la submucosa. La DES utiliza instrumentos de corte y fue desarrollada a partir de la REM con inyección submucosa. Este procedimiento permite la resección en bloque de lesiones de mayor tamaño.18 Las indicaciones son: carcinoma intramucoso de tipo intestinal, bien diferenciado, sin ulceración, menor de 2 cm si es elevado y menor de 1 cm si es plano o deprimido.19 Estas indicaciones han sido modificados por el Centro Nacional de Cáncer en Japón para incluir carcinomas intramucosos bien diferenciados sin importar el tamaño y carcinomas intramucosos bien diferenciados con cicatriz ulcerosa menor de 30 mm (Tabla 2).20 La DES es un procedimiento que requiere de mayor destreza, tiempo de procedimiento y tiene mayor tasa de complicaciones (perforación, hemorragia).21 Consiste en cuatro fases: 1) marcaje de la lesión, 2) inyección submucosa para elevar el tumor, 3) precorte de la circunferencia de la lesión y 4) disección del tejido conectivo submucoso debajo del tumor.22
Conocer la naturaleza de las lesiones, la técnica y el instrumental, además de la detección de complicaciones, no son suficientes para alcanzar el éxito técnico, ya que el endoscopista debe familiarizarse con el procedimiento y solo lo logrará mediante un aumento en el número de repeticiones. La disección endoscópica de la mucosa es una técnica que requiere de destreza y entrenamiento endoscópico. El tiempo promedio del procedimiento en expertos es de aproximadamente 50 minutos,17 en nuestro trabajo fue de 21.8 ± 14.01 minutos, sin embargo es necesario señalar que esto no traduce mayor habilidad ni simpleza del procedimiento ya que existen otros factores en el humano como los riesgos (hemorragia y perforación), peristalsis y variabilidad biológica (localización, forma y tamaño de las lesiones).
El uso de modelos inanimados tiene un ambiente controlado (evitamos los movimientos respiratorios del paciente, el reflejo nauseoso, los eructos por sobredistensión). Una de las desventajas del modelo es el sesgo del operador que conoce que el riesgo de complicaciones en este modelo no tienen significado. El modelo permitió conocer mejor las diferentes fases, sin embargo se requieren incrementar el número de repeticiones para poder valorar una curva de aprendizaje.
En general, en el humano la tasa global de complicaciones en centros experimentados es de 1.9% (hemorragia 1.5%, perforación 0.5%).23 La hemorragia, es la complicación más frecuente y se presenta en 1-45% de los casos (promedio 10%) en las series más grandes. Esta puede manejarse con endoclips, sondas térmicas o inyección. La hemorragia tardía (hematemesis o melena en los 30 días posteriores al procedimiento) se puede tratar mediante endoscopia de urgencia (13.9%). La tasa de perforación es de 4% a 10%, si es una perforación pequeña, puede manejarse con endoclips. Una perforación grande requiere de cirugía de urgencia.24 La tasa de complicaciones observada en nuestro estudio fue de 5.88% (una perforación) lo cual se encuentra dentro de los parámetros reportados en la bibliografía.
Concluimos que el uso de modelos biológicos inanimados permite el adiestramiento en técnicas endoscópicas complejas como son la disección endoscópica de la submucosa con un amplio margen de seguridad. El tamaño de la lesión no tuvo una correlación positiva con el tiempo del procedimiento, sin embargo se requiere incrementar el número de repeticiones para mejorar la curva de aprendizaje. Este modelo no es idóneo para evaluar complicaciones independientes de la perforación.
Correspondencia: Dra. Paola Figueroa Barojas.
Av. San Fernando núm. 22, Col. Sección XVI, C.P. 14080, Tlalpan, México, D.F.
Teléfono: (55) 5628 0400 ext. 179.
Correo electrónico: drapaolafigueroa@gmail.com
Recibido el 8 de junio de 2010;
aceptado el 13 de octubre de 2010.