El abordaje y manejo de pacientes críticamente enfermos representa uno de los temas más versátiles en la medicina de urgencias. Los pacientes con cirrosis hepática tienen características inherentes a su enfermedad que pueden condicionar modificaciones en el tratamiento agudo urgente. Los cambios fisiopatológicos que ocurren en esta enfermedad ameritan la puesta en marcha de un análisis, acerca de si el manejo global de un paciente críticamente enfermo puede aplicarse a pacientes con cirrosis hepática de forma general o si se deben tratar de una manera especial. A través de una revisión de la literatura médica se exploró la información disponible y se sintetizó la evidencia de forma narrativa respecto de lo encontrado acerca del manejo especial que requieren los estos pacientes, seleccionando las descompensaciones urgentes más representativas dentro de la enfermedad crónica.
The approach to and management of critically ill patients is one of the most versatile themes in emergency medicine. Patients with cirrhosis of the liver have characteristics that are inherent to their disease that can condition modification in acute emergency treatment. Pathophysiologic changes that occur in cirrhosis merit the implementation of an analysis as to whether the overall management of a critically ill patient can generally be applied to patients with cirrhosis of the liver or if they should be treated in a special manner. Through a review of the medical literature, the available information was examined, and the evidence found on the special management required by those patients was narratively synthesized, selecting the most representative decompensations within chronic disease that require emergency treatment.
La cirrosis hepática (CH) es actualmente una de las principales causas de muerte en el mundo occidental1,2, y constituye un importante problema de salud pública en nuestro país. Esta revisión trata de los aspectos fundamentales de la reanimación de pacientes con CH críticamente enfermos, con especial enfoque en la atención urgente inicial. El objetivo fue analizar la literatura disponible acerca del manejo especial que requieren los pacientes con CH en el contexto de urgencias, para las condiciones más frecuentes encontradas en esta etapa de la atención de acuerdo a la opinión de expertos. Se recabó la información pertinente y que abarcó exclusivamente a pacientes con CH en diferentes contextos clínicos urgentes: choque hipovolémico por hemorragia de tubo digestivo alto (HTDA) variceal, sepsis y choque séptico, encefalopatía hepática (EH), daño renal agudo y alteraciones electrolíticas.
MetodologíaSe elaboró la siguiente síntesis de evidencia narrativa de acuerdo a los siguientes pasos. Primer paso: se seleccionaron los tópicos enfocados en el abordaje inicial del paciente con cirrosis descompensada, respecto a la evaluación y manejo de urgencia. Segundo paso: los siguientes coautores (ESGJ y JAVRV) evaluaron la información, la sintetizaron y codificaron en los siguientes temas: hemorragia variceal, EH, sepsis, lesión renal aguda (LRA) y alteraciones electrolíticas aisladas. Tercer paso: posterior a esta codificación se desarrollaron preguntas dirigidas y se realizó una revisión sistemática en las bases de datos: DynaMed, Google Scholar y PubMed. Se utilizó la jerarquía de la pirámide de la evidencia preevaluada para la obtención de la información. Se empezó por sumarios de evidencias (guías de práctica clínica, Uptodate y Dynamed), posterior síntesis/sinopsis de evidencia (revisiones sistemáticas) y, por último, estudios originales (estudios controlados aleatorizados y estudios observacionales). La búsqueda de información fue realizada en los idiomas español e inglés. Se utilizaron las siguientes palabras claves: cirrosis, cirrosis descompensada, cirrótico crítico, fluidoterapia, soporte hídrico, hemoderivados, choque, choque hipovolémico, sepsis, choque séptico, transfusiones, vasopresores, encefalopatía, hemorragia variceal, hiponatremia y lesión renal entre los años 1980 y el primer trimestre del 2021. Los resultados obtenidos fueron enviados al equipo de coautores quienes, utilizando el formato estandarizado, extrajeron la información relevante para la inclusión de esta síntesis de evidencia narrativa. A continuación se exponen los tópicos más relevantes.
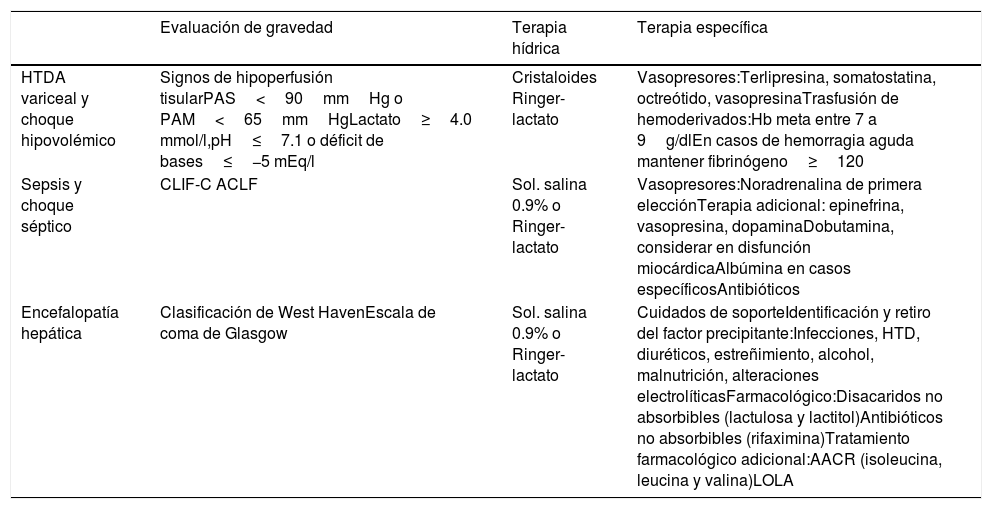
ResultadosReanimación del paciente con cirrosis hepática con hemorragia de tubo digestivo alto variceal y choque hipovolémicoEvaluación del estado de gravedad: signos vitales y evaluación de la perfusiónLa monitorización hemodinámica básica de un enfermo en estado crítico, para la adecuada identificación y el tratamiento del estado cardiopulmonar, incluye una historia clínica con examen físico dirigido y evaluación de los signos vitales (frecuencia cardíaca [FC], presión arterial media [PAM], frecuencia respiratoria [FR], temperatura y saturación de O2 por oximetría de pulso) y el gasto urinario. Sin embargo, estas variables primarias y el examen físico han demostrado repetidamente ser insuficientes e inexactas para la evaluación hemodinámica, la evaluación rápida y la identificación del estado de choque oculto o compensado, especialmente en pacientes previamente sanos o cuando el estado cardiopulmonar cambia rápidamente3. Estas evaluaciones inexactas y segadas se presentan también en el escenario del paciente con CH y pueden estar relacionadas con 2 contextos. El primero es la ocurrencia de cambios fisiopatológicos propios de la hipertensión portal, como la circulación hiperdinámica; y segundo, asociado a la necesidad de uso de bloqueadores beta en los pacientes bajo profilaxis de hemorragia variceal4,5. Existen varias herramientas para reconocer la hipoperfusión tisular y predecir la respuesta a la infusión de líquidos en la población general, sin embargo no se han estudiado por completo en la CH. Es sabido que los marcadores bioquímicos de hipoperfusión tisular como el lactato, la acidosis metabólica y la saturación de oxígeno venosa central (ScvO2) encontrados en estado de choque pueden ser anormales, lo que indica hipoperfusión tisular oculta, incluso sin hipotensión u otros signos clínicos manifiestos de choque3; sin embargo, probablemente no sea adecuado aplicar los parámetros establecidos para identificar choque hipovolémico en pacientes con CH. En uno de los pocos estudios al respecto Moreau et al. estudiaron la oxigenación tisular en pacientes con CH y reportaron que la presión arterial (PA) suele estar disminuida, la ScvO2 y la FC pueden estar sesgadas por la circulación hiperdinámica y los niveles elevados de lactato pueden reflejar la gravedad del fallo hepático más que una respuesta del estado hemodinámico6. Li et al. realizaron un estudio prospectivo, con el objetivo de validar una definición clínica de choque frente a la mortalidad a los 28 días, y se definió choque como la presencia de un signo evidente de hipoperfusión tisular como piel marmórea, presión arterial sistólica (PAS)<90mmHg o PAM<65mmHg, nivel de lactato≥4.0mmol/l, pH≤7.1, o un déficit de bases ≤−5mEq/l7.
Administración de soluciones intravenosasLa infusión de grandes volúmenes de cristaloides como reemplazo de la sangre perdida empeora la condición del paciente y perpetúa la coagulopatía resultante de la hipoxia, acidosis e hipotermia generadas. Lo anterior es debido a que los líquidos intravenosos diluyen los factores de coagulación, generan hipotermia, acidosis, edema con disfunción multiorgánica al alterar los mecanismos celulares y causar inflamación, dando lugar a varias complicaciones que incluyen disfunción cardíaca, respiratoria, gastrointestinal e inmunológica con el consecuente aumento de mortalidad8. En pacientes con CH se recomienda iniciar de manera temprana la reanimación con líquidos intravenosos para restaurar la perfusión tisular y mantener la PAM>65mmHg9 y una PAS entre 90-100mmHg10. Se ha demostrado que los pacientes con CH que se presentan con hematemesis tienen peor pronóstico en comparación con aquellos que se manifestaron con melena, y probablemente requieran reanimación hídrica adicional de acuerdo a la presentación. Li et al. realizaron un estudio retrospectivo con el objetivo de comparar la tasa de resangrado a los 5 días y la mortalidad hospitalaria en pacientes con CH y HTDA, manifestado por hematemesis versus aquellos que solo presentaron melena. Este estudio incluyó 793 pacientes y aquellos con hematemesis al ingreso tuvieron una tasa de resangrado a los 5 días significativamente mayor (17.4% frente a 10.1%, p=0.004) y mortalidad hospitalaria (7.9% frente a 2.4%, p=0.001) que en aquellos con melena11. No existen estudios relacionados con reanimación hídrica y choque hipovolémico específicamente en pacientes con CH, sin embargo basándonos en los realizados en pacientes críticamente enfermos se puede extrapolar el conocimiento generado al respecto. Dijillali et al. realizaron un ensayo clínico aleatorizado multicéntrico (CRISTAL) estratificado por combinación de casos (sepsis, traumatismo o choque hipovolémico); fue un ensayo abierto con el objetivo de evaluar la mortalidad a los 28 días, utilizando terapia con coloides versus cristaloides para la reanimación de pacientes críticamente enfermos. Se incluyeron 2,857 pacientes, 1,414 en el grupo de coloides y 1,443 en el grupo de cristaloides. Se observó que a los 28 días no existió diferencia significativa en la mortalidad en el grupo que recibió coloides comparado con el grupo que recibió cristaloides (riesgo relativo [RR] 0.96, intervalo de confianza [IC] 95%: 0.88 a 1.04; p=0.26), pero a los 90 días la mortalidad fue menor entre los pacientes que recibieron coloides (RR 0.92, IC del 95%, 0.86 a 0.99; p=0.03), además la terapia de reemplazo renal (TRR) se utilizó menos en el grupo de coloides (11.0%) frente al grupo de cristaloides (12.5%) (RR 0.93, IC 95%, 0.83 a 1.03; p=0.19). Con este estudio se concluye que no hubo una diferencia significativa en la mortalidad entre los grupos que se les administró coloides versus cristaloides12. Matthew et al. realizaron un ensayo pragmático, no cegado, aleatorizado por grupos y cruzado múltiple en el que se comparó el uso de cristaloides balanceados (solución Ringer-lactato o plasma-lyte) versus solución salina al 0.9% en pacientes críticamente enfermos, con el objetivo de valorar si presentaban eventos adversos renales y muerte dentro de los primeros 30 días. Incluyeron 7,942 pacientes en el grupo de cristaloides balanceados y 7,860 pacientes en el grupo de solución salina 0.9%. En el grupo de los pacientes con cristaloides balanceados tuvieron mayor riesgo de eventos renales adversos, en comparación con el grupo de solución salina (razón de momios [RM], marginal 0.91, IC 95%: 0.84 a 0.99; RM condicional 0.90, IC 95%: 0.82 a 0.99; p=0.04). La mortalidad hospitalaria a los 30 días fue del 10.3% en el grupo de cristaloides balanceados y del 11.1% en el grupo de solución salina (p=0.06), la incidencia de TRR fue del 2.5% en el grupo de cristaloides balanceados y 2.9% en el de solución salina (p=0.08) y la incidencia de disfunción renal persistente fue de 6.4% y 6.6% en cada grupo, respectivamente (p=0.60). Se puede concluir que el uso de cristaloides balanceados en pacientes críticamente enfermos presentó menores eventos adversos renales en comparación con el uso de solución salina al 0.9%13. Myburgh et al. realizaron un ensayo clínico controlado, aleatorizado, multicéntrico, prospectivo y ciego. Se incluyeron 6,651 pacientes admitidos en terapia de cuidados intensivos que requirieron reanimación con líquidos, a 3,315 pacientes se les administró hidroxietil-almidón al 6% y a 3,336 pacientes solución salina al 0.9%. Se observó que la TRR se realizó en 235 (7%) pacientes en el grupo de hidroxietil-almidón y en 196 (5.8%) pacientes en el grupo de solución salina (RR: 1.21; IC 95%: 1.00 a 1.45; p=0.04) se desarrolló LRA en los grupos de hidroxietil-almidón y solución salina en el 34.6% y el 38.0% de los pacientes, respectivamente (p=0.005), además el uso de hidroxietil-almidón se asoció significativamente a más eventos adversos (4.6% frente a 3.3%, p=0.006). Este estudio demostró que el uso hidroxietil-almidón al 6% se relacionó con mayor tasa de TRR y efectos adversos comparado con la administración de solución salina al 0.9%14. Con lo que se ha expuesto previamente se recomienda como primera opción de fluidoterapia, en pacientes con choque hipovolémico y CH, la terapia con cristaloide Ringer-lactato. Aunque no hay estudios que especifiquen parámetros clínicos y de laboratorio en pacientes con CH que presentan choque hipovolémico secundario a HTDA, existen diversos estudios realizados en pacientes críticamente enfermos con choque séptico recomendando los siguientes parámetros objetivos a alcanzar en las primeras 6horas de reanimación: PAM≥65mmHg, ScvO2≥70%, presión venosa central (PVC) entre 8 y 12mmHg o 12-15mmHg en pacientes bajo ventilación mecánica invasiva y gasto urinario≥0.5ml/kg/h15.
Hemoderivados y uso de fármacos vasopresoresEn los pacientes con CH y HTDA es necesario actuar de manera urgente, ya que tienen una elevada mortalidad y complicaciones. La hemorragia variceal conlleva una mortalidad de 10-20% en las primeras 6 semanas. El tratamiento médico debe iniciarse lo más rápido posible, independientemente del procedimiento endoscópico, con el objetivo de restaurar la perfusión tisular10,16. Es indispensable que durante el tratamiento de HTDA de origen variceal se administren medicamentos vasopresores considerados de primera línea como terlipresina y el octreótido, con el objetivo de disminuir el gradiente de presión venosa portal y el sangrado. Se deben iniciar tan pronto como sea posible antes de la endoscopia y continuar hasta por 5 días9,17. Escorsell et al. realizaron un ensayo clínico aleatorizado muticéntrico que incluyó a 219 pacientes con CH y HTDA variceal; 105 pacientes recibieron terlipresina y 114 escleroterapia de urgencia. La tasa de fracaso de la terlipresina fue del 33% y del 32% para la escleroterapia (diferencia no significativa). El resangrado se observó en el 43% y 44%, respectivamente (p=0.55). Los efectos secundarios aparecieron en el 20% de los pacientes que recibieron terlipresina y en el 30% de los que recibieron escleroterapia (RM 1.7; IC 95%, 0.91-3.17; p=0.06). Ambas terapias fueron similares en cuanto al requerimiento de transfusión, estancia hospitalaria y la mortalidad a las 6 semanas. Con este estudio se puede concluir que la terlipresina puede representar un tratamiento de primera línea en la hemorragia aguda por varices hasta la administración del tratamiento definitivo18. Desde los años 90 del siglo pasado se cuenta con una revisión Cochrane en la que se demostró, a través de estudios de adecuada calidad, que el uso de la terlipresina, comparada con placebo, reduce significativamente la mortalidad en HTDA variceal (RR: 0.66), actualizando la revisión por última vez en 2003 sin cambios en dichas conclusiones19. En relación con el uso de análogos de la somatostatina, como el octreótido, la revisión Cochrane disponible y actualizada en 2008 no mostró disminución en la mortalidad ante su uso comparado con placebo; sin embargo, sí se demostró reducción en la necesidad de transfusiones y una controvertida disminución en el riesgo de resangrado (por la calidad de los estudios citados)20.
Respecto a los hemoderivados debe realizarse con precaución la reanimación del volumen sanguíneo, porque una restitución con una estrategia liberal puede aumentar el riesgo de sangrado adicional. En los pacientes con HTDA variceal se recomienda mantener los niveles de hemoglobina entre 7-9g/dl16. Esta recomendación ha sido validada y confirmada por el estudio de Villanueva et al. Se realizó un ensayo controlado aleatorizado acerca del manejo de transfusión para HTDA comparando una estrategia restrictiva (transfusión cuando el nivel de hemoglobina estaba por debajo de 7g/dl, con rango objetivo después de transfusión de 7-9g/dl) contra una estrategia liberal. Se analizaron 921 pacientes, 461 fueron asignados aleatoriamente al grupo de estrategia restrictiva y 460 pacientes a una estrategia liberal. La probabilidad de supervivencia a las 6 semanas fue mayor en el grupo de estrategia restrictiva que en el grupo de estrategia liberal (95% frente a 91%; índice de riesgo de muerte con estrategia restrictiva 0.55; IC 95%: 0.33 a 0.92; p=0.02), los eventos adversos ocurrieron en el 40% en el grupo de estrategia restrictiva en comparación con el 48% en el grupo de estrategia liberal (p=0.02). En los primeros 5 días el gradiente de presión venosa portal aumentó significativamente en los pacientes asignados a la estrategia liberal (p=0.03), pero no en los asignados a la estrategia restrictiva. Además, la probabilidad de supervivencia fue mayor con la estrategia de transfusión restrictiva en los pacientes con cirrosis Child-Pugh A y B, pero no en aquellos Child-Pugh C y, por último, entre los pacientes con sangrado por varices esofágicas la tasa de resangrado fue menor en el grupo de estrategia restrictiva que en el grupo de estrategia liberal (11% frente a 22%, p=0.05)21. Basado en los hallazgos de este estudio las guías actuales sugieren iniciar transfusiones para pacientes con HTDA variceal cuando los niveles de hemoglobina disminuyen a menos de 7g/dl con un nivel objetivo de 7-9g/dl.
Las infecciones bacterianas son frecuentes en pacientes con CH y HTDA y ocurren en un 20% en 48horas22. El uso de una cefalosporina intravenosa a corto plazo es útil particularmente en pacientes con CH en estadio Child-Pugh C. La endoscopia terapéutica (ligadura o escleroterapia) es el manejo de elección, una vez estabilizado el paciente con HTDA variceal, y la mayoría de las guías internacionales recomiendan que se realice dentro de las 12horas posteriores al ingreso16.
Corrección del estatus de coagulaciónLa disfunción hepática se caracteriza por presentar niveles plasmáticos bajos de proteínas involucradas en la coagulación (excepto el factor viii y el factor von Willebrand, los cuales están aumentados). Estos fenómenos fisiopatológicos explican las anomalías de las pruebas de coagulación tradicionales como el tiempo de protrombina y el tiempo de tromboplastina parcial activada, que se observan típicamente en pacientes con CH23. La trombocitopenia es la complicación hematológica más común en pacientes con CH, y los principales mecanismos son producción disminuida de trombopoyetina (TPO) y el secuestro de plaquetas por el bazo. Conforme progresa la enfermedad hepática, el defecto plaquetario se vuelve progresivo con impacto en la adhesión, activación y agregación plaquetarias24. En el pasado se consideraba como objetivo la corrección del índice internacional normalizado (INR) y las plaquetas. Actualmente está reconocido que la administración de plasma no mejora la producción de trombina en pacientes con CH con pruebas de coagulación alteradas, e incluso puede exacerbar la hipertensión portal25. Lo anterior fue sustentado por Rassi et al. en un estudio prospectivo con 53 pacientes que recibieron una dosis estándar de plasma fresco congelado (PFC) para tratar hemorragias o previamente a procedimientos invasivos. La transfusión de PFC solo mejoró la generación de trombina y las pruebas de coagulación convencionales a valores normales en un número limitado de pacientes, y disminuyó ligeramente la generación de trombina en el 34% de los casos. Estos resultados sustentan que la transfusión de PFC en pacientes con CH mejora ligeramente los valores de las pruebas de coagulación solo en un número limitado de pacientes y, por el contrario, pueden presentarse efectos desfavorables hasta en un tercio de los casos, por lo cual se debe considerar de forma individualizada la decisión de transfusión de PFC26. Respecto a la transfusión de plaquetas no existe consenso sobre el valor umbral apropiado para la transfusión en pacientes con CH, pero se suele realizar transfusiones hasta un umbral de 50×109/l en caso de hemorragia o en caso de requerir procedimientos invasivos. Otro factor que complica las recomendaciones sobre la transfusión de plaquetas es que la cantidad de plaquetas no refleja la función plaquetaria, la cual puede alterarse por fármacos, infecciones o lesión renal27,28. Finalmente, es conocido que los niveles de fibrinógeno son normales o están ligeramente aumentados en pacientes con CH compensada; sin embargo, los pacientes con CH descompensada a menudo tienen niveles disminuidos, y se ha reconocido cada vez más como un factor de riesgo independiente de aumento de hemorragia, con un aumento del 29% en las probabilidades de mortalidad por cada reducción de 1g/l de fibrinógeno, como lo demostró en un análisis retrospectivo con 1,313 pacientes con CH, por Desborough et al.29,30. Sin embargo, diferentes sociedades médicas y grupos de expertos han propuesto mantener niveles de fibrinógeno por encima de 100-120mg/dl en el contexto de la hemorragia aguda con reemplazo de fibrinógeno mediante crioprecipitados en lugar del PFC27,31. Actualmente, se cuenta con concentrados sintéticos de fibrinógeno, cuyas ventajas sobre el PFC y los crioprecipitados son: menor riesgo de infecciones, dosificación exacta y consistente basada en fórmulas, infusiones de bajo volumen y administración expedita al no requerir pruebas cruzadas. Sin embargo, su uso no ha sido descrito en estudios de calidad en pacientes con CH y no existen recomendaciones al respecto, aunque pudieran extrapolarse de contextos ajenos a la CH32. Existen otras pruebas, como la tromboelastografía, que se han estudiado en etapas preprocedimientos y en HTDA en pacientes con CH. El beneficio observado ha sido significativo solamente en el desenlace de disminución en el requerimiento de transfusión, mas no en la mortalidad ni en eventos de resangrado33; por ello las guías actuales marcan su uso como una brecha en el conocimiento y no emiten recomendación alguna para su uso34. Incluso se ha cuestionado si su utilización representa realmente un beneficio para los pacientes o solo un ahorro de hemocomponentes35.
Puntos clave- 1.
La determinación de constantes vitales es imprescindible para el establecimiento del diagnóstico de choque hipovolémico, apoyándose de otros datos clínicos de hipoperfusión y marcadores indirectos como los niveles de lactato. Tomar en cuenta cambios derivados de la circulación hiperdinámica y el tratamiento farmacológico con beta bloqueadores.
- 2.
En pacientes con CH y choque hipovolémico se recomienda iniciar de manera temprana la reanimación con líquidos intravenosos (cristaloides).
- 3.
Restaurar la perfusión tisular y mantener la PAM>65mmHg y una PAS entre 90-100mmHg.
- 4.
El manejo farmacológico de la HTDA variceal aguda debe incluir vasopresores (terlipresina, somatostatina, octreótido, vasopresina).
- 5.
La terapia transfusional se recomienda cuando los niveles de hemoglobina son<7g/dl, con un estrategia restrictiva de 7-9g/dl.
No existe evidencia suficiente para determinar específicamente el estado de gravedad de un paciente con CH mediante los signos vitales. Por esta razón se recomienda evaluar otras variables relevantes que han sido descritas en pacientes con sepsis/choque séptico sin CH, es decir PAM<65mmHg, taquicardia (FC>100latidos por minuto) y oliguria (<0.5ml/kg/h). A pesar de que ningún estudio ha evaluado la terapia dirigida de metas tempranas en pacientes con CH con sepsis o choque séptico, la práctica clínica sugiere que la resucitación temprana es igual de importante, sin embargo, las «metas» pudieran diferir de la población general, ya que los pacientes con CH habitualmente tienen PA baja, ScvO2 mayores, diuresis y hematocrito disminuidos, así como aclaramiento alterado del lactato15. En CH la PAM es menor y la ScvO2 es mayor debido a la circulación hiperdinámica36 y adicionalmente, en las fases iniciales de la enfermedad, la disminución en la resistencia vascular sistémica es compensada por el desarrollo de la circulación hiperdinámica caracterizado por FC y gasto cardiaco (GC) aumentados. En un reporte prospectivo de CH por alcohol se demostró un empeoramiento del transporte de oxígeno conforme avanza la enfermedad hepática (saturación venosa mixta Child-Pugh A: 73 versus Child-Pugh C: 78.7; p<0.05) y mayor concentración de lactato (A: 0.79, B: 0.87, C: 2.17; p<0.05). Este aumento del lactato en la CH avanzada puede deberse a la hipoxemia tisular o por alteración del aclaramiento debido a insuficiencia hepática6. A pesar del conocimiento de que estas variables (PAM, ScvO2) pueden ser diferentes en pacientes con CH, no se ha publicado algún estudio que proponga un valor de normalidad diferente esperado en esta población. En una publicación de 2016 un grupo de expertos propuso utilizar la PAM objetivo en CH de 60mmHg y recomiendan no utilizar la ScvO2, ni el aclaramiento de lactato como metas, por las diferencias ya comentadas37–39. En otro estudio prospectivo con 142 pacientes con CH y 14 controles sanos donde se determinó el lactato en la vena hepática y en la arteria femoral, reportó niveles mayores de lactato venoso y arterial en pacientes con CH comparado con sujetos sanos (p<0.001), con un incremento en los niveles conforme avanzaba la enfermedad38. En estudios adicionales se corrobora la evidencia de que el nivel de lactato sérico en insuficiencia hepática es mayor que en controles sanos (8.24mmol/l versus 4.29mmol/l, p<0.01)39. Sin embargo, no existe un punto de corte establecido para definir en qué momento considerar hiperlactatemia en pacientes con CH. Ante esta situación un estudio retrospectivo, que incluyó 35 pacientes de una unidad de cuidados intensivos (UCI) con enfermedad hepática crónica, reportó que el lactato>2.2mmol/l se asoció con mayor mortalidad (58%), así como con evidencia clínica de choque, por lo que los autores concluyeron que la acidosis láctica en pacientes con CH se asocia con evidencia clínica de choque y con un aumento de la mortalidad hospitalaria40. Se ha demostrado que aquellos pacientes con CH que presentan sepsis/choque séptico e hiperlactatemia tienen un peor pronóstico, ya que en un estudio prospectivo de Sun et al., que incluyó 480 pacientes con CH en la UCI complicados con LRA y con seguimiento a un año, se observó que los niveles mayores de lactato sérico se asociaron con mayor mortalidad (<1.8mg/dl mortalidad 56%, 1.9-2.4mg/dl mortalidad 62%, 2.5-4.0mg/dl mortalidad 72% y>4.1mg/dl mortalidad 75%)41. La evidencia actual deja claro que, a pesar de no saber el punto de corte exacto para definir gravedad, aquellos pacientes que ingresan con hiperlactatemia y aclaran el lactato presentan mejor pronóstico. En un estudio multicéntrico realizado por Drolz et al., que incluyó 678 pacientes críticos con CH en UCI y una cohorte de validación de 250 pacientes donde se midió el lactato arterial al ingreso y se dio seguimiento por un año, encontraron que el lactato de ingreso fue directamente proporcional con el número de fallos orgánicos y mortalidad a 28 días (AUROC 0.72; p<0.001). El lactato al ingreso≥5 mmol/l y su aclaramiento a las 12horas fueron predictores significativos de mortalidad a un año42.
El consenso de Sepsis-3 estableció que la puntuación en la Evaluación de fallo orgánico relacionado con sepsis (SOFA, por sus siglas en inglés) es la mejor puntuación para realizar diagnóstico y pronóstico de pacientes con sepsis y choque séptico. Se considera que una puntuación≥2 puntos es equivalente a fallos orgánicos y establece el diagnóstico de sepsis y mayor gravedad43. Existe evidencia de que utilizar estos criterios de Sepsis-3 en pacientes con CH tiene mejor rendimiento diagnóstico y pronóstico que los criterios antiguos basados en síndrome de respuesta inflamatoria sistémica en pacientes con CH44. Sin embargo, con el advenimiento del daño hepático agudo en crónico (ACLF, por sus siglas en inglés) y su relación estrecha con las infecciones y sepsis/choque séptico, la Asociación Europea para el Estudio del Hígado (EASL-CLIF Consortium) cambió la puntuación de SOFA creando el «CLIF-SOFA», y definieron ACLF de acuerdo con este nuevo puntaje. En el puntaje de CLIF-SOFA, se evalúan 6 órganos con cambios específicos a pesar de tener enfermedad hepática avanzada. Entre los cambios destacados se encuentra el recuento de plaquetas cambiadas por el INR o por el tiempo de protombina, y la escala de Glasgow fue sustituida por EH como criterio de compromiso del sistema nervioso central. Adicionalmente, agregaron saturación de oxígeno/FiO2 como alternativa para pacientes sin línea arterial45. Estudios recientes en pacientes con CH que cursan con sepsis y choque séptico han demostrado la eficacia de estas puntuaciones para la predicción de gravedad y mortalidad, como lo demostrado por Engelmann et al. en un análisis retrospectivo con 202 pacientes con CH y fallo orgánico, quienes reportaron que la mejor puntuación para mortalidad a 28 días fue el CLIF-C ACLF, con un área bajo la curva de 0.8 y mortalidad del 100% a 28 días en pacientes con puntuación>7046. Por otro lado, Silva et al., en un trabajo prospectivo con 192 pacientes reportaron un área bajo la curva para predecir mortalidad a 30 días de 0.84, con sensibilidad del 64% y especificidad del 90%47.
La insuficiencia adrenal (IA) es frecuente en pacientes con CH y sepsis o choque séptico (51-77%), y se asocia con inestabilidad hemodinámica, daño renal, insuficiencia hepática, gravedad del estado crítico y mayor tasa de mortalidad (80-76% versus 36.7%, p≤0.001) que en pacientes sin IA9,48. Fernandez et al. reportaron incidencia de IA en un 68% en CH y choque séptico. Además, evaluaron el tratamiento con hidrocortisona a dosis de 50mg cada 6horas por vía intravenosa versus pacientes sin hidrocortisona y demostraron que la resolución del choque séptico fue de 96% versus 58% (p=0.001) y la supervivencia hospitalaria de 64% versus 32% (p=0.003), mayor en los pacientes que recibieron la hidrocortisona49. Otro estudio prospectivo doble ciego, que incluyó 75 pacientes con CH y choque séptico, demostró una prevalencia de IA del 76%. En el grupo que recibió el esteroide se observó una reducción mayor del vasopresor, mayores tasas de resolución del choque (RR: 1.58, IC 95%: 0.98-2.55, p=0.05), sin reducción en la mortalidad a 28 días (RR: 1.17, IC 95%: 0.92-1.49, p=0.19). Sin embargo, el grupo con esteroide reportó mayor recaída del estado de choque (RR: 2.58, IC 95%: 1.04-6.45, p=0.03) y también mayor sangrado gastrointestinal (RR: 3, IC 95%: 1.08-8.36, p=0.02)50.
Administración de soluciones intravenosasLas guías de Surviving Sepsis recomiendan soluciones cristaloides (salina 0.9% o Ringer-lactato) como la solución inicial en la resucitación de pacientes con sepsis. Se recomienda iniciar con 30ml/kg en las primeras 3horas, aunque algunos pacientes pueden requerir mayor volumen. No se recomienda utilizar almidones como expansores de volumen15,43. La evidencia acerca del manejo de soluciones intravenosas en el paciente con sepsis/choque séptico no incluye a pacientes con CH; sin embargo, vale la pena señalar algunos que aportan evidencia interesante sobre el uso de coloides. El estudio muticéntrico SAFE incluyó casi 7,000 pacientes ingresados en UCI que requirieran administración de líquidos para mantener o incrementar el volumen intravascular, y se aleatorizaron para recibir albúmina al 4% o solución salina al 0.9%. No se reportaron diferencias significativas en mortalidad ni en aparición de nuevos fallos orgánicos, menor tiempo de estancia en UCI o de ventilación mecánica a 28 días. Sin embargo, no se analizaron pacientes con choque séptico o sepsis, por lo que no se puede inferir con este estudio que la albúmina es inferior a soluciones cristaloides51. En otro estudio multicéntrico cegado Pemer et al. aleatorizaron a pacientes con sepsis severa en UCI para resucitación hídrica con Tetraspan (almidón hidroxietil) o Ringer-lactato. La mortalidad fue significativamente mayor en el grupo de almidón (51% versus 43%, RR: 1.17; IC 95%: 1.01-1.36, p=0.03). Asimismo, el grupo de almidón presentó mayor daño renal con necesidad de TRR (22% versus 16%, RR: 1.35; IC 95%: 1.01-1.80; p=0.04); sin embargo, no se incluyeron pacientes con CH52. En una revisión sistemática y metaanálisis que incluyó 38 estudios con 10,880 pacientes se reportó una mayor mortalidad con el uso del almidón (RR: 1.07, IC 95%: 1-1.14; I2: 0%), mayor daño renal (RR: 1.27; IC 95%: 1.09-1.47, I2: 26%) y mayor uso de TRR (RR: 1.32, IC 95%: 1.15-1.50; I2: 0%)53. En la población general no se recomienda este tipo de coloides, y conociendo los aspectos fisiopatológicos del paciente con CH tampoco están indicados.
El uso de albúmina es controversial y solo se recomienda para reducir la sobrecarga de líquidos y anasarca en quienes requieren grandes volúmenes de cristaloides, ya que este riesgo aumenta en la CH, por lo que su uso podría estar justificado en dicho contexto; sin embargo, no existen estudios que lo avalen15,43. Las infusiones de albúmina se utilizaron por primera vez en pacientes con CH hace más de 70 años y se siguen prescribiendo de forma ubicua para restaurar la normovolemia en pacientes con vasodilatación arterial periférica54. Respecto al uso de albúmina, en población general las guías de Surviving Sepsis lo recomiendan en pacientes que recibieron grandes volúmenes de cristaloides y requieren aumento de volemia. En pacientes con CH su uso no está totalmente dilucidado, a pesar de que existen ciertas indicaciones precisas en donde la infusión de albúmina es de suma importancia, como la peritonitis bacteriana espontánea (PBE), mientras que en el resto de infecciones en CH sigue sin presentarse evidencia sólida para recomendar su uso. Otro estudio aleatorizado no cegado que compara la administración de albúmina versus almidón hidroxietil en pacientes con PBE, documentó un aumento significativo de la PA y de la supresión de la actividad de la renina plasmática con la albúmina, indicando una mejoría en la función circulatoria. Aunque no incluyó pacientes con choque séptico o sepsis, nos demuestra la superioridad de la albúmina en la función circulatoria55. Otro estudio prospectivo que ha sido un referente en el uso de albúmina en PBE es el realizado por Sort et al., que reportó efectividad para prevenir daño renal con el uso de albúmina (33% versus 10%, p=0.002) y menor mortalidad (29% versus 10% p=0.01); sin embargo, incluyó pacientes sin sepsis o choque séptico56. A pesar de esta falta de información, la lógica invita a pensar que en el paciente con choque séptico la albúmina constituiría la terapia de resucitación ideal. En un estudio presentado en el congreso de la Asociación Americana para el Estudio del Hígado (AASLD) en 2015, Philips et al. reportaron resultados de pacientes con CH y choque séptico (n=308) con 154 pacientes por grupo. Uno de los grupos recibió albúmina al 5% 250ml en bolo para 15minutos y el otro solución salina 0.9% 30ml/kg para 30minutos. Se reportó una PAM>65mmHg y sostenida a las 3horas con mejores resultados en el grupo de la albúmina (25.3% versus 14.3% p<0.001, OR: 1.9, IC 95%: 1.08-3.42). Además, la reducción sostenida de la FC fue mayor en el grupo de la albúmina (94 versus 103 latidos por minuto, p=0.001), el incremento en el gasto urinario fue similar, la mejoría en el lactato fue mayor en el grupo de la albúmina (p<0.01), así como mejor sobrevida a una semana en el grupo de la albúmina (43.5% versus 38.3% p=0.03)57. Finalmente, uno de los estudios más recientes sobre albúmina en CH es el llamado Albumin to Prevent Infection in Chronic Liver Failure (ATTIRE), un ensayo multicéntrico realizado en el Reino Unido para evaluar la eficacia de la albúmina para prevenir infecciones, disfunción renal o muerte en pacientes con CH descompensada. Este estudio no mostró efecto sobre la incidencia de infecciones, reflejado en la ausencia de diferencias significativas en la incidencia de nueva infección o eventos de punto final en los pacientes que ingresaron con infección o que estaban recibiendo antibióticos en el momento de la inscripción. A pesar del régimen dirigido para aumentar el nivel de albúmina sérica a 30g/l o más, no hubo beneficios aparentes de la intervención con respecto al objetivo final primario en ninguno de los subgrupos analizados. Tampoco hubo diferencias significativas entre los grupos en la incidencia de muerte a los 28 días, 3 meses y 6 meses54.
Otro tema actual es evitar la sobrehidratación o evitar abusar de la terapia de rescate, ya que se ha demostrado recientemente en un estudio retrospectivo con más de 300 pacientes con CH y ACLF en UCI que los balances hídricos positivos se asocian a mayor mortalidad (OR: 1.04, IC 95%: 1.01-1.07)58.
Tratamiento con fármacos vasopresores en choque séptico y cirrosis hepáticaUna reanimación emergente rápida y escalonada, establecida en la fase temprana de la sepsis (primeras 6horas), mejora el resultado de los pacientes sin CH con sepsis o choque séptico en términos de disfunción orgánica y supervivencia9. Las guías de Surviving Sepsis de 2016 recomiendan el uso de noradrenalina (NAD) como el agente vasoconstrictor de elección en pacientes con choque séptico. La epinefrina (agregada o como sustituto de NAD) puede usarse cuando se requiere un segundo farmacovasopresor para mantener una PAM adecuada. La vasopresina en dosis bajas (0.03U/min), agregada a la NAD, puede utilizarse con la intención de elevar la PAM al objetivo o disminuir la dosis de NAD10,59. La NAD aumenta la PAM debido a sus efectos vasoconstrictores, con pocos cambios en la FC y menor aumento en el volumen sistólico en comparación con la dopamina. La dopamina aumenta la PAM y el GC, principalmente debido a un incremento en el volumen sistólico y la FC. Por lo tanto, la NAD es más potente que la dopamina y es más eficaz para revertir la hipotensión en pacientes con choque séptico15.
Los efectos alfa-adrenérgicos aumentan el tono vascular, pero pueden disminuir el GC y el flujo sanguíneo regional, especialmente en los lechos cutáneo, esplácnico y renal. Los efectos beta-adrenérgicos ayudan a mantener el flujo sanguíneo a través de efectos inotrópicos y cronotrópicos aumentando la perfusión esplácnica. Esta estimulación beta-adrenérgica también puede tener consecuencias no deseadas, incluyendo un aumento del metabolismo celular y efectos inmunosupresores60. En la actualidad la dopamina se utiliza únicamente en casos seleccionados debido a su alto riesgo de inducir arritmias en comparación con la NAD. La administración de dobutamina en pacientes con CH y choque séptico solo se recomienda en pacientes con disfunción miocárdica clínicamente significativa, ya que estos pacientes suelen presentar un GC elevado10,15,60. Los estudios en humanos y animales sugieren algunas ventajas de la NAD y la dopamina sobre la epinefrina o la fenilefrina debido a sus efectos adversos en la función cardiaca, sin embargo, no hay evidencia clínica de que la epinefrina produzca peores resultados clínicos y debería ser la primera alternativa elegida a la dopamina o la NAD15. Otra desventaja que podría tener la epinefrina, y más en el contexto de la CH, es que puede aumentar la producción de lactato aeróbico mediante la estimulación de los receptores adrenérgicos β2 del músculo esquelético y, por lo tanto, puede impedir el uso de depuración de lactato para guiar la reanimación59. Con sus efectos α-adrenérgicos casi puros la fenilefrina es el agente adrenérgico con menor probabilidad de producir taquicardia, pero puede disminuir el volumen sistólico y, por lo tanto, no se recomienda su uso en el tratamiento del choque séptico, excepto en circunstancias en las que la NAD se asocie con arritmias graves, el paciente presente arritmias graves o que el fármaco sea de elección como terapia de rescate cuando otros agentes vasopresores no han logrado alcanzar la PAM objetivo15. La vasopresina se ha utilizado como un complemento de las aminas para los pacientes que tienen un choque séptico grave. La razón fundamental para su uso es la deficiencia relativa de vasopresina en pacientes con choque séptico y la hipótesis de que la vasopresina administrada de forma exógena puede restaurar el tono vascular y la PA, reduciendo así la necesidad del uso de catecolaminas61. Las dosis bajas de vasopresina pueden ser eficaces para elevar la PA en pacientes refractarios a otros vasopresores y pueden tener otros beneficios fisiológicos potenciales. La terlipresina tiene efectos similares, pero es de larga duración15. En un ensayo controlado aleatorizado Choudhury et al. demostraron que la terlipresina era tan eficaz como la NAD como vasopresor en pacientes con CH con choque séptico, y además proporcionó un beneficio de supervivencia temprana con reducción del riesgo de hemorragia por varices. La terlipresina fue tan eficaz como la NAD para lograr una PAM>65mmHg a las 6 y 48horas62. Una revisión sistemática demuestra que el uso de corticosteroides en la sepsis puede resultar en una pequeña reducción absoluta de la mortalidad de aproximadamente un 2%63.
Puntos clave- 1.
Los pacientes con CH habitualmente tienen PA baja, ScvO2 mayor, diuresis y hematocrito disminuidos, y aclaramiento alterado del lactato y no existe evidencia de puntos de corte y metas en la reanimación sean diferentes en esta enfermedad.
- 2.
Los criterios de Sepsis-3 en pacientes con CH tienen mejor rendimiento diagnóstico y pronóstico que los criterios antiguos. La escala de CLIF-SOFA igualmente predice gravedad y pronóstico de una manera adecuada.
- 3.
Se recomienda la administración de cristaloides intravenosos a 30ml/kg de peso en las primeras horas de la reanimación. El uso de coloides diferentes a la albúmina se asocia a mayor tasa de complicaciones.
- 4.
El uso de vasopresores en CH y choque séptico se recomienda de acuerdo a las directrices de Surviving Sepsis.
- 5.
La IA es frecuente en pacientes con CH y choque séptico. El uso de corticosteroides en sepsis puede resultar en una pequeña reducción absoluta de la mortalidad.
La EH es una complicación de la hipertensión portal, definida como una disfunción cerebral secundaria a insuficiencia hepática y/o cortocircuitos portosistémicos que se manifiesta como un amplio espectro de anormalidades neuropsiquiátricas que van desde alteraciones subclínicas hasta el coma64,65. De acuerdo con la guía propuesta por la AASLD y la EASL, la EH debe clasificarse de acuerdo a 4 ejes: enfermedad hepática subyacente, gravedad clínica, temporalidad y presencia o ausencia de factores precipitantes64. En el primer eje se consideran 3 tipos de EH (A, B y C). El tipo A describe la EH asociada con fallo hepático agudo, el tipo B con la presencia de derivaciones portosistémicas sin evidencia de enfermedad hepatocelular y el tipo C con CH66. Para la EH tipo B y C la gravedad clínica se determina de acuerdo a la clasificación de West Haven65–67. En pacientes con alteración del estado de consciencia, la escala de coma de Glasgow es útil como una herramienta descriptiva, menos sujeta a variabilidad interobservador que la evaluación del estado de alerta65,66. De acuerdo con la existencia de factores precipitantes la EH se subdivide en no precipitada y precipitada por factores como: infecciones, hemorragia gastrointestinal, sobredosis de diuréticos u otros medicamentos como benzodiacepinas u opiáceos, alteraciones hidroelectrolíticas y estreñimiento64.
Se describe además la EH cubierta (mínima y estadio 1)68, que incluye a pacientes sin síntomas clínicos de disfunción cerebral reconocibles y su diagnóstico está basado en una evaluación neuropsiquiátrica cuidadosa que incluye la realización de al menos 2 pruebas psicométricas65. Los grados iii y iv de EH se clasifican como fallo orgánico a nivel neurológico y, por lo tanto, adquieren mayor trascendencia en el contexto de emergencias, ameritando la implementación de protocolos de protección de la vía aérea, además del uso de tubos enterales para la administración de tratamiento.
Administración de soluciones intravenosas en el contexto de encefalopatía hepáticaSe ha hipotetizado que la expansión de volumen produce supresión de los niveles de angiotensina ii, resultando en un aumento de la excreción urinaria de amonio. Un estudio de Jalan et al. demostró que la infusión de 1,000ml de solución salina al 0.9% en una hora se asoció con una disminución significativa de la actividad de renina plasmática y angiotensina ii, asociado con una disminución significativa de los niveles de amonio plasmáticos de 93 a 56micromoles/l (p<0.05) en pacientes con CH compensada69.
Tratamiento específico urgente en encefalopatía hepática. El tratamiento de la EH manifiesta o descubierta incluye el cuidado de soporte, identificación y retiro de factores precipitantes, reducción de la carga de nitrógeno del intestino y profilaxis secundaria64,66.
Manejo farmacológico de la encefalopatía hepáticaDisacáridos no absorbibles: lactulosa y lactitol. La lactulosa es el tratamiento estándar de la EH, reduce los niveles de amonio mediante la acidificación del colon con la resultante conversión del amoniaco a amonio, modificando la flora bacteriana del colon productora de ureasa a no productora de ureasa67. La dosis inicial recomendada por la AASLD/EASL es de 25ml (16.7g) cada una a 2horas hasta lograr al menos 2 evacuaciones blandas, lo cual sería la meta en el esfuerzo de corrección urgente de la EH, garantizando su adecuada administración a través de tubos enterales en pacientes cuyo estado neurológico los incapacite para una adecuada deglución o que requieran protección de la vía aérea60; sin embargo, esta es un área de oportunidad de investigación, ya que no hay estudios con alta calidad para poder ponderar si esta maniobra realmente impacta o no en resultados clínicos favorables. Los disacáridos no absorbibles previenen el desarrollo de EH (RR=0.47, IC 95%: 0.33-0.68, número necesario a tratar [NNT]=6), sin diferencias en su eficacia o seguridad entre lactulosa y lactitol. La efectividad de los disacáridos no absorbibles fue evaluada en una revisión sistemática y metaanálisis, que incluyó 1,828 pacientes de 38 estudios controlados aleatorizados, en comparación con placebo o no intervención. Los disacáridos no absorbibles tienen un efecto beneficioso en la EH, con un RR de 0.63 (IC 95%: 0.53-0.74) con un NNT de 4, así como con una disminución en la mortalidad en pacientes con EH manifiesta (RR: 0.36, IC 95%: 0.14-0.94, NNT=20)70. Un estudio reciente comparó la eficacia de la lactulosa contra la del polietilenglicol, observando desenlaces clínicos similares y, en algunos casos, superioridad clínica con el segundo71.
Antibióticos no absorbibles. La rifaximina es un antibiótico derivado de la rifamicina que se une a la subunidad b de la ARN polimerasa dependiente del ADN e impide la síntesis del ARN, alterando la microbiota intestinal y disminuyendo los microorganismos productores de amonio67,72. Las últimas recomendaciones sugieren que la rifaximina es efectiva como terapia aditiva a la lactulosa como profilaxis secundaria64. En cuanto al manejo inicial, una reciente revisión sistemática y metaanálisis demostró que la combinación de rifaximina y lactulosa aumenta la eficacia clínica de manera significativa en comparación con lactulosa en monoterapia (diferencia de riesgo [RD] 0.26, IC 95%: 0.19-0.32, p<0.00001, NNT 5), además de una disminución en la mortalidad (RD-0.16, IC 95%: –0.20-0.11, NNT: 9)73.
L-ornitina-L-aspartato (LOLA). Aumenta el metabolismo del amonio a glutamina y disminuye las concentraciones plasmáticas de amonio74. Se ha demostrado un efecto beneficioso en la mortalidad (RR 0.42, IC 95% 0.24-0.72) y EH (RR 0.70, 95% IC 0.59-0.83) al comparar LOLA con placebo en un metaanálisis de 29 ensayos clínicos controlados aleatorizados con 1,891 participantes; sin embargo, con muy baja calidad de evidencia, en comparación con lactulosa, LOLA no tiene efecto en la mortalidad o la EH75. LOLA vía IV puede ser utilizado como alternativa o agente adicional en pacientes sin respuesta al tratamiento convencional, ya que un estudio demostró mejoría en las pruebas psicométricas y niveles de amonio en pacientes con EH persistente64.
Tratamiento de desencadenantes más comunes y manejo urgente concomitante de la encefalopatía hepáticaLa identificación y manejo de factores precipitantes es uno de los pilares del tratamiento de la EH manifiesta; casi el 90% de los pacientes pueden ser tratados únicamente con la corrección del factor precipitante64. De acuerdo con el consenso de la Sociedad Internacional para la Encefalopatía Hepática y el Metabolismo del Nitrógeno (ISHEN), el manejo del episodio agudo de EH manifiesta implica la identificación y tratamiento de los factores precipitantes: infecciones (antibióticos sistémicos), hemorragia gastrointestinal (control del sangrado), sobredosis de diuréticos (expansión de volumen), estreñimiento (laxantes), alcohol (tiamina) y alteraciones electrolíticas76. Los factores desencadenantes de EH más frecuentes, reportados en un estudio descriptivo que incluyó 132 pacientes con CH, fueron: infección (49.2%), alteraciones electrolíticas (41%), estreñimiento (33.3%) y hemorragia gastrointestinal (16%). De las infecciones la más frecuente fue PBE (18%) seguida de infecciones del tracto respiratorio (14.4%) y urinario (13.7%). La hiponatremia fue el desequilibrio electrolítico más común, seguido de hipocalemia; además, se reportó que el tratamiento con lactulosa y rifaximina fue superior al tratamiento con lactulosa como monoterapia, con una menor estancia hospitalaria (7± 3.6 versus 9.64± 5.28 días, p=0.015), sin embargo la diferencia en mortalidad no fue estadísticamente significativa77.
A pesar de que la EH es la causa más frecuente de alteración del estado de alerta en el paciente con CH, el diagnóstico diferencial es extenso. Algunas de las manifestaciones clínicas más frecuentemente reportadas en pacientes con EH manifiesta son confusión (78%), cambios en el estado mental (57%), desorientación en el tiempo, persona o espacio (48%), letargia (46%) y asterixis (45%) y otras manifestaciones menos frecuentes como: somnolencia, olvido, cambios en el patrón de sueño-vigilia, dificultad para la concentración, cambios en las actividades de la vida diaria, habla arrastrada, cambios en la personalidad, irritabilidad, comportamiento inapropiado y coma78. En un estudio retrospectivo de casos y controles que incluyó 349 pacientes con CH descompensada y alteración del estado de alerta la causa más frecuente de alteración del estado de alerta fue la EH (47%), seguido de sepsis (23%), otras causas menos frecuentes fueron: alteración metabólica como hiponatremia<125mEq/l o hipoglucemia<60mg/dl (8%), ingestión de tóxicos (7%), lesión cerebral estructural (déficit focal neurológico o crisis convulsivas o una tomografía de cráneo con evidencia de isquemia, hemorragia o tumoración) (5%) y finalmente alteraciones psiquiátricas (1%). En comparación con pacientes con estado de alerta normal, los pacientes con estado de alerta alterado tuvieron niveles más altos de bilirrubina sérica, INR y creatinina, con un menor nivel de albúmina y puntuación de MELD más elevado (p≤0.001). La mortalidad entre los pacientes con alteración del estado de alerta fue significativamente mayor que en aquellos con estado de alerta normal (35% versus 16%, p<0.0001)79. La realización de tomografía de cráneo como abordaje inicial de la alteración del estado de alerta en pacientes con CH ha sido evaluada en distintos estudios; uno de ellos reportó que más de la mitad de los pacientes (64%) tienen un estudio tomográfico al ingreso, ningún paciente con CH y alteración del estado de alerta sin evidencia de focalidad neurológica a la exploración física presentó lesiones estructurales en la tomografía de cráneo y el 100% de los pacientes con focalidad neurológica (n=25) manifestada como: hemiparesia facial o afectación de algún par craneal (6 pacientes), hemiparesia o hemiplejía (5 pacientes), falta de respuesta a estímulos súbita (5 pacientes), crisis convulsivas (5 pacientes), afasia, postura de decorticación y Babinski tuvieron lesiones estructurales. Los hallazgos tomográficos fueron: evento vascular cerebral75, hemorragia intraparenquimatosa72 y tumoración66,80. El segundo estudio demostró una baja probabilidad de hemorragia intraparenquimatosa en aquellos pacientes con CH y alteración del estado de alerta sin evidencia de déficit neurológico focal o traumatismo, con una RM de 0.02 (IC 95%: 0.001-0.14) para aquellos pacientes con indicaciones de bajo riesgo, el NNT para hemorragia intraparenquimatosa varió de acuerdo con la indicación, siendo de 9 para el déficit neurológico focal, 20 para el traumatismo craneoencefálico y 293 para la alteración del estado de alerta81.
Puntos clave- 1.
La EH debe clasificarse de acuerdo a 4 ejes: enfermedad hepática subyacente, gravedad clínica, temporalidad y presencia o ausencia de factores precipitantes.
- 2.
La expansión de volumen intravenoso produce supresión de los niveles de angiotensina ii resultando en un aumento de la excreción urinaria de amonio, por lo que se ha propuesto que la infusión de cristaloides puede ser de utilidad en el manejo de la EH.
- 3.
El tratamiento de la EH incluye el cuidado de soporte, identificación y retiro de factores precipitantes, reducción de la carga de nitrógeno del intestino y profilaxis secundaria.
- 4.
A pesar de que la EH es la causa más frecuente de alteración del estado de alerta en el paciente con CH, el diagnóstico diferencial es extenso.
- 5.
Se ha demostrado que pacientes con CH y alteración del estado de alerta, sin evidencia de focalidad neurológica a la exploración física, excepcionalmente presentan lesiones estructurales en la tomografía de cráneo.
La LRA ocurre en hasta 50% de los pacientes con CH hospitalizados, y es secundaria a la combinación de la disminución del volumen arterial efectivo debido a vasodilatación arterial, asociado con un aumento en la vasoconstricción intrarrenal y alteración en la autorregulación renal37. Las infecciones, el inicio abrupto de hiperbilirrubinemia, la hemorragia gastrointestinal, el aumento de la diuresis o el uso de agentes nefrotóxicos producen alteraciones en el estado circulatorio, con reducción de la perfusión renal, precipitando la LRA. Estos factores deben ser rápidamente identificados y corregidos para prevenir el desarrollo de complicaciones renales posteriores82. Las diversas clasificaciones de ACLF mencionan diferentes definiciones de fallo orgánico renal, otorgando puntuación de creatinina con rangos tan bajos como 0.7mg/dl (AARC) o hasta la necesidad de TRR (NACSELD), por lo que la definición de LRA como urgencia médica es, consecuentemente, muy amplia. Así, la LRA, independientemente de su etiología, siempre debe catalogarse como una urgencia en CH, ya que puede representar un punto de inflexión en la evolución de la descompensación de la CH que amerita manejo en urgencias.
Distintos tipos de LRA pueden ocurrir en el paciente con cirrosis descompensada; la LRA de origen prerrenal es el más frecuente, presentándose hasta en el 70% de los casos. Además de la LRA parenquimatosa o intrínseca (necrosis tubular aguda) los pacientes con CH pueden presentar síndrome hepatorrenal (SHR) que se caracteriza por la falta de respuesta a la expansión de volumen con albúmina, ausencia de choque y sin datos que sugieran enfermedad parenquimatosa renal83.
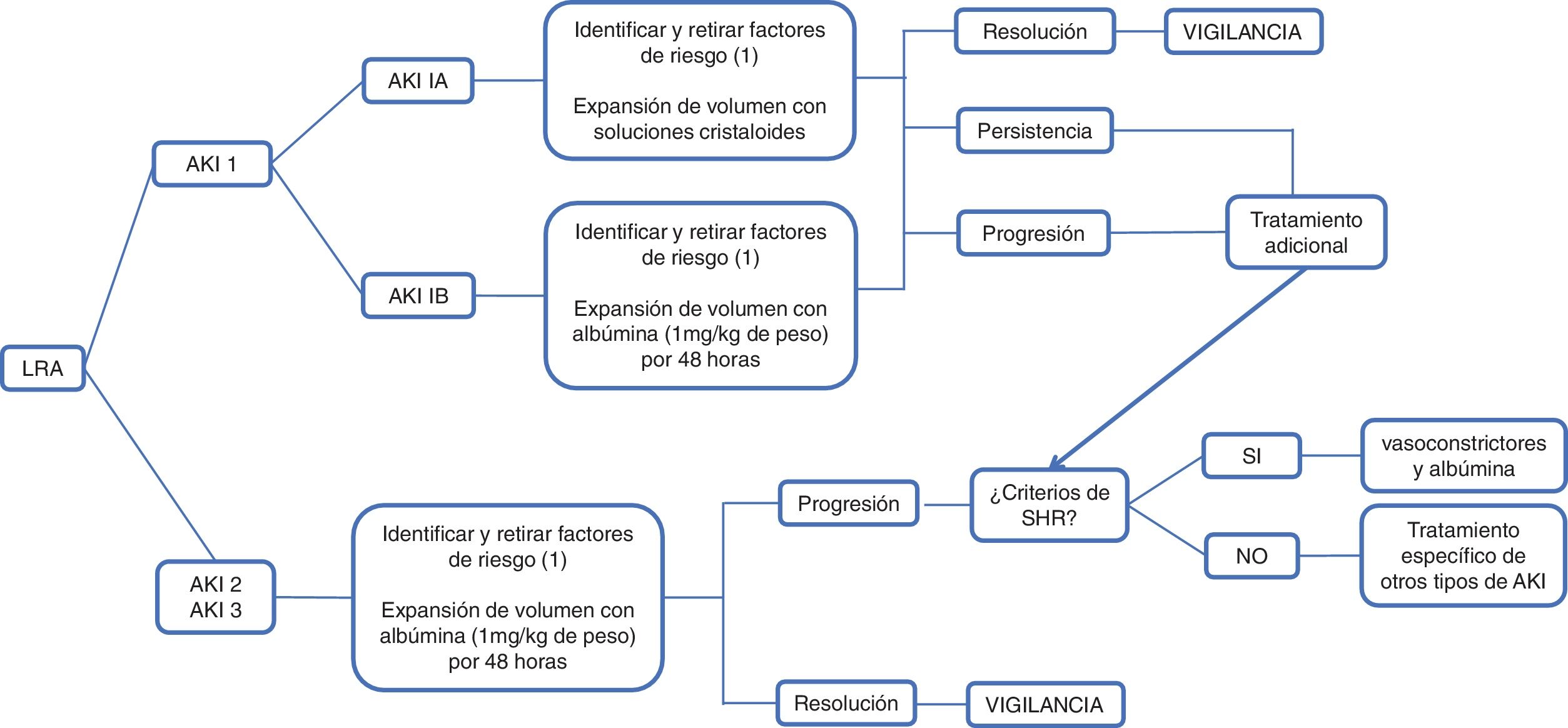
De acuerdo con el Club Internacional de la Ascitis (ICA) la LRA se define como un aumento en la creatinina sérica≥0.3mg/dl en 48horas o un aumento del 50% de la creatinina sérica basal determinada como la creatinina sérica en los 7 días hasta 3 meses previos, y se clasifica en 3 estadios. En el estadio 1 existe un aumento en la creatinina sérica≥0.3mg/dl o un incremento de 1.5 a 2 veces la creatinina basal; este a su vez se clasifica en 1A y 1B, siendo el primero cuando la creatinina sérica es <1.5mg/dl y el segundo cuando es≥1.5mg/dl. Los pacientes con estadio 1A tienen una mortalidad a corto plazo similar a aquellos sin lesión renal, con mayor frecuencia de regresión a la normalidad que aquellos con estadio 1B. El estadio 2 se define como un aumento en la creatinina sérica de 2 a 3 veces de la basal y el estadio 3 cuando existe un aumento>3 veces de la creatinina basal o el nivel de creatinina sérica es≥4.0mg/dl, con un aumento agudo≥0.3mg/dl o inicio de terapia de sustitución renal. En pacientes que no cuentan con creatinina basal previa debe utilizarse la creatinina del ingreso como referencia84 (fig. 1).
Administración de soluciones intravenosasLa evaluación del volumen intravascular es el primer paso en la determinación de la etiología de la LRA en los pacientes con CH descompensada. La evaluación de la volemia es difícil debido a la presencia de circulación hiperdinámica. De acuerdo con la guía de manejo de pacientes con CH descompensada, publicada por la EASL, independientemente del estadio del LRA se debe suspender la administración de diuréticos, bloqueadores beta y fármacos nefrotóxicos, como los antiinflamatorios no esteroideos y los vasodilatadores, además del reconocimiento y manejo temprano de infecciones bacterianas. La expansión de volumen debe realizarse de acuerdo con la causa y gravedad de la pérdida de líquidos, en la LRA estadio 1A de la clasificación propuesta por el ICA, donde la hipovolemia es la causa más frecuente, la expansión de volumen puede ser con soluciones cristaloides en casos de pérdida de volumen debido a diarrea o aumento de la diuresis o trasfusión de concentrados eritrocitarios en pacientes con hemorragia gastrointestinal37,69,85,86.
La expansión de volumen con aproximadamente 1.5litros de solución salina normal o 1g/kg de albúmina (máximo de 100g/dosis) debe ser administrada tan pronto como se identifique LRA en un paciente con CH, la reversión de la LRA en 48horas con un sedimento urinario normal es sugestivo de daño prerrenal87.
En la CH avanzada la respuesta a la administración de volumen es anormal, el aclaramiento del agua libre se encuentra disminuido debido a un incremento de la actividad del sistema nervioso simpático, disminución de la tasa de filtrado glomerular, retención de sodio y alteraciones en la absorción de agua en los túbulos distal y colector. La expansión de volumen con solución salina aumenta el volumen sistólico y el GC, reduce la resistencia vascular sistémica y puede resultar en expansión del plasma y del espacio intersticial. La mayoría del líquido intravascular es retenido en las venas del sistema esplácnico, además en pacientes con CH avanzada existe retención de sodio, por lo que un aumento en la carga de sodio no resultará en incremento de la excreción renal de sodio88.
La expansión intravascular de volumen en el paciente con CH descompensada puede potencialmente producir empeoramiento de la ascitis, derrame pleural o fallo cardíaco. La evaluación clínica de la volemia es difícil, ya que el volumen intravascular puede estar depletado, a pesar de la existencia de ascitis y edema periférico. La utilidad de la evaluación no invasiva de la volemia en el paciente con cirrosis ha sido previamente descrita; un estudio que utilizó la ecocardiografía con medición del tamaño y colapsabilidad de la vena cava inferior y la bioimpedancia multifrecuencia, demostró que los pacientes con cirrosis compensada y descompensada tienen aumento en la retención de líquido en el tronco y en las piernas, a pesar de presiones de llenado auriculares normales y ausencia de edema periférico. Los pacientes con CH descompensada tienen expansión del volumen extracelular por aumento de la permeabilidad vascular. Ninguna de estas herramientas fue confiable para predecir el volumen intravascular, por lo que la evaluación clínica continúa siendo el elemento crucial en la evaluación del volumen en pacientes con enfermedad hepática crónica89.
Utilidad de la albúminaLa albúmina sérica humana es responsable del 75% de la presión oncótica del plasma, por lo que la administración de albúmina intravascular aumenta el volumen sanguíneo circulante, y además tiene funciones antioxidantes, inmunomoduladoras y detoxificantes90. Es una molécula con carga negativa que atrae sodio, que a su vez retiene agua, aumentando la presión oncótica. En el paciente con CH la síntesis de albúmina en el hepatocito está reducida, aunado a una disminución de la concentración de albúmina efectiva91. La infusión de albúmina en pacientes con CH produce inicialmente paso del líquido del espacio intersticial al volumen plasmático con expansión de este último debido a las fuerzas oncóticas, y posteriormente la albúmina administrada es redistribuida88. En la evaluación de pacientes con LRA la propiedad de la albúmina de expandir el volumen es utilizada para determinar si la disfunción renal tiene respuesta a volumen91.
De acuerdo con el consenso del ICA y la EASL, en el paciente con LRA y estadio>1A, se debe administrar albúmina intravenosa a dosis de 1g/kg de peso por 2 días consecutivos con un máximo de 100g al día. En este contexto el LRA resolverá si la causa era hipovolemia (prerrenal). Si no existe resolución del LRA debe descartarse SHR o necrosis tubular aguda68,86.
A pesar de que en pacientes críticamente enfermos sin CH no se ha demostrado una disminución en la mortalidad a los 28 días cuando se compara la administración de albúmina (albúmina al 4%) con cristaloides (solución salina normal) para la expansión de volumen (RR 0.99, IC 95%: 0.91-1.09, p=0.87)53, en pacientes con CH la administración de albúmina se recomienda por sus propiedades antiinflamatorias y antioxidantes82.
El SHR es la consecuencia de una disfunción circulatoria extrema, con vasodilatación arterial esplácnica y miocardiopatía cirrótica asociada a disfunción diastólica y sistólica que conducen a hipoperfusión renal y fallo renal90.
El consenso del ICA de 2007 clasifica al SHR en tipos 1 y 2; el tipo 1 se caracteriza por un deterioro rápido de la función renal, generalmente secundario a un evento precipitante, mientras que el tipo 2 se caracteriza por un deterioro moderado y lento de la función renal, sin un evento desencadenante identificable. Sin embargo, en su última actualización de 2015 el ICA propone la modificación del término SHR tipo 1 por HRS-AKI (por sus siglas en inglés), definido como ausencia de respuesta a la administración de albúmina a dosis de 1g/kg de peso por 2 días consecutivos asociado al retiro de diuréticos en un paciente con CH, ascitis y LRA, de acuerdo con los criterios ICA-AKI, en ausencia de choque, uso de medicamentos nefrotóxicos (antiinflamatorios no esteroideos, aminoglucósidos y contrastes yodados) y sin evidencia macroscópica de daño parenquimatoso renal definido como proteinuria menor a 500mg/día, ausencia de microhematuria (>50 eritrocitos por campo de alto poder) y un ultrasonido renal normal, eliminando el nivel de creatinina>2.5mg/dl necesario para establecer el diagnóstico de acuerdo con la definición previa, con el fin de iniciar tratamiento temprano con vasoconstrictores y albúmina86.
Recientemente Angeli et al. proponen la reclasificación del SHR en HRS-AKI y NAKI (no AKI), el cual a su vez se clasifica en HRS-AKD (enfermedad renal aguda [siglas en inglés]) y HRS-CKD (enfermedad renal crónica [siglas en inglés]), los cuales se definen como una disminución de la tasa de filtrado glomerular estimada<60ml/min/1.73m2 por<3 meses (HRS-AKD) y>3 meses (HRS-CKD) en ausencia de otras causas estructurales84.
Una vez establecido el diagnóstico de SHR se debe iniciar el tratamiento específico, los vasoconstrictores, en particular la terlipresina, que asociada a la administración de albúmina han demostrado mejorar la función renal y la supervivencia de forma significativa. Una revisión sistemática y metaanálisis, que incluyó 13 estudios controlados aleatorizados con 739 pacientes con SHR tipo 1, reportó que el uso de terlipresina y albúmina reduce la mortalidad a corto plazo (RM 0.65, IC 95%: 0.41-1.05) en comparación con placebo, y que tanto terlipresina con albúmina como noradrenalina con albúmina son superiores a midodrina con octreótido y albúmina para la reversión del SHR (RM 26.25, IC 95%: 3.07-224.21)92.
La albúmina es crucial en la efectividad del tratamiento del SHR. La eficacia de la terlipresina como monoterapia (3.2±1.3mg/día) fue evaluada de manera retrospectiva en un estudio multicéntrico que incluyó 99 pacientes con SHR tipo 1, en el que se reportó una mejoría de la función renal en el 58% de los pacientes93. La mayor eficacia obtenida con la combinación albúmina-terlipresina en comparación con solo terlipresina podría ser secundaria a una disminución del GC asociado con la administración de terlipresina, ya que la albúmina tiene la capacidad de mantener o incrementar el GC, incluso en estadios avanzados de la CH84. La dosis de albúmina recomendada por la EASL es de 20 a 40g/día, monitorizando la sobrecarga de volumen. El tratamiento debe ser mantenido hasta la resolución del daño renal, determinado por una creatinina<1.5mg/dl o por un máximo de 14 días, ya sea por falta de respuesta o por respuesta parcial (disminución≥50% con una creatinina>1.5mg/dl)68.
Diversos estudios han demostrado que la combinación albúmina-terlipresina es más efectiva que la albúmina como monoterapia en el tratamiento del SHR tipo 1; uno de ellos incluyó 52 pacientes con SHR asignados para recibir terlipresina y albúmina o albúmina como monoterapia. En 21 (80%) de los pacientes asignados al grupo con terlipresina y albúmina hubo respuesta completa en comparación con 5 (19%) del grupo con albúmina (p≤0.001)94. En un segundo estudio, con 46 pacientes asignados a terlipresina (1-2mg IV cada 4 horas) y albúmina (1g/kg dosis única, seguido de 20 a 40g/día), o albúmina como monoterapia, el 43.5% de los pacientes en el grupo de telipresina tuvo mejoría de la función renal, en comparación con el 8.7% del grupo con albúmina (p=0.017), reportando que no hubo diferencia en la supervivencia a los 3 meses entre los 2 grupos (27% versus 19%, p=0.7)95, y en el recientemente publicado estudio CONFIRM, un estudio fase 3 realizado para confirmar la eficacia y seguridad de terlipresina asociado con albúmina en adultos con SHR tipo 1, en el que los pacientes fueron asignados de manera aleatoria con una relación 2:1 para recibir terlipresina (1-2mg IV cada 6horas) o placebo y albúmina, la reversión del SHR ocurrió en el 39% de los pacientes del grupo terlipresina y albúmina y en el 18% del grupo placebo (p>0.001), corroborando que la terlipresina es más efectiva que el placebo en mejorar la función renal, aunque la administración de terlipresina se asoció con efectos adversos graves como fallo respiratorio96.
Manejo urgente concomitanteCorrección de electrolitos: en pacientes con LRA grave pueden existir desequilibrios hidroelectroíticos que requieran TRR, sobre todo hipercalemia97. La meta de manejo de la hipercalemia aguda es la prevención o minimización de los efectos electrofisiológicos en el corazón para disminuir el riesgo inmediato de arritmias. Las opciones terapéuticas para la hipercalemia aguda incluyen: gluconato de calcio intravenoso, insulina/glucosa, beta agonistas inhalados (salbutamol), bicarbonato de sodio intravenoso y hemodiálisis98. En pacientes con CH la TRR debe ofrecerse posterior a considerar el pronóstico, y en general debe utilizarse solamente como puente al trasplante hepático o en pacientes con LRA potencialmente reversible. En pacientes no candidatos a trasplante la decisión debe tomarse de manera cautelosa97.
Corrección del estado ácido-base: los pacientes con CH compensada mantienen un estado ácido base normal gracias al desarrollo de hiperbicarbonaturia renal para compensar la disminución en las concentraciones de dióxido de carbono99.
Alcalosis respiratoria: es la alteración ácido-base más frecuente en el paciente con cirrosis (64%)100, secundaria a hiperventilación por efecto de la progesterona en el sistema nervioso central y su potenciación por estrógenos99. Otros factores asociados son la disminución de la capacidad residual funcional por ascitis, síndrome hepatopulmonar o hipertensión porto-pulmonar97.
Alcalosis metabólica: generalmente inducida por hiperaldosteronismo secundario (hipovolemia efectiva, diuréticos de asa y vómitos)100. El uso de diuréticos de asa promueve la retención de bicarbonato con depleción de cloro, aumento de la secreción de aldosterona con incremento de la excreción de potasio y aumento de la producción de amonio99. Además, la disminución de la síntesis de albúmina y el aclaramiento del lactato pueden contribuir al desarrollo de alcalosis metabólica, ya que la albúmina es un ácido débil97.
Acidosis metabólica: el riñón establece la compensación metabólica de la alcalosis respiratoria al disminuir tanto la secreción tubular de ácido como la absorción y aumentar la excreción del bicarbonato, aunado a la retención de iones de cloro que produce hipercloremia. Hasta el 70% del ácido láctico del cuerpo es metabolizado por el hígado y solo una pequeña porción por el riñón; en este contexto la CH frecuentemente resulta en la incapacidad del hígado para aclarar el ácido láctico sistémico97.
Acidosis metabólica anión gap elevado (acidosis láctica): se ha reportado hasta en un 20% a 30% de los pacientes. Las causas más frecuentes son: acidosis láctica por sepsis o choque, cetosis alcohólica o acidosis por tóxicos exógenos (metanol e ingestión de etilenglicol)100. Puede ser de tipo A o B; la primera está asociada con la alteración de la perfusión de los tejidos y producción de lactato y la segunda con una perfusión normal y poca utilización del lactato. El tipo B ocurre en casi todos los pacientes con enfermedad hepática crónica debido a una disminución en la utilización del ácido láctico vía gluconeogénesis, mientras que la tipo A ocurre en situaciones hemodinámicas que producen hipotensión, hipoperfusión y producción de lactato. El tratamiento de la acidosis láctica tipo A, que se presenta como una acidosis metabólica de anión gap elevado incluye la administración de soluciones intravenosas, soporte vasopresor o inotrópico, y en caso de acidosis láctica asociada con infecciones el inicio temprano de antibiótico es indispensable97.
Acidosis metabólica ANION GAP normal (hiperclorémica): generalmente secundaria a necrosis tubular aguda, déficit de fósforo o defectos primarios en la acidificación urinaria en cirrosis puede además ser inducida por el uso crónico de espironolactona100. A diferencia de la necrosis tubular aguda la acidificación urinaria es normal y se asocia frecuentemente con hipercalemia97.
Puntos clave- 1.
La LRA ocurre en hasta 50% de los pacientes con CH hospitalizados. Los factores desencandenantes deben ser rápidamente identificados y corregidos (infecciones, insuficiencia hepática, uso de diuréticos, nefrotóxicos y pérdidas de volumen aceleradas).
- 2.
Se recomienda suspender la administración de diuréticos, bloqueadores beta y fármacos nefrotóxicos como antiinflamatorios no esteroideos y vasodilatadores, además del reconocimiento y manejo temprano de infecciones bacterianas.
- 3.
La expansión de volumen (albúmina o cristaloides) debe ser administrada tan pronto como se identifique LRA en un paciente con CH.
- 4.
El término SHR tipo 1 fue reemplazado por SHR-LRA, definido como ausencia de respuesta a la administración de albúmina, asociado al retiro de diuréticos en un paciente con CH, ascitis y LRA de acuerdo con los criterios ICA-AKI, en ausencia de choque, uso de medicamentos nefrotóxicos y sin proteinuria o microhematuria y un ultrasonido renal normal.
- 5.
El tratamiento del SHR se basa en la administración concomitante de terlipresina y albúmina.
La hiponatremia se define como una concentración sérica de sodio<130mmol/l. Es un marcador de pobre pronóstico y se asocia con aumento de la morbimortalidad68. En el manejo de la hiponatremia es importante distinguir entre hiponatremia hipovolémica e hiponatremia hipervolémica101.
Hiponatremia hipovolémica: causada por un prolongado balance de sodio negativo con pérdida marcada del líquido extracelular. Representa menos del 10% de los casos101, frecuentemente asociados al uso de diuréticos y realización de paracentesis, ya que la depleción aguda de volumen produce liberación de hormona antidiurética, con aumento de la reabsorción de sodio en la nefrona proximal68,97. Debe tratarse cuando el sodio sérico es<130mmol/l con expansión de volumen con solución salina y suspensión de la administración de diuréticos68.
Hiponatremia hipervolémica: es el tipo de hiponatremia más frecuente y se caracteriza por expansión del volumen extracelular con ascitis y edema. Es secundaria a la activación del sistema renina-angiotensina-aldosterona por la disminución del volumen circulante efectivo asociado a la vasodilatación esplácnica97. El tratamiento se basa en un balance hídrico negativo, con restricción de líquidos a 1,000ml/día68. Si no existe mejoría en las primeras 24 a 48horas deben considerarse otras opciones101. La administración de soluciones hipertónicas con cloruro de sodio puede mejorar la natremia, pero aumenta la sobrecarga de volumen y empeora la ascitis y el edema68, por lo que su manejo está limitado a hiponatremia gravemente sintomática con manifestaciones que ponen en peligro la vida, como crisis convulsivas y coma o cuando la hiponatremia es profunda (Na<110mEq/l). En la hiponatremia aguda (<24horas de evolución) se administra solución salina al 3% 100ml para 15 a 30minutos, y este puede repetirse hasta 3 veces con un total de 300cc. La meta es el aumento de sodio sérico de 4 a 6mEq/l en las primeras 6horas. En el caso de hiponatremias crónicas sintomáticas o graves (Na<110mEq/l) se puede administrar solución salina en infusión continua a una velocidad de 15 a 30ml/h101. No se debe aumentar la concentración de sodio más de 8mmol/l al día para evitar secuelas neurológicas como desmielinización osmótica68.
Una de las opciones terapéuticas en la corrección de la hiponatremia es la administración de albúmina; esta produce un aumento en el sodio sérico al incrementar el aclaramiento urinario de agua libre secundario a la expansión del volumen intravascular101. El impacto de la albúmina en la resolución de la hiponatremia fue evaluado en un estudio retrospectivo que incluyó 1,126 pacientes con cirrosis descompensada e hiponatremia (Na<130mEq). Recibieron albúmina intravenosa 777 y los que recibieron albúmina con una media de la cantidad total utilizada de 225g (RIQ: 100-400) tuvieron mayor tasa de resolución de la hiponatremia, independientemente de la función renal y de los niveles basales de sodio, en comparación con los pacientes que no recibieron albúmina (85.41% versus 44.78%, p=0.0057, RM: 1.5; IC 95%: 1.13-2.0), evidenciando además una mejoría en la supervivencia a los 30 días102.
HipocalemiaLa presencia de sarcopenia en el paciente con cirrosis se asocia, junto con el uso de diuréticos, a bajas reservas de potasio en el cuerpo que predisponen al desarrollo de hipocalemia100. En estos pacientes los niveles totales de potasio del cuerpo pueden estar disminuidos hasta en un 30% al 40%97. La hipocalemia es frecuentemente de origen multifactorial y las principales causas son: el uso de diuréticos de asa, pérdidas gastrointestinales (vómitos/diarrea), alcalosis respiratoria, hiperaldosteronismo secundario, acidosis tubular renal e hipomagnesemia por malnutrición crónica99,100. El magnesio actúa como un inhibidor del transporte del canal ROMK (medular externa renal de potasio, principal canal de potasio en la nefrona distal) y su deficiencia aumenta la excreción de potasio99. Por otro lado, el uso de terlipresina en pacientes con hemorragia variceal puede inducir hipocalemia por vasoconstricción arterial marcada con aumento de la tasa de filtrado glomerular y excreción de potasio, además potencia el efecto de la aldosterona en la secreción de potasio en los túbulos colectores100. Puede precipitar el desarrollo de EH debido al aumento de amonio en la vena renal e incremento de la permeabilidad de la barrera encefálica causada por la alcalosis82. La hipocalemia induce acidosis intracelular en las células del túbulo proximal, que produce un aumento en la reabsorción y metabolismo de la glutamina que conlleva la amoniogénesis99. En cuanto al manejo, la corrección del potasio debe ser lenta, particularmente si se utiliza la vía intravenosa, ya que los pacientes con CH presentan una disminución en la capacidad amortiguadora de las cargas de potasio, con el riesgo de desarrollar hipercalemia de rebote99. De acuerdo con las últimas guías de manejo del paciente con CH descompensada, publicadas por la EASL, si el potasio sérico es<3 mmol/l debe suspenderse la administración de furosemida68.
HipercalemiaLos pacientes con CH pueden desarrollar hipercalemia con una prevalencia de 12% al 14%20, generalmente secundaria al uso de antagonistas de la aldosterona y otros diuréticos ahorradores de potasio (amiloride y eplerenona)82 Los pacientes con mayor riesgo de desarrollar hipercalemia son aquellos con niveles de creatinina mayores a 1.3mg/dl y pacientes con dosis de espironolactona mayores a 100mg/día99. Además del uso de diuréticos, los pacientes con CH avanzada reciben otros medicamentos ahorradores de potasio como los inhibidores de la enzima convertidora de angiotensina, bloqueadores del receptor de angiotensina y bloqueadores beta. Los inhibidores de la enzima convertidora de angiotensina y los antagonistas del receptor de la angiotensina ii (ARA II) interaccionan en la actividad del sistema renina-angiotensina con un incremento del riesgo no solo de hipotensión y de fallo renal, sino también de EH e hipercalemia, por lo que no están recomendados en pacientes con CH y ascitis103. Otros factores asociados con el desarrollo de hipercalemia son los alimentos ricos en potasio como el plátano, las naranjas o el jengibre100.
La trascendencia clínica de la hipercalemia en CH ha sido evaluada previamente. Un estudio reportó que los niveles séricos de potasio se asocian de manera significativa con la creatinina (p<0.001) y la urea (p<0.001), y de manera inversa con el sodio (p<0.001). Se reportó además un aumento en la mortalidad en los pacientes con hipercalemia (HR: 1.3, IC 95%: 1.11-1.57), con el desarrollo de un modelo de predicción de mortalidad a corto y largo plazo «Modelo K», con un índice de concordancia de 0.80 en un grupo de validación104.
De acuerdo con las últimas guías de manejo del paciente con cirrosis descompensada publicadas por la EASL, si el potasio sérico es>6mmol/l la administración de espironolactona debe suspenderse68.
Puntos clave- 1.
Los desequilibrios electrolíticos pueden ser precipitantes de otras complicaciones en CH, como EH.
- 2.
El manejo de la hiponatremia se basa en la distinción entre hiponatremia hipovolémica e hiponatremia hipervolémica.
- 3.
La hipocalemia tiene origen multifactorial: diuréticos de asa, pérdidas gastrointestinales, alcalosis respiratoria, hiperaldosteronismo secundario, acidosis tubular renal e hipomagnesemia por malnutrición crónica.
- 4.
La hipercalemia suele ser secundaria al uso de antagonistas de la aldosterona y otros diuréticos ahorradores de potasio, con mayor riesgo en aquellos con niveles de creatinina mayores a 1.3mg/dl.
Esta revisión trata de los aspectos fundamentales de la reanimación de pacientes con CH críticamente enfermos, con especial enfoque en la atención urgente inicial. El objetivo fue analizar la literatura disponible acerca del manejo especial que requieren los pacientes con CH en el contexto de urgencias para las condiciones más frecuentes encontradas en esta etapa de la atención de acuerdo a la opinión de expertos. Se intentó recabar la información pertinente y que abarcara exclusivamente a pacientes con CH en diferentes contextos clínicos urgentes, como el choque hipovolémico por HTDA variceal, sepsis y choque séptico, EH, LRA y las alteraciones electrolíticas aisladas (tabla 1).
Evaluación y reanimación del paciente con cirrosis hepática
| Evaluación de gravedad | Terapia hídrica | Terapia específica | |
|---|---|---|---|
| HTDA variceal y choque hipovolémico | Signos de hipoperfusión tisularPAS<90mmHg o PAM<65mmHgLactato≥4.0 mmol/l,pH≤7.1 o déficit de bases≤−5 mEq/l | Cristaloides Ringer-lactato | Vasopresores:Terlipresina, somatostatina, octreótido, vasopresinaTrasfusión de hemoderivados:Hb meta entre 7 a 9g/dlEn casos de hemorragia aguda mantener fibrinógeno≥120 |
| Sepsis y choque séptico | CLIF-C ACLF | Sol. salina 0.9% o Ringer-lactato | Vasopresores:Noradrenalina de primera elecciónTerapia adicional: epinefrina, vasopresina, dopaminaDobutamina, considerar en disfunción miocárdicaAlbúmina en casos específicosAntibióticos |
| Encefalopatía hepática | Clasificación de West HavenEscala de coma de Glasgow | Sol. salina 0.9% o Ringer-lactato | Cuidados de soporteIdentificación y retiro del factor precipitante:Infecciones, HTD, diuréticos, estreñimiento, alcohol, malnutrición, alteraciones electrolíticasFarmacológico:Disacaridos no absorbibles (lactulosa y lactitol)Antibióticos no absorbibles (rifaximina)Tratamiento farmacológico adicional:AACR (isoleucina, leucina y valina)LOLA |
AACR: aminoácidos de cadena ramificada; Hb: hemoglobina; HTD: hemorragia de tubo digestivo; LOLA: L-ornitina, L-aspartato.
En múltiples ocasiones nos hemos preguntado ¿son los pacientes con CH una población tan única en algunos aspectos que tendrían que reanimarse de forma general de una manera especial en comparación con otro tipo de enfermos críticos? Existen bases fisiopatológicas teóricas que implicarían que los pacientes con CH requieren de un tipo de reanimación de urgencias diferente en aspectos como el choque, sepsis, trastornos electrolíticos, alteración neurológica y daño renal. A pesar de que el paciente con CH es excepcional en varios aspectos inherentes a la fisiopatología de su enfermedad, no existen directrices especializadas para esta población en varios de los temas abordados. Esto no significa que no se pueda aplicar el conocimiento adquirido en poblaciones sin CH, de hecho, la práctica cotidiana, como se percibe de esta revisión, está plagada de prácticas extrapoladas de poblaciones sin CH. Enfatizamos que se deben tener en cuenta los aspectos únicos de los pacientes con CH en el momento de su manejo urgente, ya que no existe, a la fecha, suficiente evidencia para aseverar que los pacientes con CH deben tener un manejo estándar urgente significativamente diferente al de otros contextos, igualmente resaltando que los pacientes, con y sin CH, siempre deben analizarse y manejarse caso por caso. Las complicaciones urgentes en CH incluyen HTDA variceal, sepsis, ascitis y EH, entre otras. La reanimación inicial incluye las medidas de las vías respiratorias y la circulación, que es primordial en estos pacientes, y se ofrecen varias técnicas nuevas para el abordaje de la intubación y la reanimación en pacientes con CH grave. El conocimiento de la evaluación y el manejo de las complicaciones asociadas con la CH pueden mejorar la atención de los pacientes con enfermedad hepática grave.
FinanciaciónLos autores declaran que no se recibió ningún tipo de financiación para este estudio.
Conflicto de interesesLos autores declaran que no tienen ningún conflicto de intereses.