El diagnóstico diferencial de las lesiones quísticas de páncreas incluye lesiones no neoplásicas y lesiones epiteliales neoplásicas. El diagnóstico preciso es imperativo, pues su manejo está determinado por el riesgo de progresión maligna, los síntomas asociados y otras características. La presente revisión intenta proporcionar una ruta crítica que facilite la caracterización y manejo de las lesiones quísticas de páncreas.
The differential diagnosis of pancreatic cystic lesions includes non-neoplastic lesions and neoplastic epithelial lesions. Given that management is determined by the risk for malignant progression, associated symptoms, and other characteristics, an accurate diagnosis is imperative. The present review attempts to provide a critical path that facilitates the characterization and management of pancreatic cystic lesions.
El diagnóstico diferencial de las lesiones quísticas de páncreas (LQP) es amplio e incluye lesiones epiteliales neoplásicas o inflamatorias benignas, identificadas la mayoría de las veces de manera fortuita en estudios de imagen indicados por síntomas no relacionados con este órgano. Su frecuencia se incrementa con la edad y se estima entre el 2% y el 45% en población general1.
El riesgo de transformación maligna de las LQP descubiertas de manera fortuita (LQIP) es relativamente bajo (0.01%), aunque puede aumentar (0.21%) en quistes de 2 o más centímetros, por lo que el diagnóstico preciso es fundamental para planear su tratamiento de acuerdo con el riesgo de progresión maligna y la presencia de síntomas: por ejemplo, algunas no requerirán ni vigilancia ni tratamiento, mientras que otras necesitarán evaluación periódica y, las menos, extirpación quirúrgica2-6.
El objetivo de esta revisión es proporcionar una ruta de diagnóstico que facilite la caracterización y tratamiento adecuado de las LQIP.
Notas epidemiológicasLa frecuencia real de las LQIP en México se desconoce. Un análisis de 170 casos atendidos en el Instituto Nacional de Ciencias Médicas y Nutrición Salvador Zubirán mostró que, de manera similar a lo informado en otras series, la neoplasia mucinosa papilar intraductal (NMPI; 44.7%) fue la lesión quística más frecuente, seguida del cistoadenoma mucinoso (CAM; 18.8%), cistoadenoma seroso (14.7%), de la neoplasia sólida pseudopapilar (11.8%), pseudoquiste (4.1%), degeneración quística de tumor neuroendocrino (4.1%) y del quiste simple (1.8%)4,7. Tanto la NMPI como el CAM producen mucina y son las que mayor riesgo tienen de transformación maligna. De esta forma, una manera simple de planear la estrategia de tratamiento o seguimiento es conocer si en la lesión existe o no mucina. Un dato que puede conocerse con relativa facilidad al analizar el líquido obtenido mediante una punción guiada por métodos de imagen, preferentemente ultrasonido endoscópico (USE).
La caracterización de la LQIP reclama un estudio pormenorizado. La presentación clínica y las características morfológicas descubiertas en los métodos de imagen como tomografía axial computarizada trifásica (TAC-T), resonancia magnética nuclear (RMN) o colangiopancreatografía por resonancia magnética nuclear (CPRM) proporcionan datos importantes sobre las posibilidades diagnósticas. Estos hallazgos, en combinación con el análisis del líquido del quiste y con estudios citológicos o histológicos, permiten un diagnóstico preciso en el que se basarán las medidas de tratamiento y seguimiento. Algunos autores favorecen la cirugía en todas las LQIP, aunque esta estrategia implica una resección pancreática no exenta de riesgos y mortalidad8. El diagnóstico preciso permite seleccionar a los pacientes que verdaderamente se beneficiarán de tratamiento quirúrgico9.
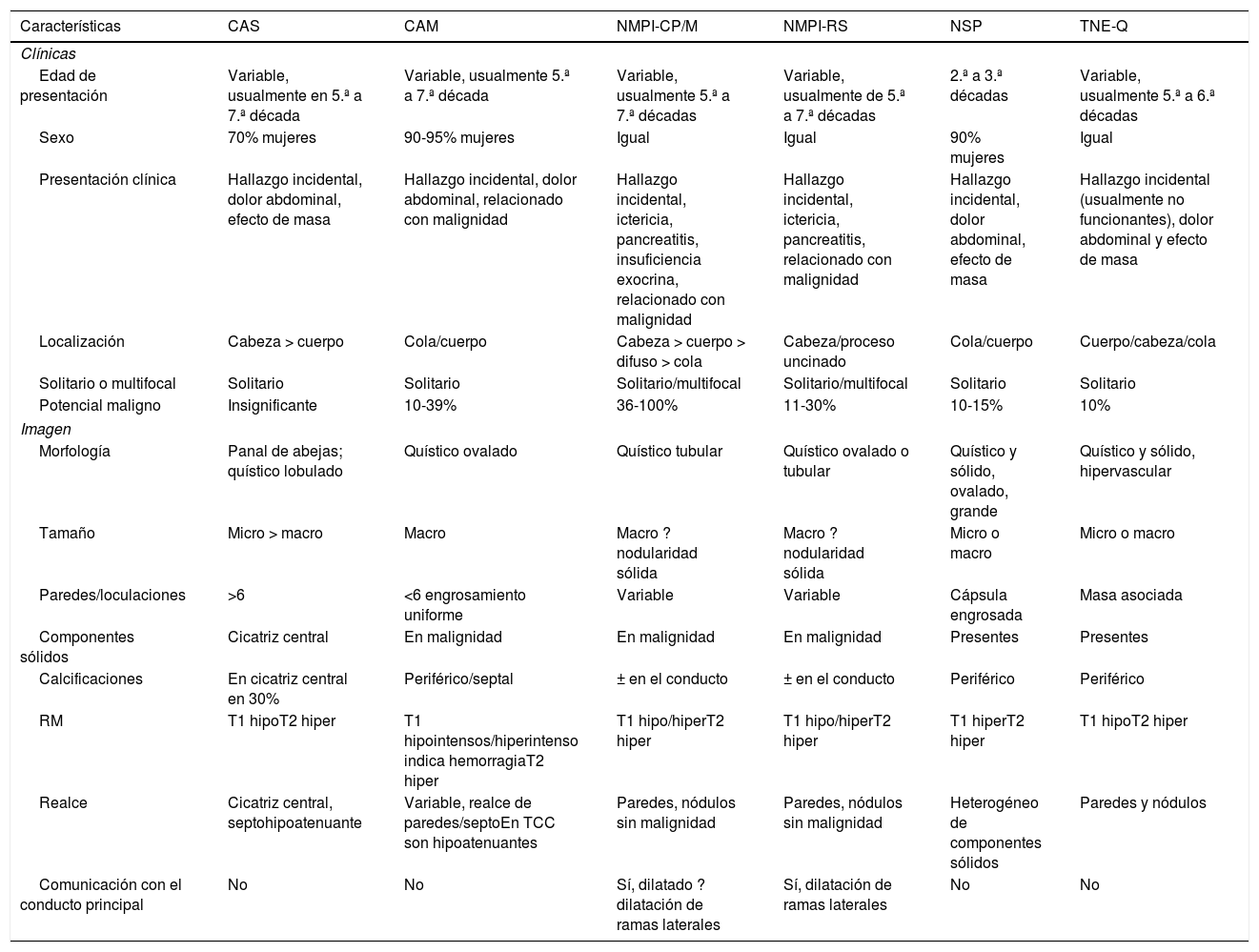
Características clínicasComo en cualquier área de la medicina, la historia clínica es fundamental. Cada una de las LQIP presenta características propias, como predilección por grupo etario o sexo, localización, características anatómicas particulares o manifestaciones específicas (tabla 1).
Características clínicas y de imagen de las neoplasias quísticas pancreáticas
| Características | CAS | CAM | NMPI-CP/M | NMPI-RS | NSP | TNE-Q |
|---|---|---|---|---|---|---|
| Clínicas | ||||||
| Edad de presentación | Variable, usualmente en 5.ª a 7.ª década | Variable, usualmente 5.ª a 7.ª década | Variable, usualmente 5.ª a 7.ª décadas | Variable, usualmente de 5.ª a 7.ª décadas | 2.ª a 3.ª décadas | Variable, usualmente 5.ª a 6.ª décadas |
| Sexo | 70% mujeres | 90-95% mujeres | Igual | Igual | 90% mujeres | Igual |
| Presentación clínica | Hallazgo incidental, dolor abdominal, efecto de masa | Hallazgo incidental, dolor abdominal, relacionado con malignidad | Hallazgo incidental, ictericia, pancreatitis, insuficiencia exocrina, relacionado con malignidad | Hallazgo incidental, ictericia, pancreatitis, relacionado con malignidad | Hallazgo incidental, dolor abdominal, efecto de masa | Hallazgo incidental (usualmente no funcionantes), dolor abdominal y efecto de masa |
| Localización | Cabeza > cuerpo | Cola/cuerpo | Cabeza > cuerpo > difuso > cola | Cabeza/proceso uncinado | Cola/cuerpo | Cuerpo/cabeza/cola |
| Solitario o multifocal | Solitario | Solitario | Solitario/multifocal | Solitario/multifocal | Solitario | Solitario |
| Potencial maligno | Insignificante | 10-39% | 36-100% | 11-30% | 10-15% | 10% |
| Imagen | ||||||
| Morfología | Panal de abejas; quístico lobulado | Quístico ovalado | Quístico tubular | Quístico ovalado o tubular | Quístico y sólido, ovalado, grande | Quístico y sólido, hipervascular |
| Tamaño | Micro > macro | Macro | Macro ? nodularidad sólida | Macro ? nodularidad sólida | Micro o macro | Micro o macro |
| Paredes/loculaciones | >6 | <6 engrosamiento uniforme | Variable | Variable | Cápsula engrosada | Masa asociada |
| Componentes sólidos | Cicatriz central | En malignidad | En malignidad | En malignidad | Presentes | Presentes |
| Calcificaciones | En cicatriz central en 30% | Periférico/septal | ± en el conducto | ± en el conducto | Periférico | Periférico |
| RM | T1 hipoT2 hiper | T1 hipointensos/hiperintenso indica hemorragiaT2 hiper | T1 hipo/hiperT2 hiper | T1 hipo/hiperT2 hiper | T1 hiperT2 hiper | T1 hipoT2 hiper |
| Realce | Cicatriz central, septohipoatenuante | Variable, realce de paredes/septoEn TCC son hipoatenuantes | Paredes, nódulos sin malignidad | Paredes, nódulos sin malignidad | Heterogéneo de componentes sólidos | Paredes y nódulos |
| Comunicación con el conducto principal | No | No | Sí, dilatado ? dilatación de ramas laterales | Sí, dilatación de ramas laterales | No | No |
CAM: cistoadenoma mucinoso; CAS: cistoadenoma seroso; NMPI-CP/M: neoplasia mucinosa papilar intraductal-conducto principal/mixta; NMPI-RS: neoplasia mucinosa papilar intraductal-ramas secundarias; NSP: neoplasia sólida pseudopapilar; RM: resonancia magnética; TNE-Q: degeneración quística de tumor neuroendocrino.
El primer paso es descartar la posibilidad de pseudoquiste. Esta es la LQP más frecuente. Se presenta en personas con antecedente de pancreatitis aguda que, generalmente, es grave. Aparece a partir de la cuarta semana de evolución y suele observarse como una lesión quística única, carente de septos y circunscrita por una pared fibrosa proporcionada por tejidos vecinos al páncreas y que puede o no comunicarse con el conducto pancreático. Su contenido es líquido, poco viscoso, con niveles altos de amilasa (>250mg/dl), nulos de antígeno carcinoembrionario (ACE) y con abundantes células inflamatorias10.
Es importante tomar en cuenta que algunas neoplasias quísticas de páncreas (NQP) se presentan con episodios de dolor abdominal o pancreatitis aguda, especialmente la NMPI, en la que se ha reportado una frecuencia de entre el 13 y el 35%. En estos casos, el diagnóstico diferencial es más difícil, sin embargo, los pseudoquistes nunca producen mucina y, por tanto, los marcadores asociados a esta, como los niveles de ACE, suelen estar ausentes.
Los enfermos con pancreatitis aguda recidivante o pancreatitis crónica a veces presentan atrofia glandular y grados diversos de afección ductal, con dilatación de conducto principal y ramas secundarias que provocan pseudoquistes, generalmente asociados a periodos de exacerbación aguda, o quistes de retención, debidos a obstrucción ductal por litiasis o zonas de estenosis. Estos cambios ductales, aunque comunes en etapas avanzadas de pancreatitis crónica, pueden observarse en NMPI de conducto principal (NMPI-CP) o de ramas secundarias (NMPI-RS), cuya mucina provoca obstrucción ductal, dolor y episodios de pancreatitis que, eventualmente, ocasionan pancreatitis crónica obstructiva. De tal forma que la LQP en pacientes con cambios compatibles con pancreatitis crónica pueden deberse a quistes de retención o NPMI. Aunque en algunos de estos el diagnóstico es fácil, con frecuencia se requerirá de más información, que se obtendrá del análisis del líquido del quiste. Otras manifestaciones clínicas asociadas a LQP y cuya presencia debe documentarse debido a que influyen en el tratamiento son: ictericia, dolor abdominal, hiporexia, saciedad temprana, náuseas, vómito o pérdida de peso. La ictericia y la pancreatitis son manifestaciones comunes de las NMPI, pero también de otras NQP que por su tamaño producen compresión a tejidos adyacentes9.
Determinar cuál o cuáles lesiones quísticas deben extirparse no es tarea fácil y las características clínicas no suelen ser suficientes para tomar estas decisiones. Se han identificado características morfológicas, de imagen, citológicas y bioquímicas específicas que ayudan a determinar el riesgo de transformación maligna (características preocupantes) o la presencia de malignidad al momento de la evaluación (características de alto riesgo), cuya presencia modifica la estrategia de tratamiento. Aunque estas se describieron inicialmente en NMPI se han exportado y aplicado en el manejo y diagnóstico de otras LQP (tabla 2).
Datos preocupantes y de alto riesgo en LQP
| Datos preocupantes |
|---|
| Quiste > 3 cmPancreatitisConducto principal > 5 mmParedes engrosadas e hipercaptantesConducto pancreático principal 5-9 mmNódulo o componente sólido al interior del quiste < 5mmCambio abrupto en el calibre del conducto pancreático principal con atrofia distalAdenopatíaCa 199 sérico > 37 U/mLTasas de crecimiento del quiste > 5mm en últimos 2 años |
| Estigmas de alto riesgo |
|---|
| Ictericia obstructivaComponente solido hipercaptante > 5mm al interior del quisteDilatación del conducto pancreático >10 mm |
Son pieza fundamental en la evaluación de las LQIP. Localización, número, tamaño, comunicación con el conducto pancreático principal o con ramas secundarias u origen en ellos, presencia de septos, lóculos, nódulos o engrosamiento de la pared son características morfológicas que permiten establecer un diagnóstico de presunción que debe apoyarse con las características fisicoquímicas del líquido como viscosidad, nivel de amilasa, glucosa y ACE.
Con excepción de las características del líquido del quiste, las otras preguntas se contestan adecuadamente con métodos de imagen. Sin embargo, debido a que la mayoría de las LQIP se observan en estudios de imagen indicados por causas ajenas a enfermedades del páncreas, el rendimiento diagnóstico del estudio índice suele ser limitado.
Debido a su disponibilidad y costo, la TAC-T de múltiples cortes suele ser el primer método de estudio. Permite caracterizar adecuadamente las características del quiste utilizando métodos de reconstrucción digital capaces de detallar el sistema ductal pancreático y el interior de los quistes. Sin embargo, además de evitar la exposición a radiación, la RMN con CPRMN, preferentemente con estimulación con secretina, ofrece mejor contraste entre los tejidos blandos y permite caracterizar mejor la relación de las lesiones con el conducto pancreático principal, así como identificar septos, nódulos o engrosamiento en la pared de los quistes2. En la actualidad ambas técnicas se consideran complementarias, con ligera predilección en centros especializados por la RMN con secretina, que en nuestro medio encuentra una clara dificultad al no contar con esta última sustancia.
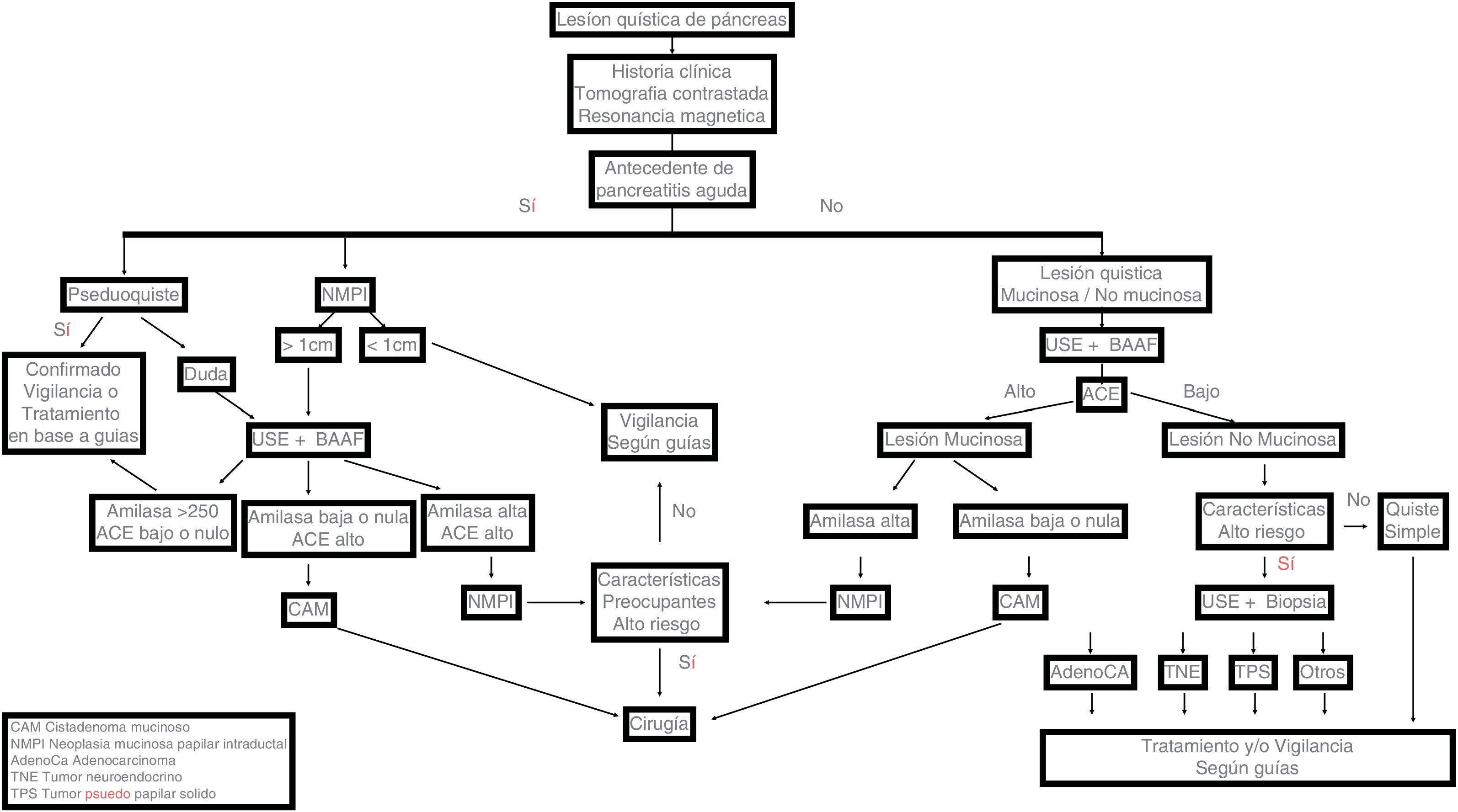
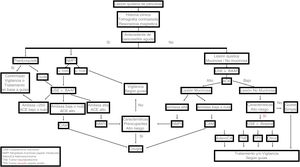
En caso de que el diagnóstico inicial se haga con base en ultrasonido abdominal o TAC convencional, se puede optar por una RMN, que complementará adecuadamente la información de las primeras. También es la técnica que se emplea para la vigilancia a largo plazo. En caso de no tener acceso a esta, el estudio inicial deberá ser una TAC-T de cortes múltiples (fig. 1).
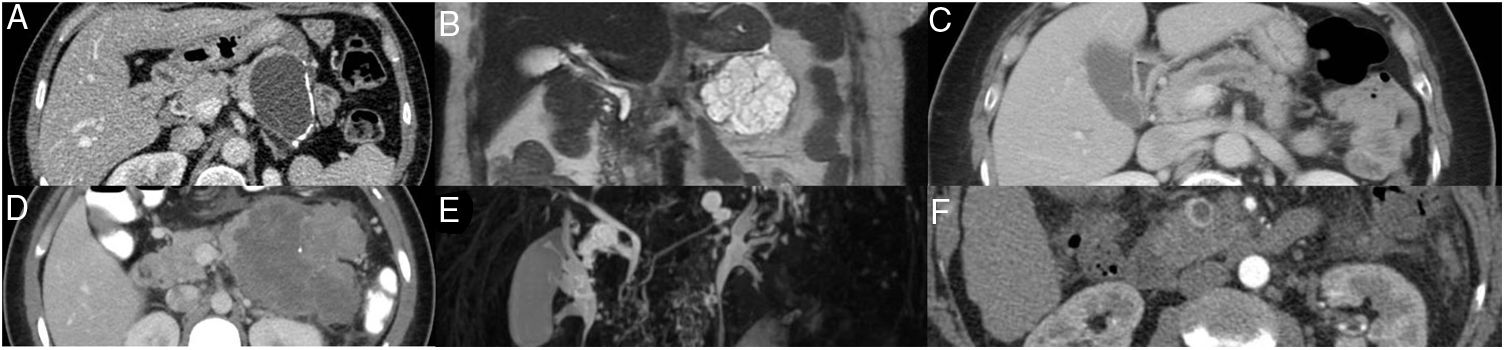
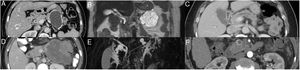
Imágenes de diferentes neoplasias quísticas de páncreas. A.CAM. Lesion quística paucilocular con calcificaciones periféricas en cola de páncreas. B. CAS. Lesión microquística multilocular en cola páncreas. C. IPMN- CP. Dilatación segmentaría del conducto pancreático principal. D. TSP. Lesión heterogénea con componentes sólido, quístico y calcificaciones séptales en cuerpo y cola de páncreas. E. IPMN - RS. Lesión quística bilobulada con comunicación al conducto pancreático principal en cuerpo-cola de páncreas. F. TNE - con degeneración quística. Lesión quística con hipercaptación de medio de contraste y pared engrasada en fase arterial en cabeza de páncreas.
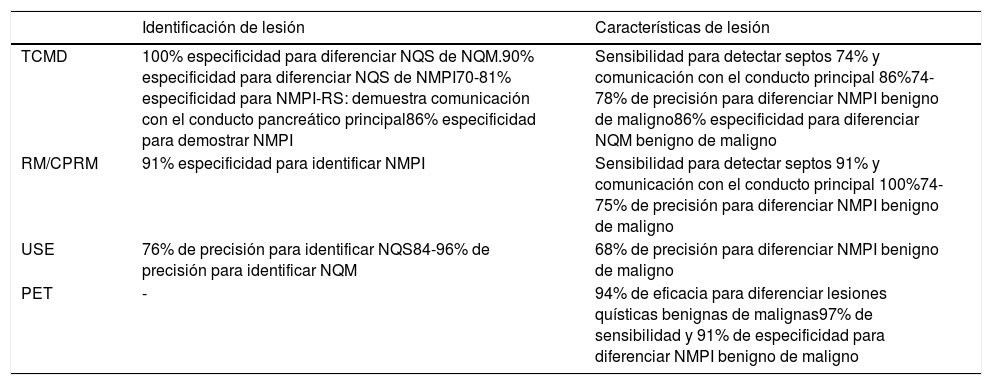
En la tabla 3 se muestran las principales características de imagen de las diferentes LQIP.
Desempeño de las modalidades de imagen para identificación y caracterización de NQP10
| Identificación de lesión | Características de lesión | |
|---|---|---|
| TCMD | 100% especificidad para diferenciar NQS de NQM.90% especificidad para diferenciar NQS de NMPI70-81% especificidad para NMPI-RS: demuestra comunicación con el conducto pancreático principal86% especificidad para demostrar NMPI | Sensibilidad para detectar septos 74% y comunicación con el conducto principal 86%74-78% de precisión para diferenciar NMPI benigno de maligno86% especificidad para diferenciar NQM benigno de maligno |
| RM/CPRM | 91% especificidad para identificar NMPI | Sensibilidad para detectar septos 91% y comunicación con el conducto principal 100%74-75% de precisión para diferenciar NMPI benigno de maligno |
| USE | 76% de precisión para identificar NQS84-96% de precisión para identificar NQM | 68% de precisión para diferenciar NMPI benigno de maligno |
| PET | - | 94% de eficacia para diferenciar lesiones quísticas benignas de malignas97% de sensibilidad y 91% de especificidad para diferenciar NMPI benigno de maligno |
NMPI-RS: neoplasia mucinosa papilar intraductal-ramas secundarias; NMPI: neoplasia mucinosa papilar intraductal; NQM: neoplasia quística mucinosa; NQS: neoplasia quística serosa; PET: del inglés positron emission tomography; RM/CPRM: resonancia magnética/colangiopancreatografía por resonancia magnética; TCMD: tomografía computarizada multidetector.
La tomografía por emisión de positrones no se usa de manera rutinaria debido a la poca disponibilidad, costo y limitaciones diagnósticas11.
La tabla 4 sintetiza el rendimiento diagnóstico de cada modalidad de imagen.
Análisis bioquímico y citológico de líquido quístico
| Parámetro | Pseudoquiste | NQS | NQM benigno | NQM maligno | NMPI |
|---|---|---|---|---|---|
| Viscosidad | Baja | Baja | Alta | Alta | Alta |
| Amilasa | Alta | Baja | Baja | Baja | Alta |
| Glucosa | Alta | Alta | Baja | Baja | Baja |
| ACE | Baja | Baja | Alta | Alta | Alta |
| CA 19-9 | Baja | Baja | Intermedia | Alta | Intermedia alta |
| Citología | Histiocitos | Células cúbicas con citoplasma rico en glucógeno | Células de epitelio mucinoso cilíndrico con atipias variables | Células de adenocarcinoma |
ACE: antígeno carcinoembrionario; NMPI: neoplasia mucinosa papilar intraductal; NQM: neoplasia quística mucinosa; NQS: neoplasia quística serosa.
El USE es una herramienta fundamental en la evaluación de las LQIP; con él se obtienen imágenes de alta resolución y mediante el uso de agujas de aspiración y biopsia se puede obtener líquido y tejido del interior y de la pared del quiste12.
El USE ha demostrado tener una eficacia diagnóstica comparable con la RMN y TAC-T tanto en la caracterización de las lesiones como en demostrar su comunicación con el conducto pancreático principal; además, es superior en la detección de lesiones multifocales, sincrónicas o metacrónicas y en identificar nódulos intramurales, que se consideran características de alarma por su alto riesgo de malignidad. En todo caso y cuando sea técnicamente posible, es necesario tomar tejido para estudio histopatológico, ya que la imagen obtenida por USE no garantiza por sí misma que la lesión sea maligna13.
Es importante recordar que la efectividad de USE depende de la experiencia y habilidad del operador, pues se han reportado bajos índices de correlación o acuerdo interobservador9. El USE con biopsias por aspiración con aguja fina (BAAF) tiene una sensibilidad del 98.6%, especificidad del 50%, certeza diagnóstica del 97.3% y precisión del 84%.
La utilidad y rendimiento diagnóstico del USE podría incrementarse si se considera el desarrollo de nuevas tecnologías como la elastografía, microscopia confocal, biopsias con pinzas a través de la aguja o el uso de contrastes. Estas tecnologías como la elastografía y contraste intravenoso ayudan a diferenciar acúmulos de moco de nódulos sólidos. Los primeros suelen observarse como estructuras de bordes bien definidos, lisos y de centro hiperecoico. En estos casos, la elastografía mostraría un tejido blando comparado con una consistencia firme del nódulo y el contraste demostraría la ausencia o presencia de flujo sanguíneo en los acúmulos de moco y nódulos sólidos, respectivamente12,14,15 (tabla 3).
Análisis de líquidoCon los datos clínicos y las características de las lesiones vistas en los métodos de imagen que se han descrito, es relativamente fácil identificar algunas lesiones, como los pseudoquistes y el cistoadenoma seroso. Resta diferenciar otras lesiones, como los quistes simples y aquellos con alto riesgo de malignidad, dentro de los cuales algunos requerirán cirugía inmediata (CAM, tumor sólido pseudopapilar, NMPI-CP), pero otros (NMPI-RS) podrán manejarse de manera conservadora. En este punto es imperativo conocer si la lesión es productora de mucina. Para averiguar esto se requiere del análisis del líquido del quiste; en específico, la medición de ACE, cuyos niveles, sin importar la cifra, indican producción de mucina. Los primeros estudios que establecieron un punto de corte >192mg/dl incluyeron solo los CAM16,17. Estudios y metaanálisis posteriores que agregaron otras neoplasias (por ejemplo, NMPI) los modificaron. En el momento actual, la utilidad de ACE es determinar la producción de mucina, pues no se ha comprobado ninguna relación entre los niveles de ACE y la presencia o ausencia de malignidad11,18.
La obtención de líquido se realiza mediante aspiración con aguja fina guiada por USE, que es un procedimiento seguro con un riesgo bajo (2-3%) de complicaciones6.
Además de ACE, se debe cuantificar el contenido de amilasa. La combinación de estos marcadores permite establecer la naturaleza mucinosa de la NQP, así como, de manera indirecta, inferir si hay comunicación con el conducto pancreático principal, lo que ayuda a diferenciar entre MCN, NMPI y otras lesiones (tabla 4).
Un nivel elevado de amilasa indica conexión de la lesión con el sistema ductal pancreático; esto es aplicable a los pseudoquistes y NMPI, pero no a las demás NQP. Un nivel de amilasa menor a 250?U/L excluye pseudoquiste pancreático, con una sensibilidad del 44% y una especificidad del 98%10.
Un punto de corte de ACE de≥192mg/dL tiene una sensibilidad del 63% y una precisión diagnóstica del 79% para diagnóstico de CAM. En NMPI, estos niveles presentan mayor variabilidad, probablemente, porque la comunicación con el conducto pancreático principal, cuya secreción es rica en agua y bicarbonato, diluye la concentración de ACE, por lo que sus niveles deben interpretarse en conjunto con datos clínicos y características de imagen17,19.
En estudios recientes se ha mostrado que niveles de glucosa intraquísticos menores de 50mg/dL se encuentran en lesiones productoras de mucina. La sensibilidad de este hallazgo es alta (95%), pero su especificidad es mediocre (57%), lo que indica que un número nada despreciable de personas reciben un diagnóstico falsamente positivo. Por tanto, debe considerarse como potencial biomarcador en investigación e interpretarse en conjunto con ACE y amilasa20-23.
La cuantificación del marcador tumoral CA 19-9 en el líquido del quiste no ofrece beneficio y, por tanto, no se recomienda. Sin embargo, su determinación en suero puede ser útil cuando se sospecha transformación maligna24.
Considerando que el análisis del líquido no permite una diferenciación óptima entre LQP mucinosas y no mucinosas, en algunos reportes se propone que la evaluación visual del líquido obtenido, en especial del «signo de la cuerda», que se define como la presencia de una cuerda o filamento de >1cm de longitud formado por el líquido del quiste que permanece íntegro por más de un segundo, es altamente específico para diagnosticar lesiones mucinosas (sensibilidad 58%, especificidad 95%, valor predictivo positivo 94% y valor predictivo negativo 60%). Sin embargo, este no reemplaza el análisis antes mencionado, pues existe una gran variabilidad en su definición, así como en la evaluación interobservador25, por lo que debe considerarse una característica complementaria que puede incrementar el rendimiento diagnóstico, especialmente cuando este es positivo26, pues se ha reportado que la precisión diagnóstica del ACE, citología y signo de la cuerda en conjunto es de alrededor del 94%, comparado con el uso de cada una de estas características de manera individual (81%, 51%, 70%, respectivamente)27.
Además del material para análisis bioquímico, se puede obtener material para estudio citológico e histopatológico de lesiones sólidas del interior del quiste, lo que proporciona datos para identificar el riesgo o presencia de transformación maligna como: displasia, carcinoma in situ o adenocarcinoma.
Un metaanálisis mostró pobre sensibilidad (54%) y buena especificidad (93%) del estudio citopatológico para diferenciar NQP mucinosa y no mucinosa: esto significa que un estudio negativo no descarta malignidad, pero uno positivo prácticamente la confirma28-30.
En ausencia de componentes sólidos, el análisis citológico del líquido es de poca utilidad, ya que generalmente son lesiones acelulares. Es importante recordar que, en LQIP menores de 1cm sin datos de alarma, la aspiración es poco útil: la mayoría tiene un comportamiento benigno y la cantidad de líquido que se obtiene es mínima. En estos casos, cuando no es posible determinar ACE en el líquido y de considerarse necesaria la obtención de tejido se puede realizar biopsia del tejido adyacente o de la pared del quiste una vez que este ha sido colapsado. Para este propósito, el uso de agujas finas de biopsia (FNB por sus siglas en inglés) y no las de aspiración, ofrece un incremento en el rendimiento diagnóstico de la evaluación de hasta el 29%, con lo que se obtiene una precisión diagnóstica para detectar lesiones malignas o premalignas del 87%31,32.
El uso de una pinza de biopsia miniaturizada (por ejemplo, microfórceps Moray; Steris Healthcare, Mento, Ohio, EE. UU. o pinzas Spybite; Boston Scientific, Marlborough, MA, EE. UU.), que se introducen a través de una aguja de aspiración de 19 G durante el procedimiento de aspiración del quiste bajo guía de USE, permite obtener fragmentos de la pared o de nódulos murales. La información en cuanto a su rendimiento diagnóstico es limitada. Su éxito técnico se ha reportado en el 86-100% y su rendimiento diagnóstico es cercano al 70%, con una sensibilidad para diferenciar lesiones mucinosas de no mucinosas del 89%33,34.
Otra técnica en estudio es la microscopia confocal. Esta consiste en introducir una fibra óptica que emite un haz de luz amplificado por la emisión estimulada de radiación o «láser» de bajo poder, que permite obtener imágenes magnificadas, microscópicas de alta resolución del recubrimiento epitelial del quiste. Comparada con el ACE, esta técnica es superior en la diferenciación de lesiones mucinosas (64 vs. 96%), así como en la identificación de displasia de alto y bajo grado, con sensibilidad del 87% y especificidad del 100%. Su uso está limitado por un costo elevado, por una gran variabilidad interobservador que disminuye su rendimiento diagnóstico hasta alrededor del 46% y porque no permite evaluar la totalidad de la pared del quiste. Se requieren más estudios pra determinar su verdadera utilidad e indicación35-37.
Análisis molecularAplicando técnicas de secuenciación de nueva generación en el líquido de los quistes, es posible identificar aquellos productores de mucina e incluso diferenciarlos en NMPI y CAM. Las mutaciones detectadas en genes KRAS o GNAS son muy sensibles y específicas para diagnosticar NMPI, pero no para CAM, mientras que mutaciones o deleciones en los genes SMAD4, CDKN2A, TP53, PIK3CA o PTEN se asocian con neoplasia avanzada. Un estudio prospectivo, que incluyó a 102 pacientes intervenidos mediante resección quirúrgica, encontró que la combinación de mutaciones de KRAS o GNAS y alteraciones en TP53, PIK3CA o PTEN tiene una sensibilidad del 89% y especificidad del 100% para detectar neoplasia pancreática avanzada. Mutaciones en el gen VHL ocurren en el 89-100% de los CAS18,30,38,39. El gen SPINK1ha surgido como un nuevo marcador tumoral, con una sensibilidad del 93% y una especificidad del 89% para diferenciar entre LQP benignas y potencialmente malignas8.
A pesar de estos prometedores hallazgos, aún se requieren estudios para integrar las pruebas moleculares a las pautas de tratamiento7.
TratamientoLos quistes simples no requieren tratamiento ni vigilancia; los pseudoquistes deben manejarse de acuerdo con sus características clínicas. El potencial de transformación maligna de los cistoadenomas serosos es extremadamente bajo, aun así, se recomienda vigilarlos e, independientemente de su tamaño, la decisión de resección quirúrgica dependerá de la presencia de síntomas40,41.
Las neoplasias mucinosas (por ejemplo, CAM y NMPI-CP o mixtos) y las no mucinosas de alto riesgo de malignidad (degeneración quística de tumor neuroendocrino de alto grado, adenocarcinoma de páncreas, tumor sólido pseudopapilar) requerirán tratamiento quirúrgico inmediato.
Las NMPI-RS y las LQP con diagnóstico incierto, pero sin malignidad evidente, se pueden tratar de acuerdo con la presencia o ausencia de características preocupantes y de alto riesgo6,18 (tabla 2).
VigilanciaLa periodicidad, técnica de imagen de seguimiento (TAC-T, RMN, USE), necesidad de repetir biopsia o aspirado dependen del tamaño, características clínicas y aspecto de la lesión.
La RMN/CPRM se considera la mejor herramienta de vigilancia. En ausencia de cambios en las características morfológicas y clínicas, se mantendrá una conducta conservadora con seguimiento periódico38.
Basados en la baja tasa de transformación maligna de los quistes pancreáticos incidentales asintomáticos (0.12% anual), algunas guías13 recomiendan una estrategia de vigilancia de «baja intensidad» e incluso indican limitar la duración de vigilancia a 5 años, en los casos en los que no se detectaron cambios. No existe información que apoye esta conducta e incluso se ha reportado el desarrollo de neoplasia maligna después de 5 años de seguimiento en quistes que habían permanecido «estables» en el 1-18% de los casos42-44.
La decisión sobre continuar o suspender el seguimiento debe individualizarse y tomarse en conjunto con el paciente. Posiblemente la vigilancia podrá suspenderse en aquellas personas no candidatas a tratamiento quirúrgico, ya sea por la presencia de comorbilidades, edad avanzada o por negativa del paciente, una vez se hayan discutido y aclarado las consecuencias de dicha conducta.
La justificación para realizar USE/BAAF durante el seguimiento es la aparición de características clínicas y radiológicas preocupantes o de alto riesgo, que modificarán la conducta terapéutica6,13.
En el momento actual, consideramos que la estrategia de vigilancia propuesta en las guías de Fukuoka para NMPI y la Unión Europea para todas las LQP son las más adecuadas6,7,38.
Tratamiento quirúrgicoLa presencia de características preocupantes o de alto riesgo, la citología sugestiva o positiva de malignidad, la dilatación del conducto pancreático principal >1cm (sin datos de obstrucción secundaria o pancreatitis crónica) o la alta sospecha de NMPI-CP o MNPI-mixto son indicaciones de resección quirúrgica.
El procedimiento quirúrgico preferentemente deberá ser ejecutado por cirujanos experimentados, en centros de referencia y ofrecida a pacientes en buenas condiciones generales24,45.
Aunque las indicaciones quirúrgicas suelen coincidir entre las diferentes guías publicadas, existen discretas variaciones, pues cada una de estas guías fue desarrollada para escenarios específicos. Las guías de la Asociación Americana de Gastroenterología proponen el manejo de LQP asintomáticas e incidentales, las de Fukuoka (de las que se extraen las características de riesgo y preocupantes de las LQP) se ocupan únicamente del manejo de NMPI y CAM, mientras que las de la Unión Europea incluyen la mayoría de LQP y escenarios clínicos6,13,38,46 (tabla 5).
Indicaciones quirúrgicas para NMPI según las guías actuales disponibles
| Guía | Indicación absoluta | Indicación relativa |
|---|---|---|
| IAP/Fukuoka, 2017, Tanaka et al.16 | IctericiaRealce de nódulo mural ≥ 5 mmConducto pancreático dilatado >10 mmCitología sospechosa o positiva para malignidad | Tamaño del quiste ≥ 3 cmAumento de tamaño ≥ 5 mm/2 añosRealce de nódulo mural < 5 mmAumento de CA 19-9 séricoConducto pancreático 5-10 mmPancreatitis aguda asociada a NMPIPared del quiste engrosada y con realceEstenosis del conducto pancreático con atrofia distalLinfadenopatía |
| Guía europea, 20186 | IctericiaQuistes sólidos con realce al contraste ≥5 mmConducto pancreático ≥10 mmCitología positivaTumor solido | Tamaño del quiste ≥ 4 cmAumento de tamaño ≥ 5 mm/añoQuistes sólidos con realce al contraste ≤ 5 mmAumento de CA 19-9 séricoConducto pancreático 5-10 mmPancreatitis aguda asociada a NMPIDiabetes de nueva aparición |
| Guía americana AGA, 2015, Vege et al.13 | Quistes sólidos y conducto pancreático >5mm detectables en RM y USEMalignidad en citología de quistes |
NMPI: neoplasia mucinosa papilar intraductal; RM: resonancia magnética; USE: ultrasonografía endoscópica.
En casos con contraindicación quirúrgica o en aquellos que la rechazan, se han explorado tratamientos menos invasivos, como la inyección de alcohol o quimioterapia al interior de los quistes y ablación por radiofrecuencia; sin embargo, en la actualidad no representan una opción viable, pues se consideran aún terapias experimentales. En la figura 2, se muestra una ruta crítica de diagnóstico de LQP.
ConclusiónLa incidencia de LQIP aumenta con la edad. El diagnóstico diferencial es extenso y representa un reto. Una estrategia estructurada enfocada en diferenciar lesiones de bajo y alto riesgo de malignidad, así como en distinguir aquellas que pueden incluirse en un programa de vigilancia o que requieren cirugía inmediata, facilita y beneficia a todos los involucrados en la atención de estos enfermos. Preferentemente, las LQP deben ser tratadas por un equipo multidisciplinario con experiencia en su manejo.
Responsabilidades éticasLa revisión bibliográfica cumple con toda la normativa vigente de buenas prácticas en investigación. Por su naturaleza, no se utilizaron expedientes clínicos ni datos de pacientes que puedan ser identificados, por lo que no se requirió de consentimiento informado y no requirió de revisión o saprobación por el comité de ética e investigación institucional.
FinanciaciónLos autores no recibieron financiamiento de ningún tipo.
Autoría/colaboracionesLas Dras. Lira-Treviño y Carranza Mendoza participaron por igual en la elaboración, diseño, revisión del manuscrito y comparten la autoría principal y cada una de ellas deberá considerarse primera autora del mismo.
Conflicto de interesesNinguno de los autores tiene conflictos de interés que reportar.