¿ Introducción
El trasplante hepático se ha convertido en un procedimiento estándar que logra una buena tasa de supervivencia de uno a cinco años para los pacientes con enfermedad hepática en fase terminal.1 Sin embargo, a pesar de las mejoras en la inmunosupresión, el rechazo se produce en 30% de los pacientes con trasplante hepático y puede causar una morbilidad significativa. La causa más frecuente de muerte después del trasplante hepático es la infección severa.2 La determinación de la expresión de citocinas puede conducir a la detección temprana de pacientes con riesgo de rechazo agudo e infección.3-5
El objetivo de este estudio fue evaluar la expresión de citocinas proinflamatorias tales como IL-1β (IL-1β), interleucina-6 (IL-6) y factor de necrosis tumoral-alfa (FNT-α); citocinas pro-fibrogénicas tales como el factor de crecimiento transformante-beta (FCT-β) y factor estimulante de colonias granulocitos macrófagos (FEC-GM); e interleucina-8 (IL-8) en células mononucleares (MN) de sangre periférica en los pacientes que recibieron trasplante hepático ortotópico (THO) a corto plazo (un mes).
¿ Métodos
Se evaluaron 14 pacientes que recibieron THO debido a cirrosis hepática, antes y después del trasplante (24, 48, 72 horas, siete, 15 y 30 días) de enero de 2005 a diciembre de 2007 en el Hospital Universitario Dr. José E. González, Monterrey, N.L.
La etiología de la cirrosis en los pacientes fue alcohólica (n = 4), infección por virus de hepatitis C (VHC) (n = 4), criptogénica (n = 3), esteatohepatitis no alcohólica (n = 1), hepatitis autoinmune (n = 1) y VHC mas carcinoma hepatocelular (n = 1). Los pacientes fueron incluidos en el postoperatorio inmediato y hasta 30 días de seguimiento en este estudio. Posteriormente, cada paciente tuvo el seguimiento habitual por el equipo de trasplantes con estudios y consulta médica cada mes durante el primer año y posteriormente cada dos o tres meses según aplicara.
Las células MN fueron aisladas por el método del gradiente de concentración con polymorphprep (Axis-Shield PoC AS, Oslo, Norway) a partir de sangre total con EDTA. La extracción de ácido ribonucleico mensajero (ARNm) se realizó con el método TRIzol de acuerdo a las instrucciones del fabricante (Gibco BRL, Burlington, Ontario, Canadá). Posteriormente se realizó la retro-transcripción-RCP utilizando cebadores oligoespecíficos para IL-1b, IL-6, IL-8, FNT-α, FCT-β y FEC-GM (Kit Molecular System Roche, San Francisco, California, US). Las infecciones en los receptores de THO se diagnosticaron por hemocultivo, urocultivo o placa de tórax de acuerdo a los hallazgos clínicos. El tratamiento de las infecciones fue establecido de acuerdo a la infección bacteriana. La terapia de inmunosupresión más frecuentemente utilizada en los receptores del THO fue ciclosporina, tacrolimus, prednisona y en ocasiones anticuerpos mono o policlonales. Durante el periodo intraoperatorio se administró 1 g de metilprednisolonona por vía intravenosa. La inmunosupresión postrasplante fue con ciclosporina, prednisona y micofenolato en dos pacientes y tacrolimus, prednisona y micofenolato en 12 pacientes. Las dosis de ciclosporina y tacrolimus fueron ajustadas de acuerdo a niveles séricos y a la ventana terapéutica. La administración de los inhibidores de calcineurina se administró en dos dosis diarias iguales, de acuerdo a parámetros internacionales. La prednisona se administró a dosis de 20 mg diario. Se descartó el rechazo agudo por la ausencia de manifestaciones clínicas (ictericia, fiebre o malestar general) así como, por la alteración de parámetros bioquímicos (aspartato amino transferasa, alanino amino transferasa, fosfatasa alcalina, gamma glutamil transpeptidasa, bilirrubina). En los pacientes con indicación precisa se realizó biopsia hepática postrasplante, confirmando la ausencia de rechazo agudo. El protocolo del estudio fue consentido de acuerdo con las guías éticas de la Declaración de Helsinki.
¿ Resultados
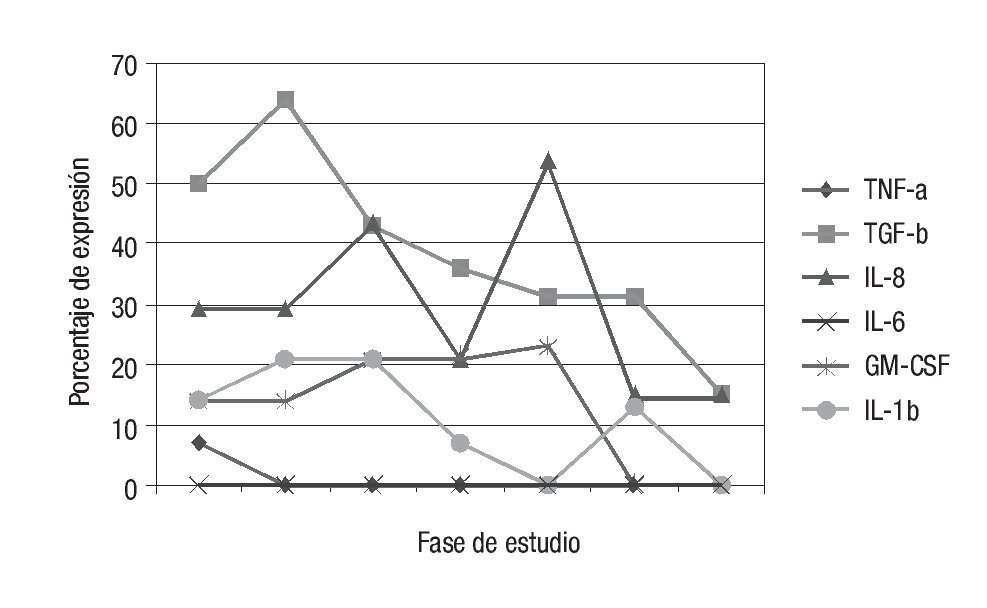
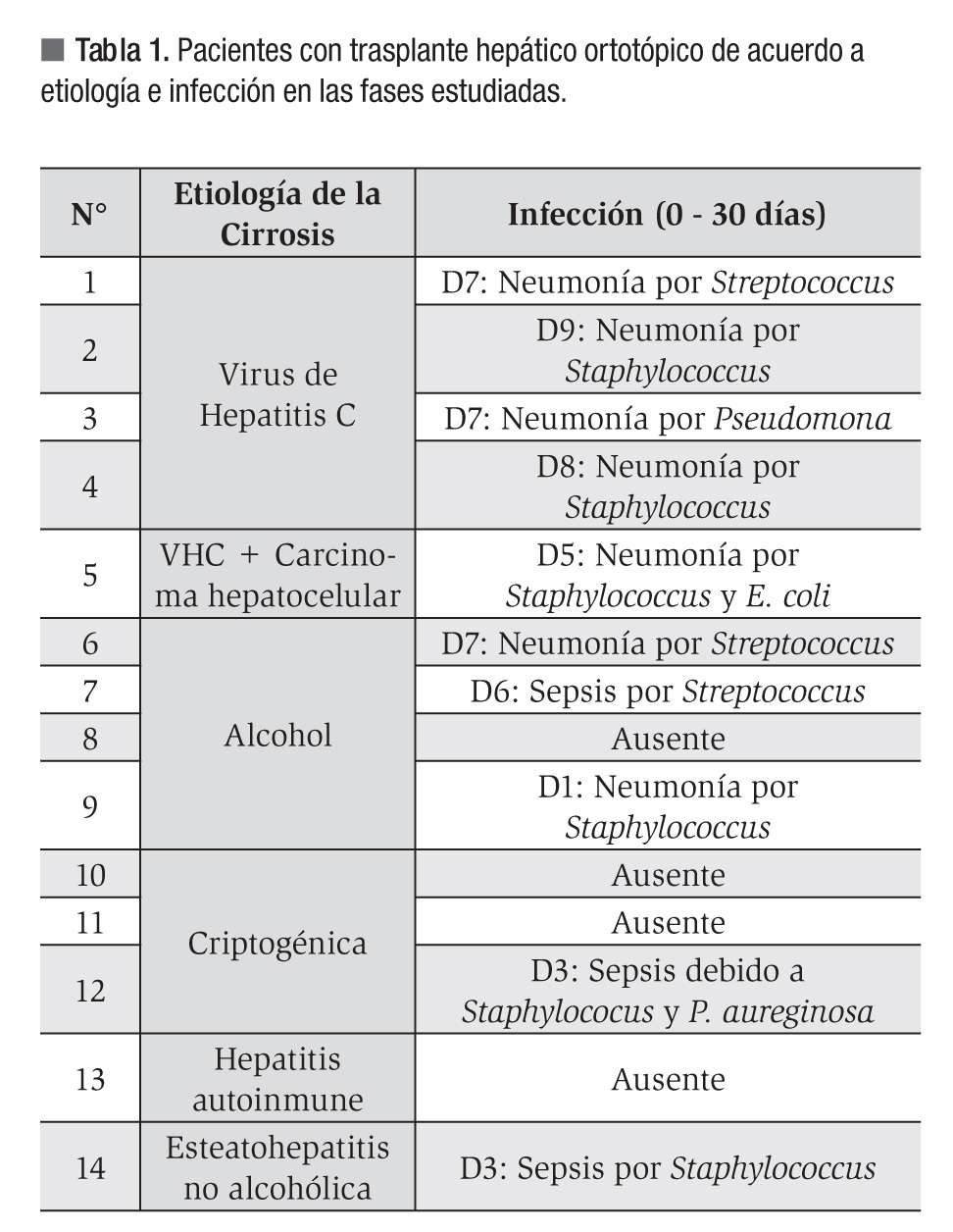
El porcentaje de expresión del ARNm de las citocinas IL-1β, IL-6, FNT-α, FCT-β, FEC-GM, IL-8 en las células MN de los pacientes trasplantados antes y durante los primeros 30 días se muestra en la Figura 1. La expresión del ARNm de IL-1β fue mayor de las 24 horas a las 48 horas (21%), el FCT-β fue mayormente expresado a los siete días (64%), el FEC-GM se expresó hasta 23% en el día siete, la IL-8 mostró mayor expresión (54%) al día siete y la citocinas IL-6 así como el FNT-α no mostraron expresión en los tiempos posteriores al trasplante. En el grupo estudiado ningún paciente presentó rechazo agudo y 11 de ellos presentaron infección bacteriana durante los 19 días post-THO (Tabla 1). Las infecciones más frecuentes en estos pacientes fueron neumonía y sepsis. Un paciente falleció a los siete días debido a falla primaria del injerto.
¿ Figura 1. Porcentaje de expresión cualitativo del ARNm de las citocinas antes y después del trasplante hepático ortotópico. La expresión del ARNm del gen de GAPDH fue utilizado para normalizar la expresión del ARNm.
¿ Discusión
Es conocido que las citocinas tienen un rol importante en las respuesta inmune y el proceso de inflamación en el trasplante hepático, el balance de las citocinas pro-inflamatorias o Th1 (IL-1β, FNT-α, IL-6) vs. citocinas anti-inflamatorias o Th-2 (IL-8) y Th3 (FCT-β) durante el periodo inicial post trasplante parece ser decisivo para la subsecuente aceptación del aloinjerto hepático.5
Estudios recientes, han determinado que la expresión génica de moléculas citolíticas, así como de transcriptos de citocinas en linfocitos de sangre periférica de pacientes con trasplante correlaciona con la expresión de ARNm intrainjerto en el rechazo al aloinjerto.6-8 Estudios previos en pacientes con trasplante hepático han mostrado una mayor expresión de citocinas Th1 y una expresión reducida de Th2 así como de FCT-β lo cual se ha asociado al desarrollo de rechazo agudo.3,5 En nuestro estudio las citocinas IL-6 y FNT-α no mostraron expresión en alguna de las fases estudiadas, la IL-1β solo mostró expresión en la primera fase post-trasplante y el FCT-β fue la citocina que más se expresó en todas las fases monitorizadas, lo cual pudiera estar relacionado con la ausencia de rechazo agudo en esta población de pacientes.
Por otro lado, no se encontró asociación entre la expresión de las diversas citocinas y la presencia o ausencia de infección bacteriana en los pacientes evaluados durante las diversas etapas del estudio. El FEC-GM es un factor de crecimiento que regula la producción neutrofílica de granulocitos. Este proceso fisiológico es base fundamental para los sistemas de defensa del huésped.9 El FEC-GM puede ser sintetizado por varios tipos de células en respuesta a determinadas señales de activación, dentro de los cuales los monocitos/ macrófagos son de las líneas celulares más importantes. Esta citocina tiene un papel fisiológico importante en la defensa del huésped.10 El FEC-GM se expresó hasta 60% en las pacientes que presentaron infección bacteriana sugiriendo su participación en la lucha contra el proceso infeccioso. El FCT-b es miembro de una familia de citocinas que regulan la diferenciación y reparación de tejido, tiene efecto pro-fibrogénico y efecto anti-inflamatorio e inmunosupresor.11,12 Es producida por una amplia variedad de células como monocitos y linfocitos, la expresión del ARNm de FCT-β es un buen indicador de la síntesis protéica hepática.4,13
En este estudio fue la citocina más frecuentemente expresada, lo cual podría estar relacionado con la regeneración del hígado; sin embargo, no mostró un patrón particular de acuerdo a la etiología o la presencia de infección.
Nuestro estudio tiene algunas limitaciones relacionadas a su diseño. Se trata de una serie de casos con una muestra pequeña y heterogénea debido a la diversa etiología de la cirrosis. En nuestro estudio no incluimos ningún grupo control (por ejemplo, pacientes sometidos a trasplante con rechazo al injerto). Sin embargo, se trata de una serie de casos con seguimiento estrecho, cuyos exámenes fueron realizados en forma homogénea, lo que aporta información valiosa por primera vez en nuestro país.
El papel de las citocinas en el post-trasplante inmediato en este estudio no mostró un perfil de expresión de acuerdo a la etiología del trasplante, por lo que se requiere futuras investigaciones para establecer el papel de estos mediadores, además de incrementar el tamaño de la muestra y de realizar la cuantificación sérica y del ARNm intrainjerto de las proteínas expresadas.
¿ Conclusión
La expresión de citocinas en los pacientes evaluados no mostró un patrón definido de acuerdo a etiología. Un incremento en el tamaño de la muestra es importante para establecer la implicación de las diversas citocinas en el trasplante hepático.
Correspondencia: Linda E. Muñoz Espinosa, M.D. Ph. D.
Ave. Gonzalitos No.235 Col. Mitras Centro C.P. 64460. Monterrey, Nuevo León, México.
Correo electrónico: linda_uanl@hotmail.com
Recibido el 5 de enero de 2011;
aceptado el 24 de marzo de 2011.