¿ Introducción
La cirrosis hepática (CH) representa el estadio final de la enfermedad hepática crónica y se ha convertido en una de las causas no malignas de muerte en sujetos en el hemisferio occidental. Anualmente se presentan 150 a 250 cirróticos por millón de habitantes y la mortalidad por esta causa es de cinco a 30 casos por 100 000 habitantes.1 En los Estados Unidos, la CH ocupa el noveno lugar como causa de muerte con cerca de 35 mil decesos cada año.2 Las autoridades sanitarias de México señalan a la cirrosis como la sexta causa nacional de mortalidad y la tercera para los hombres de 15 y 64 años de edad.3 Por su parte, Cuba ha informado que la cirrosis es la décima causa de muerte.4 La CH ocasiona un deterioro irreversible de la función hepática, lo que resulta en graves complicaciones en los estadios avanzados. La progresión de la cirrosis no sólo se relaciona con la etiología del daño hepático, sino con la respuesta individual del enfermo y las agresiones a las que se exponen.5
El estado nutricional puede afectar la evolución de la CH y la respuesta al tratamiento. La frecuencia de desnutrición energético-nutrimental (DEN) en cirróticos puede ser elevada.6,7 El estado nutricional del paciente cirrótico puede empeorar a medida que progresa la enfermedad hepática.7 En años recientes ha recibido particular atención la presencia de trastornos de la mineralización ósea en pacientes cirróticos.8 La osteoporosis, junto con otras anomalías del metabolismo mineral, se engloba dentro de la llamada osteodistrofia hepática que constituye la osteopatía más frecuente en la CH y se convierte en un factor de riesgo de desarrollo de fracturas óseas atraumáticas en este grupo de enfermos.9 La preexistencia de osteoporosis en el momento del transplante se ha transformado en el factor de riesgo más importante de ocurrencia de fracturas y se ha estimado que 20% de tales pacientes padecerá fracturas dentro del primer año siguiente al injerto.10-12 La frecuencia de osteoporosis en pacientes cirróticos se estima entre 11% a 53%13 y estudios controlados indican que dicha prevalencia llega a ser el doble de lo observado en la población control.14 Se ha descrito afectación de la densidad mineral ósea en la hepatopatía colestásica,15 la hemocromatosis16 y la hepatitis autoinmune,17 asociada al abuso de alcohol18 y tras el trasplante hepático.11,12,19
El estado nutricional puede influir en la aparición de enfermedad ósea. La obesidad puede ser protectora de la masa ósea, mientras que el bajo peso (índice de masa corporal [IMC] <19 kg/m2) predispone a la disminución del hueso cortical.20-22
Entonces sabemos que entre los pacientes cirróticos existe una prevalencia variable de enfermedad metabólica ósea (EMO) asociada a complicaciones y a un alto costo socioeconómico; que la salud ósea de un individuo cualquiera resulta del delicado y complejo equilibrio entre factores genéticos, hormonales y ambientales; que la alimentación constituye la principal influencia ambiental a la que está expuesto el cirrótico en riesgo de EMO; y que la identificación de cirróticos con EMO ameritaría la intervención individualizada higiénicodietético-nutrimental. Teniendo en cuenta que en nuestro medio no existen investigaciones sobre la EMO como problema de salud en los cirróticos, decidimos examinar la hipótesis de que la EMO estaría fuertemente asociada con el estado nutricional del cirrótico y que la frecuencia de EMO sería elevada entre los cirróticos desnutridos. El objetivo de este trabajo es establecer la asociación entre el estado nutricional, la EMO y la cirrosis hepática en enfermos atendidos en un hospital de tercer nivel de la ciudad de La Habana.
¿ Métodos
Se realizó un estudio analítico y transversal, para explorar la asociación entre las formas de la EMO y el estado nutricional en pacientes diagnosticados de CH que fueron atendidos en la Consulta especializada del Servicio de Gastroenterología del Hospital Clínico Quirúrgico Hermanos Ameijeiras de La Habana, Cuba. Fueron elegibles para participar en el estudio los pacientes con edades entre 19 a 65 años, diagnosticados de CH después completar los procedimientos contemplados en los protocolos establecidos por el Servicio hospitalario de Gastroenterología, entre noviembre de 2007 y noviembre de 2008. Los pacientes fueron informados por escrito sobre los objetivos del trabajo y firmaron el acta de consentimiento para participar en el mismo, conforme a los criterios éticos establecidos en la Convención de Helsinki sobre los Derechos Humanos.
Se incluyeron pacientes cirróticos sin importar el género, con función renal conservada, que no consumieran vitamina D o sales de calcio, o recibieran tratamiento con terapia estrogénica sustitutiva, antiandrógenos o corticoides. También se incluyeron mujeres posmenopáusicas con CH de menos de cinco años de evolución.
Se excluyeron aquellos pacientes con enfermedades causantes de osteoporosis: hiperparatiroidismo, hipertiroidismo, hipotiroidismo, diabetes mellitus, síndromes de malabsorción intestinal, enfermedades del colágeno, enfermedad de Cushing o mieloma múltiple. También se excluyeron mujeres posmenopáusicas con CH de más de cinco años de evolución, enfermos cirróticos tratados con glucocorticoides o antiandrógenos, quienes recibían suplementos con vitamina D o calcio y aquellos con historia de fracturas.
De cada paciente se registró la edad, el género y el color de la piel (blanca, negra o mestiza). Se establecieron dos grupos con base en la edad: menores o igual de 50 años y mayores de 50 años.
El diagnóstico de CH se estableció por la conjunción de manifestaciones clínicas, bioquímicas y de imagen de la enfermedad (la visión directa del hígado mediante laparoscopia), así como el examen histológico de la biopsia hepática. La etiología de la cirrosis se estableció como viral (de acuerdo con la detección de anticuerpos contra los virus B y C de la hepatitis), alcohólica (si se detectaba consumo regular de alcohol en cantidades consideradas perjudiciales para el estado de salud del enfermo23 y otras causas.
Para fines de este estudio se estableció el tiempo de diagnóstico de la CH como los años transcurridos desde el momento de establecido el diagnóstico de CH hasta la inclusión en el estudio y se estratificó en tres grupos: menos de un año, entre uno a cinco años y más de cinco años.
La progresión de la CH se determinó según la clasificación de Child-Pugh-Turcotte.24 El estadio corriente de la enfermedad se estableció como Child A (cinco a seis puntos, estadio temprano, daño mínimo), Child B (siete a nueve puntos, estadios intermedio, daño moderado), y Child C (10 a 15 puntos, estadio final, daño avanzado).
La evaluación subjetiva global del estado nutricional del paciente se realizó en el momento de la captación del paciente, en base al procedimiento elaborado por el Grupo de Apoyo Nutricional (GAN) hospitalario.25 El paciente se asignó a cualquiera de las tres categorías nutricionales posibles según el resultado de la evaluación subjetiva global: A, no desnutrido; B, moderadamente desnutrido o en riesgo de estarlo; y C, gravemente desnutrido.
La evaluación nutricional antropométrica se realizó según los procedimientos establecidos por el GAN hospitalario.26 De cada paciente se obtuvieron la talla (en cm) y el peso (en kg) y se calculó el IMC.
Se realizó densitometría ósea en todos los pacientes. La densidad mineral ósea (DMO) de la columna lumbar y el cuello de la cabeza del fémur izquierdo se midió con un densitómetro de rayos X de doble haz (LEXXOS LX 277). Los valores de DMO se convirtieron en puntajes "t" (esto es, unidades de desviación estándar) mediante el sistema incorporado de tratamiento de imágenes y procesamiento estadístico (LEXXOS versión V6.04). Las formas de la EMO se establecieron según los criterios dados por la Organización Mundial de la Salud (OMS): puntaje "t" normal mayor -1.0 s; ostepenia entre -1.0 y -2.29 s; osteoporosis igual o menor de -2.5 s.27,28 La frecuencia estimada de la EMO asociada a la CH se comparó con la obtenida previamente en sujetos aparentemente sanos.29
Análisis estadístico. Los datos de los pacientes se anotaron en formularios creados ad hoc y se almacenaron en una base de datos (Exel 7.0 de Office para Windows®, Microsoft, EUA). Se empleó el paquete estadístico SPSS-PC versión 11.5. (Statistical, EUA) para el procesamiento estadístico-matemático de los resultados. Los datos reunidos se redujeron mediante estadígrafos descriptivos de locación (media), dispersión (desviación estándar) y agregación (frecuencias y porcentajes), según el tipo de la variable. La asociación entre la EMO con las variables sociodemográficas, clínicas y nutricionales del estudio se verificó mediante la prueba de hipótesis de homogeneidad/independencia con el auxilio de pruebas estadísticas basados en la distribución de Ji cuadrada. En todas las instancias, se asumió un nivel de significancia de 5% (α = 0.05) como indicativo de asociación.30
¿ Resultados
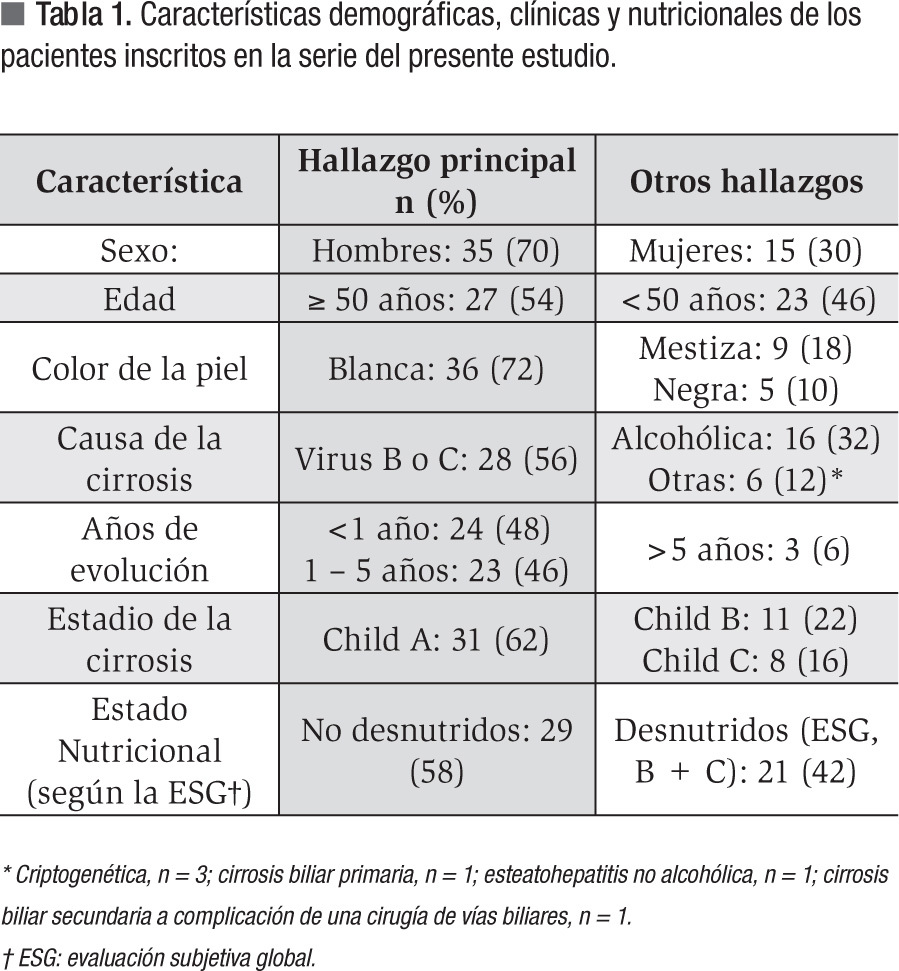
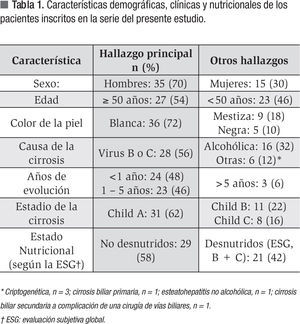
Se incluyeron 50 pacientes en el estudio y sus características demográficas y clínicas se muestran en la Tabla 1. Se incluyó una mayor proporción de hombres, la mayoría de los sujetos fueron de piel blanca y los mayores de 50 años representaron 54% de la muestra. La causa de la CH fue viral (VHB/VHC) en 56% de los casos en contraste con sólo 12% de los casos con causa no viral ni alcohólica: cirrosis biliar primaria (n = 1), esteato-hepatitis no alcohólica (n = 1), cirrosis biliar como complicación de una cirugía de vías biliares (n = 1) y criptogénica (n = 3). De los pacientes 94% tenía cinco años o menos de establecido el diagnóstico de CH en el momento de la inclusión en el estudio. De los enfermos 62% se encontraba en los estadios iniciales de la CH, mientras que sólo 16% de los cirróticos se encontraba en el último estadio de progresión de la enfermedad. De los cirróticos 42% estaba desnutrido en el momento de la inclusión en este estudio.
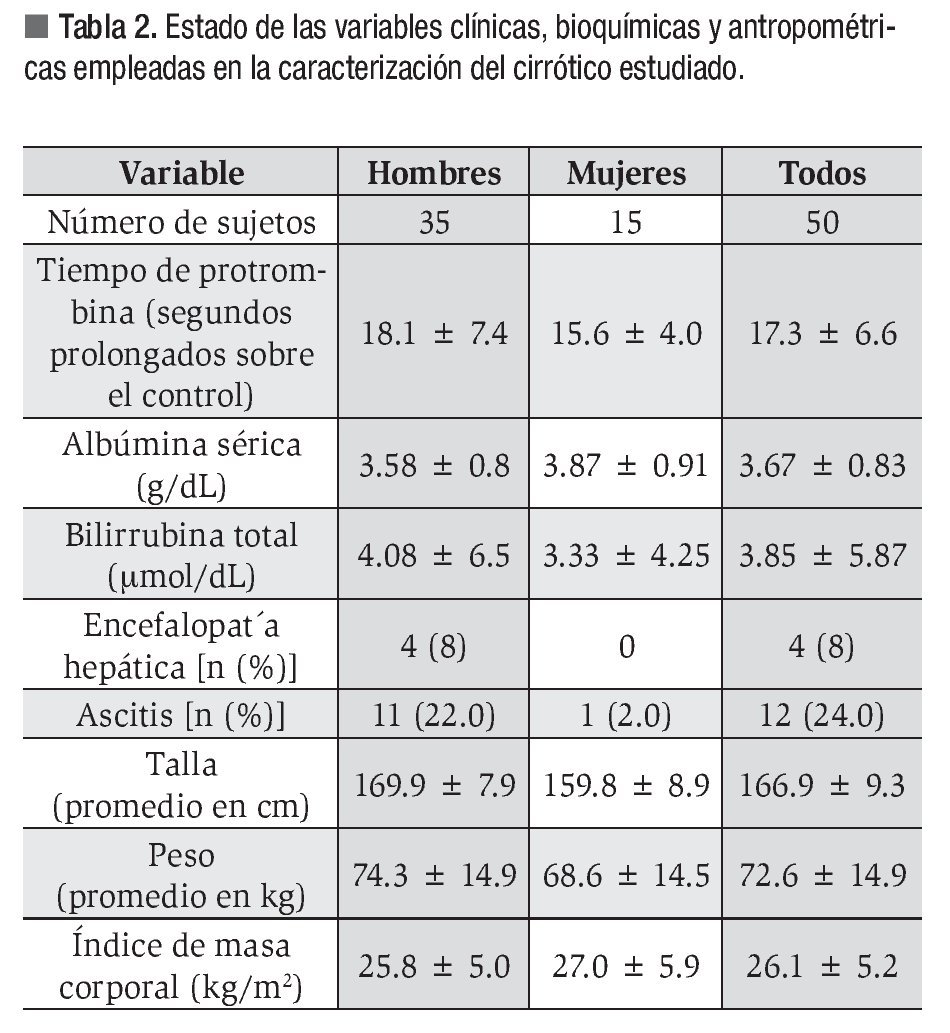
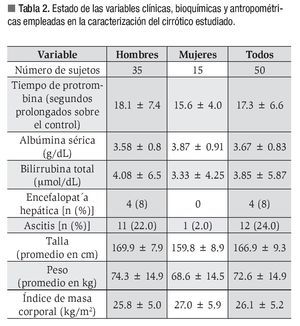
Las variables clínicas, antropométricas y bioquímicas empleadas en la caracterización del enfermo cirrótico se muestran en la Tabla 2. Cabe destacar que los hombres concentraron los casos de ascitis y encefalopatía hepática.
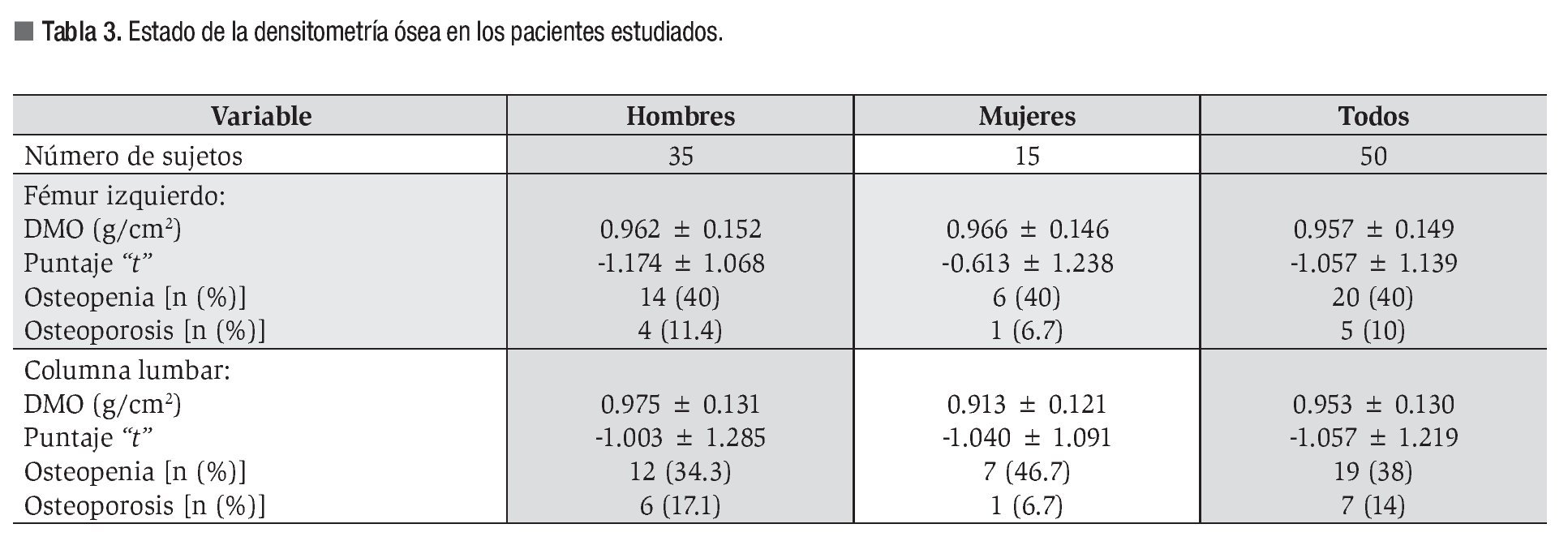
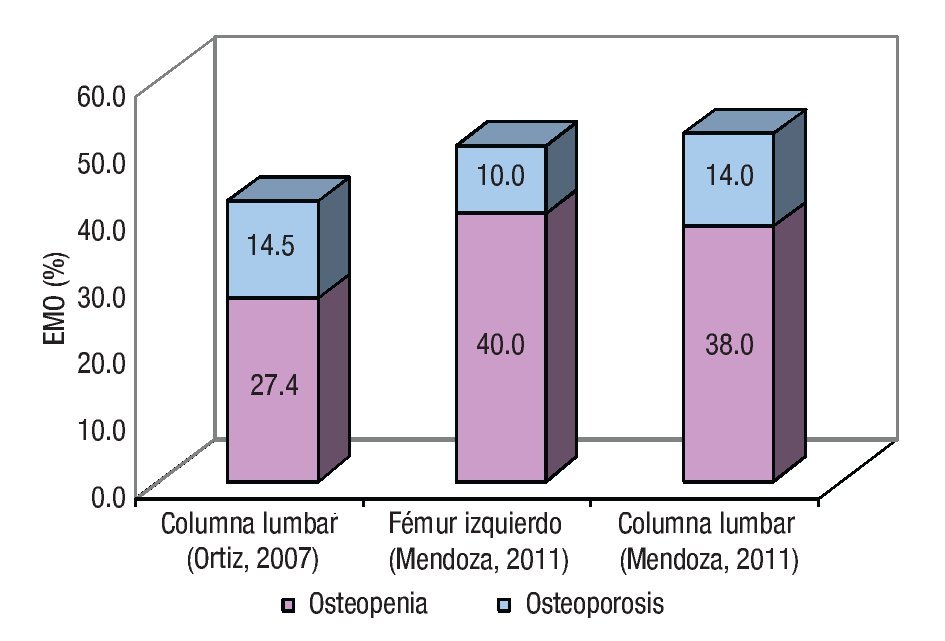
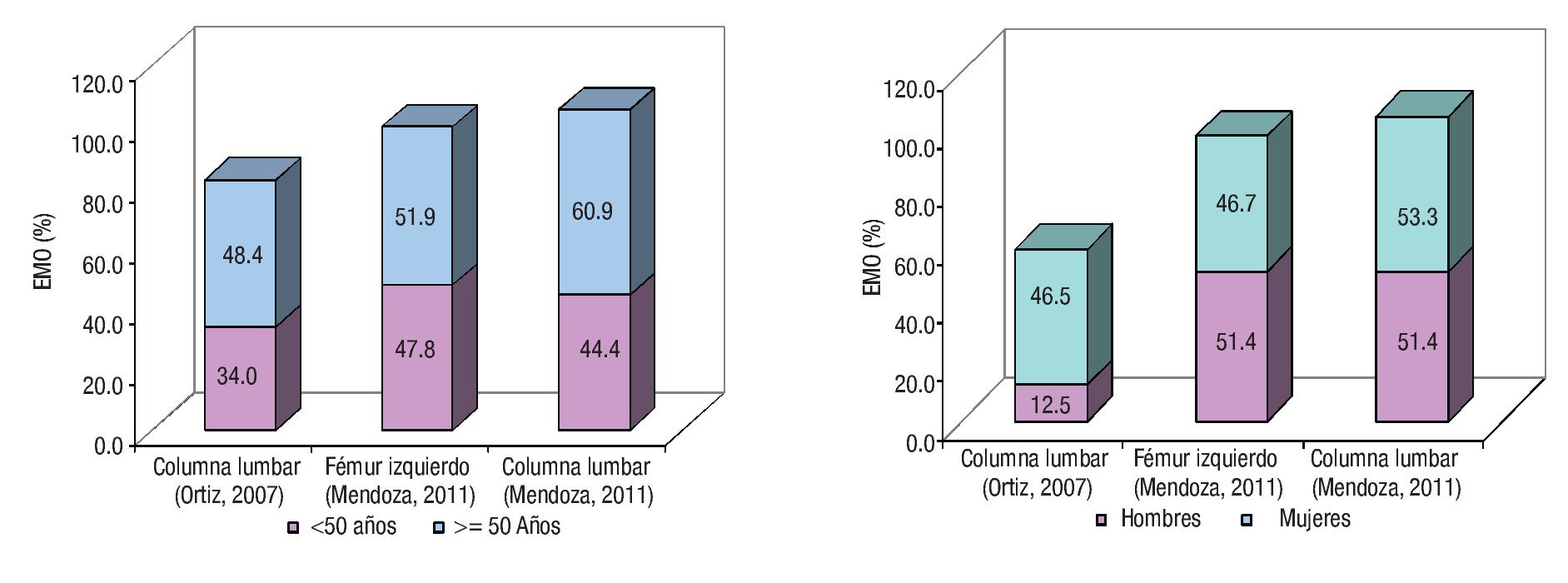
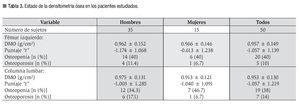
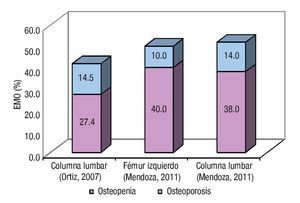
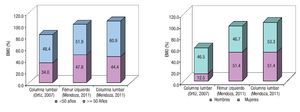
La EMO afectó a 74% de los cirróticos estudiados y la osteopenia fue la forma más prevalente al presentarse en 58% de los casos. El estado de la DMO en los pacientes cirróticos estudiados se muestra en la Tabla 3. La DMO del cuello de la cabeza del fémur izquierdo fue de 0.957 ± 0.149 g/ cm2. El puntaje "t" promedio fue de -1.057 ± 1.139 s, valor incluido dentro del rango de osteopenia. De los pacientes cirróticos 40% mostró valores de la DMO compatibles con el diagnóstico de osteopenia. Por su parte, la DMO de la columna lumbar fue de 0.953 ± 0.130 g/cm2, para un puntaje "t" promedio de -1.057 ± 1.219 s y una frecuencia de osteopenia de 38%. Las diferencias numéricas observadas entre los valores de DMO en los territorios examinados respecto al género de los pacientes no alcanzaron significación estadística. Catorce de los pacientes (28%) mostraron puntajes "t" menores de -1.0 s para el valor de DMO de ambos sitios anatómicos examinados. La Figura 1 muestra los estimados de EMO obtenidos en sujetos aparentemente sanos y cirróticos mediante DEXA de los sitios anatómicos examinados. La presencia de CH no resultó en una tasa aumentada de EMO, independientemente del sitio anatómico examinado. La Figura 2 muestra los estimados de EMO desagregados según el sexo y la edad del sujeto. La edad no influyó en la frecuencia de la EMO asociada a la CH, comparada con la tasa observada en los sujetos aparentemente sanos después de DEXA de la columna lumbar. Por el contrario, la presencia de CH incrementó en cuatro veces la frecuencia de EMO en el hombre cirrótico, cuando se comparó con sus congéneres no-cirróticos. La frecuencia de EMO en la mujer fue similar tanto para cirróticas como no-cirróticas.
¿Figura 1. Estado de la enfermedad metabólica ósea. Se muestran los estimados de frecuencia de EMO según el sitio anatómico, obtenidos en sendos estudios hechos en sujetos aparentemente sanos (Ortiz, 2007) y cirróticos (Mendoza, 2011), respectivamente.
¿ Figura 2.Influencia del sexo y la edad del paciente sobre el estado de la Enfermedad Metabólica Ósea. Se muestran los estimados de frecuencia de la Enfermedad Metabólica Ósea observados en sendos estudios hechos en sujetos aparentemente sanos (Ortiz, 2007) y cirróticos (Mendoza, 2011), respectivamente, después de segregados según el punto especificado de corte.
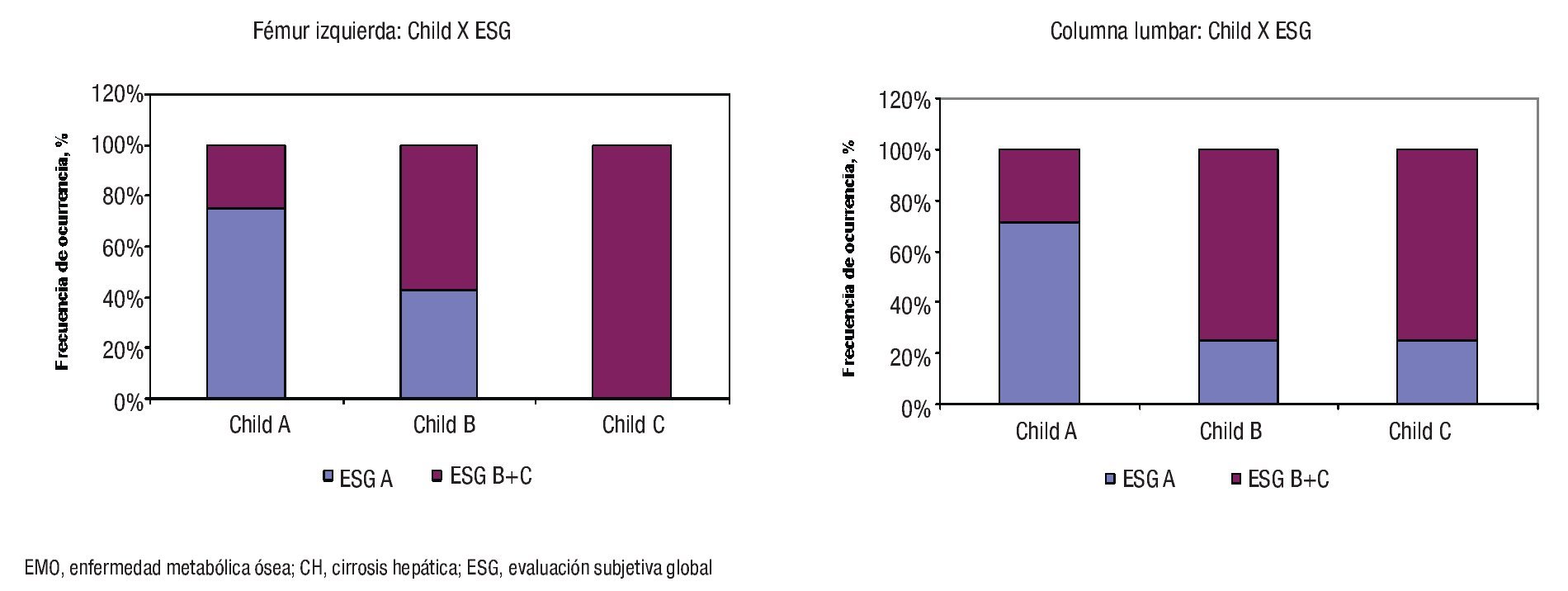
La asociación entre la EMO y la CH fue diferente según el sitio anatómico examinado. Cuando se estimó de la DMO del cuello de la cabeza del fémur izquierdo, la EMO fue sólo dependiente de la causa de la CH ya que se observó en 32.1% de las CH por causas virales, en 68.7% de CH alcohólica y en 83.3% de CH por otras causas (p <0.05, respectivamente). Por el contrario, la EMO fue dependiente del estadio de progresión de la CH ya que se encontró en 45.2% de los pacientes Child A, 36.4% Child B y 100% Child C (p <0.05, respectivamente) cuando se caracterizó de acuerdo a los valores de DMO de la columna lumbar: Para cualquier sitio anatómico examinado, la EMO fue independiente del estado nutricional del enfermo cirrótico (datos no mostrados).
Finalmente, la Figura 3 muestra la asociación entre la EMO, el estadio de progresión de la enfermedad cirrótica y el estado nutricional después de completada la ESG, para los dos sitios anatómicos examinados. Para cualquier sitio, la EMO fue dependiente tanto de la progresión de la CH como del estado nutricional: la EMO se concentró en aquellos cirróticos desnutridos y que se encontraban en el estadio final de la enfermedad: Fémur izquierdo: Ji cuadrada = 15.9 (p <0.05); Columna lumbar: Ji cuadrada = 17.3 (p <0.05); respectivamente.
¿ Figura 3. Asociación entre la frecuencia de EMO, estadio de progresión de la CH y el estado nutricional asignado mediante la ESG. A: Fémur izquierdo. B: Columna lumbar.
¿ Discusión
Se esperaba que la salud ósea siguiera un curso paralelo al estado nutricional del cirrótico y que aquellos cirróticos con peor estado nutricional fueran los que exhibirían valores disminuidos de la DMO. Contrario a lo esperado, la frecuencia de EMO asociada a la CH fue independiente del estado nutricional del cirrótico. Las razones de tal hallazgo pueden ser varias. En primer lugar, el grupo estudiado se distinguió por su heterogeneidad demográfica, clínica y nutricional, lo cual puede ocultar la influencia "pura" de una u otra variable sobre la DMO de un sitio anatómico especificado en el cirrótico. En segundo lugar, las posibles relaciones entre la salud y las variables modeladoras de la salud ósea del cirrótico pueden ser confusas e incluso caóticas. Finalmente, no se debe dejar de alertar sobre las insuficiencias del análisis univariado de fenómenos forzosamente multifactoriales. Tal vez una mejor visión de la relación salud óseasalud nutricional se obtendría de la acumulación de un número importante de casos, y con ello, la aplicación de modelos logísticos de análisis estadístico. De hecho, cuando se analiza la influencia conjunta del estado nutricional y del estadio de progresión de la cirrosis, se pudo constatar que la frecuencia de EMO era máxima entre los cirróticos en estadio terminal y desnutridos, sin importar el sitio anatómico examinado.
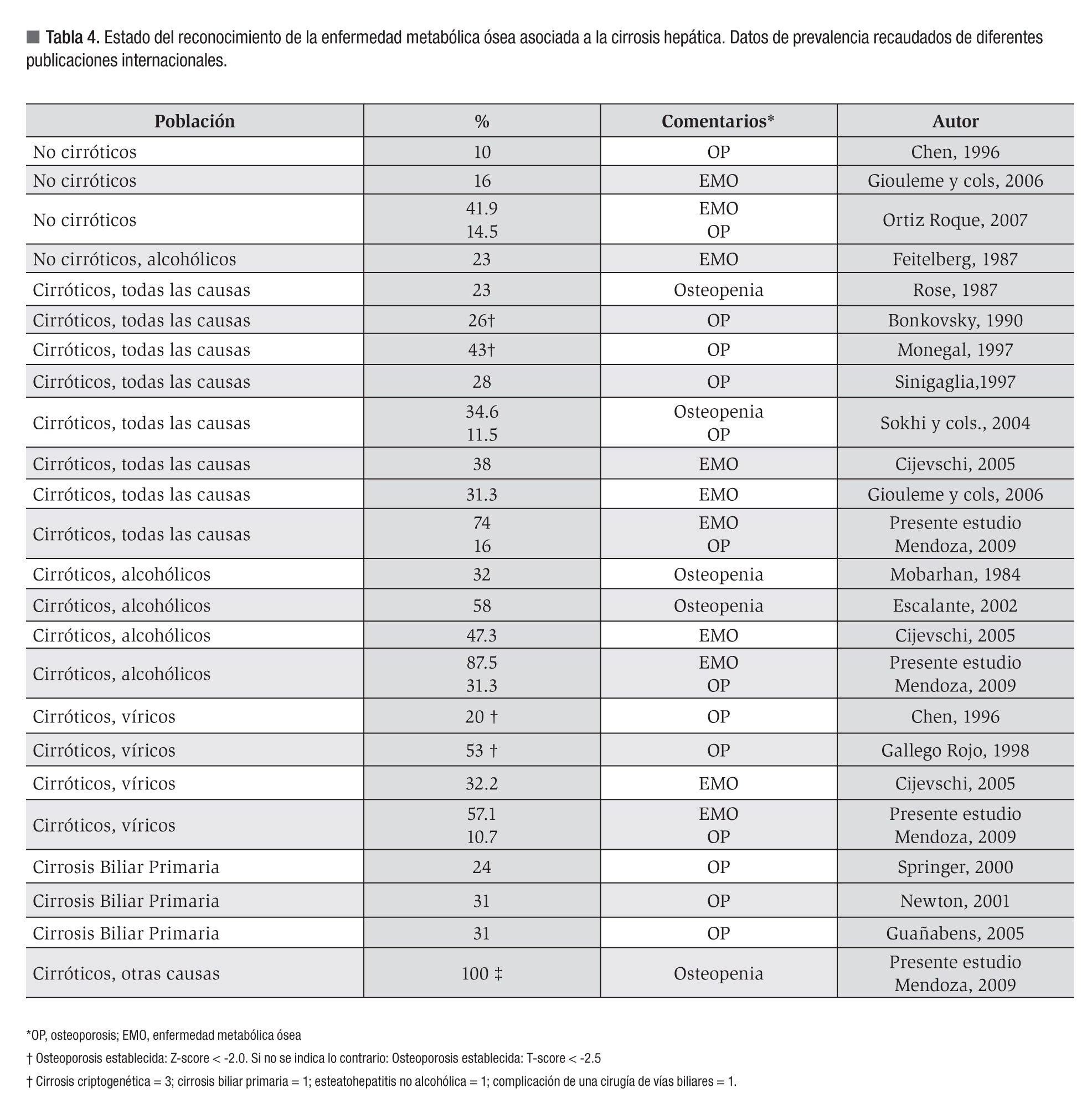
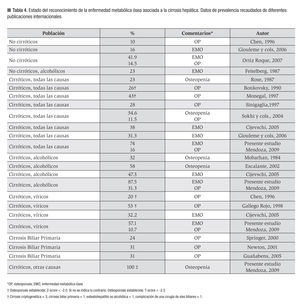
La frecuencia de EMO en cirróticos varía entre 10% a 53%.13 En la Tabla 4 se muestra la frecuencia de EMO obtenidas en diversas investigaciones publicadas. La diversa frecuencia de EMO asociada a la CH se podría explicar por la variabilidad inherente a los protocolos de investigación adoptados: la condición del paciente (hospitalizado o ambulatorio), el método empleado (ultrasonido óseo o DEXA), el tipo de maquinaria DEXA empleada (HOLOGIC o LEXXUS), el sitio anatómico examinado, el constructo para la definición de la EMO (puntaje "Z" vs puntaje "t"); las características de la cirrosis; e incluso el estado nutricional del paciente.
Los estimados de EMO para los sitios anatómicos examinados en este estudio coincidieron con las cotas superiores de los estimados de prevalencia reportados previamente,31 pero si se combinan los resultados de la DMO obtenidos en los sitios examinados, la frecuencia de la EMO asociada a la CH se incrementa hasta 74%. La frecuencia global de osteopenia fue de 58%, mientras que la de osteoporosis fue de 16%. La frecuencia observada de la EMO asociada a la CH fue independiente de las variables demográficas del estudio como la edad, sexo y color de la piel. Se debe aclarar que, en razón del diseño de la investigación, la edad del sujeto se controló para el rango comprendido entre los 19 a 65 años de edad. Si bien el 54% de los sujetos tenían edades iguales o mayores de 50 años, sólo seis de ellos eran mujeres. Aun así, si se analiza la influencia conjunta de la edad y el sexo sobre la frecuencia de EMO, 80.9% de los hombres mayores de 50 años presentaron valores disminuidos de DMO para cualquiera de los sitios examinados, en contraste con 66.7% de las mujeres incluidas en el mismo grupo etario. Esta es una prueba adicional de que la frecuencia de EMO en nuestro estudio no está determinada por una proporción no controlada de mujeres menopáusicas, y por lo tanto, podría representar el estado actual de esta entidad.
En un estudio previo, el puntaje "t" de la DMO en 886 sujetos seleccionados y 29 cirróticos (con 41% y 44.8% de mujeres, respectivamente) fue significativamente menor columna lumbar y fémur de los sujetos con hepatopatía.32 En nuestra institución contamos con los valores de la DMO obtenidos en sujetos sanos (mujeres 86.3%; edad igual o mayor de 50 años, 54.7%) mediante el mismo protocolo DEXA LEXXUS de los sitios anatómicos empleados en este estudio para establecer la EMO asociada a la CH.29 Los estimados de EMO fueron similares entre sí, lo que permite concluir que la CH no determinó una mayor frecuencia de EMO, al menos en este estudio. Las diferencias observadas en las frecuencias estimadas de las formas de EMO no alcanzaron valor estadístico.
Sin embargo, la influencia de la CH sobre la EMO pudiera estar mediatizada por el sexo, como se muestra en la Figura 2. La presencia de CH trajo consigo un incremento de cuatro veces en la frecuencia de EMO en el hombre cirrótico. A juzgar por los resultados del presente estudio, es probable que la influencia de la CH sobre la EMO sea marginal en la mujer. La poca representatividad del sexo femenino en la presente serie impide ajustar la influencia de la CH según la etiología de la misma, como se ha hecho en el pasado.17 La influencia de la edad en la EMO en la mujer cirrótica podría corresponder al cese de la producción de estrógenos, protectores de la salud ósea. La pérdida de este estímulo hormonal, junto con desequilibrios de la formación y resorción del tejido óseo, podrían explicar las tasas elevadas de EMO entre las mujeres cirróticas. Tampoco se debe ignorar la influencia de la etapa premenopáusica, como se infiere de la prevalencia de osteoporosis observada en mujeres aparentemente sanas.
La frecuencia de EMO en hombres cirróticos puede ser tan desproporcionada que oblitere otras relaciones entre la salud ósea y algunos predictores propuestos, como el estado nutricional. Es posible que en el hombre cirrótico ocurra una distorsión profunda del medio hormonal. De hecho, se describen signos de hipogonadismo en hombres cirróticos (atrofia testicular, alteraciones de la distribución del vello corporal, ginecomastia, disminución del recuento espermático, pérdida de la libido y aparición de telangiectasias) que es la resultante de la disminución de la producción testicular de hormonas masculinas, el aumento de los niveles séricos de compuestos con actividad estrogénica y el aumento de la conversión periférica de esteroides de débil acción androgénica en otros con mayor acción estrogénica.33 Puede ser que estos esteroides circulantes difieran en la acción sobre la masa ósea: algunos (inferiores en concentración) tendrían un efecto protector sobre el tejido óseo, mientras que otros (superiores en número) podrían promover la resorción ósea.33
La patogenia de la EMO en las enfermedades hepáticas crónicas aún no está bien definida. La cantidad de masa ósea depende del balance entre dos procesos opuestos: la formación ósea inducida por los osteoblastos y la resorción ósea por los osteoclastos.34 La anomalía inicial para el desarrollo de una EMO en la enfermedad hepática crónica es la disminución de la formación ósea, aunque también se ha reportado una resorción aumentada.35,36 La bilirrubina puede alterar en forma dosis-dependiente la capacidad proliferativa de los osteoblastos.37,38 En este punto, resultó llamativo que la EMO se concentrara en este estudio en los pacientes cirróticos en el estadio final de la enfermedad y que estaban desnutridos.
El reducido grado de formación ósea que se observa en las enfermedades hepáticas también podría estar relacionado con las bajas concentraciones de elementos tróficos como el factor de crecimiento similar a la insulina (IGF-1). Así, se han observado concentraciones bajas de este factor en pacientes con cirrosis y osteoporosis, los niños con colestasis, y modelos experimentales de cirrosis con osteopenia.39 Muchas de las observaciones citadas se han obtenido de mujeres postmenopáusicas y con enfermedad hepática muy avanzada, en quienes una carencia de calcio y vitamina D podría provocar hiperparatiroidismo secundario, que produciría un aumento del recambio óseo. A pesar de estas evidencias, la contribución de la resorción ósea en la osteoporosis de las enfermedades hepáticas es todavía controversial.
Existen otros factores que pueden contribuir al desarrollo de osteoporosis en la enfermedad hepática, como la predisposición genética determinada por polimorfismos del gen del receptor de la vitamina D o de la cadena a-1 del colágeno tipo 1.40,41 Recientemente se han identificado la osteoprotegerina (OPG) y su ligando RANKL como los reguladores moleculares del remodelado óseo que, al actuar sobre la diferenciación de los osteoclastos, pueden intervenir en el desarrollo de osteoporosis. Se ha postulado que una mala función hepática podría estar ligada a una menor producción de osteoprotegerina y un aumento de la resorción ósea.42 Sin embargo, el potencial papel del sistema OPG/ RANKL en el desarrollo de la EMO en la enfermedad hepática crónica está todavía por definirse.
La probable influencia de trastornos del medio hormonal del cirrótico plantearía otras inquietudes, como si la suplementación hormonal sería costo-beneficiosa en la restauración, preservación y paliación de la EMO asociada a la CH. La EMO en la CH se ha tratado mediante reemplazo hormonal con estrógenos, moduladores selectivos de los receptores de estrógenos (raloxifeno) y administración de andrógenos, pero hasta el momento no se cuenta con evidencia sólida para recomendar algún tratamiento.43
Nuestro estudio tiene algunas limitaciones. En esta investigación asumimos que el tejido óseo, en cualquier sitio anatómico que se explore, responderá de la misma manera a una agresión especificada. Sin embargo, tal parece que no es así. En el presente estudio, la DMO del cuello de la cabeza del fémur izquierdo se asoció con la causa de la CH ya que los pacientes cirróticos no víricos-no alcohólicos concentraron más de 80% de los casos con valores disminuidos de la DMO en este sitio anatómico, a pesar de la heterogeneidad clínica inherente a la subcategoría y a la poca representatividad de estos enfermos. Por su parte, todos los cirróticos en fase terminal mostraron valores de la DMO menores al esperado para una población de referencia cuando se examinó la columna lumbar. No debe desecharse del todo la influencia perniciosa de la ictericia crónica sobre el tejido óseo.17,37,38 También la EMO asociada a la CH no alcohólica, no vírica podría tener una etiopatogenia inflamatoria, como es la característica de la esteatohepatitis no alcohólica y de la cirrosis biliar primaria.44,45 Finalmente, no se puede dejar de mencionar el estado nutricional como un importante modulador de las relaciones entre el tejido óseo y la función hepática. La desnutrición asociada a la CH podría ser el resultado de cuadros de mala absorción o de cambios profundos introducidos en la dieta regular como consecuencia de la propia enfermedad. El hecho de que el estado nutricional se coaliga con el estadio de progresión de la enfermedad cirrótico para modular la frecuencia de la EMO no debe ser pasado por alto. Por todo lo anterior, hasta la realización de un estudio caso-control, la influencia de la CH sobre la EMO en enfermos cubanos no podrá ser establecida fehacientemente.
En conclusión, la frecuencia de EMO en los pacientes cirróticos en nuestra serie fue alta. La osteopenia fue la forma prevalente de la EMO entre los cirróticos. La osteoporosis afectó a casi la quinta parte de la serie de estudio. La presentación de la EMO fue independiente de las variables demográficas y su frecuencia fue independiente del estado nutricional del paciente cirrótico. Sin embargo, la EMO se concentró en los cirróticos en el estadio terminal de la enfermedad que se calificaron como desnutridos. La influencia de la CH sobre la EMO pudiera estar mediada por el sexo del sujeto. El tejido óseo en diferentes sitios anatómicos pudiera reaccionar desigualmente ante la actuación de la misma agresión, siendo ésta compuesta por la causa o la progresión de la CH.
Correspondencia: Dr. Sergio Santana Porbén.
San Lázaro 701 e/t Marqués González y Belascoaín, Centro, La Habana. Cuba.
Teléfono: 53(7)876 1895.
Correo electrónico: ssergito@infomed.sld.cu
Recibido el 9 de febrero de 2011;
aceptado el 13 de abril de 2011.