El entendimiento de la fisiopatología de la encefalopatía hepática ha condicionado nuevas opciones de tratamiento. La detoxificación del amonio es regulada por 2 enzimas en la encefalopatía hepática: la glutaminasa o la glutamina sintetasa. La primera genera amonio y la segunda detoxifica el amonio, por lo que los tratamientos son encaminados a la inhibición de la glutaminasa o a la activación de la glutamina sintetasa. Actualmente sabemos que ambas enzimas se encuentran no solo en el hígado, sino también en el músculo, intestino, riñón y cerebro, por lo que los tratamientos actuales pueden ser dirigidos a cada enzima en sitios separados. Entendiendo estos sitios potenciales de tratamiento, las opciones para el abordaje del paciente con encefalopatía hepática son diversas y deben ser personalizadas.
Understanding of the pathophysiology of hepatic encephalopathy has conditioned new treatment options. Ammonia detoxification in hepatic encephalopathy is regulated by two enzymes: glutaminase or glutamine synthetase. The first produces ammonia and the second detoxifies the ammonia, which is why treatments are aimed at glutaminase inhibition or glutamine synthetase activation. At present, we know that both enzymes are found not only in the liver, but also in the muscle, intestine, kidney, and brain. Therefore, current treatments can be directed at each enzyme at different sites. Awareness of those potential treatment sites makes different options of approach possible in the patient with hepatic encephalopathy, and each approach should be personalized.
La encefalopatía hepática (EH) se presenta en un 30-60% de los pacientes cirróticos. Es una expresión clínica de un espectro de anormalidades neuropsiquiátricas potencialmente reversibles, secundarias al acúmulo de sustancias neurotóxicas en el tejido cerebral, que es proporcional a la función sintética y de reserva del hígado. Por ello, es importante conocer y comprender sus componentes, fisiopatología y blancos terapéuticos, con el fin de disminuir el riesgo de complicaciones (neumonía intrahospitalaria, manejo inadecuado de secreciones, sarcopenia o desnutrición, entre otras) y, además, mejorar la clase funcional de los pacientes que la padecen.
La EH se clasifica de acuerdo a 4 factores: la enfermedad subyacente, la gravedad de las manifestaciones, la temporalidad y la existencia de factores precipitantes. Con relación a la enfermedad subyacente, esta se divide en 3 tipos dependiendo del contexto clínico en el que ocurra: la tipo A se presenta en el contexto de una falla hepática aguda; la tipo B, en el contexto de una derivación portosistémica sin enfermedad hepática intrínseca; y la tipo C, en el contexto de cirrosis con hipertensión portal o una derivación sistémica. De acuerdo a la gravedad de las manifestaciones se clasifica en mínima u oculta, grado I, grado II, grado III y grado IV, según las características clínicas (cambios conductuales, confusión, bradipsiquia, alteraciones del ciclo sueño-vigilia, habla incoherente, letargia, estupor y coma) y alteraciones neuropsicológicas o psicométricas que presente el paciente. En cuanto al curso temporal, puede ser episódica, recurrente (2 o más episodios de EH que ocurren dentro de un intervalo de tiempo de 6 meses o menos) o persistente (patrón de alteraciones de la conducta que siempre están presentes, sin periodos de normalidad). Por último, los episodios de EH se describen como no precipitados o precipitados, en relación con si se encuentra o no un factor desencadenante1.
Fisiopatología de la encefalopatíaHistóricamente, en la fisiopatología de la EH se ha involucrado la presencia de niveles elevados de toxinas en el parénquima cerebral, teniendo como principal agente al amonio (NH3). La evidencia actual apoya que el amonio es solo un componente más de los múltiples factores fisiopatogénicos que contribuyen a la aparición de esta2-9.
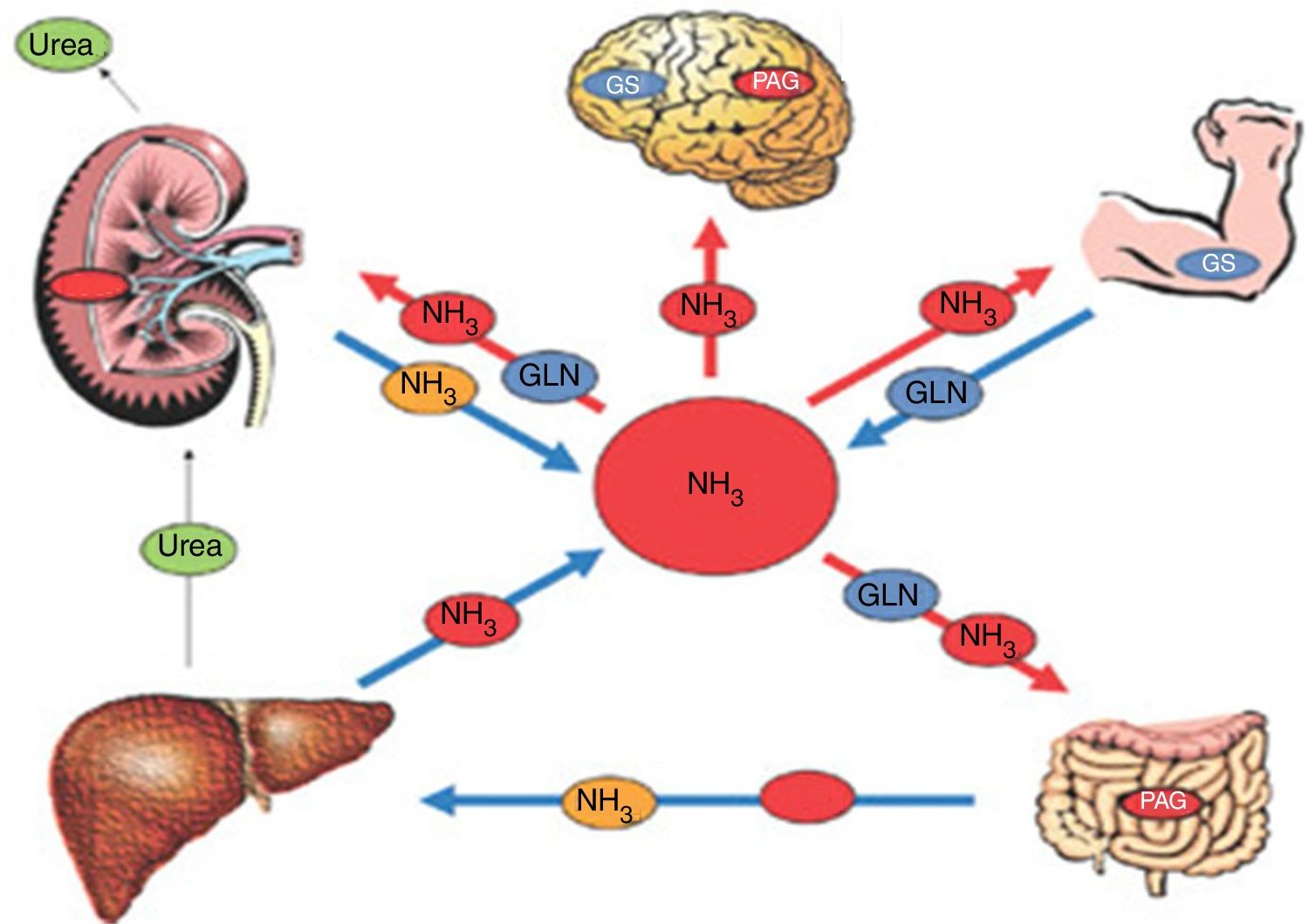
El abordaje de la fisiopatología debe incluir la integridad de los sitios naturales de detoxificación, como el hígado, intestino, músculo, riñón y astrocito, además del estudio de la circulación colateral. (fig. 1).
Fisiopatología de la EH. En los pacientes con cirrosis, la concentración de amonio puede aumentar significativamente. Esto se debe a una menor detoxificación del amonio en el hígado y alguna otra alteración del metabolismo en otros órganos como el músculo, riñón e intestino, que no permiten eliminar el amonio de manera adecuada.
GLN: glutamina; GS: glutamina sintetasa; NH3: amonio; PAG: glutaminasa activada por fosfato.
Fuente: adaptada de Rose CF. Ammonia-lowering strategies for the treatment of hepatic encephalopathy. Clin Pharmacol Ther. 2012;92:321–31.
Clasificar la gravedad de la disfunción hepática de pacientes con cirrosis de acuerdo a la escala de Child-Pugh nos da la oportunidad de estimar su función sintética, además de valorar las complicaciones propias de la hepatopatía. La preocupación por el acúmulo de neurotoxinas endógenas (NH3) surge a partir de los pacientes que se encuentran con una clasificación en escala de Child B y C, o con cirrosis descompensada. Si bien es cierto que los pacientes con una clasificación dentro de la escala de Child A tienen un porcentaje mucho menor de encefalopatía clínica, debemos buscar intencionadamente EH mínima con las pruebas adecuadas, ya que el tratamiento en esta fase impacta favorablemente en la progresión a formas clínicamente evidentes10.
El amonio en el hígado se elimina principalmente mediante el ciclo de la urea, y la urea es el principal producto de la degradación proteica producida por el hígado mediante esta vía metabólica. La L-ornitina L-aspartato (LOLA) funciona en este sitio como sustrato del ciclo de la urea y así interviene en la disminución de los niveles de amonio, por incremento en el flujo de glutamina sintetasa (GS) y del sistema enzimático del ciclo de la urea. Varios investigadores han realizado estudios de metaanálisis para estudiar la efectividad de LOLA en pacientes cirróticos con EH, subdivididos en EH manifiesta y EH mínima. Los estudios han concluido que LOLA tiene efectos benéficos en ambos grupos respecto a mejoría del estado mental y grado de EH, así como en la reducción de los niveles séricos de amonio11,12.
El zinc (Zn) es un cofactor importante en las reacciones enzimáticas llevadas a cabo tanto en el hígado como en el músculo. A nivel molecular, se considera que la carencia de este mineral disminuye la acción de la ornitina transcarbamilasa, una enzima del ciclo de la urea, y la GS, una enzima esencial en el metabolismo del nitrógeno, encargadas de la eliminación del amonio en el hígado y el músculo, respectivamente. Aportar suplemento de Zn se acompaña de un incremento en la actividad enzimática de estas 2 enzimas. Algunos estudios han podido constatar que en la población cirrótica existe una depleción importante de Zn13; se calcula que el 95% de los pacientes cirróticos con un MELD score mayor o igual a 15 puntos tienen deficiencia de Zn14, lo que correlaciona con la mayor incidencia de encefalopatía en este tipo de pacientes. En el estudio realizado por Bresci et al. se reportó una mejoría en las pruebas psicométricas de pacientes con cirrosis en el grupo que fue suplementado con Zn en comparación con el grupo que no recibió suplementación; desafortunadamente, la diferencia no fue estadísticamente significativa15. Por lo tanto, en otro artículo de revisión sobre la deficiencia de Zn, sugieren que el suplemento de Zn puede ser una terapia a considerar en aquellos pacientes refractarios al tratamiento basado en dietas hipoproteicas y administración de lactulosa16.
El beneficio del Zn fue demostrado posteriormente por el grupo de Takuma con un ensayo clínico en pacientes cirróticos con EH de grados I y II que fueron refractarios al tratamiento. En este trabajo los pacientes se dividieron en 2 brazos: los pacientes que recibirían suplemento de Zn y terapia estándar (aminoácidos de cadena ramificada y lactulosa) frente a aquellos que solo recibirían la terapia estándar. Los pacientes fueron seguidos en el tiempo durante 6 meses para dilucidar los efectos en relación con la EH y la calidad de vida. Los pacientes que recibieron suplementación mejoraron significativamente respecto a la escala de componentes físicos, el grado de encefalopatía y los niveles sanguíneos de amonio. Aproximadamente el 54% de los pacientes mejoraron su grado de encefalopatía, y de estos, el 41% mejoraron hasta EH grado 0. Cabe mencionar que dentro de las limitaciones de este estudio se encuentran: la técnica de enmascaramiento, ya que no fue un estudio ciego, y la suplementación de Zn, que contenía L-carnitina y puede actuar como antioxidante17.
Dentro de los inconvenientes de esta terapia se encuentran: la reducción de la acción del ciprofloxacino, la falta de estudios para encontrar una dosis efectiva, así como la deficiencia de cobre y dispepsia generada con el uso prolongado.
IntestinoLa sobreproducción de amonio en el intestino juega un papel clave en el desarrollo de EH. Las bases científicas se plantearon a mitad del siglo pasado, al darse cuenta de que la EH estaba relacionada con la absorción de sustancias nitrogenadas provenientes del intestino. Por las mismas fechas, se identificó la metionina como agente tóxico y se describió la riqueza de bacterias coliformes que habitan en el intestino delgado de los pacientes con cirrosis. Posteriormente, Bajaj et al. han identificado diversos cambios que ocurren a nivel de la microbiota intestinal en los pacientes con cirrosis y se han dado cuenta de que conforme estos se encuentran en una fase más descompensada de la enfermedad hay mayor disbiosis, estableciendo así la razón cirrosis disbiosis, que mientras más baja sea esta se asocia a mayor morbimortalidad18,19. Hasta la fecha solo el estudio de Chen et al. ha logrado reproducir el microbioma fecal del cirrótico20; esto es importante porque cada población es diferente, por lo que los blancos potenciales de tratamiento se deberán enfocar en la microbiota predominante.
Históricamente se ha utilizado el abordaje basado en antibióticos de pobre absorción, como rifaximina o neomicina, para reducir la producción de amonio intestinal de las bacterias productoras de ureasa. Existe poca evidencia relacionada con la eficacia de la neomicina, sin embargo, la rifaximina es una de las opciones terapéuticas más estudiadas. Múltiples trabajos han evaluado la rifaximina en el tratamiento de pacientes con EH confirmando su eficacia y seguridad en dosis de 1,200 o 2,400mg/día21-27; también se ha corroborado su utilidad como medida utilizada en profilaxis secundaria26. Otros estudios han comparado la rifaximina con los disacáridos no absorbibles y se ha visto que ambos son eficaces para el tratamiento de la EH, reduciendo los niveles de amonio en sangre y mejorando los síntomas; sin embargo, la rifaximina ha demostrado una mejoría más temprana y menos efectos secundarios23,25,27. Así mismo, se ha descrito que la utilización oral de vancomicina también puede disminuir la diversidad de la microbiota intestinal28. En un estudio en Japón de 12 pacientes con EH resistente a la lactulosa, se les agregó vancomicina al manejo y se observó una mejoría en el grado de EH29. Este pequeño estudio ciego sugiere que la vancomicina puede ser una opción en pacientes que no responden al tratamiento con lactulosa; sin embargo, se debe tener precaución debido al diseño del estudio y a que existe poca evidencia respecto a su uso.
Los disacáridos no absorbibles como la lactulosa (β-galactosidofructosa) y el lactitol (β-galactosidosorbitol) logran reducir la producción intestinal y la absorción de NH3, mediante la acidificación en el colon, un efecto laxante, el movimiento del NH3 desde la circulación portal hacia el colon y la interferencia con la captación de glutamina por parte de la mucosa intestinal y su subsecuente metabolismo a NH3. La dosis de lactulosa (15 a 30mL administrados de 2 a 4 veces al día) se titula para que el paciente tenga de 3 a 5 evacuaciones diarias y se puede administrar por vía rectal en los casos en que el paciente no puede tomar los medicamentos. Este grupo de medicamentos se consideran la terapia de primera línea para el tratamiento de la EH, y la mejoría de los síntomas ocurre en alrededor del 70% de los casos. Múltiples estudios han evaluado la lactulosa con relación al tratamiento de la EH mínima, EH manifiesta y como medida de profilaxis secundaria en pacientes con cirrosis, confirmando su eficacia y seguridad30-33. En los ensayos clínicos se ha visto que el lactitol es mejor tolerado y ha demostrado ser igual de eficaz que la lactulosa para el tratamiento de la EH34,35. A la hora de comparar la utilización de antibióticos no absorbibles (rifaximina) versus disacáridos no absorbibles (lactitol y/o lactulosa) con miras a mejorar el grado de EH, se ha reportado que no existe diferencia significativa23,25,27.
Los probióticos son mezclas de bacterias beneficiosas que se cree que pueden ayudar a la EH mediante la modulación del microbioma. Los estudios enfocados en mejorar la microbiota intestinal del cirrótico por medio de los probióticos, ya que estos podrían tener un efecto benéfico, ofrecen una alternativa interesante para modular la flora bacteriana de estos pacientes. No existe evidencia del uso de probióticos en el tratamiento agudo de la EH manifiesta. Los principales estudios sobre el uso de probióticos en EH manifiesta fueron para profilaxis secundaria y demuestran que son efectivos para prevenir EH en pacientes con cirrosis36,37.
MúsculoEl músculo esquelético ha sido descrito como el segundo buffer de detoxificación del NH3. Los miocitos proporcionan un sitio para metabolizar NH3 incorporándolo a la glutamina mediante GS, aunque la actividad de esa enzima en el músculo es baja. De esta manera, la depuración de NH3 y la producción de glutamina pueden superar la falta de metabolismo hepático, pero la sobreproducción de NH3 en otros sitios no permite que esta sea la solución a la hiperamonemia.
La desnutrición en el paciente cirrótico y su pérdida de masa muscular perpetúan y empeoran la aparición de la EH. Además, el catabolismo per se genera un exceso de glutamina en la circulación; por tanto, generará mayor producción renal e intestinal de amonio. El manejo nutricional de los pacientes con cirrosis es un punto fundamental para el manejo preventivo de la EH. La recomendación actual es que los pacientes con EH deben mantener la misma dieta que otros pacientes con cirrosis, ya que no hay evidencia de que la restricción de proteínas en la dieta prevenga los episodios de EH38,39. A pesar de tratar de mantener la nutrición, ciertos pacientes con cirrosis presentan sarcopenia y existe evidencia que sugiere que la sarcopenia está asociada con el riesgo de desarrollar EH mínima o manifiesta40,41. Tratar de mejorar el estado nutricional y la masa muscular con una dieta rica en proteínas y un refrigerio alto en proteínas antes de ir a la cama podría ayudar en teoría a la prevención de la EH38,42. Además, el ejercicio y los aminoácidos de cadena ramificada se han estudiado como opciones terapéuticas para tratar la sarcopenia en pacientes con cirrosis, con resultados satisfactorios43. Los aminoácidos de cadena ramificada también se estudiaron en una revisión de Cochrane como una opción terapéutica para la EH y se confirmó que estos aumentaron significativamente el número de pacientes que mejoraron de la EH44.
La masa muscular de los pacientes cirróticos tiene una expresión incrementada de miostatina o factor de crecimiento y diferenciación 8 (GDF-8) perteneciente a la familia de proteínas del factor de crecimiento transformador β (TGF-β). Esta proteína es conocida por sus propiedades inhibitorias de generación y crecimiento de músculo, gracias a su histórica relación con el receptor para activina IIB (RAcIIB), incrementando la transcripción mediada por Smad 2/3 y consiguiendo así su cometido. Se ha demostrado que esto es secundario al acúmulo de NH3 intramuscular, resultando en vías de activación que contribuyen a la sarcopenia45.
En este orden de ideas, es fácil pensar que la inhibición del RAcIIB o la minimización de la expresión de GDF-8 pudieran ser nuevas alternativas de tratamiento. En un estudio realizado por MacKenzie et al. se demostró el beneficio en aras de inhibir la expresión de GDF-8 mediante el ejercicio de resistencia y esto correlacionaba con un incremento de la masa muscular46.
En 2012, Duarte-Rojo et al. estudiaron los cambios en el ácido ribonucleico mensajero (ARNm) de la GS de las células mononucleares en sangre periférica por acción del ejercicio en voluntarios sanos. Ellos encontraron que la GS efectivamente se expresaba más en condiciones de ejercicio y se distribuía en el citoplasma de la sangre periférica de células mononucleares. Estos resultados pueden ser alentadores para el tratamiento de la EH debido a sus implicaciones en el metabolismo del NH347.
RiñónEste órgano también juega un papel fundamental en la homeostasis del amonio. En condiciones normales, las células renales producen iones de NH3 que pueden tomar 2 caminos: ser excretados por la orina o alcanzar la circulación sanguínea mediante la vena renal. Este último mecanismo, en personas sanas, representa la mayor parte de la concentración circulante de NH3, y su excreción hacia la vena renal se puede ver modificada según el estado ácido-base, los niveles de potasio y la función renal. Aunque la glutamina es el principal aminoácido tributario de la producción de NH3, el glutamato, la glicina y la prolina son aminoácidos implicados de igual forma en esta tarea. En los pacientes con cirrosis, se muestra como la vía alterna de mayor acción para poder detoxificar esta sustancia y, bajo condiciones de estrés, puede llegar a depurar hasta el 80% del NH348. Por ende, como ya se había mencionado anteriormente, la dieta y el ejercicio tienen un papel fundamental en este tipo de pacientes.
El glicerol fenilbutirato (GPB) es un medicamento aprobado por la Food and Drug Administration en el 2013 para el tratamiento de pacientes con trastornos del ciclo de la urea o errores innatos del metabolismo que se manifiestan por hiperamonemia, cuyo efecto podría ser emulado en la población cirrótica49. El GPB se hidroliza mediante lipasas pancreáticas para producir glicerol y 3 moléculas de ácido fenilbutírico; estas últimas sufren una β-oxidación en el hígado para producir ácido fenilacético, que se conjuga con la glutamina en el hígado y el riñón para formar fenilacetil glutamina que posteriormente se excreta en la orina. Este fármaco actúa proporcionando una ruta alternativa para la eliminación del NH3 y la eliminación de nitrógeno residual en forma de fenilacetil glutamina en orina. En consecuencia, este efecto trató de ser emulado en pacientes con cirrosis y EH, demostrando que el GPB era capaz de disminuir los niveles de NH3 en este tipo de pacientes50. Posteriormente, Rockey et al. publicaron un estudio sobre la utilidad del GPB en pacientes con cirrosis que habían cursado con 2 o más eventos de EH en los últimos 6 meses. En este trabajo se demostró que el GPB reducía la proporción de pacientes que experimentaban un nuevo evento de EH, el número total de eventos de EH y los niveles séricos de amonio51. Estos resultados son alentadores y sugieren que el GPB podría ser una potencial opción terapéutica para EH en pacientes con cirrosis.
La acetil-L-carnitina (ALC), un éster de cadena corta derivado de la carnitina, producida endógenamente en la mitocondria y los peroxisomas, está involucrada en el transporte de partículas acetílicas a través de la membrana de estos organelos. La administración de este éster ha mostrado en modelos animales disminuir la toxicidad por NH3 mediante la activación de las enzimas del ciclo de la urea, la interacción con los receptores de glutamato y la reducción de los radicales libres52-54. Existen estudios que han evaluado la utilización de la ALC en pacientes con cirrosis y EH oculta y/o manifiesta, donde se ha observado que la ALC produce mejoría en la calidad de vida, ansiedad, depresión y funciones cognitivas55-58. Estos estudios han demostrado que la administración de ALC reduce los niveles séricos de NH3 y tiene un efecto protector contra la toxicidad del amonio y la neurotoxicidad del glutamato. Por ende, aunque hoy en día se necesitan más estudios para recomendar su utilización, esta intervención podría ser considerada como un blanco terapéutico en un futuro.
CerebroLa evidencia de neuroagresión incluye la activación de la microglía, al igual que la síntesis in situ de citocinas proinflamatorias como el factor de necrosis tumoral (TNF), la interleucina 1β (1L-1β) y la interleucina 6 (IL-6)59. Los mecanismos de señalización en falla hepática incluyen: efectos directos de las moléculas proinflamatorias sistémicas, reclutamiento de monocitos después de la activación microglial, acúmulo de NH3 cerebral, lactato, manganeso, mercaptanos, algunos ácidos grasos y derivados del triptófano como sustancias neurotóxicas, al igual que alteración en la permeabilidad de la barrera hematoencefálica. Como es bien sabido, tanto las moléculas proinflamatorias como el amonio trabajarán de manera conjunta, dando como resultado edema cerebral.
Las estrategias antiamonémicas actuales realmente han demostrado impactar muy poco en la calidad de vida del paciente cirrótico; por este motivo, se están estudiando nuevos blancos terapéuticos. La evidencia apunta a que los mecanismos proinflamatorios tanto centrales como periféricos están trabajando solos o en comunión con moléculas neurotóxicas como el NH359,60. A su vez, la hiponatremia, la sepsis, la hemorragia gastrointestinal y la falla renal precipitan la producción exógena de TNF, lo cual exacerba la presentación de la EH.
Las células de la microglía son las células de defensa del sistema nervioso central (SNC) que tienen una gran habilidad para reconocer una amplia gama de cambios en la homeostasis, desde daño endotelial o tisular hasta cambios en la capacidad energética celular. Una vez que estas se activan, son productoras de una gran cascada de citocinas y quimiocinas con propiedades proinflamatorias e inflamatorias, según sea el caso. Esto fue demostrado en la autopsia de 8 pacientes con cirrosis que habían muerto por falla hepática61. Se demostró que la extensión de la activación microglial y la presencia de elevación de los niveles de ARNm procitocínicos eran predictores tanto de EH como de edema cerebral. El reclutamiento microglial se relaciona con niveles elevados de TNF y la consecuente formación de quimiocina ligando 2 (CCL2), que forma parte de las llamadas quimiocinas62. Estos hallazgos han sugerido que se trata de una nueva vía de comunicación mediada por inmunidad contra la neurona, resultando en excitabilidad alterada y complicaciones neurológicas en pacientes con enfermedades colestásicas. Se ha visto que la inhibición en CCL2 reduce notablemente la progresión a encefalopatía en modelos animales. También se ha podido demostrar que la activación microglial presenta predominio de lóbulo frontal. La GS cerebral es generada principalmente por las células de la microglía y constituye uno de los primeros mecanismos de detoxificación cerebral, por lo que se ha propuesto que el flujo anaplerótico entre el ciclo de glutamato-glutamina y el del ácido cítrico mediante la enzima piruvato carboxilasa tiene capacidades de detoxificación63.
En condiciones hiperamonémicas, al comparar la susceptibilidad a los cambios morfológicos y funcionales de las células astrogliales y microgliales, los astrocitos presentan mayor susceptibilidad64. En este contexto, se ha estudiado también la capacidad del amonio para generar liberación de sustancias proinflamatorias por parte de la microglía: hasta ahora, los resultados no muestran relación directa, y se necesitan más estudios in vivo y ex vivo en regiones cerebrales dirigidas. Estudios realizados en pacientes cirróticos encuentran gran sinergia entre el NH3 y las citocinas proinflamatorias, en especial el TNF59.
Como se ha mencionado antes, el lactato juega también un papel importante en la neuroinflamación. Existe evidencia concreta de que los niveles de este correlacionan con las concentraciones elevadas de NH3 en el cerebro de pacientes con enfermedad hepática terminal. Al mismo tiempo, se relaciona con activación microglial, severidad de los síntomas clínicos y los cambios en el electroencefalograma; ya que el ciclo del ácido cítrico y de la urea tienen conexión, por lo que el acúmulo de lactato tiene la capacidad de inhibir la producción de NH3 por desactivación de la alfa-cetoglutarato deshidrogenasa, lo cual puede activar la fosfo-fructocinasa 1, que es una enzima reguladora de la vía glucolítica, y como consecuencia llevar a más producción de lactato y con ello perpetuar el daño65.
Uno de los hallazgos más llamativos en los encéfalos de pacientes cirróticos post mortem es la gran cantidad de manganeso acumulado en los ganglios basales, acúmulo que sucede gracias a 2 vías: en primer lugar, gracias a la pobre o nula eliminación de este metal por la vía biliar, lo cual genera una concentración sérica elevada; en este orden de ideas, la hipertensión portal y la generación de circulación colateral serían la segunda vía de propagación hacia el encéfalo, favorecida por la disrupción de la barrera hematoencefálica. El manganeso ha sido identificado, junto con el estrés oxidativo/nitrosativo, como el principal agente de muerte selectiva de las células dopaminérgicas cerebrales, lo cual es compatible con la relación encontrada entre cirrosis y parkinsonismo66-68.
La última barrera de neuroprotección en el contexto de un paciente cirrótico es, sin duda, la barrera hematoencefálica. En estudios recientes se ha confirmado que, ante la exposición a un ambiente proinflamatorio (TNF e IL-1β), esta barrera tiende a perder su capacidad de contención, favoreciendo el paso de las toxinas provenientes del resto de la economía, y convirtiéndose así en otra vía deletérea entre el hígado y el cerebro. La razón de esta permeabilidad sigue siendo sujeto de estudio; algunas teorías sugieren que las proteínas de adhesión celular podrían jugar un papel importante en la génesis de este fenómeno69.
Puntos fisiopatológicos sin relación directa con el amonioVasorreactividad cerebralLa hemodinámica cerebral se ha involucrado en la fisiopatogenia de la EH, a través de daño directo sobre el endotelio vascular, lo cual genera endógenamente mayores tasas de TNF e IL-1β, como se demostró en el estudio realizado por Macías-Rodríguez et al., donde por medio de mediciones de velocidad de flujo mediante ultrasonido Doppler transcraneal, la hemodinámica cerebral se encontró alterada en los pacientes con cirrosis70. Esto se correlacionó con la medición de gravedad mediante la escala de MELD y su variable MELD-Na. La conclusión del estudio fue que tanto la estructura vascular como la capacidad de autorregulación del flujo podrían ser parte de la fisiopatología de la EH.
HiponatremiaLos niveles bajos de sodio son comunes en la población cirrótica, gracias a la activación de la hormona antidiurética. Esto se genera por una disminución en el volumen arterial efectivo relacionado con la vasodilatación esplácnica. Cuando este estado cronifica, lleva a una depleción intracelular de osmolitos orgánicos, como el mioinositol, que juega un papel importante en la hidrorregulación intracelular. Los osmolitos presentes en los astrocitos proporcionan una defensa celular contra el edema y pueden ser rápidamente acumulados o depletados según los sensores osmóticos. Una de las teorías del edema astrocitario es la presencia de hiponatremia crónica como depletor de estos osmolitos. En este orden de ideas, con la permeabilidad presente en la barrera hematoencefálica y la vulnerabilidad al ambiente hiperamonémico e inflamatorio, se produce, por ende, el edema de bajo grado y la presencia de estrés oxidativo/nitrosativo, con disfunción astrocitaria71.
Nuevos blancos terapéuticosAgentes quelantes del manganesoCon base en la evidencia que sugiere que este metal podría estar implicado en la muerte de las células dopaminérgicas y su acúmulo reportado en el tejido cerebral de los pacientes cirróticos, no es descabellado pensar que los agentes quelantes del manganeso podrían ayudar a disminuir las tasas de parkinsonismo asociado a cirrosis, además de reducir la expresión de los radicales de estrés oxidativo generados por su interacción con la microglía. Acido etilendiaminotetraacético (EDTA) y acido p amino salicílico (PAS) han sido estudiados en este punto, pero se requiere llevar a cabo más estudios72.
Proteínas transportadoras de ureaLa urea, como sabemos, es una molécula hidrosoluble, la cual clásicamente ha sido descrita como de difusión pasiva. Actualmente el descubrimiento de la secuenciación de proteínas que facilitan el transporte en ciertos tejidos ha sido revolucionario para entender la importancia fisiológica de la urea. Se han encontrado los genes responsables de la codificación en estas proteínas (SLC14A1 y SLC14A2), genes que forman parte del mismo cromosoma (18q12.q21.1). Lo novedoso de este descubrimiento en el campo de la EH radica en que su posible bloqueo podría detener la producción incrementada de NH3 intestinal (transportador de urea [UT]-B) y la estimulación de UT-A isoformas 1 y 3 reguladas por vasopresina como inductores de la urea en la médula renal73.
TaurinaUno de los puntos interesantes al analizar la fisiopatología de la EH es la baja concentración de taurina; este aminoácido actúa a nivel cerebral como antioxidante potente, como regulador de la enzima sintetasa de óxido nítrico, además de poseer propiedades antimicrobianas aumentando la habilidad fagocítica de los neutrófilos y la protección del endotelio74.
FolistatinaEs una glucoproteína miembro de la familia de TGF-β que antagoniza a muchos miembros de dicha familia, incluyendo la activina A, el factor de crecimiento y diferenciación 11 (GDF-11) y el GDF-8. La administración de esta molécula ha mostrado incrementar el peso corporal a expensas de masa muscular en ratas; además, ha mostrado mejora en la agresión y atrofia muscular, modulando la respuesta temprana de la fase inflamatoria por incremento de la densidad macrofágica y de las células Pax7+, acelerando el proceso de restauración de las miofibras y de la función muscular75.
Terapia génicaComo mencionamos previamente, las medidas antiamonio utilizadas en el tratamiento de la EH tienen una eficacia limitada; en 2015, Torres-Vega et al. publicaron un ensayo en el que se utilizó el baculovirus Bac-GS como vector para la liberación del gen de GS. La transducción en las células MA 104 o L6 mioblasto/miotúbulos con Bac-GS dio como resultado una alta expresión del gen GS, con incremento en la concentración de GS, lo cual se ha aplicado vía intramuscular en un modelo murino de hiperamonemia aguda, disminuyendo 351μM la concentración de amonio en comparación con los controles, con incremento en la concentración de GS en el músculo gastrocnemio76. Estos resultados abren la puerta hacia opciones promisorias en el manejo de la EH.
Inhibidores de la FKS1Por la relación de esta enzima como reguladora de la glucólisis, su impacto en la generación de lactato, y con ello el aumento en el riesgo de edema cerebral, podría ser un blanco terapéutico interesante a explorar. En este punto, dietas pobres en fructosa, la inhibición de esta enzima y el aumento de la entrada a vías metabólicas aerobias podrían ser terapias a explorar en la población cirrótica (tabla 1).
Opciones terapéuticas en EH
| Órgano | Mecanismo | Tratamiento planteado |
|---|---|---|
| Hígado | UT-B gen SLC14A1 | Inhibición por antagonismo de receptores o manipulación génica en su expresión |
| Músculo | Aumento de GDF-8Aumento de la GS | FolistatinaEjercicio |
| SNC | Generación de ureagénesisAntioxidante potenteQuelantes de manganesoGlucólisis infectiva | Acetil-L-carnitinaTaurinaEDTA y PASInhibición de la folistatina 1 |
| Riñón | UT-A | Aumentar la expresión génica o crear una proteína humanizada in vitro |
| Intestino | Aumentar el tránsito orocecalDisminuir el amonio arterial | ProcinéticosProbióticos |
EH: encefalopatía hepática; GDF-8: factor de crecimiento y diferenciación 8; GS: glutamina sintetasa; SNC: sistema nervioso central; UT: transportador de urea.
Recientemente la flora intestinal (microbioma) ha cobrado especial interés como una opción terapéutica en los pacientes con encefalopatía dada la generación de citocinas inflamatorias generadas en el intestino, aunado a la generación primaria de glutamina y producción secundaria de amonio.
Es bien sabido que el microbioma humano es un complejo de genes que abarca más de 1×1010 bacterias las cuales residen en el intestino75. Dicho microbioma ampliamente ha sido caracterizado en 5 phyla llamados Firmicutes, Bacteroidetes, Actinobacteria, Proteobacteria y Verrucomicrobia. Cuando estos phyla entran en un desbalance se denomina disbiosis y esto ha sido descrito ampliamente en el paciente con cirrosis, siendo lo más característico en los pacientes con encefalopatía un incremento en las bacterias gramnegativas, específicamente enterobacterias, lo que ha llevado a postular el trasplante fecal como una opción de tratamiento en estos pacientes76,77.
FinanciaciónNo se recibió patrocinio de ningún tipo para llevar a cabo este artículo.
Conflicto de interesesLos autores declaran no tener ningún conflicto de interés para este trabajo.