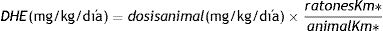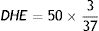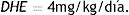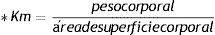La cirrosis es el desenlace común de las enfermedades hepáticas. Puede ser descompensada y llevar al desarrollo de complicaciones como la encefalopatía. La hiperamonemia que se desarrolla debido a la disfunción hepática está etiopatológicamente relacionada con la encefalopatía hepática. La cafeína (CAF) aumenta la actividad del ciclo de la urea en el hígado, aumentando la degradación del amonio. Además, al antagonizar receptores de adenosina, ejerce un efecto hepatoprotector, impidiendo la formación de fibrosis y tiene un efecto estimulante en el sistema nervioso central. El objetivo del presente estudio fue el análisis de los efectos de la cafeína sobre la evolución de la fibrosis hepática colestásica y de la encefalopatía hepática.
Material y métodosSe construyó un modelo experimental de fibrosis hepática colestásica, por medio de la ligadura del conducto biliar común, y de encefalopatía hepática, con la administración de una dieta hiperproteica. Treinta y dos ratas Wistar machos fueron divididas igualmente en cuatro grupos. El experimento duró 28 días, con administración de CAF 50 mg/kg/d. Se realizaron pruebas de laboratorio, análisis histológicos de hígado y encéfalo, pruebas de campo abierto (PCA) y análisis conductuales diarios.
ResultadosLos animales ligados tratados con CAF presentaron menores medias de transaminasas y mejorías histológicas en hígado y encéfalo. El grupo ligado sin tratamiento se presentó claramente letárgico y apático en la última semana de experimento, lo cual fue comprobado por la disminución de la actividad exploratoria durante la PCA.
ConclusiónLa CAF mejoró la microarquitectura hepática y encefálica de los animales cirróticos. Además, impidió la disminución de la actividad exploratoria de los animales durante la PCA.
Cirrhosis is the common outcome of liver diseases. It can be decompensated and lead to the development of complications, such as encephalopathy. Hyperammonemia that develops due to liver dysfunction is etiopathologically related to hepatic encephalopathy. Caffeine increases the activity of the urea cycle in the liver, augmenting ammonia degradation. By antagonizing adenosine receptors, it also has a hepatoprotective effect, impeding the formation of fibrosis, as well as having a stimulating effect on the central nervous system. The present study analyzed the effects of caffeine on the progression of cholestatic liver fibrosis and hepatic encephalopathy.
Materials and methodsAn experimental model of cholestatic liver fibrosis, through common bile duct ligature, and of hepatic encephalopathy, through the administration of a high-protein diet, was constructed. Male Wistar rats (n = 32) were equally divided into 4 groups. The experiment lasted 28 days, with the administration of 50 mg/kg/day of caffeine. Laboratory tests, histologic analyses of the liver and encephalon, open field tests (OFTs), and daily behavioral analyses were carried out.
ResultsThe ligated animals treated with caffeine had lower mean transaminase levels and improved histologic aspects of the liver and encephalon. The untreated ligated animals were clearly lethargic and apathetic at the last week of the experiment, confirmed by reduced exploratory activity during the OFT.
ConclusionCaffeine improved the microarchitecture of the liver and encephalon of the cirrhotic animals and prevented the decrease in exploratory behavior of the animals during the OFT.
Las enfermedades hepáticas son de gran importancia para la salud pública debido a su impacto socioeconómico, ya que representan altos costos de tratamiento, periodos largos de seguimiento a los pacientes y admisiones hospitalarias1. Las enfermedades hepáticas causan alta morbilidad y mortalidad como resultado de la evolución a cirrosis, la cual es una etapa final común para dichas enfermedades2. En los EE. UU., la cirrosis causó aproximadamente 49,500 muertes y fue la octava causa de muerte en 20103. De acuerdo con la Organización Mundial de la Salud (OMS), la cirrosis hepática es la 11.a causa de muerte en el mundo4.
Existen numerosas causas de la enfermedad hepática, debido a inflamación hepática o colestasis y puede culminar en cirrosis, la cual se define como un proceso difuso de formación nodular y fibrosis tras necrosis celular hepática, el desenlace común de lesiones hepáticas crónicas5.
Independientemente del agente etiológico, la cirrosis puede ser asintomática en su forma compensada. Sin embargo, cuando es descompensada aparecen una o más complicaciones de disfunción hepática, como lo es la encefalopatía, una de las más prevalentes6,7.
La encefalopatía hepática está presente en aproximadamente 30 a 45% de los pacientes con cirrosis hepática, mientras que el 80% de dicha población presenta encefalopatía hepática mínima8–10. Es un trastorno metabólico potencialmente reversible que consiste en un trastorno funcional del sistema nervioso central asociado con insuficiencia hepatocelular. La encefalopatía hepática es el resultado de enfermedades hepáticas crónicas y la presencia de una derivación portosistémica, la cual puede ser espontánea o quirúrgica (derivación portosistémica intrahepática trasyugular). El amonio es el principal elemento relacionado con su desarrollo, además de la interferencia de varias neurotoxinas y varios factores, como edema cerebral, tono GABAérgico y los microelementos zinc y manganeso11–13. Debido a que gran parte del amonio se metaboliza en urea dentro del hígado por medio del ciclo de la urea, el nivel de amonio sérico aumenta en los casos de disfunción hepática y causa que cruce la barrera hematoencefálica y se vuelva tóxica para el sistema nervioso central13,14. Por lo tanto, se sabe que las sustancias que pueden disminuir dicha concentración pueden ser utilizadas en el manejo de la complicación antes mencionada, y la cafeína (CAF) es una de esas sustancias15.
La CAF es un alcaloide farmacológicamente activo que pertenece al grupo de las metilxantinas16. Está presente en varios tipos de alimentos, como el chocolate, refrescos, tés, bebidas energéticas y café, siendo este último su fuente principal16,17. La ingesta de café ha sido asociada recientemente con una disminución en el riesgo de presentar varias enfermedades crónicas, como la diabetes mellitus tipo 2, la enfermedad de Parkinson, enfermedades inflamatorias y enfermedades hepáticas18,19. Respecto a las enfermedades hepáticas específicamente, el consumo de CAF ha sido asociado con una disminución de niveles de enzimas hepáticas y un menor riesgo de fibrosis20,21.
La CAF también aumenta la actividad de varias enzimas que afectan al ciclo de la urea, incluidas la carbamoil fosfato sintetasa 1, la ornitina transcarbamilasa, la argininosuccinato sintetasa y la argininosuccinato liasa22,23. Todas estas enzimas trabajan en favor del ciclo, catalizando la reacción de formación de urea, incrementando su síntesis y disminuyendo la concentración de amonio en suero24. Además, uno de los principales efectos de la CAF es la estimulación del sistema nervioso central, antagonizando los receptores de la adenosina25.
Con base en lo anterior, el objetivo del presente estudio fue analizar los efectos de la CAF en la evolución de fibrosis hepática colestásica inducida por ligadura del conducto biliar común (LCBC) y correlacionar su uso con el desarrollo de encefalopatía causada por hiperamonemia, como resultado de enfermedad hepática.
Materiales y métodosDiseño experimentalObtuvimos 32 ratas machos (200-350 g) de la Universidad Federal de Santa Catarina (Florianópolis, Brasil) y fueron divididas y aleatorizadas en cuatro grupos de igual número de ratas (n = 8 por grupo): cirugía simulada (CS) + CAF; CS + H2O; LCBC + CAF; y LCBC + H2O. Durante todo el experimento, los animales permanecieron en el bioterio del Instituto de Investigaciones Médicas (Curitiba, Brasil) en cajas de plástico de 47 x 34 x 18 cm, en un ciclo de 12 h de luz/oscuridad, con humedad relativa de 45-55% y temperatura entre 24 ± 1°C. Las ratas tuvieron acceso a agua filtrada y comida ad libitum. Todos los protocolos animales en nuestro estudio fueron aprobados por el Comité de Ética de Uso de Animales de la Facultad Evangélica Mackenzie de Paraná (Curitiba, Brasil), y los procedimientos fueron llevados a cabo de acuerdo con los criterios de la «Guía para el cuidado y uso de animales de laboratorio», recomendados por la Academia Nacional de las Ciencias y publicados por el Instituto Nacional de la Salud26.
Modelo experimental de fibrosis hepática colestásicaEl experimento duró 28 días, lo cual fue tiempo suficiente para el desarrollo de fibrosis hepática colestásica. Los procedimientos fueron realizados de acuerdo con Tag et al., 201527. Los animales fueron anestesiados con 90 mg/kg de ketamina y 10 mg/kg de xilacina. Se realizó tricotomía y desinfección de la región abdominal con 2% clorhexidina, seguida de laparotomía xifopubiana. Después de abrir la cavidad abdominal, se levantó el hígado y se bajaron las asas intestinales, exponiendo el conducto biliar común. Se colocaron dos ligaduras, una proximal y una distal, con hilo poliglactina 7.0. A continuación, se suturó el peritoneo, la capa muscular y la piel. Todo el procedimiento fue realizado asépticamente. En los animales con CS, solo se abrió la cavidad abdominal, sin ligadura.
Modelo experimental de encefalopatía hepáticaAdemás de la LCBC, se requirió la administración de alimento animal alto en proteínas. Del día 21 al día 28, se les dio a los animales una dieta con un contenido de 76% de proteína de soya. Se realizó una mezcla del alimento triturado usual, proteína de soya, agua y harina de trigo, resultando en una masa suave. La masa fue dividida en pequeños cilindros y horneada a 200°C por 45 min, para lograr una consistencia más similar a la del alimento estándar para animales. La proteína de soya y la harina de trigo fueron obtenidas de PopHouse Alimentos (Curitiba, Brasil). Este modelo, con algunas adaptaciones, fue descrito por Jover et al., 200628. Se realizaron registros diarios de la conducta de los animales, utilizando los criterios West Haven (tabla 1) como guía29, para documentar la evolución gradual a encefalopatía hepática clínica.
Criterios de West Haven para la clasificación de encefalopatía hepática47
| Grado | Conciencia | Intelecto/conducta | Hallazgos neurológicos |
|---|---|---|---|
| 0 | Normal | Normal | Examen normal |
| 1 | Alteración leve en la consciencia | Capacidad de atención disminuida, deterioro en la capacidad de sumar y restar | Asterixis leve o temblores |
| 2 | Letárgico y apático | Desorientado; conducta inapropiada | Asterixis obvia, dificultades en el habla |
| 3 | Somnolencia | Desorientación mayor; conducta extraña | Rigidez muscular, clonus, hiperreflexia |
| 4 | Coma | Coma | Postura de descerebración |
La CAF, obtenida de Quallitá Farmacias (Curitiba, Brasil), fue disuelta en 2 mL de agua tibia (45°C) y administrada intragástricamente a una dosis de 50 mg/kg/d30. El tratamiento fue administrado del primer al último día del experimento, por un total de 28 días. Se calculó la dosis de 50 mg/kg con base en la fórmula alométrica de la dosis humana equivalente (DHE)31, considerando un consumo humano diario promedio de 4 mg/kg:32
La dosis de 4 mg/kg/d en un adulto de 70 kg, corresponde al consumo de 280 mg/d, la cual es equivalente a dos o tres tazas de café por día33. En los grupos control, se administraron 2 mL de H2O de la misma manera.
Prueba de campo abierto (PCA)Las PCA reproducen la conducta natural animal de explorar un nuevo ambiente. Por lo tanto, se pueden evaluar las actividades exploratorias y locomotrices al colocar a los animales en un área mayor a la que están habituados34. Realizamos la prueba en una caja de madera MDF cuadrada abierta (120 cm x 120 cm x 40 cm) con un piso a cuadros, fabricada en Rudegon Mercenaria (Curitiba, Brasil). El último día del experimento, cada animal fue colocado en el centro de la caja y expuesto individualmente por cinco minutos, mientras era filmado con una cámara Nikon D340035. Los videos fueron analizados contando los cuadrantes por los que cada animal pasó y por el número de acciones de pararse sobre sus patas traseras y de asearse. La prueba fue aplicada por la misma persona en un salón cerrado, aislado de sonidos externos, para evitar cualquier cambio en los hábitos conductuales de los animales36.
Método de eutanasia y recolección de muestrasEl día 28 del experimento, los animales fueron anestesiados con 90 mg/kg de ketamina y 10 mg/kg de xilacina. Se obtuvieron 3 mL de sangre arterial por medio de punción en corazón, tras lo cual se extirparon el hígado y el encéfalo.
Análisis de laboratorioLas muestras de sangre fueron centrifugadas a 3,000 rpm durante 20 min y los sueros resultantes fueron almacenados a -20°C. Las muestras fueron después enviadas al laboratorio de análisis clínicos Bionostic (Curitiba, Paraná). Las pruebas de integridad hepática fueron realizadas utilizando el método cinético UV para ALT y AST, y para bilirrubina y fracciones se utilizó el método colorimétrico.
Evaluación histológicaLos órganos obtenidos fueron almacenados en formaldehído amortiguado por 48 h. Los fragmentos fueron, a continuación, seleccionados para procesar, de acuerdo con la técnica histológica convencional. Los fragmentos hepáticos y encefálicos fueron colocados en Paraplast® y cortados en secciones transversales de los órganos. Las secciones hepáticas fueron teñidas con hematoxilina-eosina y tricrómico de Masson y el encéfalo fue teñido con hematoxilina-eosina. El examen histológico fue realizado por un patólogo ciego a la información acerca de los grupos experimentales.
Análisis estadísticoLos valores fueron expresados como media y desviación estándar (DE) y el análisis se realizó utilizando GraphPad Prism, versión 7.0 para Windows 10. Para evaluar las diferencias entre los grupos se utilizó el análisis de varianza de una cola (ANOVA), seguido de la prueba post hoc Tukey-Kramer. Se consideró estadísticamente significativa una p < 0.05.
Consideraciones éticasTodos los protocolos animales del estudio fueron aprobados por el Comité de Ética de Uso de Animales de la Facultad Evangélica Mackenzie de Paraná (protocolo número 1566/2017). Los procedimientos fueron realizados de acuerdo con los lineamientos del Consejo Nacional para el Control de Experimentación con Animales (CONCEA) y los criterios de la «Guía para el cuidado y uso de animales de laboratorio», recomendado por la Academia Nacional de las Ciencias y publicado por los Institutos Nacionales de Salud26.
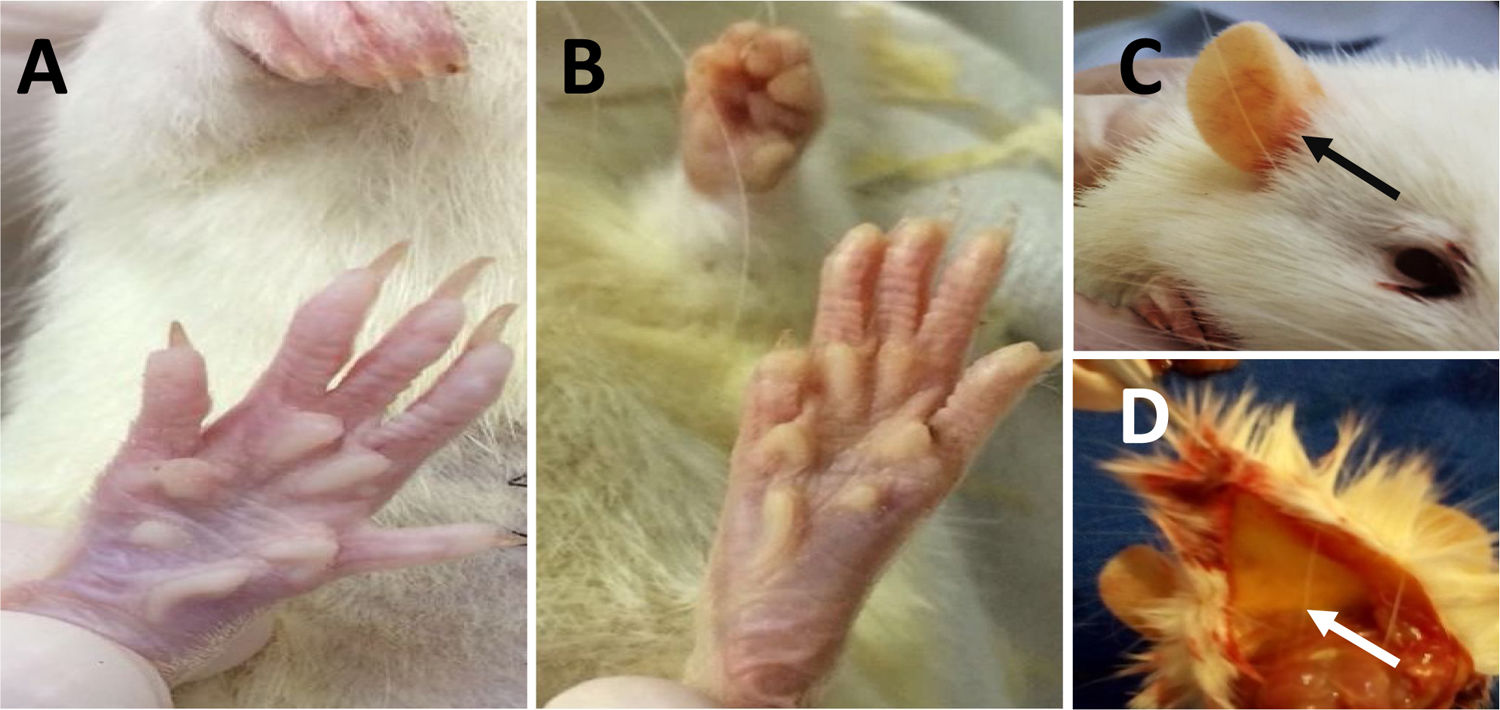
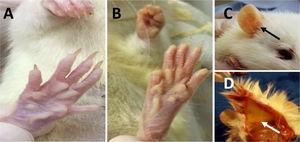
ResultadosCambios fenotípicosNo hubo cambios significativos en el peso corporal de los animales a lo largo del experimento. Alrededor del día 7, en los grupos LCBC + CAF y LCBC + H2O comenzaron a presentarse signos de ictericia (fig. 1), visible en las regiones de piernas, orejas y espalda. El color se intensificó con el avance del experimento y fue más evidente al final del mismo. Los animales también presentaron coluria, un signo característico de la hiperbilirrubinemia.
Ictericia de los animales con LCBC. A) Piel anictérica; B) ictericia de la piel y pelo al día 28 del experimento; C) ictericia de la región de la oreja (flecha negra) al día 28 del experimento; D) ictericia de la hipodermis (flecha blanca) al día 28 del experimento.
LCBC: ligadura del conducto biliar común.
A lo largo del experimento, el grupo LCBC + H2O mostró claros signos de apatía, letargo, desorientación, rigidez muscular y temblores, particularmente visibles durante la última semana del experimento, caracterizados como encefalopatía hepática grado II o grado III, de acuerdo con los criterios de West Haven (tabla 1)29. En el grupo LCBC + CAF, solo se observaron temblores ocasionalmente, caracterizados como grado 0 o I29. No se observaron cambios conductuales en los grupos control.
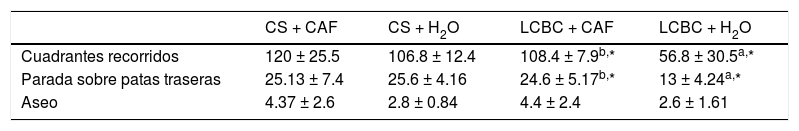
Evaluación de pruebas de campo abiertoEl número de paradas sobre patas traseras y cuadrantes recorridos por los animales en el grupo LCBC + CAF fue significativamente más alto, en comparación con el grupo LCBC + H2O (tabla 2). No hubo diferencia entre el número promedio de paradas sobre patas traseras y cuadrantes recorridos entre el grupo LCBC + CAF y su control, pero el grupo LCBC + H2O presentó una disminución en dichos promedios, en comparación con su control correspondiente.
Parámetros obtenidos en la prueba de conducta de campo abierto
| CS + CAF | CS + H2O | LCBC + CAF | LCBC + H2O | |
|---|---|---|---|---|
| Cuadrantes recorridos | 120 ± 25.5 | 106.8 ± 12.4 | 108.4 ± 7.9b,* | 56.8 ± 30.5a,* |
| Parada sobre patas traseras | 25.13 ± 7.4 | 25.6 ± 4.16 | 24.6 ± 5.17b,* | 13 ± 4.24a,* |
| Aseo | 4.37 ± 2.6 | 2.8 ± 0.84 | 4.4 ± 2.4 | 2.6 ± 1.61 |
Media (DE).
CS: cirugía simulada; CAF: cafeína; LCBC: ligadura del conducto biliar común; DE: desviación estándar.
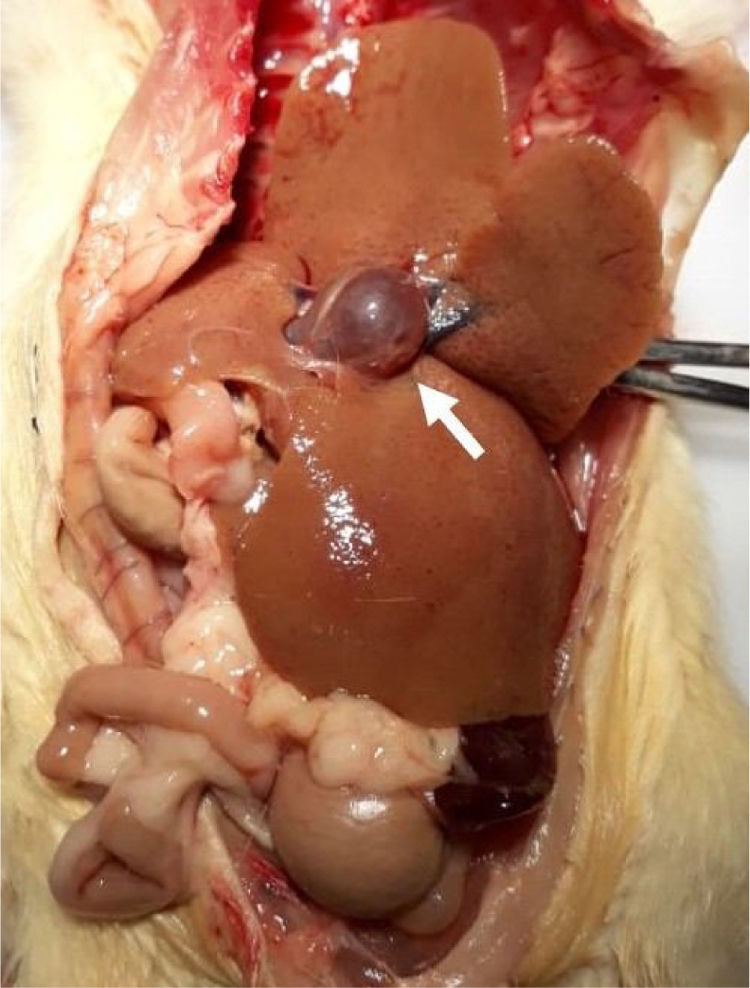
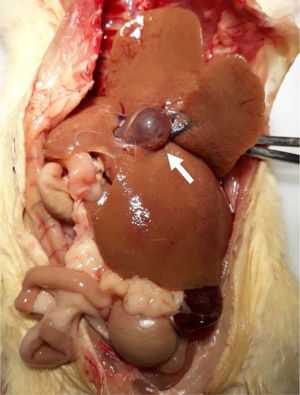
Los hígados de los animales de los grupos control fueron macroscópicamente normales (fig. 2), de color rojizo-café, forma triangular, bordes bien definidos, superficie lisa y brillante y consistencia suave. Sin embargo, los hígados de los animales con LCBC fueron de color amarillento-café, y en algunos casos, verdosos, al igual que de forma ovoide, con bordes bien definidos, fácilmente friables, y presentaron superficie irregular con aspecto micronodular, consistencia fibroelástica y hepatomegalia importante (fig. 2). Algunos animales también presentaron dilatación de la vena portal (fig. 2), posiblemente como resultado de hipertensión portal.
Respecto al encéfalo, no existieron diferencias macroscópicas. El órgano fue rosáceo-blanco, suave y friable.
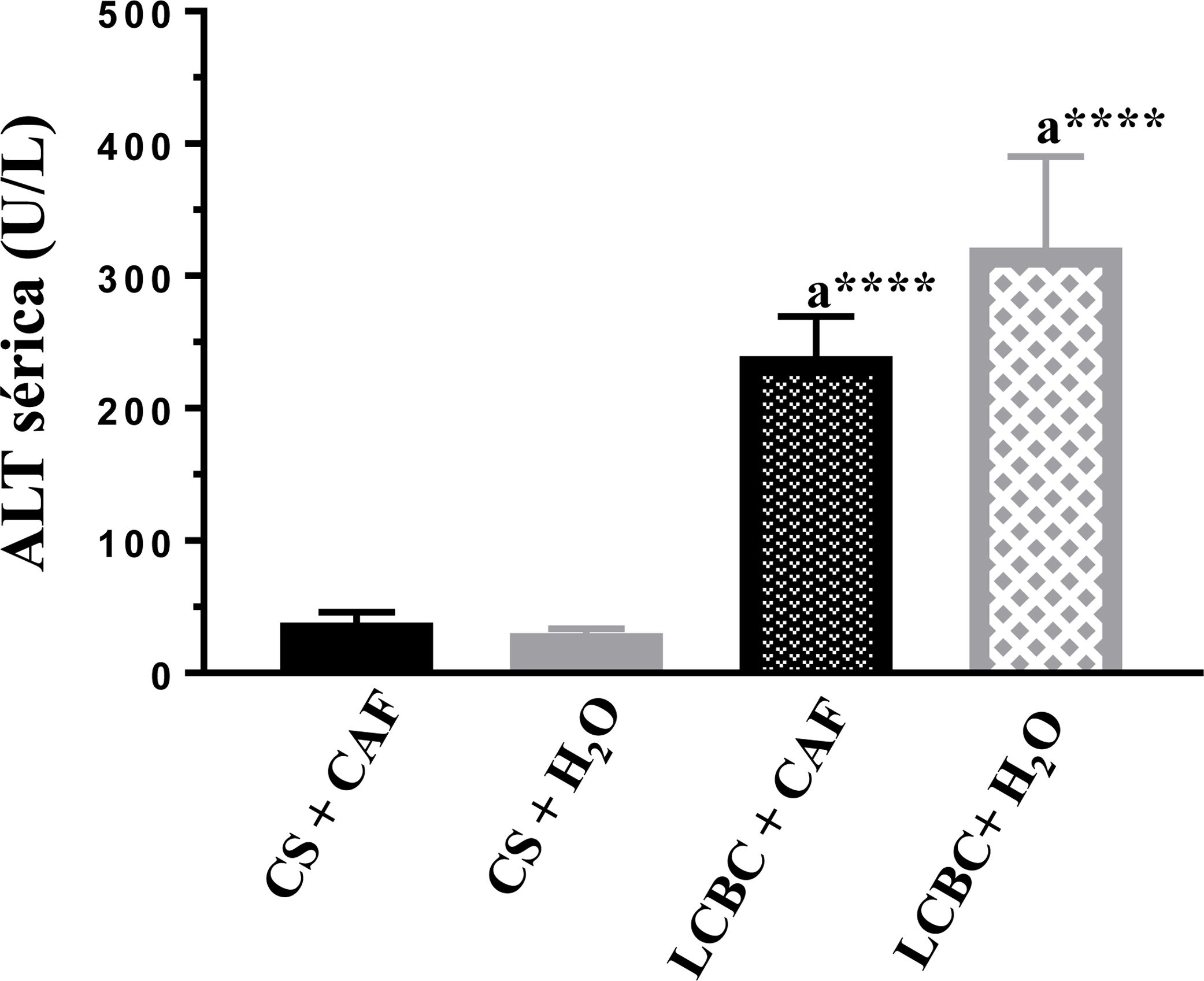
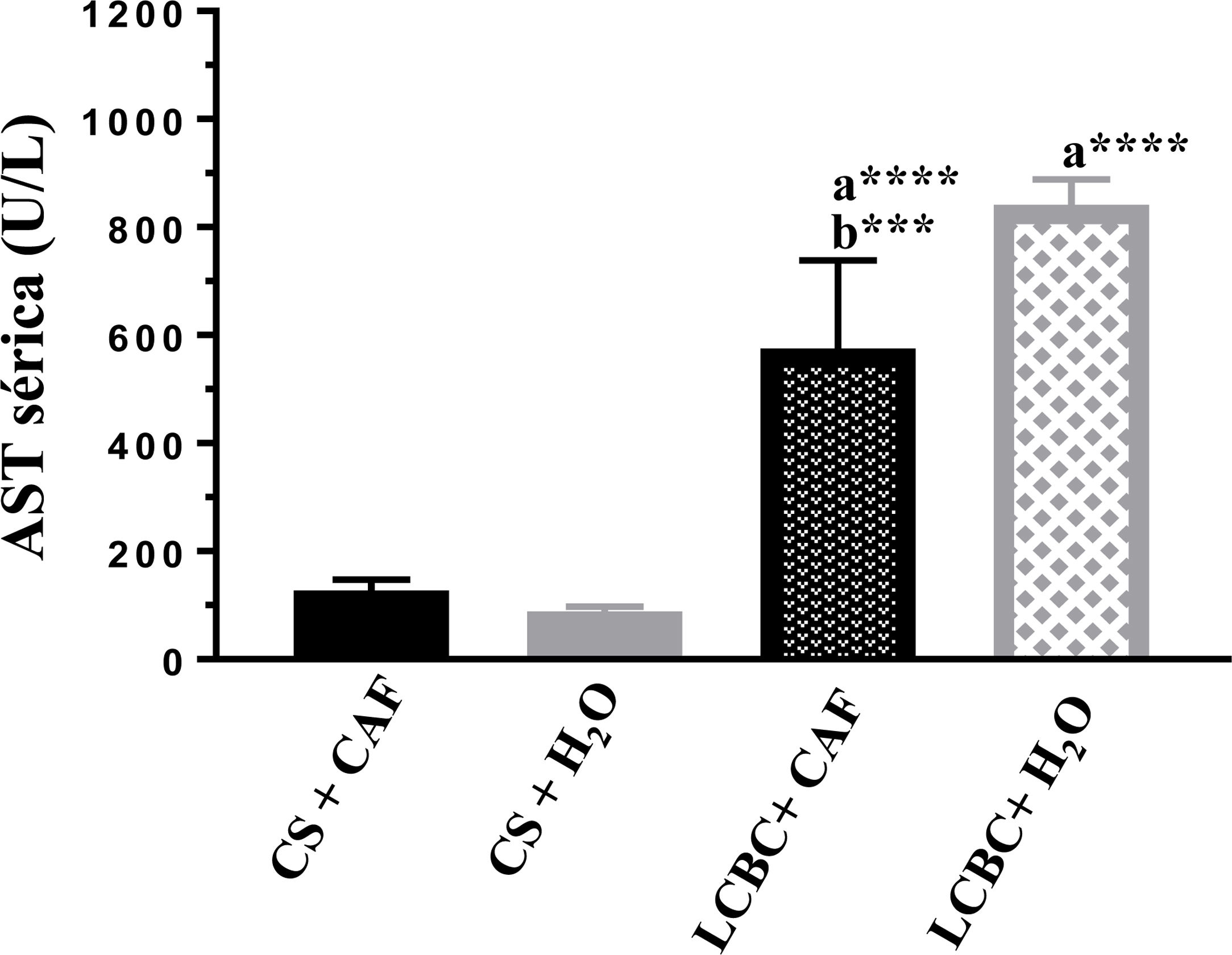
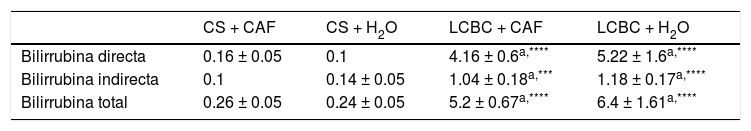
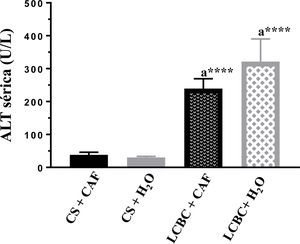
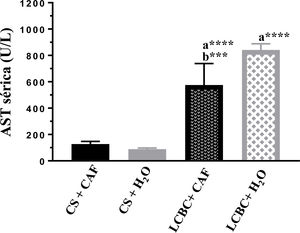
Evaluación de pruebas de laboratorioEn todos los animales con LCBC se observó un aumento significativo de las transaminasas ALT y AST (figs. 3 y 4) y de bilirrubina directa e indirecta (tabla 3), en comparación con sus respectivos controles, sin embargo, el grupo LCBC + CAF tuvo valores promedio más bajos que el grupo LCBC + H2O.
Niveles en suero de AST en cada grupo. Media (DE).
a: Diferencia significativa entre los grupos LCBC y sus respectivos controles.
b: Diferencia significativa entre los grupos LCBC + CAF y LCBC + H2O.
***p < 0.001; ****p < 0.0001.
LCBC: ligadura del conducto biliar común; CAF: cafeína; DE: desviación estándar.
Niveles séricos de bilirrubina expresados en mg/dL
| CS + CAF | CS + H2O | LCBC + CAF | LCBC + H2O | |
|---|---|---|---|---|
| Bilirrubina directa | 0.16 ± 0.05 | 0.1 | 4.16 ± 0.6a,**** | 5.22 ± 1.6a,**** |
| Bilirrubina indirecta | 0.1 | 0.14 ± 0.05 | 1.04 ± 0.18a,*** | 1.18 ± 0.17a,**** |
| Bilirrubina total | 0.26 ± 0.05 | 0.24 ± 0.05 | 5.2 ± 0.67a,**** | 6.4 ± 1.61a,**** |
Media (DE).
CS: cirugía simulada; CAF: cafeína; LCBC: ligadura del conducto biliar común; DE: desviación estándar.
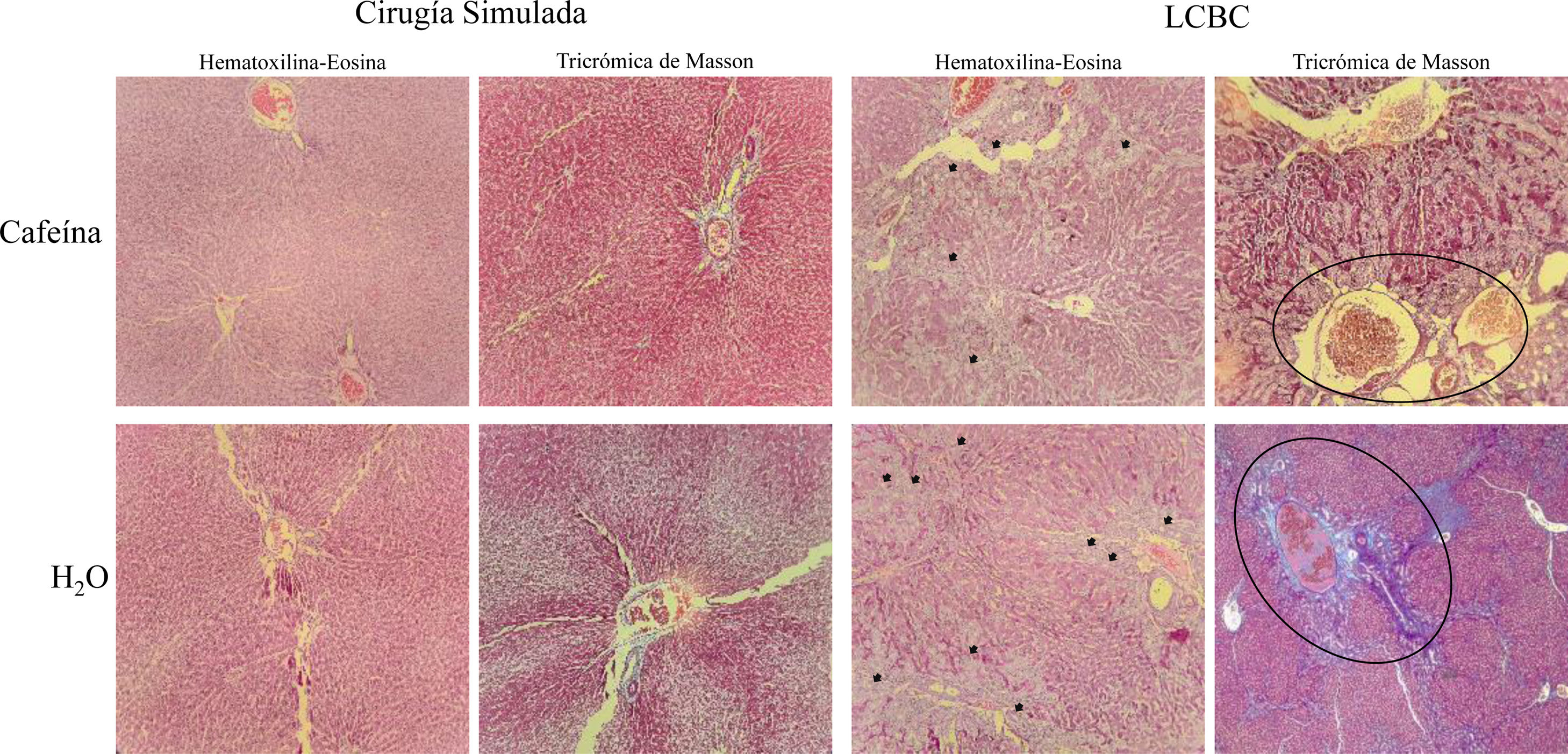
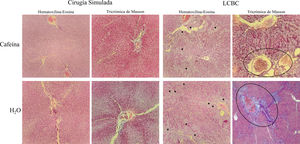
Respecto a la distorsión arquitectónica del parénquima y el ensanchamiento de los espacios portales del tejido hepático, el grupo LCBC + H2O mostró peores resultados, con el 100% de los animales presentando un grado moderado/pronunciado de distorsión. El grupo LCBC + CAF mostró mejores resultados, con un grado leve de distorsión en 40% de los casos y distorsión moderada/pronunciada en 60% (fig. 5).
Fotomicrografías de secciones hepáticas teñidas en hematoxilina-eosina y tricrómica de Masson (magnificación x100). Distorsión arquitectónica del parénquima (visualizada mejor con la tinción de hematoxilina-eosina), proliferación de conductos biliares (flechas negras), ensanchamiento de los espacios portales (dentro de los círculos negros), y fibrosis (azul en la tinción tricrómica de Masson) pueden ser observados en un grado moderado/pronunciado en el grupo LCBC +H2O. El grupo LCBC + CAF mostró mejoría significativa en estas características. Los grupos control presentaron histología normal.
LCBC: ligadura del conducto biliar común; CAF: cafeína.
Respecto a la proliferación en conducto biliar, el 100% de los animales del grupo LCBC + H2O fue clasificado con proliferación moderada/pronunciada. Del grupo LCBC + CAF, el 80% de los animales presentaron proliferación moderada/pronunciada y 20% tuvieron proliferación ligera (fig. 5).
Se utilizó la escala ISHAK para determinar el grado de fibrosis hepática, donde el grado 0 indica la ausencia de fibrosis y el grado 6 indica cirrosis37. El grupo LCBC + CAF presentó mejores resultados, en comparación con el grupo LCBC + H2O. Un total de 62.5% de los animales presentó grado 3 (fibrosis portal con septos porta-porta ocasionales), 25% tuvo fibrosis grado 4/5 (fibrosis portal con septos porta-porta y nódulos ocasionales) y 12.5% tuvieron grado 6. En el grupo LCBC + H2O, el 62.5% de los animales tuvo fibrosis grado 4/5 y el 37.5% tuvo grado 6 (fig. 5).
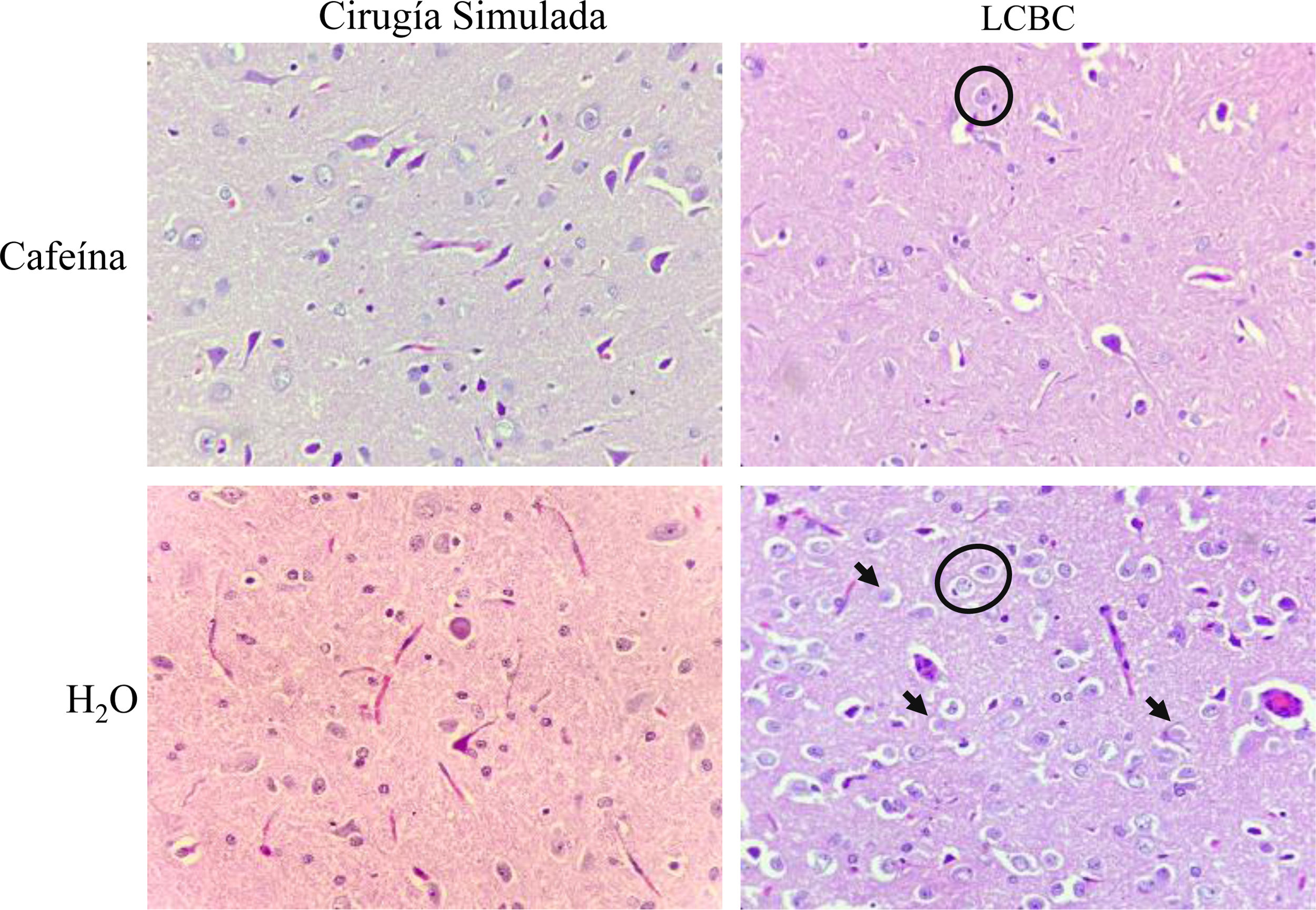
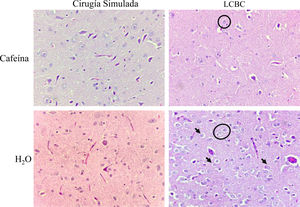
El grupo LCBC + CAF presentó mejoría significativa en el tejido encefálico, respecto a la presencia de astrocitos tipo II del Alzheimer, edema y necrosis laminar. Esto fue moderado en el 80% de dicho grupo y moderado/pronunciado en 20%. El grupo LCBC + H2O presentó necrosis moderada/pronunciada en 80% de los animales y astrocitos tipo II del Alzheimer y edema en el 100%. El aspecto espongiforme fue leve en el 100% del grupo LCBC + CAF, mientras que fue moderado/pronunciado en 80% de los animales del grupo LCBC + H2O y leve en el 20% de ellos (fig. 6).
Fotomicrografías de secciones del encéfalo teñidas en hematoxilina-eosina (magnificación, x400). Astrocitos tipo II de Alzheimer (debajo de estrellas negras), necrosis (flechas negras), edema (halo blanco alrededor de las células) y el efecto espongiforme pueden ser observados de forma moderada/pronunciada en el grupo LCBC + H2O. El grupo LCBC + CAF mostró una mejoría significativa en esas características. Los grupos control tuvieron histología normal.
LCBC: ligadura del conducto biliar común; CAF: cafeína.
Las enzimas hepáticas ALT y AST son marcadores de toxicidad y gravedad de daño hepático, y su liberación en el torrente sanguíneo demuestra la presencia de daño al parénquima hepático.38 En nuestro estudio, el daño hepático inducido por LCBC fue puesto en evidencia por el significativo aumento de dichas enzimas en la sangre, lo cual ha sido corroborado por otros estudios que han utilizado el mismo modelo27,39. En estudios similares se ha reportado que el tratamiento con CAF disminuyó la liberación de dichas enzimas al torrente sanguíneo, lo cual señala un efecto hepatoprotector y una posible mejora de la arquitectura hepática30,40.
Con la LCBC, la bilirrubina directa no alcanza a completar su flujo a través de los conductos biliares del intestino, regurgitando y acumulándose en el hígado, siendo así capturada por los sinusoides hepáticos y aumentando su concentración en suero41. Con la cronicidad de la obstrucción biliar, los ácidos biliares acumulados en el hígado comienzan a dañar las células responsables de conjugar la bilirrubina indirecta derivada de hemólisis, en bilirrubina directa, lo cual también causa que el nivel sérico de bilirrubina indirecta aumente5,41. En el presente estudio, los niveles de bilirrubina directa e indirecta, aumentaron en los animales ligados. El grupo de animales con ligadura que no recibió tratamiento tuvo la media más alta de bilirrubina total de todos los grupos. Por otro lado, el grupo tratado con cafeína mostró una disminución en la bilirrubina indirecta, en comparación con el grupo ligado sin tratamiento, demostrando que la administración de CAF promovió un menor daño a las células responsables de la conjugación de la bilirrubina indirecta en bilirrubina directa. De acuerdo con la literatura, los niveles de bilirrubina total mayores a 2 o 3 mg/dL son suficientes para que el pigmento se filtre a la piel y las membranas mucosas y conduzca al desarrollo de ictericia5,41. En los dos grupos LCBC, la cantidad de bilirrubina fue mayor a 2 mg/dL, lo cual explica la visibilidad del intenso color amarillento en los animales después del día 7 del experimento.
También fue evidente la hepatomegalia. Esta condición se asocia frecuentemente con trastornos hepatobiliares y es causada por la retención de contenidos biliares en tejido hepático y por el daño difuso que resulta de esta acumulación42,43. En la evaluación histopatológica del hígado en los grupos con LCBC, ambas áreas presentaban leve distorsión arquitectónica del parénquima y áreas con fibrosis intensa, de forma similar a los resultados en otros estudios con el mismo modelo27,39,42. Los parámetros de distorsión arquitectónica, agrandamiento portal, proliferación ductal y fibrosis hepática fueron considerados moderados/pronunciados en todos los animales con ligadura, sin tratamiento.
Los miofibroblastos hepáticos, derivados de células de Ito y fibroblastos portales, son las principales células involucradas en la formación de fibrosis hepática44. Estas células expresan receptores de adenosina, los cuales cuando son activados (usualmente por lesión hepática), estimulan la formación de fibrosis por medio de miofibroblastos. La CAF es una antagonista de los receptores de la adenosina, evita la activación de dichos receptores y, en consecuencia, disminuye la formación de tejido fibrótico45. El TGF-β es la citoquina reguladora principal del hígado y una de sus funciones es activar las células de Ito, estimulando la formación de fibrosis46. De acuerdo con la literatura, los niveles de TGF-β se elevan en modelos experimentales de enfermedad hepática, pero con la administración de CAF, los niveles de TGF-β son menores, lo cual significa que existe menor activación de las células de Ito debido a la regulación a la baja de dicha citoquina47,48.
En estudios in vitro se ha observado que la CAF también previene la activación de células de Ito al inhibir el factor de transcripción Snail-1, el cual es esencial en la activación de dichas células. La CAF también activa la enzima Nrf2, la cual regula la expresión de proteínas antioxidantes. En consecuencia, actúa reduciendo el estrés oxidativo, el cual es una de las causas de fibrosis hepática30. Por medio de todos estos mecanismos, la CAF ejerce su efecto hepatoprotector, que resulta en menor daño hepático, llevando a una menor liberación de transaminasas en el torrente sanguíneo.
En el presente estudio, el tejido hepático de los animales con ligadura, tratados con CAF, tuvo en general un patrón histológico más similar al fisiológico. El daño hepático inducido pudo ser observado microscópicamente, pero fue menor al daño observado en el grupo LCBC sin tratamiento.
Como resultado, una dosis de 50 mg/kg/d, en presencia de fibrosis hepática colestásica, tuvo un efecto hepatoprotector, especialmente con respecto a la formación de tejido fibrótico, lo que corrobora su efecto en tejido hepático lesionado, como está descrito en estudios recientes30,45,47,48.
Con la encefalopatía hepática, los cambios microscópicos principales en el encéfalo son edema y astrocitos tipo II de Alzheimer49,50, los cuales son células modificadas que presentan inflamación, núcleos crecidos e inclusiones nucleares41. También se puede encontrar necrosis laminar y una apariencia espongiforme en las capas profundas de la corteza cerebral, la materia blanca subcortical, los núcleos basales y el cerebelo51.
En el presente estudio, los animales con ligadura sin tratamiento presentaron los parámetros característicos de encefalopatía, principalmente edema y astrocitos tipo II de Alzheimer. Estas características fueron clasificadas como acentuadas en el 100% de los animales, corroborando los hallazgos de otros estudios en la literatura28,52.
El resultado del análisis histológico de las laminillas de encéfalo del grupo LCBC tratado con CAF fue satisfactorio, ya que la administración de CAF produjo una disminución significativa de edema, astrocitos tipo II de Alzheimer, el aspecto espongiforme y necrosis laminar. Los astrocitos tipo II de Alzheimer y el edema, los cambios histológicos principales observados en encefalopatía49,50, fueron clasificados como pronunciados en solo 20% de los animales, mientras que en el grupo LCBC + H2O, fueron pronunciados en el 100% de los animales.
En los últimos días del experimento, los animales del grupo LCBC sin tratamiento estaban claramente más letárgicos, confundidos, desorientados y apáticos que los animales en el grupo con tratamiento. Durante el gavaje, los animales no se resistieron a la administración de H2O, a diferencia de otros grupos o durante otros momentos del experimento. La consciencia disminuida fue demostrada y confirmada por la PCA, durante la cual, los animales mostraron una disminución en dos de los tres parámetros utilizados para evaluar la actividad exploratoria y locomotriz29. Este estado de consciencia es caracterizado como grado II o grado III de encefalopatía, de acuerdo con los criterios de West Haven (tabla 1), lo cual fue lo esperado de acuerdo con el modelo de encefalopatía elegido28,53,54. Estos hallazgos corroboran los resultados de otros estudios que utilizaron una metodología similar para inducir encefalopatía hepática28,52,55,56.
En el grupo LCBC suplementado con CAF, no se observaron signos de letargia o postración. Los valores medios de los tres parámetros evaluados en la PCA fueron similares a los de los grupos control, lo cual muestra que la administración de CAF evitó que los animales tuvieran signos característicos de los grados II y III de los criterios de West Haven29,53.
Se sabe que la CAF tiene un efecto modulador en el estado de consciencia debido a su efecto estimulador del sistema nervioso central, antagonizando a los receptores de adenosina25,57. La CAF también disminuye la concentración de amonio en suero57, al aumentar la actividad de varias enzimas en el ciclo de la urea, especialmente carbamoil fosfato sintetasa 122,23. Cataliza la reacción de formación de urea, incrementando la síntesis del compuesto, utilizando amonio como sustrato, el cual, en exceso, puede llevar al desarrollo de encefalopatía hepática24,53. Por medio de estos mecanismos, la CAF, a una dosis de 50 mg/kg/d, evitó la evolución de la encefalopatía hepática hacia grados más severos. En el cuerpo humano, esa dosis es equivalente a 280 mg/d para un adulto de 70 kg, lo cual corresponde a dos o tres tazas de café al día33. Esa cantidad de CAF es extremadamente segura. Los efectos secundarios, como ansiedad, trastornos bipolares, insomnio, agitación psicomotora y taquicardia, son observadas solo con dosis mayores (> 400 mg/d)58. Por lo tanto, la CAF sería una alternativa viable para el manejo de pacientes con enfermedad hepática y/o encefalopatía hepática.
Con base en lo anterior, y con los resultados del presente estudio, concluimos que el efecto de la cafeína como estimulante del sistema nervioso central, asociado con su acción catalítica del ciclo de la urea y su efecto hepatoprotector de atenuar las lesiones hepáticas, evitó el progreso de la encefalopatía hepática inducida, a grados más severos. También impidió la aparición de signos clínicos y la disminución de la actividad exploratoria y locomotriz, característicos de los grados II y III de los criterios de West Haven29, y atenuó la aparición de cambios histológicos en el encéfalo. Se recomienda ampliamente la realización de futuros estudios que midan el amonio cerebral y determinen las enzimas del ciclo de la urea, para una mejor comprensión de la fisiopatología involucrada en la prevención de gravedad de encefalopatía hepática, con el uso de cafeína.
FinanciaciónEl presente trabajo fue apoyado por la Facultad Evangélica Mackenzie de Paraná (beca número 03/2017,082017/072018). La fuente de financiamiento no tuvo involucramiento en el diseño del estudio, recolección y análisis de datos, decisión de publicar o preparación del manuscrito.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.