La enfermedad hepática inducida por medicamentos (drug-induced liver injury [DILI], por sus siglas en inglés) es una condición poco frecuente; sin embargo, es causante del 40-50% de las insuficiencias hepáticas agudas1,2. Existen 3 patrones de daño: hepatocelular, colestásico y mixto, representando el patrón colestásico el 20-40% de los casos3,4. Sus manifestaciones van desde las alteraciones bioquímicas en ausencia de síntomas, hasta la insuficiencia hepática aguda y el daño hepático crónico. El diagnóstico es de exclusión, basado en evidencia circunstancial. En la mayoría de los casos, el cuadro del paciente mejora con el retiro del medicamento responsable del daño5.
Se presenta el caso de un masculino de 38 años con antecedente de etilismo de 15 años de evolución con 21.6 g/día de alcohol, con fecha de último consumo etílico (1 l de fermentados) de una semana previa al inicio del cuadro clínico, sin llegar a la embriaguez. Con aplicación intramuscular de esteroides anabólicos basados en testosterona 250mg, nandrolona 100mg y estanozolol 50mg, una ampolleta cada semana, durante 31 días.
Un día posterior al retiro de dichos fármacos, presentó un cuadro clínico caracterizado por ictericia mucotegumentaria, prurito generalizado y náuseas. A su ingreso a la unidad de urgencias presentó signos vitales dentro de los parámetros normales; en la exploración física, ictericia, sin asterixis, dolor abdominal a nivel del hipocondrio derecho, EVA 5/10. Se solicitaron análisis de laboratorio, de los cuales destacaron: bilirrubina total 33.87mg/dl (0.1-1.0), bilirrubina directa 26.41mg/dl (0.1-0.25), ALT 49 IU/l (10-40), AST 65 IU/l (15-41), GGT 60 IU/l (9-40) y fosfatasa alcalina 207 IU/l (38-126). Se realizó USG de hígado y vías biliares, sin evidenciar dilatación de la vía biliar, vasculatura permeable, morfología hepática normal, y colangiorresonancia magnética, sin alteraciones. Se solicitaron pruebas analíticas especiales como parte del abordaje de una colestasis donde se reportaron: serología de virus hepatotropos (VHA, VHB, VHC y VHE) negativos, citomegalovirus y virus de Epstein-Barr, negativos. Perfil serológico de hepatopatías autoinmunes con reporte de ANA (IFI), anticuerpos antimitocondriales, anticuerpos antimúsculo liso y anti-LKM1, negativos.
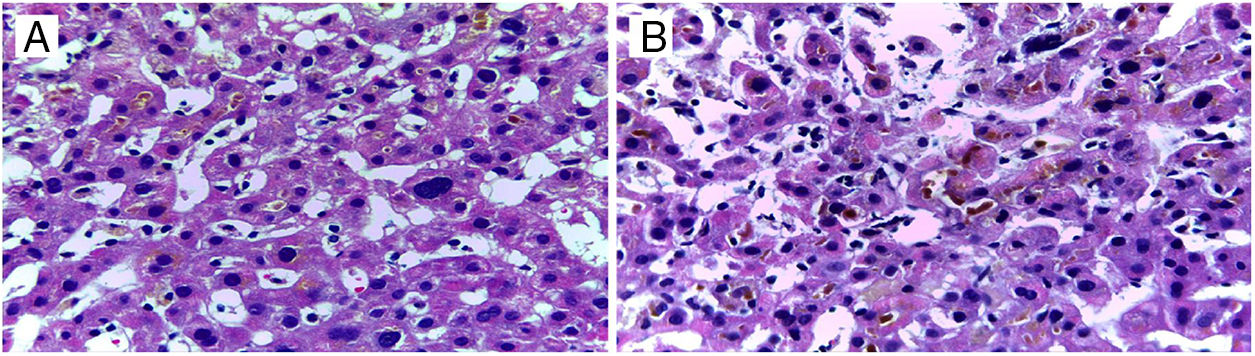
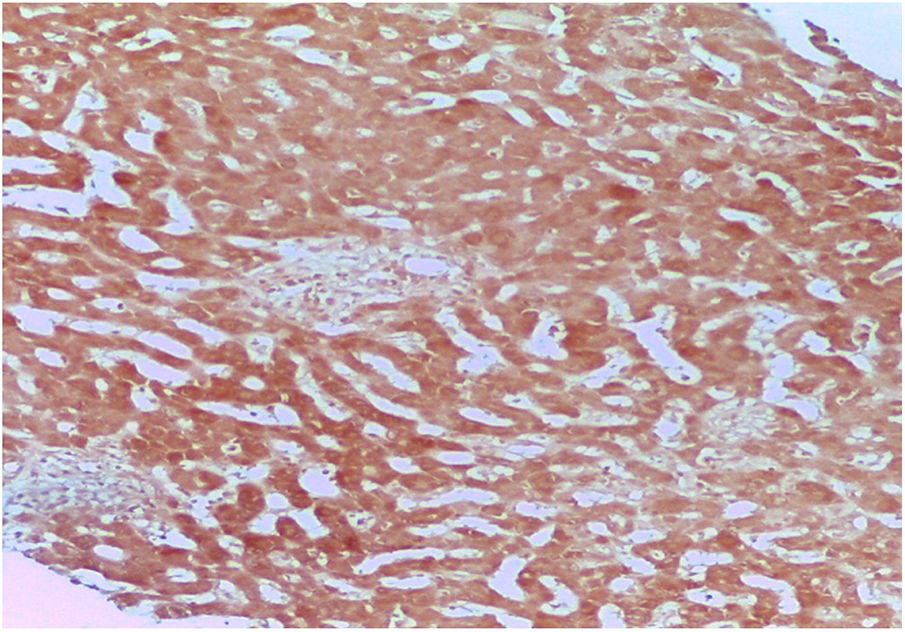
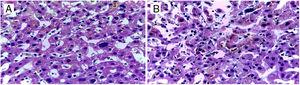
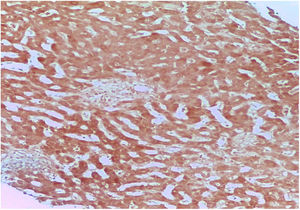
Ante la sospecha de una DILI secundaria a la aplicación de esteroides anabólicos, se calculó el valor R en 0.27, indicando un patrón de lesión colestásico. Se realizó biopsia percutánea de tejido hepático con reporte de colestasis intracitoplasmática y canalicular acentuada de predominio perivenular, zonas 2 y 3 (figs. 1 y 2). Se calculó el puntaje del Council for International Organizations of Medical Scientists/Roussel Uclaf Assessment Method (CIOMS/RUCAM por sus siglas en inglés) de 9 puntos indicando una DILI definitiva.
Durante su hospitalización, se inició manejo con metilprednisolona 60mg cada 24 h con posterior dosis reducción con prednisona, S-adenosilmetionina (SAMe) 500mg cada 12 h y ácido ursodesoxicólico 15mg/kg/día dividido en 3tomas, con adecuada evolución clínica durante 5 días de estancia intrahospitalaria. Posterior al egreso, su evolución fue favorable, normalizando sus pruebas de función hepática 4 meses posteriores a la suspensión de los esteroides anabólicos.
A pesar de que la información epidemiológica sobre el efecto tóxico de los fármacos en el hígado es escasa, se sabe que la incidencia está aumentando de forma paralela a la introducción de nuevos medicamentos, al incremento de la esperanza de vida y a la polimedicación. El diagnóstico de certeza es complicado y la notificación por profesionales sanitarios de reacciones adversas a fármacos es escasa1-3. Por lo que respecta a los esteroides anabólicos, este problema de infranotificación es aún mayor, por tratarse de sustancias que a menudo se consumen sin prescripción médica.
Los esteroides anabólicos pueden ser de consumo por vía oral o parenteral, con muy pocas indicaciones aceptadas actualmente. La hepatotoxicidad inducida por esteroides anabólicos es dependiente de la dosis y predecible. La forma de presentación más frecuente es la hepatitis colestásica, habiéndose descrito también otros tipos de lesiones asociadas a la utilización de altas dosis: colestasis pura o blanda, hepatitis colestásica aguda, lesión hepatocelular aguda y tumores hepáticos4.
En el caso que presentamos, el paciente presentaba ictericia severa, con elevación mínima de enzimas hepáticas, compatible con una colestasis pura. Hubo una clara relación temporal entre el inicio/fin del tratamiento y la aparición/desaparición de los síntomas, respectivamente. Además, se excluyeron otras causas de daño hepático. Con todo ello, y aplicando la escala CIOMS RUCAM de valoración de hepatotoxicidad5-7, el caso obtuvo 9 puntos, lo que permite concluir como altamente probable o definitiva la hepatotoxicidad por consumo de dichos anabólicos. Además, existe una página de los Institutos Nacionales de Salud de Estados Unidos de América (www.livertox.nih.gov) que describe casos de hepatotoxicidad de fármacos, así como el mecanismo del daño hepático que pueden ocasionar.
La biopsia hepática de nuestro paciente mostró un patrón canalicular compatible con las características clínicas y bioquímicas que presentó, teniendo una adecuada evolución posterior a la suspensión de dichos esteroides anabólicos.
El uso de SAMe, como fue en el caso de nuestro paciente, tuvo una respuesta favorable en conjunto con el ácido ursodesoxicólico, en donde diferentes metaanálisis han determinado la eficacia de la SAMe en la disminución del prurito y los valores séricos de bilirrubina asociados a la colestasis, comparado con el placebo8.
El pronóstico a largo plazo para la DILI, en general, depende de la presentación clínica y bioquímica inicial del paciente9. El interés de este caso radica en el abordaje para llegar al diagnóstico de la DILI, el adecuado tratamiento y la buena evolución del paciente a pesar de los altos niveles de bilirrubina total al inicio.
Responsabilidades éticasLos autores declaran que este artículo no contiene información personal que permita identificar al paciente, cumpliendo con la normativa vigente y la autorización del comité de investigación y ética de la institución.
FinanciaciónNo se recibió patrocinio de ningún tipo para llevar a cabo este artículo.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
A las Divisiones de Medicina Interna y de Anatomía patológica del Hospital General «Dr. Manuel Gea González», Ciudad de México, México.