Una de las características más importantes de la desnutrición en la cirrosis hepática es la pérdida de masa muscular y agotamiento grave de la reserva de proteínas, afectando de manera secundaria al metabolismo energético; esto influye en el estado nutricional y en la evolución de algunas complicaciones de la enfermedad.
El tratamiento nutricional es uno de los principales factores en el tratamiento integral en estos pacientes, ya que a través de la alimentación se busca lograr un adecuado consumo de energía que provea los macro- y micronutrientes necesarios a fin de evitar o corregir la desnutrición. La ESPEN recomienda un aporte calórico de 30-40kcal/kg/día, en el cual los hidratos de carbono provean del 45-60% del aporte energético diario, y las proteínas aporten de 1.0-1.5g/kg/día, el resto del gasto energético total debe ser cubierto por lípidos.
Se ha demostrado que la administración de aminoácidos de cadena ramificada no solo resulta benéfico para contrarrestar la desnutrición, sino también como tratamiento coadyuvante en complicaciones específicas como encefalopatía hepática, ascitis e incluso en carcinoma hepatocelular, por lo que tienen un papel favorable en el pronóstico y la calidad de vida.
Debido a esto, el uso de aminoácidos de cadena ramificada en pacientes con cirrosis hepática en estadios avanzados, y particularmente cuando aparecen las complicaciones, debería considerarse como parte del tratamiento nutricional.
One of the most important characteristics of malnutrition is the loss of muscle mass and the severe depletion of the protein reserve, secondarily affecting energy metabolism. That impacts nutritional status and the progression of disease-related complications.
Nutritional treatment is one of the main factors in the comprehensive management of those patients. Achieving adequate energy intake that provides the macronutrients and micronutrients necessary to prevent or correct malnutrition is attempted through dietary measures. ESPEN, the European Society for Clinical Nutrition and Metabolism, recommends a caloric intake of 30-40kcal/kg/day, in which carbohydrates provide 45-60% of the daily energy intake and proteins supply 1.0-1.5g/kg/day. The remaining portion of the total energy expenditure should be covered by lipids.
The administration of branched-chain amino acids has been shown to be beneficial not only in counteracting malnutrition, but also as a coadjuvant treatment in specific complications, thus playing a favorable role in outcome and quality of life.
Therefore, branched-chain amino acids should be considered part of nutritional treatment in patients with advanced stages of cirrhosis of the liver, particularly in the presence of complications.
La cirrosis hepática es una enfermedad difusa del hígado que altera su estructura y su función, siendo la etapa final de todas las enfermedades hepáticas crónicas1. En la historia natural de la enfermedad se observan dos fases, compensada y descompensada. La cirrosis compensada se caracteriza por ser asintomática o presentar síntomas inespecíficos mientras que la cirrosis descompensada se caracteriza por la aparición de complicaciones derivadas de la hipertensión portal como sangrado variceal, encefalopatía hepática y ascitis, entre otras2.
Una de las complicaciones más frecuentes que se observa tanto en cirrosis compensada como descompensada es la desnutrición3. Su presencia está asociada con mayor mortalidad, con desenlaces quirúrgicos adversos y con el aumento en el riesgo de desarrollo de complicaciones propias de la cirrosis4.
En el espectro de la desnutrición se observa la pérdida progresiva de la masa muscular conocida como sarcopenia, así como un síndrome que involucra la pérdida de masa muscular, masa grasa y peso, asociado al estado proinflamatorio de la enfermedad, conocido como caquexia3. La etiología de la desnutrición en cirrosis es multifactorial y se relaciona principalmente con la disminución de la ingesta de alimentos que puede ser causada por el aumento de diversas citocinas proinflamatorias con efecto anorexigénico, catabolismo aumentado, y/o por la presencia de algunas complicaciones de la cirrosis como ascitis y encefalopatía hepática5. La desnutrición en estos pacientes también se relaciona con una marcada disminución en la oxidación de la glucosa, con mayor catabolismo de grasa y proteína similar a la observada en sujetos sanos después de 2 a 3 días de inanición, sufriendo una marcada pérdida de masa muscular y el agotamiento grave de proteínas con la consecuente alteración de la función del tejido que los pone en alto riesgo de morbimortalidad6,7.
Tratamiento nutricional en cirrosis hepáticaTratamiento dietéticoEl tratamiento dietético ha mostrado beneficios tanto en estadios tempranos como en estadios avanzados de la enfermedad. De manera inicial, la restricción proteica era considerada como parte del tratamiento estándar de la cirrosis, sin embargo, esta práctica se fundamentaba en observaciones y en estudios no controlados y en la idea de que las proteínas de la dieta pueden inducir encefalopatía hepática (EH)8. Anteriormente se sugirió que el aporte de dosis elevadas de proteínas en la dieta puede desencadenar o precipitar EH9. Esta idea nació en 1893 donde observaron perros con derivación porto-cava y con una alimentación basada en productos de origen animal causaba síntomas neurológicos, posteriormente, se observó que esta condición mejoraba cuando estos animales eran alimentados con una calidad de proteínas diferente10. En 1954, Sherlock et al. mostraron por primera vez que, en pacientes cirróticos, los síntomas de EH se controlaron cuando se introdujo una dieta baja en proteínas (20g/día)11. Basándose en estas observaciones, las prescripciones dietéticas adquirieron una especial relevancia y la restricción de la ingesta de proteínas en pacientes cirróticos con EH se convirtió en una práctica común.
Estudios posteriores con mayor número de pacientes y mayor rigor metodológico mostraron que contrario a lo que se creía, no existía un beneficio importante en la evolución de EH episódica al restringir la cantidad de proteína en la dieta y que esta restricción podía incluso causar mayor degradación proteica y favorecer la aparición de esta complicación12. Por lo anterior, la restricción proteica ya no es recomendada en la actualidad y se sabe que debe evitarse de modo general, ya que puede empeorar el estado nutricional sin mejorar la EH.
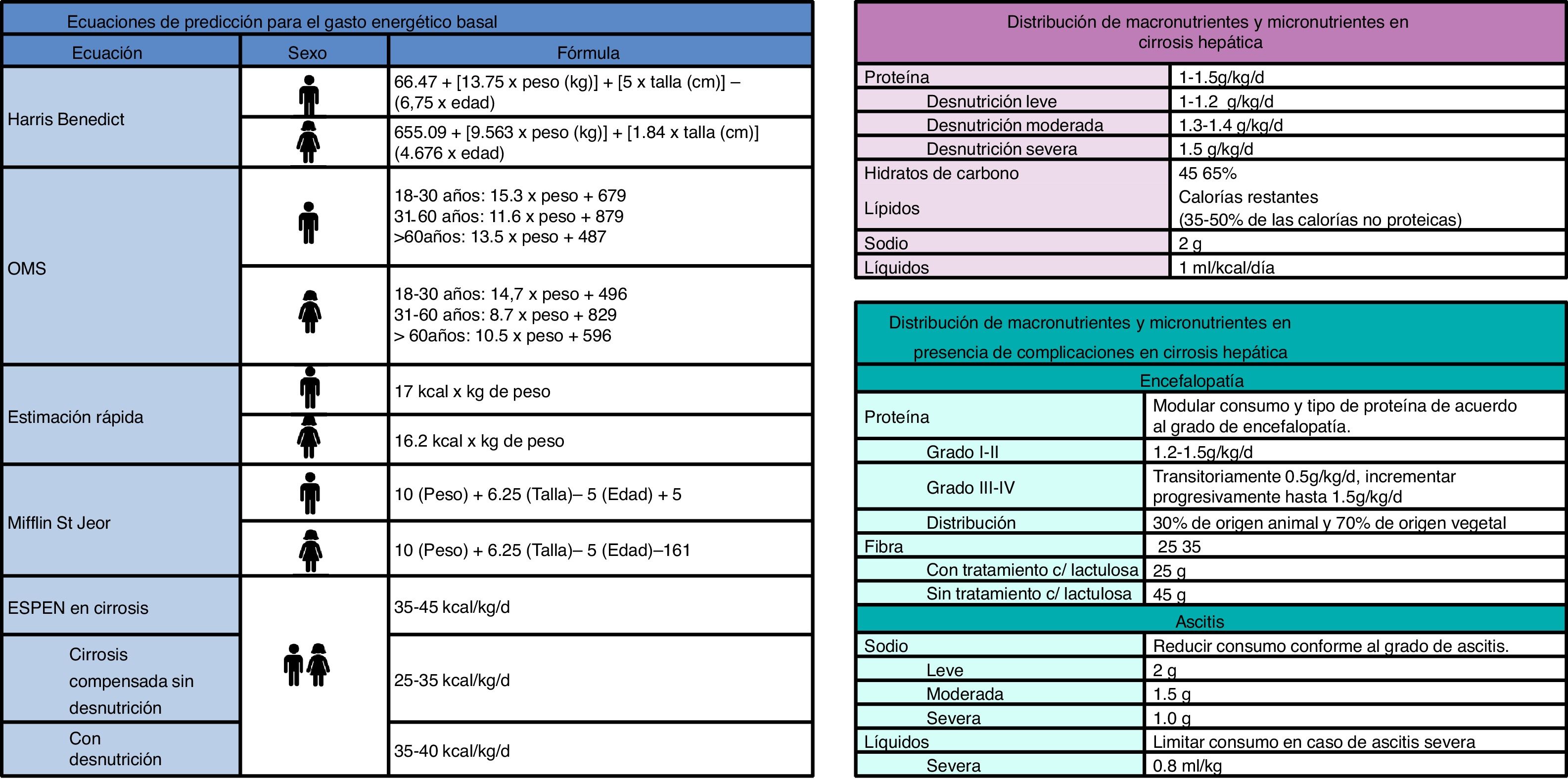
Recomendaciones nutricionalesRecomendaciones de la Sociedad Europea de Nutrición Clínica y Metabolismo (ESPEN)En relación a macronutrientes la ESPEN sugiere que los hidratos de carbono (HC) aporten del 45 al 65% de la energía total de la dieta, la recomendación de proteína es de 1.0-1.5g/kg de peso al día; la cantidad exacta debe determinarse de acuerdo con el estado nutricional del paciente; se recomienda un 60-70% de proteínas de origen vegetal y el resto de origen animal, y, una vez establecido el aporte de HC y proteínas, el resto de las calorías deben ser cubiertas por lípidos. En aquellos pacientes que presentan ascitis y/o edema se debe restringir la cantidad de sodio (<2g/día). Y, en el caso de fibra dietética se ha recomendado un consumo de 30g/día, aumentando su requerimiento en pacientes con encefalopatía hepática6 (fig. 1). Además, la ESPEN sustenta la suplementación con fórmulas de aminoácidos de cadena ramificada (AACR) en pacientes con encefalopatía hepática mediante vía enteral, así como suplementación oral en cirrosis avanzada. La suplementación con AACR también se puede considerar en niños en lista de espera para trasplante hepático6.
La recomendación de líquidos según la Sociedad Americana para la Nutrición Parenteral y Enteral estipula que el consumo ideal para cualquier adulto debería ser de 1ml/kcal/día13. La pérdida de agua corporal puede deberse a varios factores (diarrea, heridas, drenajes quirúrgicos, drenajes nasogástricos, secreciones pancreáticas, secreciones urinarias, uso de diuréticos). Se debe hacer una restricción de líquidos cuando exista hiponatremia (niveles de sodio<120 mmol/l)5.
Colación nocturnaUna de las estrategias más utilizadas y sustentadas por la literatura es la adición de una colación nocturna que contenga HC, ya que estudios previos han demostrado que mejora la masa muscular y el metabolismo energético al cubrir las necesidades energéticas requeridas por la noche, que además se aumentan por el hipercatabolismo observado en cirrosis14. Las calorías derivadas de dichas colaciones pueden oscilar entre 200 y 400kcal y deben contener HC complejos para prolongar la absorción durante la noche y proporcionar fibra dietética. Además para su prescripción se deben considerar las preferencias del paciente para asegurar una buena adherencia15,16.
En un ensayo clínico publicado en 2006, se evaluó el efecto del consumo de una porción de arroz de 200kcal en pacientes con cirrosis hepática en estadios Child A como colación nocturna observando una clara mejoría en los pacientes que consumían la colación, mejorando el metabolismo medido mediante calorimetría indirecta17.
Además de la colación nocturna con HC complejos, otra estrategia sustentada por la literatura es la prescripción de una colación nocturna con AACR. De hecho, un estudio que comparó la colación nocturna a base de alimentos ordinarios con una colación de AACR, observó que la colación nocturna con la mezcla de AACR, mejoró significativamente los parámetros nutricionales y el estado catabólico. Además, la mezcla de AACR elevó el balance de nitrógeno y el nivel de albúmina sérica en comparación con un alimento isocalórico14.
Cálculo energéticoEl estándar de oro para estimar la cantidad de energía consumida es la calorimetría indirecta, de no contar con este recurso se sugiere implementar las recomendaciones de la ESPEN, la cual sugiere un aporte calórico de 30-40kcal/kg de peso al día, basándose en el peso real del paciente, y cuando hay presencia de ascitis, en el peso ideal o hacer uso de fórmulas de estimación energética (fig. 1).
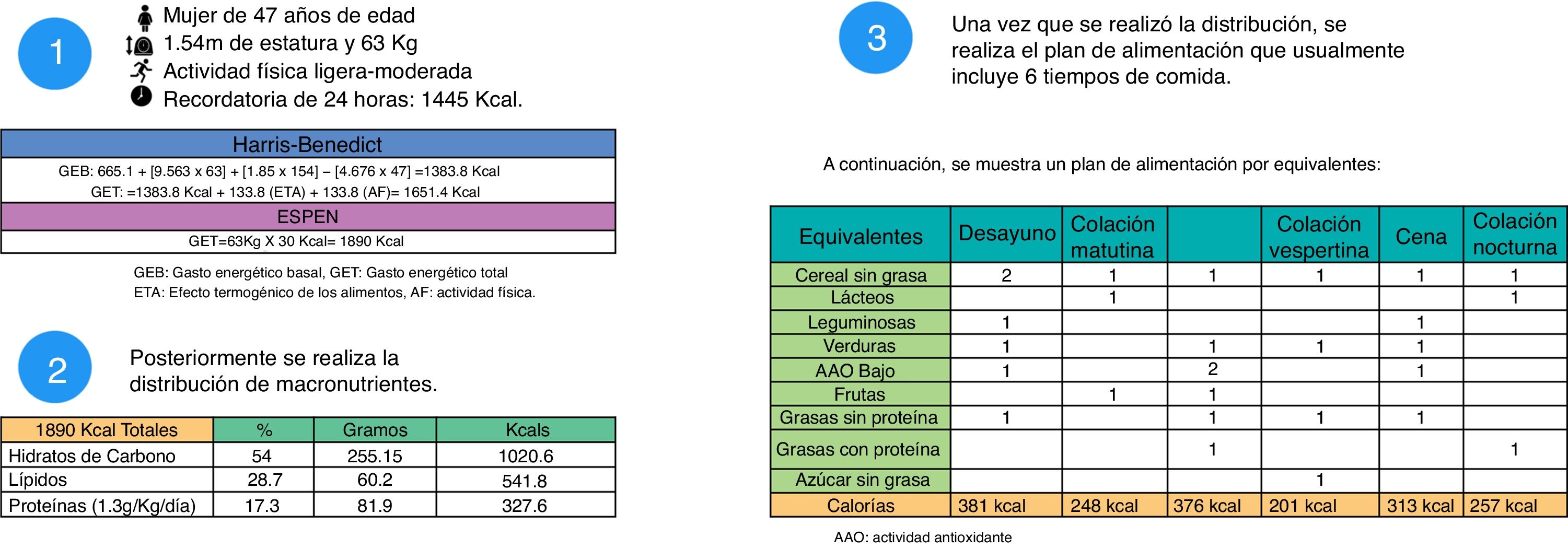
Para realizar un plan nutricional en pacientes con cirrosis se requiere conocer el estadio de la enfermedad, complicaciones presentes, comorbilidades, actividad física realizada y datos nutricionales, así como la cantidad de kilocalorías (kcals) requeridas. Los requerimientos de energía pueden estimarse mediante pruebas como la calorimetría, sin embargo, al ser un método poco accesible usualmente se utilizan las ecuaciones de predicción. Para realizar el cálculo es necesario conocer el sexo, talla y edad del paciente además de los datos mencionados anteriormente. Existen diversas fórmulas de predicción para obtener el gasto energético basal de acuerdo a las características de cada paciente, en personas sanas se puede hacer uso de las fórmulas de la Organización Mundial de la Salud, y para pacientes con obesidad se sugiere Mifflin-St. Jeor. Sin embargo usualmente la fórmula más utilizada en población general es Harris-Benedict que se divide para mujeres y hombres. Una vez obtenido el gasto energético basal, se agregan las kcals del efecto termogénico de los alimentos y de la actividad física, el resultado final es el gasto energético total de un sujeto18. En pacientes con cirrosis hepática esta fórmula tiende a subestimar el gasto energético, por ello en este grupo de pacientes se sugiere utilizar las recomendaciones de la ESPEN (fig. 2)6.
Suplementación nutricional en cirrosis hepáticaCuando el consumo dietético no es suficiente para mantener los requerimientos energéticos de un paciente, se ha propuesto la suplementación oral con fórmulas hipercalóricas o hiperproteicas, de esta manera el paciente puede recibir la energía necesaria para superar el estado catabólico característico de la enfermedad19. Entre los abordajes con suplementación que se han descrito se encuentran la suplementación con fórmulas de AACR, siendo estos los que han reportado mayor utilidad en la mejoría del estado nutricional y complicaciones asociadas como EH, fatiga física y mental y la función del sistema inmunológico20.
Formulas hipercalóricasEn relación a las fórmulas hipercalóricas, un estudio mostró una mejoría significativa en el balance de nitrógeno en pacientes que recibieron alimentación enteral con una fórmula hipercalórica inmediatamente después de ser sometidos a trasplante hepático. Otro estudio utilizó un suplemento hipercalórico oral en pacientes con diagnóstico de sarcopenia en listados para trasplante hepático, la suplementación se mantuvo hasta el día del trasplante, con esto se observó una mejora significativa en la masa muscular y la fuerza muscular, así como una tendencia hacia una mayor supervivencia pretrasplante21.
La administración enteral de dichas fórmulas se limita únicamente a aquellos pacientes que no toleren la vía oral por alguna comorbilidad presente. Algunos artículos han sugerido que la vía enteral es más eficiente que la oral en pacientes cirróticos, aunque el paciente tolere la vía oral. Sin embargo, un estudio reciente que incluyó pacientes hospitalizados con hepatitis alcohólica no pudo demostrar mejoría en la supervivencia en pacientes que recibieron nutrición enteral intensiva, en comparación con aquellos que recibieron nutrición oral convencional, además los riesgos reportados como neumonía por aspiración, hacen que la vía enteral no se recomiende fuera de las indicaciones convencionales22.
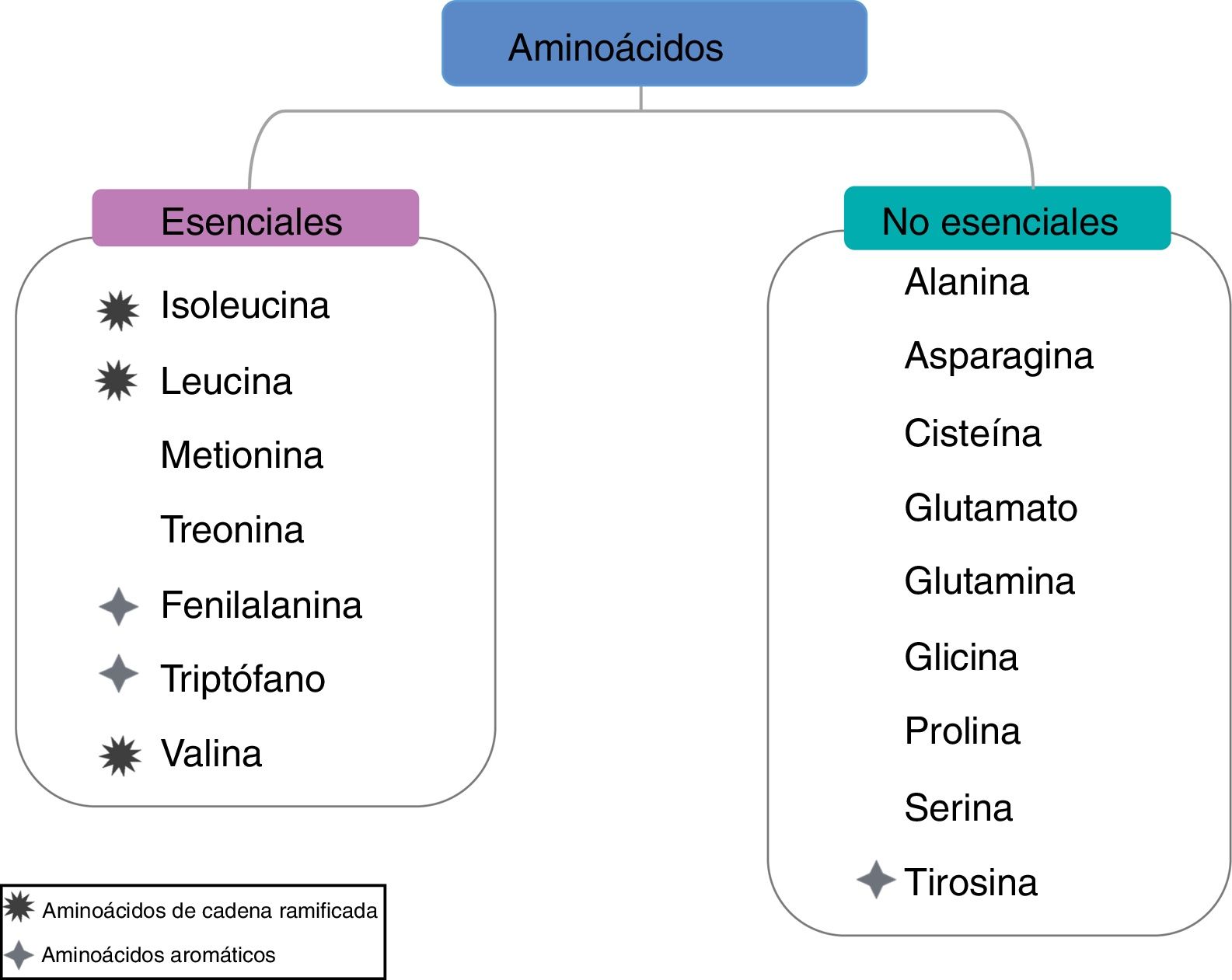
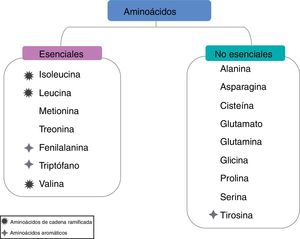
Aminoácidos de cadena ramificadaLa relación baja de los AACR séricos a los aminoácidos aromáticos es un proceso característico de la cirrosis causada por varios factores, incluyendo la reducción de la ingesta dietética, el hipercatabolismo y la detoxificación del amonio en el músculo esquelético. Además, reduce la biosíntesis y la secreción de albúmina en los hepatocitos y también se asocia con un mal pronóstico de los pacientes con enfermedad hepática crónica. Los AACR tienen cadenas laterales alifáticas con un punto de ramificación, y comprenden valina, leucina e isoleucina, y no son solo un constituyente de la proteína, sino también una fuente de glutamato, lo que facilita la desintoxicación del amonio mediante la síntesis de glutamina, esta reacción es catalizada por medio de la glutamina sintetasa presente en el músculo esquelético (fig. 3)23.
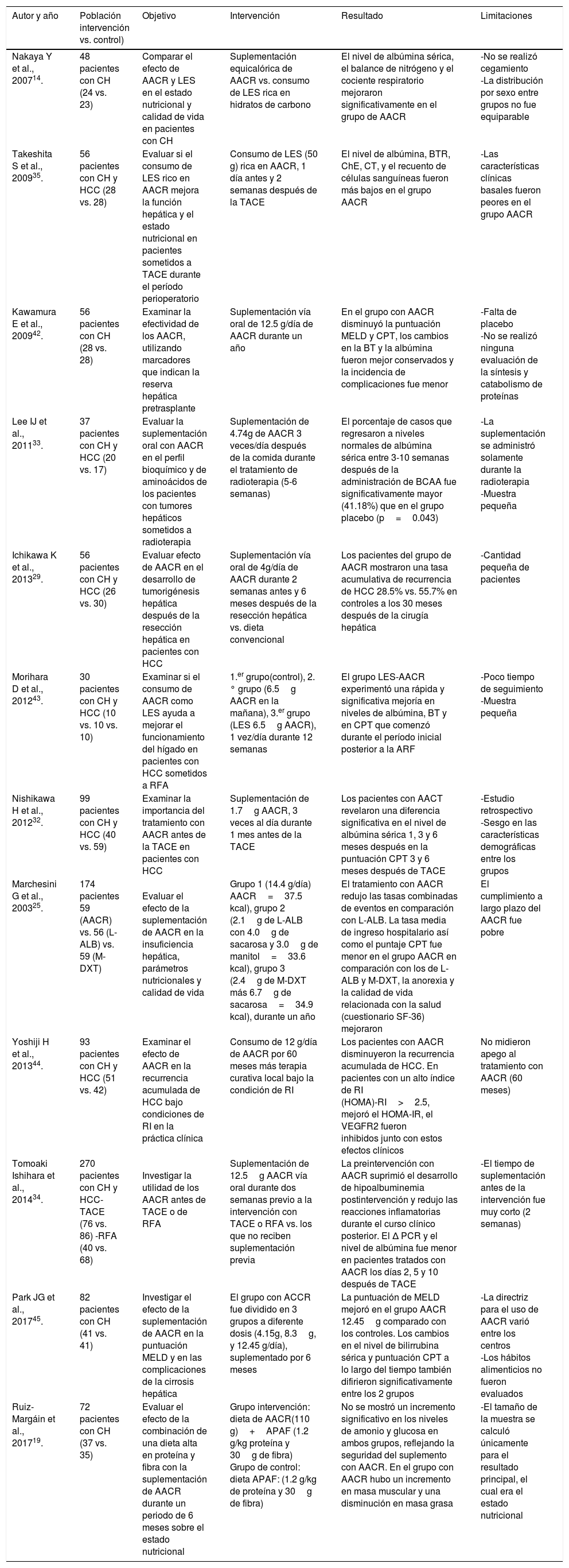
Diversos estudios han demostrado que la administración de AACR estimula la síntesis de proteína hepática, contribuyendo a mejorar el estado nutricional y la calidad de vida de los pacientes con cirrosis hepática24 (tabla 1).
Efecto de los AACR en diferentes desenlaces de la cirrosis hepática
| Autor y año | Población intervención vs. control) | Objetivo | Intervención | Resultado | Limitaciones |
|---|---|---|---|---|---|
| Nakaya Y et al., 200714. | 48 pacientes con CH (24 vs. 23) | Comparar el efecto de AACR y LES en el estado nutricional y calidad de vida en pacientes con CH | Suplementación equicalórica de AACR vs. consumo de LES rica en hidratos de carbono | El nivel de albúmina sérica, el balance de nitrógeno y el cociente respiratorio mejoraron significativamente en el grupo de AACR | -No se realizó cegamiento -La distribución por sexo entre grupos no fue equiparable |
| Takeshita S et al., 200935. | 56 pacientes con CH y HCC (28 vs. 28) | Evaluar si el consumo de LES rico en AACR mejora la función hepática y el estado nutricional en pacientes sometidos a TACE durante el período perioperatorio | Consumo de LES (50 g) rica en AACR, 1 día antes y 2 semanas después de la TACE | El nivel de albúmina, BTR, ChE, CT, y el recuento de células sanguíneas fueron más bajos en el grupo AACR | -Las características clínicas basales fueron peores en el grupo AACR |
| Kawamura E et al., 200942. | 56 pacientes con CH (28 vs. 28) | Examinar la efectividad de los AACR, utilizando marcadores que indican la reserva hepática pretrasplante | Suplementación vía oral de 12.5 g/día de AACR durante un año | En el grupo con AACR disminuyó la puntuación MELD y CPT, los cambios en la BT y la albúmina fueron mejor conservados y la incidencia de complicaciones fue menor | -Falta de placebo -No se realizó ninguna evaluación de la síntesis y catabolismo de proteínas |
| Lee IJ et al., 201133. | 37 pacientes con CH y HCC (20 vs. 17) | Evaluar la suplementación oral con AACR en el perfil bioquímico y de aminoácidos de los pacientes con tumores hepáticos sometidos a radioterapia | Suplementación de 4.74g de AACR 3 veces/día después de la comida durante el tratamiento de radioterapia (5-6 semanas) | El porcentaje de casos que regresaron a niveles normales de albúmina sérica entre 3-10 semanas después de la administración de BCAA fue significativamente mayor (41.18%) que en el grupo placebo (p=0.043) | -La suplementación se administró solamente durante la radioterapia -Muestra pequeña |
| Ichikawa K et al., 201329. | 56 pacientes con CH y HCC (26 vs. 30) | Evaluar efecto de AACR en el desarrollo de tumorigénesis hepática después de la resección hepática en pacientes con HCC | Suplementación vía oral de 4g/día de AACR durante 2 semanas antes y 6 meses después de la resección hepática vs. dieta convencional | Los pacientes del grupo de AACR mostraron una tasa acumulativa de recurrencia de HCC 28.5% vs. 55.7% en controles a los 30 meses después de la cirugía hepática | -Cantidad pequeña de pacientes |
| Morihara D et al., 201243. | 30 pacientes con CH y HCC (10 vs. 10 vs. 10) | Examinar si el consumo de AACR como LES ayuda a mejorar el funcionamiento del hígado en pacientes con HCC sometidos a RFA | 1.er grupo(control), 2.° grupo (6.5g AACR en la mañana), 3.er grupo (LES 6.5g AACR), 1 vez/día durante 12 semanas | El grupo LES-AACR experimentó una rápida y significativa mejoría en niveles de albúmina, BT y en CPT que comenzó durante el período inicial posterior a la ARF | -Poco tiempo de seguimiento -Muestra pequeña |
| Nishikawa H et al., 201232. | 99 pacientes con CH y HCC (40 vs. 59) | Examinar la importancia del tratamiento con AACR antes de la TACE en pacientes con HCC | Suplementación de 1.7g AACR, 3 veces al día durante 1 mes antes de la TACE | Los pacientes con AACT revelaron una diferencia significativa en el nivel de albúmina sérica 1, 3 y 6 meses después en la puntuación CPT 3 y 6 meses después de TACE | -Estudio retrospectivo -Sesgo en las características demográficas entre los grupos |
| Marchesini G et al., 200325. | 174 pacientes 59 (AACR) vs. 56 (L-ALB) vs. 59 (M-DXT) | Evaluar el efecto de la suplementación de AACR en la insuficiencia hepática, parámetros nutricionales y calidad de vida | Grupo 1 (14.4 g/día) AACR=37.5 kcal), grupo 2 (2.1g de L-ALB con 4.0g de sacarosa y 3.0g de manitol=33.6 kcal), grupo 3 (2.4g de M-DXT más 6.7g de sacarosa=34.9 kcal), durante un año | El tratamiento con AACR redujo las tasas combinadas de eventos en comparación con L-ALB. La tasa media de ingreso hospitalario así como el puntaje CPT fue menor en el grupo AACR en comparación con los de L-ALB y M-DXT, la anorexia y la calidad de vida relacionada con la salud (cuestionario SF-36) mejoraron | El cumplimiento a largo plazo del AACR fue pobre |
| Yoshiji H et al., 201344. | 93 pacientes con CH y HCC (51 vs. 42) | Examinar el efecto de AACR en la recurrencia acumulada de HCC bajo condiciones de RI en la práctica clínica | Consumo de 12 g/día de AACR por 60 meses más terapia curativa local bajo la condición de RI | Los pacientes con AACR disminuyeron la recurrencia acumulada de HCC. En pacientes con un alto índice de RI (HOMA)-RI>2.5, mejoró el HOMA-IR, el VEGFR2 fueron inhibidos junto con estos efectos clínicos | No midieron apego al tratamiento con AACR (60 meses) |
| Tomoaki Ishihara et al., 201434. | 270 pacientes con CH y HCC-TACE (76 vs. 86) -RFA (40 vs. 68) | Investigar la utilidad de los AACR antes de TACE o de RFA | Suplementación de 12.5g AACR vía oral durante dos semanas previo a la intervención con TACE o RFA vs. los que no reciben suplementación previa | La preintervención con AACR suprimió el desarrollo de hipoalbuminemia postintervención y redujo las reacciones inflamatorias durante el curso clínico posterior. El Δ PCR y el nivel de albúmina fue menor en pacientes tratados con AACR los días 2, 5 y 10 después de TACE | -El tiempo de suplementación antes de la intervención fue muy corto (2 semanas) |
| Park JG et al., 201745. | 82 pacientes con CH (41 vs. 41) | Investigar el efecto de la suplementación de AACR en la puntuación MELD y en las complicaciones de la cirrosis hepática | El grupo con ACCR fue dividido en 3 grupos a diferente dosis (4.15g, 8.3g, y 12.45 g/día), suplementado por 6 meses | La puntuación de MELD mejoró en el grupo AACR 12.45g comparado con los controles. Los cambios en el nivel de bilirrubina sérica y puntuación CPT a lo largo del tiempo también difirieron significativamente entre los 2 grupos | -La directriz para el uso de AACR varió entre los centros -Los hábitos alimenticios no fueron evaluados |
| Ruiz-Margáin et al., 201719. | 72 pacientes con CH (37 vs. 35) | Evaluar el efecto de la combinación de una dieta alta en proteína y fibra con la suplementación de AACR durante un periodo de 6 meses sobre el estado nutricional | Grupo intervención: dieta de AACR(110 g)+APAF (1.2 g/kg proteína y 30g de fibra) Grupo de control: dieta APAF: (1.2 g/kg de proteína y 30g de fibra) | No se mostró un incremento significativo en los niveles de amonio y glucosa en ambos grupos, reflejando la seguridad del suplemento con AACR. En el grupo con AACR hubo un incremento en masa muscular y una disminución en masa grasa | -El tamaño de la muestra se calculó únicamente para el resultado principal, el cual era el estado nutricional |
AACR: aminoácidos de cadena ramificada; APAF: alta en proteína y fibra; ARF: ablación con radiofrecuencia; BT: bilirrubina total; BTR: AACR/ratio; CH: cirrosis hepática; ChE: colinesterasa; CPT: Child Pugh Turcotte; CT: colesterol total; HCC: hepatocarcinoma; HOMA-IR: índice de resistencia a la insulina; L-ALB: L albumina; LES: colación nocturna; M-DXT: maltodextrina; MELD: Model For End-Stage Liver Disease; PCR: proteína C reactiva; RI: resistencia a la insulina; TACE: quimioembolización transarterial; VEGFR2: factor de crecimiento endotelial; Δ: basal.
Un estudio piloto evaluó la eficacia de la suplementación oral con AACR y el efecto en la reserva hepática con la finalidad de alargar el tiempo de espera para recibir trasplante hepático. Los pacientes de ambos grupos llevaron una dieta basada en las guías de la ESPEN para enfermedad hepática y solo el grupo experimental fue suplementado con AACR (952mg de L-isoleucina, 1904mg de L-leucina, 1144mg de L-valina) 3 veces al día, al final del tratamiento se observó que las escalas de severidad Child-Pugh y MELD score disminuyeron en el grupo que recibió AACR26. En otro estudio multicéntrico aleatorizado se comparó la suplementación oral con AACR, con otro grupo que recibió una cantidad similar de nitrógeno con lactoalbúmina (L-ALB) y otro grupo que recibió una cantidad similar de calorías a base de maltodextrinas (M-DXT) durante 12 meses en 174 pacientes con cirrosis descompensada; la suplementación con AACR a largo plazo demostró mayor beneficio en comparación con los grupos de L-ALB y M-DXT ya que se observó un disminución de la insuficiencia hepática progresiva, disminución en las tasas de ingreso hospitalario, así como en la puntuación de Child-Pugh, bilirrubina y calidad de vida25.
Efecto de la suplementación con AACR en complicaciones de la cirrosisDesnutriciónPreviamente, se evaluó el efecto dual de una dieta alta en proteína y fibra más suplementación con AACR en comparación con un grupo que recibió únicamente dieta alta en proteína y fibra. La dieta incluyó 1.2g/kg/día de proteína y 30g/día de fibra, y la suplementación de AACR en el grupo de intervención fue de 110g/día durante un periodo de 6 meses; al concluir el estudio se observó un incremento en masa muscular y una disminución en masa grasa en el grupo con la intervención dual de dieta más AACR19.
Encefalopatía hepáticaEn 2009, se publicó un estudio multicéntrico, aleatorizado y doble ciego en el que se compararon enfermos cirróticos con al menos un episodio de EH previo a la inclusión y que recibieron una dieta con idéntico aporte calórico (35kcal/ kg/día), pero variable cantidad de proteínas (1 a 1.2g/kg/día rica en aminoácidos ramificados AACR vs. 0.7g/kg/día) seguidos durante un año. El grupo de dieta normoproteica y enriquecida con AACR obtuvo una mejoría de las pruebas neuropsicométricas y en parámetros nutricionales, así como una tendencia a menor duración de EH. No se encontraron diferencias en cuanto a la recidiva de EH (47 vs. 34%; p=0.27) ni en la función hepática26,27.
Recientemente, la Sociedad Internacional para la Encefalopatía Hepática y el Metabolismo de Nitrógeno realizó un consenso sobre el manejo nutricional de pacientes con cirrosis y encefalopatía en donde se hizo recomendación especial de la suplementación con AACR28,29.
Y finalmente un metaanálisis actualizado que incluyó ocho ensayos clínicos aleatorizados controlados indica que las formulaciones orales enriquecidas con AACR mejoran las manifestaciones de la EH episódica30,31.
Carcinoma hepatocelularLos AACR resultan benéficos en el paciente con carcinoma hepatocelular; se ha observado que en aquellos pacientes que han recibido suplementación con AACR existe un menor riesgo para el desarrollo de carcinoma hepatocelular32. Además diversos estudios publicados en los últimos años han logrado demostrar la importancia de la suplementación nutricional con AACR en pacientes con carcinoma hepatocelular previo al tratamiento locorregional ablación por radiofrecuencia (ARF), quimioterapia de infusión arterial hepática o quimioembolización transarterial (TACE), ya que se observa una mejoría en el estado nutricional, así como en la función hepática y una mejor respuesta al tratamiento33–36.
AscitisLa hipoalbuminemia está directamente asociada con el desarrollo y persistencia de ascitis en pacientes con CH, la ascitis induce distensión abdominal y anorexia, lo que perpetúa la hipoalbuminemia. En la actualidad, los agentes diuréticos y la infusión de albúmina son el único tratamiento paliativo para la ascitis36. La suplementación con AACR complementa la síntesis de albúmina a través de un aumento en la relación de AACR a aminoácidos aromáticos19.
Los AACR además, activan la vía de mTOR (rapamicina en células de mamífero) con un posterior aumento en la síntesis de proteínas36. Algunos de los estudios mencionados previamente sustentan la mejoría de la hipoalbuminemia al suplementar con AACR23,37.
De manera interesante, debido a que algunos pacientes no muestran ningún aumento en la albúmina sérica después de la suplementación con AACR, un estudio evaluó posibles factores involucrados como la ingesta dietética y las características basales de los pacientes, demostrando que el uso continuo de AACR redujo significativamente la incidencia de ascitis y edema incluso en pacientes cuya albúmina sérica no respondía al tratamiento con AACR38.
Calidad de vidaLa calidad de vida es definida por la Organización Mundial de la Salud como «la percepción del individuo de su posición en la vida en el contexto de la cultura y sistema de valores en los que vive, y en relación con sus objetivos, expectativas, estándares y preocupaciones».
Diversos estudios han demostrado que los pacientes con CH tienen una menor calidad de vida en comparación con población sana, debido a las complicaciones de la enfermedad y las limitaciones que genera en las actividades de la vida diaria, así como factores psicológicos y los efectos secundarios de los tratamientos39–41.
En diversos ensayos controlados aleatorios la suplementación con AACR ha manifestado mejoras en la percepción de salud general utilizando el cuestionario SF-36 en comparación con los grupos de control25,38. El posible mecanismo mediante el cual la suplementación con AACR podría mejorar la calidad de vida es que la mejoría del flujo sanguíneo cerebral, ayuda a contrarrestar la fatiga y trastornos del sueño23.
ConclusiónLa desnutrición en los pacientes con cirrosis hepática es una de las complicaciones más frecuentes que además está relacionada con el pronóstico de la enfermedad por lo que el tratamiento nutricional en estos pacientes es fundamental para poder prolongar la sobrevida, mejorar la calidad de vida y preparar a los pacientes para un trasplante hepático exitoso ayudando a disminuir los días de estancia hospitalaria y susceptibilidad a infecciones postoperatorias.
Asegurar el adecuado aporte de energía diaria es uno de los objetivos principales en el tratamiento nutricional, y como ya se mencionó existen diversas ecuaciones de predicción que ayudan a calcular el gasto energético total de un paciente, sin embargo se ha observado que estas tienden a subestimar el aporte energético, por lo que las recomendaciones de la ESPEN parecen ser la mejor opción. De acuerdo a la ESPEN un aporte calórico de 30-40kcal/kg del peso real del paciente al día provee la energía suficiente, mientras que en pacientes con sobrecarga hídrica se recomienda utilizar el peso ideal al utilizar esta fórmula. Los hidratos de carbono deben aportar el 45-60% del gasto energético diario, y las proteínas el 1.0-1.5g/kg/día, de las cuales el 70% debe ser de origen vegetal y el 30% de origen animal, el resto del gasto energético total debe ser cubierto por lípidos.
El uso de AACR como suplemento nutricional es la mejor opción disponible en los pacientes que no alcanzan el requerimiento calórico a través de la dieta, o como coadyuvante en el tratamiento de las complicaciones propias de la enfermedad.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
FinanciaciónNo se recibió patrocinio de ningún tipo para llevar a cabo este artículo.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Astrid Ruiz Margáin agradecer al Consejo Nacional de Ciencia y Tecnología (CONACYT) por su apoyo y Ricardo Macias Rodriguez agradece a CONACYT-UNAM y al Patronato INCMNSZ por su apoyo.