La pancreatitis aguda grave (PAG), ocurre en 15 a 20% de todos los casos de pancreatitis aguda1 y es una causa importante de morbimortalidad y en la que aún existe controversia en puntos importantes de su manejo médico y quirúrgico. En contraste a la pancreatitis aguda leve (PAL), forma autolimitada y con recuperación total, la PAG es una entidad devastadora que compromete seriamente la vida del paciente y que en países occidentales, su mortalidad oscila entre 25 y 50%.1, 2
En 1992 en el Simposio Internacional llevado a cabo en Atlanta, Georgia, EUA, fueron analizadas un número importante de comparaciones referente a la estratificación de la gravedad, curso clínico y las diversas terapias utilizadas con el fin de establecer un criterio de selección en ensayos prospectivos aleatorios. Además, fueron establecidos conceptos y clasificación de la pancreatitis aguda y sus com-plicaciones.3 En dicho simposio, la PAG fue definida como un proceso inflamatorio que puede comprometer tejido circundante y extenderse a otros órganos, incluyendo la presencia de variables como: insuficiencia orgánica (choque hipovolémico, insuficiencia respiratoria y renal), además de complicaciones locales (necrosis pancreática, absceso y seudoquiste). (Tabla 1).
Tabla 1. Definición de PAG de acuerdo al Simposio de Atlanta.
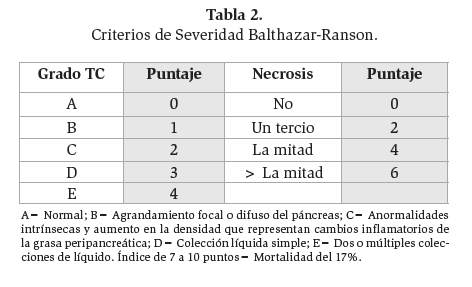
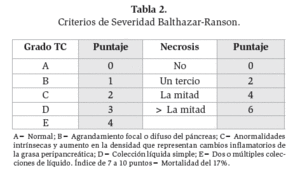
Desde el punto de vista de imagenología, con el uso de la tomografía computarizada (TC), se definió a PAL como un aumento local o difuso del páncreas con presencia homogénea o ligeramente heterogénea del parénquima en respuesta al contraste intravenoso. Por otro lado, se definió a la necrosis pancreática como un área difusa o localizada de tejido no viable y el criterio tomográfico de gravedad incluyó zonas bien definidas no aumentadas del parénquima pancreático mayor a 3 cm, o 30% del tamaño del páncreas (tabla 2). Un acúmulo de líquido extrapancreático es la extravasación hacia el espacio pararrenal anterior y otras áreas, pudiendo ocurrir tanto en PAL como en PAG; en la mayoría de los casos permanece estéril y se reabsorbe durante el periodo de recuperación. Un seudoquiste es la acumulación de jugo pancreático encapsulado por una pared no epitelizada. Es necesario un periodo de 4 semanas para su formación. Un absceso pancreático, ocurre cuando el área de necrosis pancreática pasa por un proceso de licuefacción y se infecta. Insuficiencia Orgánica Múltiple (SFOM) comprende la presencia de: insuficiencia respiratoria, choque hipovolémico, insuficiencia renal y hemorragia gastrointestinal (tabla 3). Además, un número adicional de complicaciones sistémicas se agregan a esta entidad, tales como coagulación intravascular diseminada (fibrinógeno <100 mg/dL, productos del fraccionamiento de la fibrina >80 Mg/Ml y elevación del Dímero-D) y un desequilibrio metabólico grave (Calcio <7.5 mg/dL).4
Tabla 2. Criterios de Severidad Balthazar-Ranson.
Tabla 3. Definición del Síndrome de Falla Orgánica Múltiple (SFOM).
El Simposio de Atlanta, representó una importante iniciativa para establecer una clasificación clínica, sin embargo, publicaciones posteriores han cuestionado aspectos acordados, principalmente en lo referente a la gravedad, a esto se añade el advenimiento de información científica más reciente.5
FisiopatologíaEn esta enfermedad ocurre una compleja cascada de eventos inmunológicos y pro-inflamatorios que afectan la patogénesis y el curso de la misma. La teoría más aceptada señala que la PAG es el resultado de la lesión de los acinos pancreáticos por radicales libres de oxígeno, dando inicio a la liberación de enzimas digestivas, quimiotaxis y activación de células inflamatorias.6,7 La activación de enzimas digestivas es un evento crítico en la iniciación de la autodigestión pancreática; además de la activación de proteasas (tripsina y elastasa) y lipasa que dañan tejidos y membranas celulares provocando edema, lesión vascular, hemorragia y necrosis. Una vez iniciado el proceso inflamatorio, da lugar a efectos sistémicos mediados por el sistema inmunológico, fenómeno conocido como el “síndrome de respuesta inflamatoria sistémica” (SRIS), el cual puede evolucionar hasta su manifestación extrema, conocido como “síndrome de falla orgánica múltiple” (SFOM) que es la primera causa de muerte.8 Por otra parte, mediadores inflamatorios que parecen jugar un importante papel en la patogénesis incluyen: factor de necrosis tumoral alfa (FNT-Alfa), interleucina (IL) 1 Beta, IL-6, IL-8, molécula de adhesión intercelular tipo 1, factor activador de plaquetas (FAP), oncogén relativo al crecimiento alfa/citocina inductora de quimioatracción de neutrófilos, proteína 1 quimioatrayente de monocitos y sustancia P, en tanto que los mediadores antiinflamatorios que toman parte en la regresión incluyen: IL-10, proteína 5 del complemento activada (C5a), receptores solubles de FNT, antagonista del receptor de IL-1 y endopeptidasa neutral.9 La expresión de varios de estos mediadores es regulada por factores de trascripción como el factor nuclear (FN)-KB.9
Valoración inicial, diagnóstico y predicción de la gravedadLa valoración inicial incluye el reconocimiento de factores de riesgo como edad > de 55 años, obesidad, índice de masa corporal (IMC) >30, presencia de derrame pleural o infiltrados en la telerradiografía de tórax. Los enfermos que presentan cualquiera de estas características requieren de una unidad de cuidados intensivos (UCI).
Numerosos informes han apoyado el concepto de que la edad >55 años se correlaciona con un pronóstico menos favorable,10,11 sin embargo, esto no fue determinante en otros estudios.12,13
Algunos investigadores, han concluido que la etiología de la PA no representa un valor pronóstico importante,12,13 pero otros estudios como uno retrospectivo, comparativo, longitudinal, observacional en el Hospital General de México en el 2003, señala a la etiología alcohólica como un factor de riesgo para la gravedad y mortalidad, enfatizando que dicho factor puede estar condicionado por variables tales como el sexo masculino y el estado nutricional.14
La presencia de derrame pleural en las primeras 24 horas se correlaciona con el grado de gravedad en términos de necrosis o falla orgánica múltiple y conlleva a una mayor mortalidad.15 Por otro lado, ha quedado demostrado que si el SFOM persiste por más de 48 horas, la mortalidad alcanza el 36%.16
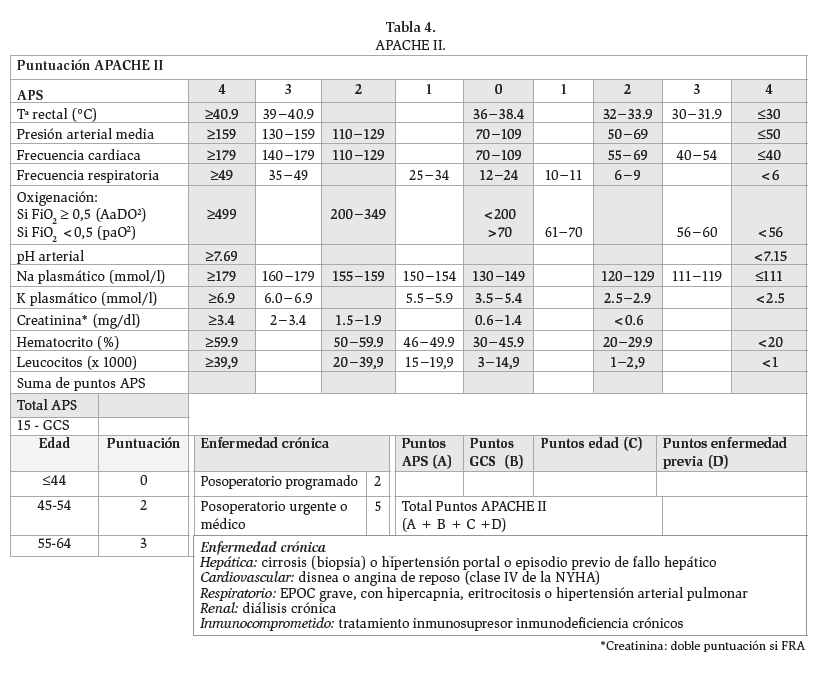
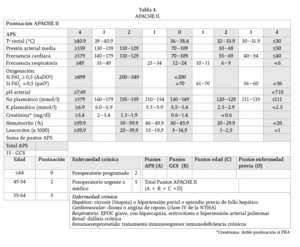
La puntuación APACHE II es una de las herramientas más útiles para determinar la gravedad dentro de las primeras 48 horas, éste incluye una variedad de constantes fisiológicas, edad y la existencia de enfermedad crónica concomitante (tabla 4).
Tabla 4. APACHE II.
Algunos estudios clíinicos han correlaciona- do puntajes altos al momento del ingreso con una mayor mortalidad (4% con puntaje <8 y del 11-18% con puntaje >8).12,16 El aumento de éste puntaje de base en las primeras 48 horas es sugestivo de PAG en tanto una disminución sugiere PAL. Dentro del puntaje de obesidad en APACHE II (conocido como Apache-O), se agrega un punto cuando el IMC es de 26-30 y 2 puntos cuando es mayor de 30.17 Los criterios de Ranson que han sido utilizados por muchos años, tienen como principal desventaja el requerir el total de 48 horas para una evaluación completa. En general, un puntaje <3 tiene una mortalidad de 0-3% (13, 18), >3 11-15%, y >6 40%;12 aunque cuenta con un poder predictivo positivo muy bajo. La cuantificación de parámetros séricos y su correlación con el grado de gravedad al momento de la valoración inicial, ha sido objeto de estudio, los valores de creatinina >2.9 mg/dL y glucémicos >250 mg/dL fueron asociados con una mortalidad mayor (39% y 16%, respectivamente).12 Otros estudios adicionales, señalan que la creatinina sérica >2 a las 24 horas es también asociada a una mortalidad mayor. Niveles de glucosa >125 mg/dL, se han asociado con mayor tiempo de estancia hospitalaria, pero no de falla orgánica, tiempo en la UCI y mor-talidad.18
La hemoconcentración ha sido propuesta como un factor pronóstico en PAG;19 este reporte señala que un valor del hematocrito >44 al momento del ingreso o falla en la corrección del mismo, dentro de las 24 horas es un predictor de PAG. Más estudios han concluido el hecho de que pacientes con un aumento del hematocrito en las primeras 48 horas, presentaban un riesgo mayor de necrosis pancreá-tica.20
Niveles > a 150 mg/L de proteína C reactiva en las primeras 72 horas, se ha correlacionado con la presencia de necrosis glandular, existiendo una sensibilidad y especificidad >80%, pero debido a que el pico ocurre entre las 36 y 72 horas este parámetro no resulta útil en la evaluación de la PAG.21,22
Otros marcadores que pudieran ser prometedores en cuanto al pronóstico y que actualmente se encuentran en fase experimental son: el péptido de activación del tripsinógeno, tripsinógeno-2 sérico, amiloide sérico A y precursores de calcitonina.22,23
ImagenologíaEntre el segundo y tercer día del ingreso, resulta posible establecer la diferencia entre PAL y PAG por imagenología.24 La primera, se caracteriza por microcirculación intacta y aumento uniforme de la glándula. La segunda, por interrupción de la microcirculación, así como la presencia de áreas desvitalizadas.24,25 Aunque la diferencia entre PAL y PAG no puede ser hecha sin medio de contraste intravenoso, la TC proporciona información valiosa basada en los criterios de Balthazar. Con el uso contraste IV, se establece un índice de severidad tomográfico.26 (Tabla 3.)
Existe cierta controversia de que el uso de contraste intravenoso pudiera aumentar la necrosis pancreática. Algunos estudios con animales han mostrado un aumento de la gravedad, pero dos informes no han demostrado exacerbación de la necrosis.26,27
Las complicaciones que pueden identificarse con el uso de TC incluyen: acúmulos de líquidos pancreáticos, complicaciones gastrointestinales y biliares (obstrucción duodenal y biliar e inflamación del colon transverso), compromiso de órgano sólido, (infarto esplénico), complicaciones vasculares (seudoaneurisma, trombosis de la vena esplénica o trombosis de la vena porta), así como ascitis pancreática.25,28 TC dinámica trifásica puede ser útil durante intervalos de la hospitalización con el fin de detectar y monitorizar el curso de complicaciones.
TratamientoLas medidas de apoyo van encaminadas a prevenir la hipoxemia y el restablecimiento del equilibrio hídrico. Los signos vitales deben monitorearse cada 4 horas, así como la determinación de la saturación de oxígeno y es recomendable que el suplemento de oxígeno sea administrado durante 24-48 horas. Una gasometría está indicada cuando la saturación de oxígeno sea menor de 95% al aire ambiente o con manifestaciones clínicas sugestivas de hipoxemia. Existe una evidencia experimental que la resucitación temprana con reposición de volumen y oxígeno suplementario minimiza el riesgo de PAG, mejorando la supervivencia.29 El traslado a la UCI, debe realizarse ante la presencia de falla orgánica sostenida y de parámetros que requieran una supervisión estrecha por médicos o enfermeras en una unidad intermedia.
Cuando sea posible, la alimentación enteral en lugar de nutrición parenteral total es recomendada en pacientes con PAG, en el caso de la PAL, la vía oral se restablece entre el tercer y séptimo día de hospitalización y el apoyo nutricional suele no ser requerido. El tiempo exacto para la tolerancia a la vía oral no ha sido objeto de ensayos prospectivos controlados, en general, es limitado a cantidades calóricas y es usualmente iniciado cuando el dolor abdominal ha disminuido, hay peristalsis y un examen general denota mejoría clínica.
Hasta el día de hoy, no existe una razón sólida basada en múltiples ensayos clínicos aleatorizados para creer que la nutrición enteral es preferible a nutrición paraenteral; sin embargo, existen argumentos a favor de la NE, ya que existe evidencia de que en la PAG la barrera intestinal está comprometida, resultando en un aumento en la permeabilidad a bacterias y endotoxinas cuando las vellosidades se atrofian, debido a la falta de uso del tracto diges-tivo.30-32 Los expertos sugieren que la alimentación enteral estimula el movimiento lisosomal hacia la superficie celular, por tanto, minimiza la liberación intracelular de enzimas pancreáticas y esto es terapéutico en pacientes con PAG; asimismo, la nutrición enteral reduce la producción de mediadores proinflamatorios y mantiene la respuesta inmunitaria, celular y humoral.
Existen algunos estudios prospectivos aleatorios, pero no doble ciego, que han comparado la nutrición enteral con nutrición parenteral en el subgrupo de pacientes con PAS, todos han incluido un reducido número de enfermos. En general, es razonable pensar que la alimentación enteral resulta segura y menos costosa; sin embargo, no hay datos convincentes de que exista una reducción significativa en la morbimortalidad de la PAG.
Antibióticos profilácticos en PAGEl valor de los antibióticos profilácticos ha sido motivo de debate por muchos años, los lineamientos prácticos en pancreatitis aguda publicados por el Colegio Americano de Gastroenterología en 2006, es claro en no recomendar su uso en pacientes con pancreatitis aguda necrotizante (PAN).4
Durante los primeros 7 a 10 días, los pacientes pueden parecer sépticos con leucocitosis, fiebre y/o falla orgánica; en este periodo la antibioticoterapia está justificada, mientras se determina la fuente de infección, pero una vez que los cultivos son negativos incluyendo el realizado por medio de aspiración de aguja fina guiado por TC y aun no se identifica la fuente de infección, deben de suspenderse.
Recientemente seis estudios aleatorios, prospectivos, han evaluado el papel de los antibióticos para prevenir la infección pancreática.33-38El número de pacientes en cada estudio fue relativamente pequeño (media de 60), en 5 de estos estudios se utilizaron antibióticos por vía intravenosa33-37 y en uno, se utilizó selectivamente la descontaminación del tracto digestivo.37 Tres demostraron una disminución de necrosis infectada34,36,37 con el uso de antibióticos profilácticos, pero esto no quedó demostrado en dos.33,38 En ninguno de estos reportes se observó una disminución importante en la mortalidad.
Recientemente, un estudio multicéntrico, doble ciego, placebo-control en cuanto a la efectividad de ciprofloxacino y metronidazol en la reducción de la morbilidad y mortalidad, concluyó que no había diferencia en el índice de necrosis infectada, complicaciones sistémicas o mortalidad en los dos grupos.39
Para una respuesta concluyente, se necesitan más estudios con mejoras en su diseño, además de la estandarización del tratamiento, alimentación, tiempo de antibióticoterapia y el establecimiento de criterios más uniformes en la estratificación de la gravedad, también considerar, el riesgo potencial de superinfección fúngica.40
Tratamiento de necrosis infectada y estérilAproximadamente 33% de pacientes con PAN desarrolla necrosis infectada (NI)4,35,41 y la mayoría de los pacientes manifiestan toxicidad sistémica (fiebre y leucocitosis) en los primeros 7 a 10 días. La distinción entre NI y necrosis estéril (NE) es un punto muy importante durante el curso de PAN y la aspiración percutánea guiada por TC, ha demostrado ser segura y precisa, debiendo practicarse entre la segunda y tercera semana de la enfermedad con tinción Gram y cultivo.42 Si la aspiración inicial es negativa y persiste la toxicidad sistémica, se repite los días 5 y 7.
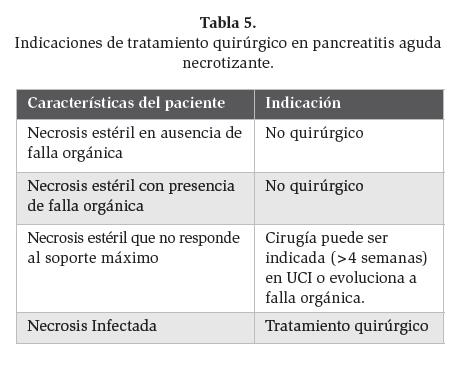
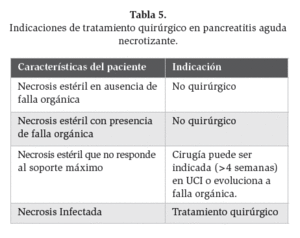
El manejo quirúrgico y el tiempo en que debe realizarse en PAN ha cambiado significativamente en los últimos años, la tabla 5 resume las indicaciones precisas (tabla 5).
Tabla 5. Indicaciones de tratamiento quirúrgico en pancreatitis aguda necrotizante.
La NI es la indicación clara de intervención quirúrgica y el tratamiento consiste en el desbridamiento quirúrgico con un régimen postoperatorio que maximice la remoción de tejido necrótico y un lavado continuo. El tiempo en el cual debe realizarse la cirugía, generalmente es lo más pronto posible y una publicación reciente señala que debe llevarse a cabo en pacientes aun cuando se encuentren “sépticos”,43 pero otras publicaciones y guías apoyan el uso de antibióticos por tres semanas previo a la cirugía, permitiendo una disminución de la inflamación y que el proceso infeccioso se organice.4 Un estudio mexicano menciona que en el caso de que se trate de una pancreatitis aguda grave (necrótico/hemorrágica), se podrán realizar varios procedimientos, los cuales generalmente se llevan a cabo después de la primera semana e inicio de la segunda, durante su estancia en la Unidad de Terapia Intensiva.46 Otro estudio mexicano demostró que el abordaje quirúrgico tardío (después de 14 días), junto con el manejo conservador intensivo inicial es el indicado para casos específicos (necrosis pancreática mayor al 30%, inestabilidad hemodinámica persistente a pesar de la terapia y criterios de Balthazar con resultado mayor a 7 puntos).47
Los tipos de cirugías generalmente recomendadas son, la necrosectomía con irrigación continua cerrada a través de catéteres, necrosectomía con abdomen abierto y la necrosectomía con drenaje abierto sin irrigación.42No existen ensayos prospectivos aleatorios comparando estos 3 procedimientos y generalmente se considera que proporcionan resultados similares en centros altamente especializados.
En cuanto a la NE debe manejarse de manera conservadora al menos que no responda al tratamiento dentro de las primeras 4 semanas en la UCI, así como la aparición de SFOM, la cual se ha reportado hasta en 48% de pacientes.42 Hasta hace un par de décadas, la necrosectomía era indicada en algunos pacientes con NE con falla orgánica ha insistido en manejar médicamente durante las primeras 2 o 3 semanas debido a que si se interviene quirúrgicamente en una etapa más temprana, podría condicionar infección con la necesidad de más procedimientos quirúrgicos. Como se ha demostrado en diferentes estudios.48 Si la cirugía es diferida por 3 semanas, la inflamación difusa localizada en retroperitoneo se resuelve considerablemente y origina una estructura encapsulada que involuciona la necrosis.44 Para este momento, la falla orgánica ha cedido y muchos pacientes se encuentran asintomáticos, únicamente en quienes persiste la elevación leucocitaria y fiebre, sugiere la posibilidad de necrosis infecciosa, náusea y vómito indican compresión del estómago y duodeno.
El manejo quirúrgico comprende desbridamiento del tejido necrótico, evacuación de fluido de la necrosis organizada y la creación de una anastomosis a la pared posterior del estómago o una Y de Roux, esto puede llevarse a cabo mediante cirugía abierta o laparoscópica. El tratamiento percutáneo del material necrótico organizado, puede ser realizado mediante la colocación de uno o más drenajes, lavado agresivo y la reposición de catéteres.
En raras ocasiones, la necrosis estéril requiere tratamiento quirúrgico urgente dentro de las primeras semanas de la enfermedad, una indicación es el desarrollo de síndrome compartimental abdominal, una segunda indicación es la presencia de dolor abdominal severo que sugiere perforación o infarto causado por extensión de exudado inflamatorio del colon o intestino delgado y la tercera es una hemorragia por un seudoaneurisma roto.45
ConclusionesA pesar de los avances en el diagnóstico temprano, así como la detección oportuna, predicción de la severidad y el valor pronóstico de los puntajes más utilizados en aquellos pacientes que potencialmente pueden presentar una evolución clínica con deterioro franco; existe todavía controversia en lo referente al abordaje que resulta más apropiado del paciente con complicaciones locales y sistémicas, como en el caso de desarrollo de necrosis infectada, uso de antibióticos profilácticos, así como las indicaciones precisas para el manejo quirúrgico posterior al soporte máximo en la UCI.
No existe la menor duda que el trabajo conjunto de un equipo multidisciplinario constituye la piedra angular para el éxito en la toma de decisiones, considerándose de manera muy importante las contribuciones y las evidencias de los ensayos clínicos que han marcado la pauta en el manejo integral de esta devastadora enfermedad.
Correspondencia:
Javier Eduardo Anaya-Ayala, M.D. Chiapas 309 A Sur, Col. Unidad Nacional. C.P. 89410. Cd. Madero, Tamaulipas. México. Correo electrónico:
javieranayala@hotmail.com
Dra. Claudia Adriana Mora-Loya. Norte 25 # 67. Col. Nueva Vallejo. C.P. 07750. México D.F. Teléfono hospital 5666 4539 Instituto Nacional de
Enfermedades Respiratorias. Unidad de Cuidados Intensivos.
Fecha recibido: 4 diciembre 2007. Fecha aprobado: 24 abril 2008