Introducción
La hemorragia por varices esofágicas (HV) es una de las principales complicaciones de la hipertensión portal y la principal causa de muerte en pacientes con cirrosis hepática.1-3 Después de un episodio de HV, las tasas de mortalidad y resangrado se incrementan durante las primeras seis semanas y luego tienden a estabilizarse.1,4 Aunque a la fecha, tanto el tratamiento con fármacos vasoactivos como el endoscópico logran altas tasas de hemostasia inicial,5-9 hasta 30% a 50% de los casos de resangrado temprano (el que ocurre en las primeras seis semanas) se presenta en los días siguientes al cuadro agudo.10-11 Por lo anterior, el tratamiento actual se dirige a detener de manera más efectiva la hemorragia aguda y a la prevención del resangrado con medidas más agresivas.1,10-13 Con base en
la importancia de este asunto, se sugiere definir como resangrado precoz el periodo que comprende entre las 48 y 120 h que siguen al cuadro agudo de hemorragia.14
Varios estudios definen factores pronósticos de mortalidad y de resangrado en el periodo de seis semanas.15-18 No obstante, hay pocas investigaciones que aclaren cuáles son los factores pronósticos de resangrado precoz y pocas exploran la capacidad de los modelos empleados para este propósito.
Estas consideraciones llevaron a realizar este estudio retrospectivo con la finalidad de evaluar los factores pronósticos de resangrado precoz posterior al cuadro agudo de HV. Asimismo, se efectuó un análisis para valorar la utilidad pronóstica de las escalas que se utilizan para este fin (Child-Pugh y Model for End Stage Liver Disease) y se propone un nuevo índice pronóstico basado en un modelo multivariado de análisis por medio de árboles de clasificación y regresión (CART).
Pacientes y métodos
Pacientes
Se consideró para el estudio a todos los pacientes con HV admitidos al Servicio de Gastroenterología del Hospital Juárez de México de enero de 2007 a enero de 2008.
Se excluyó a los individuos con carcinoma hepatocelular (CHC), con edad de 80 años o mayores, sin control de HV, con infección documentada en el transcurso de las primeras 24 h de la admisión hospitalaria, HV sin cirrosis o hemorragia por otras causas (varices gástricas, úlcera péptica, escaras por ligadura varicosa o gastropatía portal).
Tanto las características clínicas y bioquímicas al ingreso hospitalario como el uso de tratamiento farmacológico y endoscópico se recolectaron de manera prospectiva. Se determinó el Child-Pugh (CP) y el índice de Model for End Stage Liver Disease (MELD) al ingreso del paciente con las variables recolectadas.18 El cálculo de MELD se efectuó con la siguiente fórmula: MELD = 9.57 Ln (creatinina) + 3.78 Ln (bilirrubina) + 11.2 Ln (INR) + 6.43.
El diagnóstico de cirrosis se estableció con base en una biopsia hepática previa o por la combinación de criterios clínicos, bioquímicos y radiológicos. Los pacientes se incorporaron al estudio en el momento de la admisión a la unidad de Urgencias-Gastroenterología. El seguimiento de los pacientes continúa hasta la fecha y se recolectaron los datos clínicos a las seis semanas de la HV. Los datos que aquí se muestran representan el análisis de la estancia hospitalaria y los resultados al quinto día de la misma.
Este protocolo fue aprobado por el Comité de Investigación de la institución de los autores.
Tratamientos
Todos los pacientes recibieron profilaxis oral con norfloxacina, 400 mg cada 12 h por siete días. La endoscopia inicial se realizó durante las primeras 12 h del ingreso y se practicó ligadura endoscópica (LE) en todos los casos. Se utilizó la sonda de Sengstaken-Blakemore como tratamiento "puente" para un nuevo procedimiento endoscópico cuando estuviera indicado. El tratamiento farmacológico vasoactivo consistió en octreótido, 50 μg por vía intravenosa en bolo seguido de 50 μg/h en infusión por cinco días. Sólo a los pacientes con capacidad económica para adquirir el fármaco se les trató con fármacos vasoactivos de manera inicial.
En quienes sobrevivieron después del quinto día del evento agudo, se instituyó profilaxis secundaria. Se inició propranolol vía oral a una dosis de 40 mg/día y luego se incrementó hasta la aparición de datos clínicos de intolerancia, disminución del pulso por debajo de 55 latidos/minuto o reducción de 25% del pulso basal. Todos los participantes se incluyeron en un protocolo de LE a intervalos de dos a tres semanas hasta lograr la erradicación de las varices esofágicas. Los sujetos con contraindicaciones mayores o intolerancia conocida a la profilaxis farmacológica continuaron con profilaxis endoscópica.
Definiciones
La hemorragia se consideró de origen varicoso si en la endoscopia inicial se encontraba alguno de los signos de hemorragia varicosa de acuerdo con la Reunión de Consenso de Baveno.19
Fallo de control en la HV se definió como la ocurrencia de los siguientes eventos en el transcurso de 48 h del ingreso del paciente: a) hematemesis posterior a endoscopia o inicio de tratamiento vasoactivo o ambos; b) caída de la tensión arterial sistólica (TAS) <100 mmHg o >20 mmHg de la TAS basal, pulso >100 por minuto, caída súbita de al menos 2 g de hemoglobina o presencia de signos clínicos de perfusión periférica baja; c) persistencia de datos (clínicos y de laboratorio) de HV a pesar de tratamiento endoscópico intensivo (p. ej., más de dos procedimientos terapéuticos), y d) muerte.
Se consideró resangrado precoz cualquiera de los anteriores que se presentara en el periodo de 48 a 120 h posteriores al ingreso del paciente en el que se hubiese logrado un control previo de la HV.
La ausencia de criterios para fallo de control se definió como control de la HV y mortalidad intrahospitalaria, como muerte por cualquier causa ocurrida durante los días de estancia hospitalaria del paciente.
Los pacientes con fallo de control se trataron mediante nuevo procedimiento endoscópico, añadiendo fármacos vasoactivos o cirugía derivativa, o ambos, según el criterio del médico a cargo del paciente.
Los criterios de infección bacteriana incluyeron: fiebre >37.5 ºC por más de 12 h; peritonitis bacteriana espontánea, líquido ascítico con una cuenta de polimorfonucleares igual o mayor de 250/mm3; hemocultivos positivos, infección urinaria o neumonía en la radiografía de tórax. Otras infecciones se diagnosticaron con base en datos clínicos, radiológicos y bacteriológicos.
Análisis estadístico
Las variables continuas se describieron en mediana con rango intercuartil 25-75 y se compararon mediante t de Student o U de Mann-Whitney, según su prueba de normalidad. Las diferencias entre variables categóricas se establecieron por medio de la prueba exacta de Fisher o ]2 con corrección de Yate para continuidad, cuando fue necesario. Se requirió un valor p <0.05 para significancia estadística.
Se utilizaron cuatro diferentes técnicas estadísticas para la evaluación pronóstica de resangrado precoz. Primero se efectuó el cálculo de las escalas de CP y MELD al ingreso. Tanto la capacidad discriminativa como la eficiencia clínica de las mismas se estimaron por estadística de concordancia, expresada por el ABCROC. Para estas consideraciones, un ABCROC con valor superior a 0.70 se consideró relevante. Para los cálculos se empleó el paquete estadístico SPSS (SPSS Inc., versión 15.0, Chicago, IL, USA) .
En segundo término se realizó un análisis CART mediante el software CART Pro v6.0 (Salford Systems, San Diego, CA, USA). En resumen, el método permite la construcción de árboles de decisión inductiva estrictamente a través de división binaria. Este algoritmo divide cada nodo madre en dos nodos hijos homogéneos mediante la aplicación de respuestas sí/no en cada nodo de decisión. La base de generación de árboles o proceso de "aprendizaje" consiste en: 1) seleccionar la variable más discriminativa de acuerdo con una función de partición de la impureza de los datos, 2) la repetición de esta partición hasta que los nodos hijos se consideren lo suficientemente puros para ser terminales y 3) una "poda" del árbol resultante para evitar el desajuste estadístico (overfitting) y la redundancia/colinealidad del modelo. En este estudio todas las variables se incluyeron en un solo paso para el desarrollo del modelo con el afán de darle la mayor autonomía discriminativa.
El análisis de sensibilidad se basó en el índice de Gini y se llevó a cabo una validación cruzada en 10 ocasiones para determinar su validez interna. Los errores de clasificación de coste se ajustaron en 1.0. Al número de pacientes en los nodos terminales no se le fijó una cifra determinada dada la muestra reducida de individuos en el estudio y no se forzaron divisiones específicas para nodos madre o hijos. El modelo generó de manera automática los puntos de corte para las variables continuas y categóricas con base en hipótesis estadísticas de coste. De esta forma, los árboles óptimos se seleccionaron de acuerdo con sus errores de clasificación de coste, exactitud de predicción y relevancia clínica.
El tercer paso consistió en la construcción de curvas ROC para el modelo CART, el cual se comparó después, mediante los valores del ABCROC, con los demás modelos mediante la prueba Z.
Por último, se efectuó un análisis de tasas de verosimilitud (LR, likelihood ratios) con las variables significativas en la comparación inicial de grupos (resangrado precoz sí/no). De esta manera, se corroboró la exactitud de las variables integrantes del nuevo índice pronóstico. La razón por la que se escogió esta última técnica fue que las tasas de verosimilitud son estadísticas alternativas para incrementar la exactitud diagnóstica. Como tienen propiedades muy particulares y poderosas, se convierten en una herramienta más útil para los intereses clínicos que otras estadísticas. A su vez, las tasas de verosimilitud pueden tratarse de igual manera que una tasa de riesgo para propósitos del cálculo de los intervalos de confianza.20 Para estos fines, se utilizó el software MEDCALC (Version 10.0.2 Mariakerke, Belgium).
Resultados
Pacientes y tratamientos
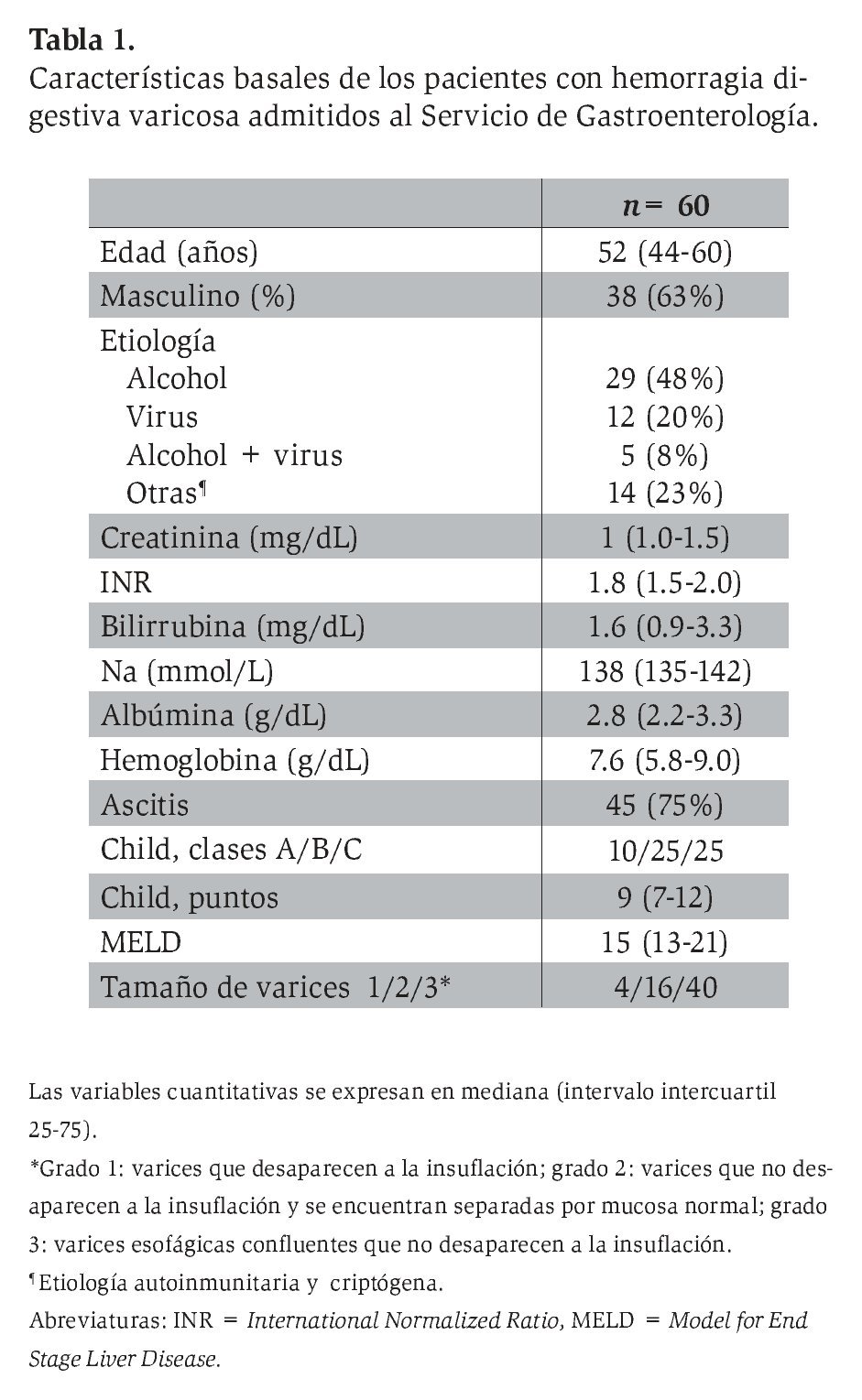
Durante el año de reclutamiento se recibió a un total de 75 pacientes cirróticos con HV en la Unidad de Urgencias-Gastroenterología del hospital de los autores. Se excluyó a 15 por las siguientes razones: dos por CHC, cuatro por CHC más fallo de control de HV, cinco por hemorragia secundaria a otras causas y cuatro individuos con infección al ingreso. Así, el análisis final comprendió a 60 pacientes (38 varones/22 mujeres) con HV. Las características clínicas y demográficas al ingreso se muestran en la Tabla 1.
La causa más frecuente de cirrosis fue la hepatopatía alcohólica (48%). Diecisiete pacientes (28%) mostraron insuficiencia renal al ingreso, que se manifestó por creatinina >1.5 mg/dL; 24 (40%) presentaron encefalopatía hepática (>grado 2). Diez (17%) de los 60 participantes desarrollaron infección por cualquier causa durante la hospitalización, cuyas causas más frecuentes fueron peritonitis bacteriana espontánea (n = 5), infección urinaria (n = 3), neumonía (n = 1) y etiología no aclarada con hemocultivo positivo (n = 1). No se observaron diferencias en términos de infección entre los pacientes con y sin resangrado precoz (3/8 vs. 7/52, respectivamente; p= 0.12).
En 25 (42%) pacientes se identificó hemorragia activa, 31 (51%) tenían estigmas de hemorragia reciente y cuatro (7%) presentaron sangre dentro de la cámara gástrica sin otra causa evidente de hemorragia.
Todos los pacientes se sometieron a endoscopia terapéutica inicial. Se practicó LE en 58 pacientes (97%) y en dos la LE se combinó con escleroterapia con polidocanol. Siete (12%) recibieron tratamiento vasoactivo. No hubo relación entre la utilización o no del fármaco vasoactivo y el resangrado precoz (2/8 vs. 5/52 respectivamente; p= 0.23) y no se documentaron eventos adversos en quienes se administraron el fármaco.
Objetivos y seguimiento
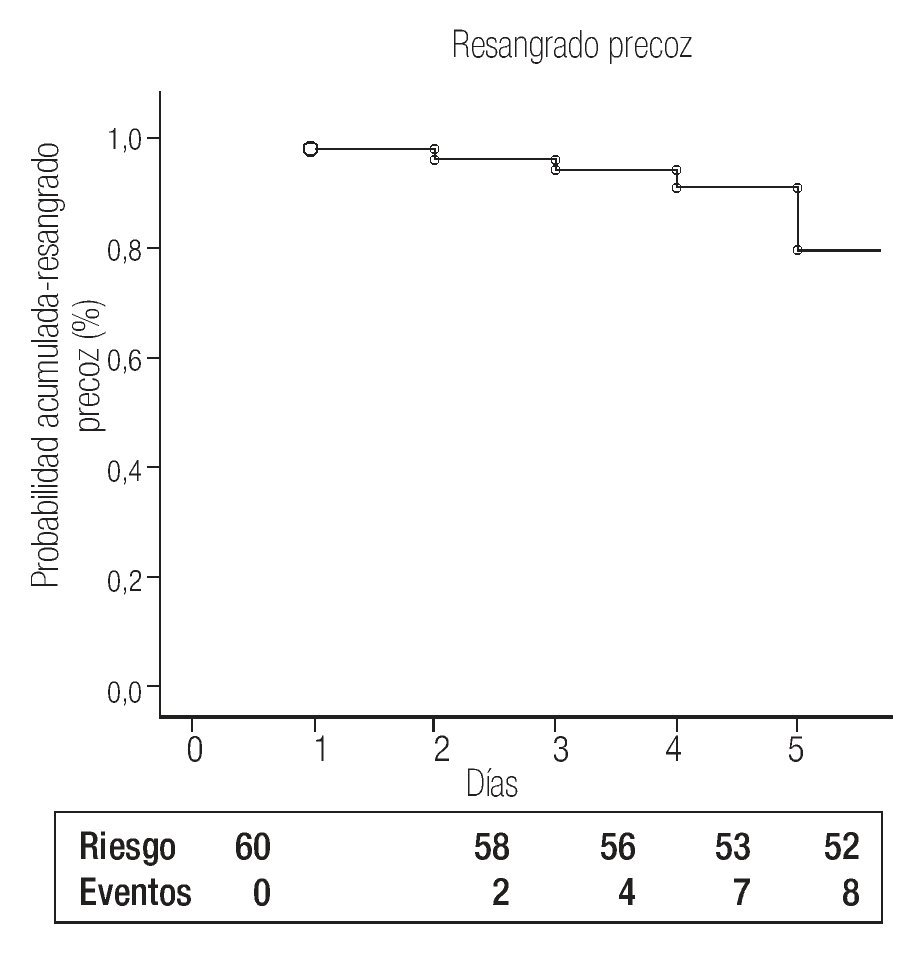
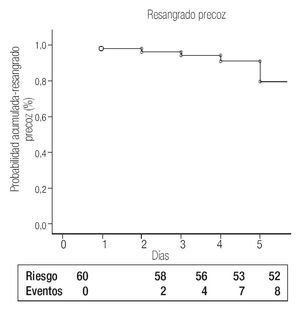
La tasa de fallo de control encontrada en el año de recolección fue de 5% (4 de 75 pacientes). Los pacientes con fallo de control se trataron mediante cirugía derivativa (n = 2) y un tercer procedimiento endoscópico (n = 1). Uno falleció sin tratamiento porque su mal estado general no le permitió entrar a cirugía. Ocho (13%) sujetos presentaron resangrado precoz y ocho (13%) murieron por las siguientes causas: resangrado intrahospitalario (n = 5), insuficiencia hepática (n = 2) y choque séptico (n = 1). La gráfica de Kaplan-Meier que muestra las proporciones acumuladas de resangrado precoz de la cohorte se muestra en la Figura 1.
Figura 1. Gráfica de Kaplan-Meier para probabilidad acumulada de resangrado precoz después de hemorragia varicosa aguda.
La mediana de estancia hospitalaria fue de nueve días (rango 3-15). El procedimiento endoscópico inicial fue efectivo en 56 enfermos (93%). En los casos en los que la endoscopia no logró la hemostasia inicial, se colocó una sonda de Sengstaken-Blackmore y se practicó un segundo procedimiento durante las siguientes 24 h, con lo que se obtuvo una tasa de hemostasia de 100%. No ocurrieron eventos adversos mayores (broncoaspiración, perforación intestinal, etc.) durante los procedimientos endoscópicos.
Escalas pronósticas
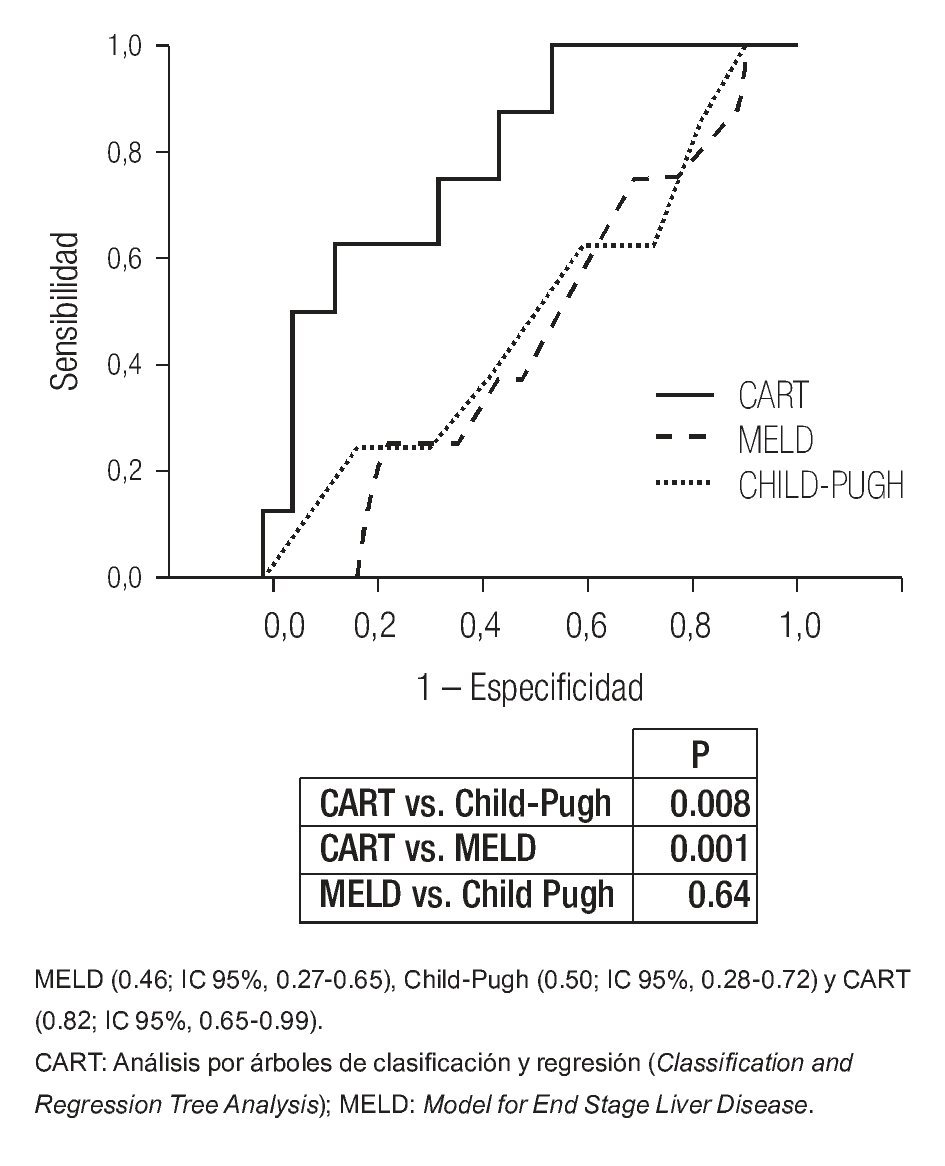
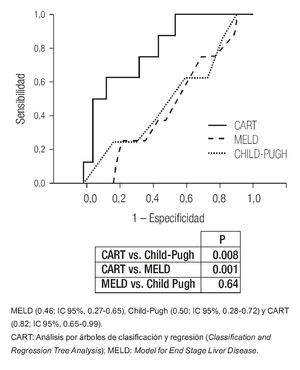
Para la evaluación de la eficiencia de los modelos pronósticos, se generaron curvas ROC para MELD y CP (ABCROC 0.46: IC 95%, 0.27-0.65; 0.50: IC 95%, 0.28-0.72, respectivamente) ambas sin relevancia clínica.
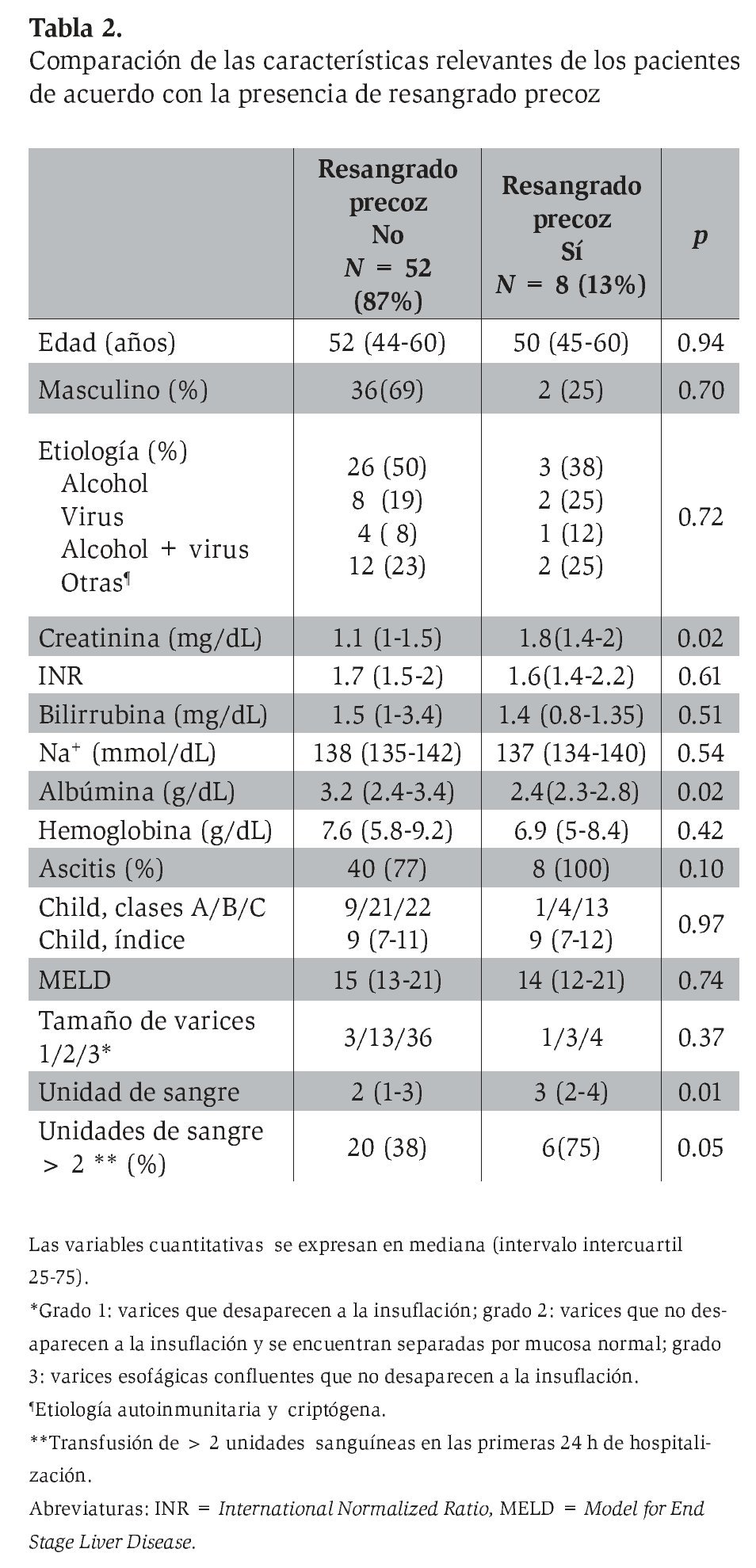
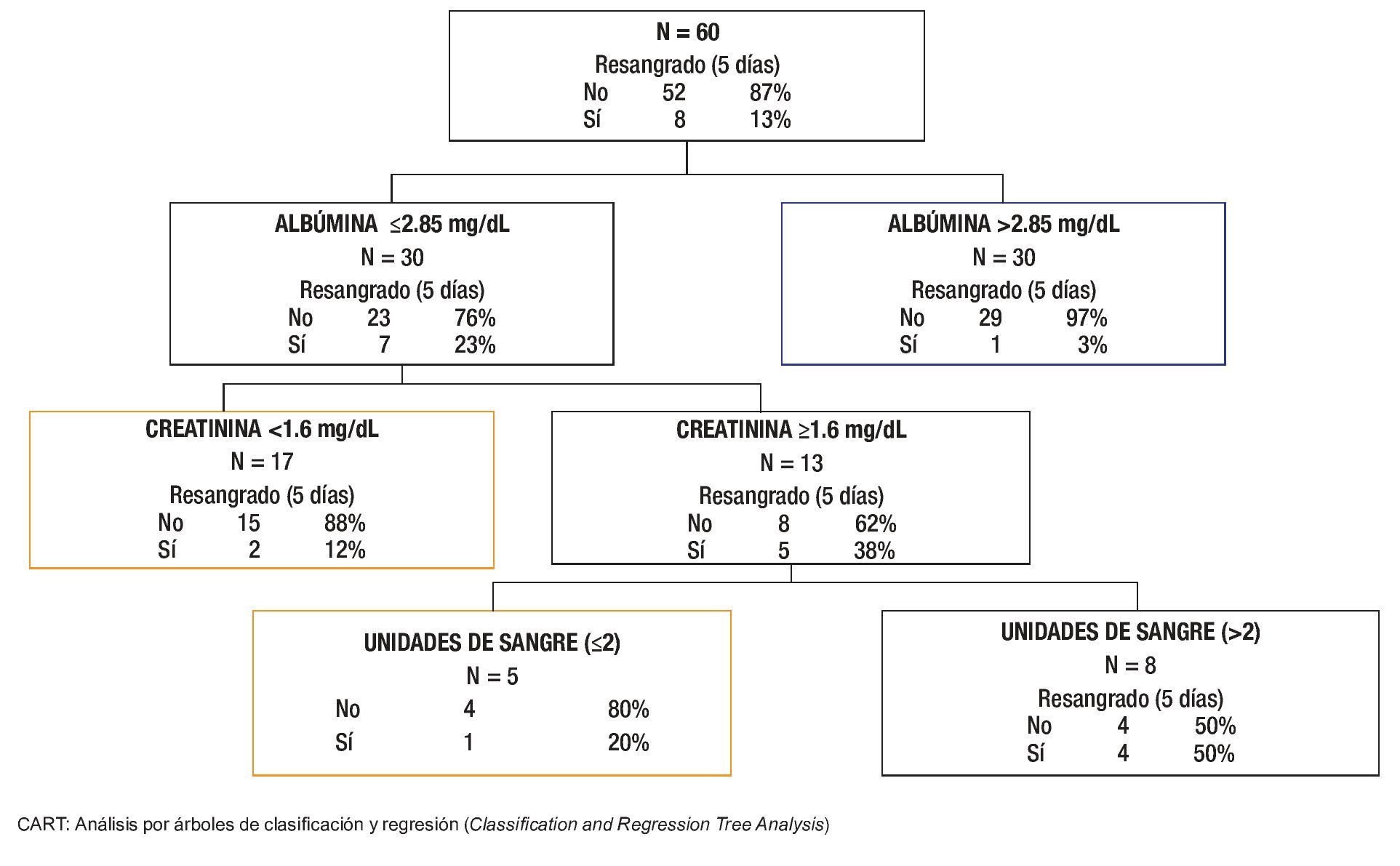
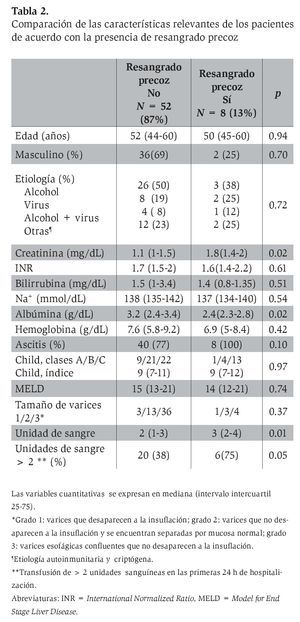
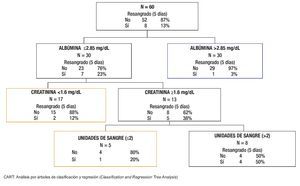
Para el análisis de la cohorte se establecieron dos grupos con base en el resangrado precoz. Después de la comparación de los grupos (Tabla 2), las variables clínicas y bioquímicas más relevantes se introdujeron de manera directa en el análisis CART. El mejor árbol de decisión (índice de Gini 0.40) se generó con dos variables bioquímicas (albúmina y creatinina) y el número de unidades sanguíneas transfundidas durante las primeras 24 h de estancia hospitalaria, que obtuvieron la mejor puntuación (Figura 2). Los mejores puntos de corte para las variables fueron albúmina de 2.85 mg/dL y 1.6 mg/dL para creatinina. El número de paquetes globulares que se consideró más relevante para la predicción de resangrado precoz fue más de dos unidades. En el análisis CART, la curva ROC (la cual se genera de manera automática) mostró una eficacia clínica muy buena (ABCROC 0.82: IC 95%, 0.65-0.99; p= 0.003). La primera división del modelo fue con albúmina y mostró 97% de probabilidad libre de resangrado precoz en los pacientes con niveles superiores al punto de corte de la variable. En la segunda y tercera divisiones del modelo, en los pacientes en los que la creatinina fue de 1.6 mg/dL o mayor o en los que se documentó una transfusión mayor de dos unidades sanguíneas en las primeras 24 h, la tasa de resangrado precoz fue de 38% y 50% respectivamente. Al comparar la eficacia de las curvas ROC construidas para CART, MELD y CP, se determinó que este nuevo modelo CART mostró mucha mayor utilidad para predecir resangrado precoz (Figura 3).
Figura 2. Modelo pronóstico para resangrado precoz basado en el árbol inductivo generado por el análisis CART de 60 pacientes después de un episodio de hemorragia varicosa aguda.
Figura 3. Comparación de las áreas bajo la curva ROC (ABCROC) de los modelos pronósticos para predicción de resangrado precoz obtenidos por CART, Child-Pugh y MELD.
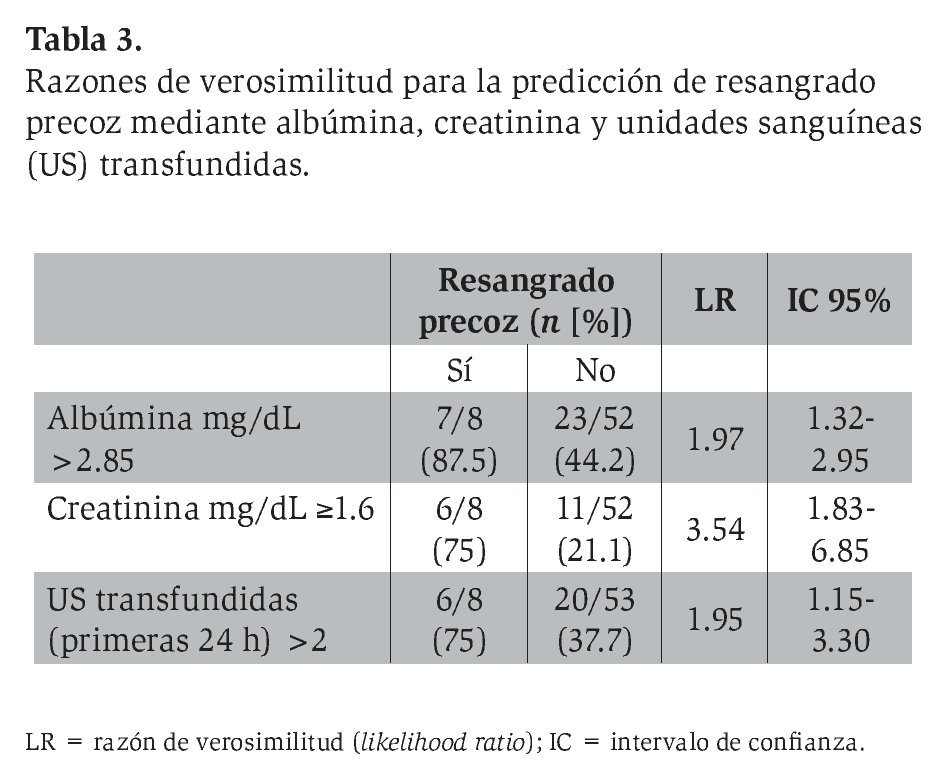
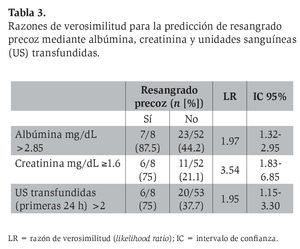
Al analizar las tres variables propuestas por CART para RP mediante tasas de verosimilitud (LR) en toda la cohorte, la dicotomización de los pacientes mediante niveles de creatinina de 1.6 mg/dL o mayores fue la que mejor LR mostró (LR 3.54; IC 95%, 1.83-6.85).
Discusión
Después de lograr el control inicial de un cuadro agudo de HV, el resangrado precoz constituye una determinante mayor de mal pronóstico y plantea un gran reto para los médicos clínicos.19 En consecuencia, son imperativos tanto el adecuado control de la hemorragia aguda como la prevención de la recurrencia en los primeros cinco días posteriores a la misma.19,21-22 Por estas razones, la estratificación adecuada de los pacientes con riesgo elevado de resangrado precoz es fundamental ya que es probable que se requieran medidas terapéuticas más agresivas para disminuir las tasas de resangrado y la mortalidad. En la actualidad, centros especializados ofrecen un tratamiento "a la carta" (p. ej., tratamientos más agresivos para pacientes con "alto riesgo") con base en la estratificación de riesgos por el gradiente de presión de la vena hepática (GPVH), un procedimiento que no está disponible en una buena parte de centros que atienden a pacientes cirróticos con HV.24-26
Algunos estudios han analizado los factores pronósticos durante los primeros cinco días que siguen a la presentación del cuadro de hemorragia aguda con resultados heterogéneos y en casi todos ellos los índices que se emplean (MELD y CP) tienen resultados contrastantes.15,23,26-27 Por otro lado, los modelos pronósticos usados se han generado sin validación estadística alguna (en el caso de CP) o por análisis de regresión logística o proporcional de Cox. La utilización de estos métodos se basa en su exactitud y su empleo, en teoría, fácil para el no estadístico.28 No obstante, a menudo los médicos clínicos encuentran desafiante integrar toda esta información pronóstica en la práctica clínica diaria.29-30 En fecha reciente, se han explorado y evaluado métodos alternativos de análisis estadístico, como el análisis por medio de CART, para la predicción de riesgo en el terreno médico, incluida la hepatología.31-33
En el presente estudio se analizaron los factores pronósticos de resangrado precoz en pacientes cirróticos con HV en una cohorte de un solo centro de atención secundaria. El principal objetivo del estudio fue proponer de manera alternativa y novedosa un modelo de predicción de resangrado precoz. Se observó 13% de resangrado precoz (con exclusión de los casos con CHC), que es similar al informado en estudios recientes bien desarrollados.26-27,34 Sin embargo, la mortalidad intrahospitalaria (13%) fue superior a muchos de los datos actuales. Es probable que esto refleje la falta de medidas de tratamiento más agresivas en pacientes de alto riesgo. También confirma que el pronóstico de los pacientes con HV no está determinado por una sola variable, sino por la interacción de ellas.
Recientemente, Flores-Rendón y colaboradores27 observaron, en un estudio retrospectivo, la escasa capacidad predictiva de fallo de control de la HV obtenida con CP y MELD (ABCROC 0.69 y 0.67 respectivamente). No obstante, en la predicción de mortalidad intrahospitalaria ambas escalas mostraron buen desempeño, con una supremacía de MELD sobre CP en los pacientes en los que la mortalidad se relacionó con la hemorragia. Estos datos pueden verse reforzados con los resultados del presente estudio, en el que ambas escalas (CP y MELD) tuvieron un pésimo desempeño como en la predicción de resangrado precoz.
El papel que el GPVH (≥ 20 mmHg) desempeña en el pronóstico de resangrado precoz puede apreciarse en el estudio de Abraldes y colaboradores,26 en el cual mostró ser la variable con mejor predicción de fallo de control de HV a los cinco días (OR 5.44; IC 90%, 1.67-17.69). No obstante, en este estudio, al excluir el GPVH del modelo, el mejor predictor fue la escala de CP (OR 17.61; IC 90%, 2.37-130.02 clase C vs. A; OR 6.41; IC 90%, 1.01-40.75 clase B vs. A).
El punto más original del presente estudio es el empleo del análisis CART para evaluar el resangrado precoz. La principal ventaja del CART es su capacidad para identificar subgrupos con diferente pronóstico con base en combinaciones simples de características clínicas. Para la predicción de resangrado precoz una vez establecida la hemostasia inicial se propone un modelo CART (Figura 2) basado en la combinación de tres variables bioquímico-clínicas (albúmina, creatinina y número de unidades sanguíneas en las primeras 24 h del ingreso). Este modelo conduce a distinguir con rapidez tres subgrupos con pronóstico diferente: primero, un subgrupo con bajo riesgo (pacientes con albúmina >2.85 mg/dL) con una baja tasa de resangrado, que quizá no requiera medidas terapéuticas agresivas; segundo, los pacientes con albúmina ≤ 2.85 g/dL y creatinina < 1.6 mg/dL o creatinina ≥ 1.6 mg/dL que no requirieron más de 2 US el primer día de hospitalización pueden incluirse en el grupo de riesgo intermedio, con 12% a 20% de resangrado precoz. Por último, un tercer grupo, el de alto riesgo (50% de resangrado precoz), que comprende a los pacientes que sobrepasaron el punto de corte determinado para albúmina y creatinina, y que recibieron múltiples transfusiones. El modelo muestra una capacidad predictiva muy buena (ABCROC 0.82: IC 95%, 0.65-0.99; p= 0.003) y su naturaleza intuitiva lo constituye como una evaluación de pronóstico fácil, sin necesidad de cálculos complejos o variables subjetivas dependientes del explorador. Además, al comparar las ABCROC de los distintos modelos puede observarse una clara superioridad del modelo CART sobre CP y MELD, la cual tiene significancia estadística (Figura 3).
Con la intención de corroborar dentro de la cohorte la capacidad predictiva de las variables propuestas por el método CART, se realizó un análisis de verosimilitud en la totalidad de la muestra analizada. Los LR para los puntos de corte de las tres variables propuestas mostraron una buena asociación con resangrado precoz (Tabla 3). La variable con mejor LR fue la creatinina (≥ 1.6 mg/ dL). Los niveles de creatinina han tenido antes su lugar como factor asociado a mortalidad a las seis semanas.31-32,34 Según el conocimiento de los autores, la función de esta variable fuera de índices pronósticos y la jerarquía de la misma en la interacción con los diferentes determinantes de resangrado precoz no se habían determinado. Ello es de especial interés porque para el tratamiento de los pacientes con alto riesgo de mortalidad y resangrado se han propuesto incluso medidas como el uso precoz de TIPS (transyugular intrahepatic portosistemic shunt).35 Es deseable que antes de emplear medidas agresivas, como TIPS o cirugía derivativa de urgencia, se agoten los objetivos terapéuticos del tratamiento médico. A la fecha, la creatinina aún no se utiliza como objetivo terapéutico en estos pacientes, por lo que no se ha empleado el tratamiento de la insuficiencia renal en cirróticos con HV más allá que con fármacos vasoactivos.36
Otro punto interesante de este estudio es el riesgo conferido a los pacientes con transfusiones múltiples durante las primeras 24 h. Con anterioridad se informaron datos similares aunque con puntos de corte de US más altos y siempre vinculados con un índice pronóstico.23 Cabe mencionar que datos preliminares muestran una menor tasa de fallo del tratamiento y de mortalidad a seis semanas con estrategias de transfusión restrictiva (nivel límite de hemoglobina en 7 g/dL) en pacientes con HV.37
El presente estudio tiene varias limitantes: primera, a pesar de que el CART desarrolla una validación cruzada interna para cada árbol, se requieren estudios posteriores en diferentes cohortes para probar la validez externa del modelo dada la dificultad para la transferencia de modelos pronósticos;9,28 segunda, su diseño retrospectivo, y tercera, el tamaño reducido de la muestra.
En conclusión, el estudio confirma la escasa efectividad de los modelos convencionales (CP y MELD) para predecir RP en pacientes cirróticos con HV aguda. Para la evaluación pronóstica de RP de este grupo de pacientes se propone un método novedoso y fácil basado en la combinación de dos variables bioquímicas y una variable clínica, el cual es superior a los modelos que suelen utilizarse.
Agradecimiento/subvenciones
En la actualidad, José Altamirano recibe el "Estímulo Héctor Orozco Zepeda 2007" por parte de FUNSALUD AC, FUNDACIÓN AMPARO y FUNDHEPA AC, México. Salvador Augustin recibe subvención por parte del Institut de Recerca Vall d´Hebron/La Caixa y forma parte del programa de posgrado de la Universitat Autònoma de Barcelona. Laura Muntaner participa en el programa de posgrado de la Universitat Autònoma de Barcelona.
Correspondencia: Dr. José Altamirano.
Unidad de Hepatología, Departamento de Medicina Interna, Hospital Universitari Vall d´Hebron. Passeig Vall d´Hebron 119, 08035 Barcelona, España. Servicio de Gastroenterología, Hospital Juárez de México. México, D F
Teléfono: 34 6719 20419. Fax: 34 9327 46068.
Correo electrónico: dr_altamirano@hotmail.com