El ejercicio en la cirrosis hepática es un tópico emergente en hepatología. A pesar de los beneficios conocidos del ejercicio en la población general, actualmente hay pocos estudios que aborden este tema en la cirrosis y aún se necesita más evidencia. Aunque algunos estudios han mencionado un aumento agudo en el gradiente de presión venosa hepática (HVPG) inducido por el ejercicio, existen datos actuales que muestran lo contrario (una disminución en HVPG) después de un programa de ejercicio durante>14 semanas. Además de este beneficio, se han descrito mejorías en el perfil metabólico, la calidad de vida, la masa muscular, la función cardiopulmonar y el estado nutricional. En conjunto, esto hace que el ejercicio en la cirrosis sea una intervención muy atractiva. Sin embargo, ciertas consideraciones deben tenerse en cuenta antes de prescribir ejercicio en esta población, incluido el riesgo cardiovascular, la enfermedad osteomuscular y las complicaciones relacionadas con la cirrosis. Después de considerar estos factores, se debe estructurar un programa de ejercicio individualizado en cada paciente, de acuerdo con lo anterior y el objetivo que se busque. En esta revisión se presenta la información sobre las limitaciones, la prescripción del tipo de ejercicio y los métodos utilizados para su monitorización, así como el tratamiento nutricional concomitante.
Exercise in cirrhosis of the liver is an emerging topic in hepatology. Despite the known benefits of exercise in the general population, there are currently few studies addressing that issue in relation to cirrhosis and more evidence is still needed. Even though some studies have reported an acute, exercise-induced increase in the hepatic venous pressure gradient (HVPG), the opposite (a decrease in the HVPG) has been shown by recent data after an exercise program carried out for>14 weeks. In addition to that benefit, improvement has been described in the metabolic profile, quality of life, muscle mass, cardiopulmonary function, and nutritional status. Together, those features make exercise in cirrhosis a very attractive intervention. However, certain aspects must be taken into account before prescribing exercise in that population and they include cardiovascular risk, musculoskeletal disorders, and complications related to cirrhosis. After considering those factors, an individually tailored exercise program should be developed for each patient, according to the points stated above and the desired goal. Information about exercise-limiting factors, type of exercise prescribed, monitoring methods, and concomitant nutritional therapy is provided in the present review.
Durante casi 20 años no existió en la literatura información suficiente para sustentar y recomendar el ejercicio físico como una intervención útil en pacientes con cirrosis e hipertensión portal. La evidencia por la cual no se recomendaba el ejercicio en cirrosis se basó en los hallazgos de 2estudios con un tamaño de muestra pequeño. En el primero se encontró un aumento agudo del gradiente de presión hepático venoso (GPHV), mientras los pacientes se ejercitaban en un cicloergómetro1. El otro estudio mostró el mismo hallazgo de aumento del GPHV, que se previno en el grupo que recibió bloqueadores beta previos al ejercicio. Con esta evidencia, existía el temor de recomendar ejercicio en los pacientes con cirrosis, por el riesgo potencial de inducir sangrado variceal2.
Una de las observaciones más importantes en estos 2estudios fue que el aumento en el GPHV fue agudo, mientras el paciente realizaba ejercicio en un cicloergómetro. Esta respuesta es similar al aumento normal y fisiológico en la presión arterial sistémica, observada en personas sanas mientras realizan ejercicio3,4. Esto hace suponer que el aumento en la presión portal durante el ejercicio es una respuesta fisiológica normal, que se puede modificar en circunstancias específicas, como un programa de entrenamiento físico. La adaptación del cuerpo, y específicamente de ciertos órganos, al ejercicio se ha documentado principalmente en enfermedades cardiopulmonares, incluyendo la insuficiencia cardíaca, enfermedad pulmonar obstructiva crónica, postinfarto agudo de miocardio, entre otras5,6.
La evidencia inicial que demostró que el ejercicio físico es seguro en pacientes cirróticos con hipertensión portal provino de un estudio aleatorizado y controlado pequeño, en el que se evaluó el efecto de ejercicio aeróbico supervisado y se encontró que el ejercicio realizado de manera crónica no solo no aumentó el GPHV, sino que lo disminuyó7. Un estudio subsecuente, no controlado, en pacientes con cirrosis por NAFLD reportó resultados similares8. Pero más allá de la seguridad del ejercicio en términos de la presión portal (y aún mejor, del descenso en el GPHV), existen múltiples beneficios potenciales del ejercicio que hacen que esta intervención sea muy atractiva y que sea considerada como tratamiento de primera línea en los pacientes con cirrosis e hipertensión portal. Estos beneficios incluyen mejoría en la función cardiopulmonar, metabólica, de la composición corporal y la calidad de vida7,9,10.
A pesar de los beneficios del ejercicio antes mencionados, actualmente no existen guías o recomendaciones sobre la prescripción de ejercicio en cirrosis, los factores limitantes que deben considerarse antes de iniciar un programa de ejercicio, el seguimiento posterior a la intervención y la importancia del tratamiento nutricional concomitante. El objetivo de esta revisión es proporcionar información que sirva como guía para la atención de pacientes con cirrosis tratados mediante un programa de ejercicio.
Asociación entre actividad física, ejercicio y aptitud físicaPara entender los alcances del ejercicio en cirrosis, y previo a la evaluación y la prescripción de esta intervención en los pacientes, es necesario entender algunas definiciones básicas. Si bien las definiciones varían dependiendo del consorcio que las emiten (fig. 1), y que estas definiciones provienen de población sin cirrosis11, el objetivo final de cualquier programa de ejercicio debería enfocarse en 3 puntos principales: a) mantener la funcionalidad mientras el paciente recibe tratamiento farmacológico o se encuentra en espera de un tratamiento definitivo (THO); b) lograr y mantener la independencia de los pacientes, y c) mejorar la calidad de vida. Cuando el cuerpo del paciente es «funcional», le permite al paciente mantener un nivel mínimo de funcionamiento, permitiéndole usar los diferentes sistemas del cuerpo (sistema nervioso central, muscular, cardiopulmonar) para realizar las necesidades básicas en la vida diaria, más allá de estar solamente confinado a la cama.
Cuando un paciente se mantiene funcional, esto le permitirá ser independiente y satisfacer las necesidades básicas en la vida diaria, incluyendo cocinar, bañarse por sí mismo, caminar sin asistencia, etc. Finalmente, la integración de funcionalidad e independencia permitirá al paciente la interacción con otras personas y limitar las comorbilidades y costos relacionados con la enfermedad, traduciéndose en una mejor calidad de vida (fig. 2).
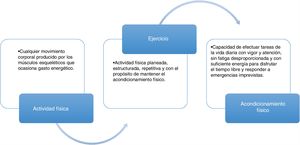
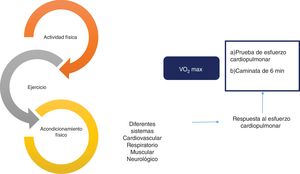
Efecto y evaluación de la interrelación entre actividad física, ejercicio y acondicionamiento físico. Existe una relación estrecha entre la actividad física, el ejercicio y el acondicionamiento físico, constituyendo un continuo con impacto en múltiples sistemas en el organismo, incluyendo cardiovascular, respiratorio, muscular y neurológico, entre los más importantes. Este efecto se evalúa habitualmente mediante la respuesta al esfuerzo cardiopulmonar, utilizando diferentes métodos como la prueba de esfuerzo cardiopulmonar y la caminata de 6 min. Finalmente, el consumo máximo de oxígeno (VO2máx) es el parámetro objetivo que más se ha estudiado con relación al acondicionamiento físico.
La integración de todos estos conceptos ayuda a tener en cuenta la importancia de la actividad física en los pacientes con cirrosis, planear y estructurar el plan de ejercicio y, al final, visualizar y centrarse en un objetivo final del programa en estos pacientes.
Monitorización de la actividad física en pacientes con cirrosisCuando un paciente con cirrosis se evalúa con el objetivo de someterlo a un programa de ejercicio, una de las preguntas básicas antes de iniciar es cómo seguir los cambios en las variables que indican aptitud física, considerando los recursos disponibles en el centro donde el paciente será evaluado, y saber las limitaciones y los beneficios de cada método. El seguimiento es un paso obligatorio posterior a iniciar cualquier intervención relacionada con el ejercicio en pacientes con cirrosis. Para este propósito, 2 objetivos deberían considerarse: 1) monitorear a los pacientes mientras realizan ejercicio, y 2) evaluar el efecto final del ejercicio en la aptitud física y acondicionamiento físico.
La monitorización de la actividad física en pacientes con cirrosis se puede realizar tanto de manera intrahospitalaria como ambulatoria. La mayoría de la información disponible en esta población, se realizó en programas supervisados (esto es, de manera intrahospitalaria), en donde se usó supervisión directa por un equipo entrenado (enfermeras, médicos, rehabilitadores físicos). Algunos de estos abordajes incluyen la monitorización de la frecuencia cardiaca (FC) durante el ejercicio, con el objetivo de alcanzar entre el 60-70% de la FC máxima (FCmáx=220 – edad, entre otras fórmulas que pudieran ser más exactas como FCmáx=207 – [0.7×edad])12,13. Otros métodos para monitorizar la actividad física en estos pacientes incluyen supervisión directa por un especialista en actividad/rehabilitación física, quien guía el ejercicio pero sin algún método objetivo como la FC, los equivalentes metabólicos (MET), etc.
Si bien existen guías recientes para la prescripción del ejercicio tanto en adultos sanos, como en diferentes enfermedades (American College of Sports Medicine [ACSM]), estas no están diseñadas para la atención de pacientes con cirrosis y aún no existen estudios que evalúen el modelo general de prescripción del ACSM en esta población. Este modelo se describirá más adelante.
Sin embargo, el reto más importante y difícil es la monitorización del ejercicio en pacientes cirróticos de manera ambulatoria. Para lograr esto, existen algunos métodos que se pueden usar de manera sencilla, precisa y relativamente barata, como los podómetros. La manera más práctica de medir la actividad física diaria en estos pacientes es contando el número de pasos realizados a través de un acelerómetro en forma de pulsera, que estime tanto el número de pasos (esto es, que funcione como un podómetro), como la actividad física en MET. Habitualmente, el promedio de pasos diarios se realiza mediante la monitorización por un periodo de 2-3 semanas14, sin embargo, 3 días de registro (2 días de registro durante la semana y 1 día del fin de semana) proporcionan información confiable15. Tudor-Locke et al. proponen la siguiente clasificación de la actividad física evaluada mediante podómetro en adultos no cirróticos16: a) sedentario < 5,000 pasos/día; b) baja actividad 5,000-7,499 pasos/día; c) actividad moderada 7,500-9,999 pasos/día, y d) activos ≥ 10,000 pasos/día. Estos valores contrastan notablemente con lo reportado en pacientes en lista de THO (3,164±2,842 pasos/día vs. 7,000-14,000 en adultos sanos, no cirróticos), en donde además se observa una correlación negativa entre la gravedad de la enfermedad y el número de pasos diarios17. Sin embargo, actualmente no existe un consenso que defina el grado de actividad física de acuerdo con el número de pasos en población con cirrosis, por lo que clasificaciones como la anterior no son aplicables para estos pacientes.
Existen distintas escalas subjetivas para evaluar la capacidad que tienen los pacientes para realizar actividades de la vida diaria, algunos ejemplos son el índice Karnofsky y la encuesta Rosow-Breslau, entre otras. Es importante mencionar que los resultados de dichas escalas no muestran asociación con el rendimiento físico real al compararse con otras herramientas más confiables como la medición del número de pasos a través de un podómetro, a pesar de que, en general, pueden ser de utilidad principalmente cuando no se dispone de más herramientas. Probablemente, la limitación más importante de las escalas subjetivas es que los pacientes se perciben más activos de lo que realmente son. Debido a esto, la monitorización objetiva de la actividad física con instrumentos capaces de medir el número de pasos resulta de especial interés en cirrosis18.
Es importante conocer los pasos que da un paciente diariamente y así diseñar intervenciones clínicas que promuevan un aumento de estos. Un estudio previo evaluó la intervención de un suplemento con aminoácidos de cadena ramificada (AACR) y la adición de 2,000 pasos al promedio de pasos diarios, y se reportó que después de 3 meses la fuerza de la pierna medida por el ergómetro y la fuerza de agarre mejoraron significativamente19. En pacientes con enfermedad cardíaca, se ha documentado que el podómetro sirve como una herramienta de automotivación debido a la información que brinda y que conduce a una competencia mayor para lograr el objetivo de los pasos diarios20.
La prueba de caminata de 6 min (6MWT) es un método comúnmente utilizado para evaluar la resistencia cardiopulmonar en pacientes con enfermedades pulmonares, neuromusculares y neurológicas, y se ha informado de que es útil para pacientes con cirrosis, incluso en pacientes hospitalizados con carcinoma hepatocelular. Por lo general, la resistencia cardiopulmonar se usa en ensayos clínicos para cuantificar los cambios a partir de una intervención de ejercicio con el objetivo de mejorar la capacidad aeróbica21,22. La 6MWT es una prueba práctica que mide la distancia que un paciente puede caminar rápidamente sobre una superficie plana en un período de 6 min. Evalúa las respuestas de todos los sistemas involucrados durante el ejercicio, incluidos el sistema pulmonar y cardiovascular, la circulación sistémica y periférica y el metabolismo muscular23. Las directrices para llevar a cabo la 6MWT establecido por la American Thoracic Society recomienda el uso de un corredor con una superficie plana de 30 m de longitud; sin embargo, no todas las instituciones tienen pasillos tan largos, lo que dificulta su aplicación, por esto mismo, el uso de corredores de 20 m también ha sido validado para la realización de esta prueba en pacientes con cirrosis24.
Además de ser una herramienta fácil de usar, la 6MWT es de bajo costo. Se utiliza para evaluar terapias y programas de rehabilitación, y como predictor de mortalidad en candidatos para trasplante hepático; de hecho, se ha observado que los pacientes que caminan menos de 250 m tienen una mortalidad más alta que aquellos que caminan más de 350 m; además, los síntomas respiratorios asociados con esta prueba correlacionan con la disminución de la capacidad pulmonar, que es una estrategia predictiva para la duración de la estancia hospitalaria y la ventilación mecánica después del trasplante25,26. Pero más allá de la importancia pronóstica de la 6MWT, esta se ha utilizado para monitorizar el efecto de diferentes programas de ejercicio en pacientes con cirrosis, mostrando su utilidad27,28.
Otro método útil para evaluar la resistencia cardiopulmonar es la prueba de ejercicio cardiopulmonar, que generalmente se realiza en una banda para correr motorizada o en un cicloergómetro. La forma más utilizada de esta prueba es la cicloergometría porque puede usarse en pacientes con inestabilidad de la marcha, limitaciones ortopédicas u obesidad severa29. El intercambio de gases se mide a través del consumo de oxígeno (VO2) y la salida de dióxido de carbono (VCO2), con lo que se puede calcular el consumo máximo de oxígeno (VO2máx), que es el parámetro más utilizado para evaluar la resistencia cardiopulmonar y que indica cuando el límite fisiológico real se alcanzó. Esto difiere del consumo pico de oxígeno (VO2pico), el cual se observa cuando el desempeño máximo se limita por factores musculares locales, y se usa en personas con enfermedades crónicas. De esta manera, el uso del VO2pico sería lo recomendado para los pacientes con cirrosis22.
Para evaluar la capacidad cardiopulmonar, y dado que la mayoría de los pacientes con cirrosis realizan muy poca actividad física, es importante seleccionar un protocolo de prueba apropiado, recomendándose aquellos que mantienen o los que aumentan la carga de trabajo por etapa de manera paulatina y levemente. Idealmente, el protocolo seleccionado debería permitir al paciente alcanzar un período de 8-12 min. El protocolo se seleccionará en función de las comorbilidades del paciente, así como de las complicaciones de la cirrosis29. Por otro lado, si se necesita evaluar de manera concomitante la presencia de enfermedad coronaria (que puede ser importante en pacientes con EHGNA), los pacientes deben alcanzar un esfuerzo máximo durante la prueba. Sin embargo, actualmente no existen estudios que evalúen cuál es el mejor protocolo para los pacientes con cirrosis13.
Factores que limitan el ejercicio y la evaluación antes de su inicioAntes de asignar un paciente a un programa de ejercicio físico, es necesario realizar una evaluación médica minuciosa que examine el estado general de salud, incluida la función cardiopulmonar, las enfermedades concomitantes y las limitaciones osteomusculares. El objetivo principal de la evaluación en población no cirrótica es identificar cualquier dato (condición médica, signo o síntoma) que constituya un riesgo potencial para participar en un programa de ejercicio de manera segura13.
Tomando en cuenta lo anterior, en la primera evaluación clínica para la prescripción del ejercicio en pacientes con cirrosis, el médico tratante debe enfocarse en 2áreas: 1) examinar cualquier condición que impida al paciente realizar ejercicio de manera segura, teniendo en cuenta las pautas recomendadas en la población general (es decir, cardiovasculares, osteomusculares, enfermedades metabólicas y renales), y 2) complicaciones específicas de la cirrosis.
En las guías del ACSM para la prescripción del ejercicio, se recomienda evaluación médica en personas con enfermedad o signos y síntomas de problemas cardiovasculares, renales o metabólicos. A pesar de que no existen recomendaciones específicas para pacientes con cirrosis, la lógica sugiere que todos los pacientes deberían evaluarse por un médico experimentado (según el juicio clínico), con el objetivo de identificar condiciones de riesgo como las descritas anteriormente, antes de iniciar con el ejercicio. Considerando que la mayoría de los pacientes con cirrosis no realizan actividad física de manera regular (i. e., 30min de actividad física moderada, 3 veces/semana, durante los últimos 3 meses) y la posibilidad de que coexista afección cardiovascular, metabólica (p. ej., en NAFLD) o renal (disfunción renal por diuréticos, síndrome hepatorrenal), todos los pacientes con cirrosis deberían someterse a una evaluación médica detallada13,30.
Para lograr una evaluación de riesgo adecuada en los pacientes que serán asignados a un programa de ejercicio, además de la evaluación médica completa, es necesario considerar algunos estudios de laboratorio y gabinete que pudieran ayudar a caracterizar mejor el estado general. Entre estos estudios se encuentran el perfil de lípidos, glucosa en ayuno, hemoglobina glucosilada, proteína C reactiva, electrocardiograma, ecocardiograma, espirometría, citología hemática, radiografía de tórax, entre otros. Existen guías específicas en las que se describe más en detalle la utilidad de cada uno de estos estudios; sin embargo, de manera general, se puede mencionar que la evaluación clínica minuciosa y el sentido común serán los que dicten los estudios a realizar, incluyendo aquellos estudios especializados para evaluar la reserva cardiaca y la permeabilidad de las arterias coronarias, en caso de que los factores de riesgo así lo indiquen (electrocardiograma, cateterismo, talio-201, o tecnecio 99m-sestamibi, etc.)31.
Entre las diferentes herramientas para abordar el estado de salud inicial y la actividad física en aquellos pacientes cuyo objetivo es comenzar un programa de ejercicio, los cuestionarios validados resultan una buena opción. Estos cuestionarios han sido desarrollados por diferentes instancias internacionales, incluyendo la Sociedad Canadiense de Fisiología del Ejercicio, la Organización Mundial de la Salud, el ACSM y la Asociación Estadounidense del Corazón (tabla 1). De estos, el cuestionario PAR-Q+ha sido ampliamente validado y en las últimas guías de evaluación y prescripción de ejercicio de la ACSM es el que se recomienda, por lo que es aconsejable su uso (ACSM 10).
Cuestionarios para evaluar la salud de la población antes de la prescripción del ejercicio
| Nombre del cuestionario | Organización | Referencia o sitio web |
|---|---|---|
| Cuestionario Global de Actividad Física | OMS | http://www.who.int/ncds/surveillance/steps/resources/GPAQ_Analysis_Guide.pdf |
| Cuestionario Internacional de Actividad Física. Versión corta y larga | OMS e investigadores | https://www.ncbi.nlm.nih.gov/pubmed/16925881http://www.elsevier.es/es-revista-revista-iberoamericana-fisioterapia-kinesiologia-176-pdf-13107139http://www.elsevier.es/es-revista-revista-iberoamericana-fisioterapia-kinesiologia-176-pdf-13107139 |
| Physical Activity Readiness Questionnaire for EveryoneElectronic Physical Activity Readiness Medical ExaminationAmerican College of Sports Medicine Risk Stratification Screening Questionnaire | National Academy of Sports MedicineAmerican College of Sports Medicine | https://eparmedx.com |
| Physical Activity and Physical Fitness-PAQNational Health and Nutrition Examination Survey | Centers of Disease Control and PreventionNational Health and Nutrition Examination Survey | https://wwwn.cdc.gov/nchs/data/nhanes/2017-2018/questionnaires/PAQ_J.pdf |
| Adult Pre-exercise Screening System | Exercice & Sports Science Australia, Fitness Australia and Sports Medicine Australia | https://www.essa.org.au/wp-content/uploads/2011/09/Screen-tool-version-v1.1.pdf |
| AHA/ACSM Health/Fitness Facility Pre-participation Screening Questionnaire | American Heart AssociationAmerican College of Sports Medicine | Whitfield, G. P., Gabriel, K. K. P., Rahbar, M. H., & Kohl, H. W. (2014). Application of the AHA/ACSM Adult Preparticipation Screening Checklist to a Nationally Representative Sample of US Adults Aged 40 and Older from NHANES 2001–2004. Circulation. 2014;129(10):1113-1120 http://doi.org/10.1161/CIRCULATIONAHA.113.004160 |
En general, los pacientes cirróticos son menos activos que los no cirróticos y la mayoría de los ensayos clínicos de ejercicio en cirrosis han sido supervisados7,28,32. Hay complicaciones específicas de la cirrosis que limitan el rendimiento del ejercicio, incluido el compromiso cardiopulmonar, como el síndrome hepatopulmonar y la hipertensión portopulmonar, e incluso el derrame pleural (hidrotórax hepático) en etapas avanzadas de la enfermedad. Estas complicaciones alteran el intercambio normal de gases y la mecánica de la interfase pleura-pulmón, causando una oxigenación anormal (hipoxemia) e hipercapnia, y restricción pulmonar (secundaria a una pobre absorción de O2). Otros factores que pueden limitar el ejercicio en la cirrosis son el edema periférico, los calambres musculares y la ascitis, ya que limitan el proceso normal de caminar y causan restricción pulmonar33,34.
Anteriormente, el aumento del GPHV inducido durante el ejercicio era una preocupación constante entre los hepatólogos, limitando su prescripción y, aún más, promoviendo el sedentarismo en la población con cirrosis. Esta recomendación derivó de 2 estudios que mostraban un aumento agudo de la presión portal mientras el paciente realizaba ejercicio en el cicloergómetro. Debido a esto, la mayoría de los estudios en curso actualmente son en pacientes con bajo riesgo de sangrado variceal. Sin embargo, la evidencia actual de nuestro grupo muestra que a largo plazo (es decir, efecto no agudo), el ejercicio en realidad se asocia a una disminución en el HVPG7. Este hallazgo fue confirmado posteriormente por un estudio no controlado, que muestra una mejora en la presión portal después de un programa de ejercicio en pacientes cirróticos con obesidad8.
Aunque algunos estudios han demostrado una correlación negativa entre la escala Child-Pugh (CTP) y la capacidad de ejercicio medida por el VO2pico35, la gravedad de la enfermedad (evaluada mediante puntuaciones como CTP y MELD) no es una contraindicación para realizar ejercicio en la cirrosis36. En las primeras fases de la enfermedad (es decir, Child-Pugh A), la tolerancia al ejercicio, medida a través del VO2pico, se encuentra relativamente conservada en comparación con las últimas etapas de la enfermedad. Por lo tanto, aunque se necesita un enfoque prudente en etapas avanzadas de la enfermedad, y se deben realizar diferentes modificaciones al programa de ejercicio antes de asignar a un paciente a la intervención, el ejercicio no está contraindicado solo en función de los puntajes de gravedad de la enfermedad. Esto es algo que debe considerarse por el médico encargado del cuidado de pacientes con cirrosis, para no perpetuar la inmovilidad y, por ende, disminuir la capacidad física.
Prescripción de ejercicio en cirrosisEvidencia del uso de ejercicio en cirrosisActualmente, no existe información disponible en la literatura con respecto a la prescripción del ejercicio o alguna guía sobre este tema en cirrosis o hipertensión portal. Sin embargo, los datos de los diferentes ensayos clínicos sobre este tópico, así como las guías recientes de prescripción de ejercicio en población no cirrótica, podrían ayudar a «guiar» la prescripción del ejercicio en este entorno clínico13. Las principales características con respecto al tipo, la duración y la intensidad del ejercicio en cirrosis, en diferentes estudios de investigación se mencionan en la tabla 2. La mayoría de los estudios incluyen a pacientes de entre 40-50 años de edad con cirrosis en una etapa compensada de la enfermedad (es decir, Child-Pugh A) y la mayoría recibe terapia nutricional especializada junto con el programa de ejercicio. En cuanto al programa de ejercicio físico, prácticamente todos los protocolos usan ejercicio aeróbico de 2maneras: cicloergometría y caminata (usando una cinta para correr o en un caso, usando un podómetro como dispositivo de monitorización).
Estudios de ejercicio en cirrosis hepática
| Autor | Tipo de estudio | Intervención | N | Descripción del ejercicio | Resultados | ||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Control | Ejercicio | Agudo/crónico | Tipo (aeróbico/anaeróbico) | Calentamiento (min) | Ejercicio(min) | Enfriamiento(min) | Carga de trabajo | Días | Monitorización | ||||
| García-Pagan et al.,19961 | EC | 8 | Agudo | Aeróbico:cicloergometría | 8-10 | 30 y 50% | Cicloergómetro (E. Jaeger, Würz burg, Alemania) | – ↑ GPVH (p=<0.01)– ↓ flujo sanguíneo hepático (p=<0.05) | |||||
| Saló y Guevara., 199737 | EC | Ascitis | 21 | Agudo | Aeróbico: cicloergometría | 30 | 3 MET | Cardiac Stress Testing Table, EDC, Inc., Lowell, MA | – ↑ PAM (p=<0.0001)– ↑ frecuencia cardiaca (p=<0.0001)– ↑ renina plasmática (p=0.001)– ↑ aldosterona (p=0.018)– ↑ norepinefrina (p=0.0001)– ↓ FPR (p=0.0001)– ↓ TFG (p=0.025)– ↓ ENaU (p=0.032) | ||||
| Bandi et al.,19982 | ECADoble ciego | Propranolol/placebo | 11 | 12 | Agudo | Aeróbico:cicloergometría | 8-12 | 30%40 W | Cicloergómetro (Ergometry System 380, Siemens-Elema, Schönander, Suecia) | – ↓ GPVH (p=<0.01) con propranolol– ↑ GPVH (p=<0.01)– ↓ FSH (p=<0.01) con placebo | |||
| Pattullo et al., 201310 | EC | Tratamiento nutricional | 10 VHC9 CH | Caminata | 10,000 pasos | 7 días semana24 semanas | Podómetro (Digiwalker SW-700, Yamax, Tokio, Japón) | – ↑ pasos/día (p=0.001)– ↓ ingesta calórica (p=<0.001)– ↓ IMC (p=<0.001)– ↓ HOMA-IR (p=0.002)– ↓ resistencia a la insulina (p=0.008) | |||||
| Zenith et al.,201428 | ECA | 10 | 9 | Crónico | Aeróbico:cicloergometría | 5 | 30(↑ 2.5 cada semana) | 5 | 60-80% del VO2 | 3 días semana8 semanas | Cicloergómetro Monark (Monark Exercise AB, Vansbro, Suecia) | – ↑ VO2 pico (p=0.001)– ↑ MM (p=0.001),– Mejora CV (p=0.01) | |
| Román, et al.201438 | ECA | Leucina 10 g/día | 9 | 8 | Crónico | Cicloergometría | 10 | 10-30 | 10-15 | 60-70% FCM | 3 días semana6 semanas | – | – ↑ capacidad de ejercicio (p=0.01)– ↑ MM (p=0.02)– Mejora CV (p=0.03) |
| Cinta de caminar | 10 | 15-20 | 10-15 | 3 días semana6 semanas | |||||||||
| Resistencia: pesas y bandas elásticas en brazos | 5-10 | 3 días semanaÚltimas 6 semanas | |||||||||||
| Macías-Rodríguez et al., 20167 | ECA | Terapia nutricional | 12 | 13 | Crónico | Cicloergometría y quinesioterapia | 10 | 40 | 10 | 60-80% FCM12-14 escala de Borg | 3 días semana14 semanas | Cicloergómetro (Ergoline, Bitz, Alemania) | – ↓ GPVH (p=0.05)– Mejora en eficiencia ventilatoria (p=0.03) y AF en EFS |
| Debette-Gratien et al., 201527 | EC | Educación terapéutica: beneficios del ejercicio | 8 | Crónico | Cicloergometría | 20 | 2 días semana12 semanas | Cicloergómetro tipo (DX1 ergómetro Kettler Alemania) | – ↑ VO2 pico (p=<0.008)– ↑ potencia máxima (p=0.02)– ↑ distancia de caminata de 6min (p=<0.02)El umbral ventilatorio (p=0.02)Fuerza muscular (p=0.008) | ||||
| Banco de fuerza | 20 | 70-80% RM 3 series, 8 repeticiones+1 repetición a la semana 6 | |||||||||||
| Román et al., 20169 | ECA | Relajación | 9 | 14 | Crónico | Cicloergometría y cinta de caminar | 10 | 10-30 al final. | 10-15 | 60-70% FCM | 3 días semana12 semanas | - | – ↑ TTE (p=<0.001)– ↑ UAV (p=0.009)– ↓ GCT (p=0.003) – -↓ Timed Up & Go test (p=0.02)– ↑ MM (p=0.01)en el grupo de ejercicio |
| Pesas y bandas elásticas | 5-10 | ||||||||||||
| Berzigotti A, et al.,201739 | Cohorte, prospectivo multicéntrico | Terapia nutricional | 50 | Crónico | Aeróbico y rutina de fuerza | 10 | 40 | 10 | 10-12 escala de Borg | 1 día semana16 semanas | – ↓ GPVH (P=0.0001)– ↓ peso (> 10%) (p=0.024) | ||
| Kruger et al., 201840 | ECA | Terapia nutricional | 20 | 20 | Crónico | Ejercicios de fuerza en casa | 8 semanas | Cicloergómetro | En el grupo de ejercicio:– ↑ distancia caminata de 6min. (p=<0.009)–↑ VO2 pico (p=<0.02) | ||||
1 watt (W) cuesta aproximadamente 10.3ml de O2/ min.
1 equivalente metabólico es equivalente al consumo de O2 reposo para un hombre sano de 70kg.
AF: actividad física; CH: cirrosis hepática; CV: calidad de vida; EC: ensayo clínico; ECA: ensayo clínico aleatorizado; EFS: ejercicio físico supervisado; ENaU: excreción de Na urinario; FPR: flujo plasmático renal; FSH: flujo sanguíneo hepático; GCT: grasa corporal total; GPVH: gradiente de presión venosa hepática; IMC: índice de masa corporal; MET: equivalentes metabólicos; MM: masa muscular; TFG: tasa de filtración glomerular; PAM: presión arterial media; RM: repeticiones máximas; TTE: tiempo total de esfuerzo; UAV: umbral anaeróbico ventilatorio; VHC: virus de hepatitis C; VO2: volumen de oxígeno.
La duración total de los protocolos varía de 30 a 60 min, y un promedio de 3 veces por semana de ejercicio físico supervisado, más ejercicios en el hogar. Algunos protocolos incluyen un programa de ejercicios trifásicos que incluye una fase de calentamiento, una fase de componente principal y un período de enfriamiento. Con el fin de limitar las lesiones que pueden ser inducidas por el ejercicio, y de acuerdo con las pautas recomendadas en la población normal, parece que el enfoque de 3 o 4 fases es el mejor para la prescripción de ejercicio en pacientes con cirrosis en etapas iniciales de la enfermedad. En este sentido, es necesario conocer el esquema general de prescripción de ejercicio en población no cirrótica, recomendado de acuerdo con las guías recientes13.
Guías para la prescripción de ejercicio en población no cirróticaAunque el esquema general de prescripción de ejercicio de la ACSM proporciona una base útil para los pacientes con cirrosis, no debería considerarse como una fórmula obligatoria y siempre debería tenerse en cuenta que no fueron hechas para esta población. Las sesiones de entrenamiento físico incluyen 4 componentes: 1) calentamiento (5-10 min); 2) acondicionamiento (20-60 min); 3) enfriamiento (5-10 min), y 4) estiramiento (10 min). El programa de ejercicio sigue un plan general bajo el acrónimo FITT (Frecuencia, Intensidad, Tiempo [duración] y Tipo [modo]). Las guías actuales recomiendan una frecuencia de 5 días/semana de ejercicio aeróbico de intensidad ligera (30-40% FC reserva [FC de reposo – FC máxima]) o moderada (40-60% de la FC reserva), durante 30-60min/día (≥ 150min/semana), que involucre grandes grupos musculares (caminar, nadar, trotar, baile, entre otros).
Recomendaciones para prescribir ejercicio en cirrosisTomando en cuenta las guías de prescripción en población no cirrótica, así como los estudios clínicos de ejercicio en cirrosis mencionados anteriormente, se deberían considerar 4puntos para la prescripción de ejercicio en pacientes con cirrosis: 1) evaluarlos cuidadosamente para buscar complicaciones generales y las inducidas por la cirrosis que pueden limitar el ejercicio; 2) diseñar y elegir el programa de ejercicio más adecuado en función del estado de salud de cada paciente; 3) establecer un objetivo, y 4) verificar la mejor herramienta disponible para hacer un seguimiento del progreso de los pacientes.
Con respecto al primer punto, previamente se mencionó la evaluación a la que debe someterse a los pacientes antes de iniciar el ejercicio, con el objetivo de prevenir lesiones o complicaciones derivadas de condiciones médicas preexistentes, incluyendo las complicaciones específicas de la cirrosis.
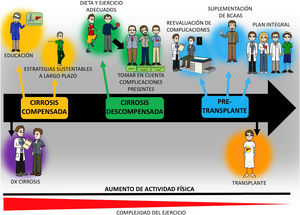
Una vez evaluado el estado de salud, se puede utilizar el esquema de prescripción de ejercicio descrito arriba, con algunas adaptaciones de acuerdo con los estudios en cirrosis. De manera simplificada, las sesiones de entrenamiento físico pueden constar de 3 componentes: 1) calentamiento (5-10 min); 2) fase principal o acondicionamiento físico (20-60 min) y 3) enfriamiento y estiramiento (10 min). Durante el calentamiento y el enfriamiento se recomienda realizar movimientos que permitan lubricar las articulaciones más importantes que se usarán o usaron, así como el estiramiento de los músculos involucrados en el entrenamiento. En la fase principal, en pacientes con poca condición física, lo recomendable sería iniciar con 20 min de actividad física, con incrementos graduales (5-10min cada 1-2 semanas) (ACSM 10). De la misma manera, el programa de ejercicio bajo el esquema FITT y con la información disponible en población con cirrosis, sugiere 5 días/semana de ejercicio de intensidad ligera o moderada (esto determinado mediante la FCreserva [30-40%] o la escala de Borg [10-14]), durante 30-60min/día (≥ 150min/semana), de una actividad como caminar o cicloergometría. De manera práctica, una actividad física moderada de 150min/semana equivale a entre≥5,400-7,900 pasos/día; esto puede ayudar a guiar de manera más fácil la prescripción del ejercicio13. Finalmente, este modelo puede usarse para educar a los pacientes con cirrosis en prácticamente todas las etapas de la enfermedad, de tal manera que les sirva como base para la rehabilitación postrasplante y evitar complicaciones metabólicas propias de este (fig. 3).
Esquema general de la intervención con ejercicio y nutrición de los pacientes con cirrosis a lo largo de su evolución. El aumento de la actividad física es recomendable a lo largo de la evolución de los pacientes con cirrosis, si bien la complejidad del ejercicio debería adecuarse según la etapa de la enfermedad y las complicaciones presentes al momento de la evaluación. El plan de ejercicio debería proveer educación a los pacientes acerca del beneficio y cómo realizarlo, así como incluir una adecuada nutrición, que puede requerir el uso de suplementos como los aminoácidos de cadena ramificada (BCAA). Finalmente, para lograr estos objetivos de un programa como tal, es necesario la participación de diferentes especialistas, incluyendo médicos, nutriólogos y expertos en actividad física, quienes adecuarán el programa de acuerdo con la etapa de la enfermedad.
En aquellos pacientes a los que no se les pueda aplicar este programa, como en los pacientes confinados a una silla de ruedas por falta de acondicionamiento físico, una de las primeras maniobras sería mantenerlo de pie con ayuda e incrementar de manera paulatina el tiempo en bipedestación. Así mismo, se pueden agregar ejercicios para mejorar la musculatura de los brazos, como las repeticiones con pelotas antiestrés. Por otro lado, en un paciente con cirrosis en etapas muy incipientes (como en aquellos con diagnóstico por biopsia, sin ningún estigma de la enfermedad), el programa de ejercicio es muy similar a una persona sin cirrosis, sin descuidar los otros factores limitantes (cardiopulmonares, osteomusculares, etc.). En pacientes con várices esofágicas, es necesario que se sigan los lineamientos ya establecidos del manejo de esta entidad clínica y no limitar la actividad física únicamente por este motivo. Cuando existe ascitis, el grado de la misma determinará el tipo e intensidad de la actividad física. Por último, en pacientes con encefalopatía hepática de nivel bajo, es aconsejable que en caso de realizar caminata, esta sea supervisada siempre por otra persona, con el propósito de evitar lesiones (p. ej., caídas).
El tener claro un objetivo previo al inicio de los programas de entrenamiento físico ayudará a planear el resto de los puntos y a alentar al paciente y a su familia, para la obtención de los resultados esperados. Por ejemplo, en el caso de un paciente con desnutrición importante y candidato a trasplante hepático, el objetivo de mejorar el estado nutricional (mejorar cantidad y calidad de tejido muscular, así como la capacidad de cicatrización postrasplante) ayudará a tener un plan bien estructurado y realizar el seguimiento adecuado del paciente (fig. 3).
La elección del método utilizado para monitorizar el progreso de los pacientes dependerá de la disponibilidad del método en el centro, el objetivo del programa, la experiencia en su uso (incluyendo la reproducibilidad y la confiabilidad), los costos y si realmente evalúa o es un subrogado confiable de lo que se requiere monitorizar.
Si bien aún hace falta mucha información con respecto a la prescripción de ejercicio en cirrosis, los puntos descritos a lo largo de este artículo proveerán bases adecuadas para evitar confinar a los pacientes al sedentarismo y ayudarán a tener una idea más clara de las variables que se tienen que considerar en este escenario clínico. Finalmente, el aumento de la actividad física y el ejercicio en esta población debe iniciar con la educación del paciente (enfermedad, intervenciones, etc.), para lograr estrategias sustentables a largo plazo (fig. 3). De la misma manera, se deben considerar las complicaciones de los pacientes al prescribir la actividad física/ejercicio, así como el estado general, e implementar un tratamiento nutricional adecuado a las necesidades del paciente. Este plan ayudará a establecer una rutina en los pacientes, que incluso ayudará a prevenir las complicaciones metabólicas postrasplante hepático. La complejidad del ejercicio/actividad física cambiará de acuerdo con la etapa de la enfermedad, pero esta no es una contraindicación per se de la intervención y debería considerarse en todos los pacientes con cirrosis (fig. 3).
Tratamiento nutricionalEl manejo dietético en pacientes con cirrosis hepática es un aspecto importante en el tratamiento integral de la enfermedad; de hecho, diversos estudios han demostrado que la combinación de dieta y ejercicio físico confiere mayores beneficios que cualquiera de las 2intervenciones aisladas8,41.
Para establecer un plan dietético en el paciente con cirrosis que realiza ejercicio, es necesario calcular el requerimiento energético con base en el estadio de la enfermedad, las comorbilidades y el nivel de ejercicio físico que se pretende prescribir con el fin de que el aporte sea suficiente para contrarrestar el catabolismo.
Requerimiento energéticoPara poder prescribir un tratamiento nutricional exitoso, es fundamental que se cubra en su totalidad el requerimiento energético del paciente, el cual puede ser estimado de distintas maneras; en condiciones ideales, se obtiene a partir de métodos como la calorimetría indirecta, sin embargo, esto resulta poco accesible por la poca disponibilidad y el alto costo. Por lo anterior, se han creado diversas fórmulas y recomendaciones para estimar el gasto energético basal (GEB); en la tabla 3 se muestran las fórmulas disponibles que se han utilizado en intervenciones de ejercicio y se explica en qué población pueden utilizarse.
Fórmulas para estimación del gasto energético basal (GEB)
| Nombre | Fórmula | Uso | |
|---|---|---|---|
| Cunningham42 | Fórmula general | GEB=(370+21.6×masa muscular magra×4.18) | Sujetos con sobrepeso u obesidad.Pacientes críticosMayor precisión en deportistas de alto rendimiento |
| Mujer | MLG=(79.5 – 0.24 [peso en kg] – 0.15 [edad, años]×peso en kg/73.2) | ||
| Hombre | MLG=(69.8 – 0.26 [peso en kg) – 0.12 [edad, años)×peso en kg/73.2) | ||
| Estimación rápida (Carrasco et al.43) | Mujer | GEB=16.2kcal×peso en kg | Sujetos sanos, con IMC normal, sobrepeso y obesidadAgregar factor de estrés por enfermedad y actividad física |
| Hombre | GEB=17kcal×peso en kg | ||
| Estimación rápida ESPEN44 | GET (con desnutrición)=35-40 Kcal×peso en kgGET (sin desnutrición)=30-35 Kcal×peso en kg | No se agrega factor de estrés | |
| Harris-Benedict45 | Mujer | GEB=655+(9.7×peso en kg)+(1.8×estatura en cm) – (4.7×edad en años) | Sujetos sanos, con IMC normalPacientes con CH utilizando peso ajustado (Wilkens) |
| Hombre | GEB=66.5+(13.7×peso en kg)+(5×estatura en cm) - (6.8×edad en años) | ||
| IOM46 | Mujer | GEB=354 – 6.91+AF×(9.36×peso [kg]+726×talla [m]) | Sujetos sanos, con IMC normalUso común en deportistas |
| Hombre | GEB=662 - 9.53+AF×[15.91×peso (kg)+539.6×talla (m)] | ||
| Mifflin et al.47 | Mujer | GEB=(10×peso en kg)+(6.25×estatura en cm) – (5×edad en años) – 161 | Sujetos con sobrepeso u obesidadPacientes hospitalizados |
| Hombre | GEB=(10×peso en kg)+(6.25×estatura en cm) – (5×edad en años)+5 | ||
| OMS/FAO48 | Mujer | GEB 18-30 años=(14.7×peso en kg)+496 GEB 30-60 años=(8.7×peso en kg)+829 GEB> 60 años=(10.5×peso en kg)+596 | Sujetos sanos con IMC normal y sobrepeso. |
| Hombre | GEB 18-30 años=(15.3×peso en kg)+679 GEB 30-60 años=(11.6×peso en kg)+879 GEB> 60 años=(13.5×peso en kg)+487 | ||
| Owen49 | Mujer | GEB=795+(7.18×peso en kg) | Sujetos con sobrepeso u obesidadValidada en atletas entrenados |
| Hombre | GEB=879+(10.2×peso en kg) | ||
| Oxford48 | Mujer | GEB 18-30 años=(10.4×peso en kg)+(615×talla en cm) – 282 GEB 30-60 años=(8.18×peso en kg)+(502×talla en cm) – 11.6 GEB> 60 años=(8.52×peso en kg)+(421×talla en cm)+10.7 | Sujetos sanos, con IMC normal |
| Hombre | GEB 18-30 años=(14.4×peso en kg)+(313×talla en cm)+113 GEB 30-60 años=(11.4×peso en kg)+(541×talla en cm) – 137 GEB> 60 años=(11.4×peso en kg)+(541×talla cm) – 256 | ||
| Schofield50 | Mujer | GEB 18-30 años=(0.062×peso en kg)+2.036 GEB 30-60 años=(0.034×peso en kg)+3.538 GEB> 60 años=(0.038×peso en kg)+2.755 | Sujetos sanos, con IMC normalPacientes con gasto energético elevado (quemaduras)Adulto mayor |
| Hombre | GEB 18-30 años=(0.063×peso en kg)+2.896 GEB 30-60 años=(0.048×peso en kg)+3.653 GEB> 60 años=(0.049×peso en kg)+2.459 | ||
| Valencia51 | Mujer | GEB 18-30 años=(11.02×peso en kg)+679 GEB 30-60 años=(10.92×peso en kg)+677 GEB> 60 años=(10.98×peso en kg)+520 | Sujetos sanos, con IMC normal, sobrepeso y obesidad creada en población mexicana |
| Hombre | GEB 18-30 años=(13.37×peso en kg)+747 GEB 30-60 años=(13.08×peso en kg)+693 GEB> 60 años=(14.21×peso en kg)+429 | ||
MLG se calcula de la misma manera que en Cunningham.
Género (hombre=1/mujer=0).
MLG: Masa libre de grasa; O: obesidad; T: trauma; Q: quemadura (sí=1/no=0); VE: ventilación minuto espirada.
A
A pesar de que Harris-Benedict y las fórmulas de estimación rápida son las más utilizadas, se ha documentado que en deportistas y sujetos en intervenciones que involucren ejercicio físico, las fórmulas de Cunningham, IOM y Owen son más apropiadas, así como Mifflin-St Jeor es la fórmula de elección en sujetos con sobrepeso u obesidad, ya que favorece la reducción de peso paulatina43,52; sin embargo, la fórmula de elección para calcular el GEB de cada paciente queda a criterio del nutriólogo responsable, que deberá tomar en cuenta al momento del cálculo las características propias de cada paciente.
Cuando el GEB se obtenga a partir de una fórmula de estimación rápida, no es necesario agregar factor de estrés por enfermedad ni de actividad física, sin embargo, si se obtiene a partir de cualquier otra fórmula, se agrega un porcentaje de calorías de acuerdo con el factor de estrés de la enfermedad, ya que de esta manera se pretende contrarrestar el hipermetabolismo presente en hasta el 58% de los pacientes, además se debe considerar el factor de actividad física que se realizará (tabla 4A y B)13,53,54.
A Factor estrés hepatopatía
| Estadio | Porcentaje a agregar al GEB |
|---|---|
| Fibrosis leve | – |
| Fibrosis avanzada | 5% |
| Cirrosis compensada | 10% |
| Cirrosis descompensada (encefalopatía hepática/varices esofágicas/ ictericia) | 15% |
| Cirrosis descompensada (ascitis/peritonitis bacteriana/carcinoma hepatocelular) | 15-30% |
| B Factor de actividad física | |
|---|---|
| Nivel | Porcentaje a agregar al GEB |
| Encamado | 10% |
| Actividad ligera | 15-20% |
| Actividad moderada | 20-30% |
| Actividad intensa | 30-40% |
| Actividad muy intensa | 40-45% |
La energía total requerida será obtenida entonces a partir del GEB+el estadio de la hepatopatía+el nivel de actividad física que se pretende indicar al paciente.
Recomendación y distribución de macronutrimentosUna vez obtenida la energía total en kilocalorías, se distribuyen entre hidratos de carbono, proteínas y lípidos. La cantidad específica de macronutrimentos depende de muchos factores, entre ellos, la cantidad de actividad física realizada y la presencia de complicaciones55.
Para comenzar la distribución se toma en cuenta primero la cantidad de proteínas por kilogramo de peso, esto se determina con base al estado nutricional del paciente55:
- –
Sin desnutrición: 1.2g/kg peso/día.
- –
Desnutrición leve: 1.3g/kg peso/día.
- –
Desnutrición moderada: 1.4g/kg peso/día.
- –
Desnutrición severa: 1.5g/kg peso/día.
Posteriormente, se determina el porcentaje de hidratos de carbono que puede ir del 45 hasta 65% del aporte calórico total. Esto debe establecerse con base en cada paciente, aunque se sugiere que en pacientes que realizarán ejercicio físico el aporte mínimo de hidratos de carbono sea del 55%. Las calorías restantes deberán ser aportadas por los lípidos. El paciente debe ingerir al menos 1ml por cada kcal indicada en la dieta y es importante que se mantenga una hidratación adecuada previa y durante el ejercicio físico44.
Debe realizarse una distribución al menos 5 tiempos de alimentación tomando en cuenta 2colaciones, una puede indicarse antes de la realización del ejercicio físico y otra como colación nocturna. De hecho, aunque los horarios de cada tiempo de comida dependerán de cada paciente, debe sugerirse que el espacio entre un alimento y otro no sea mayor de 4 h, evitando así largos períodos de ayuno.
SuplementaciónLa suplementación con AACR ha sido estudiada en esta población y su consumo se ha relacionado con incremento de la masa muscular, disminución de episodios de encefalopatía hepática, mejoría de la reserva hepática en pacientes con carcinoma hepatocelular, disminución de la resistencia a la insulina y mejoría en calidad de vida, por lo cual su consumo está ampliamente sustentado en pacientes con hepatopatía crónica56,57.
En un estudio piloto se evaluó el efecto de ejercicio aeróbico moderado más 10 g de leucina por día; se observó que en el grupo que recibió dicha intervención hubo una mejoría en la capacidad funcional y la calidad de vida, así como un aumento significativo de la masa muscular sin evidencia de complicaciones38. Existen algunos otros estudios que han evaluado el tratamiento conjunto de ejercicio físico más la suplementación de los 3AACR que sugieren un mayor efecto que el tratamiento aislado con suplementación o con ejercicio solos, encontrándose una mejoría en la capacidad anaeróbica y un potencial efecto benéfico en el control de la glucemia. Además, el consumo se ha relacionado con menor incidencia en las complicaciones propias de la enfermedad, aun así hace falta mayor evidencia acerca de los beneficios del suplemento en este grupo de pacientes58.
Otra estrategia que ha sido documentada como benéfica es la implementación de una colación nocturna que proporcione entre 200-400kcal, y sea, particularmente rica en proteína (20-40g), fibra e hidratos de carbono complejos, ya que ha demostrado mejoría en la masa muscular y el metabolismo energético al cubrir las necesidades calóricas durante la noche59,60. De hecho, al combinarse con la suplementación de AACR, la colación nocturna demuestra una mejoría importante en parámetros nutricionales, balance de nitrógeno y calidad de vida61.
ConclusionesSi bien aún hace falta generar más evidencia que sustente la seguridad y la eficacia del ejercicio en condiciones específicas en pacientes con cirrosis e hipertensión portal, la información disponible actualmente sustenta su uso de manera general en esta población. Para realizar una prescripción adecuada, es necesario conocer a priori las condiciones generales del paciente, así como las complicaciones derivadas de la cirrosis y visualizar el objetivo que se quiere alcanzar con el programa de ejercicio, así como las limitaciones que existen en el centro de atención.
Responsabilidades éticasEste trabajo de investigación no requirió consentimiento informado de pacientes ya que es una revisión de literatura.
Este trabajo no requirió la autorización de comités de ética debido a que es una revisión bibliográfica.
Los autores declaran que este artículo no contiene información personal que permita identificar a pacientes.
FinanciaciónNinguna.
Conflicto de interesesNinguno.
Ricardo U. Macías-Rodríguez agradece el apoyo brindado por la Universidad Nacional Autónoma de México (UNAM), el Patronato INCMNSZ y el Consejo Nacional de Ciencia y Tecnología (CONACYT) para la realización de este trabajo (parte de este artículo se basó en el trabajo de Doctorado realizado en la UNAM).