La enfermedad por reflujo gastroesofágico (ERGE) es muy prevalente en la población general, se presenta con un amplio espectro de manifestaciones clínicas que requiere de un diagnóstico y tratamiento de precisión.
ObjetivoEsta es una revisión de expertos que establece recomendaciones de buena práctica clínica para el diagnóstico y tratamiento personalizado de la ERGE.
MétodosLas recomendaciones de buena práctica clínica se generaron por un grupo de expertos en ERGE, miembros de la Asociación Mexicana de Gastroenterología (AMG), después de hacer una extensa revisión de la literatura publicada y de discutir cada recomendación en una reunión presencial. Este documento no pretende ser una guía de práctica clínica con la metodología que este formato requiere.
ResultadosUn total de 15 expertos en ERGE elaboraron 27 recomendaciones de buena práctica clínica para el reconocimiento de síntomas y complicaciones, uso racional de pruebas diagnósticas y tratamiento médico de los diferentes fenotipos, identificación y manejo de la enfermedad refractaria, de la sobreposición con trastornos funcionales, del tratamiento endoscópico y quirúrgico, así como sobre la ERGE en el embarazo, el adulto mayor y el paciente obeso.
ConclusionesActualmente, es posible un diagnóstico de precisión en la ERGE que permite prescribir una terapia personalizada en los sujetos con esta condición. Las recomendaciones de buena práctica clínica del grupo de expertos de la AMG presentadas en este documento pretenden ayudar al médico general y al especialista en el proceso del diagnóstico y tratamiento de precisión del paciente con ERGE.
Gastroesophageal reflux disease (GERD) is very prevalent in the general population, with a broad spectrum of clinical manifestations, requiring accurate diagnosis and treatment.
AimThe aim of this expert review is to establish good clinical practice recommendations for the diagnosis and personalized treatment of GERD.
MethodsThe good clinical practice recommendations were produced by a group of experts in GERD, members of the Asociación Mexicana de Gastroenterología (AMG), after carrying out an extensive review of the published literature and discussing each recommendation at a face-to-face meeting. This document does not aim to be a clinical practice guideline with the methodology such a document requires.
ResultsFifteen experts on GERD formulated 27 good clinical practice recommendations for recognizing the symptoms and complications of GERD, the rational use of diagnostic tests and medical treatment, the identification and management of refractory GERD, the overlap with functional disorders, endoscopic and surgical treatment, and GERD in the pregnant woman, older adult, and the obese patient.
ConclusionsAn accurate diagnosis of GERD is currently possible, enabling the prescription of a personalized treatment in patients with this condition. The goal of the good clinical practice recommendations by the group of experts from the AMG presented in this document is to aid both the general practitioner and specialist in the process of accurate diagnosis and treatment, in the patient with GERD.
La enfermedad por reflujo gastroesofágico (ERGE) es una condición que afecta aproximadamente a uno de cada cinco adultos de la población general, se presenta con un amplio espectro de manifestaciones clínicas y afecta significativamente la calidad de vida de los pacientes. Existen diferentes pruebas diagnósticas y diversas modalidades terapéuticas. Actualmente, es posible hacer una evaluación diagnóstica apropiada que permite identificar el fenotipo de la ERGE e indicar un tratamiento de precisión. Esta revisión tiene por objetivo hacer recomendaciones de buena práctica clínica para el gastroenterólogo y el médico general basadas en la evidencia científica reciente, discutida por un grupo de expertos en ERGE1–5.
MétodosEsta revisión de expertos fue comisionada por la Asociación Mexicana de Gastroenterología (AMG). Los especialistas se seleccionaron con base en su reconocida trayectoria académica docente, de investigación y asistencial con especial interés en la ERGE. Se hizo una extensa revisión de la literatura de los últimos 20 años sobre esta entidad, sus pruebas diagnósticas y tratamiento. Los expertos se dividieron en cinco grupos de trabajo para revisar las publicaciones y elaborar recomendaciones sobre: 1) reconocimiento de síntomas típicos, extraesofágicos y complicaciones de la ERGE; 2) uso racional de pruebas diagnósticas; 3) tratamientos de precisión basados en fenotipos endoscópicos y por medición del reflujo gastroesofágico; 4) tratamiento endoscópico y quirúrgico de la ERGE y 5) ERGE en poblaciones especiales. La versión 1.0 de las recomendaciones realizadas por cada uno de los grupos fue discutida y votada por todos los expertos en una reunión presencial. La versión 2.0 de los enunciados, creada en la reunión presencial, fue nuevamente revisada y corregida por cada uno de los grupos dando por resultado la versión 3.0. Esta última fue sometida a una lectura final por todos los participantes para su aprobación y se generó el documento que aquí se presenta.
Reconocimiento de síntomas típicos, extraesofágicos y complicaciones de la enfermedad por reflujo gastroesofágicoDefiniciónLa enfermedad por reflujo gastroesofágico se define como una condición que se desarrolla cuando el ascenso del contenido gástrico ocasiona síntomas y/o complicaciones que afectan la calidad de vida de quien lo padece.
Los pacientes pueden ser diagnosticados con ERGE con base en las manifestaciones clínicas y pruebas objetivas que demuestran el reflujo gastroesofágico como la medición del pH esofágico o la aparición de lesiones o esofagitis en la endoscopia.
Las manifestaciones clínicas de la ERGE se clasifican en síndromes esofágicos y extraesofágicos, los primeros se subdividen a su vez en sintomáticos y con lesión mucosa. Los síndromes sintomáticos son el dolor torácico por reflujo y la ERGE no erosiva (ERNE). Aquellos con lesión en la mucosa son la esofagitis erosiva (EE), estenosis, esófago de Barrett (EB) y adenocarcinoma del esófago (ACE)1.
Existen tres presentaciones fenotípicas de la ERGE, la más frecuente es la ERNE que se encuentra en 60-70% de los pacientes, la EE en 30% y el EB en 6-8%2.
De todos los pacientes con pirosis y endoscopia normal, 50% tienen un tiempo de exposición al ácido (TEA) anormal y pertenecen al grupo de ERNE. El restante 50% tiene un TEA normal, son los denominados trastornos funcionales esofágicos y se dividen en pirosis funcional (60%) e hipersensibilidad al reflujo (40%)3.
Los síndromes extraesofágicos se clasifican en los que poseen una asociación establecida (tos, laringitis, asma y erosiones dentales) y aquellos con relación posible, fibrosis pulmonar, otitis media, sinusitis y laringitis1.
EpidemiologíaLa ERGE es una enfermedad frecuente, con una prevalencia variable a nivel mundial, estimándose en 20% en la población general.
En una revisión sistemática de la epidemiología de ERGE definida como pirosis y/o regurgitación una vez a la semana, se informó una prevalencia de 10-20% en el mundo occidental mientras que en Asia fue menor a 5%4. En un estudio más reciente, el rango de la prevalencia estimada fue de 18.1-27.8% en Norteamérica y de 8.8-25.9% en Europa, de 2.5 a 7.8% en Asia, 8.7 a 33.1% en Medio Oriente, 11.6% en Australia y 23.0% en América del Sur. La evidencia sugiere un aumento en la prevalencia desde 1995 particularmente en Norteamérica y Asia5. La incidencia de síntomas en Norteamérica, Europa y el sureste asiático ha aumentado 50% en relación con la informada en la mitad de 1990, pero se ha estancado desde entonces5.
La obesidad y el tabaquismo son factores de riesgo. La primera tiene una razón de momios (OR) de 1.73, se asocia con EE (OR 1.59), EB (OR 1.24) y ACE6.
Se ha mencionado que la disminución en la prevalencia de gastritis por Helicobacter pylori podría explicar el incremento de la ERGE. Pero no se ha encontrado una asociación consistente entre los síntomas de la enfermedad y la presencia de H. pylori o la respuesta al tratamiento de erradicación. Un metaanálisis demostró que el riesgo para desarrollar síntomas de ERGE no se incrementó después de la terapia de erradicación. En ensayos clínicos, la eliminación no fue consistentemente vinculada con el desarrollo de novo de ERGE2 y no parece afectar la curación o recurrencia en la enfermedad preexistente. Los datos acumulados sugieren que el H. pylori tiene un posible factor preventivo para EE, EB y ACE. Este efecto es atribuido a la disminución en la producción de ácido por la gastritis del cuerpo gástrico y de atrofia gástrica ocasionando una reducción en la exposición esofágica al ácido2.
El consumo de tabaco está débilmente asociado con síntomas de ERGE (OR 1.26). La relación está apoyada por un estudio longitudinal en el cual los individuos que lo disminuyeron tuvieron tres veces mayor reducción de síntomas de regurgitación y pirosis que los que continuaron con este hábito7. El tabaquismo es un factor importante para el desarrollo de EE y ACE6.
Fisiopatología de la enfermedad por reflujo gastroesofágicoLa fisiopatología de la ERGE es multifactorial.
La ERGE es causada por el retorno del ácido a través de un esfínter gastroesofágico inferior incompetente con o sin la presencia de hernia hiatal (HH).
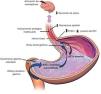
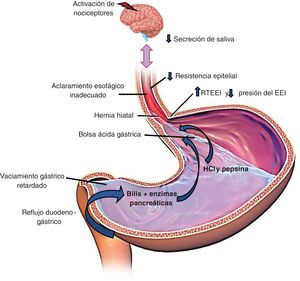
Los principales mecanismos para evitar el reflujo son: la unión esofagogástrica (UEG) compuesta por el esfínter esofágico inferior (EEI) y el diafragma crural (DC), el aclaramiento esofágico del material refluido mediante la peristalsis primaria y secundaria, y el aclaramiento químico por la neutralización del ácido por el bicarbonato de la saliva8. En la figura 1 se ilustran estos mecanismos fisiopatológicos.
Los factores que favorecen el reflujo del contenido gástrico al esófago incluyen los siguientes aspectos.
Alteración de la barrera antirreflujo:
- -
Las relajaciones transitorias del EEI (RTEEI). Este fenómeno es mediado por el nervio vago y se caracteriza por relajaciones no precedidas por la deglución. Ocurren frecuentemente en el periodo posprandial y son inducidas por la distensión gástrica. Las RTEEI son el mecanismo más común asociado a los episodios de reflujo9.
- -
HH. La presencia de HH causa pérdida de la barrera antirreflujo formada por la UEG. Se ha demostrado que la exposición esofágica al ácido es mayor en pacientes con HH. Además, el saco herniario permite que el material refluido se acumule en ese sitio y ocasione nuevos episodios de reflujo. Los sujetos con HH grandes tienen enfermedad por reflujo grave y muchos con modalidad más leve tienen evidencia de HH pequeñas10,11.
- -
Presión disminuida del EEI. La incompetencia del EEI es más común en EE, EB y HH.
Factores gástricos:
- -
Bolsa ácida. Es la acumulación del ácido gástrico no neutralizado por el alimento, después de una comida. Tiende a localizarse debajo de la UEG en el sujeto normal. En pacientes con ERGE, la bolsa de ácido se extiende hasta el esófago distal sobre todo en presencia de HH grandes y es responsable de los episodios de reflujo posprandial2.
- -
Retraso en el vaciamiento gástrico. Aproximadamente 30% de los pacientes con ERGE tienen retraso en el vaciamiento gástrico y este mecanismo favorece las RTEEI y la posibilidad de tener episodios de reflujo.
Sensibilidad esofágica: la sensibilidad esofágica desempeña un papel en la ERGE. Los síntomas pueden correlacionarse con los componentes del material refluido. El ácido, la extensión proximal del reflujo y el gas favorecen la percepción de los síntomas12.
Algunos pacientes con reflujo son más sensibles al ácido y esta sensibilidad puede estar asociada a la alteración en la integridad de la mucosa. Los episodios de reflujo que alcanzan el esófago proximal tienen mayor relación sintomática y pueden estar relacionados con la localización superficial de los nervios aferentes de la mucosa en el tercio superior del esófago13.
Síntomas típicos y manifestaciones extraesofágicasRecomendación 1.La presencia de síntomas típicos como pirosis y regurgitación o de manifestaciones extraesofágicas como tos, laringitis, asma bronquial o erosiones dentales sugieren la posibilidad de ERGE y obligan a una evaluación diagnóstica apropiada.
Los síntomas típicos de la ERGE son la pirosis y la regurgitación14. La primera se define como la sensación de ardor retroesternal que asciende del estómago hacia la boca. Ocurre particularmente después de grandes comidas grasas o la ingestión de alimentos condimentados, de productos cítricos, con chocolate o alcohol. La posición supina o el agacharse favorecen la regurgitación. La pirosis nocturna puede ocasionar alteraciones del sueño y afectar las actividades diarias. Se ha informado que la deprivación del sueño, así como los factores psicológicos pueden aumentar la percepción de la pirosis15. La frecuencia y la intensidad de esta no se asocian con el grado de daño a la mucosa esofágica. La regurgitación se define como el retorno sin esfuerzo del contenido gástrico hacia el esófago y que puede alcanzar la boca6. Estos síntomas son poco sensibles y específicos para detectar la ERGE. Los valores de sensibilidad y especificidad para el diagnóstico basados en síntomas son de 67 y 70%, respectivamente16.
El dolor torácico es otro síntoma asociado a esta enfermedad. Puede ser indistinguible del malestar por cardiopatía isquémica. La ERGE es la causa más frecuente de dolor torácico no cardiaco6.
Para considerar que un paciente tiene ERGE y no solamente reflujo gastroesofágico, debe presentar manifestaciones leves dos o más días a la semana, o síntomas moderados o graves al menos un día a la semana. Estos afectan la calidad de vida de los enfermos1.
La disfagia, el hipo y el eructo, son otros síntomas asociados a la ERGE. La disfagia se considera alarmante y siempre requiere una evaluación diagnóstica con endoscopia.
Las manifestaciones extraesofágicas que tienen una asociación establecida con la ERGE son la tos, laringitis, asma y erosiones dentales. Numerosos síntomas se han tratado de asociar a esta entidad, sin embargo, la evidencia de causalidad aún es discutida. Entre estos se incluye la faringitis, sinusitis, otitis, fibrosis pulmonar y globus, entre otros6. Los mecanismos fisiopatológicos de estas manifestaciones son el daño directo del ácido (microaspiración) o indirecto (la presencia de ácido en el esófago induce un reflejo vagal)7. Se considera que los síndromes extraesofágicos usualmente son de causa multifactorial y que la ERGE es uno de varios factores agravantes potenciales. Por lo tanto, es necesario investigar y hacer pruebas objetivas para demostrar que la ERGE es causa de estas manifestaciones17.
Complicaciones de la enfermedad por reflujo gastroesofágicoRecomendación 2.La estenosis péptica, la hemorragia digestiva, el EB y el ACE son complicaciones de la ERGE y deben sospecharse en población con factores de riesgo como síntomas de más de cinco años de duración, obesidad, sexo masculino, edad mayor de 50 años y consumo de tabaco.
Los hombres tienen mayor probabilidad de presentar EE, EB y ACE6. La edad avanzada es inconsistente con un riesgo aumentado para síntomas de ERGE, pero está relacionada al desarrollo de complicaciones y con hospitalizaciones por estenosis esofágica18.
En EE. UU. parece ser similar la prevalencia de síntomas de ERGE entre las diferentes razas, pero los individuos caucásicos tienen mayor riesgo de EE, de estenosis, de EB y ACE18.
Uso racional de las pruebas diagnósticasPrueba con inhibidores de la bomba de protonesRecomendación 3.En pacientes con pirosis y regurgitación sin datos de alarma, recomendamos una prueba con inhibidores de la bomba de protones (IBP) a dosis estándar por dos a cuatro semanas y en casos de dolor torácico no cardiaco por cuatro a ocho semanas.
La prueba con IBP se emplea de manera habitual en la práctica clínica y es recomendada por las guías internacionales. El IBP debe indicarse 30 a 60 minutos antes del desayuno por dos a cuatro semanas para los síntomas típicos de ERGE sin datos de alarma, y durante cuatro a ocho para el dolor torácico no cardiaco. Si los pacientes muestran una mejoría de 50%, deberán tratarse como enfermos con ERGE. Después de cuatro a ocho semanas de tratamiento continuo, se indicará un esquema a demanda o se suspenderá el IBP. En caso de recaída sintomática o una respuesta inadecuada, se deberá realizar una endoscopia después de haber suspendido el IBP por un periodo de dos a cuatro semanas19,20. Esta prueba tiene limitaciones como la falta de estandarización en la dosis, el tipo de IBP y la duración de la terapia. También se ha reconocido un efecto placebo de 20%8,21,22. El rendimiento diagnóstico de la prueba con IBP en personas con síntomas típicos tiene una sensibilidad de 79% (intervalo de confianza [IC] 95%, 72-84%) y una especificidad de 45% (IC, 95%, 4-49%), utilizando como estándar de referencia la endoscopia y la medición del pH esofágico de 24h. En sujetos con dolor torácico no cardiaco, la sensibilidad y especificidad de la prueba con IBP es de 79% (IC 95%, 69-86%)23.
Recomendación 4.En pacientes con manifestaciones extraesofágicas y síntomas típicos de ERGE recomendamos una prueba con IBP a doble dosis por 12 semanas. En aquellos con síntomas extraesofágicos sin manifestaciones típicas de ERGE sugerimos la realización de pruebas diagnósticas objetivas.
La prueba con IBP ha sido extrapolada para su uso en pacientes con síntomas extraesofágicos (disfonía, tos, asma), siendo propuesta como método diagnóstico y terapéutico; sin embargo, existen resultados inconsistentes de su eficacia. Un primer metaanálisis encontró que esta prueba no mejoró dichos síntomas en comparación con el placebo (riesgo relativo [RR] 1.28, IC del 95% 0.94–1.74)24. En cambio, en dos metaanálisis recientes, los sujetos tuvieron una tasa de respuesta significativamente más alta comparado con placebo (diferencia de riesgo=0.15; IC del 95% 0.01-0.30) y una superioridad moderada de IBP sobre placebo en reflujo laringofaríngeo (RR 1.31, IC del 95% 1.03-1.67)25,26.
La mejoría de los síntomas extraesofágicos no debe tomarse como prueba confirmatoria de la ERGE debido al efecto placebo, múltiples mecanismos fisiopatológicos y diversas manifestaciones extraesofágicas24. No obstante, se recomienda la prueba con IBP dos veces al día por 12 semanas en pacientes con síntomas extraesofágicos que tienen manifestaciones típicas de reflujo. Aquellos con signos extraesofágicos en los que la pirosis y la regurgitación están ausentes deben ser estudiados con pruebas diagnósticas objetivas de ERGE17,20.
EndoscopiaRecomendación 5.Recomendamos la endoscopia diagnóstica en pacientes con datos de alarma, riesgo de EB, en aquellos que no respondan a una prueba con IBP y en los casos que presenten recurrencia de síntomas al suspender el IBP o los bloqueadores de ácido competitivos del potasio (P-CAB).
La endoscopia es la prueba más útil para evaluar la mucosa esofágica. La presencia de EE, EB y estenosis esofágica son hallazgos diagnósticos de ERGE. La clasificación de Los Ángeles (LA) de EE sigue siendo la escala validada de mayor utilidad27. Debido a la variabilidad interobservador, los diferentes consensos de expertos establecen que la EE grado A de LA no es evidencia definitiva de ERGE14,28. La EE de grado B, C y D sí se consideran diagnósticas. El hallazgo de un segmento de >3cm de EB confirmado por biopsia es un diagnóstico definitivo de ERGE sin necesidad de realizar la medición del reflujo. Cuando existe EE grave (grado C/D de LA), se recomienda repetir la endoscopia después de un tratamiento con IBP a doble dosis por ocho semanas para evaluar la cicatrización de la mucosa y descartar EB, lo cual puede ser difícil de detectar cuando existe inflamación grave19,20.
Para aumentar el rendimiento diagnóstico de ERGE, la endoscopia debe hacerse dos e idealmente cuatro semanas después de la suspensión de los IBP. En un estudio se compararon las características clínicas y endoscópicas de pacientes con ERGE. Utilizando la regresión logística se demostró que los usuarios de IBP con mayor frecuencia se clasificaban como ERNE (OR: 3.2; p<0.001)29. Un estudio pequeño prospectivo, en 12 personas con EE y cicatrización de la mucosa, evaluó los cambios endoscópicos e histológicos tras dos semanas de suspender los IBP. A las dos semanas todos los sujetos tenían evidencia de EE por endoscopia y dilatación de los espacios intercelulares, incremento de linfocitos intraepiteliales e hiperplasia papilar en la biopsia30.
En el contexto de los sujetos con síntomas de ERGE que no responden a los IBP, es necesario descartar esofagitis eosinofílica (EEo). Por lo tanto, se recomienda suspender los IBP de dos a cuatro semanas previas a una endoscopia diagnóstica, ya que existe evidencia de que estos pueden ocultar los hallazgos endoscópicos e histológicos de EEo31. Durante las dos a cuatro semanas sin estos fármacos se le puede recomendar a los pacientes el uso de antiácidos para el alivio de los síntomas de reflujo20.
Se debe realizar una evaluación endoscópica completa, la cual incluye: evaluar la presencia de EE, hiato diafragmático, longitud axial de la HH e inspección del EB. Como mencionamos anteriormente, durante la evaluación endoscópica se debe examinar si existe EE y reportarla de acuerdo con la clasificación de LA. El hiato diafragmático se debe describir utilizando la clasificación de Hill sobre la válvula gastroesofágica en retrovisión y con insuflación gástrica, siendo los grados I y II normales; los grados III y IV se han asociado de forma independiente a una pobre respuesta terapéutica con los IBP y a la presencia de EE32,33. La evaluación del EB se debe hacer según la clasificación de Praga y con toma de biopsias usando el protocolo de Seattle34.
Medición de reflujo gastroesofágico: pH-impedancia, cápsula inalámbrica, impedancia de la mucosaRecomendación 6.En pacientes sin evidencia previa de ERGE en la endoscopia y con síntomas refractarios a la terapia antisecretora, recomendamos la realización de pHmetría con cápsula inalámbrica o pH-impedancia sin tratamiento. En aquellos con evidencia previa de ERGE en endoscopia y síntomas refractarios, sugerimos la evaluación con pH-impedancia con tratamiento.
La medición ambulatoria del reflujo existe en dos configuraciones: con catéter o con cápsula inalámbrica. Esta última o Bravo® (Medtronic™, Minneapolis, MN, Estados Unidos) se coloca durante la endoscopia en el esófago distal (6cm proximales a la unión escamocolumnar) utilizando un mecanismo de succión y clipaje35. Con esta técnica puede medirse la exposición al ácido hasta por 96 horas, además de valorar la relación entre los síntomas reportados por el paciente y los episodios de reflujo. Es mejor tolerada, aunque tiene un mayor costo19,36. En la pHmetría con catéter, se introduce a través de la nariz una sonda con un sensor de pH el cual se coloca a 5cm por encima del borde superior del EEI identificado mediante manometría. Esta técnica mide el TEA en el esófago distal durante 24 horas y establece la asociación sintomática con los episodios de reflujo. Adicionalmente, los catéteres de pH pueden combinarse con anillos de impedancia intraluminal (pH-IIM) para valorar el movimiento del aire y los líquidos a través del esófago (anterógrado-retrógrado), independientemente del pH, y clasificarlos en ácidos, débilmente ácidos, débilmente alcalinos, gaseosos, líquidos o mixtos8.
El TEA es la métrica más reproducible y el mejor predictor de respuesta al tratamiento farmacológico o quirúrgico. Según el consenso de Lyon 2.0, el TEA normal o fisiológico debe ser <4%. Uno> 6% es definitivamente patológico. Entre 4-6% se considera una zona gris, no concluyente, que requiere de parámetros adicionales como el número de episodios de reflujo por impedancia, la media de la impedancia basal nocturna (MNBI) y la asociación sintomática. Se considera normal <40 episodios de reflujo en 24h. Son anormales> 80 y no concluyentes entre 40 y 80. Una MNBI <1,500 Ohms apoya el diagnóstico de ERGE, mientras que una > 2,500 Ohms la descarta. El análisis del índice de onda peristáltica inducida por deglución después de un episodio de reflujo (PSPWI) puede apoyar el diagnóstico de ERGE, cuando este índice es menor de 60%37. En un ensayo clínico, doble ciego, en pacientes con pirosis, regurgitación y/o dolor torácico, y respuesta parcial a los IBP, a los cuales se les realizó medición de reflujo con cápsula inalámbrica sin IBP (siete días), seguido de una intervención de suspensión de IBP durante tres semanas; se estableció que un TEA <4% en los cuatro días del monitoreo tiene un OR de 10.0 (IC 95%) para predecir una suspensión exitosa de los IBP37. Es por esto, que la medición del pH con cápsula inalámbrica (hasta 96 horas) es el método de elección, para evaluar de forma objetiva los síntomas esofágicos de la ERGE. En sujetos con manifestaciones típicas asociadas a eructos excesivos, sospecha de rumiación o en signos extraesofágicos se recomienda la pH-IIM de 24 horas, ya que la impedancia permite detectar los episodios de eructos o rumiación y su asociación con episodios de reflujo14,20.
La pH-IIM de 24 horas con doble dosis de IBP es el método de elección para la medición ambulatoria de reflujo en pacientes con evidencia previa de ERGE y síntomas persistentes a pesar de un tratamiento óptimo. Respecto a los valores de TEA y el número de episodios de reflujo en una pH-IIM realizada con IBP, en un estudio retrospectivo que incluyó voluntarios sanos y sujetos con ERGE probado, se estableció que un TEA> 0.5% y/o número de episodios de reflujo> 40 tiene una sensibilidad de 86% y especificidad de 36% para la persistencia de síntomas y mejoría global de 79% después del manejo quirúrgico38. La combinación de un TEA> 4% y> 80 episodios de reflujo/día bajo tratamiento antisecretor óptimo es evidencia de ERGE refractario14. La pH-IIM con IBP en este grupo de pacientes ayuda a determinar quiénes tienen ERGE refractario y se benefician de escalar la terapia o identificar si se trata de una sobreposición con un trastorno funcional esofágico39 (figs. 2-4).
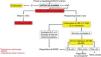
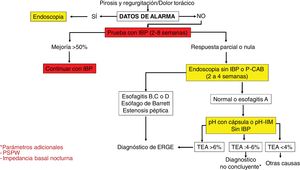
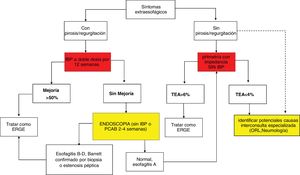
Algoritmo diagnóstico en pacientes con síntomas típicos de enfermedad por reflujo gastroesofágico o dolor torácico no cardiaco.
IBP: inhibidores de la bomba de protones; P-CAB: bloqueadores de ácido competitivos del potasio; pH-IIM: catéteres de pH combinados con anillos de impedancia intraluminal; TEA: tiempo de exposición al ácido; PSPW: onda peristáltica inducida por deglución después de reflujo.
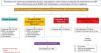
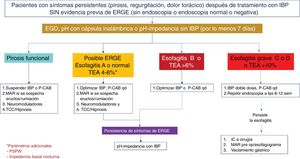
Algoritmo diagnóstico y terapéutico en pacientes con síntomas de enfermedad por reflujo gastroesofágico (ERGE) refractarios a tratamiento con inhibidores de la bomba de protones (IBP), sin evidencia previa objetiva de ERGE. Este grupo de pacientes deben someterse a una nueva endoscopia después de suspender dos a cuatro semanas los IBP. En aquellos con endoscopia normal o con esofagitis A, se debe medir el reflujo con cápsula inalámbrica o pH-impedancia sin IBP. Los pacientes que muestren esofagitis B, C o D de Los Ángeles o tiempo de exposición al ácido (TEA)> 6% requieren optimización del tratamiento con IBP o cambio a bloqueadores de ácido competitivos del potasio (P-CAB). La endoscopia debe repetirse en aquellos con esofagitis grave después de ocho semanas de tratamiento. La persistencia de esofagitis establece el diagnóstico de ERGE refractaria y son candidatos a evaluación de cirugía antirreflujo. Los pacientes con endoscopia normal o esofagitis A y TEA entre 4-6% requieren de pruebas adicionales como onda peristáltica inducida por deglución después de reflujo (PSPW) o impedancia basal nocturna y manometría de alta resolución (MAR) con impedancia ante la sospecha de eructos o rumiación. Los pacientes con trastorno funcional como hipersensibilidad al reflujo o pirosis funcional requieren tratamiento con neuromoduladores o terapia cognitivo conductual (TCC). Aquellos pacientes con esofagitis B o TEA> 6 o entre 4 y 6% que persistan con síntomas después de tratamiento con IBP o P-CAB, deben estudiarse con pH-impedancia con tratamiento antisecretor.
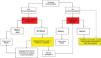
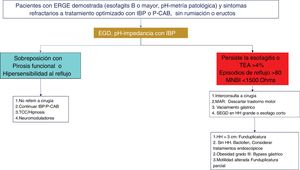
Algoritmo diagnóstico y terapéutico en enfermedad por reflujo gastroesofágico (ERGE) refractaria. Los pacientes con esofagitis B o mayor o tiempo de exposición al ácido (TEA) patológico y síntomas persistentes después de un tratamiento óptimo con inhibidores de la bomba de protones (IBP), o bloqueadores de ácido competitivos del potasio (P-CAB) de ocho semanas, deben estudiarse con nueva endoscopia (EGD) y/o pH-impedancia bajo tratamiento con IBP. La falla en la cicatrización de la esofagitis o un TEA> 4% o un número de episodios de reflujo> 80 o media de impedancia basal nocturna (MNBI) <1,500 Ohms deben ser evaluados para tratamiento antirreflujo. Los pacientes con sobreposición de ERGE y trastornos funcionales (pirosis funcional o hipersensibilidad al reflujo) deben tratarse con neuromoduladores o terapias psicológicas, además de continuar en el tratamiento antisecretor.
Recomendación 7.No recomendamos el esofagograma para el diagnóstico de ERGE.
En la era de la endoscopia, pHmetría y manometría de alta resolución (MAR), el esofagograma ha sido desplazado en el diagnóstico y manejo de la ERGE40.
En un estudio de Saleh et al., evaluaron a 20 pacientes con esofagograma, comparándolos con pH-IIM, para el diagnóstico de ERGE. Encontraron una sensibilidad de 46%, especificidad de 44%, un valor predictivo positivo (VPP) de 50% y un valor predictivo negativo (VPN) de 40%, por lo que actualmente el esofagograma, no tiene un rol en el diagnóstico de ERGE41. Este estudio puede ser útil en la evaluación complementaria de las estenosis esofágicas y es obligado, ante la sospecha de esófago corto.
Manometría esofágicaRecomendación 8.La manometría esofágica de alta resolución no se recomienda para el diagnóstico de ERGE. Es indispensable para la evaluación preoperatoria del candidato a cirugía antirreflujo.
En pacientes con ERGE que no responden a los cambios en el estilo de vida, terapia con IBP y sin hallazgos relevantes en la endoscopia, se recomienda realizar una MAR, para el diagnóstico diferencial, así como evaluar otros factores que pudieran estar condicionando la ERGE.
La acalasia es un trastorno de la motilidad esofágica, caracterizado por aperistalsis y falta de relajación de la UEG. Clínicamente, los pacientes cursan con disfagia progresiva, pirosis por la acidificación del alimento retenido, regurgitación y dolor torácico ocasional con o sin pérdida de peso, por lo que se puede confundir con ERGE y en la mayoría de los casos se retrasa el diagnóstico41. En sujetos con acalasia, la MAR tiene una sensibilidad de 93-98% y especificidad de 96-98%42.
El síndrome de rumiación y los eructos supragástricos se pueden presentar con síntomas típicos de reflujo con pobre respuesta al tratamiento con IBP. La MAR con impedancia es diagnóstica en ambos trastornos43. La rumiación se caracteriza por el incremento de la presión intrabdominal> 30mmHg, un evento de reflujo que se extiende hasta el esófago proximal y relajación del esfínter esofágico superior. Los eructos excesivos pueden ser gástricos o supragástricos. Este último se define por la succión de aire faríngeo hacia el esófago, seguido de una contracción muscular, que resulta en la expulsión abrupta de aire, antes de llegar al estómago44. En la MAR con impedancia se observa una contracción de la UEG, presiones intratorácicas negativas y relajación del esfínter esofágico superior, con flujo de aire aboral ilustrado por aumentos de la impedancia, seguido de expulsión de aire. También con la MAR, se identifican tres tipos de UEG; tipo 1: el EEI y DC están superpuestos; tipo 2: el EEI y DC se encuentran separados por <3cm; tipo 3: el EEI y DC están separados por> 3cm45. Este último tipo identifica la HH13. La manometría esofágica es un estudio obligatorio en la evaluación de pacientes candidatos a cirugía, para descartar la presencia de trastornos mayores de la motilidad, como la acalasia. Es controversial la utilidad de la manometría como predictor de disfagia posoperatoria. En general, la presencia de aperistalsis contraindica la funduplicatura de Nissen y una reserva peristáltica anormal, puede sugerir la realización de un Nissen flojo o una funduplicatura parcial. La manometría debe efectuarse para la identificación del borde superior del EEI y la colocación apropiada del sensor de pH para una medición del reflujo gastroesofágico con catéter.
Pruebas diagnósticas en manifestaciones extraesofágicasRecomendación 9.En pacientes con manifestaciones extraesofágicas sin síntomas típicos, recomendamos la investigación de ERGE mediante pH-impedancia sin IBP o P-CAB. No sugerimos la endoscopia ni la laringoscopia para el diagnóstico de ERGE en sujetos con manifestaciones extraesofágicas.
Las manifestaciones otorrinolaringológicas no acompañadas de síntomas típicos de pirosis y regurgitación tienen una baja probabilidad de asociación con ERGE y varía dependiendo del signo predominante: global <9% (rango 10-59%), disfonía (14.8%), tos crónica (7-13%), laringitis (10.4%) asma (4.8-9.3%) y globus (7%)46–48. La laringoscopia tiene una sensibilidad de 86%, especificidad de 9% y precisión diagnóstica de 44% al compararse contra la pH-IIM. Los hallazgos en la laringoscopia de eritema, edema, hiperplasia linfoide de laringe posterior, ulceraciones, estenosis subglótica y pólipos de cuerdas vocales no son específicos de ERGE, no se correlacionan con el TEA y no predicen la respuesta a IBP ni a la funduplicatura. Además, pueden observarse en trastornos alérgicos, infecciosos o en población sana49–51. Por lo anterior, la laringoscopia no es una prueba diagnóstica útil de ERGE. La endoscopia tiene una sensibilidad de 20-35% en presencia manifestaciones extraesofágicas de ERGE y, por ello, no se recomienda como prueba diagnóstica en este escenario48,52. El TEA medido por pH-IIM tiene sensibilidad y especificidad variables siendo de 50-92% y 50-63%, respectivamente, con un VPP de 94% y VPN de 58% en presencia solo de manifestaciones extraesofágicas. El TEA patológico (> 6%) sin tratamiento antisecretor parece predecir la respuesta a IBP, aunque la probabilidad preprueba es baja si el único síntoma es tos sin pirosis14,48,52,53. Algunos estudios de costo-efectividad han reportado que investigar ERGE mediante pH-IIM como estrategia inicial tiene un menor costo que la prueba con IBP por 12 semanas ($1,897 vs. $3,033 dólares americanos), por lo que, además de evitar un sobrediagnóstico, también impide el uso injustificado prolongado de antisecretores54–57. Al comparar el rendimiento diagnóstico de la pHmetría con catéter, la pH-IIM y la medición de pH mediante la cápsula inalámbrica, las ventajas de la pH-IIM son varias: detecta reflujos ácidos, ácidos menores, no ácidos, así como el número total de reflujos, permite medir la impedancia basal nocturna, e identificar la sobreposición con trastornos funcionales56–58. La cápsula inalámbrica puede ser útil cuando los catéteres transnasales no son tolerados o en caso de alta sospecha de un resultado negativo, pero no ofrece superioridad con respecto a la pH-IIM en la evaluación de los síntomas otorrinolaringológicos. Uno de los problemas reportados por algunos investigadores es la dificultad que tiene el paciente para registrar los episodios de tos, ya que se ha demostrado una diferencia entre el tiempo de inicio de esta y su registro en el sistema portátil de pH, lo cual incrementa los falsos negativos de esta prueba59–61. El empleo de otras técnicas como pHmetría faríngea o Restech® (Respiratory Technology Corporation, Houston, TX, Estados Unidos) o medición de pepsina salival no se recomiendan ya que tienen una sensibilidad baja de <40%, pobre correlación con síntomas y con los hallazgos de la pH-IIM62. La respuesta a una prueba con IBP varía entre 14-28% en sujetos con tos crónica sin síntomas típicos, se incrementa a 43% cuando el individuo tiene TEA anormal, y alcanza 78% cuando la tos se asocia a pirosis, aunque la especificidad generalmente es baja (14%)63. Debido a la baja probabilidad de respuesta al tratamiento antisecretor, varias guías internacionales recomiendan en la actualidad investigar la presencia de reflujo para justificar la terapia antisecretora20,64 (fig. 5).
Tratamiento médicoModificaciones al estilo de vidaRecomendación 10.Las modificaciones al estilo de vida deben recomendarse en todos los pacientes con ERGE e incluyen: bajar de peso en aquellos con sobrepeso u obesidad, cenar temprano, elevar la cabecera de la cama, dormir en decúbito lateral izquierdo y dejar de fumar.
Diversos alimentos y bebidas se asocian a la aparición de síntomas de reflujo, como los ácidos, cítricos, picantes, grasas, café, bebidas carbonatadas y alcohólicas, entre otros65. Pero también algunos hábitos alimenticios y patrones dietéticos pueden relacionarse con la aparición de síntomas de reflujo (en especial con los eventos nocturnos), como el consumo de comidas copiosas antes de dormir o de acostarse66. Entre los factores del estilo de vida que se relacionan con la ERGE destacan el sobrepeso y la obesidad, el consumo de alcohol, el tabaquismo y la falta de actividad física regular67.
La evidencia que sustenta el papel de los factores dietéticos y del estilo de vida en la ERGE tiene algunas limitaciones. A pesar de la alta prevalencia de la enfermedad, el número de estudios realizados es relativamente bajo, con grupos pequeños, no controlados, con resultados contradictorios, con gran variabilidad y diferencias individuales68–70.
Los estudios más recientes y de mejor diseño han determinado que no existe suficiente evidencia para recomendar de forma generalizada la eliminación de alimentos específicos en la ERGE. Por el momento, la sugerencia más razonable indica que la eliminación de alimentos detonantes debe hacerse en forma individual y guiada por la propia experiencia del enfermo68.
Hay evidencia que demuestra que acostarse sobre el lado izquierdo y elevar la cabecera de la cama reduce el desarrollo de síntomas de reflujo, principalmente nocturno. De forma similar, no consumir alimentos al menos dos a tres horas antes de acostarse y evitar fumar tabaco pueden tener efectos benéficos en la ERGE71.
La obesidad aumenta el riesgo de ERGE, posiblemente debido a la composición de la dieta y al aumento de la grasa intraabdominal que inducen cambios fisiológicos que favorecen el reflujo. La evidencia de mejor calidad se refiere al efecto positivo de la pérdida de peso controlada mediante dieta y actividad física sobre la ERGE72,73.
Mientras la evidencia que apoya los cambios en el estilo de vida se va fortaleciendo, es razonable hacer estas recomendaciones en los pacientes con ERGE como medidas de salud general que, además de ayudar al control de la enfermedad, contribuyen a mejorar la calidad de vida.
Inhibidores de la bomba de protonesRecomendación 11. Los IBP son fármacos de elección en el tratamiento de la ERGE. En la ERNE se usan a dosis estándar por cuatro semanas y en la EE por ocho semanas. En las esofagitis graves, C o D de LA se recomienda la doble dosis de IBP por ocho semanas.
Los IBP son los fármacos más utilizados para el tratamiento de la ERGE. Han mostrado ser más efectivos que los antagonistas de receptores H2 (ARH2) para aliviar los síntomas y cicatrizar las lesiones, por ello, se consideran fármacos de primera línea74. Su eficacia es de 70 a 80% en EE y de 50 a 60% en la ERNE20. Los IBP de liberación retardada (omeprazol, lansoprazol, rabeprazol, pantoprazol, esomeprazol e ilaprazol), de liberación dual retardada (dexlansoprazol) y de liberación inmediata (omeprazol-bicarbonato) se recomiendan a dosis estándar por cuatro semanas en la ERNE y por ocho en la erosiva19,20,75. En los casos de esofagitis grave (clasificación C y D de LA) debe usarse la doble dosis de IBP de liberación retardada por ocho semanas19,20,75. La tasa de alivio de síntomas y cicatrización de esofagitis es similar con los siete IBP disponibles en México76. Deben administrarse 30 a 60 minutos antes del desayuno en el régimen de dosis estándar una vez al día y 30 a 60 minutos antes del desayuno y la cena en el régimen de doble dosis19,20,75. Varios estudios sugieren que las diferencias genéticas en el metabolismo por la isoenzima del citocromo P450 (CYP)2C19 pueden afectar la respuesta a los IBP, sin embargo, la utilidad de una prueba genética para la identificación de metabolizadores rápidos o lentos no se recomienda en la práctica diaria. Ante la sospecha de esta condición, se sugiere cambiar a rabeprazol o ilaprazol, los IBP que no tienen un metabolismo primario por la CYP2C1977.
Recomendación 12.La terapia a demanda en la ERNE y en esofagitis leves (A y B de LA) y el uso continuo de IBP en esofagitis graves (C y D) son los esquemas más efectivos para el tratamiento de mantenimiento en la ERGE. Se recomienda utilizar la dosis mínima necesaria para controlar los síntomas y mantener la cicatrización de la esofagitis.
La ERGE es una enfermedad crónica recurrente, por ello, se requiere de un tratamiento de mantenimiento. En los casos de ERNE o esofagitis leves (grados A y B de LA) el esquema a demanda (el IBP solo se toma cuando existan síntomas y se suspende cuando estos desaparecen) ha demostrado ser el régimen más costo/efectivo en comparación con la terapia intermitente o continua19,20,75,78. La recurrencia de esofagitis en la EE grave es superior a 80% a los seis meses, por ello, los IBP deben usarse en forma continua en estos casos79. Se recomienda utilizar la dosis mínima necesaria de IBP para controlar los síntomas y mantener la cicatrización de la esofagitis. Esta estrategia disminuye costos y reduce la aparición de posibles efectos adversos relacionados con los IBP19,20,75.
Múltiples efectos adversos se han relacionado al uso de los IBP, sin embargo, la gran mayoría de ellos han sido producto de estudios de asociación y no de causalidad. Solamente un mayor riesgo de infecciones entéricas se ha establecido con el uso de IBP80.
Bloqueadores de ácido potasio-competitivosRecomendación 13. Los P-CAB son fármacos de elección en el tratamiento de la ERGE. Se recomiendan a dosis estándar por cuatro semanas en ERNE y por ocho semanas en la EE tanto en las formas leves como en las graves. En la terapia de mantenimiento, a demanda o continua, puede usarse la mitad de la dosis del P-CAB.
Los P-CAB son una nueva clase terapéutica de antisecretores, recientemente introducidos en México, con ventajas farmacocinéticas y farmacodinámicas sobre los IBP. No requieren de activación, se superconcentran en el espacio ácido de la célula parietal, se unen competitivamente y de manera reversible al sitio de enlace con el potasio (K+) de la bomba de protones, tienen una vida media plasmática hasta cuatro veces mayor que los IBP y producen una inhibición completa del ácido desde la primera dosis. Esto los hace ser fármacos más rápidos, más potentes, cuya dosificación es independiente de los alimentos y elevan el pH intragástrico por arriba de 4 desde la primera dosis y con duración hasta por 24 h81–83. El revaprazán, vonoprazán, tegoprazán y fexuprazán han sido ensayados y aprobados para uso clínico en países asiáticos82,83. En México, solo está disponible el tegoprazán. Los ensayos clínicos de estos agentes en países asiáticos y en EE. UU. han mostrado que los P-CAB no son inferiores a los IBP en el tratamiento de la EE leve y son superiores en la cicatrización de las esofagitis graves C y D de LA84,85. El tegoprazán mostró ser más rápido y efectivo que el placebo en el control de la pirosis en la ERNE86. Los P-CAB han mostrado controlar efectivamente los síntomas nocturnos en la ERGE86. En el tratamiento de mantenimiento en la ERGE erosiva, la mitad de la dosis de P-CAB ha sido superior a los IBP84,85. También han mostrado ser eficaces en la terapia a demanda en la variedad no erosiva de la ERGE. Por ello, en los países donde están disponibles, los P-CAB pueden ser considerados fármacos de primera línea en el tratamiento de la ERGE. Se recomienda su uso a dosis estándar (tegoprazán 50mg diarios) por cuatro semanas en la ERNE y por ocho en la EE leve y grave. En la terapia de mantenimiento se sugiere usar la mitad de la dosis estándar tanto a demanda como en el tratamiento continuo87–89.
En los ensayos clínicos y en el seguimiento poscomercialización, los P-CAB han exhibido un perfil de seguridad similar a los IBP, sin reportarse efectos adversos graves atribuibles a estos agentes82–86.
Tratamientos adyuvantes en la enfermedad por reflujo gastroesofágicoRecomendación 14.Los antiácidos, alginatos y protectores de la mucosa pueden usarse en combinación con fármacos antisecretores para el alivio de los síntomas ocasionales de la ERGE. Los ARH2 se pueden usar por periodos cortos (dos semanas) en caso de síntomas nocturnos no controlados por los IBP. Los procinéticos solo están indicados en pacientes con ERGE y síntomas sugestivos de retraso del vaciamiento gástrico (saciedad, plenitud, llenura).
Los antiácidos en la ERGE se usan exclusivamente para el alivio transitorio de los síntomas de la enfermedad, no deben emplearse para tratamiento crónico. Los alginatos son útiles para evitar el reflujo desde la bolsa de ácido y puede ser eficaces particularmente en los pacientes con síntomas posprandiales, nocturnos o con HH19,20,75. El protector de la mucosa, el bioadhesivo a base de condroitín sulfato y ácido hialurónico Esoxx-One® (Alfa Sigma, Ciudad de México, Mexico) en combinación con IBP ha mostrado mejorar los síntomas en sujetos con ERNE90. Los ARH2 controlan la fuga ácida nocturna en aquellos tratados con doble dosis de IBP. Por ello, solo están indicados para el manejo de los síntomas nocturnos que no se controlan con doble dosis de IBP. Por la taquifilaxia o tolerancia asociada al uso de antagonistas H2, solo se recomiendan por periodos cortos de tiempo entre dos a cuatro semanas. Los procinéticos en combinación con IBP no son mejores que los IBP solos en el tratamiento de la ERGE. Su indicación está restringida a personas con ERGE con síntomas de gastroparesia como náusea, vómito y llenura temprana. Los fármacos agonistas del neurotransmisor del ácido gamma-aminobutírico (GABAB) reducen el número de RTEEI. El baclofeno ha demostrado que en combinación con IBP puede mejorar los síntomas de eructos y regurgitación predominantes en pacientes con ERGE que no responden a la monoterapia con IBP, no obstante, sus efectos adversos sobre el sistema nervioso central (mareo, confusión) limitan su uso19,20,75.
Tratamiento médico de la enfermedad por reflujo gastroesofágico no erosivaRecomendación 15. En pacientes con ERNE se recomienda un tratamiento inicial con dosis estándar de IBP o P-CAB por cuatro semanas. Para la terapia de mantenimiento sugerimos el esquema a demanda o intermitente con la dosis mínima necesaria de IBP o P-CAB para controlar los síntomas.
El objetivo del tratamiento en la ERNE es el control de los síntomas. Los IBP son los fármacos de elección al proporcionar mayor alivio sintomático en comparación con ARH2 y el placebo91,92. Los IBP producen alivio completo de los síntomas en 50-60% de los pacientes con ERNE91,92,93. La elevada frecuencia de sujetos con pirosis funcional incluidos en la ERNE podría explicar la menor tasa de respuesta a los IBP en comparación con otros fenotipos de la enfermedad. En la dosis adecuada, las tasas de respuesta sintomática son similares entre todos los IBP76,94,95.
Las características farmacodinámicas de los P-CAB ofrecen un perfil útil para el tratamiento inicial de la ERNE. Los P-CAB alcanzan mejoría de los síntomas en 66.7% de los pacientes que reciben esta clase terapéutica como primera opción y en 53.8% de aquellos que persistían con síntomas después de ocho semanas de IBP96.
Dos terceras partes de los pacientes con ERNE que responden a IBP presentan recaída de los síntomas al suspender el tratamiento79. En estos sujetos se puede considerar la terapia a demanda o intermitente con IBP o P-CAB para abordar los síntomas. En un ensayo clínico controlado con omeprazol a demanda, 83% de los participantes presentaron remisión de los síntomas a los seis meses97. En una revisión sistemática que comparó la terapia a demanda contra placebo en personas con ERNE, los días sin molestias fueron similares a los alcanzados con la terapia continua78. En un ensayo clínico que comparó tegoprazán contra placebo en el control de los signos de ERNE, se encontró un aumento en los días libres de síntomas86. Los datos preliminares de un ensayo clínico fase 2 que contrastó vonoprazán contra placebo en pacientes con ERNE demostraron que este P-CAB fue eficaz y seguro para el control de los síntomas en el tratamiento a demanda98.
Por lo anterior, la terapia continua y a demanda con ambas clases tienen tasas de respuesta similares y ambas son superiores al placebo.
Las dosis altas de IBP aumentan los costos y se han asociado a complicaciones, aunque no hay evidencia directa de una relación causal entre el uso de IBP y estos eventos adversos99–101. La reducción de la dosis de IBP en ERGE es efectiva para la mayoría de los pacientes. En un ensayo con personas con esta enfermedad en las que se utilizaron dosis altas de IBP, se logró reducir la dosis en 80% sin recurrencia de los síntomas o la necesidad de aumentar nuevamente la dosis de IBP102.
Tratamiento médico de la enfermedad por reflujo gastroesofágico erosivaRecomendación 16. En pacientes con EE recomendamos el tratamiento inicial con dosis estándar de IBP o P-CAB por ocho semanas. En los casos de esofagitis grave (grados C o D de LA) debe utilizarse doble dosis de IBP por ocho semanas. Para el tratamiento de mantenimiento de las esofagitis leves (A y B de LA) sugerimos el esquema a demanda con dosis estándar de IBP o la mitad de la dosis de P-CAB. En esofagitis graves se debe emplear un tratamiento de mantenimiento continuo con dosis estándar de IBP o la mitad de la dosis de P-CAB.
Los IBP y los P-CAB son los fármacos antisecretores de primera elección en la EE20. Se recomienda usar la dosis estándar, una vez al día por ocho semanas, con lo que se logra el control sintomático y la curación endoscópica de las lesiones en más de 80% de los casos. El empleo de dosis doble se sugiere en aquellos que no responden al tratamiento estándar y en los casos con esofagitis grave (C y D de LA). Los P-CAB han mostrado un efecto inhibidor del ácido más rápido, potente y sostenido83,103,104. No se han observado diferencias significativas entre IBP y P-CAB en el control sintomático del reflujo83,96,103–106, pero los P-CAB parecen ser más efectivos que los IBP en lograr la cicatrización de las erosiones esofágicas, con diferencias estadísticamente significativas, aunque con variaciones clínicas marginales que tienden a igualarse con el tiempo83,104. Consensos y recomendaciones de expertos ubican a los P-CAB como una opción equivalente a los IBP en esofagitis leve y como la mejor alternativa farmacológica para esofagitis grave96,106–108.
La mayoría de los pacientes con EE requerirán de tratamiento a largo plazo. En estos casos, los IBP deben administrarse en la dosis más baja que controle eficazmente los síntomas y mantenga la curación de la esofagitis por reflujo20,109. Los P-CAB se han propuesto como terapia de primera línea para este fin, principalmente cuando la esofagitis es grave85,110.
Tratamiento médico del esófago de BarrettRecomendación 17. Se recomienda realizar tamizaje para EB en poblaciones con factores de riesgo y síntomas de ERGE. Los factores de riesgo incluyen: sexo masculino, raza caucásica, edad mayor a 50 años, historia de tabaquismo, de síntomas crónicos de ERGE (al menos una vez por semana por más de cinco años), antecedentes de EE, presencia de obesidad central e historia familiar de EB o ACE.
El EB es considerado una lesión precursora del ACE y, en la actualidad, las guías clínicas recomiendan realizar su tamizaje en poblaciones con factores de riesgo111. Un metaanálisis que incluyó 49 estudios y 307,273 individuos demostró que en pacientes con síntomas de reflujo y al menos un factor de riesgo fue mayor que en aquellos sin manifestaciones (12.2 vs. 0.8%). Por otra parte, en este mismo ensayo, la presencia de factores de riesgo se asoció con EB: historia familiar (23.4%); sexo masculino (6.8%); edad> 50 años (6.1%) y obesidad central (1.9%)112.
Algunas de las guías actuales proponen limitar el tamizaje en pacientes con al menos tres factores de riesgo, pero los mismos autores reconocen que esto se encuentra basado en recomendaciones de expertos y que su implementación estricta ha reducido el impacto en el tamizaje del ACE113. De este modo, se reconoce que limitar a la presencia de reflujo o bien a un número específico de factores de riesgo podría disminuir la detección oportuna del EB. Un estudio que evaluó cohortes de pacientes con ACE en EE. UU. (n=663) y Reino Unido (n=645) demostró que 54.9 y 38.9% de los pacientes, respectivamente, no cumplían con los criterios para tamizaje114. De este modo, se propone realizar el tamizaje en personas con factores de riesgo y síntomas de reflujo con el fin de detectar el EB oportunamente.
Recomendación 18.Los pacientes con EB deben tomar tratamiento continuo con IBP y mantenerse en un programa de vigilancia.
Diferentes estudios observacionales han demostrado que el uso crónico de los IBP reduce la progresión de la displasia y la aparición de ACE en pacientes con EB34.
El metaanálisis publicado por Singh et al. con datos de siete estudios y 2,813 pacientes mostró una reducción en 71% de la progresión en usuarios de IBP a dosis estándar (razón de momios 0.29; 0.12 – 0.79)115. No obstante, no existe actualmente evidencia consistente de dosis más altas de IBP sobre la oncogénesis y solo se recomienda el incremento de las dosis para el control de síntomas y en aquellos candidatos a terapia de erradicación endoscópica34,113.
La detección de displasia es el objetivo fundamental del seguimiento en los pacientes con EB sin esta34. La mayoría de las guías clínicas actuales sugiere un intervalo de revisión de tres a cinco años para este grupo de enfermos, aunque la más reciente sugiere considerar la extensión máxima del EB en la decisión del intervalo, incrementándolo en sujetos con EB> 3cm113.
Sobreposición con enfermedad por reflujo gastroesofágicoRecomendación 19. Recomendamos una evaluación clínica detallada para identificar criterios de dispepsia y síndrome de intestino irritable (SII) por la posible sobreposición con ERGE.
La ERGE y la dispepsia son altamente prevalentes lo que produce que coexistan en el mismo individuo de manera común incrementando la sintomatología y empeorando su calidad de vida116. La prevalencia de esta sobreposición varía de acuerdo con los criterios utilizados. Con los de ROMA II, oscila de 12-35% y con los criterios de ROMA III, se incrementa a 20-48%117. Sin embargo, la sobreposición de estos problemas no solo se debe al azar y se han propuesto mecanismos fisiopatológicos que explican este fenómeno. La acomodación gástrica alterada, el vaciamiento retrasado y la hipersensibilidad visceral tiene un rol en la generación de síntomas de reflujo en pacientes con dispepsia118. El mecanismo por el cual la alteración en el acomodamiento gástrico influye en la generación de reflujo se debe a la liberación de óxido nítrico que impacta en la región del EEI promoviendo el incremento de RTEEI119.
Es interesante que la sobreposición ERGE/dispepsia puede generar mayor riesgo de lesiones orgánicas en comparación con quienes las padecen de manera aislada. En un estudio se encontró que la prevalencia de lesiones ulcerosas pépticas fue mayor en el grupo de ERGE/dispepsia vs. aquellos con problemas aislados, 4.7 vs. 0.6%, respectivamente (p=0.027). La sobreposición de ERGE con dispepsia es más frecuente con el subtipo de distrés posprandial120 y afecta negativamente la calidad de vida de quienes la sufren. Se ha encontrado que los individuos con sobreposición de ERGE/dispepsia acuden más frecuentemente al médico comparados con los que solo tienen ERGE o dispepsia (16.7 vs. 8.5 vs. 12.3%), tienen más días de ausencia laboral (4.3 vs. 2.9 vs. 0.7%) y mayor consumo de medicamentos antisecretores (30.5 vs. 16.4. vs. 9.4%) asociado a menores puntuaciones de la escala SF36 de calidad de vida121.
El SII es muy frecuente al igual que la ERGE. Por ello, la sobreposición de estas dos entidades es también común. Se ha estimado que coexisten en un amplio margen que va de 5 a 30% en estudios de encuesta en población abierta, siendo los pacientes con la variante no erosiva de la ERGE los que más comúnmente lo padecen, en comparación con los de la variante erosiva (74.3 vs. 10.5%). Esto se debe, muy probablemente, a la hipersensibilidad visceral que es más típica en los no erosivos y prácticamente universal en los sujetos con SII122. Se ha identificado la prevalencia de esta sobreposición de acuerdo con los subtipos del SII, siendo el subtipo con diarrea el que presenta mayor prevalencia de ERGE en 40.9% comparado con 32.9% de aquellos con estreñimiento123. Además, se ha demostrado que los individuos con sobreposición ERGE/SII tienen menor calidad de vida124. La presencia de SII en pacientes con ERGE predice de manera independiente el peor control de los síntomas de la ERGE en comparación con los que no tienen la sobreposición. Esta última ocurre por la elevada prevalencia de ambos trastornos, pero también se relaciona con que comparten mecanismos fisiopatológicos para la generación de los síntomas.
Tratamiento de la enfermedad por reflujo gastroesofágico refractariaLa persistencia de los síntomas de ERGE a pesar de tratamiento médico no necesariamente implica el diagnóstico de ERGE refractaria.
La persistencia de los síntomas a pesar del tratamiento médico ocurre en 30-40% de los pacientes con ERGE39,125. Las causas por las cuales puede fallar la terapia, en especial con los IBP, son múltiples e incluyen: la falta de apego, inadecuada toma o administración del IBP, diferencias farmacogéneticas (polimorfismos asociados a CYP), diagnóstico incorrecto, entre otras (tabla 1)125. En ese sentido, es importante reconocer estas causas y poder clasificar a los sujetos con «falla terapéutica» en dos grandes grupos:
Causas de síntomas persistentes en enfermedad por reflujo gastroesofágico (ERGE)
| Causas de síntomas persistentes de ERGE |
|---|
| Falta de adherencia al tratamiento |
| Inadecuada prescripción o administración |
| Polimorfismos genéticos (metabolismo de IBP) |
| Mala calidad de los fármacos |
| Hipersensibilidad esofágica |
| Hipervigilancia, ansiedad, somatización |
| Pirosis funcional |
| Otras enfermedades esofágicas• Esofagitis eosinofílica• Esofagitis por píldoras (AINE, potasio, bifosfonatos)• Esofagitis infecciosas |
| Trastornos motores del esófago• Acalasia• Espasmo esofágico difuso• Esófago en «Jackhammer» |
| Trastornos gastroduodenales• Eructos supragástricos excesivos• Síndrome de rumiación |
| Otros• Síndrome de Zollinger-Ellison• Gastroparesia |
AINE: medicamentos antiinflamatorios no esteroides; IBP: inhibidores de la bomba de protones.
Síntomas de ERGE persistente en pacientes sin diagnóstico previo. Estos son aquellos que asumen padecer ERGE y que fallan al tratamiento, pero en los cuales no existe evidencia previa objetiva de la enfermedad (mediante estudios endoscópicos o fisiológicos). En estos casos, se recomienda realizar los análisis necesarios para tener evidencia de ERGE antes de volver a tratar a los pacientes39,126.
Síntomas de ERGE persistente en pacientes con diagnóstico previo. En estos casos, los pacientes cuentan con una evidencia objetiva de la enfermedad (EB, EE, TEA anormal) y estando bajo tratamiento médico las molestias siguen presentes. Es importante primero revisar el apego y la adherencia al uso de IBP y descartar las causas mencionadas en la tabla 1. En este último caso, estos sujetos deben de reevaluarse mientras consumen el IBP39,126.
La ERGE refractaria se define como la evidencia objetiva de ERGE (EE o exposición anormal al ácido esofágico y/o números elevados de episodios de reflujo en la pH-IIM) a pesar de la terapia médica utilizando una doble dosis de IBP por ocho semanas.
Aunque la mayoría de los pacientes con síntomas persistentes de ERGE, a pesar del tratamiento médico, están tomando una dosis estándar de IBP, el diagnóstico estricto de ERGE refractaria implica que el sujeto haya ingerido dosis doble por al menos ocho semanas39,126–128. Esta definición proviene de consensos y grupos de expertos, pero en realidad se desconoce su costo beneficio. Con base en esta definición, en la actualidad existen parámetros fisiológicos que se han obtenido durante la pH-IIM en pacientes con doble dosis de IBP y que predicen la respuesta al tratamiento de la ERGE refractaria. El estudio más importante es el de Gyawali et al. en donde se demuestra que un TEA> 0.5% y> 40 episodios de reflujo detectados por impedancia son parámetros que pueden predecir la respuesta al tratamiento quirúrgico hasta en 79% de las personas con ERGE refractaria, en especial si el síntoma que persiste es la regurgitación38.
Recomendación 20:Recomendamos la optimización del tratamiento antisecretor en pacientes con síntomas de ERGE refractarios mediante las siguientes estrategias: a) apego al tratamiento y dosis apropiada de IBP en relación con alimentos; b) usar doble dosis de IBP; c) emplear IBP diferente; d) cambiar IBP por P-CAB y e) utilizar tratamientos adyuvantes.
Los IBP convencionales (omeprazol, pantoprazol, lansoprazol), por lo general, son moléculas lábiles al ácido, por lo que estos medicamentos tienen un recubrimiento entérico que evitan su rápida degradación en el estómago para que posteriormente puedan absorberse en el intestino delgado distal129. Por lo tanto, es recomendado que se ingieran en ayuno, ya que la presencia de alimento retrasara el vaciamiento gástrico y existe mayor probabilidad de que se degraden los fármacos. Múltiples estudios de farmacocinética han demostrado que las comidas reducen su potencia entre 50–70%130. Además, los IBP convencionalmente inhiben de forma irreversible la secreción de ácido por lo que no bloquean la síntesis de aquel proveniente de la generación de nuevas bombas de protones. Estas consideraciones farmacocinéticas y farmacodinámicas brindan evidencia indirecta que destaca la importancia de una adherencia óptima de dosificación e ingesta de los IBP convencionales antes de las comidas. Es importante mencionar que existen modificaciones farmacológicas a los IBP (formulaciones de liberación dual retardada como el dexlansoprazol) o aquellos con vidas medias más largas, como el ilaprazol que pueden evitar la necesidad de tomar estrictamente el medicamento antes del ayuno. Sin embargo, la recomendación para todos los IBP será la de que se ingieran en ayuno.
El parámetro fisiológico que se emplea como subrogado de la potencia de los IBP es la elevación del pH intragástrico por arriba de 4. Además de las propiedades farmacológicas y farmacocinéticas, es importante recordar que los IBP se metabolizan a través de la vía metabólica de la CYP y que existen polimorfismos genéticos que determinan si este metabolismo es lento, intermedio, rápido o ultrarrápido. Estos factores pueden predecir la respuesta clínica a los IBP.
Si se extiende la vida media plasmática de los fármacos, si se disminuye la variabilidad individual farmacocinética y farmacodinámica, si se incrementa la rapidez de acción y si la absorción es independiente de los alimentos, entonces los IBP tendrán un mejor rendimiento131. Así pues, optar por IBP que ofrezcan esos beneficios como el rabeprazol, dexlansoprazol e ilaprazol en caso de ERGE refractaria puede ser una opción. Por ejemplo, Fass et al. evaluaron la eficacia del dexlansoprazol en 142 pacientes con ERGE refractaria132. Después de un periodo de selección de seis semanas, los sujetos cambiaron a dexlansoprazol 30mg o placebo durante seis semanas adicionales. Los autores demostraron que después del cambio, la pirosis se controló en 88% de los casos. En otro estudio se observó que el uso de ilaprazol en sujetos con ERNE e hipersensibilidad al reflujo, 20mg de ilaprazol fueron efectivos para mejorar las puntuaciones de los síntomas, los hallazgos histopatológicos y los biomarcadores inflamatorios133.
Otras formas de optimizar el desempeño de los IBP es dividir o duplicar la dosis. Por ejemplo, se ha demostrado que una dosis dividida de 20mg de esomeprazol dos veces al día, en lugar de 40mg una sola vez, mejora la supresión ácida134. Esta estrategia puede ser útil cuando existen síntomas nocturnos. Respecto a duplicar la dosis existen varios estudios. Uno japonés efectuado en pacientes sin respuesta a dosis estándar de rabeprazol mostró una mejoría significativa al duplicar la dosis (74 vs. 45%, p <0.001)95. En un metaanálisis reciente de 25 estudios con 592 sujetos que recibieron terapia con IBP dos veces al día, la dosis estándar de 40mg de pantoprazol tomada dos veces al día mantuvo el pH intragástrico> 4 durante un promedio de 68% al día 3 y esomeprazol 40mg dos veces al día mantuvo el pH gástrico> 4 durante un promedio de 88%135.
Los P-CAB son fármacos efectivos en el manejo de la ERGE refractaria. Existen varios estudios que demuestran la utilidad de vonoprazán en esta condición136,137. Un estudio en 124 pacientes japoneses demostró que 20mg de este medicamento normaliza la exposición esofágica al ácido hasta en 46% y mejora los síntomas y la cicatrización de la mucosa en comparación con los IBP136. Con tegoprazán existe un estudio que demostró que 50mg de este mejoró de forma significativa los síntomas de reflujo nocturno y la calidad del sueño en comparación con 40mg de esomeprazol138. Sin duda, los P-CAB representan de forma racional una buena opción para los pacientes con ERGE refractaria, siempre y cuando los síntomas estén relacionados con la exposición esofágica al ácido.
Los tratamientos adyuvantes como antiácidos, alginatos y ARH2 pueden usarse concomitantemente con los IBP en ERGE refractaria (ver recomendación 14).
Recomendación 21.Los pacientes con síntomas persistentes o refractarios de ERGE al tratamiento deben ser investigados mediante medición ambulatoria del reflujo para identificar la sobreposición con trastornos funcionales esofágicos.
La persistencia de síntomas de ERGE a pesar del tratamiento médico es bien reconocida y se estima que ocurre en 54.1% de los usuarios de IBP139. La razón es compleja y heterogénea; se han descrito algunos factores asociados a la continuidad de estos síntomas a pesar de la terapia a dosis estándar o doble de IBP tales como la presencia de signos atípicos, mayor tiempo de manifestaciones de ERGE, gravedad de estas y falta de adherencia a modificaciones del estilo de vida y al tratamiento140. Sin embargo, existen otros factores bien reconocidos para esta persistencia de síntomas a pesar de la buena adherencia al tratamiento destacando la presencia de hipersensibilidad visceral60. Esta puede estar relacionada a la sensibilización por estímulos inflamatorios previos que llevan a un incremento de receptores purinérgicos ionotróficos, receptores vaniloides transitorios y canales iónicos ácido-sensibles capaces de inducir hiperalgesia141,142. También se ha encontrado una mayor sensibilidad a estímulos tanto químicos como mecánicos143. Finalmente, otro estudio analizó la prevalencia de trastornos funcionales esofágicos en pacientes con y sin evidencia probada de ERGE. Se encontró que en los sujetos sin ERGE, 76% tuvieron pirosis persistente a pesar del tratamiento médico (pirosis funcional). Dos terceras partes de aquellos con persistencia de síntomas y ERGE demostrado también presentaron criterios para pirosis funcional, el resto mostraron hipersensibilidad al reflujo144. Por esta razón, los individuos con persistencia de síntomas deben ser investigados para corroborar la presencia de ERGE como causa de esta o detectar tempranamente trastornos sensitivos-sensoriales como explicación de los síntomas de estos pacientes (figs. 3 y 4).
Recomendación 22.Recomendamos suspender el tratamiento antisecretor y utilizar neuromoduladores y terapias psicológicas en pacientes con pirosis funcional. En el caso de hipersensibilidad al ácido o sobreposición de ERGE con trastornos funcionales sugerimos optimizar el tratamiento antisecretor y emplear concomitantemente neuromoduladores y terapias psicológicas.
La persistencia de los síntomas de reflujo puede deberse también a la hipersensibilidad e hipervigilancia esofágica, por lo que se supone que están implicados mecanismos de sensibilización central y periférica, también en correlación con la respuesta al estrés. En estos casos, los analgésicos viscerales, por ejemplo, antidepresivos tricíclicos (ATC), inhibidores selectivos de la recaptación de serotonina (ISRS), inhibidores de la recaptación de serotonina y norepinefrina (IRSN) o trazodona, pueden ser de ayuda, particularmente para evitar el uso innecesario de altas dosis de terapias inhibidoras del ácido en pacientes diagnosticados como refractarios a los IBP145. Se ha utilizado citalopram 20mg/día146, venlaflaxina 75mg/día147, amitriptilina 12.5-25mg/día148 y la sertralina 50mg/día149. Un enfoque empírico sugerido por Scarpellini et al. podría ser la asociación de un ISRS (citalopram o fluoxetina) con una dosis estándar de IBP por la mañana150. Cuando se prescriben estos fármacos es importante explicar sus efectos adversos y que su eficacia clínica puede tardar en aparecer de dos a cuatro semanas. La modalidad cognitivo conductual y la hipnosis son las terapias psicológicas que han mostrado ser más útiles en el manejo de pacientes con pirosis funcional e hipersensibilidad al ácido y en la sobreposición de estos trastornos con la ERGE19,20.
Tratamiento de las manifestaciones extraesofágicasRecomendación 23. Recomendamos el tratamiento con doble dosis de IBP por 12 semanas en pacientes con manifestaciones extraesofágicas y evidencia objetiva de ERGE.
Los sujetos que presentan síntomas atípicos de reflujo (tos, laringitis y asma) acompañados de signos típicos (pirosis, regurgitación) se benefician modestamente del manejo empírico con IBP por al menos ocho semanas a dosis estándar siempre que no existan datos de alarma17. Recientemente, las guías y consensos sugieren el uso de doble dosis de IBP por ocho a 12 semanas como primera estrategia en estos pacientes17,19. Es claro que el IBP dos veces al día es superior a una vez al día en la supresión del ácido gástrico y probablemente sea más efectivo para los síntomas extraesofágicos. En un estudio de cohorte prospectivo se observó una tasa de respuesta más alta (54% más) en personas que no respondieron a IBP en dosis estándar después de ocho semanas151. En cuanto a los procinéticos, evidencia limitada sugiere que la adición de estos agentes pudiera ser de utilidad en individuos con obesidad y/o regurgitación, pero no en aquellos con pirosis17.
Frecuentemente, se asume que las manifestaciones como odinofagia, carraspera, la sensación de cuerpo extraño (globo faríngeo), la visualización de la laringe «irritada», e incluso la halitosis, pueden deberse a ERGE. Sin embargo, no existe evidencia de que estas se asocien a la enfermedad, especialmente si se presentan de forma aislada. En estos casos, se recomienda hacer pruebas objetivas de ERGE antes de prescribir tratamiento. Frecuentemente, estos síntomas (al igual que otros trastornos de la interacción cerebro e intestino) se asocian a hipervigilancia e hipersensibilidad visceral19,151–154.
Tratamiento endoscópico y tratamiento quirúrgicoRecomendación 24. Recomendamos la cirugía antirreflujo en pacientes con evidencia objetiva de ERGE, con regurgitación como síntoma predominante, con HH grande, sin trastorno grave de la motilidad esofágica, en ausencia de síntomas importantes de dispepsia o SII, realizada por un cirujano experimentado, en un sujeto que rechaza el tratamiento médico a largo plazo.
El tratamiento quirúrgico en pacientes con diagnóstico objetivo de ERGE es igual de efectivo que el abordaje médico con IBP155. Los mejores predictores de una respuesta favorable al tratamiento quirúrgico son pHmetría positiva y la respuesta sintomática adecuada al IBP156,157. Los sujetos con ERGE refractaria, es decir aquellos con persistencia de EE y TEA anormal después de un tratamiento óptimo con IBP o P-CAB son candidatos a funduplicatura158. Todo individuo que va a ser sometido a funduplicatura debe realizarse un estudio de MAR con la finalidad de descartar alteraciones motoras en el esófago159. Cuando existe una disminución de la reserva peristáltica, la funduplicatura parcial es aconsejable160.
En pacientes con manifestaciones extraesofágicas sin síntomas típicos de ERGE, la cirugía no se recomienda161. La funduplicatura puede ser útil en un pequeño grupo de personas, en las cuales existe la evidencia objetiva de reflujo como causa de estas manifestaciones162. En sujetos con EB, la indicación de funduplicatura es para el control de los síntomas, aunque en un metaanálisis reciente se demostró un menor riesgo de progresión a displasia de alto grado o ACE163,164. Respecto al tipo de cirugía, no se han encontrado diferencias en el control de los signos de ERGE entre la funduplicatura parcial o completa165.
El aumento magnético del EEI o LINX® (Ethicon Johnson & Johnson, Bridgewater, New Jersey, y Cincinnati, Ohio, Estados Unidos) se realiza mediante un dispositivo hecho de imanes en forma de anillo que se coloca quirúrgicamente alrededor de la UEG. Este aparato ha demostrado disminuir los síntomas, el TEA y el uso de IBP166. El aumento magnético del EEI ha resultado exitoso en el control de la regurgitación167. Al ser comparado con la funduplicatura quirúrgica, produce menos distensión abdominal168. Recientemente, se ha utilizado en pacientes con HH mayores de 3cm169-171. Se ha informado erosión del esófago o migración del anillo magnético en 0.3% a cuatro años de seguimiento172–174. La funduplicatura endoscópica sin incisión es útil en un pequeño subgrupo de sujetos con HH pequeñas <2cm y EE leves A y B175–181. En México, no están disponibles estos procedimientos.
La radiofrecuencia ha demostrado disminuir algunos síntomas de reflujo, pero no el TEA, ni incrementa la presión del EEI182,183, razones por las que no se considera un procedimiento adecuado para el tratamiento de pacientes con ERGE184,185.
Enfermedad por reflujo gastroesofágico en poblaciones especiales: embarazo, adultos mayores y obesidadRecomendación 25. Recomendamos el tratamiento con IBP a dosis estándar para el control de la ERGE en el embarazo.
Durante el embarazo, la incidencia de ERGE es frecuente. Esto es debido al aumento de peso y al incremento de la presión intraabdominal. Los síntomas pueden iniciar desde el primer trimestre y son más comunes hacia al final del embarazo186. El tratamiento en este grupo de pacientes debe estar basado en la seguridad para la madre y el feto, siempre iniciando con medidas no farmacológicas. El uso de IBP es adecuado en embarazadas. Estos fármacos se clasifican en la categoría B según la Agencia de Fármacos y Alimentos (FDA) con excepción del omeprazol que es catalogado como categoría C. Antes de iniciar cualquier medicamento, se debe tener una discusión cuidadosa con la paciente acerca de los riesgos y beneficios de la terapia antisecretora187.
Recomendación26. Recomendamos la realización de endoscopia en adultos mayores con síntomas de ERGE por la elevada prevalencia de enfermedad más grave.
La ERGE en adultos mayores tiende a ser más grave, debido a una menor percepción de la pirosis. Cuando se realizan estudios diagnósticos en pacientes mayores se encuentra con mayor frecuencia EE grave, razón por la cual es obligado un abordaje diagnóstico temprano independientemente de la gravedad de los síntomas188. Se ha descrito que en esta población los factores protectores del esófago como el bicarbonato salival esta disminuido por la xerostomía. Además, es más frecuente encontrar trastornos de la motilidad y HH en este grupo189. El tratamiento de la ERGE en el adulto mayor debe seguir los mismos lineamientos que para pacientes más jóvenes.
Recomendación27. En el paciente con ERGE y obesidad candidato a cirugía bariátrica recomendamos la derivación gastroyeyunal como intervención de elección. La manga gástrica y la que es ajustable no se recomiendan por ser procedimientos reflugénicos que pueden empeorar la ERGE.
La funduplicatura laparoscópica en el paciente obeso es factible y segura, sin embargo, este grupo tiene mayor recurrencia de los síntomas de reflujo posterior al procedimiento190–195. Por este motivo, la derivación gastroyeyunal o bypass gástrico se considera la mejor operación en estos sujetos196. La manga gástrica es un procedimiento que puede ocasionar o agravar la ERGE, debido a la disminución de la presión del EEI por disrupción del ligamento frenoesofágico y la alteración del ángulo de His197. Posterior a una banda gástrica se han demostrado cambios en la motilidad esofágica y aumento del reflujo gastroesofágico, por lo tanto, esta técnica no se recomienda en pacientes obesos con ERGE198.
FinanciaciónEl laboratorio Alfasigma, Carnot y Medix proporcionaron el apoyo financiero en cuanto a logística, gastos de viaje y reunión presencial para todos los expertos en ERGE. Ningún participante recibió honorarios para la realización de estas guías. Estas recomendaciones están avaladas por la AMG.
Conflicto de interesesM.A. Valdovinos fue conferencista para Carnot, Megalabs y Bayer.
M. Amieva Balmori fue conferencista para Carnot y AstraZeneca.
E. Coss-Adame fue conferencista para Asofarma, Carnot y Grunenthal.
F. Huerta Iga y G. Torres Villalobos fueron conferencistas para Carnot.
E.C. Morel Cerda fue conferencista para AstraZeneca y Megalabs.
J.M. Remes-Troche es asesor y miembro de consejo consultivo para Asofarma, Carnot y Pisa. Conferencista para Asofarma, Abbot, Carnot, Chinoin, Johnson y Johnson, Medix y Medtronic.
J.L. Tamayo de la Cuesta fue conferencista para Carnot y Chinoin.
A.S. Villar Chávez fue conferencista para Carnot y Asofarma.
L.R. Valdovinos García fue conferencista para Carnot, AstraZeneca, Asofarma y Chinoin.
G. Vázquez-Elizondo fungió como investigador para Carnot, Chinoin y Novo Nordisk de México; asesor y miembro de consejos consultivos para Chinoin, M8 Moksha y Eurofarma; conferencista para Chinoin, Asofarma de México, Carnot y Eurofarma.
R. Carmona, M. González-Martínez y J.A. Arenas declaran no tener conflictos de interés.
O. Gómez: conferencista Carnot, Chinoin, Asofarma.