La resistencia bacteriana puede dificultar el tratamiento antimicrobiano de las gastroenteritis agudas. La susceptibilidad bacteriana de los enteropatógenos a la rifaximina, un antibiótico que alcanza altas concentraciones fecales (hasta 8,000μg/g) no se ha evaluado en México.
ObjetivosDeterminar la susceptibilidad a rifaximina y a otros antimicrobianos de bacterias enteropatógenas aisladas de pacientes con gastroenteritis aguda en México.
Material y métodosSe analizaron las cepas bacterianas en las heces de 1,000 pacientes con diagnóstico de gastroenteritis aguda. Se probó la susceptibilidad a la rifaximina (RIF) con microdilución (< 100, < 200, < 400 y < 800μg/ml), la susceptibilidad a cloranfenicol (CLO), trimetoprim-sulfametoxazol (T-S), neomicina (NEO), furazolidona (FUR), fosfomicina (FOS), ampicilina (AMP) y ciprofloxacino (CIP) se probó por difusión-agar a las concentraciones recomendadas por CLSI y ASM.
ResultadosLas bacterias aisladas fueron: Escherichia coli (E. coli) enteropatógena (EPEC) 531, Shigella 120, Salmonella no-typhi 117, Aeromonas spp. 80, E. coli enterotoxigénica 54, Yersinia enterocolitica 20, Campylobacter jejuni 20, Vibrio spp. 20, Pleisiomonas shigelloides 20 y E. coli enterohemorrágica (EHEC 0:157) 18. La susceptibilidad global acumulada a RIF < 100, < 200, < 400, < 800μg/ml fue del 70.6, el 90.8, el 99.3 y el 100%, respectivamente. La susceptibilidad global a cada antibiótico fue: AMP 32.2%, T-S 53.6%, NEO 54.1%, FUR 64.7%, CIP 67.3%, CLO 73%, FOS 81.3%. La susceptibilidad a RIF < 400 y < 800μg/ml fue significativamente mayor que con los otros antimicrobianos (p<0.001).
ConclusionesLa resistencia de las bacterias enteropatógenas a antimicrobianos utilizados en gastroenteritis es alta. La rifaximina fue activa contra el 99-100% de las bacterias en concentraciones alcanzables en el contenido intestinal con las dosis recomendadas.
Bacterial resistance may hamper the antimicrobial management of acute gastroenteritis. Bacterial susceptibility to rifaximin, an antibiotic that achieves high fecal concentrations (up to 8,000μg/g), has not been evaluated in Mexico.
ObjectiveTo determine the susceptibility to rifaximin and other antimicrobial agents of enteropathogenic bacteria isolated from patients with acute gastroenteritis in Mexico.
Material and methodsBacterial strains were analyzed in stool samples from 1,000 patients with diagnosis of acute gastroenteritis. The susceptibility to rifaximin (RIF) was tested by microdilution (<100, <200, <400 and <800μg/ml) and susceptibility to chloramphenicol (CHL), trimethoprim-sulfamethoxazole (T-S), neomycin (NEO), furazolidone (FUR), fosfomycin (FOS), ampicillin (AMP) and ciprofloxacin (CIP) was tested by agar diffusion at the concentrations recommended by the Clinical & Laboratory Standards Institute and the American Society for Microbiology.
ResultsIsolated bacteria were: enteropathogenic Escherichia coli (E. coli) (EPEC) 531, Shigella 120, non-Typhi Salmonella 117, Aeromonas spp. 80, enterotoxigenic E. coli (ETEC) 54, Yersinia enterocolitica 20, Campylobacter jejuni 20, Vibrio spp. 20, Plesiomonas shigelloides 20, and enterohemorrhagic E. coli (EHEC 0:157) 18. The overall cumulative susceptibility to RIF at <100, <200, <400, and <800μg/ml was 70.6, 90.8, 99.3, and 100%, respectively. The overall susceptibility to each antibiotic was: AMP 32.2%, T-S 53.6%, NEO 54.1%, FUR 64.7%, CIP 67.3%, CLO 73%, and FOS 81.3%. The susceptibility to RIF <400 and RIF <800μg/ml was significantly greater than with the other antibiotics (p<0.001).
ConclusionsResistance of enteropathogenic bacteria to various antibiotics used in gastrointestinal infections is high. Rifaximin was active against 99-100% of these enteropathogens at reachable concentrations in the intestine with the recommended dose.
La diarrea aguda constituye un problema importante de salud, principalmente en los países en desarrollo. A pesar de la disminución de las tasas de mortalidad por esta enfermedad en la última década en varios países, entre ellos México1-3, la gastroenteritis aguda sigue siendo un problema de salud debido a una alta morbilidad. En México es la segunda enfermedad infecciosa, solo precedida por enfermedades respiratorias, con más de 5 millones de nuevos casos en el año4.
A pesar de contar con ciertos indicios clínicos, determinar el agente causal de la diarrea aguda en un paciente basándose solamente en los hallazgos clínicos es difícil. A menudo, la gastroenteritis aguda se debe a una infección viral, especialmente en los niños menores de 5 años de edad1, mientras que la infección bacteriana es más frecuente en los niños mayores y adultos. Las bacterias enteropatógenas detectadas con mayor frecuencia en pacientes con gastroenteritis endémica son Escherichia coli (E. coli) (EPEC, EIEC, EHEC, ETEC), Campylobacter jejuni (C. jejuni), Shigella spp., Salmonella spp., Yersinia enterocolitica (Y. enterocolitica)5-8, con menor frecuencia Aeromonas spp., Vibrios spp.9-12 y Pleisomonas shigeloides (P. shigeloides)13-15. El número de casos varía en función de la región geográfica, la edad de los pacientes y la época del año en que fue realizado el estudio.
Los objetivos del manejo terapéutico de los pacientes afectados de gastroenteritis son preservar la vida, aliviar los síntomas, evitar las complicaciones, acortar la enfermedad y evitar la diseminación de los agentes patógenos a la población. En la gastroenteritis aguda la terapia de rehidratación oral es el tratamiento estándar y se indican agentes antimicrobianos en casos severos o prolongados, con sospecha de shigelosis, cólera o cuando el patógeno es conocido para evitar el contagio16. Sin embargo, en la práctica clínica diaria cuando se reporta el resultado del cultivo en heces el paciente ya se está recuperando o el tratamiento es tardío. Conocer la susceptibilidad a los antimicrobianos de las bacterias causantes de un síndrome tiene importancia en 2 aspectos: uno es el abordaje terapéutico temprano, por necesidad empírico, y el otro es la vigilancia epidemiológica de la resistencia bacteriana que es útil para dirigir medidas para prevenirla.
El uso empírico de antimicrobianos puede ser ineficaz por la emergencia de resistencia bacteriana, por lo tanto, los posibles esquemas terapéuticos deben ser actualizados frecuentemente tomando en cuenta los patrones de resistencia regionales17-20. Algunos estudios clínicos indican que las quinolonas son superiores a otros antibióticos o al placebo en el tratamiento empírico de pacientes adultos con diarrea17,20-22. En los niños, en quienes no están indicadas las quinolonas y también en adultos se han utilizado otros antimicrobianos, como ampicilina (AMP), trimetoprim-sulfametoxazol (T-S), cloranfenicol (CLO), furazolidona (FUR), y antibióticos no absorbibles, como neomicina y recientemente rifaximina (RIF)17,23-25. Sin embargo, no se tienen datos recientes de la susceptibilidad bacteriana a estos antimicrobianos en México. La RIF es un antibiótico semisintético derivado de la rifamicina S de amplio espectro que actúa inhibiendo la síntesis del RNA bacteriano, no absorbible por vía oral y que alcanza una concentración muy alta en la luz intestinal (∼8,000μg/g de heces), posee una excelente actividad bactericida sobre microorganismos enteropatógenos y no provoca alteraciones importantes en la flora intestinal26.
El objetivo de este estudio es investigar la susceptibilidad de las bacterias causantes de gastroenteritis aguda a la RIF y a los antibióticos más utilizados en México en el tratamiento de infecciones gastrointestinales.
Material y métodosAislamientos bacterianosSe analizaron las cepas bacterianas en las heces de 1,000 pacientes con diagnóstico de gastroenteritis o diarrea aguda en 10 laboratorios de hospitales de la ciudad de México que atienden a pacientes externos e internados. Las cepas fueron conservadas y congeladas antes de la identificación bioquímica, serológica y de la prueba de susceptibilidad a los antimicrobianos en caldo leche y caldo soya glicerol a –70°C27; en los primoaislamientos iniciales de las muestras de heces que se realizaron de cada laboratorio en particular se utilizaron los siguientes medios de cultivo: agar MacConkey, agar de MacConkey-Sorbitol, agar Salmonella-Shigella, agar XLD, agar Campylobacter, agar Yersinia, agar TCBS, agar verde brillante y caldo tetrationato28.
Los aislamientos fueron identificados bioquímicamente en cada laboratorio utilizando procesos y sistemas manuales y automatizados AutoScan 4, Walkaway (MicroScan) o el Vitek 2 (Biomeriux)29-31 con una probabilidad de aceptación>95% en la identificación; la tipificación e identificación serológica que procedía en determinadas especies bacterianas como E. coli, Salmonella y Shigella se realizó utilizando antisueros y reactivos de aglutinación o coaglutinación específicos marca Biorad32, Phadebact33, Oxoid34, Sanofi-Pasteur35, «O» Beli36 y Probac37. Los serogrupos y serotipos detectados se mencionan en la tabla 1.
Bacterias aisladas de 1,000 pacientes con diagnóstico de gastroenteritis aguda y sus serotipos
| Bacteria | Número | Serotipos involucrados |
|---|---|---|
| E. coli enteropatógena grupo A, B y C | 531 | O127:B8, O111:B4, O55:B5, O26:B6 y otros serotipos |
| O119:B4, O128:B12, O124:B17, O86:B7, O126:b16 y otros serotipos | ||
| O142:B86, O119:K90, O124:B17, O86:B7, O126:B16 y otros serotipos que deben corresponder a: O128:K73, O44:K74, O18:K77, O20:K61 y O20:K84 | ||
| E. coli enterotoxigénica (LT) | 54 | Solo serotipos productores de toxina termolábil (LT) |
| E. coli enterohemorrágica | 18 | Solo serotipo O:157 |
| Shigella dysenteriae | 54 | Todos los serotipos aglutinables con el antisuero específico |
| Shigella flexneri | 24 | Todos los serotipos aglutinables con el antisuero específico |
| Shigella boydii | 27 | Todos los serotipos aglutinables con el antisuero específico |
| Shigella sonnei | 15 | Todos los serotipos aglutinables con el antisuero específico |
| Salmonella grupo A | 24 | Especie más probable: S. paratyphi |
| Salmonella grupo B | 21 | Especie más probable: S. typhimurium |
| Salmonella grupo C1 | 24 | Especie más probable: S. choleraesuis |
| Salmonella grupo C2 | 24 | Especie más probable: S. newport |
| Salmonella grupo D | 24 | Especie más probable: S. enteritidis |
| Vibrio spp. | 20 | – |
| Yersinia enterocolitica | 20 | – |
| Campylobacter jejuni | 20 | – |
| Pleisomonas shigeloides | 20 | – |
| Aeromonas | 80 | – |
Las pruebas de susceptibilidad a los antimicrobianos (PSA) se realizaron por el método de difusión en agar (CLO, T-S, neomicina [NEO], FUR, fosfomicina [FOS], AMP, ciprofloxacino [CIP]) y por microdilución (RIF) siguiendo la normatividad recomendada por Clinical Laboratory Standards Institute38, así como las recomendaciones de la American Society for Microbiology39. Las concentraciones de los antibióticos ensayados y las condiciones de las PSA fueron las siguientes AMP 10μg/ml, T-S 1.25/23.75μg/ml, CLO 30μg/ml, CIP 5μg/ml, FUR 100μg/ml, NEO 30μg/ml, FOS 50μg/ml. RIF se probó con 100μg/ml; las cepas que no fueron susceptibles a esta concentración se sometieron sucesivamente a 200μg/ml, 400μg/ml y 800μg/ml. Para susceptibilidad a RIF se consideró MIC100, mientras para los otros antibióticos se fue MIC90.
Análisis estadísticoLa susceptibilidad de las bacterias a RIF se comparó con la de los otros antimicrobianos con la prueba Z y se consideró significativa con una p<0.05. El software estadístico empleado fue Statistica 8.0 y Stata 11.
ResultadosSe analizaron los coprocultivos de 511 hombres y 489 mujeres, 65% mayores de 20 años de edad. Las bacterias aisladas fueron E. coli 603 (EPEC 531, ETEC 54, EHEC 18), Shigella 120 (dysenteriae, flexneri, boydii, sonnei), Salmonella 117 (paratyphi, typhimurium, cholerasuis, newport, enteritidis), Vibrio spp. 20, Y. enterocolitica 20, C. jejuni 20, P. shigeloides 20 y Aeromonas spp. 80.
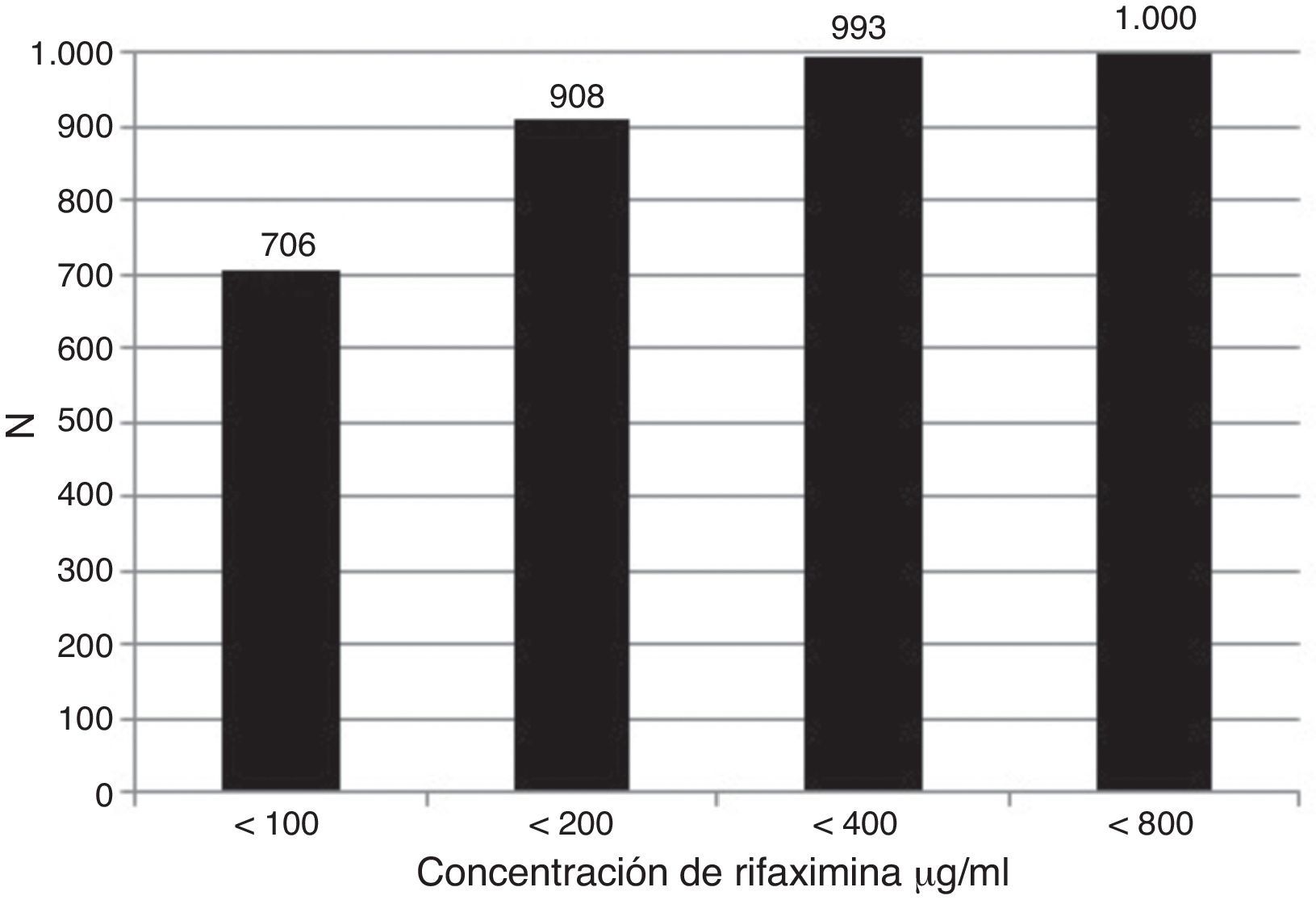
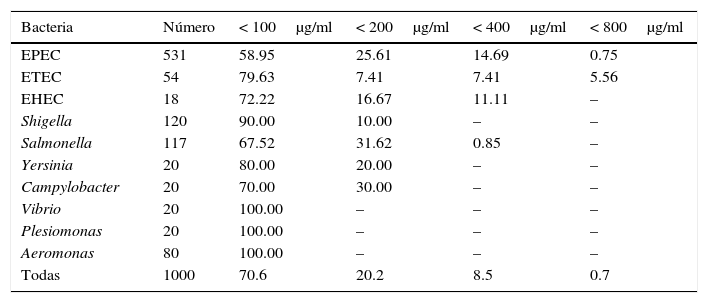
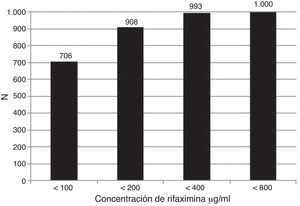
La susceptibilidad global de las bacterias a las diferentes concentraciones de RIF (MIC100) se muestra en la figura 1; los resultados de patrones de susceptibilidad acumulada en todas las cepas ensayadas fueron a<100μg/ml: 70.6%; a<200 μg/ml: 90.8%; a<400 μg/ml: 99.3% y a<800 μg/ml: 100.0%. La susceptibilidad de cada grupo de bacterias a las diferentes concentraciones de RIF se anota en la tabla 2. Más del 99% de las cepas de Shigella, Salmonella, Yersinia, Campylobacter, Vibrio, Pleisiomonas y Aeromonas fueron susceptibles a concentraciones<100 o < 200μg/ml, mientras que el 11-15% de las E. coli requirieron < 400 o incluso < 800μg/ml.
Susceptibilidad acumulada de las bacterias aisladas en forma global a la rifaximina. En las 1000 cepas RIF se probó con una concentración de 100 μg/ml, las que no fueron susceptibles a esta concentración se sometieron sucesivamente a 200 μg/ml, 400 μg/ml y 800 μg/ml. Las cepas susceptibles acumuladas fueron 706 (< 100), 908 (< 200), 993 (< 400) y 1,000 (< 800).
Susceptibilidad de las bacterias a diferentes concentraciones de rifaximina
| Bacteria | Número | < 100μg/ml | < 200μg/ml | < 400μg/ml | < 800μg/ml |
|---|---|---|---|---|---|
| EPEC | 531 | 58.95 | 25.61 | 14.69 | 0.75 |
| ETEC | 54 | 79.63 | 7.41 | 7.41 | 5.56 |
| EHEC | 18 | 72.22 | 16.67 | 11.11 | – |
| Shigella | 120 | 90.00 | 10.00 | – | – |
| Salmonella | 117 | 67.52 | 31.62 | 0.85 | – |
| Yersinia | 20 | 80.00 | 20.00 | – | – |
| Campylobacter | 20 | 70.00 | 30.00 | – | – |
| Vibrio | 20 | 100.00 | – | – | – |
| Plesiomonas | 20 | 100.00 | – | – | – |
| Aeromonas | 80 | 100.00 | – | – | – |
| Todas | 1000 | 70.6 | 20.2 | 8.5 | 0.7 |
Resultados expresados en % de cepas susceptibles.
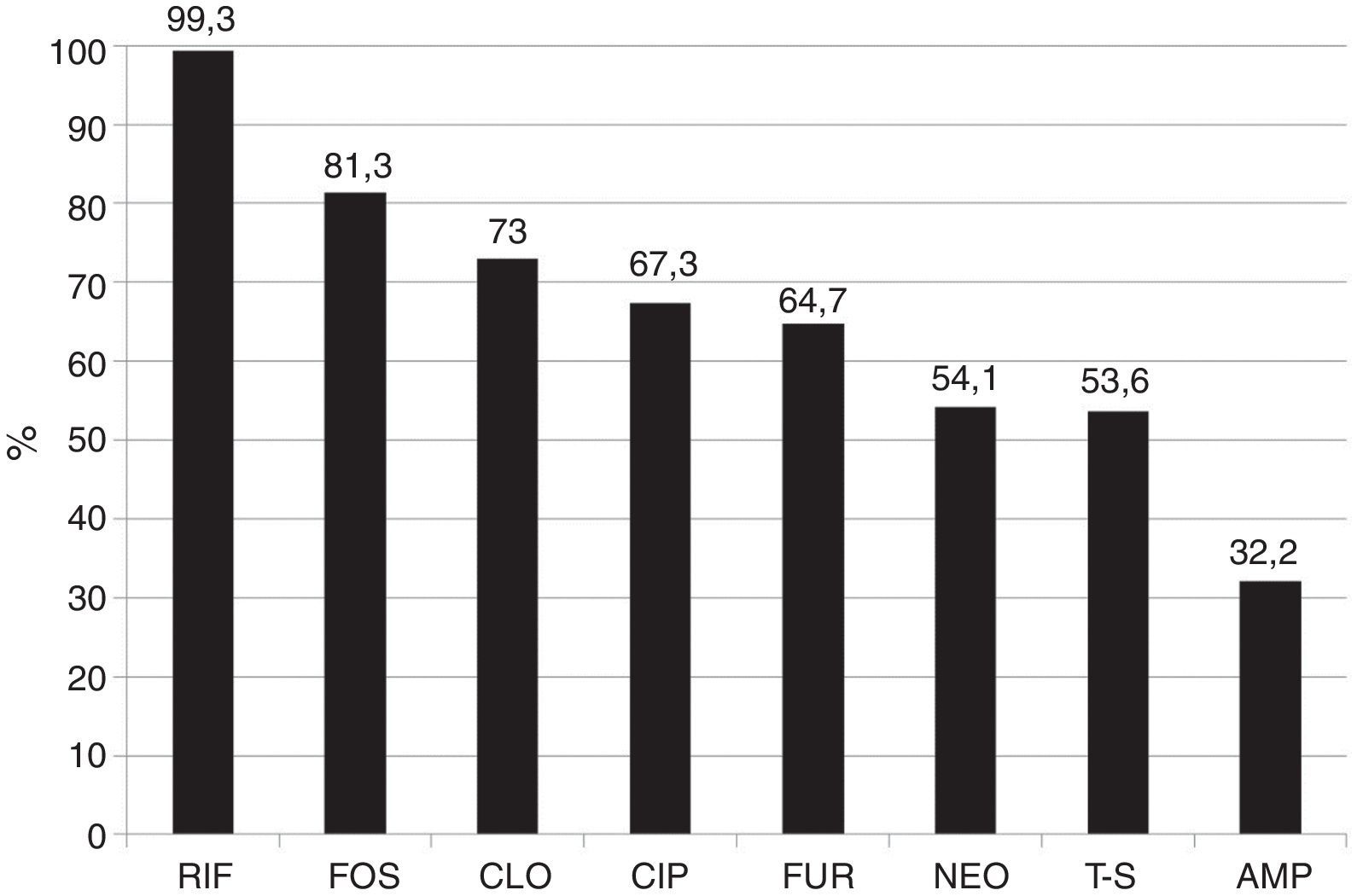
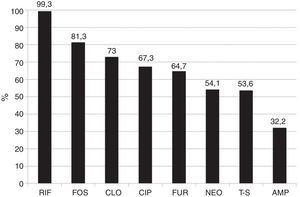
La susceptibilidad global a cada antibiótico de todas las especies bacterianas fue: RIF (< 400μg/ml) 99.3% y (< 800μg/ml) 100%, FOS 81.3%, CLO 73.0%, CIP 67.3%, FUR 64.7%, NEO 54.1%, T-S 53.6%, AMP 32.2%. La susceptibilidad global a RIF con < 400 y con < 800μg/ml fue superior (p<0.001) a la susceptibilidad global a cada uno de los 8 fármacos estudiados (fig. 2) y en la mayoría de los casos también en cada grupo bacteriano por separado.
Susceptibilidad global de las 1,000 cepas bacterianas aisladas a los distintos antibióticos.
Rifaximina vs. los otros antimicrobianos p < 0.0001.
AMP: ampicilina; CIP: ciprofloxacino; CLO: cloranfenicol; FOS: fosfomicina; FUR: furazolidona; NEO: neomicina; RIF: rifaximina (< 400 μg/ml); T-S: trimetoprim-sulfametoxazol.
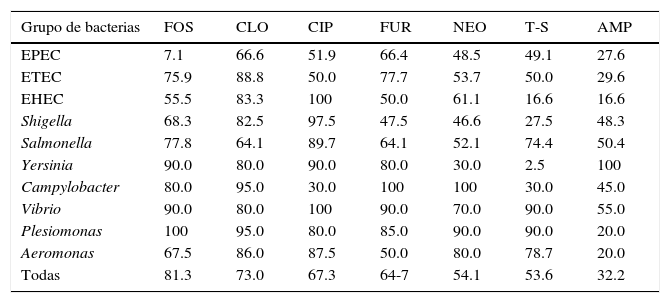
La susceptibilidad de cada grupo bacteriano a los antibióticos probados se menciona en la tabla 3.
Susceptibilidad de cada grupo de bacterias a los antimicrobianos probados
| Grupo de bacterias | FOS | CLO | CIP | FUR | NEO | T-S | AMP |
|---|---|---|---|---|---|---|---|
| EPEC | 7.1 | 66.6 | 51.9 | 66.4 | 48.5 | 49.1 | 27.6 |
| ETEC | 75.9 | 88.8 | 50.0 | 77.7 | 53.7 | 50.0 | 29.6 |
| EHEC | 55.5 | 83.3 | 100 | 50.0 | 61.1 | 16.6 | 16.6 |
| Shigella | 68.3 | 82.5 | 97.5 | 47.5 | 46.6 | 27.5 | 48.3 |
| Salmonella | 77.8 | 64.1 | 89.7 | 64.1 | 52.1 | 74.4 | 50.4 |
| Yersinia | 90.0 | 80.0 | 90.0 | 80.0 | 30.0 | 2.5 | 100 |
| Campylobacter | 80.0 | 95.0 | 30.0 | 100 | 100 | 30.0 | 45.0 |
| Vibrio | 90.0 | 80.0 | 100 | 90.0 | 70.0 | 90.0 | 55.0 |
| Plesiomonas | 100 | 95.0 | 80.0 | 85.0 | 90.0 | 90.0 | 20.0 |
| Aeromonas | 67.5 | 86.0 | 87.5 | 50.0 | 80.0 | 78.7 | 20.0 |
| Todas | 81.3 | 73.0 | 67.3 | 64-7 | 54.1 | 53.6 | 32.2 |
Resultados expresados en % de cepas susceptibles.
Como se puede notar, un gran número de cepas muestran una proporción muy alta de resistencia bacteriana a NEO, T-S y AMP. Sin embargo, Yersinia sigue siendo muy susceptible a AMP (100%), Vibrio a T-S (90%) y Campylobacter a NEO.
DiscusiónLa prevalencia y la incidencia de las bacterias causantes de gastroenteritis a nivel mundial varían de acuerdo con el tipo de población estudiada, el lugar geográfico donde se realiza el estudio, la época del año en la cual se hace el diagnóstico microbiológico y otras características clínicas y socio-demográficas de los pacientes estudiados6,40-42. Aunque esta no es una investigación de prevalencia, las cepas se recolectaron durante todo el año 2013, por lo que no influyeron las variaciones estacionales y refleja la frecuencia con que se recibieron las cepas en los laboratorios de análisis clínicos, dominando E. coli, Shigella, Salmonella y Aeromonas. Estos datos concuerdan con otros reportes en México23,43,44.
Se han publicado estándares para definir la susceptibilidad o la resistencia bacteriana para la mayoría de los antibióticos38. Sin embargo, no hay puntos de corte clínicos para rifamicinas contra enteropatógenos, aunque un valor de ≤ 32μg/ml de RIF fue aplicado por algunos investigadores en diarrea del viajero45-47. La susceptibilidad de las bacterias a un antibiótico implica que los aislamientos son inhibidos por la concentración generalmente alcanzable del agente antimicrobiano en el sitio de la infección cuando se utiliza la dosis recomendada. Se han reportado concentraciones fecales de RIF hasta 8,000μg/g (media 7,961μg/g) después de 3 días de tratamiento en la dosis recomendada de 800mg/día y 3 días después de terminada la terapia aún permanecen en las heces concentraciones medias de 3,266μg/g48. En este estudio se evaluó la susceptibilidad a RIF en 4 concentraciones: < 100, < 200, < 400 y < 800μg/ml. La susceptibilidad general observada a estas concentraciones implica una cierta resistencia bacteriana a la RIF a concentraciones de < 100μg/ml que se supera en las concentraciones más altas, siempre muy por debajo de los valores alcanzables en la luz intestinal. Los puntos de corte para considerar las bacterias resistentes a RIF se han establecido en 32, 128 o incluso 256μg/ml46-49, pero como se observó en este estudio, las bacterias resistentes a concentraciones menores de RIF no lo son si se incrementa la concentración del antibiótico in vitro; finalmente, el 99.3% fue susceptible a < 400μg/ml y el 100% a < 800μg/ml, que son 10-20 veces menores a la concentración media que se alcanza in vivo con el tratamiento recomendado.
Se ignoran las concentraciones en la luz intestinal, o fecales, de los otros antimicrobianos probados en este estudio, de modo que para el análisis de susceptibilidad se utilizaron las concentraciones recomendadas internacionalmente. En general, la susceptibilidad bacteriana a RIF fue superior a los demás antimicrobianos probados en este estudio. En investigaciones recientes con enteropatógenos aislados de viajeros provenientes de Latinoamérica y de Asia también se encontró que la proporción de bacterias susceptibles a RIF fue mayor que a otros antimicrobianos; llamó la atención que las cepas de C. jejuni provenientes de Asia mostraron una resistencia variable a RIF, mientras las provenientes de México y Guatemala fueron 100% susceptibles46,47. En el presente estudio, las cepas de C. jejuni fueron 100% susceptibles con < 100-200μg/ml. Varias cepas de E. coli requirieron concentraciones de RIF mayores de 100μg/ml, lo que concuerda con otras observaciones de bacterias provenientes de México50.
La RIF tiene un amplio espectro de susceptibilidad que incluye bacterias anaerobias26,49. La resistencia bacteriana es muy baja y no se induce fácilmente51. Además, Ouyang-Latimer et al. compararon la susceptibilidad de bacterias enteropatógenas obtenidas en 2006-2008 con las obtenidas 10 años antes y no encontraron un incremento de los niveles de MIC90 para RIF en ninguno de los organismos analizados46. Es más, las bacterias intestinales normales que se vuelven resistentes a 100μg/ml de RIF después de 5 días de tratamiento desaparecen de las heces espontáneamente en pocas semanas52.
La baja proporción de bacterias susceptibles a AMP, T-S, neomicina, FUR y CIP, del 32.2 al 67.3% en ese orden, concuerda con estudios realizados en otras regiones del mundo53-56 y puede ser explicada por la inducción de resistencia bacteriana debida al amplio uso o abuso de estos antimicrobianos. A este respecto llama la atención el CLO, que conserva una aceptable susceptibilidad general del 73%, ya que después de ser utilizado ampliamente en México, en los últimos 30 años se ha restringido su uso a la fiebre tifoidea. Además, a modo de comparación, en este estudio se introdujo la prueba de susceptibilidad a FOS. Este es un antibiótico que se utiliza poco en México, principalmente para infecciones urinarias. La susceptibilidad general de la FOS fue mayor que con los otros antimicrobianos, solo por debajo de RIF.
En México se utiliza ampliamente sin necesidad de receta médica un antibiótico poco absorbible, la neomicina. Según nuestros datos es claro que AMP, T-S, neomicina y FUR no serían buenas opciones terapéuticas. La RIF se ha utilizado con éxito en pacientes con diarrea infecciosa aguda en niños y en adultos, así como en diarrea del viajero, con excelente tolerancia57-60. La RIF parecería ser la mejor opción, ya que posee un alto índice terapéutico puesto que reúne una alta eficacia con baja frecuencia de efectos adversos26. Los efectos adversos atribuibles a otros antibióticos son frecuentes, especialmente por betalactámicos y T-S principalmente por alergia y también neurotoxicidad por sulfonamidas y CIP61.
El tratamiento con antimicrobianos es una herramienta valiosa en el control de varias infecciones gastrointestinales, ya que reduce la duración y la intensidad de la enfermedad, previene complicaciones que eventualmente pueden ser graves y puede disminuir la transmisibilidad. Desafortunadamente, desde hace varias décadas se han seleccionado cepas de bacterias enteropatógenas resistentes a los antimicrobianos de uso común y aquellos que en algún momento fueron considerados de primera elección62. La selección y la diseminación de la resistencia antimicrobiana entre las diferentes especies bacterianas causantes de gastroenteritis es un problema creciente de salud pública que complica el manejo terapéutico de los casos graves. Estudios realizados en muchas partes del mundo han revelado un aumento importante de bacterias resistentes a los antimicrobianos en muchas enfermedades infecciosas incluidas las gastroenteritis63,64. Para reducir la aparición de cepas bacterianas resistentes a los antimicrobianos parecería prudente evitar el uso indiscriminado de antibióticos en el ganado, determinar periódicamente los patrones locales de resistencia bacteriana, reducir la facilidad del acceso a los antimicrobianos (p. ej., evitar la automedicación de antimicrobianos) y reforzar la educación médica en este tema.
Limitaciones del estudio. Los coprocultivos se obtuvieron de 10 laboratorios que enviaron coprocultivos positivos con bacterias enteropatógenas provenientes de pacientes con diagnóstico de gastroenteritis aguda o diarrea aguda. Por lo tanto, no fue posible la obtención de los datos clínicos, como el tiempo de evolución de los síntomas, las características de las evacuaciones, los síntomas acompañantes de la diarrea y la intensidad o gravedad del cuadro clínico, que permitieran su correlación con el género y especie de la bacteria aislada. Los coprocultivos vinieron de la ciudad de México y no reflejan necesariamente el resto del país.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
FinanciamientoLa investigación fue financiada por Alfa Wassermann S.A. de C.V.
Conflicto de interesesAlberto Frati es actualmente director médico de Alfa Wassermann S.A. de C.V. productor de RIF, participó en la planeación del proyecto y en la revisión del manuscrito, pero no intervino en ninguna fase de la realización del estudio, de la enumeración de resultados ni en el análisis estadístico. Los demás autores declaran no tener conflictos de interés.
Véase contenido relacionado en DOI: http://dx.doi.org/10.1016/j.rgmx.2016.01.001, Remes Troche JM. Reflexiones sobre la resistencia a antibióticos y qué hacer al respecto. Rev Gastroenterol Méx. 2016;81(1):1–2.