¿ Introducción
La infección por virus de la hepatitis C (VHC) representa un importante problema de salud pública. La Organización Mundial de la Salud estima que aproximadamente 180 millones de personas están infectadas, lo cual representa el 3% de la población mundial.1 Una revisión reciente que incluye los datos disponibles de América Latina calcula una prevalencia de 1.23%, pero con fluctuaciones desde 0.1% hasta 2.4%, evidenciando además variabilidad significativa en los distintos países de acuerdo a la región geográfica reportada.2 En México, de acuerdo a la encuesta nacional de salud, la seroprevalencia anti-VHC positivo es del 1.4%,3 y es la segunda causa más frecuente de cirrosis hepática entre quienes acuden a hospitales de tercer nivel para su atención.4 Otros autores consideran que la prevalencia puede ser mayor en base a una revisión sistemática de la literatura publicada en México, con un rango que oscila entre 1 y 2.5%.5 Se considera que el riesgo de desarrollar cirrosis hepática fluctúa del 5% al 25% tras de un periodo de 25 a 30 años de estar infectado6,7 y que los sujetos con cirrosis por VHC pueden descompensarse (30% de riesgo a 10 años) o presentar carcinoma hepatocelular (1 al 3% por año).8 La historia natural de la enfermedad permite predecir que la morbimortalidad y los costos de atención relacionados a las complicaciones de la infección crónica por VHC incrementarán de manera significativa en las próximas décadas.6,9-10
El tratamiento de la hepatitis crónica por VHC ha mostrado un avance substancial en la última década. El estándar de manejo actual incluye la combinación de interferón pegilado (PEGIFN) alfa-2b 1.5 µg/kg/semana más ribavirina (RBV) ajustada a peso (800 -1400 mg/d) o PEGIFN alfa-2a 180 µg/semana más RBV 1000-1200 mg/día por 24 a 48 semanas dependiendo del genotipo de VHC y la carga viral.6,11 Con los esquemas mencionados la tasa global de respuesta viral sostenida (RVS) reportada en base a los grandes estudios clínicos aleatorizados es del 50 al 55%. Los factores asociados a no respuesta son múltiples; sin embargo, entre los más importantes se encuentran el cursar con infección por genotipo 1, la etnicidad afroamericana (en estudios en los Estados Unidos de América [EUA]), una carga viral alta y la presencia de cirrosis.12-16
¿ Respuesta a terapia actual en pacientes con hepatitis crónica por virus C en la población latina
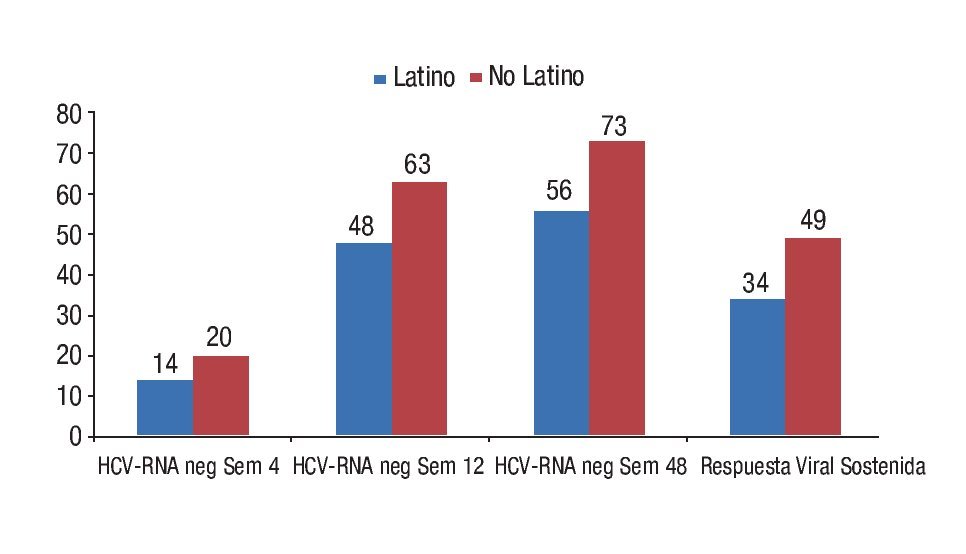
Desde hace muchos años, la etnicidad ha sido implicada como un factor predictivo de respuesta al tratamiento antiviral combinado con PEGINF/ RBV.17 Este factor adquiere importancia relevante en nuestro medio ante los resultados de los estudios recientemente publicados en los que se demuestra que la tasa de RVS es inferior en la población latina. En el primero de ellos publicado por Rodríguez-Torres y colaboradores, en el que se incluyeron 569 pacientes con genotipo 1, la tasa de RVS fue mayor en los blancos no latinos que en los latinos (49% vs. 34%, p < 0.001). Asimismo, en los no latinos la negatividad del ARN-VHC fue más frecuente a la semana 4 (p = 0.045) y durante todo el periodo de tratamiento (p < 0.001 en todos los momentos de comparación)18 (Figura 1). El otro estudio fue realizado en la Universidad de Nuevo México y si bien cuenta con un diseño retrospectivo, como grupo total, los latinos descontinuaron el tratamiento más frecuentemente (64.8% vs. 80.2%, p < 0.001) y mostraron una más baja tasa de RVS entre los infectados con genotipos 2 y 3 (45.3% vs. 75.3%, p < 0.001). Tras la corrección del mayor número de suspensiones del tratamiento entre los latinos, la diferencia en la RVS se mantuvo (65.9% vs. 87.3%, p = 0.014). Los autores concluyen que esto puede deberse a una mayor tasa de recaída posterior al tratamiento (25% vs. 7.5%, p=0.02).19
¿ Figura 1. Respuesta viral sostenida en pacientes con hepatitis crónica por virus C de acuerdo a su origen étnico.
Entre las posibles explicaciones para esta diferencia se postula una mayor prevalencia de resistencia a la insulina y de diabetes mellitus en la población latina; de hecho, en el primero de los estudios una proporción importante de los latinos presentó obesidad, diabetes y esteatosis hepática mayor del 33% en la biopsia hepática basal.17 Otro factor implicado es la variabilidad genética; sin embargo, en estas publicaciones no se efectuaron análisis de este tipo.
A este último respecto cabe destacar los estudios recientes que han identificado un polimorfismo de nucleótido único (SNP) cercano al gen de la interleucina-28B (IL28B) que identifica la respuesta al manejo antiviral combinado con PegIFN en pacientes con infección crónica por VHC.20-24
El gen de la IL28B codifica a la proteína de interferón-3, la cual actúa por medio de la vía JAKStat con la inducción de cientos de genes estimulados por interferón (ISG) que han sido implicados de manera amplia tanto en la respuesta al tratamiento basado en interferón como en la posibilidad de depuración viral espontánea.23
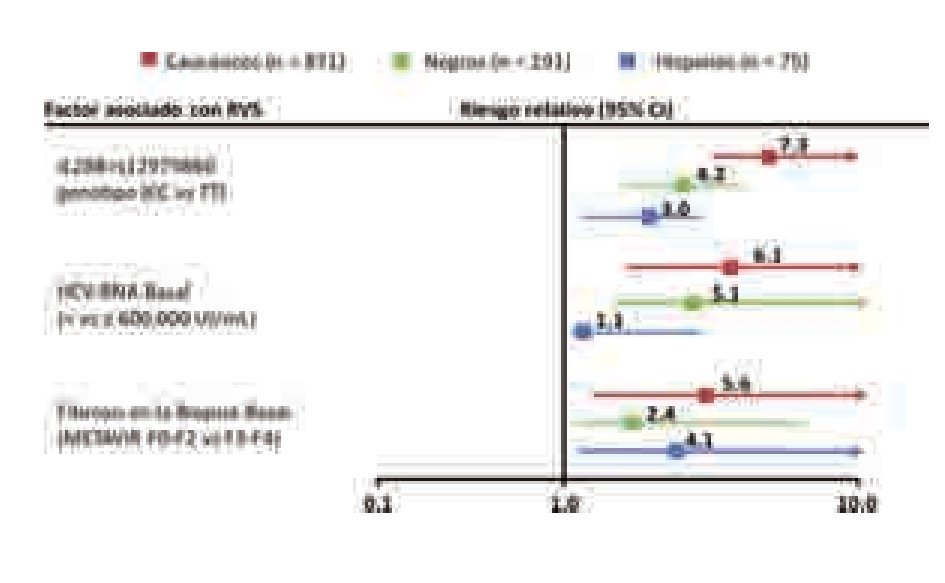
En la primera comunicación, publicada por Ge y colaboradores se analiza a 1 137 pacientes incluidos en el estudio IDEAL y se demuestra que el polimorfismo IL28B en el cromosoma 19 (rs12979860) es el predictor más potente de respuesta al tratamiento antiviral (OR 7.1), superando a la carga viral (OR 4.2) y al grado de fibrosis (OR 3.0).20 El genotipo CC de este polimorfismo se asocia a tasas superiores de RVS que el genotipo TT y la diferencia se mantiene en todos los grupos raciales (Figura 2). Los otros dos estudios muestran resultados similares en poblaciones autraliana21 y japonesa.22
¿ Figura 2.Polimorfismo del gen IL28B y posibilidad de respuesta viral sostenida en diferentes grupos étnicos en comparación con otros factores de predicción de respuesta.
En un estudio llevado a cabo por Rauch y colaboradores en 1 362 individuos (1 015 con infección por VHC y 347 con depuración espontánea del virus) se evaluó la asociación entre más de 500 000 polimorfismos de nucleótido simple de IL28 con la respuesta al tratamiento o la persistencia del VHC. La hepatitis C crónica se asoció con polimorfismos en el locus IL28B que codifica la citocina antiviral interferón lambda. El alelo menor rs8099917 se asoció con progresión a infección crónica por VHC (RM de 2.31). Esta asociación se observó tanto en sujetos con monoinfección por VHC como en aquellos con coinfección por VHC/VIH. Este polimorfismo también se asoció a la falta de respuesta al tratamiento (RM de 5.19) observándose el mayor efecto en sujetos con infección por VHC genotipo 1 o 4. Este alelo de riesgo se observó en el 24% de los sujetos con depuración espontánea del VHC, en el 32% de aquellos crónicamente infectados y en el 58% de quienes no respondieron.24
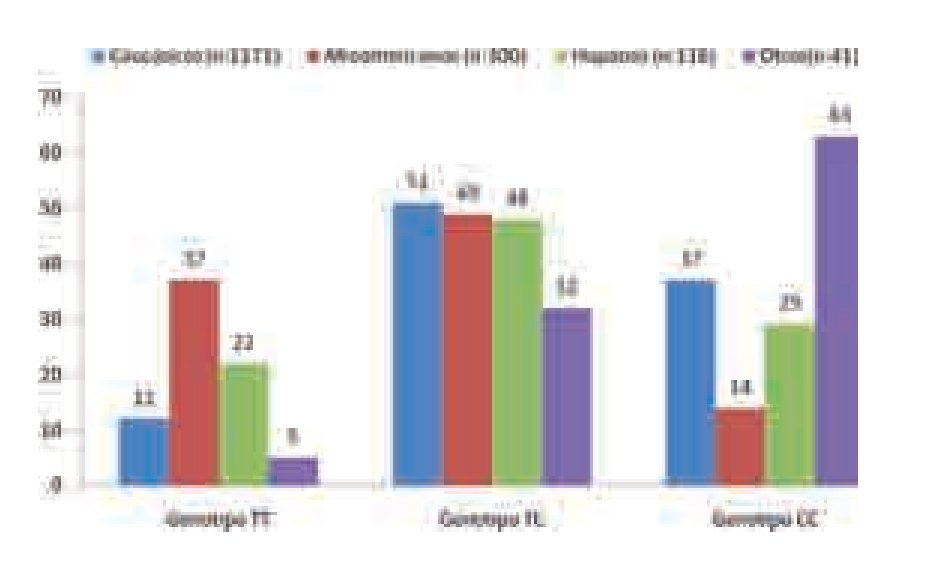
Lo anterior establece una firme asociación entre el polimorfismo del gen IL28B y la posibilidad de RVS con el estándar de tratamiento actual así como con las posibilidades de depuración espontánea. Si se subanaliza a la población de hispanos incluida en el estudio de Ge y colaboradores, a pesar de que se trata sólo de 75 sujetos, se evidencia el que el número de portadores del genotipo favorable CC es muy bajo,20 hecho que se resalta en una publicación más reciente en la que el genotipo CC se encontró sólo en el 29% de 116 hispanos en comparación con una frecuencia de 27% en caucásicos y de 63% de otros grupos étnicos.25 (Figura 3). Este factor aunado a que en nuestra región11 y en nuestro país el genotipo 1 es más frecuente26,27 y al creciente fenómeno de la obesidad, diabetes mellitus y probablemente del número de casos de esteatohepatitis no alcohólica, factores asociados a una más rápida evolución de la hepatopatía por VHC y a menor respuesta al tratamiento antiviral combinado, hace que la población latina sea un grupo especial en el que la búsqueda de mejores alternativas de tratamiento tenga gran relevancia, ya que el número de no respondedores al estándar de manejo aumentará en los próximos años, y de hecho, actualmente el paciente no respondedor representa uno de los retos más frecuentes en la consulta cotidiana del especialista a cargo de este grupo de enfermos.
¿ Figura 3. Frecuencia del genotipo rs12979860 (gen IL28B) en diferentes poblaciones de acuerdo a su etnicidad.
¿ Definición de no respuesta a tratamiento basado en interferón
De acuerdo a la cinética viral durante el tratamiento basado en IFN en monoterapia, combinación con IFN/RBV o con PEGIFN/RBV los sujetos pueden ser catalogados como respondedores rápidos, respondedores tempranos completos o parciales, pacientes con pérdida de respuesta durante el tratamiento, no respondedores o recaída6,11 (Tablas 1 y 2).
Tal como se menciona en las Tablas se denomina NO respondedor al sujeto que nunca logra negatividad del ARN-VHC durante el tratamiento y puede ser identificado de manera tan temprana como a las 12 semanas, siendo característica el no lograr una disminución de al menos dos logaritmos (base 10) con respecto al ARN-VHC basal. A diferencia de éste, el paciente con Recaída es el sujeto en quien se logra ARN-VHC indetectable durante el tratamiento, que termina siendo indetectable, pero en quien durante el periodo de seguimiento posterior al tratamiento (primeras 24 semanas) nuevamente se detecta ARN-VHC positivo. El porcentaje promedio de sujetos con genotipo 1 que presentan recaída es del 20 al 30%; en los infectados con genotipo 2 y 3 la proporción es menor.12,15,16 Un porcentaje mucho menor lo constituyen los pacientes con Pérdida de la respuesta durante el tratamiento (Breakthrough) definidos como aquellos en los que reaparece el ARN-VHC durante el esquema de tratamiento planeado después de que habían logrado la negatividad.
Además a los no respondedores se les debe caracterizar de acuerdo al esquema terapéutico al que fallaron ya que de ello depende la posibilidad de obtener una RVS en caso de recibir un nuevo esquema de manejo. Así, se dividen en:
1. No respondedor a tratamiento con IFN en monoterapia.
2. No respondedor a tratamiento combinado con IFN/RBV.
3. No respondedor a tratamiento combinado con PEGIFN/RBV.
Es fundamental distinguir al verdadero no respondedor de los sujetos que no recibieron un esquema completo de tratamiento sea por una duración menor de acuerdo a su genotipo, falta de apego del paciente, dosis inferiores a las recomendadas por intolerancia al esquema o por cualquier otro motivo, en cuyo caso deberá considerarse el inicio de un esquema con las dosis apropiadas, durante el tiempo adecuado y, en caso necesario, el uso de terapias adyuvantes (factor estimulante de granulocitos/macrófagos, eritropoyetina, antidepresivos, etc.) para optimizar la terapia individualizando cada caso.11
¿ Tratamiento en pacientes No respondedores a tratamiento con interferón convencional en monoterapia
El manejo de este grupo de enfermos ha sido explorado en múltiples ensayos clínicos controlados. Se han realizado al menos tres meta-análisis en los que se sugiere que entre 13% y 16% de los no respondedores a IFN en monoterapia pueden lograr una RVS si son retratados con esquema combinado con IFN y RBV.28-30 En el tercero de estos meta-análisis se incluyen también pacientes con recaída mostrando una respuesta agrupada (en no respondedores y recaídas) del 14% con IFN/ RBV y del 2% si se utiliza nuevamente el esquema con IFN exclusivamente, con una diferencia total del 7% a favor del retratamiento con combinación en comparación con monoterapia con IFN (p = 0.01, IC 2 al 13%).30
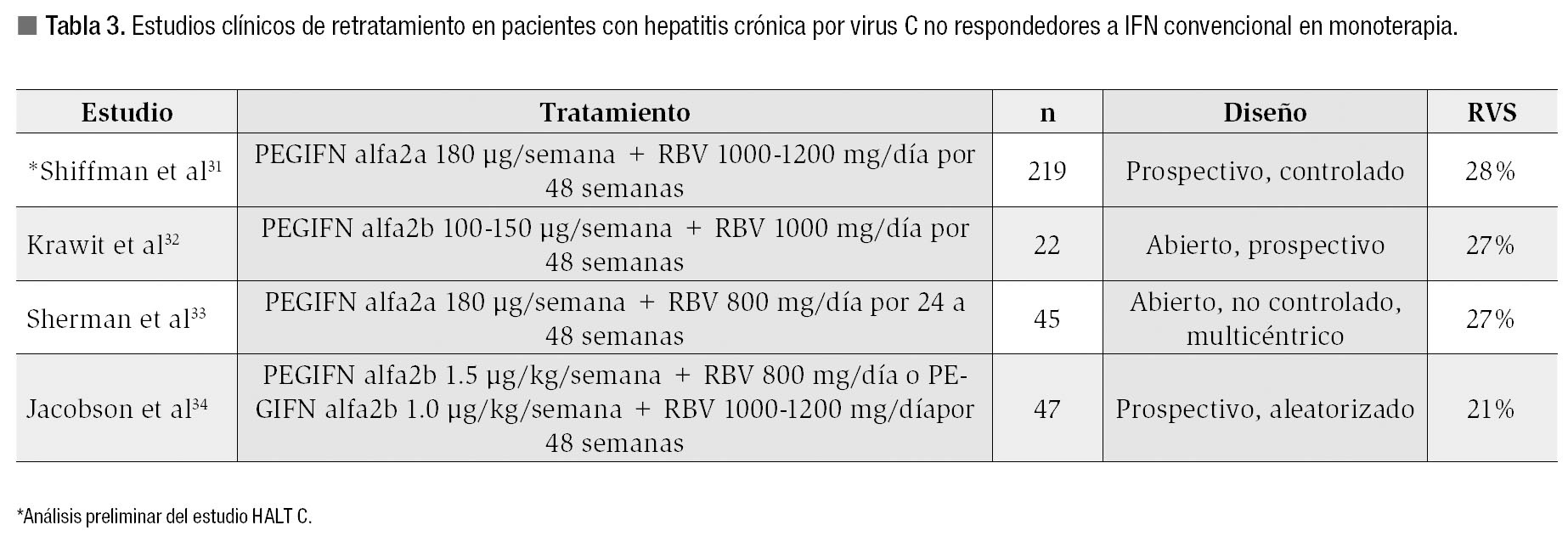
Los resultados son mejores retratando a estos sujetos con la combinación PEGIFN/RBV.31-34 Con este esquema los resultados en no respondedores a IFN en monoterapia oscilan entre 21 y 28% y alcanzan 52% en pacientes con recaída, con una tasa de RVS al combinar ambos grupos (no respondedores y recaídas) del 28 al 35%.31-34 Un estudio reciente en el que se evaluó el tratamiento prolongado con disminución de la dosis de PEGIFN alfa 2a (de mantenimiento) en pacientes con fibrosis avanzada/cirrosis (HALT-C),31 en el que participaron 1 145 pacientes no respondedores a manejo previo basado en IFN (con o sin RBV) tratados al menos por 12 semanas, contó con un tratamiento inicial de PEGIFN alfa 2a 180 µg/semana y RBV 1000-1200 mg/día por 20 semanas en todos los casos. A los sujetos que lograron ARN-VHC indetectable a la semana 20 del esquema se les ofreció continuar con el mismo esquema por 48 semanas. El análisis inicial de los primeros 604 reclutados, de los cuales 219 habían recibido monoterapia con IFN convencional, la respuesta al final del tratamiento fue de 44% y la RVS de 28%31 (Tabla 3).
¿ Retratamiento en pacientes no respondedores a tratamiento combinado con interferón convencional más RBV
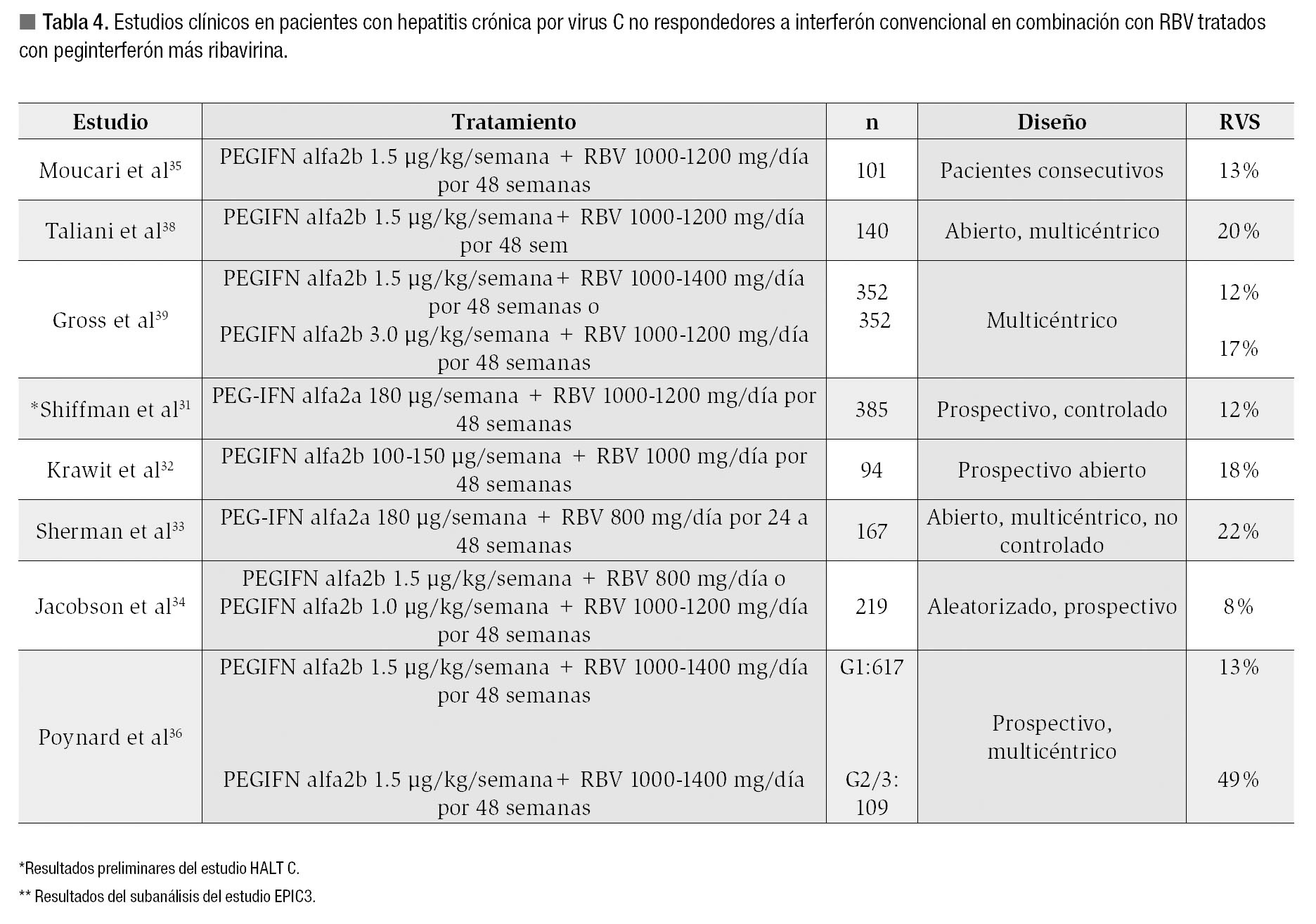
La opción lógica de manejo de retratamiento a comparar en los pacientes no respondedores a terapia combinada con IFN convencional/RBV era el entonces recién aprobado esquema con PEGIFN/ RBV. La RVS obtenida en los múltiples ensayos clínicos fluctúa entre 8 y 35% siendo en general menor que la obtenida en los sujetos que fallaron a IFN en monoterapia.30-39 En la Tabla 4 se resumen los estudios con mayor número de sujetos incluidos en los que se evaluó el retratamiento de pacientes previamente no respondedores a IFN/RBV.
Tres estudios merecen especial mención. En el primero de ellos, realizado por Shiffman y colaboradores31 incluye la fase de tratamiento inicial del estudio HALT C, se identificaron 385 no respondedores a tratamiento combinado IFN/RBV quienes fueron negativos a la semana 20 de tratamiento con PEGIFN 180 µg/semanay RBV 1000-1200 mg/d, la respuesta al final del tratamiento fue del 25% y la RVS del 12%. Los principales factores basales asociados a RVS fueron contar con genotipo 2/3, carga viral baja (< 1.5X106 UI/ mL) y ausencia de cirrosis hepática. Un análisis posterior de esta población refuerza la importancia del mantenimiento de la dosis de PEGIFN y la no suspensión de la RBV durante las primeras 20 semanas de manejo; así, la RVS disminuyó a 7% en los sujetos que recibieron < 60% de la dosis de PEGIFN en comparación con una RVS del 17% en quienes recibieron la dosis completa. Además, suspender la RBV en las primeras 20 semanas de manejo conduce a un notable descenso de la RVS (al 4 -6%) a pesar de recibir la dosis completa de PEGIFN.40
El estudio EPIC3 es el más grande diseñado para evaluar la utilidad de dosis de mantenimiento (PEGIFN alfa 2b 0.5 µg/kg/semana) en pacientes con fibrosis avanzada/cirrosis que fallaron a un esquema previo de terapia basada en IFN. En la primera parte del programa se ofreció a todos los sujetos no respondedores o con recaída, manejo durante 12 semanas con PEGIFN alfa 2b 1.5 µg/ kg/semana + RBV 800-1400 mg/día de acuerdo al peso. En caso de contar con ARN-VHC indetectable a la semana 12, el esquema se continuaba hasta 48 semanas.36 La tasa global de RVS fue del 22%, siendo mayor en los sujetos con recaída (38%) que en los no respondedores a IFN/RBV (14%). Es importante recalcar que ningún sujeto con ARN-VHC > 750 UI/mL a la semana 12 de tratamiento tuvo RVS (VPN = 100). Este hallazgo implica que si a un paciente no respondedor a IFN/RBV a quien se le ofrece la opción de retratamiento con PEGIFN alfa 2b/RBV y no logra negatividad del RNA-VHC a la semana 12, el esquema debe suspenderse. Los factores relacionados con RVS fueron nuevamente genotipo 2/3, tipo de tratamiento y respuesta previa (mejor respuesta en recaída), grado de fibrosis en la biopsia basal y carga viral baja (< 600 000 UI/mL).36 Los resultados de este estudio permitieron extender la indicación de PEGIFN alfa 2b/RBV para su uso en pacientes con falla a terapia previa tanto en EUA como en la Unión Europea.41
El tercer estudio denominado RENEW, exploró la utilidad de emplear dosis más altas de PEGIFN alfa 2b (3.0 µg/kg/semana) en combinación con RBV 800-1400 mg/día ajustada al peso contra la dosis convencional de 1.5 µg/kg/semana en combinación con RBV.39 Los 704 sujetos incluidos en 100 centros académicos de EUA (91% genotipo 1, 70% varones, 40% F3/F4 en la escala de METAVIR y 16% afroamericanos) fueron no respondedores a IFN/RBV. La tasa de RVS con la dosis de 1.5 µg/ kg/semana coincidió con la que posteriormente mostraría el estudio EPIC3 y si bien la tasa de RVS fue mayor con la dosis de 3.0 µg/kg/semana (17%, p = 0.03), también se observó con la dosis más alta una tendencia a más efectos adversos (13 vs. 11%) y mayor frecuencia de la disminución de dosis (37% vs 45%). Los autores concluyen que en esta población de difícil tratamiento la dosis más alta merecía ser estudiada como esquema de primera línea.39
¿ Tratamiento en pacientes no respondedores a tratamiento combinado con PEG-interferón más RBV
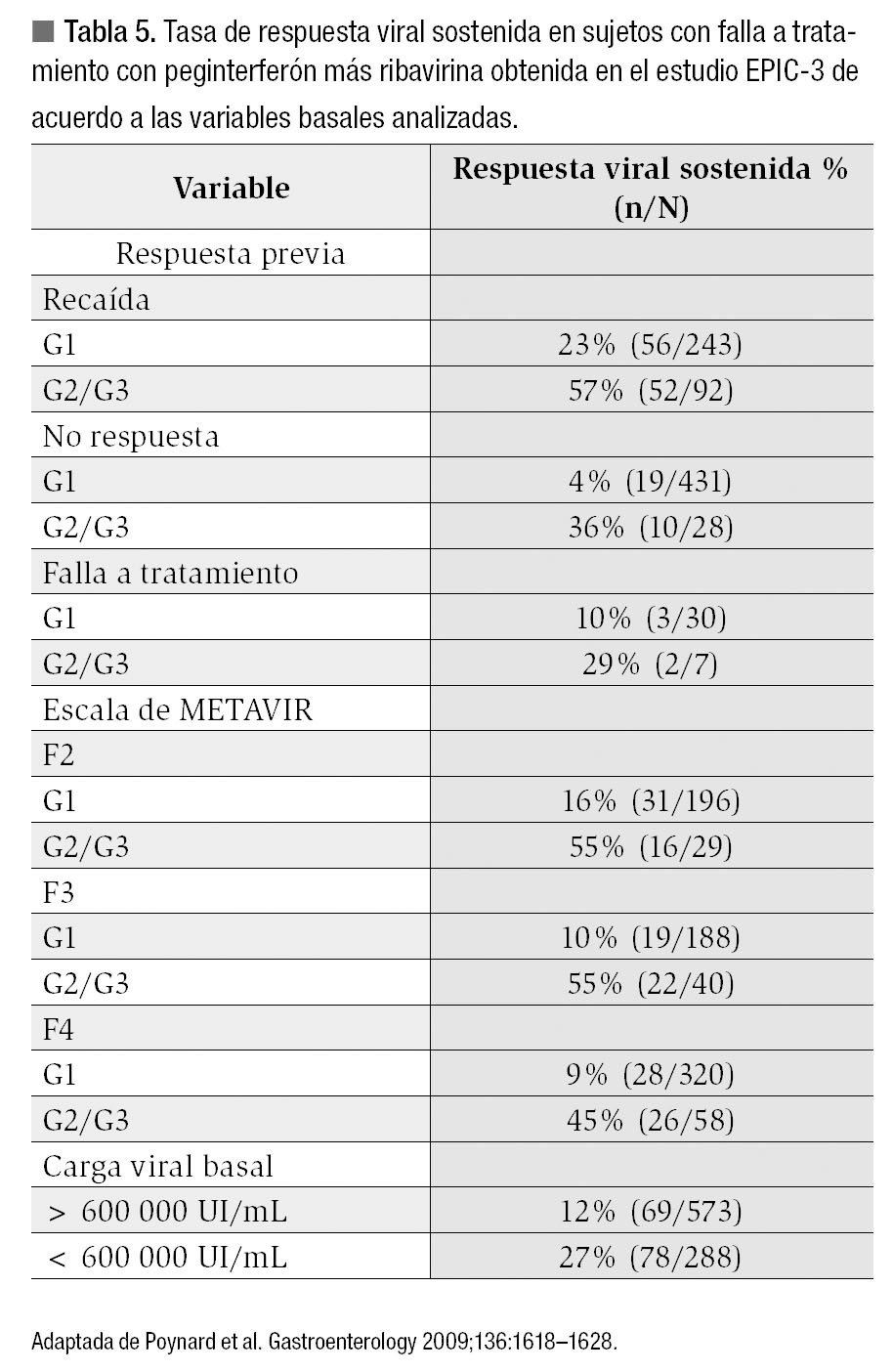
Recientemente se obtuvo información relacionada a las tasas de respuesta en los sujetos no respondedores al estándar de tratamiento actual. El retratamiento con el mismo esquema de tratamiento o con el cambio de PEGIFN no produce altas tasas de RVS tal como lo muestran dos grandes estudios multicéntricos. El primero de ellos es el programa EPIC-3; en este ensayo no comparativo participaron 375 pacientes refractarios a manejo con PEGIFN alfa 2a/RBV y 488 pacientes con falla a manejo con PEGIFN alfa 2b/RBV. La tasa de RVS alcanzó sólo 6% en los sujetos con falla a un esquema combinado con PEGIFN en comparación con la de 33% obtenida en los sujetos con recaída. No se observó diferencia entre los sujetos tratados con PEGIFN alfa 2b o alfa 2a.36 Los factores predictores de RVS fueron G2/G3, menor grado de fibrosis y carga viral basal baja (< 600 000 UI/mL) (Tabla 5). Nuevamente resalta el hecho de que ningún sujeto con ARN-VHC < 750 UI/mL lograra una RVS, por lo que en caso de que se decida retratar a un sujeto con PEGIFN/RBV con falla a un esquema similar previo, el objetivo realista inicial debe ser la negatividad a la semana 12 antes de decidir continuar con el manejo. Cabe destacar que en las guías actuales de manejo NO se recomienda el retratamiento con PEGIFN más RBV en los pacientes que no obtuvieron RVS después de un tratamiento completo con PEGIFN más RBV, aún si se administra un tipo diferente de PEGIFN (para recaídas, recomendación clase III, nivel C; para no respondedores recomendación clase III, nivel B).6,11
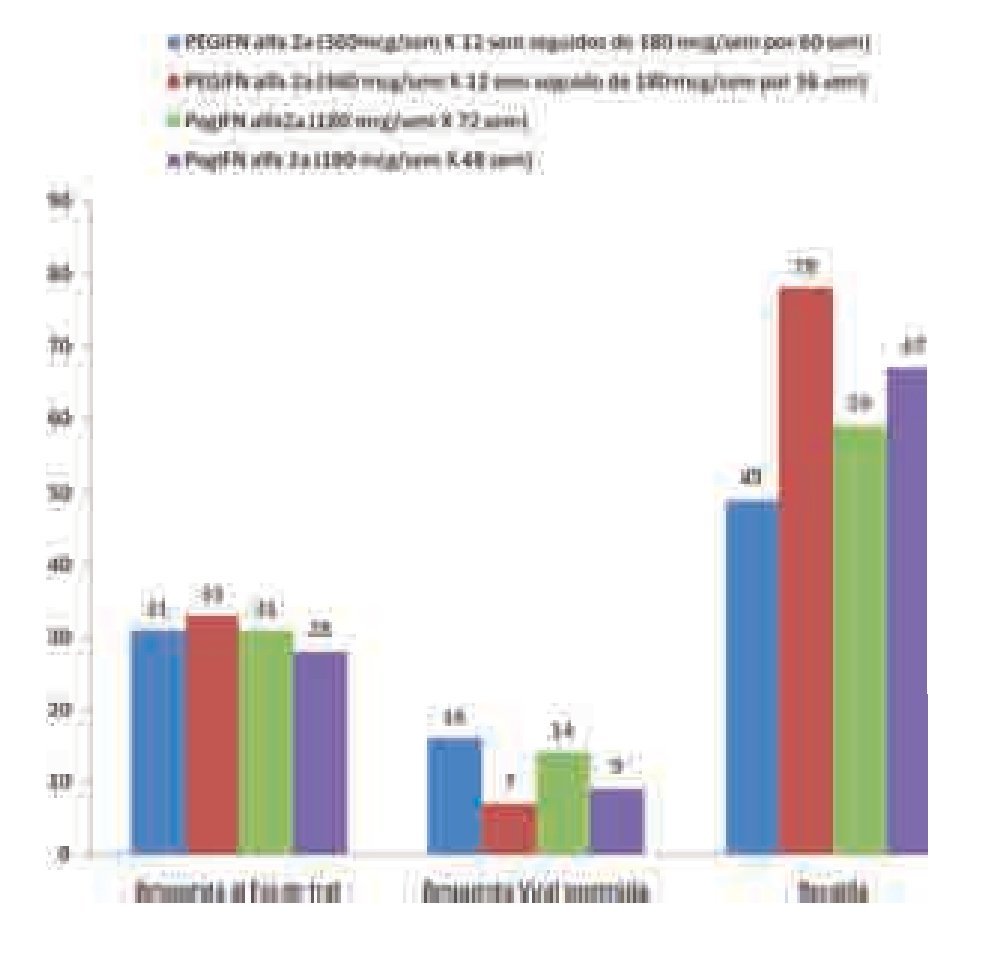
Una alternativa de manejo fue propuesta en el estudio internacional, aleatorizado, denominado REPEAT, en el que se incluyeron 950 sujetos con falla a esquema con PEGINF alfa 2b/RBV.42 En este ensayo se evaluó tanto el uso de dosis más altas de PEGIFN alfa 2a (dosis de inducción de 360 µg/semana por las primeras 12 semanas) y la prolongación del tiempo de tratamiento de 48 a 72 semanas. No se incluyó un brazo comparativo con PEGIFN alfa2b (Figura 4). La tasa de RVS fue superior en el brazo de dosis de inducción y duración de 72 semanas en comparación con el manejo estándar con dosis de 180 µg/semana más RBV por 48 semanas (16% vs. 9%; p = 0.006). Al analizar agrupados los datos de los dos brazos de inducción en comparación con la dosis estándar no se halló diferencia (RVS de 13% vs. 10%; p = 0.92). Sin embargo, la comparación entre el tratamiento durante 72 y 48 semanas resultó a favor del esquema más prolongado (16% vs. 8%; p < 0.001). De esta forma, la extensión de la terapia mejoró significativamente la tasa de RVS, en tanto que la dosis de inducción no logró efecto benéfico. Un análisis posterior mostró que la negatividad del ARN-VHC a la semana 12 de tratamiento es un fuerte predictor de RVS cuando se emplea este esquema.43
¿ Figura 4.Retratamiento con peginterferón alfa2a más ribavirina en pacientes no respondedores a peginterferón alfa2b más ribavirina (Estudio REPEAT).
¿ Terapia de mantenimiento en pacientes con falla a tratamiento previo basado en interferón
Bajo la premisa de que el interferón aún sin lograr erradicación viral podría ser de beneficio y disminuir o detener la progresión de la hepatopatía crónica por VHC se diseñaron tres estudios multicéntricos, controlados y aleatorizados.
HALT-C. En este ensayo se incluyeron 1 050 pacientes con hepatitis crónica por VHC y fibrosis avanzada, no respondedores a tratamiento previo. Los pacientes fueron distribuidos de forma aleatoria para recibir PEGIFN alfa 2a (90 µg/semana por 3.5 años) o ningún tratamiento.44 Los pacientes fueron estratificados de acuerdo al grado de fibrosis (622 con fibrosis avanzada y 428 cirróticos) y, además de la evaluación clínica periódica (cada tres meses), se realizó nueva biopsia hepática 1.5 y 3.5 años después de la aleatorización. En total 517 pacientes recibieron PEGINF y 533 fueron seguidos sin tratamiento. Se observó mejoría en el grupo tratado en cuanto a niveles de aminotransferasas, disminución de los niveles de ARN-VHC y del puntaje de actividad necroinflamatoria (p <0.001). Sin embargo, no se observó diferencia significativa en la tasa de mortalidad (6.6% vs. 4.6%), progresión a cirrosis (28.2% vs. 31.9%) o desarrollo de hepatocarcinoma (2.3% vs. 2.8%)44 (Figura 5).
¿ Figura 5. Respuesta a la terapia de mantenimiento con PEGIFN alfa2a en comparación con ningún tratamiento en el estudio HALT-C.
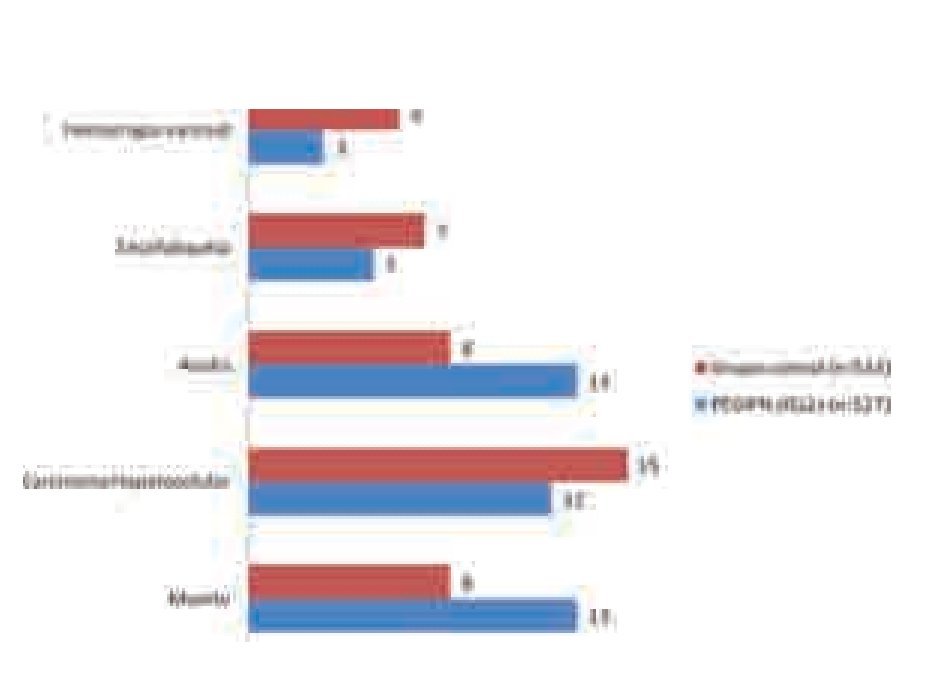
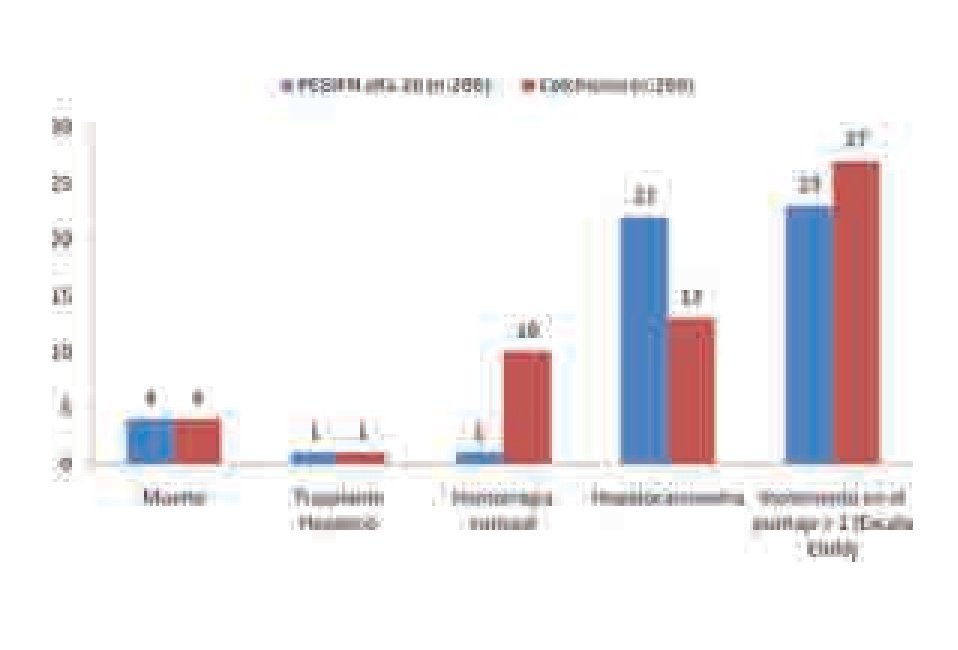
COPILOT. En este estudio multicéntrico, aleatorizado, controlado, se evaluó si era posible disminuir la progresión de la enfermedad hepática en 555 pacientes con fibrosis avanzada y con falla a tratamiento previo con IFN o PEGIFN más RBV.45 Los dos brazos de tratamiento a comparar fueron: PEGIFN alfa2b (0.5 µg/kg/semana) y colchicina (0.6 mg dos veces/día) por cuatro años. Los puntos primarios de evaluación incluyeron: Muerte, necesidad de trasplante hepático, progresión con aumento de dos puntos en la escala de Child-Turcote, desarrollo de hepatocarcinoma, ascitis, ictericia o encefalopatía. Al término de los cuatro años, no se obtuvo diferencia significativa en la supervivencia libre de eventos (p = 0.311) y las variables primarias evaluadas fueron muy similares (Figura 6). El análisis de intención de tratar en los pacientes con hipertensión portal al momento de la inclusión mostró una menor tasa de hemorragia variceal en quienes recibieron PEGIFN que en los tratados con colchicina (p = 0.038).45
¿ Figura 6.Tratamiento de mantenimiento. Resultados del estudio COPILOT a cuatro años.
EPIC -3. El objetivo de este programa era evaluar la seguridad y eficacia de PEGIFN alfa2b a dosis bajas (0.5 µg/kg/semama) como esquema de mantenimiento en pacientes refractarios a tratamiento con cualquier IFN y RBV.46 El estudio incluyó un total de 631 sujetos, que fueron aleatorizados para recibir PEGIFN o participar en el grupo control sin tratamiento. De éstos, 454 provenían del estudio de retratamiento EPIC-3 y 172 fueron incluidos directamente. De manera similar a los dos estudios previamente mencionados, la variable primaria de eficacia fue el tiempo de desarrollo del primer evento clínicamente significativo definido como: Descompensación de la función hepática, sangrado variceal, evolución a clase C en la escala de Child-Pugh, encefalopatía hepática grado 2, ascitis que requiriera de paracentesis terapéutica o tratamiento adicional, desarrollo de hepatocarcinoma, muerte o necesidad de trasplante hepático. En el análisis primario, un total de 36 sujetos en el grupo control y 27 en el grupo de PEGIFN presentaron eventos clínicamente significativos (p = 0.14, HR 1.45, IC 95% 0.88-2.40). El análisis secundario reveló 87 eventos clínicos en el grupo control y 63 en el grupo de tratamiento (p = 0.01, HR 1.56, IC 95% 1.13-2.17). Los principales eventos que resultaron diferentes en el análisis secundario fueron el surgimiento o crecimiento de varices esofágicas (43 en el grupo control y 16 en el de tratamiento). Al analizar a los sujetos con várices esofágicas al inicio del estudio (n = 82) se presentaron 14 eventos en el grupo de observación en comparación con cuatro en el grupo de PEGIFN (p = 0.001). Si bien el perfil de seguridad fue similar, ocurrió un mayor número de eventos infecciosos serios en el grupo que recibió PEGINF (25 vs. 3). Los autores concluyen que si bien en el análisis primario la terapia de mantenimiento con PEGIFN no fue superior al no tratamiento, se observó una disminución en el análisis de las variables secundarias, principalmente en los sujetos con varices esofágicas preexistentes, por lo que el uso de la terapia de mantenimiento con PEGIFN podría retrasar la progresión de la hipertensión portal y de los episodios hemorrágicos asociados.46
En resumen, los resultados de los estudios de mantenimiento con PEGIFN reportados hasta el momento no favorecen el uso generalizado de este tipo de terapia con dosis bajas. Los potenciales beneficios sobre la actividad necroinflamatoria, niveles de aminotransferasas y disminución en la carga viral no son suficientes para justificar la terapia de mantenimiento al no estar asociados con una disminución significativa en términos de progresión de la enfermedad hepática, mortalidad o desarrollo de hepatocarcinoma. Aún queda por definir si la disminución en la progresión de la hipertensión portal y en el número de episodios hemorrágicos observados en los estudios COPILOT y EPIC-3 es suficientemente contundente ante la existencia de otras estrategias profilácticas para el sangrado variceal extensamente validadas y aceptadas.
¿ Retratamiento con otros tipos de interferón
Interferón consensus. El interferón consensus (CIFN) es un interferón tipo 1, sintético, recombinante, derivado de una secuencia que incluye los aminoácidos más comúnmente encontrados en los diferentes subtipos de interferón alfa naturales. A pesar de no ser considerado como un agente de primera línea en el manejo de los pacientes con hepatitis crónica por virus C, podría tener un papel en el manejo de aquellos que fallaron a un esquema basado en IFN.47
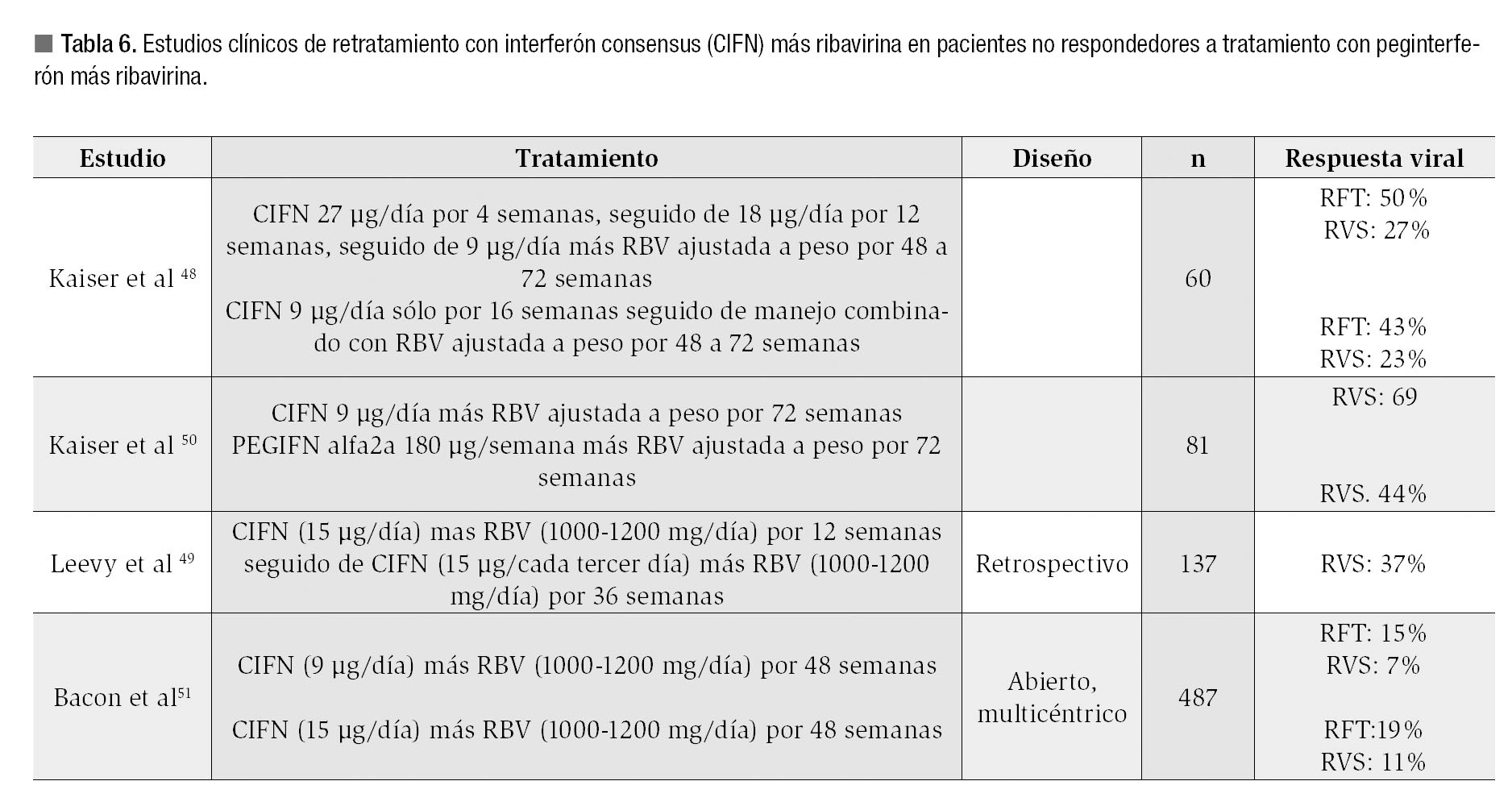
Estudios de tratamiento con CIFN en pacientes con falla a tratamiento con PEGIFN/RBV han mostrado resultados promisorios.48-51 Un estudio retrospectivo incluyó a 137 sujetos que no obtuvieron respuesta viral temprana (disminución > 2 log a la semana 12) al tratamiento con PEGIFN/ RBV, quienes fueron tratados con CIFN 15 µg/día más RBV 1000-1200 mg/día por 12 semanas (como terapia de inducción), seguido de 15 µg tres veces por semana más RBV 1000-12000 mg/día por 36 semanas, lográndose una RVS del 37%.49 Más recientemente, el estudio multicéntrico, abierto, de fase 3 denominado DIRECT, comparó la utilidad de dos dosis de CIFN (9 µg/día vs. 15 µg/día) más RBV 1000-1200 mg/día por 48 semanas en sujetos sin respuesta a un esquema de al menos 12 semanas de PEGIFN/RBV.51 Se incluyeron 343 sujetos que fueron aleatorizados a una de las dos dosis. La RVS fue de 7% y 11% a las dosis de 9 y 15 µg/día respectivamente. En los pacientes con cirrosis hepática las tasas de RVS fueron de 3.8% y 4.5% respectivamente, en tanto que entre los no cirróticos la RVS fue mayor: 7.8% (9 µg/día) y 13.1% (15 µg/ día). La intensidad de la disminución de la carga viral durante el tratamiento previo con PEGIFN/ RBV fue un factor predictor de buena respuesta; así, en los pacientes que durante el tratamiento estándar lograron una disminución del ARN-VHC > 2 log con respecto a la basal, las tasas de RVS fueron de 13.3% en quienes recibieron 9 µg/día y de 30% en los tratados con 15 µg/día de CIFN, lo que podría permitir el considerar el uso de CIFN más RBV en un grupo seleccionado de pacientes refractarios a PEGIFN/RBV49 (Tabla 6).
Albumin-interferón. El previamente conocido como Albuferon (Alb-IFN), es una molécula de fusión en la cual la albúmina se une a una molécula de interferón alfa2b, con lo que se obtiene una mayor vida media lo que condujo a su evaluación para aplicarse en conjunto con RBV a dosis cada dos a cuatro semanas.52 En un estudio fase II recientemente se evaluó la eficacia y la seguridad de Alb-IFN en 115 sujetos no respondedores a tratamiento previo, los cuales fueron asignados a cinco grupos de tratamiento: 1) Alb-IFN (900 µg cada dos semanas) más RBV 1000-1200 mg/día por 48 semanas, 2) Alb-IFN (1200 µg cada dos semanas) más RBV 1000-1200 mg/día por 48 semanas, 3) Alb-IFN (1200 µg cada cuatro semanas) más RBV 1000-1200 mg/día por 48 semanas, 4) Alb-IFN (1500 µg cada dos semanas) más RBV 1000-1200 mg/día por 48 semanas, y 5) Alb-IFN (1800 µg cada dos semanas) más RBV 1000-1200 mg/día por 48 semanas. La mayor parte de los pacientes fue genotipo 1 (93%) y no respondedora a PEGIFN/RBV (69.6%). Las tasas de RVS para cada grupo fueron: 30%, 13%, 25%, 9%, y 9% respectivamente.52 En total, 68% de los pacientes con ARN-VHC indetectable a la semana 12 lograron una RVS. En el grupo específico de pacientes con genotipo 1 no respondedores a PEGIFN/RBV la tasa de RVS global fue del 11%.52
¿ Esquemas con nuevos agentes específicos
En la actualidad existen múltiples agentes en desarrollo clínico que incluyen los denominados STAT-C (Specifically targeted antiviral therapies for hepatitis C). Algunos de ellos han sido evaluados en los pacientes que no obtuvieron RVS con el estándar de tratamiento combinado PEGIFN/RBV.53-54 Las moléculas más avanzadas son aquellas que inhiben a la proteasa NS3/4A del VHC, específicamente telaprevir y boceprevir.
Telaprevir. Este agente ha sido evaluado en un estudio fase IIb, controlado con placebo, aleatorizado y doble ciego (PROVE 3), que incluyó a 453 pacientes con genotipo 1 sin respuesta a esquema previo de al menos 12 semanas con PEGIFN/RBV.55
Los sujetos fueron asignados aleatoriamente a uno de cuatro brazos de tratamiento: 115 al grupo T12PR24 que recibió telaprevir (1 125 mg en dosis de carga, seguido de 750 mg cada ocho horas) por 12 semanas y PEGIFN alfa2a (180 µg/semana) y RBV 1000-1200 mg/día por 24 semanas; 113 sujetos correspondieron al grupo T24PR48 y recibieron telaprevir por 24 semanas y PEGIFN/ RBV por 48 semanas (a las mismas dosis que el grupo T12PR24); 111 pacientes que integraron el grupo T24P24 recibieron telaprevir, PEGIFN alfa2a 180 µg/semana sin RBV por 24 semanas y 114 del grupo PR48 o control quienes recibieron PEGIFN alfa2a (180 µg/semana) y RBV (1000-1200 mg/d) por 48 semanas. Las tasas de RVS en los tres grupos de teleprevir fueron: 51% (grupo T12PR24), 53% (T24PR48) y 24% (T24P24). En todos los casos, la RVS fue significativamente mayor que la obtenida en el grupo control (14%) (p <0.001, p <0.001, y p = 0.02, respectivamente). Cabe destacar la importante disminución de la RVS obtenida en el grupo en el que no se administró RBV. Las tasas de RVS fueron mayores en los pacientes con recaída al esquema previo obteniendo una RVS (69%, 76%, 20%, y 42%, respectivamente), seguidos por quienes presentaron pérdida de la respuesta durante el tratamiento (breakthroughs) (57%, 63%, 40% y 36%). Las tasas más bajas de RVS se observaron en los no respondedores al esquema previo (39%, 38%, 9% y 11%). La suspensión del tratamiento fue mayor en los grupos que recibieron telaprevir comparados con el control (15% vs 4%), siendo el evento adverso más común la erupción cutánea (51% de los pacientes con telaprevir y 5% de ellos grave). Los resultados de este estudio demuestran claramente, que el telaprevir tiene el potencial de aumentar la RVS en pacientes con falla al tratamiento previo, pero solamente cuando se emplea en combinación con PEGIFN y RBV. De hecho, la RVS en los no respondedores tratados con el esquema de telaprevir y PEGIFN sin RBV fue del 10%, muy similar a la obtenida en el grupo de pacientes retratados con PEGINF/RBV en el estudio REPEAT.42 Los resultados también ponen en evidencia que el incremento en la RVS está acompañado por un aumento en el riesgo de presentar eventos adversos.
En la actualidad el telaprevir está siendo evaluado en tres estudios fase III, dos de ellos en pacientes sin tratamiento previo y uno en falla a manejo; este último, denominado REALIZE (Retreatment of patients with telaprevir-based regimen to optimize outcomes) incluirá a 650 pacientes genotipo 1, no respondedores a PEGIFN/RBV. Su diseño permitirá comparar la eficacia, la seguridad y la tolerabilidad de dos regímenes de telaprevir (con y sin inicio retrasado) combinado con el esquema estándar de PEGIFN/RBV con respecto a las del esquema estándar. Los tres brazos del estudio comprenden: Grupo 1 - telaprevir 750 mg cada ocho horas por 12 semanas en combinación con PEGIFN/RBV por 12 semanas, seguido de 36 semanas de PEGIFN/RBV; grupo 2 - PEGIFN/RBV por cuatro semanas de tratamiento inicial seguido de triple terapia con telaprevir 750 mg cada ocho horas por 12 semanas más PEGIFN/RBV seguido de 32 semanas de PEGIFN/RBV, y finalmente el grupo 3) Control con PEGIFN/RBV a dosis convencional por 48 semanas.56
Boceprevir. El boceprevir es otro inhibidor de la proteasa del VHC que ha sido estudiado en no respondedores a PEGIFN/RBV. En un estudio de selección de dosis, se evaluó inicialmente la administración de 100 a 800 mg tres veces por día en combinación con PEGIFN alfa2b con o sin RBV.57 Después del análisis de seguridad intermedio, se decidió que todos los pacientes recibieran la dosis de 800 mg tres veces por día en combinación con RBV. La RVS en los seis grupos tratados con boceprevir varió del 2 al 14% lo que se compara con el 2% del grupo control que recibió PEGIFN alfa2b 1.5 µg/kg/semana más RBV 800 a 1400 mg/día.57 En el estudio fase III de boceprevir58 denominado RESPOND-2 se evalúan dos estrategias de tratamiento con boceprevir: 48 semanas de tratamiento en todos los pacientes (fase inicial de cuatro semanas con PEGIFN alfa2b 1.5 µg/kg/semana y RBV a dosis de 600-1400 mg/día, seguido de la adición de boceprevir 800 mg tres veces/día por 44 semanas), con posibilidad de terapia guiada por la respuesta; así en los pacientes que logren ser ARN-VHC indetectable a la semana 8 y en ciertos puntos posteriores el manejo se podría acortar a 36 semanas. En el RESPOND-2 se incluyeron 403 pacientes refractarios a manejo y aleatorizados en una proporción 1:2:2 a uno de tres grupos: 1) Control con PEGIFN/RBV por 48 semanas, 2) PEGIFN/RBV más boceprevir por 48 semanas, o 3) PEGIFN/RBV más boceprevir empleando la terapia guiada de acuerdo a la respuesta. Los resultados parecen ser muy prometedores con tasas superiores de RVS al 50% en los grupos tratados con boceprevir y serán presentados en la próxima reunión de la AASLD 2010.60
¿ Conclusiones
A pesar de los grandes avances obtenidos en la última década en el tratamiento de la hepatitis crónica por virus C hasta 50% de los pacientes que reciben el esquema estándar actual con PEGIFN/RBV serán no respondedores o presentarán recaída después del manejo. Esta situación parece ser más relevante en la población hispana en la que se han reportado tasas inferiores de respuesta viral sostenida en comparación con las obtenidas en otros grupos poblacionales. El manejo de estos pacientes debe tomar en cuenta que realmente se trate de un "no respondedor" y que la falla al esquema recomendado no se deba a otras causas como falta de apego, disminución de dosis por intolerancia o acortamiento inapropiado de la duración del régimen. El tratamiento posterior a seleccionar debe estar acorde con el patrón de respuesta durante la terapia y el esquema previamente recibido. Los estudios recientes muestran que es posible obtener RVS en 10 a 20% de los pacientes que fallaron a tratamiento con interferón convencional/ RBV si son retratados con PEGIFN/RBV. Desafortunadamente la RVS sólo se obtiene en el 6 al 8% de los sujetos con retratamiento con PEGIFN/RBV por 48 semanas cuando el esquema previo fue basado en PEGIFN, por lo que su uso no se recomienda de manera abierta en todos los casos. La prolongación de la terapia a 72 semanas parece ser una alternativa de utilidad con un incremento modesto en la tasa de RVS. Los mejores candidatos a retratamiento son los que presentaron recaída durante el esquema previo, por lo que pueden ser considerados para un nuevo esquema. Ninguno de los tres grandes estudios multicéntricos diseñados con para demostrar la utilidad de la terapia de mantenimiento con dosis bajas de PEGIFN para detener o disminuir la progresión de la enfermedad hepática por el VHC a pesar de no erradicar el virus, ha logrado tal propósito como tampoco ha tenido la terapia un impacto contundente en la evolución clínica por lo que no se recomienda su uso generalizado en los pacientes con fibrosis avanzada/ cirrosis en quienes haya fallado un esquema basado en IFN. Actualmente se encuentran en evaluación otros tipos de IFN como el consensus y el albumin-IFN. Otras combinaciones promisorias son las conformadas por PEGIFN/RBV y un agente antiviral directo (STAT-C). De éstos, los que se encuentran en fases clínicas más avanzadas son los inhibidores de proteasa (telaprevir y boceprevir); los resultados preliminares parecen ofrecer un incremento en la tasa de éxito y proporcionar una mejoría significativa en el tratamiento de los pacientes con hepatitis crónica por VHC refractarios al manejo actual.
Correspondencia: Dr. Juan Francisco Sánchez Ávila.
Clínica de Hepatitis Viral. Departamento de Gastroenterología. Instituto Nacional de Ciencias Médicas y Nutrición Salvador Zubirán. Vasco de Quiroga No. 15, Delegación Tlalpan. C.P. 14000. México, D.F.
Tel. 5487 0900 ext. 2707- 2714. Fax. 5655 3203.
Correo electrónico: frsanchez@prodigy.net.mx